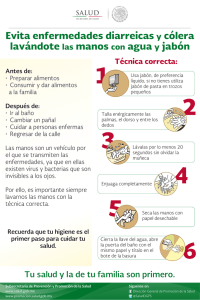
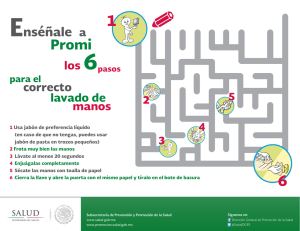
UNIVERSIDAD BANCARIA DE MÉXICO “Constancia, Unidad y Trabajo” INGENIERÍA MECÁNICA AUTOMOTRIZ Reporte de Práctica: Elaboración de Jabón Artesanal PRESENTADO POR Guerra Grajeda Guillermo Ortega Corvera Juan Manuel Anacoreta Juárez Oscar Morales Guzmán Miguel Ángel DOCENTE DE GRUPO Elizabeth Delfín Ferreira ASIGNATURA Taller de Innovación y creatividad GRUPO IMA 802 - V Teoloyucan, Estado de México, Febrero 2020 Competencia de la practica Elabora jabones artesanales por saponificación, relacionando el concepto de innovación y creatividad, al experimentar con esencias naturales y material vegetal, para obtener diversos resultados, valorando la iniciativa empresarial y reconociéndolo como un producto que pueda posicionarse en el mercado con las innovaciones que proponga el alumno según su ámbito profesional. Introducción Nuestras actividades diarias nos ponen en contacto día a día con este químico, y sólo sabemos que sirve para limpiar, que suele tener un olor agradable y que sus formas pueden ser variadas. Sin embargo, poca información poseemos respecto a su composición química. Durante esta práctica referiremos la química detrás de este producto y seremos capaces de responder a varias incógnitas: ¿Cómo funciona un jabón? ¿Por qué hace burbujas? ¿Por qué limpia? ¿De dónde viene? ¿Por qué sus diferentes presentaciones? ¿Es lo mismo jabón y detergente? El jabón ocupa hoy un lugar esencial en la sociedad. Atrae por su aroma, su textura y sus burbujas, atributos que determinan el uso especial que se le ha dado desde las primeras civilizaciones. Aunque no se puede precisar la fecha exacta en que se preparó por primera vez, existen indicios de que ya se usaba en 2500 a.C. Los habitantes de la América prehispánica tenían la costumbre del baño diario y el lavado frecuente de sus ropas. Para ello utilizaban dos insumos: para lavar la ropa, la raíz de la planta de jabón Xiuhamolli (Aniseia martinicensis), que contiene saponinas que producen espuma y la corteza y fruto del Copalxocotl (Protium copal), para lavar el cuerpo y el cabello. Aún hoy, el extracto de la corteza se utiliza en el tratamiento de la lepra. A lo largo de la historia, distintas civilizaciones utilizaron diversos ingredientes para elaborar el jabón: una sustancia grasa, ya sea de origen vegetal o animal, y un álcali, ya sea cenizas de madera o de plantas, ricas en carbonatos de sodio o potasio. Ese es el origen de la reacción más antigua, la saponificación. Uno de los métodos más empleados actualmente para fabricar jabones es el denominado “saponificación”, que consiste en calentar la grasa o aceite con soluciones concentradas de hidróxido de sodio o potasio, con lo que los ácidos grasos que se producen durante la hidrólisis reaccionan inmediatamente con el álcali para producir directamente la mezcla de las sales de sodio o potasio de los ácidos grasos. En el agua, el jabón forma entre 100 y 200 micelas; es decir, asociaciones o conglomerados de moléculas que orientan sus cabezas con carga hacia la superficie del agregado molecular, mientras que las cadenas alifáticas quedan hacia dentro. La micela es una partícula energéticamente estable, ya que los grupos con carga están unidos mediante enlaces de hidrógeno de baja energía con las moléculas del agua circundante, mientras que los grupos afines a las grasas se orientan hacia el interior de la micela e interactúan con otros grupos de características similares. Los jabones limpian debido a las afinidades diferentes de los extremos de sus moléculas. La suciedad grasa no se elimina fácilmente sólo con agua, que la repele por ser insoluble en ella. Sin embargo, el jabón posee una cadena larga alifática o hidrocarbonada sin carga que interactúa con la grasa, disolviéndola, mientras que la región con carga se orienta hacia el exterior, formando gotas. Una vez que la superficie de la gota grasa está cubierta por muchas moléculas de jabón, se forma una micela con una pequeña gota de grasa en el interior. Esta gota de grasa se dispersa fácilmente en el agua, ya que está cubierta por las cabezas con carga o aniones carboxilato del jabón. La mezcla que resulta de dos fases insolubles (agua y grasa), con una fase dispersada en la otra en forma de pequeñas gotas, se denomina emulsión. Por lo tanto, se dice que la grasa ha sido emulsionada por la solución jabonosa. De esta manera, en el proceso de lavado con un jabón, la grasa se elimina con el agua del lavado. Las formas de fabricación del jabón comerciales y las artesanales difieren mucho tanto en su proceso como en la calidad de su producto final. En los jabones industriales el proceso de saponificación va acompañado de un calentamiento extra que acelera la reacción química. Las materias primas de aceites que son utilizados en este proceso son ácidos grasos aislados de los aceites vegetales o animales, de manera que el resto de componentes no saponificables que contienen las materias primas no quedan en el producto final. La glicerina que genera el propio proceso de saponificación es aislada y se vende por separado como otro producto. El jabón industrial está carente tanto de sustancias insaponificables como de glicerina. Estos elementos que no están en los jabones industriales son importantes para la piel, porque ayudan en su hidratación y en su nutrición. Además de estas carencias en estos jabones también se añaden químicos que pueden causar irritación y otros problemas de piel. Este proceso industrial trata de maximizar el beneficio y minimizar la inversión, con la consecuente degeneración del producto. Material Empleado - 1 vaso de precipitado de 250 ml. - 1 vaso de precipitado de 500 ml. - 1 probeta 250 ml. - 1 parrilla de calentamiento - 100 gr. de Hidróxido de sodio (NaOH) - 250 ml. de agua desmineralizada - 500 ml de Aceite vegetal de oliva. - 200 ml. de aceite de coco. - 20 ml. de aceite esencial de bergamota. - 10 ml. de pigmento verde oliva. - 6 moldes de plástico de formas diversas, (vasos del No 8, 10, 12). Desarrollo experimental El experimento realizado en el laboratorio consistió en los siguientes pasos: 1. En primer lugar se realizó el pesaje del Hidróxido de sodio (NaOH) para lo cual se colocó en una balanza y así obtener la cantidad deseada, la cual en este caso eran necesarios 100 gr. 2. Posteriormente, en un vaso de precipitado se coloca 200ml de agua. 3. A continuación, se coloca dentro del mismo vaso de precipitado con agua la cantidad de Hidróxido de sodio (NaOH) que se había pesado anteriormente en el primer paso, la cual eran 100gr. 4. Después de realizar estos pasos, se agita la mezcla de agua e Hidróxido de sodio (NaOH), lo cual provocara que se calentara automáticamente. 5. En otro vaso de precipitado se procedió a colocar aceite de oliva y aceite de coco. 6. Después de realizar la mezcla de estos elementos, se coloco el vaso de precipitado en la parrilla y se calentó la mezcla. 7. Ya que la mezcla de aceite ya se ha calentado levemente, se procede a colocar dentro la mezcla de agua e Hidróxido de sodio (NaOH), junto con el agitador magnético. 8. Posteriormente, ya que se ha realizado esta mezcla, se agita un poco y después se coloca el pigmento verde oliva. 9. Se deja agitar esta mezcla hasta que se tenga una consistencia semisólida. 10. Se coloca el aceite de bergamota y se continúa agitando. 11. Después de dejar mezclando la sustancia agregadas, se colocaron en moldes y dejaron enfriar den estos. Análisis de resultados Los resultados obtenidos de este experimento dieron como resultado que el uso de ingredientes común de la vida cotidiana como aceite de oliva hace posible que se pueda fabricar un producto que es importante para la higiene del ser humano. Los ingredientes utilizados en esta práctica mostraron que son de utilidad para poder fabricar un jabón. El proceso de fabricación es muy sencillo y cualquier persona puede realizarlo en casa, obteniendo buenos resultados. Discusión de resultados El jabón es una sal obtenida a partir de la reacción entre una base alcalina y un ácido. El proceso de la saponificación que es la reacción química que transforma la grasa en jabón, requiere de la dilución de la sosa cáustica en agua. Los métodos clásicos para hacer el jabón en casa son dos: al frío o al calor. El primero, el más sencillo y adaptado al principiante, permite aprovechar el calor emitido por la reacción química del álcali. El jabón obtenido con el método al frío necesita de un tiempo de maduración de aproximadamente cuatro semanas para completar el proceso de la transformación y absorber el líquido. En el método al calor, en cambio el material recibe una fuente externa de calor para acelerar la reacción química. El jabón obtenido con el método al calor queda listo en un tiempo más breve, pero tiene una consistencia mucho más rústica el irregular que la del jabón al frío. Cuestionario 1. Explica por qué los jabones logran limpiar la suciedad. El jabón es una sal (más o menos como la de mesa) que proviene de una reacción química conocida como saponificación. Y, al igual que otras sales, puede disolverse en el agua. Pero lo que caracteriza a las moléculas de jabón es que están formadas de dos partes principales que la hacen poder limpiar. Por un lado, tiene una parte hidrófila (es decir, que atrae las moléculas de agua y se adhiere a ellas) y otra parte hidrófoba (que repele las moléculas de H2O). Esta segunda parte además puede adherirse a la grasa, algo que el agua sola no puede hacer. En suma, la molécula de jabón una parte que se une al agua y otra que se une a los aceites. Las dos secciones de las partículas de jabón actúan encapsulando las grasas. Básicamente rodean las pequeñas moléculas de grasa con la parte que las atrae, y la otra (que se adhiere al agua) hace que salgan de la superficie que nos encontramos limpiando. Puedes entenderlo de la siguiente manera: piensa en la forma de una flor como si la vieras desde arriba. Imagina que los pétalos son las moléculas de jabón, y que la parte que está pegada al centro es la parte de la molécula que atrae los lípidos, y que el otro extremo del pétalo es la parte que atrae el agua. En esta imagen el centro de la flor representaría las moléculas de grasa. Y a todo esto, ¿por qué es importante que las moléculas de jabón puedan unirse a las grasas?, ¿y por qué es importante que se deshaga de ellas? La razón es sencilla: es en las grasas donde se acumula la mayor cantidad de suciedad. Polvo, células muertas y diversas bacterias pueden adherirse a los lípidos. Entonces, al eliminar la grasa de nuestra piel, nuestra ropa y demás objetos que deseemos limpiar, también se quita la mugre. 2. Investigar el pH adecuado de un jabón. Un pH adecuado para un jabón sería alrededor de un 7.0, que indicaría un pH neutro, que podríamos utilizarlo sin problemas. Cuando elaboramos un jabón de forma tradicional en casa, el pH resultante no será más bajo que 7, siempre tenderá a ser alcalino. Eso no es un problema, ya que dejándolo reposar y saponificar conseguiremos que el pH baje lo más próximo a 7. Un jabón casero recién hecho tendrá un pH muy alto hasta que pase el proceso de saponificación. 3. ¿Qué significa hipoalergénico? De acuerdo con la RAE, hipoalergénico se define como “algo que produce una reacción alérgica muy reducida o nula” esto quiere decir que es menos probable que algo hipoalergénico ocasione alergias; las pruebas que se realizan para poder categorizar algo como hipoalergénico verifican que no contengan componentes que, estadísticamente, tienen mayor posibilidad de ocasionar reacciones negativas. 4. ¿Qué tipo de plantas y extractos podrías usar para elaborar jabones medicinales? Prácticamente la mayoría de plantas y extractos de estos pueden ser usados para su uso en jabones medicinales, como por ejemplo el extracto de lavanda que es usado para pieles sensibles y con acné. 5. Enlista y describe las principales aplicaciones y características de los jabones en la sociedad. - Aplicaciones: 1. Para que una solución jabonosa sea realmente útil como desinfectante debe de contar con las siguientes características: 2. Tiene que ser una solución anti séptica con potencia bactericida de amplio espectro. 3. Equilibrar la eficacia aséptica reduciendo al mínimo los riesgos en su composición. 4. Presentarse en solución homogénea, y de rápida actuación. 5. De fácil adquisición y coste asumible. - Características: 1. El jabón es un agente espumante Si juntamos algunas gotas de una solución de jabón y agua contenida en un frasco y agitamos, se forma una espuma consistente. 2. El jabón es un agente emulgente Si dentro de un frasco juntamos un poco de agua y un poco de aceite y agitamos, podemos ver que no se mezclan de forma homogénea. Sin embargo, si agregamos unas gotas de una solución de jabón y agitamos nuevamente, podremos observar que la separación del agua del aceite es mucho más lenta. El jabón estabiliza la emulsión del aceite en el agua. 3. El jabón es un agente mojante Si soplamos un poco de polvo de azufre sobre la superficie libre del agua pura contenida en un recipiente, las partículas de azufre permanecen en la superficie del agua, aunque el azufre sea más denso que el agua. Juntando algunas gotas de una solución de jabón, las partículas de azufre se mojan y bajan hasta el fondo del recipiente. Conclusiones Esta practica nos llevo a tener como conclusión que la fabricación de jabones caseros es benéfica para las personas, además de que su costo es muy bajo a cambio de grandes benéficos para nuestra piel, además de que estos jabones los podemos fabricar en nuestras casas adaptándolos a nuestras necesidades. Bibliografia BROWN, Theodore (2013). Química, la ciencia central. Pearson Educación: Naucalpan. CHANG, Raymond. (2011). Fundamentos de química. Mcgraw Hill: Distrito Federal CLAYDEN Jonathan, Organic Chemistry.Oxford:. Oxford University Press, 1ª ed., 2001. CRUZ, Martín de la. “An Aztec herbal: the classic codex of 1552”. Traducción y comentarios de William G., introducción de Bruce B. Nueva York: Dover Publications, 2000. DELGADO Ortíz, Sara (2012). Laboratorio de química general. McGraw Hill: Distrito Federal. ESCOBEDO, Wendy. Estudio del potencial anti-Helicobacter pylori, gastoprotector y antiinflamatorio de Cyrtocarpa procera, Tesis de Doctorado en Ciencias Biomédicas, Facultad de Medicina, Universidad Nacional Autónoma de México, 2013 TWITCHELL, E. “A reagent in the chemistry of fats”. J. Am. Chem. Soc. 1906, vol. 28, p. 196. WADE, Leroy, Química orgánica, Madrid: Pearson educación, 2004, p. 1162-1168. WILCOX, Michael, “Soap”. Poucher’s Perfums, Cosmetics and Soaps. 10 ed. Gran Bretaña: Kluwer Academic Publishers, 2000, p. 453-465.