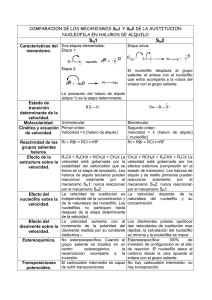
Objetivos 1. Conocer la preparación de un haluro de alquilo terciario a partir del alcoho l correspondiente. 2. Realizar ensayos sencillos con el fin de conocer algunas reacciones básica s de clasificación de haluros de alquilos. 3. En la práctica de Haluros de alquilos aprendimos como obtener el cálculo del rendimiento Introducción Haluros de alquilo Los halogenuros poseen por lo menos un átomo de halógeno (flúor, bromo, yodo o cloro) unido a un átomo de carbono. Algunos son de gran interés comercial co mo la decametrina, un insecticida derivado de la piretrina, una sustancia extraída del pyrethrum, una planta originaria del este de África. En este caso, se encontró que la piretrina modificada por síntesis química es tan activa como la piretrina, p ero es más estable a la luz del sol, lo que facilita su uso en el campo. La característica principal de la estructura de halogenuro de alquilo es el áto mo de halogenuro, -X, y las reacciones características de un halogenuro de alquil o son las que tienen lugar en el halógeno. El átomo o grupo que define la estruct ura de una familia particular de compuestos orgánicos y, al mismo tiempo, determ ina sus propiedades se llama grupo funcional. En el caso de los halogenuros de al quilo, el grupo funcional es el halógeno. Propiedades físicas de los halogenuros de alquilo. Debido a su mayor peso molecular, los haloalcanos tienen puntos de eb ullición considerablemente más altos que los alcanos de igual número de carbonos . Para un grupo alquilo dado, el punto de ebullición aumenta con el incremento e n el peso atómico del halógeno, de modo que un fluoruro hierve a la temperatura más baja, y un yoduro, a la más elevada. [2]A pesar de sus modestas polaridades, los halogenuros de alquilo son insolubles en agua, tal vez porque paces de establecer puentes de hidrógeno. no son ca Son solubles en los solvente s orgánicos típicos de baja polaridad, como benceno, éter, cloroformo o ligroína. Procedimiento experimental 1. Pesar tubo de ensayo. 2. Addicionar 2 mL de alcohol terbutilico en el tubo de ensayo. 3. Pesar nuevamente el tubo de ensayo con los 2 mL de (CH 3)3COH. 4. Adicionar 5 mL HCL concentrado, tapar el tubo de ensayo y agitar vigoros amente por 1 min. 5. Ventilar el tubo de ensayo observar que se forman dos fases. 6. Con pipeta o jeringa separar fase. 7. Addicionar 2 mL H2Od al tubo de ensayo, agitar y observar que se forman dos fases. ( Separar y descartar fase acuosa). 8. Adicionar 2 mL sln de NaHCO3 al 5% a la capa organica agitar hasta me zclar completamente ( si se forman dos fases remover fase acuosa). 9. Adicionar Na2SO4 anhidro y agitar. 10. Pesar el producto secado. ( Cloruro recuperado). Resultados y Discusión Datos Obtenidos Peso del tubo de ensayo 7.7152 g Peso del Tubo de ensayo + Alcohol 9.8669 g Peso del producto secado 9.1591 g % Rendimiento: (Peso Final / Peso Inicial) %Rendimiento:(9.1591g - 7.7152g) / (9.8669g-7.7152g) = 67.10508% Discusión Cuando se mezcla el alcohol terbutilico y al HCl anteriormente se da la formació n del cloruro de terbutilico; quedando dos fases inmiscibles, en la parte superior e l cloruro de terbutilo como fase orgánica y en la parte de inferior la fase acuosa o fase inorgánica la cual es expulsa. Una vez obtenida la fase orgánica se la adici ona bicarbonato de sodio y posteriormente sulfato de sodio anhidrido este último que realiza la función de secar. Como grupo acordamos que el porcentaje de rendimiento de 67.10508% es un po rcentaje aceptable. Conclusiones 1. Se preparo un cloruro de terbutilo terciario a partir de alcohol terbutilico y HCl con esta reacción se garantizaron dos fases en el tubo de ensayo. 2. Se realizaron ensayos para concocer las racciones del cloruro del terbutilo l as cuales sirven para clasificar y diferenciar a los haluros de alquilo 3. Se calculo el rendimiento del cloruro recuperado en comparación con el ag regado Cuestionario 1. Describa el mecanismo de la reacción efectuada en el laboratorio. ¿Dónde se encontraba la fase orgánica cuando la separó de la mezcla de reacció n, y cuando la lavó? ¿ Cómo lo supo? R./ En el tubo de ensayo se obtuvieron 2 fases inmiscibles entre sí, la fase en l a parte inferior del tubo de ensayo era transparente al igual que la fase superio r pero de consistencia viscosa. La fase líquida orgánica obtenida en ésta práctica, a partir del alcohol terbutílic o y HCl concemtrado fue cloruro de terbutilo, como residuo se obtuvo agua, la fase inorgánica (fase inferior del tubo de ensayo). La obtención del cloruro de terbutilo se debió a una reacción de sustitución nuc leofílica, en la cual el grupo hidróxilo fue sustituido por el ión cloruro, liberán dose agua. 2. ¿Cómo llevaría acabo la conversión del bromuro de n-butilo en alcohol n-butíli co? R./La síntesis de un alcohol a partir de haluros de alquilo tiene lugar mediante una sustitución nucleofílica. En los haluros primarios y algunos secundarios tie ne lugar mediante una SN2. Mientras que en los haluros de alquilo terciarios ti ene lugar mediante una SN1. 3. Explique si sería conveniente emplear exactamente las mismas condiciones de l a experiencia de hoy, al obtener el cloruro de terbutilo, para sintetizar el brom uro de s-butilo. R./ No por que el carbocatión que se forma del alcohol secbutilico es menos e stable que el carbocatión terciario que seria el terbutilo. 4. Describa los siguientes métodos de obtención de Haluros de alquilo, incluyendo mecanismos de acción: •A partir de alquenos por bromación alílica. Ejemplo: •A partir de alquenos por adición de HBr y HCl. Ejemplo: •A partir de alcoholes (a) Reacción con HX, donde X = Cl, Br o I; Orden de reactividad: 3º >2º > 1º. Ejemplo: (b) Reacción de alcoholes primarios y secundarios con SOCl2 en piridina. Ejemplo: c) Reacción de alcoholes primarios y secundarios con PBr3, en éter. Ejemplo: 5. ¿Cómo explica Ud. El hecho de que el alcohol n-butílico tenga un punto de eb ullición más alto que el bromuro de n-butilo? 6. En la producción de cloruro de terbutilo ¿qué compuestos secundarios? Plantee mecanismo de acción. R./ Compuestos secundarios: agua, cloruro de calcio y terbutanol. Mecanismo de acción 7. ¿ Por qué es indispensable la presencia de un ácido en las reacciones de form ación de halogenuros a partir de alcoholes? R./ Se requiere un ácido para convertir el alcohol en alcohol protonado, el cual disocia por pérdida de la molécula de agua, débilmente básica, con mucho más facilidad que el alcohol mismo. Además las reacciones son catalizadas por ácidos porque a pesar que los propio s halogenuros de hidrógeno acuosos son ácidos fuertes, la presencia de H2SO4 adicional acelera la formación de halogenuros de alquilo. 8. ¿Qué significa el término SN2? R./ La SN2 (sustitución nucleófila bimolecular) es una reacción concertada, es d ecir, transcurre en una única etapa. El mecanismo consiste en el ataque del nucleófilo al carbono que contiene el gru po saliente. Este carbono presenta una polaridad positiva importante, debida a la electronegatividad del halógeno. Al mismo tiempo que ataca el nucleófilo se pro duce la ruptura del enlace carbono-halógeno, obteniéndose el producto final. Diagrama de energía en la SN2 En el diagrama de energía se representa la energía potencial frente a la coordenad a de reacción, y nos da el cambio energético que sufren los reactivos al transform arse en los productos correspondientes. Durante el transcurso de la reacción los reactivos aumentan su energía hasta alcan zar el estado de transición, formándose el complejo activado. En ese punto el enl ace carbono-nucleófilo se encuentra medio formado y el carbono-grupo saliente m edio roto. 2Estereoquímica en la SN2 El ataque del nucleófilo al carbono que contiene el grupo saliente puede ocurrir d e dos formas distintas. En el primer caso el nucleófilo puede aproximarse al sust rato por el lado en que se encuentra el grupo saliente. Esta aproximación se den omina ataque frontal, en ella el nucleófilo ocupa el lugar del grupo saliente, prod uciéndose retención en la configuración. LEER MÁS: ESTEREOQUÍMICA EN LA SN2 El grupo saliente en la sustitución nucleófila - SN2 El grupo saliente tiene la misión de abandonar el sustrato al mismo tiempo que at aca el nucleófilo. Los mejores grupos salientes son las especies menos básicas, p uesto que se enlazan débilmente al carbono. En la tabla periódica los mejores gr upos salientes se encuentran a la derecha y abajo. El nucleófilo en la SN2 Los nucleófilos son bases de Lewis que atacan a un carbono desplazando al grup o saliente. Es frecuente encontrar nucleófilos iónicos, pero también existen numer osos ejemplos de nucleófilos neutros. La característica general de todo nucleófilo es la presencia de pares solitarios sobre el átomo que ataca. LEER MÁS: EL NUCLEÓFILO EN LA SN2 Sustrato en la sustitución nucleófila - SN2 Existe una importante diferencia de velocidad entre los sustratos; bromuro de meti lo, bromuro de etilo, bromuro de isopropilo y bromuro de tert-butilo cuando reacc ionan con un nucleófilo en las mismas condiciones. Sustratos cíclicos en SN2 Los sustratos cíclicos tensionados reaccionan más lentamente mediante el mecanis mo SN2 que los sustratos acíclicos. Así, el bromuro de isopropilo reacciona más rápido con el ión acetato que el bromuro de ciclopropilo. Disolvente en la sustitución nucleófila - SN2 Los disolventes pueden clasificarse según el esquema siguiente. 9. Predica cuál de los siguientes alcoholes reacciona más rápido frente al HBr: •Alcohol Bencílico. •Alcohol p-Me-Bencílico. •Alcohol p-nitro-Bencílico. R./ La reactividad depende considerablemente de la rapidez de formación del ion carbonio, la que a su vez, depende de la estabilidad de este. Se sabe como estima r la estabilidad de un ion carbonio, basándose en efectos inductivos y de resonanc ia. Debido al efecto inductivo liberador de electrones del grupo alquilo, la estabilidad , y en consecuencia la rapidez de formación de los cationes de alquilo simples sig ue el orden 3°>2°>1° Se sabe que el catión bencilo o bencílico debido a la estabilidad por resonancia e s un ión muy estable por lo que reaccionará más rápido frente al HBr. El efecto del anillo bencenito sobre la orientación cuando éste está unido a un gr upo OH, y además se le adicional HBr, el bromo se une al carbono adyacente del anillo y se libera agua. 10. Escriba el mecanismo de la reacción de sustitución nucleofílica entre la n-buta nol y el HBr. Escriba un cuadro comparativo de las reacciones tipo SN1 Y SN2 respecto a: •Orden de reacción. •Estereoquímica. •Condiciones de reacción. •Sustrato. •Reacción en competencia. •Subproductos y productos orgánicos colaterales. SN1 SN2 Orden de reacción Orden 1 Esteteoquímica Retención e inversión d Inversión de la configu Orden 2 e la configuración ración Condiciones de reacció Disolvente polar prótic Disolvente polar aprótic n o o Sustrato -Nucleófilo débil -Nucleófilo fuerte -Según la reactividad d -No tiene impedimento el sustrato: estérico 3 2 1 CH3X -Según la reactividad d el sustrato: CH3 1 2 3 Reac. en competencia En varios pasos Concertado Bibliografía •https://es.slideshare.net/mobile/Daniielitho0o/obtencion-declorurodet erbutilo-1 •https://www.docsity.com/es/obtencion-de-cloruro-de-terbutilo/70259 2/ •https://es.slideshare.net/mobile/IrvindeJessRodrguezM/reporte-de-pr cticasntesis-y-propiedades-del-cloruro-de-tercbutilo