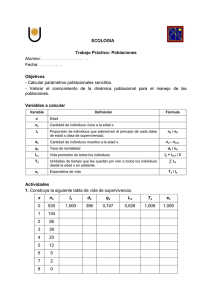
Grupo 3 Mónica Avila, Karen Campos, Alexander Cruz, Bernardo Gamarra, Manuel Llaro Abstract Métodos: Diseño de la investigación Estudio transversal comparativo retrospectivo de ETSs disponibles sobre tratamiento anticancerígeno que recibieron autorización en el mercado entre 2011 y 2013. Selección de las jurisdicciones de las ETSs: De las 29 jurisdicciones europeas, 9 presentaban públicamente reportes de las organizaciones encargadas de las ETSs, de estas 3 se excluyeron, Bélgica no fue incluida ya que solo tenía un número limitado de reportes, Portugal e Irlanda se excluyeron por solo tener breves resúmenes proveyendo información limitada al estudio. Selección de los medicamentos y reportes Recolección de la información y análisis ETS guías • En general, todas las guías de HTA preferían puntos finales clínicamente y relevantes para el paciente relacionados con la morbilidad, la mortalidad y la calidad de vida. • Para 7 de 79 evaluaciones, el rechazo se basó en el perfil clínico y el costo / costo-efectividad. • El número de HTA incluidas por jurisdicción varió entre 7 (Países Bajos) y 18 (Alemania). • El 27% (21/79) de las evaluaciones tenía una recomendación de beneficio negativa / menor, pero el porcentaje varía considerablemente según la jurisdicción (6% –69%). • En general, pocos medicamentos fueron rechazados principalmente por razones clínicas (4/79 recomendaciones), mientras que 10 de 79 fueron rechazados principalmente por cuestiones de costo / costo-efectividad. • Para Francia, Alemania y los Países Bajos, las recomendaciones de beneficios negativos / menores se basaron únicamente en el perfil clínico, mientras que se basaron principalmente en el perfil de costo / costo-efectividad o en ambos (perfil clínico y de costo / costo-costo) para Inglaterra, Escocia y Polonia. Los end points incluidos en los REAs • La Figura 3 detalla los puntos finales incluidos en las REA y su impacto en las recomendaciones. Los datos generales de supervivencia fueron incluidos por todas las agencias en todas las REA, pero los datos no siempre son maduros. Alemania no incluyó datos de supervivencia libre de progresión en ninguna de las REA. En las otras jurisdicciones, los datos de supervivencia libre de progresión se incluyeron en el 80% –100% de las REA. Frecuentemente faltan datos de calidad de vida, y la inclusión varía, del 29% (Polonia) al 67% (Inglaterra). Cuando no se incluyeron los datos de la calidad de vida, esto se debió a que los datos no se recopilaron o eran inmaduros o no eran sólidos. Los datos de seguridad fueron incluidos por todas las jurisdicciones para todos los medicamentos. • Los datos generales de supervivencia y seguridad tuvieron un impacto en la recomendación en 94% y 86% de las ETSs, respectivamente. El impacto de los datos de supervivencia general fue principalmente positivo (48% / 94%) o neutral (35% / 94%), mientras que el de los datos de seguridad fue principalmente negativo (39% / 86%) o neutral (34% / 86%) . Impacto de los datos finales sobre las recomendaciones: • Los datos de supervivencia libre de progresión tuvieron un impacto en el 56% de las recomendaciones, pero esto varió mucho entre jurisdicciones, del 0% en Alemania al 85% en Escocia. El impacto de los datos de supervivencia libre de progresión fue principalmente positivo (35% / 56%). La influencia de los datos de la calidad de vida parece bastante limitada, ya que solo el 41% de las recomendaciones se vieron afectadas por los datos de la calidad de vida, siendo el impacto principalmente neutral (19% / 41%) o positivo (16% / 41%). • En al menos dos casos (cabazitaxal y crizotinib), el impacto difirió entre jurisdicciones debido a cómo se interpretó la relevancia clínica del tamaño del efecto de Supervivencia general o supervivencia libre de progresión. • En REAs se indicó explícitamente que la ganancia de supervivencia libre de progresión fue considerada clínicamente relevante por múltiples jurisdicciones para pertuzumab para cáncer de seno (18.5 versus 12.4 meses, HR = 0.62), crizotinib para cáncer de pulmón (7.7 versus 3 meses, HR = 0.49), vemurafenib para melanoma (5.3versus 1.6 meses, HR = 0.26) y afatinib para cáncer de pulmón (11.1 versus 6.9 meses, HR = 0.58). Discusión • Este estudio se suma al conocimiento existente al centrarse en las diferencias en la evaluación de los end points clínicos en REA para medicamentos contra el cáncer en las agencias europeas de ETSs. Destaca la brecha de evidencia existente entre la situación ideal (tipo preferido de evidencia según lo solicitado por las agencias de ETSs) y la realidad (evidencia real provista). • La supervivencia general y la calidad de vida se consideran los puntos finales preferidos relevantes para el paciente, pero los datos concluyentes sobre estos puntos finales no siempre están disponibles (por ejemplo, supervivencia general inmadura o datos de calidad de vida incompletos / sin datos). Sin embargo, para la calidad de vida, la falta de evidencia no parece afectar negativamente las recomendaciones. La variación entre países que encontramos al valorar los puntos finales clínicos fue más sorprendente para los datos de supervivencia libre de progresión. • La variación que encontramos en la relevancia de los datos de supervivencia libre de progresión refleja el debate en curso sobre la creciente dependencia de la supervivencia libre de progresión para demostrar un beneficio clínico con fines reguladores. • Otorgar acceso temprano a nuevas terapias basadas en datos de supervivencia libre de progresión puede beneficiar a los pacientes que necesitan terapias que extiendan la vida, pero esto corre el riesgo de reembolsar terapias que luego resulten no tan efectivas o seguras como se pensaba inicialmente. • Este estudio muestra que la consideración de los datos finales varía entre las jurisdicciones ETSs. También se observan más divergencias entre los organismos de ETSs y las agencias reguladoras de medicamentos porque el regulador está dispuesto a aceptar un mayor grado de incertidumbre clínica para acelerar el acceso a las terapias. Actualmente, el desarrollo de medicamentos contra el cáncer está diseñado para cumplir con los requisitos de licencia de medicamentos y no se ajustan específicamente a los requisitos de la ETSs. Un debate de múltiples partes interesadas sería esencial para alinear requisitos concretos de evidencia sólida en oncología y estandarizar la definición de "beneficio clínico relevante", que beneficiará a los pacientes y a la sociedad en general. Bibliografía • S. Kleijnen, I. Lipska, T. Leonardo Alves, K. Meijboom, A. Elsada, V. Vervölgyi, A. d'Andon, A. Timoney, H. G. Leufkens, A. De Boer, W. G. Goettsch, Relative effectiveness assessments of oncology medicines for pricing and reimbursement decisions in European countries, Annals of Oncology, Volume 27, Issue 9, September 2016, Pages 1768–1775, https://doi.org/10.1093/annonc/mdw233