Elucidación estructural: Resolución de
problemas
Objetivos:
Composición:
átomos presentes
y su proporción
en la molécula, lo
que se traduce
en la obtención
de una formula
molecular.
Composición
elemental es
55.8% de C;
6.98% de H y
37.2% de O ello
nos llevaría a una
formula empírica:
C4H6O2.
Determinando el
peso molecular
resulta ser 172,
por lo que la
fórmula
molecular
resultará ser:
C8H12O4
Constitución:
Uniones
existentes entre
los átomos, lo
que se traduce
en la
determinación de
los grupos
funcionales y
subestructuras
presentes en la
misma
Su análisis
funcional nos
dice que se trata
de un ácido
ciclohexano-1,2dicarboxílico
(constitución)
Configuración:
disposición
espacial de los
átomos en la
molécula.
Conformación:
disposición espacial de
la molécula que surge
debido a la posibilidad
de rotación o giro de
los enlaces simples en
la misma.
Disposición
relativa de dichos
grupos
carboxílicos en el
ciclo,
encontrándonos
que resultan ser
trans(configuración)
Determinar su
conformación, es decir
determinar si la
molécula se encuentra
con ambos grupos en
posiciones
ecuatorial,ecuatorial o
axial, axial cuando el
anillo de ciclohexano
se encuentra en
conformación silla
Procedimiento:
De una manera general podemos indicar como objetivos sucesivos los siguientes:
1.
2.
3.
4.
Obtención de una fórmula molecular.
Identidad de los grupos funcionales.
Conectividades de los carbonos.
Posicionamiento de los substituyentes y/o los grupos funcionales sobre el
esqueleto carbonado (Obtención de subestructuras).
5. Determinación de las propiedades estereoquímicas (incluyendo tanto los
aspectos estáticos como dinámicos).
6. Asignación de una estructura a la molécula.
7. Comprobación de que las propiedades espectroscópicas observadas se
corresponden con las que debería tener la estructura propuesta.
1
1) DETERMINACIÓN DE LA FÓRMULA MOLECULAR
Conocemos sólo el peso molecular.
•
•
En primer lugar debemos saber si la sustancia a estudiar posee algún
oligoelemento distinto de C, H, O, N. en cuyo caso procederíamos a restar a
dicho peso la masa correspondiente a dichos elementos.
Vamos a considerar, sin embargo, que la sustancia no posea ninguno de
tales oligoelementos :
F, Cl, Br, I, S, P, etc.. o sabemos exactamente el número de ellos.
En dicho caso utilizaremos una regla simple conocida como “regla del 13”,
consistirá en dividir el peso molecular por 13 y de la observación de dicha
operación deduciremos una primera fórmula empírica asignable al
hidrocarburo:
CcocienteHcociente
•
•
+ resto
Ejemplo: PM = 128 128/13 = 9; Resto = 11 C11H20
A continuación debemos observar el valor del peso molecular, si dicho valor
es par podemos pensar se trata de un producto orgánico que o bien no
posee Nitrógeno en su estructura o bien posee un número par de átomos del
mismo.
Procederemos a continuación a introducir en la fórmula anterior átomos de
Oxígeno y/o Nitrógeno de acuerdo con la siguiente premisa: “La introducción
de un átomo de Oxígeno implica retirar de la misma CH4, de igual forma la
introducción de un átomo de Nitrógeno implica retirar de la misma CH2”, así
para el caso considerado anteriormente tendríamos: Sin Nitrógeno: C11H20 +
O – CH4 = C10H16O y sucesivamente C9H12O2; C8H8O3; … Con Nitrógeno: Al
ser par el peso molecular debe poseer un número par de ellos, por lo que:
C11H20 + 2 N – 2 CH2 = C9H16N2, a continuación introduciendo Oxígeno
obtendríamos: C9H16N2 + O – CH4 = C8H12N2O y así sucesivamente
C7H8N2O2, …
La cuestión de cual de esas fórmulas empíricas es la fórmula molecular debemos
hacerlo con ayuda de técnicas espectroscópicas como IR, UV, 1H-RMN ó 13C-RMN.
Conocemos la distribución isotópica del pico molecular por EM
Si el compuesto sólo posee C, H, N, O, F, P y I. La fórmula molecular puede
estimarse a partir de las intensidades relativas de los picos de masas M+1 y M+2
respecto de M, cumpliéndose:
% (M+1)/M = 1.1 nº C + 0.36 nº N
% (M+2)/M = (1.1 nº C)2/200 + 0.20 nº O
Con ambas expresiones podemos calcular la fórmula molecular.
•
•
La limitación viene dada por el hecho de que debemos saber el número de
oligoelementos presentes y que elementos como Cl, Br, S, Si, etc.. no son
monoisotópicos y desvirtuarían las intensidades de ambos picos, por lo que
impiden aplicar las fórmulas anteriores.
Es necesario observar así mismo la paridad del pico molecular para poder
estimar la presencia o ausencia de nitrógeno.
2
2) DETERMINACION DEL INDICE O NÚMERO DE INSATURACIONES.
Dicho parámetro nos va a dar una idea bastante aproximada del tipo de producto
que estudiamos. Partimos para ello de la fórmula molecular.
Para calcular dicho parámetro utilizaremos la expresión:
N.I. = {(2 .nº C – nº H + nº N)/2} + 1
•
•
•
•
•
•
Como podemos observar en la expresión no interviene el número de átomos
de oxígeno, ni otros oligoelementos.
Si en la fórmula aparece S no se considera aunque el número de
instauraciones puede desvirtuarse: puede haber más instauraciones pero
estas estarán sobre el átomo de azufre.
Si hay halógenos se consideraran equivalentes a átomos de hidrogeno
Si hay P (fósforo) se considerará equivalente a Nitrógeno pero debemos
hacer la misma consideración que para el azufre.
Si hubiera Si, se considera equivalente al Carbono.
No se consideran otros oligoelementos
Ejemplos: Una fórmula molecular de C12H14O4 dará
N.I. = (12.2-14)/2 + 1 = 6
Una fórmula molecular de C7H5NO3 dará
N.I. = (7.2-5 + 1)/2 + 1 = 6
Una vez obtenido el número de instauraciones debemos tener en cuenta las
siguientes consideraciones:
•
•
•
•
•
Un ciclo equivale a una instauración.
Un anillo bencénico o heterociclo aromático hexagonal equivale a 4
insaturaciones: (tres dobles enlaces más un ciclo).
Un heterociclo aromático pentagonal equivale a tres instauraciones: (dos
dobles enlaces más ciclo).
Un triple enlace equivale a dos instauraciones.
Un doble enlace equivale a una instauración.
3
3) IDENTIFICACION DE LOS GRUPOS FUNCIONALES
Una vez determinado el número de instauraciones debemos buscar a continuación
los grupos funcionales presentes en nuestra molécula. Para ello las posibilidades a
considerar son muy diversas pero en la mayoría de los casos es suficiente con
observar los espectros de UV e IR, principalmente este último.
•
•
•
•
Los hidrocarburos aromáticos y sus derivados En el IR suelen presentar
una distribución característica del tipo de sustitución en la zona de 16002000 cm-1 que suele ser difícil de ver debido a su baja intensidad. En torno a
los 700 cm-1 también suelen dar algunas absorciones características.
Los grupos carbonilo de aldehidos y cetonas absorven en el IR
aproximadamente a 1700 cm-1). Algunas veces podemos asegurarnos del
tipo de carbonilo observando el espectro de C-13: mientras que aldehídos y
cetonas resuenan en torno a 190-210 ppm, los ácidos y sus derivados lo
hacen en torno a 170 ppm.
Los grupos hidroxilo (OH) suelen aparecer en el IR en torno a los 3300
cm-1 como una banda ancha e intensa, en el caso de los ácidos carboxílicos
dicha banda baja su frecuencia situándose en torno a los 3000 cm-1
englobando la zona de los CH, además la absorción del carbonilo suele ser
más ancha de lo habitual.
Los grupos amino (NH y NH2) en el caso de alifáticos suele aparecer de
una forma similar a los OH comentados con anterioridad en el caso de
productos aromáticos y en el de las amidas (R-CONH2), suelen aparecer
como dos picos distinguibles para el caso de los primarios (NH2) y como una
banda aguda para los secundarios (-NH-). Los aminoácidos suelen dar
espectros de IR poco resueltos y con bandas muy anchas.
4) IDENTIFICACION DE SUBESTRUCTURAS Y CONECTIVIDADES EN LA
MOLECULA.
Una vez determinado el número de instauraciones y los grupos funcionales
presentes en nuestra molécula el camino a recorrer se asemeja a la resolución de
un rompecabezas, cada persona suele tener o adquirir su propia técnica. Pero no
por ello podemos dejar de dar una serie de sugerencias:
4
RMN de C-13
Se observa en primer
lugar el espectro de RMN
de
C-13
y
en
él
principalmente
tres
factores:
•
•
•
El número total de
Carbonos
diferentes
existentes.
Su
desplazamiento
químico ( ).
La
existencia
de
subespectros
(DEPT,
“off resonance”, APT,
etc..)
RMN de protones
A continuación en el
espectro de RMN de
protones tres son los
parámetros a destacar:
•
•
•
El desplazamiento
químico de las señales
).
Las integrales
relativas.
La multiplicidad de las
señales.
De ellos podemos deducir
algunas
características
reseñables como:
De ellos podemos deducir
algunas
características
reseñables como:
•
•
•
•
•
Del
recuento
del
número
total
de
carbonos
podemos
deducir la simetría de
la molécula o en su
caso las relaciones de
equivalencia
entre
algunos grupos.
Dividiéndolo en zonas
podemos
obtener
subestructuras:
De
160-210
ppm:
Grupos carbonilo (CO)
De
100-160
ppm:
Carbonos
sp2
(etilénicos
y
aromáticos)
De
0-100
ppm:
Carbonos
sp3
(alifáticos)
A su vez dependiendo
del
desplazamiento
químico
podemos
deducir
donde
se
encuentran
anclados
los grupos funcionales.
Del “off resonance” o
las
intensidades
relativas
podemos
deducir posibles tipos
de
sustitución
en
anillos,
subestructuras,
•
•
Del
desplazamiento
químico
se deduce
principalmente
el
entorno y tipo de los
diferentes tipos de
hidrógenos.
De las integrales la
equivalencia química
de
los
diferentes
grupos
así
como
importantes
consecuencias sobre la
simetría
de
la
molécula.
De la multiplicidad de
las señales se van a
obtener
principalmente
información sobre la
conectividad,
relaciones espaciales,
subestructuras,
estereoquímica, etc..
5
Espectro de Masas
Del espectro de masas nos
interesan en particular:
•
•
•
Intensidades de los
picos y relación m/e de
los picos mas intensos
Diferencias de masas
entre dichos picos.
La posible existencia
de picos metaestables.
De
ellos
podemos
deducir
algunas
características
reseñables como:
•
•
•
Las intensidades nos
van
a
indicar
la
existencia
determinadas
agrupaciones
o
subestructuras
muy
características,
por
ejemplo los picos de
masa 91 (bencilo), 43
(acetilo),
31
(metoxilo), etc...
Las
diferencias
de
masas deben de ser
lógicas desde el punto
de vista químico y de
alguna manera nos
indican las secuencias
y/o
conectividades
existentes
en
la
molécula
La existencia de picos
metaestables
está
asociada
a
la
secuencia
de
fragmentación de la
molécula y nos indican
igualmente
conectividades en ella.
5) IDENTIFICACION DE LA ESTRUCTURA.
Una vez determinado todo lo anterior lo que nos resta es proponer una o varias
posibles estructuras isómeras de la molécula y decidir cual de ellas se ajusta más a
todos los datos espectroscópicos que poseemos.
Para ello volveremos a repasar con cada una de ellas todos y cada uno de los datos
espectroscópicos, normalmente en sentido inverso al utilizado para la elección,
eligiendo aquella que más se ajuste a ellos. Suele ser de mucha utilidad para ello la
utilización de Tablas para la elucidación estructural como las que se recogen en la
mayoría de los manuales de problemas de elucidación estructural.2
6) JUSTIFICACIÓN TEORICA DE LOS DATOS ESPECTROSCÓPICOS DE LA
MOLÉCULA.
Una vez asignada podríamos pasar a justificar todos los datos espectroscópicos de
acuerdo con los manuales existentes para cada una de las técnicas. Y si es posible
asignar configuraciones o conformaciones a la molécula.
6
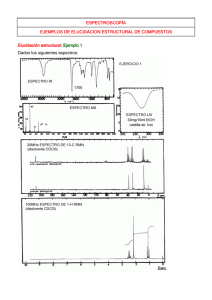
Ejemplo 1.:
1) Empezaremos por encontrar la formula molecular, pues no la tenemos. Del
espectro de masas obtenemos un pico molecular de relación m/e 72. Aplicaremos la
regla del 13, obteniendo:
7
72/13 = 5 Resto = 7 => C5H12 -> + O – CH4 = C4H8O -> + O – CH4= C3H4O2 -> …
2) Número de instauraciones.
Para ello deberíamos elegir una de las fórmulas moleculares, se puede hacer de una
manera general con la primera de ellas C5H12
NI = 2.5-12/ 2 + 1 = 0, siendo para las siguientes C4H8O NI = 1, C3H4O2 NI = 2, …
O bien determinar la verdadera fórmula molecular que podemos elegir viendo que
en el espectro UV hay una absorción y por lo tanto debe existir un cromóforo (o lo
que es lo mismo un doble enlace = 1 insaturación al menos);
en el espectro IR en el que se observa un grupo carbonilo (C=O) (al menos una
instauración y un átomo de Oxígeno) o en el espectro de RMN de C-13 en el que se
observa la existencia de al menos 4 átomos de Carbono diferentes
por lo que la formula sería:
C4H8O NI = 1
3) Grupos funcionales presentes.
En el espectro de IR se observa la existencia de un grupo carbonilo (C=O). Para ver
de que tipo es debemos tener en cuenta que al presentar una absorción a max =
8
280 nm (A = 0.7; = 1 cm; c = 33.3/72.0.01 moles /litro) => = 15) debe
tratarse de un aldehído o una cetona. Observando el espectro de RMN de C-13
vemos una señal a 210 ppm que sale como singulete en el “off resonance”
indicando que se trata de una cetona.
4) Subestructuras y conectividades.
En el espectro de
13
C-RMN aparecen 4 señales diferentes a aproximadamente:
210 (CO), 36 (CH2), 29 (CH3) y 8 ppm (CH3)
(la multiplicidad indicada se obtiene del “off resonante”)
NOTA: En este caso al ser una molécula tan simple se podría asignar ya una
estructura definitiva e inequívoca:
BUTANONA: CH3CH2COCH3
Pero esto no es lo normal, por lo que seguiremos el protocolo normal.
En el espectro de 1H-RMN observamos
tres grupos de señales a :
2.5 (cuadruplete, 2H)
2.1 (singulete, 3H)
1.1 (triplete, 3H)
(el número de Hidrógenos se obtiene asignando a la altura total de la integral el
valor de 8 Hidrógenos) De ello podemos deducir:
El grupo CH2 a 2.5 ppm al salir como cuadruplete implica que se encuentra vecino a
un CH3, dicho metilo debe, a su vez, salir como un triplete. La señal del metilo a
2.1ppm debe encontrarse vecina a un carbono cuaternario (sin Hidrógeno), en este
caso el C=O.
En el espectro de masas observamos 4 picos a m/e:
72 (M+),
57 (M-15),
9
43 (M-29)
29 (M-43)
que en vista de la estructura CH3CH2COCH3 podemos asignar respectivamente a
los iones:
57 (CH3CH2CO)+ ,
43 (CH3CO)+ ,
29 (CH3CH2)+
que corresponderían a las roturas de los enlaces del carbono carbonílico de acuerdo
con la tercera regla de la fragmentación simple.
4) En vista de todas las pruebas anteriores se asigna al producto la estructura:
BUTANONA: CH3CH2COCH3
10
Ejemplo 2.:
1) Empezaremos por encontrar la formula molecular en el espectro de masas:
tenemos un pico molecular de relación m/e 122 (35.3, 100%) y nos dan las
intensidades de los picos M+1 (3.12, 8.84%) y M+2 (0.23, 0.65%), de dichas
intensidades podemos deducir la fórmula molecular suponiendo que por ser M par
la molécula no contiene átomos de Nitrógeno:
8.84 = 1.1 . nº C => nº C = 8
11
0.65 = 8.842/200 + 0.20 nºO => nº O = (0.65-0.39)/0.20 = 1.3
luego la fórmula molecular será:
C8HxO, donde X = 122-(12·8)-16 = 10; => C8H10O
Si lo hubiésemos hecho por la regla del 13 hubieramos obtenido:
C9H14 => C8H10O => C7H6O2 …
2) Número de instauraciones.
NI = (8.2-10)/2 + 1 = 4 insaturaciones
3) Grupos funcionales presentes.
Considerando dicho NI y la fórmula molecular podríamos pensar que se trata de un
producto aromático, al no tener el espectro de UV no lo podemos saber a ciencia
cierta. Observando el espectro de IR
vemos que sí es aromático pues presenta una serie de pequeñas absorciones entre
1600-2000 cm-1, además de una fuerte absorción a 1601.9 cm-1 de los dobles
enlaces. Podría tratarse de un producto aromático monosustituido debido a la
presencia de las bandas a 753.2 y 691.8 cm-1.
Para determinar el tipo de función oxigenada existente en la molécula deberíamos
observar el espectro de RMN de C-13, pero no lo tenemos por lo que debemos
hacerlo con el espectro de RMN protónica, aunque la única posibilidad es que se
trate de un éter, pues no hay más insaturaciones que las debidas al anillo
aromático y no se trata de un alcohol.
4) Subestructuras y conectividades.
En el espectro de 1H-RMN observamos
12
dos señales en la zona de los protones aromáticos que integran por 5 H: una a 7.4
ppm (triplete, 2H) y otra a 7.0 (multiplete, 3H), una señal a 4.1 ppm (cuadruplete,
2H) y otra a 1.5 ppm (triplete, 3H). El grupo CH2 a 4.1 ppm al tener dicho
desplazamiento nos indica que está oxigenado y al salir como cuadruplete implica
que se encuentra vecino a un CH3, dicho metilo debe, a su vez, salir como un
triplete (señal a 1.5 ppm). Las señales de los Hidrógenos aromáticos algo
apantalladas respecto a la referencia del benceno ( = 7.3 ppm) nos indica la
existencia como sustituyente en dicho anillo de un grupo electrón-donante (caso del
éter), por lo que la estructura debe ser:
ETIL-FENIL ETER: C6H5-OCH2CH3
En el espectro de masas observamos sólo 2 picos a m/e:
122 (M+),
94 (M-28),
el pico a 94 al ser un pico de masa par procedente de la fragmentación de un
molécula de masa par debe corresponder a la perdida de una molécula neutra de
masa 28, que debería ser etileno, por lo que dicho ión se formaría a través de una
Transposición de McLafferty:
13
Ejemplo 3.:
1) Empezaremos por encontrar la formula molecular en el espectro de masas:
Al darnos la masa exacta es como si nos diesen la formula molecular pues la
espectrometría de masas de alta resolución permite distinguir entre las distintas
fórmulas isomericas.Así en este caso dicha masa corresponde a una fórmula
molecular de C5H8O.
14
También si no tenemos una tabla de masas isotópicas1 podemos hacerlo mediante
la regla del 13, como en casos anteriores obteniendo como posibles fórmulas:
C6H12 —› C5H8O —› C4H4O2 …
2) Número de instauraciones.
NI = (5.2-8)/2 + 1 = 2 insaturaciones
3) Grupos funcionales presentes.
Considerando dicho NI y la fórmula molecular y al tener el espectro de UV una
absorción a 209 nm indicaría que existe conjugación en la molécula; pero como
ademas aparece una absorción a 328 nm debe tratarse de una cetona o aldehido
insaturado. Dicha suposición se confirma en el IR
en el que podemos observar un pico intenso de grupo carbonilo a 1700 cm-1 y otro
más débil a 1610 cm-1. Al observar el espectro de RMN de C-13 advertimos una
señal a 191 ppm (CH alsalir como duplete) que corresponde a un aldehido
Luego se trata de un aldehido
-insaturado.
4) Subestructuras y conectividades.
En el espectro de C-13 se observan además del pico correspondiente al aldehído a
191 ppm otras cuatro señales a:
160 (CH), 130 (CH),
25 (CH2)
y
10 ppm (CH3)
por lo que la molécula no posee ninguna simetría (El número de carbonos coincide
con el de la fórmula molecular). Los carbonos etilénicos son dos CH, lo que indica
que tendremos:
-CH=CH-CHO
15
Como no hay más instauraciones que esas dos de la estructura la estructura tiene
que ser:
CH3CH2-CH=CH-CH=O
2-PENTENAL
5) Justificación de la estructura.
En el espectro de 1H-RMN observamos la confirmación de dicha estructura:
el protón aldehídico a 9.25 (d, 1H), nos indica que se encuentra vecino a un CH,
siendo la 3JH1-H2
7 Hz; las siguientes señales a 6.70(doble triplete, 1H) y 5.82
(doble doble multiplete, 1 H) corresponden a los protones vinílicos H-3 y H-2
respectivamente, siendo la 3JH3-H2
14.7 Hz y la 3JH3-H4
7 Hz, se observa además
3
que existe acoplamiento entre JH2-H4
1.5 Hz; la señal a 2.1 ppm (multiplete, 2H)
corresponde al grupo metileno y debería presentar una multiplicidad de doble
cuadruplete o quintuplete por estar entre un CH3 y un CH, pero además debe existir
el acoplamiento arílico con H-2 por lo que aparecerá como ddc o dq; finalmente la
señal a 0.80 (triplete, 3H) corresponde al metilo terminal y saldrá como triplete por
estar vecino a un grupo metileno.
En el espectro de masas observamos como más significativos los picos a m/e:
84 (M+),
83 (M-1),
55 (M-29)
el pico a 83 debe corresponder al ion acilo procedente de la perdida del protón
aldehídico, y el pico a 55 puede proceder bien de la perdida de CO del pico anterior,
bien de la perdida del radical etilo en el ión molecular.
16
17
Tabla de Absorción de IR
Grupo Funcional
Absorción
Característica(cm-1)
Notas
Alquil C-H Stretch
2950 - 2850 (m or s)
El enlace C-H de los alcanos es
muy frecuente y se usa poco para
determinar la estructura.
Alquenil C-H
Stretch
Alquenil C=C
Stretch
3100 - 3010 (m)
1680 - 1620 (v)
Alquinil C-H
Stretch
Alquinil C=C
Stretch
~3300 (s)
2260 - 2100 (v)
Aromático C-H
Stretch
Aromático C-H
Bending
Aromático C=C
Bending
~3030 (v)
860 - 680 (s)
1700 - 1500 (m,m)
Alcohol/Fenol O-H
Stretch
3550 - 3200 (broad,
s)
Ácido carboxílico
O-H Stretch
3000 - 2500 (broad,
v)
Un pico de absorción cerca de
3000 cm-1 es frecuentemente
producido por una insaturación
Las aminas primarias producen
dos picos de absorción, las
secundarias uno y las terciaras
ninguno.
Amina N-H Stretch
3500 - 3300 (m)
Nitrilo C=N Stretch
2260 - 2220 (m)
Aldehido C=O
Stretch
Cetona C=O Stretch
Ester C=O Stretch
Ácido Carboxílico
C=O Stretch
Amida C=O Stretch
1740 - 1690 (s)
1750 - 1680 (s)
1750 - 1735 (s)
1780 - 1710 (s)
1690 - 1630 (s)
El pico de absorción de los
carnonilos es de los más fuerte
absorción en el infrarrojo, y es
muy usado en la determinación
estructural. Puede emplearse para
conocer el número de grupos
carbonilo y estimar su tipo.
3700 - 3500 (m)
Como las aminas, una amida
produce de cero a dos picos de
absorción N-H dependiendo del
tipo.
Amida N-H Stretch
18
1
H-RMN. Desplazamientos químicos característicos de
protones para distintos grupos funcionales
Función
Tipo de protón
ciclopropano
Alcanos
desplazamiento
químico (ppm)
0.2
0.9
1.3
1.5
1.5-2.0
acíclico
cíclico
Alquenos
4.6-5.9
1.8
Alquinos
2-3
Aromáticos
Haluros de alquilo
Alcoholes
Fenoles
Éteres
Aldehídos
Ácidos carboxílicos
Aminas alifáticas
Aminas aromáticas
Amidas
Ar-H
Ar-CH3
-CH2-X (X= I,Cl, Br)
C-O-H
H-C-OH
Ar-OH
-CH2-O-
6-8.5
2.3
3.2-3.5
1-5
3.4-4
4-4.7
3.3-4
-CHO
9-10
H-C-CO
2-2.7
-COOH
10.5-13
R-NH2
1-3
Ar-NH2
3-5
RCONHR
5-9
19
13
C RMN. Desplazamientos químicos característicos de carbono
Desplazamientos químicos
220 200 180 160 140 120 100 80
relativos al TMS (ppm)
H3C-C- primario
60
40
20
F
Cl
Br
I
Cl
Br
I
Br
I
H3C-SH3C-N
H3C-O-H2C-C secundario
Ciclopropanos
-H2C-S-H2C-N
-H2C-O-H2C-Hal
>CH-C- terciario
>CH-S>CH-N
>CH-Hal
F
C-C cuaternario
C-SC-N
C-OC-Hal
Alquinos
C=C=C Alenos
C=C Alquenos
Aromáticos
Heterociclos aromáticos
-S-CN
-N=C=S Isotiocianatos
-O-CN
-N=C=O
-CN
-NC
>C=N- Azometinos
(-CO)2O Anhidridos
-COOR
-CONHR
-(CO)2NR Imidas
-COOH
-COCl
-CHO
>C=O
20
0
-20