(6. ESPECTROSCOPÍA EJEMPLOS)
Anuncio
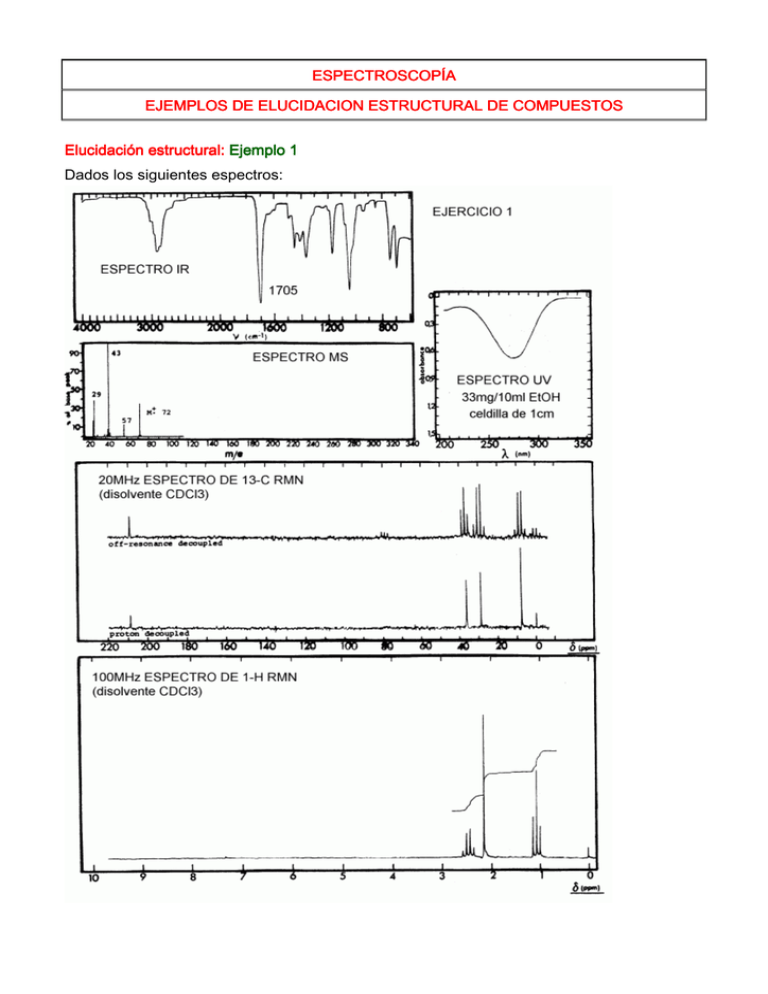
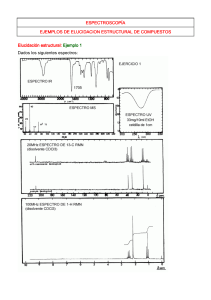
ESPECTROSCOPÍA EJEMPLOS DE ELUCIDACION ESTRUCTURAL DE COMPUESTOS Elucidación estructural: Ejemplo 1 Dados los siguientes espectros: 1) Empezaremos por encontrar la formula molecular, pues no la tenemos. Del espectro de masas obtenemos un pico molecular de relación m/e 72. Aplicaremos la regla del 13, obteniendo: 72/13 = 5 Resto = 7 => C5H12 -> + O – CH4 = C4H8O -> + O – CH4= C3H4O2 -> … 2) Número de instauraciones. Para ello deberíamos elegir una de las fórmulas moleculares, se puede hacer de una manera general con la primera de ellas C5H12 NI = 2.5-12/ 2 + 1 = 0, siendo para las siguientes C4H8O NI = 1, C3H4O2 NI = 2, … O bien determinar la verdadera fórmula molecular que podemos elegir viendo que en el espectro UV hay una absorción y por lo tanto debe existir un cromóforo (o lo que es lo mismo un doble enlace = 1 insaturación al menos); en el espectro IR en el que se observa un grupo carbonilo (C=O) (al menos una instauración y un átomo de Oxígeno) o en el espectro de RMN de C-13 en el que se observa la existencia de al menos 4 átomos de Carbono diferentes por lo que la formula sería: C4H8O NI = 1 3) Grupos funcionales presentes. En el espectro de IR se observa la existencia de un grupo carbonilo (C=O). Para ver de que tipo es debemos tener en cuenta que al presentar una absorción a λ max = 280 nm (A = 0.7; λ = 1 cm; c = 33.3/72.0.01 moles /litro) => ε = 15) debe tratarse de un aldehído o una cetona. Observando el espectro de RMN de C-13 vemos una señal a 210 ppm que sale como singulete en el “off resonance” indicando que se trata de una cetona. 4) Subestructuras y conectividades. En el espectro de 13C-RMN aparecen 4 señales diferentes a aproximadamente: 210 (CO), 36 (CH2), 29 (CH3) y 8 ppm (CH3) (la multiplicidad indicada se obtiene del “off resonante”) NOTA: En este caso al ser una molécula tan simple se podría asignar ya una estructura definitiva e inequívoca: BUTANONA: CH3CH2COCH3 Pero esto no es lo normal, por lo que seguiremos el protocolo normal. En el espectro de 1H-RMN observamos tres grupos de señales a : 2.5 (cuadruplete, 2H) 2.1 (singulete, 3H) 1.1 (triplete, 3H) (el número de Hidrógenos se obtiene asignando a la altura total de la integral el valor de 8 Hidrógenos) De ello podemos deducir: El grupo CH2 a 2.5 ppm al salir como cuadruplete implica que se encuentra vecino a un CH3, dicho metilo debe, a su vez, salir como un triplete. La señal del metilo a 2.1ppm debe encontrarse vecina a un carbono cuaternario (sin Hidrógeno), en este caso el C=O. En el espectro de masas observamos 4 picos a m/e: 72 (M+), 57 (M-15), 43 (M-29) 29 (M-43) que en vista de la estructura CH3CH2COCH3 podemos asignar respectivamente a los iones: 57 (CH3CH2CO)+ , 43 (CH3CO)+ , 29 (CH3CH2)+ que corresponderían a las roturas de los enlaces del carbono carbonílico de acuerdo con la tercera regla de la fragmentación simple. 4) En vista de todas las pruebas anteriores se asigna al producto la estructura: BUTANONA: CH3CH2COCH3 5) Justificación de los datos espectroscópicos. De acuerdo con las Tablas de Espectroscopia2 tenemos que dichos producto debería presentar las siguientes propiedades: UV: (página U65) IR: (página I 125) C-13: (página C170) 1H-RMN: (página H 125) EM: (páginas M 10, M20, M,25, M35) http://www.ugr.es/~quiored/espec/ej_1.htm ESPECTROSCOPÍA EJEMPLOS DE ELUCIDACION ESTRUCTURAL DE COMPUESTOS Elucidación estructural: Ejemplo 2 1) Empezaremos por encontrar la formula molecular en el espectro de masas: tenemos un pico molecular de relación m/e 122 (35.3, 100%) y nos dan las intensidades de los picos M+1 (3.12, 8.84%) y M+2 (0.23, 0.65%), de dichas intensidades podemos deducir la fórmula molecular suponiendo que por ser M par la molécula no contiene átomos de Nitrógeno: 8.84 = 1.1 . nº C => nº C = 8 0.65 = 8.842/200 + 0.20 nºO => nº O = (0.65-0.39)/0.20 = 1.3 luego la fórmula molecular será: C8HxO, donde X = 122-(12·8)-16 = 10; => C8H10O Si lo hubiésemos hecho por la regla del 13 hubieramos obtenido: C9H14 => C8H10O => C7H6O2 … 2) Número de instauraciones. NI = (8.2-10)/2 + 1 = 4 insaturaciones 3) Grupos funcionales presentes. Considerando dicho NI y la fórmula molecular podríamos pensar que se trata de un producto aromático, al no tener el espectro de UV no lo podemos saber a ciencia cierta. Observando el espectro de IR vemos que sí es aromático pues presenta una serie de pequeñas absorciones entre 1600-2000 cm-1, además de una fuerte absorción a 1601.9 cm-1 de los dobles enlaces. Podría tratarse de un producto aromático monosustituido debido a la presencia de las bandas a 753.2 y 691.8 cm-1. Para determinar el tipo de función oxigenada existente en la molécula deberíamos observar el espectro de RMN de C-13, pero no lo tenemos por lo que debemos hacerlo con el espectro de RMN protónica, aunque la única posibilidad es que se trate de un éter, pues no hay más insaturaciones que las debidas al anillo aromático y no se trata de un alcohol. 4) Subestructuras y conectividades. En el espectro de 1H-RMN observamos dos señales en la zona de los protones aromáticos que integran por 5 H: una a 7.4 ppm (triplete, 2H) y otra a 7.0 (multiplete, 3H), una señal a 4.1 ppm (cuadruplete, 2H) y otra a 1.5 ppm (triplete, 3H). El grupo CH2 a 4.1 ppm al tener dicho desplazamiento nos indica que está oxigenado y al salir como cuadruplete implica que se encuentra vecino a un CH3, dicho metilo debe, a su vez, salir como un triplete (señal a 1.5 ppm). Las señales de los Hidrógenos aromáticos algo apantalladas respecto a la referencia del benceno (δ = 7.3 ppm) nos indica la existencia como sustituyente en dicho anillo de un grupo electróndonante (caso del éter), por lo que la estructura debe ser: ETIL-FENIL ETER: C6H5-OCH2CH3 En el espectro de masas observamos sólo 2 picos a m/e: 122 (M+), 94 (M-28), el pico a 94 al ser un pico de masa par procedente de la fragmentación de un molécula de masa par debe corresponder a la perdida de una molécula neutra de masa 28, que debería ser etileno, por lo que dicho ión se formaría a través de una Transposición de McLafferty: figura 5) Justificación de los datos espectroscópicos. De acuerdo con las Tablas de Espectroscopia2tenemos que dichos producto debería presentar las siguientes propiedades: UV: (página U80) IR: (página I 55) C-13: (página C120) 1H-RMN: (página H 255) EM: (páginas M 40) http://www.ugr.es/~quiored/espec/ej_2.htm ESPECTROSCOPÍA EJEMPLOS DE ELUCIDACION ESTRUCTURAL DE COMPUESTOS Elucidación estructural: Ejemplo 3 Dados los siguientes espectros: 1) Empezaremos por encontrar la formula molecular en el espectro de masas: Al darnos la masa exacta es como si nos diesen la formula molecular pues la espectrometría de masas de alta resolución permite distinguir entre las distintas fórmulas isomericas.Así en este caso dicha masa corresponde a una fórmula molecular de C5H8O. También si no tenemos una tabla de masas isotópicas1 podemos hacerlo mediante la regla del 13, como en casos anteriores obteniendo como posibles fórmulas: C6H12 —› C5H8O —› C4H4O2 … 2) Número de instauraciones. NI = (5.2-8)/2 + 1 = 2 insaturaciones 3) Grupos funcionales presentes. Considerando dicho NI y la fórmula molecular y al tener el espectro de UV una absorción a 209 nm indicaría que existe conjugación en la molécula; pero como ademas aparece una absorción a 328 nm debe tratarse de una cetona o aldehido insaturado. Dicha suposición se confirma en el IR en el que podemos observar un pico intenso de grupo carbonilo a 1700 cm-1 y otro más débil a 1610 cm-1. Al observar el espectro de RMN de C-13 advertimos una señal a 191 ppm (CH alsalir como duplete) que corresponde a un aldehido Luego se trata de un aldehido α,β-insaturado. 4) Subestructuras y conectividades. En el espectro de C-13 se observan además del pico correspondiente al aldehído a 191 ppm otras cuatro señales a: 160 (CH), 130 (CH), 25 (CH2) y 10 ppm (CH3) por lo que la molécula no posee ninguna simetría (El número de carbonos coincide con el de la fórmula molecular). Los carbonos etilénicos son dos CH, lo que indica que tendremos: -CH=CH-CHO Como no hay más instauraciones que esas dos de la estructura la estructura tiene que ser: CH3CH2-CH=CH-CH=O 2-PENTENAL 5) Justificación de la estructura. En el espectro de 1H-RMN observamos la confirmación de dicha estructura: el protón aldehídico a 9.25 (d, 1H), nos indica que se encuentra vecino a un CH, siendo la 3J H1-H2 ≈ 7 Hz; las siguientes señales a 6.70(doble triplete, 1H) y 5.82 (doble doble multiplete, 1 H) corresponden a los protones vinílicos H-3 y H-2 respectivamente, siendo la 3JH3-H2 ≈ 14.7 Hz y la 3JH3-H4 ≈ 7 Hz, se observa además que existe acoplamiento entre 3JH2-H4 ≈ 1.5 Hz; la señal a 2.1 ppm (multiplete, 2H) corresponde al grupo metileno y debería presentar una multiplicidad de doble cuadruplete o quintuplete por estar entre un CH3 y un CH, pero además debe existir el acoplamiento arílico con H-2 por lo que aparecerá como ddc o dq; finalmente la señal a 0.80 (triplete, 3H) corresponde al metilo terminal y saldrá como triplete por estar vecino a un grupo metileno. En el espectro de masas observamos como más significativos los picos a m/e: 84 (M+), 83 (M-1), 55 (M-29) el pico a 83 debe corresponder al ion acilo procedente de la perdida del protón aldehídico, y el pico a 55 puede proceder bien de la perdida de CO del pico anterior, bien de la perdida del radical etilo en el ión molecular. 6) Justificación de los datos espectroscópicos. De acuerdo con las Tablas de Espectroscopia2 tenemos que dichos producto debería presentar las siguientes propiedades: UV: (página U65) IR: (página I 120) C-13: (página C90, C170) 1H-RMN: (página H 120, H215) EM: (páginas M 25) Referencias y notas: (1) R.M. Silverstein, F.X. Webster, Spectrometric Identification of Organic Compounds, 6ª Ed.,New York, 1998. 1998 http://www.ugr.es/~quiored/espec/ej_3.htm