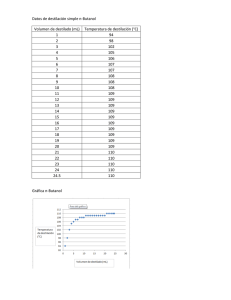
Estudio experimental de la destilación diferencial seguida a partir de la velocidad de evaporación. 1Facultad E.B Viñas Reyes1*, M. Pérez Camacho1 de Estudios Superiores Zaragoza, Universidad Nacional autónoma de México, Batalla de 5 de Mayo s/n, Ejercito de Oriente, C.P. 09230, Ciudad de México., México. *elivirey@gmail,com Área de participación: Ingeniería Química Resumen El motivo de este trabajo es aportar mejoras en la práctica experimental L3 “Análisis y operación de un sistema de destilación” del módulo “Procesos de separación” del séptimo semestre de la carrera de ingeniería química de la Facultad de Estudios Superiores Zaragoza de la UNAM, para que los estudiantes pueda entender e interpretar el fenómeno de la destilación diferencial para lo cual, se realizó el estudio experimental de este fenómeno empleando dos mezclas binarias: tolueno-hexano y acetona-cloroformo seguidas a partir de la velocidad de vaporación e índice de refracción. Palabras clave: destilación diferencial, velocidad de vaporización, experimentación. Abstract The reason for this work is to provide improvements in the experimental practice L3 "Analysis and operation of a distillation system" of the module "Separation processes" of the seventh semester of the chemical engineering career of the Facultad de Estudios Superiores Zaragoza UNAM, so that Students can understand and interpret the phenomenon of differential distillation for which, the experimental study of this phenomenon was carried out using two binary mixtures: toluene-hexane and acetone-chloroform followed from the vaporization rate and refractive index. Key words: differential distillation, vaporization rate, experimentation. Introducción La destilación simple o diferencial es una operación intermitente en la que la mezcla a destilar se carga en el matraz de destilación, donde se suministra el calor necesario para llevarla a su temperatura de burbuja, originando una porción de vapor (masa diferencial de vapor dV)), rica en el componente más volátil y en equilibrio termodinámico con el líquido remanente en el matraz de composición y. Esta primera porción de vapor tiene la característica de tener la más alta concentración del componente más volátil. El vapor es retirado tan rápido como se genera, haciéndolo pasar a través de un condensador total a su fase líquida xD dando lugar al producto destilado (fig. 1). A medida que transcurre la destilación se va modificando la composición del líquido ya que preferentemente se eliminan los componentes más volátiles, con lo que va aumentando la temperatura de burbuja de la mezcla. Naturalmente, el vapor en equilibrio con el líquido también cambia continuamente su composición, empobreciéndose en el componente más volátil. Este tipo de destilación se usa frecuentemente en trabajos de laboratorio y en plantas piloto. También se utiliza con fines analíticos para caracterizar fracciones de petróleo o distintos productos determinando intervalos de destilación. El motivo de este trabajo es que el alumno pueda entender e interpretar el fenómeno de la destilación diferencial para lo cual, se realizo el estudio experimental de este fenómeno empleando dos mezclas binarias seguida a partir de la velocidad de evaporación en el laboratorio del módulo “Procesos de separación” del séptimo semestre de la carrera de ingeniería química. Metodología Primeramente se da una introducción a los estudiantes sobre el tema de la destilación diferencial para posteriormente pasar al procedimiento experimental. Para explicar la destilación diferencial se emplea el esquema de la fig. 1. En el cual se aprecia el material y el montaje que se debe realizar para llevar acabo el experimento y la nomenclatura utilizada. Li = x= Lf = V= y= Lf = xf = D= Fig. 1. Esquema del proceso de destilación diferencial xD = xDm = Moles totales iniciales de líquido cargados en el matraz a t=0 Fracción mol del componente más volátil en el líquido a t=0 Moles de líquido al finalizar la destilación Flujo de vapor que abandona el matraz a cualquier tiempo (moles/tiempo) Fracción mol del componente más volátil en el vapor a cualquier tiempo en equilibrio con el líquido del hervidor Moles totales presenten en el líquido del matraz al finalizar la operación Fracción mol del componente más volátil en el líquido al finalizar la operación Moles totales del destilado líquido al finalizar la operación Fracción mol del componente más volátil destilado. Fracción mol promedio del producto destilado al finalizar la operación. El objetivo general de la práctica es estudiar el proceso de destilación diferencial en dos sistemas de mezclas binarias. El objetivo académico de la práctica es demostrar la influencia de la velocidad de vaporización en la dinámica de separación del componente más volátil de otro menos volátil en una destilación diferencial. Los objetivos específicos de la práctica son: 1. Orientar la Orientar la aplicación de la Ecuación de Rayleigh al análisis de los datos experimentales para entender el fenómeno de destilación diferencial. 2. Comparar el comportamiento de dos sistemas binarios en el equilibrio líquido-vapor. Reactivos: tolueno, heptano, cloroformo y acetona 60 ml de cada uno. Servicios: energía eléctrica, agua de enfriamiento Material: dos kits de destilación, dos parrillas de calentamiento con agitación, refractómetro, recirculador de agua, termómetros, probetas graduadas, tubos de ensaye, vasos de precipitados, soportes universales, mangueras, gradillas, cronómetro, reóstato. Procedimiento: 1. Se arma el sistema de destilación como se observa en la fig. 1 2. Al inicio de la operación se cargan 50 mL de cada reactivo. L moles totales de componentes A (más volátil) y B (menos volátil), con una fracción mol (x) para A. Sistema 1: Heptano -Tolueno Sistema 2: Acetona-Cloroformo 3. Se mide el índice de refracción de ambos sistemas y se calienta la mezcla. A continuación, se abre con cuidado el paso del agua al condensador total el cual, se debe abierta durante toda la destilación, y se conecta el reóstato en una posición tal que la ebullición no sea demasiado rápida. Después de iniciar la operación, a cualquier tiempo “t”, en el matraz están presentes L moles totales de líquido, con una fracción mol (x) para el más volátil y una vez alcanzada la ebullición, inicia el desprendimiento del vapor (moles/tiempo) el cual tiene una fracción mol (y) del componente más volátil en equilibrio con el líquido. 4. Cuando inicia la destilación, se toma la primera muestra para analizar su composición en el refractómetro, se lee la temperatura a la que se ha comenzado la destilación y el volumen de destilado (D). 5. Cada dos minutos se recolecto muestra de destilado (x), se midió su volumen y analizo una pequeña muestra de cada uno en el refractómetro también, se tomó lectura de la temperatura. 6. El proceso se detuvo cuando el volumen en el matraz de destilación era de 6 a 10 mL. 7. Al finalizar la operación, el destilado que se ha colectado constituye D moles totales, con una fracción mol promedio xDm para el más volátil. Todo el líquido recolectado en el destilado se homogeniza y se determina su composición tomando una pequeña muestra y se realiza su análisis en el refractómetro. 1. Planteamiento matemático del proceso. Balance total de materia Desarrollando el lado izquierdo de (3) Acumulación = Entradas – Salidas + Generación Ldx + xdL = ydL 𝑑𝐿 𝑡 =0−𝑉+0 (1) Balance total de materia del componente más volátil 𝑑𝑥 𝑡 Agrupando términos de (4) dL(y-x) = Ldx (5) Separando variables en (5) e integrando = 0 − 𝑉𝑦 + 0 (2) 𝑑𝐿𝑥 = 𝐿 𝑥 𝑑𝑥 = ∫𝑥 𝑖 (𝑦−𝑥) 𝑓 (6) y resolviendo (6) tenemos 𝑑𝐿 𝑦 𝑑𝑡 ó, equivalentemente 𝐿𝑖 𝑑𝐿 ∫𝐿𝑓 Sustituyendo (1) en (2) 𝑑𝑡 (4) d(Lx) = ydL (3) 𝐿𝑓 𝑥 𝑖 𝑖 𝑑𝑥 𝑙𝑛 𝐿 = ∫𝑥 𝑓 (𝑦−𝑥) (7) A la Ec. (7) se conoce como Ecuación de Raleigh Para integrar el segundo miembro de la Ec. (7), es necesario conocer la relación existente entre la concentración del vapor y que se va desprendiendo en cada instante, y la concentración de la fase líquida que hay en el interior del matraz de destilación x. Esta relación se conoce como relación de equilibrio líquido-vapor. Para determinar la fracción mol xf en el líquido remanente del matraz para el componente más volátil se emplea la Ec. (7) y se requieren valores de equilibrio para trazar la grafica 1/(y-x) vs x como se ve en las figuras 2 y 3, para aplicar integración gráfica o numérica al segundo miembro de la Ec. 7 con la finalidad de tener el valor de xf. Figura 2 y 3 Relación de equilibrio vs composición para los sistemas 1 y 2. Procedimiento empleando método numérico por Simpson ¾. 1. Como xf se desconoce, se necesita un procedimiento de tanteos para integrar. 2. Proponer un valor para xf. Recordando que el valor final de xf debe ser menor que xi. 3. Integrar para determinar el área (A) bajo la curva (fig. 2 y 3) para ambos sistemas. De acuerdo con los datos de la experimentación, conocemos Li y Lf que medimos indirectamente al hacer la restar Lf = Li-Dn donde Dn es la cantidad de destilado obtenido cada 2 minutos. 4. Cuando A = la integral con el valor propuesto de xLf se detiene el proceso. La tabla 1 y 2 presenta los valores de Lf, A, xf, que se calcularon para un total de 11 y 5 muestras para el sistema 1 y 2 respectivamente. Los valores teóricos de D y xD se determinaron con las Ec. 8 y 9. Tabla 1. Resultados para la Ec. De Balance general para el sistema 1 No. 0 1 2 3 4 5 6 7 8 9 10 11 Lf (mol) 0.8114 0.7952 0.7546 0.7222 0.6897 0.6573 0.6167 0.5680 0.5128 0.4650 0.4211 0.3757 A 0 0.0202 0.0726 0.1165 0.1625 0.2107 0.2744 0.3567 0.4589 0.5569 0.6559 0.7700 Li = Lf + D xf 0.4180 0.4162 0.4115 0.4076 0.4035 0.3992 0.3936 0.3863 0.3773 0.3686 0.3600 0.3500 D 0 0.0162 0.0568 0.0893 0.1217 0.1542 0.1948 0.2434 0.2986 0.3465 0.3903 0.4358 xD-TEOR 0 0.5064 0.5040 0.5021 0.5001 0.4980 0.4954 0.4920 0.4880 0.4842 0.4806 0.4766 D = Li - Lf Tabla 2. Resultados para la Ec. De Balance general para el sistema 2 No. Lf (mol) A xf D 0 1.3137 0 0.582 0 1 1.1559 0.1278 0.5765 0.1578 2 1.064 0.2107 0.5731 0.2496 3 1.0246 0.2485 0.5714 0.2891 4 1.0114 0.2614 0.5708 0.3022 5 0.9986 0.2744 0.5703 0.3151 xD-TEOR 0 0.6218 0.6202 0.6194 0.6192 0.6189 (8) Del balance en el componente más volátil Li xf = Lf xf + DxD 𝑥𝐷 = 𝐿𝑖 𝑥𝑖−𝐿𝑓𝑥𝑓 𝐿𝑖 −𝐿𝑓 (9) Se construyo una curva de calibración a partir de las soluciones indicadas en las tablas 3 y 4 para seguir la variación de la fracción mol del componente más volátil en el destilado xD, midiendo el índice de refracción (I.R) 1.00 0.90 0.80 0.70 0.60 0.50 0.40 0.30 0.20 0.10 0.00 y= 1.38 31.616x2 - 100.3x + 79.287 R² = 0.9997 1.43 %V Hep. 20 40 60 80 100 100 80 60 40 20 0 y = 59.961x2 - 178.53x + 132.86 R² = 0.99 1.48 1.34 1.36 1.38 1.4 1.42 IR I.R Figura 4 y 5. Curvas de calibración para el sistema 1 y 2 de estudio. Tabla 3. Sistema1. Índice de refracción vs composición %V Tol. 1.00 0.90 0.80 0.70 0.60 0.50 0.40 0.30 0.20 0.10 0.00 X x de una pequeña muestra de las porciones de destilado tomado cada dos minutos como se presenta en la tabla 4 y 5 para cada sistema estudiado. Vol. ml Vol. ml Tolueno Heptano 0 1 2 3 4 5 frac. Mol Tolueno 5 4 3 2 1 0 0.00 0.26 0.48 0.68 0.85 1.00 frac. Mol Heptano 1.00 0.74 0.52 0.32 0.15 0.00 1.44 1.46 1.48 Tabla 4. Sistema 2. Índice de refracción vs composición I.R %V Ace. 1.39 1.41 1.43 1.45 1.47 1.49 0 20 40 60 80 100 %V Vol ml Clorof. Acetona 100 80 60 40 20 0 0 1 2 3 4 5 Vol ml Clorof. 5 4 3 2 1 0 frac. Mol Acetona 0 0.21 0.42 0.62 0.81 1 frac. Mol Clorof. 1 0.79 0.58 0.38 0.19 0 I.R 1.36 1.37 1.39 1.41 1.44 1.46 En la tabla 4 y 5 se resumen los datos recabados cada dos minutos durante la destilación como son: la temperatura (T), el volumen de destilado (VD), se midió el I.R de una pequeña muestra de cada destilado y por tanto su composición (xD-Exp) en las curvas de calibración (fig. 4 y 5) para el sistema 1 y 2. Tabla 4 y 5. Datos recolectados durante la destilación para los sistemas 1 y 2. No. t (min) T (°C) VD (ml) 0 1 2 3 4 5 6 7 8 9 10 11 0 4.46 6.46 8.46 10.46 12.46 14.46 16.46 18.46 20.46 22.46 24.46 23 95 96 96 96 96 96 96 96 96 96 96 0 2 5 4 4 4 5 6 6.8 5.9 5.4 5.6 I.R 1.439 1.426 1.426 1.427 1.427 1.427 1.429 1.429 1.431 1.433 1.435 1.437 xD-Exp (mol) 0.5496 0.5445 0.5395 0.5345 0.5345 0.5195 0.5145 0.4948 0.4802 0.4562 0.4373 No. t (min) T (°C) VD (ml) 0 0 23 0 1 2 50 12 2 4 50 7 3 6 50 3 4 8 50 1 5 10 50 1 I.R xD-EXP (mol) 1.405 0 1.400 0.622 1.398 0.620 1.397 0.619 1.395 0.619 1.395 0.619 Resultados y discusión Se aprecia claramente en la fig. 6 referida al sistema 1, como la composición del destilado (xD) al inicio del experimento tiene la característica de tener la más alta concentración del componente más volátil y va empobreciendo en este a medida que transcurre la destilación en cambio, en el sistema 2, se observa que a la acetona le costó más trabajo liberarse para enriquecer al destilado debido a que estos componentes se atraen fuertemente por lo que se presenta un paulatino incremento en la composición de la acetona a medida que progresa la destilación al incrementarse la temperatura (fig.7). 0.70 0.60 0.60 0.55 0.50 xD xD 0.50 0.45 0.40 0.30 0.40 0.20 0.35 0.10 0.00 0.30 0 2 4 6 t(min) XD-Exp 8 10 0 12 2 4 t(min) xD-Exp XD-Teor 6 8 xD-Teo Figura 6 y 7 presentan variación de la comparación de xD experimental y la calculada (con Ec.9) para cada sistema estudiado. Efecto de la velocidad de vaporización en la destilación. Se estudiaron dos sistemas diferentes para observar la influencia de la velocidad de vaporización en la dinámica de separación del componente más volátil de otro menos volátil en una destilación diferencial y de acuerdo con lo que se observa en fig. 9 y 10 se puede inferir que en el sistema 1, la velocidad de vaporización del heptano en relación al tolueno es constante en comparación con el sistema 2, acetona-cloroformo que es una mezcla con punto de ebullición máximo en donde la velocidad de vaporización del sistema se mantuvo constante al inicio de la destilación, posteriormente entró a una zona de transición donde la composición de la mezcla era más rica en el componente más volátil. Fig. 9 Velocidad de vaporización del sistema 1. Fig. 10 Velocidad de vaporización del sistema 2. 0.50 0.35 0.45 0.30 0.35 0.25 0.30 0.20 Li-Lf Li-Lf 0.40 0.25 0.20 0.15 0.15 0.10 0.10 0.05 0.05 0.00 0.00 0 2 4 6 8 t(min) 10 12 14 0 2 4 6 8 10 12 t(min) Trabajo a futuro Mejorar la metodología relacionada con la recopilación de datos durante la práctica experimental con la finalidad de compara los datos experimentales con los que predice la teoría. Incorporar en la práctica experimental del laboratorio de 7° semestre, el objetivo académico y específicos que se siguieron en este experimento a favor, de que el estudiante comprenda el proceso de destilación diferencial y la influencia de la velocidad de vaporización en la dinámica de separación del componente más volátil de otro menos volátil en una destilación. Se plantea evaluar en una segunda etapa dicho aprendizaje de una forma, no solo cualitativa por lo que se continúa trabajando en ello. Conclusiones Este trabajo es una propuesta de mejora continua y para realizar las modificaciones pertinentes en el trabajo experimental que se realiza en los laboratorios de la carrera de ingeniería química de tal forma, que estos contengan objetivos claros de aprendizaje y contribuyan a que los estudiantes desarrollen sus habilidades y su pensamiento crítico. Se inicio por replantear los objetivos de la práctica experimental L3 “Análisis y operación de un sistema de destilación” así como la recolección y tratamiento de los datos experimentales promoviendo la reflexión, la toma de decisiones y las habilidades de argumentación sobre los resultados obtenidos así como compartir ideas es decir, se buscó involucrar activamente a los estudiantes. Agradecimientos Agradecemos al programa UNAM-DGAPA-PAPIME-PE105219 por el financiamiento para la presentación de este trabajo. Referencias 1. McCabe, Warren L. Operaciones unitarias en ingeniería química. McGraw-Hill, 4ta. Edición, España, 1998,1121 págs. 2. Treybal, Robert E. Operaciones de Transferencia de Masa. McGraw-Hill, 2da. Edición, E.U.A., 1955, 865 págs. 3. Wankat, Phillip C. Ingeniería de Procesos de Separación. Pearson Educación, 2da. Edición, México, 2008, 723 págs. 4. Valiente, Antonio B. Problemas de Balance de Materia y Energía en la Industria Alimentaria. Limusa, 2da. Edición, México, 1986, 309 págs.