MANUAL DE PROCEDIMIENTOS
ANALÍTICOS
TRIGLICÉRIDOS
INTRODUCCIÓN.
Los triglicéridos son ésteres de ácidos grasos cuya hidrólisis produce glicerol y ácidos grasos libres. Si su determinación
se realiza en conjunción con otros ensayos para lípidos; entonces resulta útil en el diagnóstico de hiperlipoproteinemia.
Algunos de los métodos estándar que se emplean para cuantificar los niveles de triglicéridos involucran la hidrólisis
enzimática ó alcalina en la liberación del glicerol. El procedimiento que aquí se refiere, esta basado en la hidrólisis
enzimática gracias a su especificidad y a que no es interferida por fosfolípidos.
Método: Enzimático Colorimétrico (GPO -PAP)
Fundamento: Los triglicéridos (TG) son hidrolizados enzimáticamente por una lipasa a glicerol el
cual mediante la glucokinasa (GK) y la glicerol fosfato oxidasa (GPO) libera peróxido de hidrógeno
(H2O2) que se valora a través de la reacción de Trinder finalizando con la formación
quinoneimina. (1)
lipasa
TG + H2O ----------- glicerol + ac. grasos
GK
glicerol + ATP ------ glicerol-3-P + ADP
GPO
G-3-P + O2 ----------dihidroxiacetona-P + H2O2
POD
H2O2 + 4-AAP + p-clorofenol ---------- quinona + H2O
Composición del reactivo: (concentración inicial)
Tampón GOOD
50 mmol/l
pH 7.5
P-clorofenol
2 mmol/l
R2
Lipoprotein lipasa
150 000 U/l
Vial
Glicerol kinasa
500 U/l
enzimas Glicerol-p-oxidasa
2 500 U/l
peroxidasa
440 U/l
4-aminofenazona
0.1 mmol/l
ATP
0.1 mmol/l
Patrón
2.26 mmol/l
Preparación: Disolver el contenido de R2 en R1.
Estabilidad: Estable 6 semanas a 2-8 °C o 1 semana a 15-25 °C
Muestra: Suero (no ictérico ni hemolítico) o plasma heparinizado o con EDTA de paciente en
ayuna de 12 horas. Los TG son estables en suero 3 días a 2-8 °C. (2)
Técnica:
Blanco Patrón Muestra
0.01 ml
Patrón
0.01 ml
Muestra
1 ml
1 ml
1 ml
Reactivo
Mezclar e incubar 5 minutos A 37 °C ó 10 minutos a T ambiente. Medir la Absorbancia a 505 nm
(490 - 550) frente al blanco de reactivo. El color es estable por 30 minutos
Cálculo:
R1
Tampón
Absorbancia Muestra
------------------------------ x CP = CM
Absorbancia Patrón
Factor de conversión: mg/dl x 0.0113 = mmol/l
Linealidad: 9.12mmol/l. Para concentraciones superiores mezclar 0.1 ml (100 l) de muestra con
0.2 ml (200 l) de cloruro de sodio al 0.9 % y repetir la determinación, multiplicar el resultado por 3.
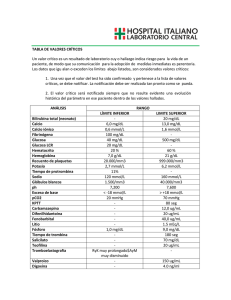
Valores de referencia: 0.35 -1.71 mmol/l. (4)
Sospechoso: a partir de 1.71 mmol/l.
Elevado: a partir de 2.28 mmol/l.
Notas: La bilirrubina o los sueros ictéricos elevan falsamente los niveles de TG. (3) La hemólisis interfiere en
el ensayo.
Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y evitar
contactos con piel y mucosas.
Control de calidad: Todos los sueros control con valores de triglicéridos determinados por este método
pueden ser empleados.
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de plástico); cronómetros; baño de
María con control a 37 0C; espectrofotómetro con capacidad para medir absorbancias especificadas en la técnica.
Semiología: (4)
Aumento:
Hiperlipoproteinemias tipos: I, IIB, III, IV, V
Enfermedad Hepática
Síndrome Nefrótico
Hipotiroidismo
Diabetes incontrolada
Pancreatitis
Enfermedad por almacenamiento de glucógeno
Endocrinopatías
IMA
Disfunción pancreática
Toxemia
Disminución:
Enfermedad pulmonar obstructiva crónica
Infarto cerebral
Hipertiroidismo
Malnutrición
Síndrome de malabsorción
COLESTEROL
INTRODUCCIÓN.
El colesterol es un compuesto liposo que se encuentra en sangre y en tejido biliar y cerebral; actuando como precursor
de los ácidos biliares, los esteroides y la vitamina D. La determinación de colesterol en suero es la principal prueba para
diagnosticar y clasificar lipemias. Los niveles de colesterol están relacionados con enfermedades de tiroides e hígado.
Los métodos enzimáticos han reemplazado metodologías antiguas que involucran a la colesterol esterasa y oxidasa, así
como indicadores de Trinders.
Método: Enzimático (CHOD - PAP)
Fundamento: La colesterol esterasa hidroliza los esteres de colesterol presentes en la muestra
dando colesterol libre que por acción de la colesterol oxidasa (CHOD) se transforma en H2O2 o
colesten-3-ona. En la reacción catalizada por la peroxidasa (PAP) se obtiene un compuesto
coloreado llamado quinoneimina.
Col. esterasa
Esteres de col. + H2O ------ colesterol + Ac. grasos
CHOD
Colesterol + O2 --------- 4-colesterona + H2O2
POD
2H2O2 + 4-AAP + fenol ------- quinoneimina + 2H2O
Composición de reactivos: (concentración inicial)
R1
Pipes pH 6.9
90 mmol/l
Tampón
Fenol
26 mmol/l
R2
Peroxidasa
1250 µ/l
Liofilizado
Col. esterasa
300 mmol/l
CHOD
300 mmol/l
4-AAP
0.4 mmol/l
Patrón
5.16 mmol/l
Preparación: Disolver con agitación suave 2, con un poco de 1. Luego completar.
Estabilidad: 4 meses de 2-8 0C o 40 días a temperatura ambiente protegido de la luz.
Muestra: Suero (no ictérico ni hemolítico) o plasma heparinizado o con EDTA de paciente en
ayuna de 12 horas. Estable por 7 días a 2-8 0C ó 3 meses congelada a -20 0C
Técnica:
Blanco
Patrón
Muestra
Reactivo
1 ml
Patrón
10 µl
1 ml
Muestra
10 µl
1 ml
Mezclar e incubar 5 minutos a 37 0C ó 10 minutos a temperatura ambiente. Ajustar a cero con
blanco reactivo. Leer a 505 nm (490-550). La coloración es estable 60 minutos.
Cálculo:
Absorbancia Muestra
------------------------------ x CP = CM
Absorbancia Patrón
Factor de conversión: mg/dl x 0.0258 = mmol/l
Linealidad: hasta 15.51 mmol/l. Para concentraciones superiores mezclar 0.1 ml (100 l) de
muestra con 0.2 ml (200 l) de cloruro de sodio al 0.9 % y repetir la determinación, multiplicar el
resultado por 3.
Valores de referencia: 3.8 - 6.7 mmol/l. Estos valores varían con la dieta, la edad o de país a
país.
Notas: El Ac. Ascórbico por encima de 300 µmol/l interfiere negativamente. (2)
La hemólisis superior a 3 g/l de Hb interfiere positivamente. Se elimina restando la absorbancia de un
blanco de muestra.
La bilirrubina > 10 mg/dl interfiere.
Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y evitar
contactos con piel y mucosas.
Control de calidad: Todos los sueros control con valores de colesterol determinados por este método
pueden ser empleados.
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de plástico); cronómetros; baño de
María con control a 37 0C; espectrofotómetro con capacidad para medir absorbancias especificadas en la técnica.
Semiología: (3)
Aumento:
Enfermedad cardiovascular
Aterosclerosis
Hipercolesterolemia familiar
Íctero obstructivo (con aumento de bilirrubina)
Hipotiroidismo
Nefrosis
Xantomatosis
Diabetes incontrolada
Síndrome nefrótico
Obesidad
Disminución:
*Cuando no se absorbe por el tracto gastrointestinal:
Malabsorción
Anemia
Estrés
Enfermedad hepática
Hipertiroidismo
Sepsis
Drogas (antibióticos)
*Otras causas: Anemia perniciosa,
Cáncer, Íctero hemolítico, Hipolipoproteinemias
COLESTEROL LIPOPROTEINAS DE ALTA DENSIDAD (HDL-C)
Método: Precipitante fosfotúngstico
Fundamento: Al reaccionar el suero con un reactivo precipitante de Proteínas, precipitan las
LDL (lipoproteínas de baja densidad) o VLDL (lipoproteínas de muy baja densidad) quedándose
en el sobrenadante las HDL (lipoproteínas de alta densidad) donde se determina el colesterol
ligado a las mismas por el método enzimático CHOD - POD. (1)
Composición de reactivos: (precipitante) (concentración inicial)
Ac. Fosfotúngstico
14 mmol/l
MgCl2 H2O
2 mmol/l
Patrón de colesterol
1.29 mmol/l
Preparación: Utilizar el reactivo precipitante sin diluir.
Estabilidad: 2-8 0C hasta su fecha de caducidad.
Muestra: Suero (no ictérico ni hemolítico) o plasma de paciente en ayuna de 12 horas. El
HDL-c es estable 7 días a 15-25 0C y 14 días a 2-6 0C.
Técnica: (dosificar en tubos de centrifuga)
0.5 ml
Muestra
0.05 ml
Reactivo precipitante
Mezclar, dejar reposar 10 min a temperatura
ambiente.
Centrifugar 20 minutos A 4000 rpm ó 2 minutos a 12000 rpm. Determinar el colesterol, por el
método CHOD - PAP, al sobrenadante.
Nota: Si el sobrenadante quedara turbio realizar lo siguiente:
0.25 ml
Solución Salina (0.9 %)
0.25 ml
Muestra
0.05 ml
Reactivo precipitante
Mezclar, reposar 10 min., centrifugar.
Multiplicar resultado del colesterol por 2.
Cálculos HDL-c:
HDL-c = resultado del colesterol (CHOD - PAP) x
1.1 (dilución)
Cálculos LDL-c: (utilizando la formula de Friedewald).
LDLc = Col. total - HDLc - (Triglicéridos / 2.2)*
* Esta fórmula no ofrece confiabilidad cuando las concentraciones de triglicéridos están por encima de 4.5
mmol/l o cuando hay presencia de quilomicrones.
Valores de referencia:
LDL-COLESTEROL: 3.9 - 4.9 mmol/l
HDL-COLESTEROL: (H) 0.9 - 1.42 mmol/l
(M) 1.16 - 1.68 mmol/l
Riesgo de IMA relacionado con colesterol y LDLc (mmol/l)
Colesterol
LDL- c
Bueno
5.1
3.3
5.1 - 6.2
3.3 - 4.1
Límite
Elevado
6.2
4.1
La HDLc disminuida con triglicéridos elevados
constituye también un factor de riesgo independiente
de IMA.
Riesgo de IMA relacionado con HDLc (mmol/l)
Pronóstico favorable
Riesgo normal
Indicador de riesgo
Hombres
> 1.42
0.90-1.42
< 0.90
Mujeres
> 1.68
1.16-1.68
< 1.16
Notas: Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y
evitar contactos con piel y mucosas.
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; espectrofotómetro con capacidad para medir absorbancias especificadas
en la técnica.
Semiología: (2)
Aumento de HDL:
Enfermedades crónicas de hígado
Algunas formas de intoxicación crónica
Alcohólicos
Disminución de HDL:
Alfa lipoproteinemia familiar
Hipertiroidismo
Hipertrigliceridemia
Diabetes y Obesidad
Drogas y hábito de fumar
Aumento de LDL:
Hiperlipidemia familiar tipo II
*Causas secundarias:
Drogas
Síndrome nefrótico
Embarazo
Mieloma múltiple
Porfiria
Enfermedad Hepática
Diabetes
Hipertiroidismo
Aumento de VLDL
Alcoholismo
Diabetes obesidad
Enfermedad Renal crónica
Pancreatitis
Embarazo
Anticonceptivos
PRUEBA DEL FRIO:
(prueba de los quilomicrones)
Fundamento: Los quilomicrones transportan los triglicéridos de la dieta (exógenos) o son las
lipoproteínas menos densas por lo que su aumento provoca la aparición de una capa cremosa
en el suero. Esta prueba se realiza solamente si el suero del paciente esta turbio o lechoso.
Técnica: Añadir 0.5 ó 1 ml de suero en un tubo de 12 x 75 mm ó de 12 x 100 mm. Dejar en
reposo 12-24 horas a 4 0C (refrigerador)
Resultados:
Positivo: Se forma un sobrenadante o una capa cremosa sobre el suero en ayuno de 12 horas
que indica la presencia de quilomicrones pero si, además, el resto del suero permanece
turbio, esto indica un aumento de las VLDL que transportan los triglicéridos endógenos.
Negativo: Cuando no hay formación de capa cremosa ni de suero turbio.
INDICE BETA PRE- BETA
Método: Colorimétrico.
Reactivos: reactivo beta pre beta
Muestra: suero (no hemolizado )
Composición de reactivos: (concentración inicial)
Cl2Ca (anhidro) ó
2.8 g
1.4 g
Cl2Ca 2H2O
3.7 g
1.85 g
NaCl
0.222 g
0.111 g
Disolver
Heparina
2 ml
2 ml
(5000 U/ml)
H2O destilada csp
1000 ml
500 ml
Técnica:
Blanco
Patrón
200 µl
Muestra
Control
200 µl
Muestra
5
ml
5
ml
5 ml
Reactivo
Mezclar y dejar reposar durante 10 minutos.
Leer contra blanco reactivo a 578 nm.
El resultado obtenido en el equipo, a la longitud de onda especificada, se toma como el valor de la
muestra.
Notas: Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y
evitar contactos con piel y mucosas.
Valores de referencia: hasta 0.50
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de plástico); cronómetros;
espectrofotómetro con capacidad para medir absorbancias especificadas en la técnica.
FÓSFORO
INTRODUCCIÓN.
La mayor parte del fósforo corporal se encuentra distribuido en los huesos como hidroxiapatita, mientras que el restante
se encuentra como fosfato inorgánico y ésteres de fosfato.
El fósforo esta involucrado en el metabolismo de los carbohidratos y es un componente estructural de otras sustancias
fisiológicamente importantes. Es por ello que un incremento de los niveles de fósforo en un suero, puede deberse a
hipervitaminosis, hipoparatiroidismo y enfermedades renales.
El método del que se hace referencia a continuación, se basa en la medición del complejo de fosfomolibdato en el
rango UV.
Método: UV fosfomolibdato.
Fundamento: El fósforo inorgánico reacciona con el molibdato de amonio en un medio ácido
para formar el complejo de fosfomolibdato que es capaz de absorber luz a 340 m. (1)
Composición de reactivos: (concentración inicial)
R1 Ac. Sulfúrico
210
mmol/l
Molibdato amónico
0.40 mmol/l
Detergente Tritón X-100 10 ml
Patrón
1.61 mmol/l
Estabilidad: Hasta su fecha de caducidad se puede almacenar a 2-25 0C.
Muestra: Suero, estable por 7 días a 2 - 8 0C.
Orina: Diluir la orina, 0.1 ml (100 l) de muestra con 0.9 ml (900 l) de agua destilada (dilución 1:10),
multiplicar el resultado por 10 y multiplicar por el volumen de orina en litros. Ofrecer los resultados
en mmol /24 h.
Técnica:
Blanco
Patrón
Muestra
Patrón
50 µl
Muestra
50 µl
Reactivo
5 ml
5 ml
5 ml
Mezclar, incubar 5 minutos a temperatura ambiente.
Leer frente a blanco reactivo a 340 nm (ó 334 nm)
La lipemia y la hemólisis interfieren en la determinación, por lo que es necesario realizar un blanco
muestra (BM), sustituyendo el reactivo por solución salina; reste la absorbancia obtenida (BM) de
la de la muestra para realizar los cálculos. El blanco muestra se lee contra solución salina.
Factor de conversión: mg/dl x 0.323 = mmol/l
Linealidad: Hasta 6.46 mmol/l. Para concentraciones superiores mezclar 0.1 ml (100 l) de
muestra con 0.2 ml (200 l) de cloruro de sodio al 0.9 % y repetir la determinación, multiplicar el
resultado por 3.
Valores de referencia:
Suero: 0.8 - 1.6 mmol/l.
Orina: 9.68– 32.29 mmol/24h
Notas: Los eritrocitos contienen fosfatos inorgánicos que pueden
ser hidrolizados por acción de las
fosfatasas y salir a través de la célula, incrementando así la concentración de fósforo inorgánico, por
lo que es necesario separar rápidamente los eritrocitos del suero.
Interferencias: hemólisis, lipemia y detergentes.
Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y evitar
contactos con piel y mucosas.
Control de calidad: Todos los sueros control con valores de fósforo determinados por este método
pueden ser empleados.
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de plástico); cronómetros;
espectrofotómetro con capacidad para medir absorbancias especificadas en la técnica.
Semiología:
Aumento (hiperfosfatemia)
Insuficiencia renal
Nefritis severas
Hipoparatiroidismo (con Ca bajo o función renal normal)
Hipocalcemia
Ingesta excesiva de álcali (historia de úlcera péptica)
Ingesta excesiva de vitamina D
Fracturas en la fase recuperativa.
Tumores óseos
Enfermedad De Addison
Acromegalia
Disminución (hipofosfatemia)
Hiperparatiroidismo (con Ca alto o función renal normal): Raquitismo (niños) osteomalacia (adultos).
Coma diabético (por aumento del metabolismo de los carbohidratos.
Hiperinsulinismo
Administración continua de glucosa (EV) en no diabéticos
CALCIO
INTRODUCCIÓN.
El 99% del calcio presente en el cuerpo, se encuentra distribuido en huesos y dientes, mientras que el 1% restante esta
presente en sangre y tejidos blancos. Este compuesto actúa como un factor en la coagulación de la sangre, en el
metabolismo y en la fisiología neuromuscular.
El calcio contenido en suero esta distribuido en la siguiente proporción aproximadamente: un 45% enlazado a proteinas,
un 5% en forma de complejo en forma no ionizada, y el 50% restante en forma iónica libre siendo fisiológicamente
activa, por lo que tiene gran importancia en las funciones biológicas.
Método: Test colorimétrico complexona cresolftaleína.
Fundamento: El calcio (Ca2+), con la cresolftaleína, forma un complejo violeta en medio alcalino
cuya intensidad de color es directamente proporcional a la cantidad de calcio existente en la
muestra.
Composición de reactivos: (concentración inicial)
R1 (tampon) Tampón etanolamida
R2 (color)
Cresoftaleína
8-hidroxiquinoleína
Patrón
500 mmo/l
0.62 mmo/l
69 mmo/l
2.5 mmol/l
Estabilidad: Hasta su fecha de caducidad se puede almacenar a 2-25 0C.
Muestra: Suero o plasma heparinizado. El Ca es estable en suero 10 días a 2-8 0C u 8 meses a 20 0C.
Orina: Diluir la orina, 1 ml de muestra con 2 ml de agua destilada (dilución 1:3), multiplicar el
resultado por 10 y multiplicar por el volumen de orina en litros. Ofrecer los resultados en mmol /24
h.
Técnica:
blanco patrón muestra
Patrón
20 µl
Muestra
20 µl
R1
1 ml
1 ml
1 ml
Mezclar de 2-5 minutos a la
temperatura de medición.
R2
1 ml
1 ml
1 ml
Mezclar o esperar 5 minutos a temperatura ambiente. Leer frente a blanco a 570 nm (550-590)
Coloración estable 40 minutos.
La lipemia y la hemólisis interfieren en la determinación, por lo que es necesario realizar un blanco muestra
(BM), sustituyendo el reactivo por solución salina; reste la absorbancia obtenida (BM) de la de la muestra
para realizar los cálculos. El blanco muestra se lee contra solución salina.
Cálculo:
Absorbancia Muestra
------------------------------- x CP = CM
Absorbancia Patrón
Factor de conversión: mg/dl x 0.25 = mmol/l
Linealidad: Hasta 3.75mmol/l. Para concentraciones superiores mezclar 0.1 ml de muestra con
0.2 ml de cloruro de sodio al 0.9 % y repetir la determinación, multiplicar el resultado por 3.
Valores de referencia:
Suero: 2.02 - 2.6 mmol/l.
Orina: (H): 2.23 - 4.29 mmol/24h
(M): 2.50 - 4.21 mmol/24h
Notas: Se recomienda utilizar material de plástico desechable o de cristal o plástico pasados por ácido
(ac. Nítrico diluido a la mitad con agua destilada) y luego enjuagados varias veces con agua destilada para
evitar contaminaciones. Separar el coagulo lo antes posible al obtener el suero, para evitar el trasiego de
iones Ca hacia los hematíes.
La lipemia y la hemólisis interfieren en la determinación.
Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y evitar
contactos con piel y mucosas.
Control de calidad: Todos los sueros control con valores de calcio determinados por este método pueden
ser empleados.
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de plástico); cronómetros;
espectrofotómetro con capacidad para medir absorbancias especificadas en la técnica.
Semiología:
Aumento (hipercalcemia):
Hiperparatiroidismo (asociado con fósforo bajo)
Cáncer: De hueso o que lo metastizan (pulmón, mama, tiroides, riñón); Enfermedad de Hodgkin;
Mieloma múltiple; Renal o de pulmón que pueden producir hormona paratiroidea; Sarcoidosis por
IgA, IgG altas; Leucemias
Enfermedad de Addison
Hipertiroidismo
Enfermedad de Paget (con FAL alta)
Inmovilización prolongada
Excesiva ingesta de vitamina D
Uso prolongado de diuréticos
Acidosis respiratoria
Disminución (hipocalcemia)
Pseudohipocalcemia (hiperproteinemia)
Hipoparatiroidismo (2rio a cirugía, irradiación, etc)
Hiperfosfatemia (por fallo renal, laxantes, citostáticos)
Malabsorción
Pancreatitis aguda
Alcalosis
Osteomalacia
Diarreas
Raquitismo
BILIRRUBINA
INTRODUCCIÓN.
La bilirrubina se origina por degradación del grupo hem de la hemoglobina, que a su vez aparece en el plasma como
consecuencia de la destrucción de los glóbulos rojos en el sistema retículo endotelial. La hemoglobina, una vez liberada
en el interior del eritrocito, se combina con las haptoglobinas, proteinas plasmáticas especificas para su transporte. En
una primera etapa y tras su liberación de la haptoglobina, se forma, por acción de una oxigenasa, un grupo formilo con
lo que se rompe el anillo tetrapirrólico del hem, formándose el compuesto denominado biliverdina, que en una etapa
posterior y por acción de una reductasa se transforma en bilirrubina.
Método: Colorimétrico de Jendrassik y Gróf.
Fundamento: La bilirrubina se valora colorimétricamente por la formación de azobilirrubina, de color rojo cereza,
cuando se le hace reaccionar con el Ac. Sulfanílico diazotado (reacción de Malloo Evelyn). (1)
La bilirubina conjugada, muy polar, reacciona en medio acuoso con el reactivo de diazotación, por lo que se le llamo
directa, pues al poner en contacto el suero o el reactivo aparecía directamente el color. Pero la bilirrubina libre,
poco polar, no da directamente la reacción o es preciso añadir un tercer reactivo para que se produzca la reacción
de diazotación con la consiguiente aparición de color, por eso se le llama indirecta.
Composición de reactivos: (concentración inicial)
R1
R2
R3
Ac. Sulfanílico
HCl
Nitrito sódico
Cafeína
Benzoato de Na
29 mmol/l
0.17 N
25 mmol/l
0.26 mol/l
0.52 mol/l
Estabilidad: A 15-25 0C, hasta su fecha de caducidad.
Muestra: Suero o plasma. La estabilidad de la muestra, separada ya de los hematíes y protegida de la luz, es de 3
meses a -18 0C ó 4 días a 4 0C ó 1 día a 15 0C.
Técnica: (para c/ muestra, preparar 4 tubos)
Total
(T)
R1
R2
Sol. Sal.
R3
Muestra
200 l
1 gota
2 ml
200 l
Blanco
Blanco
Directa
Total
Directa
(D)
(BT)
(BD)
200 l
200 l
200 l
1 gota
2 ml
2 ml
200 l
Mezclar, y esperar 5 minutos.
Leer contra blanco a 546 nm. (530-550)
200 l
200 l
Nota: por cada corrida debe montarse un patrón para total (PT) con su blanco (PBT) y un patrón para directa (PD) con
su blanco (PBD)
Cálculo:
Para total:
Abs (T) – Abs (BT)
------------------------------- x CP = CM
Abs (PT) – Abs (PBT)
Para directa:
Abs (D) – Abs (BD)
------------------------------- x CP = CM
Abs (PD) – Abs (PBD)
Técnica para pediatría: (para c/ muestra, preparar 2 tubos)
Cafeína
Suero ó Plasma
Ácido Sulfanílico
Diazo reactivo
Blanco Muestra
1,5 ml
0.05l
0.1 ml
Muestra
1,5 ml
0.05l
0.1 ml
Mezclar, y esperar 10 minutos.
Leer contra blanco a 546 nm (530-550).
Preparación del Diazo Reactivo.
2 ml de Acido Sulfanílico
0.5 ml de Nitrito de Sodio
Preparar en el momento de ejecutar la técnica .
Cálculo:
Se resta la absorbancia de la Muestra a la absorbancia del Blanco y se efectúa el cálculo:
Absorbancia Muestra
------------------------------- x CP = CM
Absorbancia Patrón
Factor de conversión: mg/dl x 17.1 = mol/l
Linealidad: Hasta 342 mol/l. Para concentraciones superiores mezclar 0.1 ml (100 l) de muestra con 0.2 ml (200
l) de cloruro de sodio al 0.9 % y repetir la determinación, multiplicar el resultado por 3.
Valores de referencia:
Total: hasta 17 mol/l.
Directa: hasta 4.3 mol/l.
Notas: La bilirrubina es fotosensible por lo que su exposición a la luz puede provocar disminución de su
concentración. La hemólisis interfiere en el ensayo.
Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y evitar contactos con
piel y mucosas.
Control de calidad: Todos los sueros control con valores de bilirrubina determinados por este método pueden ser
empleados.
Materiales requeridos: Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de
plástico); cronómetros; espectrofotómetro con capacidad para medir absorbancias especificadas en la técnica.
Semiología:
Aumento
No conjugada (indirecta):
Anemias hemolíticas
Traumas (hematomas)
Infarto pulmonar hemorrágico
Síndrome de Crigler Najjar
Enfermedad de Gilbert
Cáncer de la cabeza del páncreas
Coledocolitiasis
Síndrome de Dubin Johnson
Metástasis hepáticas
Hepatitis
Linfoma
Colestasis secundaria a drogas
Cirrosis
Conjugada (directa):
Conjugada o no conjugada:
GLUCOSA
INTRODUCCIÓN.
La glucosa es el principal carbohidrato presente en la sangre periférica, por lo que su oxidación es la principal fuente de
energía celular en el cuerpo. Las determinaciones de glucosa se emplean en el diagnóstico y tratamiento de diabetes
mellitus.
Método: GOD - PAP
Fundamento: La glucosa oxidasa (GOD)cataliza la oxidación de la glucosa a ácido Glucónico o
peróxido de hidrógeno el cual se valora mediante la reacción de Trinder dando lugar a una
quinoneimina coloreada. (1)
GOD
Glucosa + O2 + H2O ---------- H2O2 + gluconato
POD
2H2O + fenol + 4-AA--------- quinona + 4H2O
Composición de reactivos: (concentración inicial)
R1
Tris Ph 7.4
92 mmol/l
Tampón Fenol
0.3 mmol/l
R2
GOD
15000 U/l
Peroxidasa
1000 U/l
(POD)
4-AA
2.6 mmol/l
Patrón de
5.5 mmol/l
glucosa
Preparación: Disolver R2 en R1
Estabilidad: 1 mes a 2-8 0C ó 7 días a Ta.
Muestra: Suero, plasma o LCR. La glucosa en suero o plasma es estable 3 días a 2-8 0C.
Técnica:
R1
Patrón
Muestra
Blanco
Patrón
1.0 ml
1.0 ml
0.01 ml
Muestra
1.0 ml
0.01 ml
*Mezclar e incubar 5 minutos a 37 0C.
*Leer la absorbancia a 505 nm (490 550 nm) del patrón o de la muestra frente al blanco
reactivo.
*La coloración es estable 30 minutos a temperatura ambiente.
Cálculo:
Absorbancia Muestra
------------------------------- x CP = CM
Absorbancia Patrón
Factor de conversión:mg/dl x 0.0555 = mmol/l
Valores de referencia : 4.2 - 6.1 mmol/l.
Linealidad: hasta 18.0 mmol/l. Para concentraciones superiores mezclar 0.1 ml (100 l) de
muestra con 0.2 ml (200 l) de cloruro de sodio al 0.9 % y repetir la determinación, multiplicar el
resultado por 3.
Notas: El suero o plasma debe separarse de los elementos celulares en el plazo máximo de 1 hora,
añadiendo un inhibidor de la glucólisis como el fluoruro, puede aplazarse la separación hasta 24 horas.
No se han observado interferencias por hemoglobina (4 gr/l), bilirrubinas (15 mg/dl), ácido ascórbico (10
mg/dl) y la lipemia moderada no afecta los resultados. Aunque algunos autores sí refieren que la hemólisis,
la ictericia y la lipemia afectan el ensayo.
La composición del reactivo de trabajo puede variar ligeramente según la casa comercial en que se adquiera
el mismo.
Control de calidad: Todos los sueros control con valores de glucosa determinados por este método
pueden ser empleados.
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de plástico); cronómetros; baño de
María con control a 37 0C; espectrofotómetro con capacidad para medir absorbancias especificadas en la técnica.
Semiología: (2)
Aumento:
Diabetes
Enfermedad de Cushing (por aumento de glucocorticoides).
Estres: por IMA, infecciones severas.
Feocromocitoma.
Adenoma pituitario: por aumento de GH.
Adenoma de páncreas por aumento de glucagón.
Pancreatitis.
Daño por trauma cerebral.
Enfermedad hepática crónica.
Enfermedades crónicas.
Malnutrición crónica.
Disminución
Sobredosis de insulina.
Enfermedad de Addison.
Sepsis bacteriana
Cáncer de islotes de páncreas.
Necrosis hepática
Hipotiroidismo.
Enfermedad por almacenamiento de glucógeno.
Estados psicógenos.
PRUEBA DE TOLERANCIA A
LA GLUCOSA ORAL DE 2h
(PTG-O 2h)
Fundamento:
En pacientes sanos, la respuesta de la insulina para eliminar del flujo sanguíneo una sobrecarga de glucosa
administrada por vía oral es inmediata, con un pico a los 30 - 60 minutos, retornando a la normalidad a las
dos horas. (1, 2)
Indicaciones:
Antes de la prueba:
Los 3 días precedentes se debe aplicar una dieta que contenga por lo menos 150 g/ día de
carbohidratos.
La falta de apetito o la inactividad (reposo en cama u hospitalización) invalidan la prueba.
Guardar ayuno de 12 horas o no más de 16 horas, suprimiendo incluso el café. Sólo agua.
Prohibido fumar o realizar ejercicios, incluso ligeros.
No debe aplicarse la prueba a personas enfermas en las dos semanas precedentes.
Se deben tener controladas algunas enfermedades endocrinas que alteran la prueba, Ej. acromegalia,
síndrome de Cushing, hipertiroidismo, feocromocitoma.
Evitar fármacos como diuréticos, salicilatos, hipoglicemiantes y anticonvulcivantes por lo menos 3 días
antes.
Suprimir los anticonceptivos durante todo un ciclo.
Durante la prueba:
Se debe permanecer en absoluto reposo, sin ingerir alimentos, ni fumar después de la primera
extracción hasta la próxima.
Pueden ocurrir mareos o nauseas durante la prueba.
Después de la prueba:
Puede comer o tomar normalmente.
Se debe administrar hipoglicemiantes a las personas que lo necesiten tan pronto termine la prueba.
Procedimiento:
Entre las 7-8 horas de la mañana, después de un ayuno de 12 h y luego de 30 min de reposo, se
obtiene muestra venosa (1 ml de sangre + 1 gota [20 l] de EDTA o fluoruro) para determinar glucosa
plasmática por el método GOD PAD.
5 minutos después se ingiere una sobrecarga de 75 gr. de dextrosa (150 ml de solución de dextrosa al
50 %) para los adultos.
Para los niños: 1.75 g/Kg de peso hasta 75 g (peso en kilogramos del niño por 3.5 [1.75 por 100/50]; el
resultado sería el volumen en ml de dextrosa al 50 % a ingerir por el niño
100 g para la PTG de 6 horas (200 ml de dextrosa al 50 %).
La próxima extracción se realizara según las indicaciones del médico (a las 2 h ó cada 1 h).
En caso de existir nauseas, mareos, sudoración u otra manifestación de hiperactividad del
sistema nervioso vegetativo, debe extraerse una muestra sanguínea inmediatamente o suspender la
prueba.
Si el paciente vomita la solución de glucosa el tetst queda invalidado y se debe repetir 3 días después.
Si la primera determinación es superior a 11 mmol/l el test debe suspenderse o de lo contrario debe
ser monitoreado por las posibles reacciones severas o el coma.
A los pacientes con glucosa en ayunas por encima de 11.1 mmol/l no debe realizársele esta prueba.
Indicaciones del test: (2, 3)
Historia familiar de diabetes.
Obesidad.
Episodios inexplicables de hipoglicemia.
Historia de infecciones frecuentes.
Mujeres con historia de macrofetos, muerte neonatal, parto prematuro y abortos.
Glicosurias o hiperglicemias transitorias en embarazadas, cirugías, traumas, estrés e infarto agudo del
miocardio.
Glicemia en ayuno dudosa (< 11.1 mmol/l).
Interpretacion: (1)
A
D
U
L
T
O
S
N
I
Ñ
O
S
Ayuna
6.1
2 horas
Normal
Diabetes
7
11.1
Tolerancia
Alterada
7
7.8 - 11.1
7.2
7.8
7.8
7.8 - 11.1
Normal
Diabetes
Tolerancia
Alterada
3horas
Embarazadas
5.8 9.2
8.1
Deberá igualar 2 ó más valores después de una sobrecarga de 100 g de glucosa.
GLUCOSA POSPRANDIAL DE 2 HORAS
Indicaciones y procedimientos:
Se seguirán las mismas indicaciones y procedimientos que para la PTG-O 2h horas excepto que
en vez de ingerir una sobrecarga de glucosa después de la primera extracción en este caso se
desayunará una dieta rica en carbohidratos que deberá incluir: jugo de frutas, leche con azúcar
o tostadas. (1,2)
Utilidades del test: (3)
En el seguimiento del diabético.
En el monitoreo de terapia con insulina.
Para confirmar diabetes en pacientes con glucosa en ayuno normal.
Notas:
En el posprandial de 3 horas la variación es que se le indica al paciente que desayune, antes de la
prueba, como lo hace todos los días, y se le extrae sangre en ayuno y 3 horas después. Este test
da información del control del tratamiento o de la respuesta terapéutica luego de la ingestión
de comidas en pacientes diabéticos.
UREA
INTRODUCCIÓN.
La urea es el principal metabolito de las proteinas y constituye alrededor del 50% de los solutos contenidos en la orina.
La concentración de urea en sangre oscila entre 1.7 – 6.7 mmol/l y sólo aumenta de modo significativo cuando se ha
perdido más del 50% de la función renal. La concentración de urea en sangre es, sin embargo, una medida bastante
imperfecta de la función renal. Depende entre otros factores, del aporte de proteinas en la dieta, del catabolismo
proteico y del volumen de la diuresis. Puede hallarse cifras algo elevadas aun cuando la función de los riñones sea por
completo normal.
Método: Test enzimático – colorimétrico (Berthelot).
Fundamento: en medio alcalino y en presencia de salicilato e hipoclorito de sodio, los iones de
amonio reaccionan produciendo un compuesto de color verde cuya absorbancia se mide a 580
nm.
ureasa
urea + H2O --------------CO2 + 2NH3
Composición de reactivos: (concentración inicial)
R1
R2
Tampón fosfatos pH 6.7
EDTA
Salicilato sódico
Nitropusiato sódico
Hipoclorito de sodio
50 mmol/l
2 mmol/l
60 mmol/l
3.2 mmol/l
140 mmol/l
Hidróxido sódico
150 mmol/l
Reactivo ureasa
30 000 U/l
Patrón de urea
8.32 mmol/l
Disolver R3 (ureasa) con R1 (tampón)
Estabilidad: 4-semanas a 2-8 0C y 7 días a 15-25 0C.
Muestra: Suero o plasma. La urea en suero es estable por 72 horas a 2-8 0C u 8 horas a
temperatura ambiente.
Orina: Diluir la orina, 0.1 ml (100 l) de muestra con 5 ml de agua destilada (dilución 1:50),
multiplicar el resultado por 10 y multiplicar por el volumen de orina en litros. Ofrecer los resultados
en mmol /24 h.
Técnicas:
Blanco Patrón
Muestra
R1 + R3
1 ml
1 ml
1 ml
Muestra
0.01 ml
Patrón
0.01ml
R3
Mezclar e incubar 5 min. a 37 0C ó 10 min. a TA
R2
1ml
1 ml
1ml
Mezclar e incubar 5 min. a 37 0C ó 10 min. a TA
Leer contra blanco reactivo a 580 nm (570-623) a 37 0C.Ajuste a cero con agua destilada o aire.
La coloración es estable 30 min. a TA.
Cálculo:
Absorbancia Muestra
------------------------------- x CP = CM
Absorbancia Patrón
Factor de conversión:
mg/dl x 0.1665 = mmol/l
Valores de referencias:
Suero: 1.7-8.3 mmol/l
Orina: 333 – 582 mmol/24h
Linealidad:
Hasta 26.64mmol/l. Para concentraciones superiores mezclar 0.1 ml (100 l) de muestra con 0.2
ml (200 l) de cloruro de sodio al 0.9 % y repetir la determinación, multiplicar el resultado por 3.
Notas : Todo el material a usar debe estar libre de amoniaco, metales pesados o detergentes.
Evitar contactos con las manos o contaminación con gotas de sudor.
Interferencias: Los anticoagulantes fluoruro, citrato y EDTA pueden inhibir la ureasa. Los iones de amonio
pueden elevar sus valores.
Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y evitar
contactos con piel y mucosas.
Control de calidad: Todos los sueros control con valores de urea determinados por este método pueden
ser empleados.
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de plástico); cronómetros; baño de
María con control a 37 0C; espectrofotómetro con capacidad para medir absorbancias especificadas en la técnica.
Semiología: (3)
Aumento (azoemia):
Prerrenal:
Deshidratación.
Disminución del volumen sanguíneo.
Shock.
Fallo cardiaco congestivo.
Hemorragia gastrointestinal masiva.
Aumento del catabolismo proteico (fiebre, estrés, quemaduras).
Renal:
Uremia (acidosis, desequilibrio Hidroelectrolítico, coma, vómitos)
Postrenal:
Obstrucción o perforación del tracto urinario.
Disminución:
Fallo renal.
Desnutrición.
Ingesta aumentada de líquido con riñón normal.
Embarazo.
CREATININA.
INTRODUCCIÓN.
La creatinina es un producto del metabolismo muscular de la creatina. Su concentración en suero o plasma es
notablemente más constante y depende mucho de la ingesta proteica y del catabolismo de la urea. Por este motivo es
más fiable como índice de retención nitrogenado. Es por ello, que la concentración de creatinina es un índice de
funcionalismo renal que goza de aceptación universal.
Método: Cinético Espectrofotométrico
(basado en la reacción de Jaffé)
Fundamento:
La creatinina presente en la muestra reacciona con el picrato en medio alcalino, originando un
complejo coloreado. Se mide la velocidad de formación de dicho complejo en periodos iniciales
cortos, evitándose así la interferencia de otros compuestos.
Composición de reactivos: (concentración inicial)
R1 ácido pícrico 25 mmol/l
R2 NaOH
0.2 mmol/l
Patrón
177 mmol/l
Preparación de los reactivos listo para usar: Mezclar volúmenes iguales de los reactivos 1 y 2,
homogenizar. Estable 1 semana.
Muestra: Suero o plasma: la creatinina es estable 24 horas a 2-8 0C.
Orina: Diluir la orina, 0.1 ml (100 l) de muestra con 5 ml de agua destilada (dilución 1:50),
multiplicar el resultado por 10 y multiplicar por el volumen de orina en litros y dividir entre 1000.
Ofrecer los resultados en mmol /24 h.
Técnica:
Manual
Reactivo R1+ R2 1.0 ml
Muestra o patrón
0.1 ml
Mezclar y poner en marcha el cronómetro, leer la absorbancia 505nm (490-510) a los 30
seg.(DO1) y a los 90 seg.(DO2). Se debe tener temperatura a 37 0C. Ajuste a cero con agua
destilada.
Cálculo:
(Absorbancia 2 - Absorbancia 1) muestra
--------------------------------------------------- x CP = CM
(Absorbancia 2 - Absorbancia 1) Patrón
Factor de conversión: mg/dl x 88.4 = mol/l
Valores de referencias:
Suero: 44-125 umol/l
Orina: 5-18 mmol/24 h
Linealidad:
Hasta 884 mmol/l. Para concentraciones superiores mezclar 0.1 ml (100 l) de muestra con 0.2 ml
(200 l) de cloruro de sodio al 0.9 % y repetir la determinación, multiplicar el resultado por 3.
Notas: La hemólisis interfiere en la determinación. La concentración de bilirrubina superior a 130 mmol/l
interfiere. No utilizar sueros lipémicos.
La determinación puede ser afectada por concentraciones elevadas de sustancias reductoras.
Procurar que la temperatura de reacción sea constante.
Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y evitar
contactos con piel y mucosas.
Control de calidad: Todos los sueros control con valores de creatinina determinados por este método
pueden ser empleados.
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de plástico); cronómetros; baño de
María con control a 37 0C; espectrofotómetro con capacidad para medir absorbancias especificadas en la técnica y con
termostato acoplado.
Semiología:
Aumento:
Compromiso de la funcion renal.
Nefritis crónicas.
Obstrucción del tracto urinario.
Enfermedades musculares: gigantismo, acromegalia, miastenia gravis.
Distrofia muscular.
Poliomielitis.
Acidosis diabética.
Inanición.
Hipertiroidismo.
CREATININA
INTRODUCCIÓN.
La creatinina es un producto del metabolismo muscular de la creatina. Su concentración en suero o plasma es
notablemente más constante y depende mucho de la ingesta proteica y del catabolismo de la urea. Por este motivo es
más fiable como índice de retención nitrogenado. Es por ello, que la concentración de creatinina es un índice de
funcionalismo renal que goza de aceptación universal.
Método: De Jaffé, con desproteinización.
Fundamento:
La creatinina presente en la muestra reacciona con el picrato en medio alcalino, originando un
complejo coloreado que se mide espectrofotométricamente a 500 nm.
Composición de reactivos: (concentración inicial)
1 Ác. Pícrico
0.04 mol/l
2 NaOH
2.5 mol/l
Patrón de creatinina 177 mmol/l
Ac. Sulfúrico
0.33 mol/l
Tungstato de sodio
0.303 mol/l
4ml de 1+ 1ml de 2.
Picrato alcalino
Preparar en el
momento de usar.
Muestra: Suero o plasma: la creatinina es estable 24 horas a 2-8 0C.
Orina: Diluir la orina, 0.1 ml (100 l) de muestra con 5 ml de agua destilada (dilución 1:50),
multiplicar el resultado por 10 y multiplicar por el volumen de orina en litros. Ofrecer los resultados
en mmol /24 h.
Técnica:
Filtrado libre de proteínas:
Agua destilada
Patrón
Muestra
Ác. Sulfúrico
Tungstato de Na
10%
Patrón (ml)
Muestra (ml)
macro
micro
macro
micro
9
1
1.8
0.2
8
1.6
1
0.5
0.5
0.2
0.1
0.1
Agitar para mezclar. Reposar 3-5 min.
Nota: Con la adición de cada reactivo se debe mezclar.
Centrifugar a 2500 – 3000 rpm por 10 min.
Reacción de color
Blanco
React.
4 (1) ml
Patrón
Muestra
Agua destilada
Filtrado
4 (1) ml
de proteínas.
4 (1) ml
Patrón diluido
2(0.5) ml 2 (0.5)ml 2 (0.5) ml
Picrato alcalino
Mezclar bien y dejar en reposo por 15 min.
Leer patrón y muestra contra blanco reactivo a 500
nm.
Nota: Entre paréntesis se refiere a microtécnica.
Cálculo:
Absorbancia Muestra
------------------------------- x CP = CM
Absorbancia Patrón
Factor de conversión: mg/dl x 88.4 = mol/l
Valores de referencias: 44-125 mol/l
Linealidad: Hasta 520 mol/l. Para los valores superiores diluir la muestra: 1 ml filtrado + 3 ml
de solución salina fisiológica, multiplicando el resultado por 4.
Notas: La hemólisis interfiere en la determinación. La concentración de bilirrubina superior a 130 mmol/l
interfiere. No utilizar sueros lipémicos.
La determinación puede ser afectada por concentraciones elevadas de sustancias reductoras.
Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y evitar
contactos con piel y mucosas.
Control de calidad: Todos los sueros control con valores de creatinina determinados por este método
pueden ser empleados.
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de plástico); cronómetros;
espectrofotómetro con capacidad para medir absorbancias especificadas en la técnica.
Semiología:
Aumento:
Compromiso de la función renal.
Nefritis crónicas.
Obstrucción del tracto urinario.
Enfermedades musculares: gigantismo, acromegalia, miastenia gravis.
Distrofia muscular.
Poliomielitis.
Acidosis diabética.
Inanición.
Hipertiroidismo.
ÁCIDO ÚRICO
INTRODUCCIÓN.
El ácido úrico es el producto final del metabolismo de las purinas. En el hombre, cerca de la mitad del ácido úrico total,
se elimina por excreción urinaria y por degradación microbiana en el tracto intestinal.
La cuantificación de ácido úrico es útil en el diagnóstico de gota, disminución de la función renal, desórdenes
mieloproliferativos, etc. Los niveles de ácido úrico están asociados al nitrógeno retenido, la urea, la creatinina y otros
constituyentes no proteicos.
Método: Test enzimático Colorimétrico (uricasa-PAP)
Fundamento: El ácido úrico es oxidado por la uricasa a alantoína y peróxido de hidrógeno (H2O2)
que en presencia de POD y 4-AAP y DCPS forma un compuesto rosáceo.
uricasa
Ac. úrico + 2H2O + O2 ------------ alantoína + CO2 +
H2O2
POD
H2O2 + 4AAP + DCPS -------------2H2O + quinona
Composición de reactivos: (concentración final)
R1
Fosfatos pH 7.4 50 mmol/l
Tampón
2-4 DCSP
4 mmol/l
R2
Uricasa
60 U/l
Liofilizado Peroxidasa
660 U/l
enzimas
Ascorbato
200 U/l
Oxidasa
4-AA
1 mmol/l
Patrón
356.91mmol/l
Preparación: Disolver R2 en R1.
Estabilidad: 1 mes a 2 8 0C. ó 10 días a temperatura ambiente, protegida de la luz.
Muestra: Suero o plasma. El ácido úrico es estable de 3 a 5 días en suero a 2-8 0C.
Orina: Diluir la orina, 0.1 ml (100 l) de muestra con 0.9 ml (900 l) de agua destilada (dilución 1:10),
multiplicar el resultado por 10 y multiplicar por el volumen de orina en litros y dividir entre 1000.
Ofrecer los resultados en mmol /24 h.
Técnica:
Muestra
o patrón
Reactivo
Blanco Patrón
20 µl
Muestra
20 µl
1.0 ml
1.0 ml
1.0 ml
Mezclar e incubar 5 minutos a 37 0C ó 10 minutos a temperatura ambiente. Ajustar a cero con
blanco reactivo. Efectuar las lecturas a 505 nm (490-550) de las absorbancias del estándar y de la
muestra frente a blanco reactivo.
Coloración estable como mínimo 30minutos.
Cálculo:
Absorbancia Muestra
------------------------------- x CP = CM
Absorbancia Patrón
Factor de conversión: mg/dl x 59.485 = umol/l
Valores de referencias:
Suero: M: 142 - 339 umol/l
H: 202 - 416 umol/l
Orina: 1.2 – 6 mmol/24 h.
Linealidad:
Hasta 1487 umol/l. Para concentraciones superiores mezclar 0.1 ml (100 l) de muestra con 0.2 ml
(200 l) de cloruro de sodio al 0.9 % y repetir la determinación, multiplicar el resultado por 3.
Notas: Si la muestra de orina es turbia, calentarla a 60 0C para disolver el Ac. Úrico.
Interferencias: los anticoagulantes no interfieren. La lipemia aumenta los niveles de Ac. Úrico. La bilirrubina y
el ascorbato pueden provocar niveles bajos de Ac. Úrico.
Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y evitar
contactos con piel y mucosas.
Control de calidad: Todos los sueros control con valores de ácido úrico determinados por este método
pueden ser empleados.
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de plástico); cronómetros; baño de
María con control a 37 0C; espectrofotómetro con capacidad para medir absorbancias especificadas en la técnica.
Semiología: (1)
Aumento:
Fallo de la función renal.
Gota
Otras: leucemia, quimioterapia para cáncer, mononucleosis, ejercicios violentos, linfomas, mieloma
múltiple, cáncer matastásico, acidosis metabólica eclampsia severa, cetosis diabética, inanición,
policitemia, shock, hemoglobinopatías, alcoholismo.
Disminución:
Tratamiento con drogas uricoséricas: (alopurinol, probenecid, sulfinpirazone)
Síndrome de fanconi.
Enfermedad Neoplásica.
Enfermedad de Wilson
ALBÚMINA
INTRODUCCIÓN.
La albúmina es la más homogénea, soluble, estable, de todas las fracciones de proteinas plasmáticas. La
albúmina está relacionada fisiológicamente con los problemas concernientes al equilibrio hídrico, porque es
la que presenta mayor presión oncótica, y con la función transporte, ya que posee una gran capacidad para
fijar numerosas sustancias de tipo fisiológico (bilirrubina, ácido úrico, ácidos grasos) o no (rojo congo,
sulfamidas, penicilina, etc).
Método: Espectrofotométrico: verde de bromocresol.
Fundamento: La albúmina presente en la muestra reacciona con el verde de bromocresol en
medio ácido, originando un complejo coloreado que se cuantifica por espectrofotometría. (1)
Composición de reactivos: (concentración inicial)
1 Succinato pH 4.2
75 mmol/l
Verde de bromocresol
15 mmol/l
Brij-35(20%) preservativo 10 ml
2 Patrón
45 g/l
Los reactivos están listos para usar.
Estable a temperatura ambiente 15-25 0C hasta su fecha de caducidad. Proteger de la luz.
Muestra: Suero o plasma. La albúmina es estable 6 días a 2-8 0C.
Técnica:
Blanco Patrón Muestra
Reactivo 4 ml
4 ml
4 ml
0.02 ml
Patrón
Muestra
0.02 ml
Mezclar y dejar 5 minutos a temperatura ambiente. Ajuste a cero con blanco reactivo.
Leer la absorbancia del patrón o de la muestra frente al blanco reactivo a 600 nm (578-650). El
color es estable durante al menos 30 minutos.
Cálculos:
Absorbancia Muestra
-------------------------------- x CP = CM
Absorbancia Patrón
Factor de conversión: gr/dl x 10 = gr/l
Valores de referencia: 38-52 gr/l
Linealidad: Es lineal hasta 60 gr/l. Para concentraciones superiores mezclar 0.1 ml (100 l) de
muestra con 0.2 ml (200 l) de cloruro de sodio al 0.9 % y repetir la determinación, multiplicar el
resultado por 3 (dilución 1:3)
Notas: La bilirrubina (25 mg/dl) o la hemoglobina (1 gr/dl) interfieren.
La reacción de la albúmina con el verde de bromocresol es Inmediata. Otras proteínas reaccionan
lentamente, por lo que es conveniente no demorar la lectura.
Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y evitar
contactos con piel y mucosas.
Control de calidad: Todos los sueros control con valores de albúmina determinados por este método
pueden ser empleados.
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de plástico); cronómetros;
espectrofotómetro con capacidad para medir absorbancias especificadas en la técnica.
Semiología: (2)
Aumento: Nunca aumenta.
Disminución:
1. Por disminución de la síntesis:
Enfermedad hepática
Inanición
Analbuminemia congénita
2. Por aumento de las perdidas:
Síndrome nefrótico
Gastroenteropatía perdedora de proteínas
Eczemas
Quemaduras
Artritis reumatoidea
Lupus eritematoso
Infecciones crónicas
3. Por aumento del catabolismo:
Embarazo
Tirotoxicosis
Síndrome de Niscott
PROTEÍNAS TOTALES
INTRODUCCIÓN.
Las proteínas, como constituyentes fundamentales que son de todos los protoplasmas, se han
llamado “la esencia del proceso vital”. Intervienen como parte básica de la célula viviente y también
son responsables de una parte principal de su función. Por ejemplo, las proteínas sirven como
componentes estructurales de células, enzimas, algunas hormonas y algunos receptores para
hormonas, moléculas de transporte, anticuerpos y factores de coagulación, etc. Las proteínas
difieren entre sí por los tipos de aminoácidos prese3ntes, su disposición, cantidad, peso molecular,
cambios superficiales, etc.
Método: Test colorimétrico "Biuret"
Fundamento: Los grupos -CO-NH unidos entre sí (enlaces peptídicos) dan una reacción con
formación de color violeta con las sales cúpricas en medio alcalino (reacción de Biuret)
Composición de reactivos: (concentración inicial)
R1 Tartrato K-Na
15 mmol/l
NaOH
100 mmol/l
Ioduro K
15 mmol/l
Sulfato de cobre
5 mmol/l
Patrón
70 g/dl
Estabilidad: A temperatura ambiente es hasta la fecha de caducidad indicada en el envase.
Muestra: Suero o plasma. Las proteínas son estables 6 días a 4 0C.
Técnica:
Blanco Patrón Muestra
Patrón
50µl
Muestra
50µl
Reactivo 2.5 ml 2.5 ml
2.5 ml
Mezclar e incubar 15 minutos a 30-37 0C. Dejar enfriar 5 minutos a temperatura ambiente.
Leer, frente a blanco reactivo, a 546 nm (530-560). La coloración es estable 30 minutos.
Cálculos:
Absorbancia Muestra
------------------------------ x CP = CM
Absorbancia Patrón
Factor de conversión: gr/dl x 10 = gr/l
Valores de referencia:
Suero: 66 - 87 gr/l
Orina: 0.02 – 0.15 g/l/24h
Linealidad: Es lineal hasta 150 gr/l. Para concentraciones superiores mezclar 0.1 ml (100 l) de
muestra con 0.2 ml (200 l) de cloruro de sodio al 0.9 % y repetir la determinación, multiplicar el
resultado por 3 (dilución 1:3)
Notas: Con sueros ictéricos (> de 85 mol/l de bilirrubina), hemolíticos o lipémicos se prepara un blanco
muestra.
Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y evitar
contactos con piel y mucosas.
Control de calidad: Todos los sueros control con valores de proteínas totales determinados por este
método pueden ser empleados.
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de plástico); cronómetros;
espectrofotómetro con capacidad para medir absorbancias especificadas en la técnica.
Semiología:
Ver Electroforesis de Proteínas
INA AMINOTRANSFERA (ALAT) (EC: 2.6.1.2)
INTRODUCCIÓN.
La alanina aminotransferasa en suero (ALT), también conocida como transaminasa glutámica piruvica (TGP),
es una enzima de los tejidos, que cataliza el intercambio de grupos amino y cetónicos entre - aminoácidos
y - cetoácidos. La ALT se encuentra ampliamente distribuida en los tejidos, principalmente en el hepático
(la TGP está contenida principalmente en el citoplasma de las de las células del parénquima hepático) y es
por ello que por ejemplo en la hepatitis viral aguda los valores de TGP, son casi siempre superiores a los de
la TGO, debido a que la extensión de la lesión celular es amplia, pero la lesión de la célula individual es
ligera.
Método: Cinético-UV.
Fundamento: La secuencia de la reacción enzimática que se lleva a cabo, es la siguiente:
ALAT
L-Alanina +
------------------
Piruvato +
-Cetoglutarato ----------------L-glutamato
LDH
Piruvato + --------------- Lactato
NADH + H+ -------------- + NAD+ + H2O
El piruvato formado en la primera reacción se reduce a lactato en presencia de la lactato deshidrogenasa
(LDH) y NADH. Por lo que para determinar la actividad de la ALT se mide la oxidación del NADH a 340 nm
(ó 334).
Composición de reactivos: (concentración final)
R1
Tampón TRIS pH 100 mmol/l
Tampón
7.3
L-alanina
500 mmol/l
R2
NADH+
0.18 mmol/l
Comprimido
LDH
1200 U/l
R3
15 mmol/l
-Cetoglutarato
Sol. Starter
Preparación y estabilidad: Disolver 4 comprimidos de R2 en un frasco de 100 ml de R1. El reactivo
liofilizado se debe almacenar a 2 a 8 0C antes de reconstituirse. Después de la reconstitución permanece
estable durante 3 semanas a 2 a 8 0C y 4 días a temperatura ambiente.
R3 listo para usar, una vez abierto es estable 6 meses a 2 a 8 0C ó 3 semanas a 15 - 25 0C.
Muestra: Suero. Estable de 4 a 8 0C durante 7 días. (4)
Técnica: Llevar, previamente, los reactivos a la temperatura de medición.
Manual
Reactivo R1+R2
1.0 ml
Muestra
100 l
Mezclar y esperar un minuto a 37 0C.
R3
100 l
Mezclar y esperar 1 minuto. Anotar la lectura a 340 nm y poner en marcha el cronómetro. Repetir la lectura a
1, 2 y 3 minutos. Calcular el valor medio de la disminución de extinción por minuto (E340 nm /min).
Cálculo: E/min x 1905 = U/l para 340 nm.
E/min x 1942 = U/l para 334 nm.
(Se debe comprobar el factor, con los controles, cada vez que se realice por primera vez el procedimiento)
Linealidad: Si la actividad es > 285.75 (E/min para 340 y 334 nm > 0.150), mezclar 0.1 ml (100 l) de
muestra con 0.9 ml (900 l) de cloruro de sodio al 0.9 % y repetir la determinación, multiplicar el resultado
por 10.
Factor de conversión:
= 16.67 x 10-9 Kat/l
= 16.67 x 10-3 Kat/l
1kat/l = 60 U/l
1U/l
Valores de referencia:
(H) hasta 40 U/l (M) hasta 31 U/l
Notas: Las muestras hemolizadas no deben usarse, ya que los eritrocitos presentan 7 veces más la actividad de ALAT
en suero.
El fosfato de piridoxal puede elevar los niveles de la ALAT por activación de la apoenzima a partir de la transaminasa. (5)
Dicho reactivo puede encontrarse en agua contaminada por crecimiento microbiano.
Así mismo, los niveles elevados de piruvato en suero, pueden interferir con el desempeño de la prueba. Young y
colaboradores, han publicado una lista de drogas que interfieren en la determinación de la actividad de la ALT. (6)
Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y evitar contactos con
piel y mucosas.
Control de calidad: Todos los sueros control con valores de ALAT determinados por este método pueden ser
empleados.
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de plástico); cronómetros; baño de
María con control a 37 0C; espectrofotómetro con capacidad para medir absorbancias especificadas en la técnica y con
termostato acoplado.
Semiología:
Aumento:
Enfermedades hepatocelular (de moderado a elevado incremento.)
Cirrosis activa (incremento medio)
Neoplasia hepática
Íctero obstructivo
Pancreatitis
Delirum Tremens, quemadura severa, trauma, shock.
Hepatitis tóxica e infecciosa.
Mononucleosis infecciosa.
Infarto agudo del miocardio ( puede no aumentar)
Disminución:
Aspirina o salicilatos.
ASPARTATO AMINOTRANSFERASA (ASAT) (EC: 2.6.1.1)
INTRODUCCIÓN.
La Aspartato aminotransferasa en suero (AST), también conocida como transaminasa glut{amica oxalacética en suero
(TGO), es una enzima que cataliza el intercambio de grupos amino y ceto entre - aminoácidos y - cetoácidos
. Se encuentra ampliamente distribuida en los tejidos, principalmente en el cardíaco, hepático, muscular y renal; razón
por la cual, los daños ocurridos en dichos tejidos ocasionarían la liberación de la enzima AST, hacia la circulación
general, alcanzamdo sus máximos niveles después de un infarto al miocardio, dentro de las primeras 16 a 48 horas
transcurridas. Así mismo, las enfermedades hepatobiliares tales como cirrosis, carcinoma metastásico y hepatitis biliar,
también aumentan los niveles de AST.
Método: Cinético-UV.
Fundamento:
La AST cataliza la transferencia de un grupo amino entre el L-Aspartato y el 2- oxoglutarato que a su vez
reacciona con el NADH en presencia de la malato deshidrogenasa (MDH) para formar NAD +. La actividad de AST se determina al
medir la oxidación de NADH a 340 nm (ó 334). El reactivo empleado para la determinación, también contiene lactato deshidrogenasa
que se encarga de convertir el piruvato endógeno de la muestra en lactato durante la fase inicial previa a la determinación.
ASAT
L-Aspartato +
--------------- Oxalacetato +
2-Oxoglutarato -------------- L-Glutamato.
MDH
Oxalacetato + --------------- L-Malato +
NADH + H+ ------------- NAD+ + H2O
Composición de reactivos: (concentración final)
Tampón TRIS pH 7.8 100 mmol/l
L-aspartato
200 mmol/l
NADH
0.18 mmol/l
LDH
800 U/l
MDH
600 U/l
R3
15 mmol/l
-Cetoglutarato
Preparación y estabilidad: Disolver 4 comprimidos de R2 en un frasco de 100 ml de R1. El reactivo
liofilizado se debe almacenar a 2 a 8 0C antes de reconstituirse. (Se puede preparar menos volumen,
disolviendo 1 comprimido con 25 ml de tampón). Después de la reconstitución permanece estable durante 3
semanas a 2 a 8 0C y 4 días a temperatura ambiente.
R3 listo para usar, una vez abierto es estable 6 meses a 2 a 8 0C ó 3 semanas a 15- 25 0C.
Muestra: Suero. Estable de 4 a 8 0C durante 7 días. (4)
Técnica: Llevar, previamente, los reactivos a la temperatura de medición.
Macro-test
Reactivo R1+R2
1.0 ml
Muestra
100 l
Mezclar y esperar un minuto a 37 0C.
R3
100 l
R1
Tampón
R2
Mezclar y esperar 1 minuto. Anotar la lectura a 340 nm y poner en marcha el cronómetro. Repetir la lectura a
1, 2 y 3 minutos. Calcular el valor medio de la disminución de extinción por minuto (E340nm /min).
Cálculo: E/min x 1905 = U/l para 340 nm.
E/min x 1942 = U/l para 334 nm.
(Se debe comprobar el factor, con los controles, cada vez que se realice por primera vez el procedimiento)
Linealidad: Si la actividad es > 285 (E/min para 340 y 334 nm > 0.150), mezclar 0.1 ml (100 l) de muestra con 0.9
ml (900 l) de cloruro de sodio al 0.9 % y repetir la determinación, multiplicar el resultado por 10.
Factor de conversión:
1U/l = 16.67 x 10-9 kat/l
= 16.67 x 10-3 kat/l
1kat/l = 60 U/l
Valores de referencia:
(H) hasta 37 U/l (M) hasta 31 U/l
Notas: Las muestras hemolizadas no deben usarse, ya que los eritrocitos presentan 7 veces más la actividad de ALAT
en suero.
El fosfato de piridoxal puede elevar los niveles de la ALAT por activación de la apoenzima a partir de la transaminasa. (5)
Dicho reactivo puede encontrarse en agua contaminada por crecimiento microbiano.
Así mismo, los niveles elevados de piruvato en suero, pueden interferir con el desempeño de la prueba. Young y
colaboradores, han publicado una lista de drogas que interfieren en la determinación de la actividad de la ALT. (6)
Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y evitar contactos con
piel y mucosas.
Control de calidad: Todos los sueros control con valores de ASAT determinados por este método pueden ser
empleados.
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de plástico); cronómetros;
baño de María con control a 37 0C; espectrofotómetro con capacidad para medir absorbancias especificadas
en la técnica y con termostato acoplado.
Semiología:
Aumento:
Infarto del miocardio (4 a 10 veces el valor normal paralelo al aumento de la CPK), arritmia severa y angina severa.
Enfermedades hepáticas (10 a 100 veces de lo normal): Hepatitis aguda; Cirrosis activa; Necrosis Hepática;
Carcinoma primario o metastásico; MNI más HVA.
Otras enfermedades: Pancreatitis aguda; Anemia hemolítica aguda; Quemadura severa; Embolia pulmonar;
Enfermedades renal aguda; Distrofia muscular progresiva; Gangrena; Hipertermia maligna; Trauma e irradiación de
músculo esquelético
Disminución:
Embarazo, Beriberi y Diabetes Mellitus con acidosis
AMILASA (EC: 3.2.1.1)
INTRODUCCIÓN.
En el páncreas se forman las enzimas amilasa y lipasa, y también, como precursores inactivos, las proteasas
tripsinógeno y quimotripsinógeno, que se activan después del duodeno. Las enzimas digestivas de la
secreción del páncreas desintegran sustancias nutritivas. La amilasa desdobla polisacáridos. La amilasa que
se mide en suero procede en 1/3 aproximadamente del páncreas, la mayor parte procede de las glándulas
parótidas. Como consecuencia de su bajo peso molecular, la amilasa se filtra glomerularmente y puede
demostrarse en la orina.
La determinación de amilasa en suero y orina es la prueba que se desarrolla más comúnmente para
diagnosticar pancreatitis aguda, enfermedad en la cual los niveles de dicha enzima se elevan durante largos
períodos de tiempo en orina y suero.
Método: Cinético - colorimétrico.
Principio: La amilasa se encarga de hidrolizar al PNFG7 a PNFG3 y maltotetraosa. A su vez la
glucoamilasa hidroliza a la PNFG3 a
p-nitrofenol y este último produce un color amarillo. El
incremento ocurrido en la absorbancia se mide a 405 nm y es proporcional a la actividad de la
amilasa en la muestra.
-amilasa
PNPG7 bloqueado---------------G2-5 + PNP-G2-5
glucoamilasa
PNP-G2-5 ------------------ PNP-Gluc + Glucosa
- glucosidasa
PNP-Glucósido ----------------- PNP + Glucosa
Composición de reactivos: (concentración final)
Reactivo (Listo MES Tampón 100 mmol/l
para usar).
pH 6.0
CNPG3
2.25 mmol/l
NaCl
350 mmol/l
Acetato de Ca
6 mmol/l
Tiocianato
900 mmol/l
Potásico
Azida Sódica
0.095 %
Preparación y estabilidad: El reactivo esta listo para el uso, almacenar entre 2° y 8°C hasta la fecha de
caducidad.
Muestra: Suero, plasma heparinizado, orina.
Técnica: Llevar, previamente, los reactivos a la temperatura de medición.
Reactivo R1+R2
1 ml
Suero o plasma
20 l
Orina
10 l
Mezclar y esperar 30 segundos a 37 0C. Anotar la lectura a 405 nm (400-410)y poner en marcha el
cronómetro. Repetir la lectura a 1, 2 y 3 minutos. Calcular el valor medio de la disminución de extinción por
minuto (E/min).
Cálculo: E/min x 5188 = U/l.
Para las muestras de orina se multiplicará el resultado por 2.
(Se debe comprobar el factor, con los controles, cada vez que se realice por primera vez el procedimiento)
Linealidad: Si la actividad es > 1127 (E/min > 0.220), mezclar 0.1 ml (100 l) de muestra con 0.9 ml (900
l) de cloruro de sodio al 0.9 % y repetir la determinación, multiplicar el resultado por 10.
Valores de referencia: hasta 90 U/l
Factor de conversión:
= 16.67 x 10-9 kat/l
= 16.67 x 10-3 kat/l
1kat/l = 60 U/l
Notas: Debido al contenido de -amilasa en la saliva y el sudor, no pipetear el reactivo con la boca y evitar
el contacto de la muestra y el reactivo con la piel.
Interferencias: Lipemia, hemólisis, insulina, bacterias.
Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y evitar
contactos con piel y mucosas.
Control de calidad: Todos los sueros control con valores de amilasa determinados por este método
pueden ser empleados.
1U/l
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de plástico); cronómetros; baño de
María con control a 37 0C; espectrofotómetro con capacidad para medir absorbancias especificadas en la técnica y con
termostato acoplado.
Semiología:
Aumento:
Pancreatitis (3 a 6 horas después del dolor)
Parotiditis
Úlcera péptica perforada
Apendicitis
Rotura de un ectópico
Aneurisma diseminado de la aorta
Insuficiencia renal
Macroamilasemias (aumenta aparentemente)
Colecistitis aguda
Exacerbación aguda de la pancreatitis crónica
Obstrucción del conducto pancreático
Alcoholismo ( intoxicación )
Obstrucción intestinal
Aumento en suero y disminución en orina en coagulación intravascular diseminada y
macroamilasemias
Disminución
Hepatitis
Cirrosis hepática
Toxemia del embarazo
Quemadura severa
CREATIN-KINASA (CPK) (EC: 2.7.3.2)
Introducción.
La creatin cinasa es una enzima que juega un papel importante en el mecanismo para el almacenamiento de
energía en tejidos, esto mediante la catalización de la reacción reversible entre creatina y ATP, para formar
fosfato de cretina y ADP. Dicha enzima, se encuentra distribuida en varios órganos, registrándose su
actividad más alta ( en orden decreciente) en el músculo esquelético, corazón y cerebro. Es por ello que su
determinación ayuda en el diagnóstico de distrofias musculares y otras enfermedades del músculo
esquelético, infarto al miocardio, enfermedades renales y/o disfuncionales.
Método: Ensayo cinético UV-NAC activado.
Fundamento: Determinación cinética de la actividad de la creatin-kinasa después de la activación mediante
N-acetilcisteina de acuerdo a la siguiente reacción.
CK
Creatin-fosfato + ADP--------- creatina + ATP
--------HK
ATP + glucosa --------- glucosa-6-P + ADP
--------G6PDH
Glucosa-6-P + NADP+ --- gluconato-6-P + NADPH + H+
--
Composición de reactivos: (concentración final)
R1
Tampón
R2
Comprimido
Imidazol pH 6.7
Glucosa
Acetato Magnesio
100 mmol/l
20 mmol/l
10 mmol/l
EDTA
ADP
AMP
Diadenosin-5-P
NADP
Hexoquinasa(HK
G-6-PDH
N-Acetilcisteína
Creatín-Fosfato
2 mmol/l
2 mmol/l
5 mmol/l
10 mmol/l
2 mmol/l
2500U/l
1500 U/l
20 mmol/l
30 mmol/l
Preparación y estabilidad: Disolver 1 comprimido en 15 ml de Tampón R1. La estabilidad del
monoreactivo es de 5 días de 2 a 8 0C o 24 horas a temperatura ambiente.
Muestra: Suero, plasma heparinizado ó con EDTA. La actividad de la CK/NAC en suero disminuye un 10%
al cabo de un día de 2 a 8 0C ó una hora de 15 a 25 0C
Técnica: Llevar, previamente, los reactivos a la temperatura de medición.
Reactivo
1 ml
(Listo para usar.)
Muestra
20 l
Mezclar e incubar 2 minutos a 37 0C. Anotar la lectura a 340 nm (334) y poner en marcha el cronómetro.
Repetir la lectura a 1, 2 y 3 minutos. Calcular el valor medio de la disminución de extinción por minuto
(E/min). Ajuste a cero con blanco agua o aire.
Cálculo: E/min x 8095 = U/l para 340 nm.
E/min x 8254 = U/l para 334 nm.
(Se debe comprobar el factor, con los controles, cada vez que se realice por primera vez el procedimiento)
Linealidad:
A 340 nm es lineal hasta 2023 U/l (E/min > 0.220). Para concentraciones mayores mezclar 0.1 ml (100 l)
de muestra con 0.9 ml (900 l) de cloruro de sodio al 0.9 % y repetir la determinación, multiplicar el resultado
por 10.
Factor de conversión:
= 16.67 x 10-9 kat/l
= 16.67 x 10-3 kat/l
1kat/l = 60 U/l
1U/l
Valores de referencia:
Hombres: 24-195 U/l.
Mujeres: 24-170 U/l.
NOTA: La hemólisis interfiere en el ensayo a concentraciones superiores a 0.2 mg/dl de hemoglobina.
Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y evitar
contactos con piel y mucosas.
Control de calidad: Todos los sueros control con valores de CPK determinados por este método pueden
ser empleados.
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de plástico); cronómetros; baño de
María con control a 37 0C; espectrofotómetro con capacidad para medir absorbancias especificadas en la técnica y con
termostato acoplado.
Semiología:
Aumento:
Infarto del Miocardio (4 a 6 horas)
Otras enfermedades que producen incremento de la CPK:
- Enfermedades cerebro-vasculares agudas
- Distrofia muscular progresiva (de 300-400 veces lo normal)
- Dermatomiositis
- Delirum tremens
- Alcoholismo crónico
- Shock eléctrico
- Mixedema
- Cirugía cardiaca
- Desfibrilación cardíaca
- Convulsiones, infarto cerebral, isquemias, o hemorragias subaracnoidea
- Hipotiroidismo
- Psicosis aguda
- Trauma del sistema nervioso central.
- Infarto o edema pulmonar
CREATIN-KINASA, ISOENZIMA MB
CK-MB
Método: Ensayo cinético UV. NAC activado.
Fundamento: La CK-MB está formada por las subunidades CK-B y CK-M. La fracción CK-M está
inhibida por un anticuerpo específico que no influye en la fracción CK-B. La restante actividad de
esta fracción que corresponde a la actividad de la CK-MB es determinada mediante técnica
cinética UV al igual que CK-NAC.
Composición de reactivos: (concentración final)
Imidazol pH 6.7 100 mmol/l
R1
Glucosa
Tampón
20 mmol/l
Acetato de Mg 10 mmol/l
EDTA
2 mmol/l
Ac. Anti-CK-M 2000 U/l
R2
ADP
Comprimido
2 mmol/l
AMP
5 mmol/l
Diadenosín-5-P 10 mmol/l
NADP+
2 mmol/l
Hexoquinasa
2500 U/l
(HK)
G-6-PDH
1500 U/l
N-acetilcisteína 20 mmol/l
Creatin -fosfato 30 mmol/l
Vial liofilizado
Control
Preparación y estabilidad: Disolver un frasco de R2 en 2.5 ml de tampón. La estabilidad del
monoreactivo es de 7 días de 2-8 0C ó 12 horas a 15-25 0C.
Control: Disolver con 3 ml de H2O destilada suavemente y evitando la formación de espuma.
Muestra: Suero, plasma heparinizado o con EDTA. La actividad de CK-MB en suero disminuye: a
4 0C un 10 % al cabo de 24 horas, o bien a 25 0C un 10 % al cabo de 1 hora.
Técnica: Llevar, previamente, los reactivos a la temperatura de medición.
Reactivo
2.5 ml
Muestra
100 l
Mezclar y dejar reposar 10 minutos a 37 0C. Leer extinción E1 y después de exactamente 5
minutos, leer la extinción E2 a 340 nm.
Nota: antes de la determinación de la CK-MB, se determina la actividad de la CPK total, para
asegurar correctamente la interpretación diagnóstica del resultado. Diluir las muestras, 1:10, si son
superiores a 1000 U/l.
Calcular E = E2 - E1
Cálculo:
De la CK-MB en la muestra: E x 1651 = U/l
De la CK-B E x 825 = U/l
(Se debe comprobar el factor, con los controles, cada vez que se realice por primera vez el procedimiento)
Linealidad: Antes de efectuar la determinación de CK-MB, se determinará la actividad de CK total
por el método CK-NAC activado. Si la actividad de CK es superior a 1000 U/l, Para
concentraciones superiores mezclar 0.1 ml (100 l) de muestra con 0.2 ml (200 l) de cloruro de
sodio al 0.9 % y repetir la determinación, multiplicar el resultado por 3 (dilución 1:3)
1U/l = 16.67 x 10-9 kat/l
= 16.67 x 10-3 kat/l
1kat/l = 60 U/l
Valores de referencia:
CPK – MB: Está aumentada si se encuentra entre el 6 y el 25 % de la actividad total de la CPK. La
probabilidad de IMA es alta si se reflejan las siguientes condiciones:
CPK (H): > 190 U/l
(M): >167 U/l
CPK - MB > 24 U/l
Notas: La hemólisis interfiere en los sueros control con valores de CK-MB determinados por este método
pueden ser empleados.
Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y evitar
contactos con piel y mucosas.
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de plástico); cronómetros; baño de
María con control a 37 0C; espectrofotómetro con capacidad para medir absorbancias especificadas en la técnica y con
termostato acoplado.
Semiología:
Aumento:
Infarto del miocardio (aumento de 4-6 horas después del IMA)
Isquemia miocárdica
Distrofia muscular de Duchenne
Polimiositis
Mioglubinuria
Síndrome de Reye
LACTATO DESHIDROGENASA (LDH) (EC: 1.1.127)
INTRODUCCIÓN.
La lactato deshidrogenasa es la enzima que completa la oxidación anaeróbica de la glucosa por vía
glucolítica y se halla presente en todos los tejidos, particularmente en el músculo cardíaco y el esquelético,
hígado y riñón. La enzima en circulación es una mezcla de 5 isoenzimas, las cuales difieren en su movilidad
electroforética y sus pH óptimos.
La elevación de la enzima LDH puede deberse a infartación al miocardio, enfermedades del hígado y/o
renales, algunos tipos de anemia, enfermedades malignas y distrofias muscular.
Método: Ensayo cinético UV
Fundamento: Ensayo cinético optimizado de acuerdo con la siguiente reacción:
Piruvato – NADH + H+ ------ Lactato + NAD+
------
Composición de reactivos: (concentración final)
R1
Tampón
R2
Comprimido
Tampón TRIS
pH 7.5
Piruvato
NADH
50 mmol/l
0.6 mmol/l
0.18 mmol/l
Preparación y estabilidad: Disolver 1 comprimido en 15 ml de tampón R1. La estabilidad es de 5 días a
2 a 8 0C ó 24 horas a temperatura ambiente.
Muestra: Suero. Estable durante 48 horas a 2-8 0C.
Técnica: Llevar, previamente, los reactivos a la temperatura de medición.
Reactivo
R1+R2
Muestra
Macro-test
1.0 ml
20 l
Mezclar y esperar 1 minuto a 37 0C. Anotar la lectura a 340 nm y poner en marcha el cronómetro. Repetir la
lectura a 1, 2 y 3 minutos. Calcular el valor medio de la disminución de extinción por minuto (E/min).
Cálculo: E/min x 9690 = U/l. para 340 nm.
E/min x 9880 = U/l para 334 nm
(Se debe comprobar el factor, con los controles, cada vez que se realice por primera vez el procedimiento)
Linealidad: Si la actividad es > 1453 (E/min para 340 y 334 nm > 0.150), mezclar 0.1 ml (100 l) de
muestra con 0.9 ml (900 l) de cloruro de sodio al 0.9 % y repetir la determinación, multiplicar el resultado
por 10.
Factor de conversión:
= 16.67 x 10-9 kat/l
= 16.67 x 10-3 kat/l
1kat/l = 60 U/l
1U/l
Valores de referencia:
230 - 460 U/l
Notas: La hemólisis interfiere en el ensayo.
Interfieren también: oxalato y EDTA.
Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y evitar
contactos con piel y mucosas.
Control de calidad: Todos los sueros control con valores de LDH determinados por este método
pueden ser empleados.
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de plástico); cronómetros; baño de
María con control a 37 0C; espectrofotómetro con capacidad para medir absorbancias especificadas en la técnica y con
termostato acoplado.
Semiología:
Aumento:
Infarto del miocardio: La elevación de la LDH en el infarto del miocardio es caracterizada por: altos niveles (
2 a 10 veces por encima de lo normal) en las 12 a 24 horas del infarto. La elevación continua en los 6 a 10
días (más que la TGO y la CPK), por tal razón es utilizada para el diagnóstico tardío del infarto; retornando
a la normalidad entre los 8 y 14 días.
Infarto pulmonar: Usualmente hay un incremento de la LDH a las 24 horas de iniciado el dolor.
Condiciones generales del incremento en los niveles:
Niveles elevados:
Infarto miocardio; Leucemia; Anemias hemolíticas; Enfermedades hepáticas; Necrosis de músculo
esquelético; Esprue; Infarto pulmonar agudo; Neoplasias; Infarto renal agudo y enfermedad renal crónica;
Mixedema; Shock con necrosis de órganos menores.
Incremento importante (2 a 40 veces):
Anemias megaloblásticas; Shock y anoxia; Cáncer
Incremento moderado (2 a 4 veces):
Infarto miocardio; Infarto pulmonar; Leucemia granulocítica; Anemia Hemolítica; Mononucleosis infecciosa;
Distrofia muscular progresiva.
Incremento ligero
Delirum Tremens; Hepatitis; Cirrosis; íctero obstructivo; Mononucleosis; Hemólisis; Shock y Anoxia.
La angina y la pericarditis no producen elevación de la LDH.
Elevación urinaria:
o Cáncer de riñón o de próstata
o Glomerulonefritis
o Hipertensión maligna
o Lupus nefrítico
o Necrosis tubular aguda
o Transplante renal
o Pielonefritis ( a veces)
Disminución
Buena respuesta a la terapia contra el cáncer.
Referencias:
FOSFATASA ALCALINA (ALP) (EC: 3.1.3.1)
INTRODUCCIÓN.
La fosfatasa alcalina de origen humano hidroliza todos los monoésteres ortofosfóricos. Esta enzima está
presente en casi todos los tejidos y fluidos humanos; son fuentes particularmente ricas el intestino delgado,
hueso, hígado y riñón. Los niveles normales de fosfatasa alcalina dependen de la edad, incrementándose sus
concentraciones durante el período de crecimiento de huesos. Por ello, una elevación moderada de ALP no
atribuida a hígado o huesos, puede deberse a la enfermedad de Hodgkins, e infecciones bacterianas
abdominales.
Método: Ensayo cinético optimizado. Metódica DGKC.
Fundamento del método: La fosfatasa alcalina hidroliza los ésteres del ácido fosfórico en medio
alcalino, produciendo fosfato inorgánico y el correspondiente resto orgánico con el que se había
esterificado.
ALP
p-nitrofenilfosfato ---------- p-nitrofenol + fosfato
Composición de reactivos: (concentración final)
Tampón (pH 9.8) 1 mol/L
R1
dietanolamina
Tampón
Cloruro
0.5 mmol/l
magnésico
p-nitrofenilfosfato 10 mmol/l
R2
Comprimido
Preparación y estabilidad:
Disolver el contenido del frasco R2 con 15 ml de Tampón R1.
El monoreactivo es estable 5 días a 18 –20 °C ó 21 días a 2-8 °C.
Muestra: Suero, plasma heparinizado. La actividad de la enzima debe ser determinada
rápidamente o bien separar el suero de los hematíes. La pérdida de la actividad enzimática es
menor de un 10% entre 2 a 3 días a 15-25 0C o durante 1 mes a -20 0C.
Técnica: Llevar, previamente, los reactivos a la temperatura de medición.
Reactivo R1 + R2
3.0 ml
Muestra
50 l
Mezclar y esperar 1 minuto a 37°C. Ajustar el cero con blanco agua o frente a aire, en una cubeta
de 1 cm de paso de luz y una longitud de onda de 405 nm.(400-410)
Cálculo: E/min x 3300 = U/l.
(Se debe comprobar el factor, con los controles, cada vez que se realice por primera vez el procedimiento)
Linealidad:
Si la actividad es > 825 (E/min > 0.250), mezclar 0.1 ml (100 l) de muestra con 0.9 ml (900 l) de
cloruro de sodio al 0.9 % y repetir la determinación, multiplicar el resultado por 10.
Factor de conversión:
= 16.67 x 10-9 kat/l
= 16.67 x 10-3 kat/l
1kat/l = 60 U/l
Valores de referencia:
Niños: < 645 U/l
Adultos: 98 – 279 U/l
Control de calidad: Todos los sueros control con valores de ALP determinados por este método pueden
1U/l
ser empleados.
Notas: Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y
evitar contactos con piel y mucosas.
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de plástico); cronómetros; baño de
María con control a 37 0C; espectrofotómetro con capacidad para medir absorbancias especificadas en la técnica y con
termostato acoplado.
Semiología:
Aumento:
o Enfermedades hepáticas ( asociada a aumento de la ASAT, ALAL y Bil.)
1. Incremento marcado:
- Íctero obstructivo (aumento del doble o más de lo normal)
- Lesión ocupadora de espacio (Absceso o neo)
- Cirrosis hepatobiliar
- Cirrosis biliar
2. Incremento moderado
- Hepatitis
- Cirrosis alcohólica
o
o
- Pancreatitis
Enfermedades óseas
1. Incremento marcado
- Enfermedad Paget
- Metástasis ósea
- Osteítis deformante
- Osteosarcoma
2. Incremento moderado.
- Osteomalasia
Otras enfermedades
Mononucleosis infecciosa
Leucemia
Crecimiento anormal
Embarazo (último trimestre, retorna a la normalidad 1 mes después del parto)
FOSFATASA ÁCIDA (ACP) (EC: 3.1.3.2)
INTRODUCCIÓN.
La fosfatasa ácida de origen humano hidroliza todos los monoésteres ortofosfóricos. Esta enzima a pesar de
su amplia distribución, su mayor importancia clínica estriba en la atención al estudio de la enzima secretada
por la glándula prostática humana, esto en cuanto a su caracterización y determinación estructural. Dicho
conocimiento es importante para obtener un diagnóstico que no sea afectado por interferencia de la fosfatasa
ácida producida por otros tejidos.
Método: Ensayo cinético colorimétrico. Método de Hillmann modificado.
Fundamento: La fosfatasa ácida a pH 5.0 hidroliza el naftilfosfato o fosfato inorgánico a
naftol. El naftol se hace reaccionar con un cromógeno diazotado formando un compuesto
coloreado con pico de absorción a los 405 nm.
naftilfosfato + H2O --------- naftol + fosfato
naftol + Fast Red TR --------------- Azo Dye
Composición de reactivos: (concentración final)
R1
Citrato pH 5.0 50 mmol/l
Tampón
R2
10 mmol/l
naftilfosfato
Comprimido Fast Red TR
6 mmol/l
R3
Tartrato sódico 2 mmol/l
Tampón acetato 5 mmol/l
R4
Preparación y estabilidad: Disolver 1 comprimido en un frasco de R1. Una vez disuelto tiene una
estabilidad de dos días a 2-8 0C ó 6 horas a temperatura ambiente.
Muestra: Suero.
Técnica: Llevar, previamente, los reactivos a la temperatura de medición.
Total
No inhibida
por tartrato
Reactivo
1 ml
1 ml
R1+ R2
Tartrato
10 l
Muestra
100 l
100 l
Mezclar y esperar 5 minutos a 37 0C. Anotar la lectura a 405 nm y poner en marcha el cronómetro.
Repetir la lectura a 1, 2 y 3 minutos. Calcular el valor medio del aumento de extinción por minuto
(E/min).
Cálculo:
Fosfatasa Ácida Total (U/l)= E/min x 750
Fosfatasa Ácida Prostática (U/l)= (E/min fosfatasa ácida total - E/min fosfatasa ácida. No inhibida por
tartrato) x 750
(Se debe comprobar el factor, con los controles, cada vez que se realice por primera vez el procedimiento)
Linealidad: Hasta 150 U/l (E/min > 0.220) Para concentraciones mayores mezclar 0.1 ml (100
l) de muestra con 0.9 ml (900 l) de cloruro de sodio al 0.9 % y repetir la determinación, multiplicar
el resultado por 10.
Factor de conversión:
1U/l = 16.67 x 10-9 kat/l
= 16.67 x 10-3 kat/l
1kat/l = 60 U/l
Valores de referencia:
(H) hasta 5.4 U/l (M) hasta 4.2 U/l
Notas: Utilizar solamente suero. No plasma.
Si la determinación no se realiza el mismo día, es aconsejable añadir 20 l de tampón acetato acético 5
MOLAR, pH 5.0 por cada 1 ml de suero.
La hemólisis interfiere en el ensayo. La bilirrubina provoca disminución de su actividad.
Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y evitar
contactos con piel y mucosas.
Control de calidad: Todos los sueros control con valores de ACP determinados por este método pueden
ser empleados.
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de plástico); cronómetros; baño de
María con control a 37 0C; espectrofotómetro con capacidad para medir absorbancias especificadas en la técnica y con
termostato acoplado.
Semiología:
Aumento:
o Incremento elevado en el cáncer metastásico de próstata
o Moderada elevación.
- Hiperparatiroidismo
- Hepatitis
- Excesiva destrucción de plaquetas
GAMMA GLUTAMIL TRANSFERASA
( - GT) (EC: 2.3.2.1)
INTRODUCCIÓN.
La GGT es una enzima del grupo de las peptidasas, las cuales catalizan el rompimiento hidrolítico de los
péptidos para formar aminoácidos o péptidos más pequeños.
Específicamente, la GGT cataliza la transferencia de grupos -glutamil de péptidos de distinto tamaño, hacia
moléculas aceptoras de péptidos de distinto tamaño, hacia moléculas aceptoras de péptidos. Aún cuando los
niveles más elevados de GGT están localizados en los tejidos renales, la fuente de las enzimas presentes en
suero es de origen hepático. Los niveles elevados de esta enzima están asociados con desórdenes
hepatobiliares y pancreáticos; también se presentan en alcohólico.
Método: Ensayo cinético.
Fundamento: Determinación cinética de la actividad de la gamma glutamil transferasa,de acuerdo
a la siguiente reacción:
- GT
L--glutamil-3carboxi-p-nitroanilina------L--glutamilglicina
+ glicil glicina
+ 5-amino-2-nitrobenzoato
Composición de reactivos: (concentración final)
R1
Tampón TRIS 100
Tampón
pH 8.25
mmol/l
R2
Glicilglicina
100 mmol/l
Comprimido
3 mmol/l
L--glutamil3carboxi-pnitroanilina
Preparación y estabilidad: Disolver un comprimido en 50 ml de tampón R1. La estabilidad es de
21 días a 2 a 8 0C ó 5 días a temperatura ambiente.
Muestra: Suero, no utilizar plasma. La - GT es estable en el suero durante 8 horas a 15 0C ó 3
días a 2-8 0C, o un mes a –20 0C.
Técnica: Llevar, previamente, los reactivos a la temperatura de medición.
Manual
Reactivo R1+R2
1.00 ml
Muestra
100 l
Mezclar y esperar 1 minuto a 37 0C. Anotar la lectura a 405 nm (400-410) y poner en marcha el
cronómetro. Repetir la lectura a 1, 2 y 3 minutos. Calcular el valor medio de la disminución de
extinción por minuto (E/min).
Cálculo:
E/min x 1190 = U/l.
(Se debe comprobar el factor, con los controles, cada vez que se realice por primera vez el procedimiento)
Linealidad: Hasta 250 U/l. Para concentraciones mayores mezclar 0.1 ml (100 l) de muestra
con 0.9 ml (900 l) de cloruro de sodio al 0.9 % y repetir la determinación, multiplicar el resultado
por 10.Factor de conversión:
1U/l = 16.67 x 10-9 kat/l
= 16.67 x 10-3 kat/l
1kat/l = 60 U/l
Valores de referencia:
(H) 11 - 50 U/l (M) 7 - 32 U/l
Notas: La hemólisis interfiere en el ensayo; al igual que los anticonvulsivantes (barbitúricos, alantoína y
fenitoína)
Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y evitar
contactos con piel y mucosas.
Control de calidad: Todos los sueros control con valores de GGT determinados por este método pueden
ser empleados.
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o
de plástico); cronómetros; baño de María con control a 37 0C; espectrofotómetro
con capacidad para medir absorbancias especificadas en la técnica y con
termostato acoplado.
Semiología:
Aumento:
o Colecistitis
o Colelitiasis
o Cáncer metastásico del hígado
o Cirrosis hepática
o Pancreatitis
o Cáncer de los conductos biliares
o Alcoholismo
o Uso de barbitúricos
o Obstrucción del tracto biliar
COLINESTERASA (CHE)
(EC: 3.1.1.8)
Método: Test cinético-colorimétrico. Birreactivo
Fundamento: La colinesterasa cataliza la hidrólisis de los ésteres de colina. Utilizando la
butirilcolina se determina la colinesterasa cinéticamente de acuerdo a las siguientes reacciones:
CHE
Butirilcolina + H2O ----------- Tiocolina + Butirato
Tiocolina + Ditiobisnitrobenzoato -----
2-nitro-5-mercaptobenzoato
Composición de reactivos: (concentración final)
R1
Tampón fosfato 50 mmol/l
Tampón
5.5 DTNB
0.25 mmol/l
R2
Butirilcolina
7 mmol/l
Preparación y estabilidad: Disolver el contenido del frasco R1 con 250 ml de agua destilada. La
estabilidad de esta solución es de 8 semanas a 2 a 8 0C y al abrigo de la luz.
Disolver el contenido del frasco R2 con 100 ml de agua destilada. La estabilidad de esta solución
es de 8 semanas a 2 a 8 0C.
Muestra: Suero, plasma heparinizado o con EDTA. Estable durante 7 días a 15-20 0C.
Técnica: Llevar, previamente, los reactivos a la temperatura de medición.
R1
3 ml
Muestra
Muestra diluida 1:2 0.02 ml
con sol. Salina.
R2
0.10 ml
Mezclar y verter la solución en la cubeta, y poner en marcha el cronómetro. Repetir la lectura a 30,
60 y 90 seg. a 405 nm, a 370C, frente a aire o agua destilada. Calcular el valor medio de la
disminución de extinción por 30 seg. (E/30 seg.).
Cálculo: E/30 seg. x 39000 = U/l.
(Se debe comprobar el factor, con los controles, cada vez que se realice por primera vez el procedimiento)
Linealidad: Si la actividad es > 93 000 (E/min > 0.200), mezclar 0.1 ml (100 l) de muestra con
0.9 ml (900 l) de cloruro de sodio al 0.9 % y repetir la determinación, multiplicar el resultado por 10.
Factor de conversión:
1U/l = 16.67 x 10-9 kat/l
= 16.67 x 10-3 kat/l
1kat/l = 60 U/l
Valores de referencia:
4659 - 14443 U/l
Control de calidad: Todos los sueros control con valores de CHE determinados por este método
pueden ser empleados.
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de plástico); cronómetros; baño de
María con control a 37 0C; espectrofotómetro con capacidad para medir absorbancias especificadas en la técnica y con
termostato acoplado.
Semiología:
Aumento:
Síndrome nefrótico.
Disminución:
Enfermedades hepáticas parenquimatosas:
o Hepatitis vírica,
o Cirrosis,
o Carcinoma metastásico,
o Congestión hepática de la insuficiencia cardiaca
o Absceso amebiano.
o Sus cifras más bajas son características del acmé de la hepatitis aguda.
o Ya que, en la recuperación, esta enzima vuelve a la normalidad, se puede decir que sus niveles sirven de
evaluación y de pronóstico.
o Es casi siempre baja en la cirrosis con ictericia, ascitis u otras evidencias de insuficiencia
parenquimatosa.
o Su depresión persistente en los cirróticos es de muy mal pronóstico.
Desnutridos con infecciones agudas.
Anemias.
IMA.
Dermatomiositis.
Intoxicación por insecticidas órgano fosforados ya que son inhibidores potentes de esta enzima.
Notas:
En todas estas enfermedades las cifras de CHE están disminuidas en los pacientes que muestran también
disminución de la albúmina sérica; por lo que se ha sugerido que sus niveles bajos indican una síntesis
proteica disminuida por parte del hígado.
Su determinación no se usa mucho como una medida del estado de la función hepática. Tampoco existe
comprobación suficiente de que sea útil en diagnóstico diferencial de las ictericias.
Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y evitar
contactos con piel y mucosas.
Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y evitar
contactos con piel y mucosas.
MAGNESIO
Método: Test colorimétrico Calmagita
Fundamento: El magnesio (Mg2+), forma un complejo de color púrpura al reaccionar con la
Calmagita en medio alcalino. La intensidad del color es proporcional a la concentración de
magnesio.
Composición de reactivos: (concentración inicial)
R1
Aminometilpropanol
EGTA
R2
Calmagita
Estándar Sol de Mg
1 mmo/l
0.21mmol/l
0.30 mmo/l
0.824 mmol/l
Estabilidad: Mezclar a partes iguales los reactivos R1 y R2. Esta solución es estable 24 horas
15-25 °C ó 4 días de 2-8 °C.
Muestra: Suero o plasma heparinizado.
Orina: Diluir la orina (dilución 1:3), 1 ml de muestra con 2 ml de agua destilada acidificada hasta 3,4 con HCl , multiplicar el resultado
por 10 y multiplicar por el volumen de orina en litros. Ofrecer los resultados en mmol /24 h.
Técnica:
Patrón
Muestra
Mezcla
reactiva
Blanco
Patrón
10 µl
1 ml
1 ml
Muestra
10 µl
1 ml
Mezclar e incubar 5 minutos a temperatura ambiente. Leer frente al blanco a 520 nm (500-550)
Coloración estable 30 minutos.
La lipemia y la hemólisis interfieren en la determinación, por lo que es necesario realizar un blanco muestra (BM), sustituyendo el
reactivo por solución salina; reste la absorbancia obtenida (BM) de la de la muestra para realizar los cálculos. El blanco muestra se lee
contra solución salina.
Cálculo:
Absorbancia Muestra
------------------------------- x CP = CM
Absorbancia Patrón
Factor de conversión: mmol/l x 0.25 = mg/dl
Linealidad: Hasta 2.06 mmol/l. Para concentraciones superiores mezclar 0.1 ml (100 l) de
muestra con 0.2 ml (200 l) de cloruro de sodio al 0.9 % y repetir la determinación, multiplicar el
resultado por 3 (dilución 1:3)
Valores de referencia:
Suero: 0.66 – 1.03 mmol/l.
Orina: (H): 2.23 - 4.29 mmol/24h
(M): 2.50 - 4.21 mmol/24h
Notas: Se recomienda utilizar material de plástico desechable o de cristal o plástico pasados por ácido (ac. Nítrico diluido a la
mitad con agua destilada) y luego enjuagados varias veces con agua destilada para evitar contaminaciones. Los detergentes pueden
quelar la reacción e invalidarán la determinación.
No emplear plasmas obtenidos con anticoagulantes que se complejan con el Ca, como EDTA, citrato u oxalato.
Separar el coagulo lo antes posible al obtener el suero, para evitar el trasiego de iones Ca hacia los hematíes.
La lipemia y la hemólisis interfieren en la determinación.
Los reactivos contienen preservativos y otras sustancias que pueden ser dañinos. No ingerirlos y evitar contactos con piel y mucosas.
Usar preferentemente material de un solo uso.
Control de calidad: Todos los sueros control con valores de calcio determinados por este método pueden
ser empleados.
Materiales requeridos:
Pipetas de alta precisión; gradillas para tubos; tubos de 12x75 mm (de cristal o de plástico); cronómetros;
espectrofotómetro con capacidad para medir absorbancias especificadas en la técnica.
Semiología:
Aumento:
Disminución:
FORMULA PARA LA DETERMINACIÓN DE ACTIVIDAD ENZIMÁTICA.
U/l
Δ absorbanci a
1
V
3
10
t
d v
= coeficiente de extinción molar ó cm2 x mol-1
d = trayecto óptico de la cubeta en cm.
V = volumen total.
v = volumen de la muestra.
t = tiempo de medida en minutos.
Abreviaturas:
CP = concentración del patrón.
CM = concentración de la muestra.
PNP = paranitrofenol
Una Unidad Internacional (UI) se define como la cantidad de enzima que cataliza la
transformación de un micromol de sustrato por minuto en condiciones específicas.
1 kat = 60 Unidades (U)
1 U = 16.67 x 10-3 kat
Tabla de conversión de unidades.
De unidades convencionales a unidades internacionales (SI) y viceversa.
CPK
LDH
TGO
TGP
FAL
AMIL
FAC
GGT
CHE
AU
Unidad
convencional
Factor de
conversión
Unidades
SI
U/l
0.0167
60
kat/l
U/l
16.67
0.06
nkat/l
mg/dl
59.5
mol/l
TG
mg/dl
Col
mg/dl
BUN
mg/dl
Glic
mg/dl
Creat
mg/dl
Bil.
mg/dl
PT
g/dl
Alb
g/dl
Ca
mg/dl
P
mg/dl
Lact.
mg/dl
Mg
mg/dl
Hb
g/dl
Hierro
g/dl
0.0168
0.0114
87.5
0.026
38.66
0.167
6.006
0.0555
18.02
88.4
0.0113
17.1
0.0585
10
0.10
10
0.10
0.250
4.01
0.323
3.097
0.111
9.008
0.411
2.431
0.621
1.61
0.179
5.59
mmol/l
mmol/l
mmol/l
mmol/l
mol/l
mol/l
g/l
g/l
mmol/l
mmol/l
mmol/l
mmol/l
mmol/l
mol/l
Selección del procedimiento y equipo de análisis.
Antes de seleccionar un procedimiento de análisis se deben definir las metas de calidad. Sólo
entonces se podrá revisar la literatura técnica y tomar la decisión acerca de qué técnicas
cumplen mejor la meta.
El mismo principio vale para la selección del equipo.
Antes de comprar reactivos, equipos (kits) producidos comercialmente o sistemas de medición,
se debe reunir y revisar toda la información. Las características claves para el proceso de
evaluación están bien definidas en la tarjeta metódica que comprende los siguientes aspectos:
1. Principio del método.
2. Referencias bibliográficas.
3. Material que se va a investigar (suero, plasma, etc.)
4. Recolección y preservación del material problema (condiciones, tiempo).
5. Descripción de la técnica.
6. Blanco: tipos de blancos utilizados.
7. Patrón: preparación de estándares.
8. Evaluación final (longitud de onda, slit, etc.)
9. Preparación de los reactivos, su estabilidad.
10. Cristalería necesaria.
11. Calibración lineal entre ----- y ------ ó curva de calibración.
12. Especificidad, interferencias.
13. Sensibilidad ( = S ).
14. Reproducibilidad: x S (N); % CV o repetibilidad.
15. Exactitud.
16. Valores de referencia.
17. Factores biológicos que causan variación.
18. Tipo de distribución de los valores normales ( Gausiana, log-normal).
19. Consumo de reactivos por muestra, para 100 muestras.
20. Costo por muestra.
21. Tiempo necesario por muestra y en serie.
PROGRAMACIÓN PARA EL PROCEDER ANALÍTICO EN EL HITACHI 705.
PROGRAMA #6
TEST CODE
ASSAY CODE
SAMPLE VOLUME
R1 VOL.
R2 VOL.
WAVELENGHT 1
WAVELENGHT 2
RGT. BLK. ABS.
RGT. BLK. CON.
STD. CONC.
FACTOR
STD.ABS.ALLOWANCE
NORMAL RANGE L
NORMAL RANGE H
ABS. LIMIT (RATE)
CONTROL ID. No.
PROGRAMA #7
CPK (13)
2-22-31
5
180-YES
180-1-YES
376
340
0
0
X-X-1
-1
10%
24
195
10000
X-X-X
13
LDH (26)
2-19-28
5
180-YES
180-2-YES
376
340
0
0
X-X-1
1
10%
80
285
8500
X-X-X
26
TGO (19)
2-19-31
20
400-NO
40-3-YES
376
340
0
0
X-X-1
1
10%
0
31
6000
X-X-X
19
TGP (20)
2-19-31
20
400-NO
40-4-YES
376
340
0
0
X-X-1
1
10%
0
31
6000
X-X-X
20
TEST CODE
ASSAY CODE
SAMPLE VOLUME
R1 VOL.
R2 VOL.
WAVELENGHT 1
WAVELENGHT 2
RGT. BLK. ABS.
RGT. BLK. CON.
STD. CONC.
FACTOR
STD.ABS.ALLOWANCE
ALP (5)
2-19-31
5
180-NO
180-5-YES
660
415
0
0
X-X-1
-1
10%
UA (34)
1
10
400-NO
1-1-NO
600
505
0
0
X-X-1
1
10%
TRIG (33)
1
4
400-NO
1-1-NO
600
505
0
0
X-X-1
1
10%
CHOL (11)
1
4
400-NO
1-1-NO
600
505
0
0
X-X-1
1
10%
NORMAL RANGE L
NORMAL RANGE H
ABS. LIMIT (RATE)
CONTROL ID. No.
PROGRAMA #7
98
279
15000
X-X-X
5
142
416
0
X-X-X
34
TEST CODE
ASSAY CODE
SAMPLE VOLUME
R1 VOL.
R2 VOL.
WAVELENGHT 1
WAVELENGHT 2
RGT. BLK. ABS.
RGT. BLK. CON.
STD. CONC.
FACTOR
STD.ABS.ALLOWANCE
NORMAL RANGE L
NORMAL RANGE H
ABS. LIMIT (RATE)
CONTROL ID. No.
PROGRAMA #7
BUN (8)
1
3
300-NO
300-9-NO
546
600
0
0
X-X-1
1
10%
1.7
8.3
0
X-X-X
8
AMYL (7)
2-5-13
10
350-YES
0-1-NO
660
415
0
0
X-X-1
-1
10%
0
96
15000
X-X-X
7
TEST CODE
ASSAY CODE
SAMPLE VOLUME
R1 VOL.
R2 VOL.
WAVELENGHT 1
WAVELENGHT 2
RGT. BLK. ABS.
RGT. BLK. CON.
STD. CONC.
FACTOR
STD.ABS.ALLOWANCE
NORMAL RANGE L
NORMAL RANGE H
ABS. LIMIT (RATE)
CONTROL ID. No.
D-BIL (15)
1
20
350-NO
100-8-YES
600
546
0
0
X-X-1
1
10%
0
4.3
0
X-X-X
TP (32)
1
10
500-NO
1-1-NO
700
546
0
0
X-X-1
1
10%
67
87
0
X-X-X
0.35
1.71
0
X-X-X
33
3.8
6.7
0
X-X-X
11
CREAT(14) T-BIL (31)
2-19-22
1
20
20
350-NO
350-NO
70-14-NO 100-8-YES
570
600
505
546
0
0
0
0
X-X-1
X-X-1
-1
1
10%
10%
44
0
125
17.1
4500
0
X-X-X
X-X-X
14
31-31
ALB (2)
1
3
500-NO
1-1-NO
700
600
0
0
X-X-1
1
10%
34
52
0
X-X-X
GLU (18)
1
4
400-NO
1-1-NO
600
505
0
0
X-X-1
1
10%
4.22
6.67
0
X-X-X
PROGRAMA #7
TEST CODE
ASSAY CODE
SAMPLE VOLUME
R1 VOL.
R2 VOL.
WAVELENGHT 1
WAVELENGHT 2
RGT. BLK. ABS.
RGT. BLK. CON.
STD. CONC.
FACTOR
STD.ABS.ALLOWANCE
NORMAL RANGE L
NORMAL RANGE H
ABS. LIMIT (RATE)
CONTROL ID. No.
PROGRAMA #7
15
32
2
18
CA (9)
1
7
350-NO
350-15-NO
660
570
PHOS (29)
1
5
500-NO
1-1-NO
376
340
GGT (16)
2-6-14
20
350-NO
0-1-NO
660
415
ACP (1)
2-19-31
20
350-YES
1-1-NO
660
415
X-X-1
1
10
2.02
2.60
0
X-X-X
9–9
X-X-1
1
10
0.80
1.60
0
X-X-X
29
X-X-1
-1
10
11
50
15000
X-X-X
16
X-X-1
-1
10
0
9
15000
X-X-X
1
TEST CODE
ASSAY CODE
SAMPLE VOLUME
R1 VOL.
R2 VOL.
WAVELENGHT 1
WAVELENGHT 2
RGT. BLK. ABS.
RGT. BLK. CON.
STD. CONC.
FACTOR
STD.ABS.ALLOWANCE
NORMAL RANGE L
NORMAL RANGE H
ABS. LIMIT (RATE)
CONTROL ID. No.
PROGRAMA #7
DETERMINACIÓN DE TGO. ( Aspartato – Amino –Transferasa ).
METODO : Reitman y Frankel.
Fundamento :
alfa – cetoglutarato + l – aspartato .
L- glutamato + oxalacetato.
El oxalacetato formado reacciona en solucion alcalina con la 2,4 dinitrofenilhidracina.
el producto de la reaccion se mide fotometricamente entre 500 – 560 nm.
Reactivos :
1. Buffer- sustrato para T.G.O.
2. Reactivo de color ( 2 ,4 dinitrofenilhidracina )
3. Hidroxido de sodio 0,4 mol/ l.
4. Standard de 15 u/l
Técnica :
En tres tubos :
BR
P
M
0.5 ml 0.5 ml 0.5 ml
Buffer- sustrato
0.1 ml
Standard ( 15 ul )
0.1 ml
Agua destilada
Incubar 5 minutos a 37 °C.
0.1 ml
Muestra
Mezclar . Dejar exactamente 30 minutos a 37 0c
0.5 ml 0.5 ml 0.5 ml
Reactivo de color
Mezclar dejar exactamente 20 minutos a
temperatura ambiente
5 ml
5 ml
5 ml
Naoh 0.4 mol/l
Mezclar. Reposar 5 minutos. Leer contra “BR”,
los tubos “P” y “M” con filtro 546 nm.
CIFRAS NORMALES : HASTA 12 U/L.
NOTA: LAS MUESTRAS POR ENCIMA DE 85 U/L DILUIR 0.1 ml DE SUERO + 0.9 ml
DE SOL. SALINA 0.9%
REPETIR LA TÉCNICA Y EL RESULTADO POR 10.
LEER EN TRAMITANCIA Y BUSCAR EN LA CURVA DE CALIBRACIÓN.
DETERMINACIÓN DE ACIDO URICO.
METODO: HENRY SIBEL KING.
FUNDAMENTO: EL FILTRADO DE PROTEINAS SE HACE REACCIONAR CON
FOSFOTUNSTATO ALCALINO, EL CÚAL ES REDUCIDO POR LOS URATOS,
FORMANDO UN COMPLEJO DE COLOR AZUL QUE SE MIDE FOTOMETRICAMENTE
A 620 nm.
REACTIVOS:
1. ACIDO SULFÚRICO 2/3N (0.33)
2. TUNGSTATO DE SODIO 10%
3. ACIDO FOSFOTUNGSTICO
4. CARBONATO DE SODIO 1.32 MOL/L.
FLP
AGUA DESTILADA
SUERO
MUESTRA ( ml)
3.2
0.4
AC. SULFURICO 2/3 N
0.2
TUNGSTATO DE SODIO 10%
0.2
MEZCLAR FUERTE POR AGITACIÓN Y CENTRIFUGAR 5 MINUTOS A 300 R.P.M.
TÉCNICA :
BR
P
M
AGUA DESTILADA
1ml
0.8ml
_
PATRON
_
0.1ml
_
FLP
_
_
1 ml
AC. FOSFOTUNGSTICO
0.3ml
0.3 ml
0.3 ml
CARBONATO DE SODIO 1.32 0.3ml
0.3 ml
0.3 ml
EL PATRON ES EL QUE VIENE EN LA CAJA DE AC. URICO.
MEZCLAR Y REPOSAR 15 MINUTOS. LEER POR T. Y USAR FILTRO 590 nm.
BUSCAR LA CONCENTRACIÓN EN EL DISCO.
VALORES DE REFERENCIA:
MUJER.142-339 mol/l
HOMBRE. 202-416 mol/l