Tema I
ESTRUCTURA DE LAS MOLÉCULAS
ORGÁNICAS
ÍNDICE
1.
Introducción
2.
Los enlaces del carbono.
2.1.
2.2.
2.3.
2.4.
2.5.
2.6.
2.7.
2.8.
3.
La hibridación sp3
La hibridación sp2
La hibridación sp
La molécula de agua.
La molécula de amoníaco
Resumen de hibridación.
Parámetros de enlace.
La molécula de benceno.
Aromaticidad.
Estructuras de Lewis.
3.1.
3.2.
3.3.
3.4.
3.5.
3.6.
Estructuras de Lewis de átomos.
El enlace químico. Estado de
valencia.
Reglas de Lewis.
Violaciones a la regla del octete.
Resumen de las reglas de Lewis.
Ejemplos de estructuras de Lewis de
moléculas.
4.
Efectos electrónicos.
4.1.
Electronegatividad y polaridad de
enlace.
4.2. Momento dipolar y geometría
4.3. Efecto inductivo
a)
Grupos con efecto inductivo
b)
Tipos de efecto inductivo
c)
Fuerza de los ácidos
4.4. Efecto mesómero
a)
Deslocalización electrónica,
b)
resonancia y formas resonantes
Efecto conjugativo o mesómero y
principales casos de conjugación
Grupos con efecto mesómero.
c)
4.5. Efectos electrónicos en compuestos
aromáticos.
1.1. Introducción
1. Introducción
¿Por qué el carbono?
1. Introducción
¿Por qué el carbono?
1. Introducción
Los enlaces del carbono son covalentes.
Los átomos tienen tendencia a adquirir la configuración
electrónica del gas noble mas cercano, a rodearse de un octeto de
electrones.
En el caso del carbono esto es difícil, acumularía mucha carga
El carbono forma enlaces covalentes compartiendo electrones.
El carbono se rodea de un
octeto de electrones
1. Introducción
La vida se construye alrededor del carbono
La corteza terrestre contiene un
0.1 % de carbono …
…pero los compuestos orgánicos
suponen un 95% de los conocidos
El carbono es el elemento clave alrededor del cual
se construye el proceso de la vida misma
1. Introducción
• Las cadenas de carbono son muy estables
El carbono tiene una facilidad única para formar enlaces fuertes con
otros átomos de carbono.
Puede formar cadenas tridimensionales.
Además puede formar enlaces fuertes con otros átomos como H, O, N.
83 kcal/mol
53 kcal/mol
Átomos más grandes,
mayor distancia de
enlace
40 kcal/mol
Repulsión de pares
electrónicos
no
enlazados
Energía de enlace
34 kcal/mol.
Repulsión de 2x pares
electrónicos
no
enlazados
2. Los enlaces del carbono
2. Los enlaces del carbono
2.1.
La hibridación sp3
2. Los enlaces del carbono
sp3
sp3
109°280
2 py
2s
Combinación lineal
2px
sp3
sp3
2 pz
4 OA
4 OA sp3
H
H
sp3
H
sp3
C
sp3
sp3
H
H
H
CH4
H
H
2. Los enlaces del carbono
La molécula de etano
2. Los enlaces del carbono
Enlace σ sp3 - sp3 según la TOM.
2. Los enlaces del carbono
2.2. La hibridación sp2
2. Los enlaces del carbono
La molécula de etileno
Combinación lineal
sp2
sp2
2 py
2s
2px
sp2
2 pz
p
4 OA
Axial
Axial
LATERAL
H
H
sp2
sp2
Axial
p
p
H
H
Axial
C
sp2
sp2
Axial
H
sp2
sp2
H
3 OA sp2 + 1 OA p
H
C
C2H4
H
La presencia del enlace explica la planariedad de la molécula.
2. Los enlaces del carbono
La molécula de etileno. El enlace π.
2. Los enlaces del carbono
•
Enlace π
2. Los enlaces del carbono
2.3.
La hibridación sp.
2. Los enlaces del carbono
Acetileno : C2H2
p
Combinación lineal
2 py
2s
sp
sp
p
2px
2 pz
4 OA
2 OA sp + 2 OA p
LATERAL
p
H
sp
p
p
sp
p
sp
sp
p
LATERAL
H
H
s
C
s
p
C2H2
C
s
H
2. Los enlaces del carbono
2. Los enlaces del carbono
2.4.
La molécula de agua
2. Los enlaces del carbono
2.5.
La molécula de amoníaco.
2. Los enlaces del carbono
Hibridación sp2.
Nitrógeno
Oxígeno
Estructura
Tipo
Iminas
Carbonilos
Geometría
Trigonal plana
Trigonal plana
Hibridación sp.
Estructura
Hibridación sp.
Tipo
Nitrilos
Geometría
Lineal
2. Los enlaces del carbono
2.6. Resumen de hibridación.
2. Los enlaces del carbono
2.7. Parámetros de enlace
Ángulos de enlace
Enlace
Longitud
típica (Å)
Momento
dipolar
(D)
Energía de
disociación
(kcal/mol)
C-H
1.07
0.40
99
X-H
1.01(N)
0.96(O)
1.31(N)
1.51(O)
93(N)
111(O)
C-C
1.54
0
83
C=C
1.33
0
146
C≡C
1.20
0
200
C-N
1.47
0.22
73
C=N
1.30
1.90
147
C≡N
1.16
3.50
213
C-O
1.43
0.74
86
C=O
1.23
2.30
184
C-Cl
1.78
1.46
81
C-Br
1.93
1.38
68
C-I
2.14
1.19
51
2. Los enlaces del carbono
2.8. La molécula de benceno. Aromaticidad.
H
H
C
H
H
H
C
C
H
C
C
C
H
C
C
H
C
C
H
C
H
C
H
H
El benceno es una molécula muy importante de estructura tan
característica que sirve para clasificar todos los compuestos
orgánicos en dos grandes grupos. Los que tienen esta estructura y
los que no la tienen.
En el benceno los seis enlaces del anillo son idénticos y con una
gran deslocalización electrónica lo que proporciona una gran
estabilidad a la molécula, conocida como aromaticidad.
2. Los enlaces del carbono
2.8. La molécula de benceno. Aromaticidad.
Regla de Hückel: Cuando el número de electrones π
deslocalizados que forman el sistema cíclico plano es igual a 4n+2
el sistema es aromático. Siendo n cualquier número entero: 0, 1, 2,
3, etc.
6 electrones π
deslocalizados n=1
N
N
N
N
N
Píridina
N
H
O
Furano
N
H
Pirrol
N
H
Imidazol
H
H
H
H
H
6 electrones π
deslocalizados n=1
[18] Anuleno
18 electrones π
deslocalizados
n=4
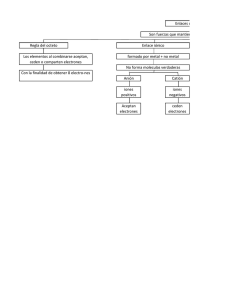
3. Estructuras de Lewis
3. Estructuras de Lewis
Los enlaces covalentes se forman por una coparticipación de
los electrones de valencia entre dos elementos que poseen
afinidades electrónicas similares. Cada elemento debe
satisfacer la regla del octeto.
H
1s1
+
+
H
1s1
H2
El mismo razonamiento se
aplica a Li2 ,O2 a F2
s2
H + H H H H--H
F: 2s2 2p5
F: 2s2 2p5
F
F
F
F
3. Estructuras de Lewis
3.1.
Estructuras de Lewis de los átomos.
Ne Ar : ns2 np6
F Cl : ns2 np5
O
S : ns2 np4
N
P : ns2 np3
C
Si : ns2 np2
B
Al
:
ns2 np1
Be Mg : ns2
H Li Na : ns1
3. Estructuras de Lewis
3.2. El enlace químico. Estado de valencia.
F
H
HF
O
F
H
O
H
H 2O
F
O
H
NH3
N
H
H
H
H
N
H
H
H
N
H
H
3. Estructuras de Lewis
3.2. El enlace químico. Estado de valencia.
Las reglas precedentes sugieren la forma molecular CH2
Esta molécula existe pero es inestable. La forma más estable es
CH4. Sugiere la disponibilidad de cuatro electrones no apareados.
Estado de valencia excitado
C
ns1 np3
3. Estructuras de Lewis
3.3. Reglas de Lewis
1.
Se elige el átomo central
NUNCA H. Generalmente es
el menos electronegativo.
2. Se cuentan los e- de valencia.
3. Se forman enlaces entre el
átomo
central
y
los
periféricos.
4. Los e- restantes se sitúan
como pares solitarios para
completar los octetes.
•
Amoníaco
N es central.
2. e- de valencia =
(4 pares)
1.
3.
4.
5+3x1= 8
3. Estructuras de Lewis
Ejemplos de estructuras de Lewis
•
Dióxido de Carbono, CO2
1.
2.
3.
C es central
e- de valencia =
4+2x6 = 16 (8 pares)
o
c
o
4.
o
c
o
Enlaces múltiples:
La estructura del CO2 no
cumple la regla del octeto,
a no ser que…
5.
6.
o
c
o
o
c
o
¿Cómo es el CN-?
3. Estructuras de Lewis
Carga formal = nº de e- no enlazantes – ½ e- enlazantes
Ión Sulfito, SO32-
•
1.
2.
S es central.
e- de valencia =
6+3x6+2=26 (13 pares)
3.
O
S
Cargas formales
•
Cada átomo tiene “en
propiedad” la mitad de los
e- compartidos y la
totalidad de sus pares
solitarios
O
S: tiene 6/2+2=5
Debería tener 6
O
O
4y5
O
S
S
O
O
O
O
+1
O: tiene 2/2+2=7
Debería tener 6
-1
3. Estructuras de Lewis
Dióxido de azufre, SO2
•
S es central
2. e- de valencia =
6+2x6=18 (9 pares)
1.
3.
O
S
S
Resonancia:
Para completar el
octete….
O
S
O
O
S
O
O S
O
O S
O
O
4.
O
•
O
Las dos estructuras son
equivalentes. La estructura
real es un híbrido de
resonancia entre las dos.
3. Estructuras de Lewis
3.4. Violaciones a la regla del octete
H
H C
H
1.
Especies con un número impar de electrones.
2.
Algunos compuestos que contienen elementos del segundo período
deficientes en electrones de valencia.
Trifluoruro de boro , BF3
1. B es central
2. e- de valencia= 3+3x7=24 e- (12 pares)
F
3.
F
B
4.
B
O
Separación de cargas
Los elementos electronegativos no
deben quedar con cargas formales
positivas y viceversa.
F
F
F
F
N
F
F
B
F
El boro es a menudo
deficiente en electrones
3. Estructuras de Lewis
3. Compuestos que contienen elementos del tercer periodo o
superiores.
Ión Sulfato, SO421. S es central
2. e- de valencia=
6+4x6=32 e- (16 pares)
Elementos con orbitales nd
Las estructuras de Lewis deben escribirse
con la menor separación de carga posible. Solo los
elementos del tercer periodo o superiores
admiten más de cuatro pares de e- a su alrededor.
O
o
3.
O
S
o
O
O
O
4.
2
O
S
O
O
o
S
o
o
o
S
o
o
o
S
o
o
o
o
o
o
S
o
o
o
S
o
o
o
S
o
o
o
3. Estructuras de Lewis
3.5. Resumen de las reglas de Lewis
Cuenta los electrones de valencia (no olvidar las cargas si se trata de
un ión molecular).
Número de pares de electrones: (electrones de valencia /2)
Sitúa como átomo central el menos electronegativo. ¡Nunca H!
Une los átomos con pares de electrones enlazantes (PE)
Completa los octetos agregando pares de electrones solitarios (PS) a
los átomos.
Establece enlaces múltiples con los átomos que queden con su octeto
incompleto
Asigna cargas formales: CF=Z- (#PE/2) – (#PS)
Elige las estructuras con la menor separación de carga posible
(recuerda que los átomos del 3er período en adelante admiten más de
cuatro pares a su alrededor).
Indica si hay estructuras equivalentes en resonancia.
3. Estructuras de Lewis
3.6. Ejemplos de estructuras de Lewis de moléculas
4. Efectos electrónicos
4. Efectos electrónicos
4.1.
Electronegatividad y polaridad de enlace.
4. Efectos electrónicos
Electronegatividad
4. Efectos electrónicos
Comparación de las polaridades de enlaces C-Cl y C-Li
4. Efectos electrónicos
•
Polaridad de enlace:
4. Efectos electrónicos
4.2. Momento dipolar y geometría
4. Efectos electrónicos
•
Acetona y acetonitrilo:
4. Efectos electrónicos
4.3. Efecto inductivo
El desplazamiento de la densidad electrónica de los enlaces σ
de una molécula orgánica como consecuencia de la diferencia
de electronegatividad de los átomos enlazados.
En el ejemplo, el átomo de Cl atrae hacia sí el par de e- del enlace con el
C. Aparece una carga parcial negativa, δ-, sobre Cl y una carga parcial
positiva, δ+, sobre el C.
Este C a su vez retira carga del C contiguo en menor medida.
El efecto disminuye rápidamente con la distancia, de modo que no es
perceptible a distancia de mas de 3 C.
El efecto inductivo afecta solo al esqueleto σ, no afecta a los orbitales π
4. Efectos electrónicos
a) Grupos con efecto inductivo:
Atractor (-I)
Dador (+I)
• O- , CO2• CH2R , CH3 , D
•
•
•
•
•
•
NR3 , CO2H , COR
SR2+ , F , SH
NH3+ , Cl , SR
NO2 , Br , OH
SO2R , I , NH2
CN , CO2R , OR
Veremos que este efecto tiene una importancia notable en la reactividad química.
4. Efectos electrónicos
b) Tipos de efecto inductivo:
Efecto inductivo positivo (+I) Efecto inductivo negativo (-I)
Lo ejerce un sustituyente que:
Cede los electrones de un enlace σ con
mayor intensidad que el hidrógeno (es
más electropositivo que éste).
Lo ejerce un sustituyente que atrae
hacia si los electrones de un enlace σ
con más intensidad que el hidrógeno
(por ser más electronegativo que éste).
O produce un efecto de hiperconjugación
(radicales alquilo).
CH 3
CH 3
H2
C
CH 3
CH3
C
H
C
CH 3
CH 3
-F / -Cl / -Br / -I /-OCH3
-NR2 / -NR3/
-CN / -COR / -COOR / -CF3
CH3
4. Efectos electrónicos
c) La fuerza de los ácidos:
Para comparar la fuerza de los ácidos, se observa la fuerza de
la base conjugada y particularmente la densidad electrónica
del oxigeno. Cuando la densidad es alta la base es fuerte y por
lo tanto el ácido conjugado es débil.
Ácido
Base
pKa
3.77
4.76
4.86
4. Efectos electrónicos
Para los grupos atractores de electrones tenemos: (NO2>F>Cl>Br>I).
Esto significa que Br es más atrayente de electrones que I y por lo
tanto para las bases conjugadas, la densidad electrónica sobre el
oxígeno será más importante en el caso de I que en el caso Br, lo que
explica los pKa de sus ácidos respectivos.
Ácido
Electronegatividad de X = {I,Br,Cl,F }
pKa
2.5
3.17
2.8
2.87
3.0
2.85
4.0
2.66
4. Efectos electrónicos
El efecto inductivo se debilita a partir del tercero o el cuarto
enlace. Un átomo o un grupo de átomos (aquí COOH) es
capaz de sentir el efecto inductivo de otro átomo (cloro en este
caso), si este no está en una posición muy lejana.
Ácido
pKa
4.90
2.87
4.06
4.82
4. Efectos electrónicos
4.4. Efecto mesómero
a) Deslocalización electrónica, resonancia y formas resonantes
Formas resonantes
Híbridos de
resonancia
Reglas para dibujar formas resonantes:
Todas las formas resonantes deben de ser estructuras de Lewis
válidas
Solo se mueven electrones π y pares de electrones no enlazantes
Entre las formas resonantes sólo cambia la posición de los
electrones
4. Efectos electrónicos
Estabilidad de formas resonantes:
Dado que las formas conjugadas son diferentes, una tendrá la
descripción de la realidad, aunque ninguna es la correcta. Hay
criterios que permiten la determinación de la estabilidad relativa de
tales estructuras:
Primer criterio: las estructuras que presentan un nombre
máximo de octeto son las preferidas.
Segundo criterio: las cargas deberían situarse de preferencia
sobre los átomos más electronegativos.
Tercer criterio: las estructuras preferidas donde las cuales la
separación de cargas de signos opuestos es la mínima y/o la
separación de cargas del mismo signo es la máxima. (Es una
consecuencia de la ley de Coulomb: Hace falta energía para separar dos cargas de
signos opuestos).
4. Efectos electrónicos
Estabilidad relativa de estructuras resonantes.
4. Efectos electrónicos
b) Efecto conjugativo o mesómero y principales casos de
conjugación.
Alternación enlace simple – enlace doble.
A
B
C
A
D
B
C
Participación de un par libre
A
B
C
A
B
C
D
4. Efectos electrónicos
Participación de una caja cuántica vacía.
A
B
C
A
B
C
Radicales electrones solitarios.
A
B
C
A
B
C
4. Efectos electrónicos
c)
Grupos con efecto mesómero
Deslocalización electrónica debida a la movilidad de los electrones de
los enlaces π.
Los electrones de un enlace π y los electrones no enlazados forman una nube
capaz de desplazarse a lo largo de la cadena
Efecto mesómero negativo (-M)
El sustituyente retira electrones π
de la cadena a la que está unido.
Efecto mesómero positivo (+M)
El sustituyente cede electrones π a
la cadena a la que está unido.
-X -NH2 -OR -OH
-CHO –COOR -COOH –CN –NO2
- M creciente
+ M creciente
El efecto mesómero se transmite sin debilitarse a lo largo de toda la conjugación
4. Efectos electrónicos
c)
Grupos con efecto mesómero
Dador (+M)
• O- , S- , NR2
• NHR , NH2 ,
NHCOR
• OR , OH , OCOR
• SR , SH , Br
• I , Cl , F
• R
Atractivo (-M)
•
•
•
•
NO2 , CHO , CN
COR , CO2H , SO2R
CO2R , SO2OR , CONH2
NO , CONHR , Ar ,
CONR2
4. Efectos electrónicos
La escritura de las formas conjugadas permite entender donde
actuarán un electrófilo o un nucleófilo.
Un nucleófilo, especie rica en electrones, actuará en las posiciones
deficientes en electrones.
H
H
C
H
C
C
C
H
H
O
C
H
H
H
H
C
C
C
C
H
H
O
C
H
H
H
H
C
C
C
C
H
H
O
C
H
H
H
H
C
C
C
C
H
H
O
C
H
La escritura de las formas límites del benceno permite entender la
regioselectividad cuando haya sustituyentes aromáticos.
4. Efectos electrónicos
4.5.
Efectos electrónicos en compuestos aromáticos
El efecto inductivo atractor o dador (-I y +I) se transmite por
medio de enlaces σ mientras que el efecto conjugativo atractor o
dador (-M y +M) se transmite por medio de los enlaces π y los
pares no enlazantes n.
H
H
Benceno
C
H
H
H
C
C
H
C
C
C
H
C
C
C
H
C
C
H
C
H
H
Anilina
H