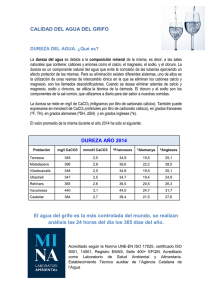
Universidad Iberoamericana León Química General Aplicada “Proyecto Parcial 2” David Caballero Paola Henaine Eduardo Mata Serrano Nicole Flores Dureza del agua. Paola Henaine Eduardo Serrano Nicole Flores Se le denomina dureza del agua a la concentración de compuestos minerales que hay en una determinada cantidad de agua, el grado de dureza es directamente proporcional a la concentración de sales alcalinas y es importante a la hora de calificar la calidad de un agua. El agua denominada comúnmente como “dura” tiene una elevada concentración de dichas sales y el agua “blanda” las contiene en muy poca cantidad. Por lo general la dureza del agua es causada por la presencia de iones calcio (Ca2+) y magnesio (Mg2+) disueltos en el agua. Otros cationes como el aluminio (Al3+) y el fierro (Fe3+), también pueden contribuir a la dureza, sin embargo, su presencia es menos crítica. Dureza (M) = [Ca2+] + [Mg2+] La forma de dureza más común y problemática es la causada por la presencia de bicarbonato de sodio (Ca(HCO3)2). El agua la adquiere cuando la lluvia pasa por piedra caliza (CaCO3). Cuando el agua de lluvia cae, disuelve dióxido de carbono (CO2) del aire y forma ácido carbónico (H2CO3), por lo que se acidifica ligeramente: CO2 (g) + H2O (l) = H2CO3 (ac) Por lo tanto, el agua de lluvia toma iones calcio Ca2+ y iones bicarbonato HCO3 y se vuelve dura. Cuando el agua dura se calienta, las dos reacciones anteriores se revierten y se forma carbonato de calcio, agua y dióxido de carbono: Ca2+ (ac) + 2HCO3 El carbonato de calcio (CaCO3) es mucho menos soluble en agua que el bicarbonato de calcio (Ca(HCO3)2) y es por esto que se forma un sólido conocido como sarro, incrustaciones o incrustaciones de calcio. Como este tipo de dureza es fácil de remover se le conoce como dureza temporal. Dureza mg/L como CaCO3 Moderada 60-120 Dura 120-180 Muy dura Más de 180 El agua, generalmente, es dura en las regiones en las cuales, su subsuelo contiene calcio y yeso y es blanda en las montañas primitivas conformadas de rocas de granito, gneis y esquisto. El agua de la lluvia es blanda. La unidad de medida de la dureza se puede medir en diferentes unidades como: Mg/l de Calcio, Mg/l de Magnesio, Mg/l de CaCO3, Ppm de CaCO3, ºdH (Grados Alemanes), ºeH (Grados Ingleses o Clark), Mmol/l, Mval/l (eq/l), aunque, lo ideal es hacer la conversión a grados franceses (hFº)., ya que, es la unidad por excelencia más utilizada en el sector de los tratamientos de agua. Esta unidad nos indica la cantidad de cal y magnesio que tiene el agua. Por ejemplo: 1 grado alemán (°dH), equivale a 1,78ºhF. Es decir, si tenemos 36 ºdH y lo multiplicamos por 1,78ºhF, obtendremos un resultado de 64ºhF. Un grado alemán de dureza significa: 1 gramo de CaO disuelto en 100 l de agua. Las concentraciones de calcio y magnesio existentes (mg) por cada litro de agua; puede ser expresado en concentraciones de CaCO3. El agua dura puede causar distintos problemas, como: El uso de detergentes, ya que con la dureza del agua se evita la formación de espuma debido a la presencia de sales insolubles y se debe usar más jabón. El jabón hecho a base de grasa animal puede reaccionar con el ion calcio Ca2+ y magnesio Mg2+ formando un precipitado que puede irritar la piel y arruinar la ropa. Algunos alimentos, particularmente los frijoles y los chíncharos, cuando son cocidos con agua dura se endurecen. El sarro puede tapar tuberías y conexiones. Además de hacer menos eficiente hasta en un 90% los elementos de calefacción con una capa de 25mm de carbonato de calcio (CaCO3) El agua, es una sustancia ampliamente utilizada en la industria, desempeñando diversas funciones como: la producción de energía de vaporización, trasferencia de calor, transporte de materias primas, fabricación de productos, lavado, entre otras. Por tal motivo ésta tiene que someterse a una serie de procesos que la acondicionen ya que, en la industria, de igual manera, las aguas duras presentan grandes inconvenientes, principalmente en equipos donde la temperatura del agua es alta y se producen incrustaciones, provocando una menor eficiencia debido a la reducción de la conductividad térmica y con ello, un mayor consumo de energía. Aunque, existen posibles métodos para eliminar la dureza del agua y se tienen que llevar a cabo diferentes procesos químicos: 1) El ablandamiento del agua Es un proceso importante porque la dureza del agua en las casas y en las compañías es disminuido durante este proceso y puede prevenir los efectos negativos. El agua dura causa un alto riesgo de depósitos de cal en los sistemas de agua de los usuarios. Debido a la deposición de la cal, las tuberías se bloquean y la eficiencia de las calderas y los tanques se reduce Existen tres maneras básicas para ablandar el agua: 1. Forzar la precipitación de las sustancias insolubles, como el CaCO3 y el Mg(OH)2, antes que entren al sistema de agua. 2. Remover los iones de Ca2+ y Mg2+ del agua. 3. Evitar que los iones de calcio y del carbonato de calcio se precipiten por medio de la formación de complejos. B) Intercambio Catiónico Este método es más común para sistemas domésticos y es un método de ablandamiento total porque remueve toda la dureza del agua. Este proceso sustituye los iones calcio Ca2+ y magnesio Mg2+ por otros iones que no contribuyen a la dureza como lo son el ion sodio Na+ y el ion potasio K+. Se debe hacer fluir el agua por un contenedor lleno de una resina que contenga los iones sodio y potasio. Los iones en la resina son intercambiados por los iones causantes de la dureza del agua. Una vez que todos los iones de la resina han sido intercambiados, la resina ya no puede remover más iones calcio Ca2+ y magnesio Mg2+ hasta que esta se regenere usando cloruro de sodio NaCl o cloruro de potasio KCl. C) Formación de Complejos Otro de los métodos usados en los ablandadores domésticos de agua es la adición de polifosfatos (que contengan el ion P6O18) al agua. Estos iones rodean los iones calcio Ca2+ disueltos y evitan que estos se precipiten como carbonato de calcio CaCO3. Fuentes de consulta: Central del Agua - Conversión de Unidades de Dureza.. (s.f.). Recuperado 21 octubre, 2019, de https://www.centraldelagua.com/informaci%C3%B3n/conversi%C3%B3n-unidades-dureza/ Una Introducción a la Dureza del Agua. (s.f.). Recuperado 21 octubre, 2019, de https://www.itacanet.org/esp/agua/Seccion%206%20Tratamiento%20de%20agua/durezaagua/Agua %20dura.pdf Ambientum. (2018, 11 abril). Dureza de las aguas - Enciclopedia Medioambiental. Recuperado 21 octubre, 2019, de https://www.ambientum.com/enciclopedia_medioambiental/aguas/dureza_de_aguas.asp La dureza del agua. (2018, 12 febrero). Recuperado 21 octubre, 2019, de https://www.facsa.com/ladureza-del-agua/ FAQ-ablandamiento-agua. (s.f.). Recuperado 21 octubre, 2019, de https://www.lenntech.es/procesos/ablandamiento/preguntas-mas-frecuentes/faq-ablandamientoagua.htm Dureza del agua: definición, eliminación y laboratorio | Quimitube. (s.f.). Recuperado 21 octubre, 2019, de http://www.quimitube.com/dureza-del-agua