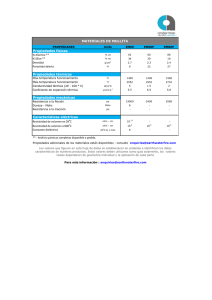
UNIVERSIDAD NACIONAL AUTONOMA DE MÉXICO MATERIALES NO METÁLICOS GRUPO: 01 SEGUNDO TRABAJO: “CERÁMICOS TRADICIONALES” NOMBRE DEL PROFESOR: RAMÍREZ DÍAZ EDGAR I. M.I. NOMBRE DE LOS ALUMNOS: CAJAL AVIÑA, ARTURO CHÁVEZ REAL, SANTIAGO GÓMEZ CAMARGO, RODRIGO LUNA CONTRERAS, ALFREDO SANTIBÁÑEZ OLIVAS, DIEGO DARÍO SILVA GALINDO, JOSÉ LUIS FECHA DE ENTREGA: 11/09/13 Sílice 𝑆𝑖𝑂2 El sílice tiene diferentes fases que tienen la misma composición estequiométrica pero diferente estructura cristalina. Se dividen en Cristobalita (Cristobalite), Tridimita (Tridymite) y Cuarzo (Quartz), las cuales se pueden apreciar en la siguiente gráfica. -Cristobalita La cristobalita es una modificación del cuarzo a altas temperaturas, pero a diferencia de éste, la cristobalita se genera rara vez en la naturaleza. Por esta razón la cristobalita para uso industrial es manufacturado sintéticamente sometiendo cuarzo puro a temperaturas aproximadas a 1500 [ºC] en un horno rotatorio. La calcinación hace que los granos se unan, tienen un alto 𝑔 grado de blancura y una reducción en su densidad al 2.35 [𝑐𝑚3 ] . La cristobalita es químicamente inerte. Utilizando una combinación de molinos libres de hierro y tecnologías ópticas, se puede crear polvo de cristobalita altamente refinada con partículas de 1 [𝜇𝑚] de tamaño. Naturalmente se puede extraer del Cerro San crisóbal, cerca de Pachuca, Hidalgo y en la mina de Santín, en Guanajuato. También existen minas de este material en Estados Unidos, Nueva Zelanda y Japón. Tiene una estructura cristalina tetragonal con un número de coordinación 4. Propiedades Tiene una dureza de 6.5 (Mohs) 𝑔 Una baja densidad de 2.33[𝑐𝑚3 ] Alta resistencia química Aplicaciones Manufacturar aislantes Filtros Materiales refractores -Tridimita La tridimita es un mineral de sílice, que es usado comunmente en análisis científicos. Los cristales de este raro y único mineral son microscópicos y muy delgados, los más ragos llegan a medir 1 [cm]. Su estructura cristalina es triclínica con número de coordinación 4 Propiedades Tiene una dureza de 7 (Mohs) Abrasivo 𝑔 Densidad de 2.35[𝑐𝑚3 ] Aplicaciones Usado como aerogel utilizado en el trasnbordador espacial Stardust para la recolección de partículas extraterrestres Facilita el flujo de polvos para productos farmacéuticos Pasta dental por ser un fuerte abrasivo Recolector de ADN y ARN Cosméticos Material refractario -Cuarzo El cuarzo es un mineral en forma de roca muy importante y puede ser encontrado en piedras sedimentarias, metamorfas y magmáticas. Gradnes depósitos de cuarzo son importantes en las aplicaciones industriales. Es procesado y refinado a partir del material crudo, sometiéndolo a un lavado complejo, separación, secado y pasandolo por un molino para producir arena fina. Para manufacturar harina de cuarzo y polvos finos con tamaños específicos de las partículas requieren de más procesos de separación. Tiene una estructura cristalina hexagonal Propiedades Dureza de 7 (Mohs) 𝑔 Densidad de 2.65[𝑐𝑚3 ] Alta resistencia química Baja expansión térmica Conductividad térmica relativamente buena Buenas propiedades eléctricas Aplicaciones Se usa como abrasivo en la producción de piedra, arcilla y vidrio Fundición Cubiertas anticorrosivas Piedras ingenieríles El caolín o caolinita, es una arcilla blanca muy pura que se utiliza para la fabricación de porcelanas y de refractarios. También es utilizada en ciertos medicamentos y como agente adsorbente y de aprestos para almidonar. Cuando la materia no es muy pura, se utiliza en fabricación de papel. Conserva su color blanco durante la cocción. Su fórmula es Al2Si2O5(OH)4 ó Al2O32SiO22H2O (disilicato alumínico dihidratado) Composición: Silicato de aluminio hidratado formado por la descomposición de feldespato y otros silicatos de aluminio. Esta descomposición se debe a los efectos prolongados de la erosión, y por la meteorización de los feldespatos las Micas y otros alumosilicatos (roca madre). Su fórmula general es Al4(OH)8Si4O10. Conserva su color blanco durante la cocción, al cono seger 14 - 15 (1.420°C) tiene una contracción del 14 al 18 %, Peso Molecular: 270.41. Punto de fusión al 1.770°C. Su gravedad específica es de 2.62 Está formado por pequeñas capas hexagonales de superficie plana. En su estructura cristalina se distinguen dos láminas, una formada por tetraedros, en cuyos vértices se situarían los átomos de oxígeno y el centro estaría ocupado por el átomo de silicio, y otra formada por octaedros, en cuyos vértices se situarían los átomos del grupo hidróxido y el oxígeno, y en el centro el átomo de aluminio 1. Analisis de porcentaje 46.62 % SiO2 37.71 % Al2O3 0.40 % K2O 0.16 % MgO 0.25 % CaO 0.18 % P2O5 0.51 % Fe2O3 0.36 % TiO2 13.80 % L.O.I. Fases: 1. a los 450°C pasa de caolinita a metacaolín, con una pérdida de peso del 14%. 2. a 950°C aparece la fase con estructura de espinela 3. a 1050°C en mullita y cristobalita 4. a 1350°C presenta ya una composición de un 30 % de mullita, 15 % critobalita y un 55% de fase vítrea.[3] En general estos cambios de fase conllevan una contracción del producto, que es un poco menor en el caso de que esté realizado a una presión elevada. Usos: Papel: Como carga y recubrimiento del papel. En el acabado de papel de arte y tapiz y en papel corrugado. Reduce la porosidad y da suavidad y brillo a la superficie. Refractarios: En la elaboración de perfiles, bloques y ladrillos refractarios, así como en ladrillos de alta alúmina. En la elaboración de cemento refractario y resistente a los ácidos. En cajas de arcilla refractaria para cocer alfarería fina. Cerámica: En la fabricación de sanitarios, comedores, porcelana eléctrica y tejas de alto grado, vajillas, objetos de baño, refractarios y cajas de arcilla refractaria para cocer alfarería fina. El metacaolín es un material cementante suplementario, dado que es un aluminosilicato activado térmicamente, que se produce al calcinar el caolín a temperaturas aproximadas a 550ºC, produciéndose una transformación de su estructura cristalina. La aplicación del metacaolín o MK permite el refinamiento de poros. Según un estudio de Khatib, Sabir y Wild que analizaron el volumen y tamaño de poros en pastas con cemento portland adicionadas con MK (0,5, 10 y 15%) encontraron que el tamaño de poro disminuye, pero el volumen de poros totales se incrementa. Formado del Metacaolín: Metacaolinita Al2Si2O7 , mineral de arcilla no contiene cationes interlaminares o agua entre capas. La temperatura de deshidroxilación depende de la capa estructural orden de apilamiento. Dehydroxylates caolinita desordenadas entre 530 y 570 C, ordenó caolinita entre 570 y 630 C. Caolinita desordenada deshidroxilada muestra mayor actividad puzolánica que ordenó. La deshidroxilación del caolín en metacaolín es un proceso endotérmico debido a la gran cantidad de energía requerida para eliminar los iones hidroxilo unidos químicamente. Por encima del rango de temperatura de deshidroxilación, caolinita se transforma en metacaolín, una estructura amorfa complejo que conserva algo de orden de largo alcance debido a la capa de apilamiento. Gran parte del aluminio de la capa octaédrica tenga mejor coordinación tetraédrica y pentahedrally.coordinated. Con el fin de producir una puzolana (material cementoso suplementario) deshidroxilación casi completa debe ser alcanzado sin riesgo de sobrecalentamiento, es decir, a fondo tostado pero no quemados. Esto produce un estado amorfo, altamente puzolánico, mientras que el sobrecalentamiento puede provocar la sinterización, para formar un punto muerto quemado, no reactivo refractario, que contiene mullita y un defecto de Al-Si espinela. Temperaturas de activación óptimos reportados varían entre 550 y 850 C de duración variable, sin embargo, el rango de 650-750 C es más comúnmente citado. En comparación con otros minerales de arcilla caolinita muestra un amplio intervalo de temperaturas entre deshidroxilación y recristalización, mucho favoreciendo la formación de metacaolín y el uso de arcillas de caolín activados térmicamente como puzolanas. También, debido a que la capa octaédrica se expone directamente a la capa intermedia (en comparación con, por ejemplo, TOT minerales de arcilla tales como esmectitas), desorden estructural se logra más fácilmente tras el calentamiento. Ventajas: aumento de resistencias a la compresión y flexión Permeabilidad reducida (incluyendo la permeabilidad a cloruros) Reducido potencial de formación, que se produce cuando el calcio es transportado por el agua a la superficie donde se combina con el dióxido de carbono de la atmósfera para hacer carbonato de calcio, que se precipita sobre la superficie como un residuo blanco. Aumento de la resistencia al ataque químico Aumento de efectos durabilidad reducida de álcali-sílice reactividad (ASR) trabajabilidad mejorada y acabado de hormigón encogimiento reducido, debido a la "empaquetamiento de las partículas" hacer más densa de hormigón de color mejorada por aclarar el color del hormigón por lo que es posible tinte más ligero integrante color. Usos: Concreto de alto rendimiento, alta dureza y de peso ligero. Prefabricados y derramó el molde de concreto, Fibrocemento y ferrocemento Productos de fibra de vidrio de hormigón armado Mostradores, esculturas Mortero y stucco Mullita Mullita General Categoría Minerales nesosilicatos Clase 9.AF.20 (Strunz) Fórmula química Al4+2xSi2-2xO10-x (x~0.4) Propiedades físicas Color Incoloro, blanco, amarillo, rosa, rojo o gris Raya Blanca Lustre Vítreo Transparencia Transparente a translúcido Sistema cristalino Ortorrómbico, dipiramidal Hábito cristalino Cristal prismático a acicular, alargado Dureza 6 - 7 (Mohs) Densidad 3,17 Pleocroísmo Visible, incoloro a rosa Solubilidad Insoluble en ácidos (La mullita o porcelainita es un mineral de la clase de los nesosilicatos. Fue descubierta en 1924 en la isla de Mull de la región de Argyll, en Escocia (Reino Unido), siendo nombrada así por el nombre de esta isla.) I. —Introducción. La influencia de la mullita en las propiedades físicas de los materiales cerámicos es tan grande que, desde los comienzos de los estudios verdaderamente científicos y sistemáticos en este campo de la ciencia, el conocimiento de cuanto a este compuesto se refiere, ha constituido y constituye hoy día una de las mayores preocupaciones de los ceramistas conscientes. Prueba de ello son los numerosos trabajos científicos y técnicos que sobre este tema y sus afines, se realizan actualmente en el mundo entero. La mullita es muy poco frecuente en la naturaleza. El yacimiento más importante se encuentra en la isla de Mull, en la parte oeste de Escocia, donde se ha formado, en opinión de los geólogos, en condiciones de presión y temperatura muy semejante a las que son necesarias para obtenerla artificialmente. La mullita es sin embargo muy frecuente en los productos artificiales tales como porcelana, productos a base de fire-clay, refractarios de alto contenido en alúmina, etc. Todos los silicatos de aluminio, hidrosilicatos de aluminio, o mezclas de geles de alúmina y de sílice se transforman en mullita a temperatura elevada. Entre los silicatos alumínicos existen tres compuestos que se encuentran en la naturaleza y forman mineralógicamente el ''grupo de la silimanita'\ Estos minerales son la silimanita, la andalucita y la distena o cianita. Todos ellos, a temperatura elevada, producen mullita y un líquido silíceo. Es interesante hacer notar, con Sosman, que la transformación es monótropa. Se verifica en un solo sentido, es decir, que una vez producida la transformación en mullita, ésta no se recombina de nuevo con el líquido resultante volviendo a producir un mineral del grupo de la silimanita. Este hecho es de gran transcendencia en cuanto a los materiales refractarios se refiere. Por tanto, un procedimiento de obtención de mullita es el de calcinación de estos productos naturales a una temperatura adecuada, durante un tiempo determinado. Características químicas (Es un silicato de aluminio del tipo nesosilicato, anhidro. Además de los elementos de su fórmula, suele llevar como impurezas: titanio, hierro, sodio y potasio.) Sistema Al^O^-SiO^. Para poder aprovechar al máximo las condiciones de formación de la mullita en los productos cerámicos, y conocer las fases que pueden acompañarla, es necesario el conocimiento de las reacciones que tienen lugar en el sistema AlaOg-SiOa al variar la temperatura. Este sistema, aunque estudiado ya en 1924 por N. L. Bowen y J. W. Grieg , que establecieron el diagrama de fases aceptado en el mundo cerámico durante algún tiempo, ha sido objeto de numerosos trabajos de investigación posteriores. No es de extrañar el interés que técnicos y científicos muestran respecto a este tema si se tiene en cuenta que de su conocimiento han de extraerse muchas de las conclusiones más importantes respecto a la mullita formada por reacción de estos óxidos a elevada temperatura. Los trabajos existentes hasta la fecha son numerosísimos y en ellos la base principal de discusión puede decirse que es la forma de fusión que presenta la mullita, es decir si se trata de una fusión congruente o de una fusión incongruente. En el diagrama existen un punto eutéctico y un punto peritectico. Ambos óxidos reaccionan entre sí al aumentar la temperatura, dando lugar, según los autores, a un compuesto único estable de fórmula 3 • AI2O3 • 2 SÍO2, que funde incongruente mente a 1.810° C y que es idéntico al descubierto por Bowen, Grieg y Zies en una roca de la isla de Mull, que denominaron mullita. Cuando se alcanza el equilibrio por encima de 1.470° C es posible la existencia de tres fases cristalinas que son: mullita, cristobalita y corindón. Por debajo de 1.470° C existe tridimita, puesto que la cristobalita a no es estable. El punto de fusión de la cristobalita se encuentra a 1.713° C, el punto de fusión de la a-alúmina a 2.050° C. A 1.585° C existe un eutéctico, es decir, un punto invariante en el cual están en equilibrio: cristobalita, mullita y líquido La composición de la fase líquida en este punto es intermedia entre las composiciones de ambas fases sólidas y, según los autores, es 94,5 % de SÍO2 y 5,5 % AI2O3 en peso, lo cual equivale a 92,3 % de SiO^ y IJ % de mullita (3 AI2O3 • 2 SiOa) en peso. En el diagrama primitivo (1924), Bowen y Grieg indican como punto de fusión de la cristobalita 1.725° C; el punto de fusión de la a-alúmina, 2.040 C, y el eutéctico a 1.545° C. A 1.810° C existe en el sistema un punto peritéctico, punto invariante que nos indica la temperatura a la cual funde la fase mullita en fusión incongruente, dando lugar a corindón, como nueva fase cristalina, y a un líquido cuya composición no es intermedia entre la mullita y la alúmina sino que contiene 45 % de SiOa y 55 % de AI2O3, lo cual equivale en peso a 23,4 % de SÍO2 y 76,6 % de mullita de composición 3 ÁI2O3 • 2SÍO2. Formación y yacimientos Se forma en general a partir de una refundición de arcillas de edad terciaria. Se ha encontrado en inclusiones fundidas arcillosas en rocas eruptivas terciarias (Isla de Mull, Escocia); como inclusiones microscópicas en sillimanita en inclusiones pelíticas en una tonalita (Val Sissone, Italia), en un conjunto complejo de rocas similares al esmeril (Sithean Sluaigh, Escocia). Suele encontrarse asociado a otros minerales como: corindón, sillimanita, cianita,magnetita, espinela, pseudobrookita, sanid ina o cordierita. Usos La mullita es usada en la fabricación de cerámica, en la que aparece como cristales en forma de aguja que mejoran las propiedades de la cerámica, su forma sintética es considerada una cerámica que resiste altas temperaturas, lo que se denomina material refractario. Feldespatos La familia de los minerales llamados genéricamente "feldespatos", comprende un grupo de aluminosilicatos relacionados entre sí, con cantidades variables de potasio, sodio y calcio y más raramente con otros cationes (bario, hierro, plomo, rubidio y cesio), en series de minerales en solución sólida. Los feldespatos comunes pueden ser considerados como la solución sólida de tres componentes: ortoclasa u ortosa (KAlSi 3O8), albita (NaAlSi3O8), y anortita (CaAl2Si2O8). Los dos últimos conforman los extremos de una serie isomorfa completa, con cantidades variables de sodio y calcio, denominada plagioclasa: albita, oligoclasa, andesina, labradorita, bitownita y anortita. El feldespato de potasio se presenta en tres formas: microclino, ortoclasa y sanidina. El primero es característico de rocas plutónicas y pegmatitas, el segundo de porfiritas, pegmatitas y vetas hidrotermales y el tercero de rocas volcánicas. Albita, oligoclasa y andesina son comunes en granodioritas, dioritas y en las rocas volcánicas afines. Los principales feldespatos comerciales son: el sódico - cálcico (albita y oligoclasa, de bajo contenido en calcio en la serie de minerales albitaanortita) y el potásico (microclino y ortoclasa), entre otros. Feldespato de sodio Los feldespatos son un grupo de minerales formados por silicatos dobles de aluminio y de calcio, sodio, potasio, algunas veces de bario o mezclas de esas bases. Es de la familia de los tectosilicatos. Forman el grupo más importante de la corteza terrestre ya que constituyen el 60% de esta. Etimología Su nombre proviene del alemán, Feld y Spat, el término feldespático hace referencia a los materiales que contienen feldespatos. Composición Potassium feldspar crystals in a granite, eastern Sierra Nevada, Rock Creek Canyon, California. Scale bar is 2.0 cm. Su estructura consiste en una base de silicio (Si4+) en la que una parte ha sido sustituida, isomórficamente, por aluminio Al desequilibrarse las cargas se compensan con cationes metálicos (K+, Na+, Ca+2). Pueden ser monoclínicos o triclínicos. Son de color blanco, de brillo vítreo o bien de colores muy claros. Su origen espetrográfico, muy abundantes y formados a través de la consolidación de los magmas. Son muy alterables y se deterioran a través de un proceso llamado caolinización. Todos los feldespatos son minerales duros, de peso específico comprendido entre 2,5 y 2,75. Se dividen en 3 grupos: Ortoclasas, (feldespatos potásicos) que son monoclínicos como laortosa. Esta inicia la fusión sobre los 1.180 ºC, si se aumenta la temperatura se descompone y se forma leucita. orthoclase (monoclinic),[2] — KAlSi3O8 sanidine (monoclinic)[3] —(K,Na)AlSi3O8 microcline (triclinic)[4] — KAlSi3O8 anorthoclase (triclinic) — (Na,K)AlSi3O8 Plagioclasas, (feldespatos de calcio o sodio) que son triclínicos como la albita o la labradorita. albite (0 to 10) — NaAlSi3O8 oligoclase (10 to 30) — (Na,Ca)(Al,Si)AlSi2O8 andesine (30 to 50) — NaAlSi3O8 — CaAl2Si2O8 labradorite (50 to 70) — (Ca,Na)Al(Al,Si)Si2O8 bytownite (70 to 90) — (NaSi,CaAl)AlSi2O8 anorthite (90 to 100) — CaAl2Si2O8 Feldespatos de bario. Donde el catión predominante es el Ba+2 la celsian, BaAl2Si2O8, minéral des roches métamorphiques riches en baryum le hyalophane, K0.75Ba0.25Al1.75Si2.25O8, minéral des roches ignées et métamorphiques Tabla de las plagioclasas según proporción albita/anortita Nombre % NaAlSi3O8 % CaAl2Si2O8 Densidad Fórmula albita 100-90 0-10 2,63 NaAlSi3O8 oligoclasa 90-70 10-30 2,65 (Na,Ca)(Al,Si)AlSi2O8 andesita 70-50 30-50 2,68 NaAlSi3O8 — CaAl2Si2O8 labradorita 50-30 50-70 2,71 (Ca,Na)Al(Al,Si)Si2O8 bytownita 70-90 2,74 (NaSi,CaAl)AlSi2O8 30-10 anortita 10-0 90-100 2,76 CaAl2Si2O8 Determinación de las plagioclasas según el color u macla A simple vista, se determinan les plagioclasas en función de su color, ou de leurs macles : Los feldespatos alcalinos son en general rosados. feldespatos plagioclasas, a menudo tienen tonos de color verde pálido. Las plagioclasas presentan una mayor luminiscencia a la luz UV que las ortoclasas Determinación de las plagiocasas al microscopio polarizado Si no es posible determinar el tipo de macla, al estar las variedades de plagiocasas clasificadas según el contenido de anortita, también varía en forma gradual las propiedades ópticas, lo que nos permite identificarlas Extinction des plagioclases. Quartz en blanc-gris, feldspaths plagioclases maclés, en orange la biotite Son tres métodos para poder distinguirlas Método de Michel Lévy se aplica en secciones que contengan maclas. Determinación del angulo de extinción de las plagioclasas : Amener l'axe principal en direction Nord-Sud. Le cristal doit être gris uniforme, avec seulement la trace des plans de macle. Tourner la platine support de 45°. Le cristal doit être gris uniforme. On ne doit plus voir la trace des plans de macle. Revenir Nord-Sud. Mesurer l'angle d'extinction d'un côté, puis de l'autre. Faire 5 mesures et prendre la plus grande. Angle d'extinction selon la composition des plagioclases (valeurs approximatives) Función de los feldespatos en cerámica El feldespato sódico principalmente actúa como fundente produciendo a una menor temperatura el producto, sobre todo en media alta temperatura, para baja es necesario reforzarlos con otros fundentes. Constituye el "cemento" entre las partículas de los demás componentes. Disminuye en productos porosos el coeficiente de dilatación. Es muy habitual, introducir el feldespato a partir de rocas con alto contenido en feldespatos, como Cornish stone,nefelina sienita, pegmatita, granito. Se suele sustituir el contenido de un esmalte en alta temperatura por nefelina sienita (feldespatoide), para bajar a cono 6, al peso. la proporción de feldespato en las pastas oscila entre 15 a 45 % en pastas de porcelanas de alta tensión. La ortosa y albita tienen en proporción de 35 de ortosa y 65 % de albita un punto eutéctico que funde a la temperatura de 1063ºC. Junto con el cuarzo y la mica es un mineral constituyente del granio, siendo el responsable de la descomposición (meteorización) de éste. La meteorización del feldespato (o caolinización) se produce en ambientes húmedos y cargados de CO2. El CO2 se convierte en CO3 para unirse con el potasio, calcio o sodio, formando carbonatos, en el caso del calcio se denomina calcita. Por su parte, los silicatos dobles forman silicatos alumínicos hidratados, caolín. - Feldespato de potasio Formula química: KAlSi3O8 Relación estequiométrica: Su estructura consiste en una base de silicio (Si4+) en la que una parte ha sido sustituida, isomórtificamente, por aluminio. Al desequilibrarse las cargas se compensan con cationes metálicos, en este caso el del potasio K+. Propiedades: Su dureza, insolubilidad en ácidos y la presencia de bandas de desmezcla, suelen distinguirlos de otros minerales. Color: blanco, amarillo o salmón • Brillo: De vítreo a perlado • Dureza: De 6 a 6,5 • Densidad: Entre 2,56 – 2,76 (Plagioclasa) • Feldespatos alcalinos, densidades más bajas. • Índice de refracción: Plagioclasa, valores más altos • Micropertita, puede producir iridiscencia. Aplicaciones: Minerales industriales utilizados en la fabricación de porcelanas para uso eléctrico (como aislante), esmaltes cerámicos, vidrios y abrasivos. Algunas variedades se han tallado en cabujones para joyería. Estructura cristalina: Estructura monoclínica: tiene el cristal tres ejes de distinta longitud, dos de los cuales son oblicuos (es decir, no perpendiculares) entre sí, pero perpendiculares al tercero. Consta de cuatro tetraedros de Si04 (sílice) se unen formando un anillo, el cual, a su vez, se enlaza con otros formando una cadena, que corre paralela al primer eje cristalográfico y es paralela también a las caras de exfoliación. Estas cadenas se unen entre sí por los oxígenos, conservando en los intersticios y en posiciones más o menos fijas los cationes. Métodos de fabricación o extracción: Su origen es petrográfico, son muy abundantes y formados a través de la consolidación de los magmas. Son muy alterables y se deterioran a través de un proceso llamado caolinización que se produce en ambientes húmedos y cargados de CO2. El CO2 se convierte en CO32- que se combina con el potasio, calcio o sodio, formando carbonatos que, en el caso del calcio, se denomina calcita. Los silicatos dobles forman silicatos alumínicos hidratados, caolín. Junto con el cuarzo y la mica es un mineral constituyente del granito, siendo el responsable de la descomposición (meteorización) de éste. Minerales característicos. Los feldespatos potásicos (KAlSi3O8) forman una disolución parcial sólida con el término albítico (NaAlSi3O8) de las plagioclasas, es la serie isomórfica de los feldespatos alcalinos. Microclina (KAlSi3O8): Cristaliza en el sistema triclínico y es de color variable (blanco o amarillento) pero llama la atención las variedades verdes que se llaman amazonitas. Ortosa u ortoclasa (KAlSi3O8): Cristaliza en el sistema monoclínico y es comúnmente blanca o rosa. La variedad fuertemente brillante, casi transparente y de gran pureza es la llamada adularia o piedra luna. Sanidina ((K, Na)AlSi3O8): Con sustitución parcial de potasio por sodio, incolora, blanca, gris o amarillenta. Es corriente que presente maclas de Carlsbad. - Leucita. Uno de los minerales feldespatoides más comunes, el aluminosilicato de potasio, (KAlSi2O6). Relación estequiométrica: Es muy similar al feldespato de potasio (KAlSi3O8) en cuanto a la composición, pero al poseer un átomo menos de Si4+ el sistema se equilibra con un O2- menos. Contiene 21.5% de K, 23.5% de Al2O3 y el 55% de SiO2. A veces el sodio puede reemplazar a parte del potasio. Atacable por ácido clorhídrico. Propiedades: Color: Blanco o grisáceo con ligeros tonos amarillentos o rosados. Raya: Incolora o blanca. Brillo: De vítreo a craso. Dureza (escala de Mohs): 6 Densidad: 2.5 g/cm3 Tenacidad: frágil Aplicaciones: Generalmente se utiliza en la fabricación de vidrios, aunque también es usada como fertilizante en Italia (debido a su alto contenido de potasio) y como fuente de alumbre comercial. Estructura cristalina: Sistema cristalino tetragonal (a=13, c=14, α=β=γ=0º) Métodos de fabricación o extracción: Se encuentra sólo en rocas ígneas, particularmente en lavas recientes ricas en potasio y pobres en sílice. Algunas ubicaciones importantes incluyen Roma, Italia, Uganda y los montes Leucita en Wyoming (EE.UU.). Generalmente se presenta en granos o cristales trapezoidales, raras veces en masa. CRISÓLITO El crisólito o asbesto blanco es la forma más frecuentemente encontrada del asbesto, con un 95% de los asbestos en Estados Unidos, y con cifras similares en otros países. Es un mineral de silicato blando y fibroso del grupo de las serpentinas de filosilicatos, y como tal, es diferente a otros asbestiformes en el grupo de los anfíboles. Su fórmula química idealizada es Mg3(Si2O5)(OH)4. Existen tres politípos de crisólito. Estos son muy difíciles de distinguir a simple vista y se debe de utilizar el método de microscopía de luz polarizada. Algunas publicaciones anteriores se refieren al crisólito como un grupo de minerales -los tres politípos listados debajo y, algunas veces el pecoraitapero en las recomendaciones de 2006 de la Asociación Mineralógica Internacional prefiere tratarlo como un solo mineral con diferentes variaciones en sus formas de origen natural. NOMBRE Clinocrisólito SISTEMA CRISTALINO Monoclínico Ortocrisólito Ortorrómbico PARÁMETROS DE CELDA UNITARIA a = 5.3 [Å], b = 9.19 [Å], c = 14.63 [Å], β = 93° a = 5.34 [Å], b = 9.24 [Å], c = 14.2 [Å] Paracrisólito Ortorrómbico a = 5.3 [Å], b = 9.24 [Å], c = 14.71 [Å] El clinocrisólito es la más común de las tres formas, mayormente encontrada en Asbestos, Quebec, Canadá. Sus dos índices refractivos medibles tienden a ser menores a la de los demás. Los paratipos ortorrómbicos pueden ser distinguidos por el hecho que, para el ortocrisólito, el mayor de los dos índices refractivos es el medido paralelo al eje largo de las fibras (como en el clinocrisólito); mientras que para el paracrisólito, el mayor de los dos índices refractivos es el medido perpendicular al eje largo de las fibras. PROPIEDADES FÍSICAS La dureza del crisólito en bruto es aproximadamente las misma que la de una uña humana, es fácilmente desmenuzada en fibras que estas son conformadas a su vez por pequeñas fibrillas. Estas fibrillas de origen natural tienen un largo que oscila en el rango de varios milímetros, hasta más de diez centímetros, aunque el crisólito procesado industrialmente comúnmente esta compuesto por fibras más pequeñas. El diámetro de estos conglomerados es de 0.1 – 1 μm, y las fibrillas individuales son aún más finas, 0.02 – 0.03 μm, con cada fibra conteniendo miles de fibrillas. Las fibras del crisólito tienen una resistencia a la tensión considerable, y estas pueden ser hiladas y tejidas para hacer ropa. También son muy resistentes al calor y excelentes aislantes, tanto térmicos como eléctricos y acústicos. PROPIEDADES QUÍMICAS La fórmula química idealizada del crisólito es Mg3(Si2O5)(OH)4, aunque algunos iones de magnesio pueden ser remplazados por hierro u otros cationes. El intercambio de iones de hidróxido por fluoruro, oxido o cloruro son también conocidos, aunque rara vez se presenten estos casos. Un mineral relacionado, pero mucho más raro es la pecoraita, en donde todos los cationes de magnesio en el crisólito se sustituyen por cationes de níquel. El crisólito es resistente a las bases más fuertes, pero las fibras son atacadas por ácidos: los iones de magnesio son selectivamente disueltos, dejando un esqueleto de sílice. Es estable térmicamente hasta unos 550°C, donde se comienza a deshidratar. La deshidratación es completa a unos 750°C, siendo los productos finales son forsterita (silicato de magnesio), sílice y agua. El balance de masa de la reacción de deshidratación del crisólito es la siguiente: 2Mg3Si2O5(OH)4 MICROESTRUCTURA g2SiO4 + SiO2 + 4H20 Esta es una muestra vista en el microscopio electrónico del mineral de crisólito, donde podemos observar las fibras del mineral de crisólito, compuestas por pequeñas fibrillas. Aquí podemos ver las fibrillas con un mayor detalle. APLICACIONES Las excelentes propiedades que presenta y su relativo bajo costo, pueden explicar sus numerosas aplicaciones industriales, así como el hecho de que figure, o haya figurado durante muchos años, en la composición de muchísimos productos o acabados industriales. Además, existen numerosos yacimientos en todo el planeta y su costo de extracción es bajo. Debido a estas características, se le ha utilizado masivamente en diversos sectores: como material de construcción en tejas, baldosas, azulejos, papel o cemento; en la fabricación y reparación de automóviles, camiones y tractores (embragues, frenos, juntas o componentes de la transmisión); en la fabricación, reparación y mantenimiento de materiales ferroviarios; en la construcción naval, reparación y desguace de barcos; en la siderurgia; en el sector eléctrico (centrales térmicas y nucleares) y en diversos materiales textiles, envases o revestimientos. ESTEATITA: Relación estequiométrica: El talco es un silicato de magnesio hidratado, cuya fórmula teórica es Mg3Si4O10(OH)2. En la escala de Mohs se toma como patrón de la menor dureza posible, asignándosele convencionalmente el valor 1. Mg3Si4O10(OH)2 Propiedades: Al tacto resulta tan grasiento o jabonoso que puede rayarse con la uña, de coloración blanca, grisácea, verde pálido o rosácea, en función del contenido de Mg, Fe y Si. Aplicaciones: Se utiliza en diversas aplicaciones. En forma de polvo se utiliza como relleno en la fabricación de papel y cartulina, para lacas y pinturas, en la industria cerámica, como aditivo de gomas y plásticos, así como para prevenir irritaciones de la piel y para hidratar ésta. Por su resistencia a elevadas temperaturas se utiliza en la fabricación de materiales termorresistentes. Es la base de muchos polvos en la cosmética. Se utiliza en la industria alimentaria como E553b. Uso cerámico 1. Como moldes de fundición de metales blandos como la plata. 2. Por su resistencia a elevadas temperaturas se utiliza en la fabricación de materiales termo-resistentes. 3. Se pueden encontrar en la arqueología un material cerámico cocido, pasando a un a dureza de 1 del talco al 5.5-6.5 ya como cristobalita. Función en esmaltes En esmaltes de alta temperatura se utiliza como fundente por su aporte de MgO Agregándolo en bajas cantidades aumenta el brillo del esmalte y disminuye su punto de fusión. También colabora en disminuir el coeficiente de dilatación térmica. En bajas cantidades ayuda en aumentar fuertemente la tensión superficial del esmalte, logrando que la superficie del mismo se vuelva dura y resistente a la abrasión. Si se agrega talco en grandes cantidades a un esmalte, favorece la cristalización y por ende produce un efecto mate aumentando el coeficiente de dilatación térmica. En cuanto a los colores de los esmaltes, el MgO colabora en alterar algunos de ellos como por ejemplo: 1. Al marrón de níquel a un verde. 2. Al verde de cromo lo lleva a un verde oliva 3. Al verde de cobre lo transforma en un verde oliva con tono grisáceo 4. Al amarillo de Hierro a un verdoso amarillento 5. Al cobalto lo lleva de un azul a un violeta Función en la pasta En las pastas cerámicas en proporciones de hasta el 8 % con objeto de aumentar la fundencia en pastas blancas gresificadas, buscando eutécticos con feldespatos alcalinos. Funciona como un fundente en pastas de baja y media temperatura. Otra ventaja del uso del talco es que ayuda a mejorar la pasta en cuanto a la resistencia al choque térmico, por tanto es muy aconsejable usarlo en pasta aptas para artículos que se pondrán directamente al fuego y en pastas para rakú. Si hacemos mezclas de arcilla pura con talco esteatitico puro, veremos que existe una región eutéctica muy pronunciada de vitrificación de ambos minerales entre 45% 50% talco y 50% 55% arcilla. a temperatura. media 04 a 2 orton. y en ello se basan las pastas de esteatita pura de baja expansión y transparentes a un amplio rango de radiofrecuencia, es curioso el echo de que si la arcilla y el talco son demasiado puros se llega al caso de tener que agregar sílice 2 a 5% para aumentar la expansión y acomodarnos al modelo comercial de los vidriados. En inglés estas pastas se denominan talc body. Pasta blanca para 1050: ◾Sílice 5 % ◾Feldespato 10 % ◾arcilla de bolas 40 % ◾Talco 45 Desmoldante Se puede usar el más puro, o bien directamente el de farmacia, muy finamente molido como desmoldante, se espolvorea retirando todo el sobrante. Abrasivo Se puede usar para pulir las piezas de cerámica. Estructura: Las impurezas más comunes son CaO (hasta 8%) y Al2O3 (hasta 6%). Unas impurezas de hierro enttre 0.6% a 0.7% Fe2O3 pueden ser usuales en cerámica Métodos de fabricación: El talco suele aparecer de forma masiva (forma también llamada esteatita) y pocas veces en cristales bien formados. Se forma por metamorfosis de silicatos de magnesio como la olivina, piroxeno o anfíbol. Los principales productores son Estados Unidos, China y la Unión Europea, de donde procede la mayor parte de la producción mundial. En Málaga se puede encontrar en diversas minas, como en la Mina Jaboncillo de Mijas y la cantera “Tres Amigos” en Málaga. Referencias: Yet – Ming Chiang Dianbar Birnie III, . David Kinergy, Physical Ceramics Bellotto, M.; Gualtieri A., Artioli A., Clark S.M. (1995). "Kinetic study of the kaolinite-mullite reaction sequence". Physics and Chemistry of Minerals 22: 207–217. http://chemistry.osu.edu/~woodward/ch754/str_poly.htm https://www.osha.gov/dts/sltc/methods/inorganic/id142/id142.html http://en.wikipedia.org/wiki/Cristobalite http://www.quarzwerke.com/home/maerkte_und_produkte/Range%20o f%20products/englHigh%20Performance%20Fillers/Quartz http://www.quartzpage.de/gen_struct.html http://www.quartzpage.de/gen_mod.html#T http://rruff.info/doclib/hom/cristobalite.pdf http://www.azomining.com/Article.aspx?ArticleID=481 http://es.wikipedia.org/wiki/Mullita boletines.secv.es/upload/196605079.pdf http://ceramica.wikia.com/wiki/Feldespato http://ceramica.wikia.com/wiki/Talco