Informe de Laboratorio de Espectros de Emisión: Experimento de Química
Anuncio

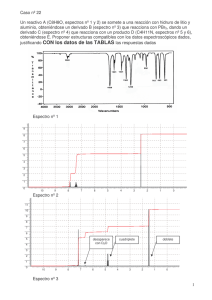
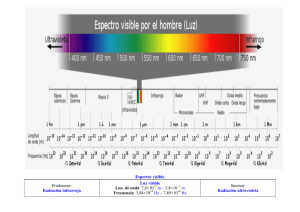
Universidad Central. Estrada, Naranjo, Ospina. Informe de laboratorio espectros de emisión ESPECTROS DE EMISIÓN Estrada Kim, Naranjo Rick y Ospina Alejandra Código: 1069751855, 1000696025,1023979918 Universidad Central, Facultad de Ingeniería y Ciencias Básicas. Profesora: Diana Milena Jacome. Fecha: 27/08/2019 https://es.scribd.com/doc/19622798/Espectro-de-emision-y-absorcion Espectro de emisión: Mediante suministro de energía calorífica, se estimula un determinado elemento en su fase gaseosa, sus átomos emiten radiación en ciertas frecuencias del visible, que constituyen su espectro de Resumen— El laboratorio de espectros de emisión, tuvo como objetivo, conocer el principio de la espectroscopia. El presente informe ilustra 6 elementos químicos con sus respectivas longitudes de onda radiadas, diferenciadas por la paleta de colores que emite. I. OBJETIVOS A. Observar diferentes espectros de emisión producidos por diferentes elementos. B. Comparar el espectro de emisión observados en el laboratorio con los producidos por algunos cuerpos celestes y así determinar algunos elementos químicos que los conforman. II. MARCO TEÓRICO Espectros de emisión: La espectrometría de emisión es una técnica espectroscópica que analiza las longitudes de onda de los fotones emitidos por los átomos o moléculas durante su transición desde un estado excitado a un estado de inferior energía. Cada elemento emite un conjunto característico de longitudes de onda discretas en función de su estructura electrónica. Espectro de absorción: Se presenta cuando un sólido incandescente se encuentra rodeado por un gas más frío el espectro resultante muestra un fondo interrumpido por espacios oscuros denominados líneas de absorción porque el gas ha sido absorbido de la luz aquellos colores que este irradia por sí mismo. Imagen 1. Foto del espectro de Absorción. Fuente: tomado de Scribd emisión. Ninguno de estos se repite. Imagen 2. Foto del espectro de Emisión. Fuente: tomado de Scribd https://es.scribd.com/doc/19622798/Espectro-de-emision-y-absorcion Espectro Continuo: Cuando se descompone la luz blanca del sol con la ayuda de un prisma, se observa un abanico de colores. Se dice que la luz blanca posee un espectro continuo porque se pasa de un color al otro sin interrupción en la sucesión de colores. Experimentalmente, se constata que todo cuerpo (gaseoso o sólido) sometido a altas presiones y altas temperaturas, emite un espectro continuo de luz. Lámpara de Neón: Una lámpara de Neón es una lámpara de descarga de gas en forma de un tubo de vidrio lleno de gas neón a baja presión. Un Ion de neón recoge un electrón del electrodo negativo cambiándolo de nuevo a gas neón normal. Este proceso produce un fotón de luz que es el que vemos como un resplandor en el terminal negativo. Cuando el proceso se desarrolla en corriente alterna son los dos terminales los que emiten un resplandor, 60 veces por segundo. Lámpara de Hidrógeno: La excitación eléctrica del hidrógeno a baja presión (aproximadamente 0.2 a 0.5torr) produce un espectro continuo en la región ultravioleta. El mecanismo por el cual se produce el espectro continuo requiere Universidad Central. Estrada, Naranjo, Ospina. Informe de laboratorio espectros de emisión la formación inicial de una especie molecular excitada seguida de la disociación de la molécula excitada para dar dos especies atómicas más un fotón ultravioleta. Lámpara de Kriptón: El kriptón es un gas noble incoloro, inodoro e insípido de muy pequeña reactividad caracterizado por un espectro de líneas verde y rojo-naranja muy brillantes. Es uno de los productos de la fisión nuclear del uranio. Para propósitos prácticos puede considerarse un gas inerte aunque se conocen compuestos formados con el flúor. Lámpara de Mercurio: En las lámparas de mercurio el espectro de emisión de mercurio predominan las radiaciones ultravioletas .Para que estas radiaciones sean útiles se recubren las paredes interiores del tubo con polvos fluorescentes que convierten los rayos ultravioletas en radiaciones visibles. De la composición de la estas sustancias dependerá la cantidad y calidad de la luz y las cualidades cromáticas de la lámpara. IV. RESULTADOS Longitud de Onda: Es la distancia que existe entre dos puntos sucesivos que se encuentran en el mismo estado de vibración (misma elongación, velocidad, aceleración). Se simboliza mediante la letra griega λ (lambda) y se expresa en unidades de longitud (m). Espectro Visible: Es el espectro de radiación electromagnética que es visible para el ojo humano. Va desde una longitud de onda de 400 nm hasta 700 nm. Además, también se conoce con otro nombre: el espectro óptico de la luz. III. Fotografía 1. Lámpara Neón. Fuente propia METODOLOGÍA MAPA CONCEPTUAL Fotografía 2. Argón. Fuente propia Universidad Central. Estrada, Naranjo, Ospina. Informe de laboratorio espectros de emisión Fotografía 3. Hidrogeno. Fuente propia Fotografía 6. Mercurio. Fuente propia NEÓN ARGÓN HIDRÓGENO Fotografía 4. Kriptón. Fuente propia KRYPTON HELIO MERCURIO LONGITUD DE ONDA EXPERIMENTAL Azul 500 LONGITUD DE ONDA DE REFERENCIA Verde 540,1 Verde Amarillo Rojo Azul Verde Naranja Rojo 560 590 660 500 560 610 660 Azul Amarillo Rojo Azul Verde Naranja Rojo 500 590 660 500 560 610 660 Azul Naranja Rojo Azul Verde Naranja 500 560 660 500 560 610 Amarillo Naranja Rojo Violeta Azul Verde Naranja Rojo Violeta Azul-verde Rojo Violeta Azul Verde Naranja Rojo Azul Amarillo Rojo Azul Verde Naranja 585,2 603 650,6 419,1 470,2 570,6 603,2 630,8 397,0072 486,133 656,272 428,3 446,4 588 605,6 757,7 447,148 501,567 587,562 435,835 546,065 579,065 Tabla 1. Resultados experimentales vs longitud de onda de referencia. Fuente: propia. Fotografía 5. Helio. Fuente propia Universidad Central. Estrada, Naranjo, Ospina. Informe de laboratorio espectros de emisión V. COLORES IMAGEN PROBLEMA EJERCICIO NEÓN ARGÓN HIDRÓGENO KRYPYON HELIO Violeta Azul Azul-verde Verde Verde claro Amarillo Naranja Rojo Rojo oscuro -x -x -x -x -- -x -x --x x -- -x ---x -x -- -x -x --x x -- -x ----x x -- -x -x --x --- ELEMENTO PRESENTE Si Si Si Si Si Si VI. - - - MERCURIO CONCLUSIONES Imagen 3. Foto Clasificación de Estrellas Fuente: tomado de Perseo https://astroperseo.org/2016/08/27/las-estrellas-clasificacion-espectral/ Las clases de luminosidad se designan mediante número romanos: I, II, III, IV, V .A menor número romano, mayor tamaño de la estrella. Las clases I y II designan supergigantes, l clase III gigantes, la clase IV subgigantes y la clase V, las enanas de la secuencia principal. Menos utilizadas son las clases VI y VII, para designar a las subenanas y las enanas blancas. Nuestro Sol es de tipo G2V, es decir, una estrella de tipo espectral G2 y clase de luminosidad V. El origen del espectro de emisión de un elemento químico se encuentra en su estructura electrónica. el espectro de emisión de un elemento funciona como una huella, es única para cada compuesto. La espectroscopia de emisión es una técnica espectroscópica que examina las longitudes de onda de los fotones emitidos por los átomos o moléculas durante su transición de un estado excitado a un estado de menor energía. Imagen 5. Foto Clasificación de Estrellas Fuente: tomado de Perseo https://astroperseo.org/2016/08/27/las-estrellas-clasificacion-espectral/ VII. CUESTIONARIO A. Investigar cómo se clasifican las estrellas de acuerdo a su tipo espectral. Los tipos espectrales se definen en función de las características presente en el espectro de las estrellas. Originalmente, los tipos espectrales fueron definidos por letras del alfabeto: A,B,C…. Conforme avanzaba la clasificación, algunos tipos se refundieron, y con ellos sus letras. Posteriormente, los diferentes tipos espectrales pudieron asociarse a la temperatura de las estrellas y fueron ordenados en temperaturas decrecientes. B. Explique la diferencia entre los espectros de emisión y los espectros de absorción. La diferencia entre el espectro de emisión y absorción es que en el espectro de emisión el elemento emite su propia luz dejando un espacio grande en negro dependiendo de cuál sea el elemento y su longitud de onda. El espectro de absorción: el elemento absorbe la luz mediante la onda de frecuencia que se acople a él, y las rayas en negro son diferentes longitudes de onda. VIII. - BIBLIOGRAFÍA Guillermo Pérez. (2017). Espectrometría de emisión. 2017, de Universidad Central. Estrada, Naranjo, Ospina. Informe de laboratorio espectros de emisión - - - - - - - - Espectrometría.com Sitio web: https://www.espectrometria.com/espec trometra_de_emisin Observatoire de Paris. (2014). Las diferentes clase de Espectros. 2014, de Ventanas Abiertas al Universo Sitio web: https://media4.obspm.fr/public/VAU/t emperatura/radiacion/espectroscopia/e spectros-estelares/OBSERVER.html Cchecoman. (2009). Espectro de emisión y absorción. 11 de Septiembre del 2009, de Scribd Sitio web: https://es.scribd.com/doc/19622798/Es pectro-de-emision-y-absorcion Electrónica para el aficionado y el experto. (2014). ¿Qué es una Lámpara de neón?. 2014, de Electrónica Unicrom Sitio web: https://unicrom.com/lampara-de-neon/ D. A. Skoog, F. J. Holler, S. R. Crouch, P rincipios de análisis instrumental, 6ta edición, Cengage Learning, México, 2008. Lourdes Cardenal. (2011). Kriptón. 31 marzo del 2011, de Wikipedia Sitio web: http://depa.fquim.unam.mx/amyd/arch ivero/Apuntes3_18591.pdf Javier García Fernández, Oriol Boix. (2001). Clases de Lámparas de Descarga. 2001, de Recursos docents Citcea coordinats Sitio web: https://recursos.citcea.upc.edu/llum/la mparas/ldesc2.html Fernando Pino. (2011). El espectro visible de luz. 02 de Octubre del 2011, de Vix Sitio web: https://www.vix.com/es/btg/curiosidad es/2011/10/02/el-espectro-visible-deluz LuviFran. (2016).Las estrellas clasificación Espectral. 27 de Agosto del 2016, de Agrupación Astronómica Perseo Sitio web: https://astroperseo.org/2016/08/27/lasestrellas-clasificacion-espectral/ - Fátima Jacqueline Aguirre Sánchez, Perla Isela Hernández Rubio, Naomi Montoya Calderón, Gabriela Rodríguez Franco. (2017). Espectros de emisión y de absorción. 01 de Mayo del 2017, de FisicaCCH 10 Sitio web: https://sites.google.com/site/fisicaiicch 10/espectros-de-emisión-y-deabsorción