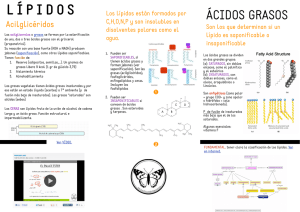
Grasas y aceites en la nutrición humana. Consulta FAO/OMS de expertos. (Estudio FAO Alimentación y Nutrición - 57) Indice Organizada por la Organización de las Naciones Unidas para la Agricultura y la Alimentación y la Organización Mundial de la Salud Roma, 19-26 de octubre de 1993 ORGANIZACION MUNDIAL DE LA SALUD Roma, 1997 Las denominaciones empleadas en esta publicación y la forma en que aparecen presentados los datos que contiene no implican, de parte de la Organización de las Naciones Unidas para la Agricultura y la Alimentación, juicio alguno sobre la condición jurídica de países, territorios, ciudades o zonas, o de sus autoridades, ni respecto de la delimitación de sus fronteras o límites. M-80 ISBN 92-5-303621-4 Reservados todos los derechos. No se podrá reproducir ninguna parte de esta publicación, ni almacenarla en un sistema de recuperación de datos o transmitirla en cualquier forma o por cualquier procedimiento (electrónico, mecánico, fotocopia, etc.), sin autorización previa del titular de los derechos de autor. Las peticiones para obtener tal autorización, especificando la extensión de lo que se desea reproducir y el propósito que con ello se persigue, deberán enviarse a la Dirección de Información, Organización de las Naciones Unidas para la Agricultura y la Alimentación, Viale delle Terme di Caracalla, 00100 Roma, Italia. © FAO 1997 La presente versión electrónica de este documento ha sido preparada utilizando programas de reconocimiento óptico de texto (OCR) y una revisión manual cuidadosa. No obstante la digitalización sea de alta calidad, la FAO declina cualquier responsabilidad por las eventuales diferencias que puedan existir entre esta versión y la versión original impresa. Indice Agradecimientos Participantes Secretaría Críticos y colaboradores Capítulo 1 Introducción Conclusiones y recomendaciones generales de la Consulta Capítulo 2 - Composición de las grasas alimentarias Capítulo 3 - Aspectos sobre la digestión y el metabolismo de las grasas Capítulo 4 - Tendencias globales sobre la disponibilidad de los aceites y grasas comestibles Capítulo 5 - Elaboración y refinado de aceites comestibles Capítulo 6 - Selección de usos de las grasas y de los aceites en la alimentación Capítulo 7 - Los lípidos en las primeras etapas del desarrollo Capítulo 8 - Salud, obesidad y valores energéticos de las grasas alimentarias Capítulo 9 - Enfermedades coronarias del corazón y lipoproteínas Capítulo 10 - Acidos grasos isoméricos Capítulo 11 - El cáncer y las grasas alimentarias Capítulo 12 - Las grasas alimentarias y la respuesta inmunitaria Capítulo 13 - Las grasas alimentarias, la hipertensión y los accidentes vasculares cerebrales Capítulo 14 - Constituyentes no glicéridos de las grasas Capítulo 15 - Etiquetado nutricional Anexo - Indices nacionales de suministro de grasas alimentarias Bibliografía Cuadernos técnicos de la FAO Agradecimientos La FAO y la OMS agradecen sinceramente las aportaciones de los expertos que participaron en esta consulta. Algunos de los expertos participantes prepararon los borradores de los artículos que, tras ser discutidos y corregidos, han constituido la base del texto de los capítulos de este Informe. La FAO y la OMS desean también dar las gracias a todos los demás expertos que prepararon artículos, y revisaron y modificaron los borradores de los artículos antes de la consulta. Presentamos nuestro agradecimiento especial al Dr. Mark Hegsted, que actuó como Presidente de la Consulta de Expertos y brindó orientaciones para la preparación de este Informe. Agradecemos también a la Dra. Joyce Beare-Rogers por su asistencia a las dos organizaciones en la preparación de esta Consulta, en la compilación y revisión de los borradores de los artículos, y en la preparación del Informe final. Participantes K.T. Achaya 282 Hundred Feet Road Indiranagar, Bangalore 560038 India Mohamed Saleh Hamed Al-Jasir* Nutrition Department Ministry of Health Riyadh Saudi Arabia *(No pudo asistir) Abigail Andah Food Research Institute P.O. Box M 20 Ministry Post Office Branch Accra Ghana Joyce Beare-Rogers 41 Okanagan Drive Nepean, Ontario, K2H 7E9 Canada Mark A. Bieber Best Foods Technical Center 150 Pierce St. Call Box 6710 Somerset, NJ 08873-6710 USA G. Bray Pennington Biomedical Research Center Department of Medicine Louisiana State University 6400 Perkins Road Baton Rouge, LA 70808-4124 USA K.K. Carroll Center for Human Nutrition Department of Biochemistry University of Western Ontario London, Ontario N6A 5C1 Canada M.A. Crawford Institute of Brain Chemistry and Human Nutrition Queen Elizabeth Hospital for Children Hackney Road London E2 8PS United Kingdom Ricardo Uauy Dagach Institute of Nutrition and Food Technology University of Chile Casilla 15138 Santiago 11 Chile Jacqueline Dupont Human Nutrition Program U.S. Department of Agriculture Agricultural Research Service Bldg 005, BARC-W Beltsville, MD 20705 USA S. Endres Medizinische Klinik Klinikum Innenstadt Ludwig Maximillian Universität Zienssenstrasse 1 München 80-336 Germany Claudio Galli Istituto di Scienze Farmacologiche Via Balzaretti 9 20133 Milano Italy D.M. Hegsted 58 Boulder Road Wellesley Hills MA 02181-1520 USA Martijn B. Katan Department of Human Nutrition Wageningen Agricultural University Bomenweg 2 6703 HD Wageningen The Netherlands Onno Korver Unilever Research Laboratorium Olivier van Noortlaan 120 3133 AT, Vlaardingen The Netherlands Christine Lewis Division of Technical Evaluation Office of Food Labeling Food and Drug Administration 200 C Street SW (HFS-165) Washington, DC 20204 USA Mario Mancini Institute of Internal Medicine and Metabolic Disease Federico II University Via Pansini 5 80131 Naples Italy T.A.B. Sanders Department of Nutrition and Dietetics School of Life, Basic Medical and Health Sciences King's College, University of London Campden Hill Road London W8 7AH United Kingdom Kalyana Sundram Palm Oil Research Institute of Malaysia P.O. Box 10620 50720 Kuala Lumpur Malaysia Petru T. Teodorescu Institute for Food Chemistry Girlei Street, no. 1 Sector 1, 71-576 Bucharest Romania Walter C. Willett Department of Nutrition Harvard School of Public Health 665 Huntington Avenue Boston, Massachusetts 02115 USA Yukio Yamori Graduate School of Human and Environmental Studies Kyoto University Yoshida-Nihonmatsu-Cho Sakyo-ku 606 Kyoto Japan Young K. Yeo Department of Dairy Science Kyungpook National University Taegu Republic of Korea Secretaría FOOD AND AGRICULTURE ORGANIZATION OF THE UNITED NATIONS Viale Terme di Caracalla 00100 Rome, Italy John R. Lupien Director, Food Policy and Nutrition Division J.P. Cotier Chief, Nutrition Planning, Assessment and Evaluation Service (ESNA) F. Sizaret Senior Nutrition Officer (ESNA) W. D. Clay Senior Nutrition Officer (ESNA) R. C. Weisell Nutrition Officer (ESNA) S. Chevassus-Agnès Nutrition Officer (ESNA) G. Kouthon Agricultural Services Division Food and Agricultural Industries Service G. Blaak Senior Officer, Plant Production and Protection Division Crop and Grassland Service (AGPC) A. Hodder Agricultural Officer (Horticulture) AGPC WORLD HEALTH ORGANIZATION Avenue Appia 20 CH-1211 Geneva 27, Switzerland Graeme A. Clugston Chief, Nutrition, Division of Food and Nutrition (FNU/NUT) K. Bailey Nutrition Programme (FNU/NUT) R. Buzina Nutrition Programme (FNU/NUT) N. G. Khaltaev Acting Chief, Diabetes and Other Non-communicable Diseases, Division of Non-communicable Diseases (NCD/DBO) Críticos y colaboradores Lynne M. Ausman Tufts University Boston, Massachusetts 02111 USA K. G. Berger 17 Grosvenor Road Chiswick London, W4 4EO, UK Mark A. Bieber Best Foods Technical Center 150 Pierce St., Call Box 6710 Somerset, NJ 08873-6710, USA Bengt Borgstrom Department of Physiology and Chemistry University of Lund P.O Box 750 Lund, Sweden S-220-07 David Buss Ministry of Agriculture Fisheries and Food Nobel House, 17 Smith Square London SW1P 3JR UK P. C. Calder Department of Biochemistry University of Oxford South Parks Road Oxford OX1 3QU, UK Susan Carlson University of Tennessee Medical Group 853 Jefferson Avenue, Room 201 Memphis TN 38163-0001, USA John M. Dietschy Department of International Medicine Southwestern Medical Center University of Texas 5323 Harry Hines Blvd. Dallas, TX 75235-8887, USA Jacqueline Dupont Human Nutrition Program U.S. Department of Agriculture Agricultural Research Service Bldg 005 BARC-W Beltsville, MD 20705, USA Charles E. Elson Nutritional Science Univesity of Wisconsin 1415 Linden Drive Madison, WI, 53706-1527 USA Pierre Falardeau Clinical Research Institute of Montreal 110 Pine Avenue West Montreal, Quebec H2W 1R7 Canada J.P. Flatt Department of Biochemistry and Molecular Biology University of Massachusetts Medical Center Worcester, MA, 01655-0001 USA Henry N. Ginsberg Division of Preventive Medicine and Nutrition Department of Medicine College of Physicians and Surgeons of Columbia University 630 West 168th Street New York, NY 10032 USA Kenneth C. Hayes Foster Biomedical Research Laboratory Brandeis University Waltham, MA 02254 USA John C. Hoak Division of Blood Diseases and Resources Department of Health and Human Services Federal Building, Room 516, Bethesda, MD, 20892-0001 USA Gunhild Hølmer Department of Biochemistry and Nutrition Building 224 Technical University of Denmark Copenhagen 2800, Denmark James M. Iacono Western Human Research Center U.S. Department of Agriculture Agricultural Research Service P.O. Box 29997 Presidio of San Francisco San Francisco, CA, 94129-0602 USA Sheila Innis Department of Paediatrics, Faculty of Medicine University of British Columbia Research Centre, Room 179 950 West 28th Ave Vancouver BC V5Z 4H4 Canada Eric Jéquier Institute of Physiology Faculty of Medicine University of Lausanne Rue du Bugnon 7 CH-1005 Lausanne Switzerland Patricia B. Johnston Department of Food Science University of Illinois 1304 West Pennsylvania Ave. Urbana, IL 61801 USA J. T. Judd Lipid Nutrition Laboratory U.S. Department of Agriculture Human Nutrition Research Center Bldg. 308-E, Rm 126 A, BARC-East Beltsville, MD 20705 USA David Klurfeld Department of Nutrition and Food Science Wayne State University 3009 Science Hall Detroit MI, 48202, USA Denis Lairon Institut National de la Santé et de la Recherche Médicale U-130 18 Ave Mozart 13009 Marseilles, France Michael Lathan Division of Nutritional Sciences Cornell University Savage Hall Ithaca, New York 14853-630, USA Alexander Leaf Veterans Administration Medical Center 1400 VFW Parkway West Roxbury, MA 02132, USA Neil MacFarlane Roche Lipid Technologies Heanor Gate Industrial Estate Delves Road Heanor, Derbyshire, DE75 7SG, UK David J. Mela Consumer Sciences Department Institute of Food Research Reading Laboratory Early Gate Whiteknights Rd Reading, RG6 2EF, UK Simin Nikbin Meydani * Human Nutrition Research Center on Aging - Tufts University Boston, Massachusetts 02111 USA *(Preparó el borrador del capítulo, Grasas Dietéticas y respuesta inmunitaria) Anthony B. Miller Faculty of Medicine Department of Preventive Medicine and Biostatistics McMurrich Building University of Toronto Toronto, Ontario M5S 1A8 Canada Robert J. Nicolosi Department of Clinical Laboratory Sciences University of Massachusetts Weed Hall, South Campus 302 Wilder Street Lowell, MA 01854 USA Johannes Nieuwenhuis Unilever Research Laboratorium P.O. Box 114 3130AC Vlaardingen The Netherlands K.R. Norum Institute for Nutrition Research School of Medicine University of Oslo P.O. Box 1046 Blindern 0316 Oslo 3 Norway Thomas A. Pearson Mary Imogene Basset Research Institute 1 Atwell Road Cooperstown, NY, 13326-1934, USA Edward G. Perkins University of Illinois Department of Food Science 1208 W. Penn. Ave Urbana, IL 61801 USA Andrew Prentice Dunn Clinical Nutrition Centre 100 Tennis Court Road Cambridge CB2 1QL, UK W.M. Ratnayake Health and Welfare Canada Health Protection Branch Sir F.G. Banting Research Centre Ottawa, Ontario, Canada Serge Renaud Institut National de la Santé et de la Recherche Médícale 22 Ave. du Doyen Lépine Case 18 69675 Bron Cedex France Barbara J. Rolls Program Biobehavioral Health Pennsylvania State University 104 Benedict House University Park, PA 16802, USA Gérard Roquelin Institut Français de Recherche Scientifique pour le Développement en Cooperation, ORSTOM B.P. 181 Brazzaville, Congo Dino Rotondo Department of Immunology University of Strathclyde Glasgow G4 ONR, UK James Shepherd Department of Pathological Biochemistry Royal Infirmary Glasgow, G4 05F, Scotland, UK Andrew Sinclair Department of Applied Biology Royal Melbourne Institute of Technology GPO Box 2476 V Melbourne, Victoria 3001 Australia Petru T. Teodorescu Institute for Food Chemistry Girlei Street, no. 1 Sector 1 71-576 Bucharest Romania J. N. Thompson Nutrition Research Division Health and Welfare Canada Banting Research Centre Ottawa, Ontario, Canada Ricardo Uauy Dagach Institute of Nutrition and Food Technology, University of Chile Casilla 15138 Santiago, Chile 11 K.W.J. Wahle Lipid Metabolism Laboratory Division of Biological Sciences The Rowett Research Institute Greenburn Road, Bucksburn Aberdeen AB2 9SB, UK Herbert Wessels Lipid Institute Pinsallee 68/78 D-4400 Münster, Germany Capítulo 1 Introducción Conclusiones y recomendaciones generales de la Consulta Introducción El papel de las grasas y aceites en la nutrición humana es una de las principales áreas de interés e investigación en el campo de la ciencia de la nutrición. Los resultados de estas investigaciones tienen consecuencias de amplio alcance para los consumidores, los responsables del cuidado de la salud, y los educadores nutricionales, así como para los productores, elaboradores y distribuidores de alimentos. Tanto en la literatura científica como en los medios de comunicación populares, surgen constantemente nuevas pruebas relacionadas con los beneficios y riesgos asociados a determinados aspectos de las grasas de la alimentación. Las controversias sobre estos resultados van evolucionando periódicamente. Seleccionar entre todas las réplicas y contrarréplicas, entre estudios incompletos e incompatibles, entre intereses partidistas y de la competencia, en busca de elementos de verdad y de un curso de acción prudente, constituye un reto. Esta es todavía una tarea esencial, ya que un cambio de los puntos de vista sobre los efectos de las grasas y aceites en la alimentación puede influir profundamente en el consumo de diversos alimentos, y, en último término, sobre el estado nutricional y de salud, sobre la producción agrícola, las tecnologías de preparación de los alimentos, los estudios de mercado y la educación nutricional. Invitados por la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO) y por la Organización Mundial de la Salud (OMS), se reunió en Roma del 19 al 26 de octubre de 1993 un grupo internacional de expertos en nutrición, salud pública, y ciencia y tecnología de los alimentos, para estudiar los últimos datos científicos sobre las grasas y aceites de la dieta. Los expertos que asistieron a la consulta debatieron muchos de los variados e importantes papeles que representan en la nutrición humana las grasas y los aceites. Consideraron los consumos de distintos tipos y niveles de grasas y aceites en la alimentación, y sus efectos sanitarios asociados. Examinaron muchos de los factores técnicos asociados a la producción, preparación, comercialización y utilización de las grasas y aceites. Finalmente, se elaboró una serie de recomendaciones sobre las grasas y aceites en la alimentación, con el fin de asesorar a los responsables de las políticas, a los especialistas en el cuidado de la salud, a la industria de la alimentación, y a los consumidores. Esta «Consulta FAO/OMS de expertos sobre las grasas y aceites en la nutrición humana» formó parte de una serie continua de reuniones sobre temas relacionados con la nutrición patrocinada por la FAO y por la OMS. La consulta fue la segunda reunión de este tipo que se llevó a cabo sobre grasas y aceites; la primera había tenido lugar en 1977. Este informe sobre la reunión contiene el examen de las cuestiones y datos considerados, las conclusiones y recomendaciones del grupo, y una bibliografía. Los expertos examinaron una amplia gama de temas, y esto aparece reflejado en el informe. Este informe contiene capítulos sobre los siguientes temas: la composición de las grasas alimentarias; aspectos de la digestión y metabolismo de las grasas; tendencias generales respecto de la disponibilidad de aceites y grasas comestibles; elaboración y refinado de aceites comestibles; usos seleccionados de las grasas y los aceites en la alimentación; los lípidos en las primeras etapas del desarrollo; salud, obesidad y valores energéticos; enfermedades coronarias del corazón y lipoproteínas; ácidos grasos isoméricos; cáncer y grasas alimentarias; grasas alimentarias y respuesta inmunitaria; grasas alimentarias, hipertensión, y accidentes vasculares cerebrales; componentes no glicéridos de las grasas; y etiquetado de los alimentos. Dado que los esfuerzos dirigidos a un aspecto de la relación alimentación-salud pueden afectar también a otros aspectos, hay. que tener cuidado en no insistir demasiado sobre un determinado aspecto, en detrimento de otros. Por tanto, las recomendaciones representan una síntesis y ponderación de varios aspectos. Debe señalarse que los datos relativos a diferentes temas pueden variar considerablemente. Mientras no se disponga de más información científica, y hasta que no mejore el conocimiento de las complejas interacciones metabólicas que determinan la mejora de las condiciones nutricionales y de salud, no será posible llegar a un acuerdo completo sobre cada tema. Esto constituye un dilema que se refleja en la naturaleza de las conclusiones y recomendaciones que surgieron en la consulta. En este capítulo se presentan las conclusiones y recomendaciones finales precedidas por una breve nota que identifica las cuestiones fundamentales. Incitamos a los lectores a que examinen los capítulos del informe para obtener una información más detallada sobre los temas considerados y conocer las deliberaciones que han conducido a las conclusiones y a las recomendaciones generales de la consulta. Conclusiones y recomendaciones generales de la Consulta Consumos mínimos convenientes de grasas y aceites Adultos. Es esencial para la salud ingerir cantidades adecuadas de grasas alimentarias. Además de contribuir a satisfacer las necesidades energéticas, el consumo de grasas alimentarias debe ser suficiente como para satisfacer las necesidades de ácidos grasos esenciales y de vitaminas liposolubles. El consumo mínimo necesario para mantener un buen estado de salud varía tanto a lo largo de la vida de una persona como entre distintos individuos. Un consumo adecuado de grasas es particularmente importante antes y durante el embarazo y la lactancia. Es necesario, muchas veces, aumentar la disponibilidad y consumo de grasas para superar los problemas de desnutrición proteica y energética. Las recomendaciones que se hagan a la población en relación con los rangos deseables de consumo de grasas pueden variar según las condiciones reinantes, especialmente los patrones de la alimentación y el predominio de enfermedades no transmisibles relacionadas con ella. Ingestión mínima recomendada para los adultos: Para la mayoría de los adultos, las grasas ingeridas en la alimentación deberían aportar al menos el 15 por ciento de su consumo energético. Las mujeres en edad fértil deberían obtener al menos el 20 por ciento de su necesidad energética en forma de grasas. Se deben realizar esfuerzos concertados para asegurar un adecuado consumo de grasas entre poblaciones en las que las grasas aportan menos del 15 por ciento de la energía alimentaria. Lactantes y niños pequeños. Tanto la cantidad como la calidad de las grasas ingeridas pueden afectar al crecimiento y desarrollo de los niños. Estas influencias se realizan a través de los niveles energéticos y de la acción de los ácidos grasos específicos y de varios componentes no glicéridos de las grasas. La leche materna aporta entre el 50 y el 60 por ciento de la energía en forma de grasas, y durante la etapa del destete (esto es, la transición desde el momento en que todo el alimento procede de la leche materna hasta aquél en que ningún alimento procede de ella), hay que tener cuidado para evitar que el consumo de grasas disminuya demasiado rápidamente, o por debajo de los niveles requeridos. El empleo de grasa, especialmente de aceites vegetales, en las comidas que se dan a los lactantes durante el destete ya los niños pequeños es un modo eficaz de mantener la densidad energética de sus dietas. El consumo de las cantidades adecuadas de ácidos esenciales también es importante para un crecimiento y desarrollo normal. El ácido araquidónico y el ácido docosahexanoico (ADH) son particularmente importantes para el desarrollo del cerebro, y la leche materna constituye una buena fuente de estos ácidos grasos. Los lactantes prematuros que han tenido un aporte intrauterino de ácido araquidónico y de ADH insuficiente, y que nacen con escasas reservas de grasa, presentan problemas especiales. Recomendaciones con respecto a la alimentación de lactantes y de niños pequeños: Los lactantes deberían alimentarse con la leche materna siempre que sea posible. La composición de los ácidos grasos de los preparados para lactantes debería corresponder a la cantidad y proporción de los ácidos grasos contenidos en la leche materna. Durante el destete, y al menos hasta la edad de dos años, la alimentación infantil debería contener del 30 al 40 por ciento de la energía en forma de grasas, y aportar unos niveles de ácidos grasos esenciales similares a los que se encuentran en la leche materna. Límites superiores de ingestión de grasas/aceites El consumo excesivo de grasas en la alimentación se ha relacionado con el aumento del riesgo de obesidad, de enfermedades coronarias del corazón, y de ciertos tipos de cáncer. Los mecanismos mediante los cuales se producen estas relaciones son complejos y variados, y, en muchos casos, no se han comprendido claramente. Los niveles elevados de colesterol sérico y de lipoproteínas de baja densidad (LDL) constituyen factores de alto riesgo de aterosclerosis y de enfermedades coronarias del corazón. El grado de riesgo de éstos y otros factores puede variar, entre otros, según: el tipo y nivel de consumo de ácidos grasos, el porcentaje de energía que aporta el total de las grasas, el colesterol presente en los alimentos, los niveles de lipoproteínas, el consumo de antioxidantes y de fibra, los niveles de actividad y el estado de salud. Una alimentación de bajo contenido de grasas suele tener un contenido reducido de colesterol y un contenido elevado de antioxidantes y fibra. En los adultos, el consumo de alimentos ricos en grasas no presenta ninguna ventaja nutritiva una vez que se han satisfecho las necesidades energéticas y nutritivas esenciales. Recomendaciones sobre límites superiores de ingestión de grasas alimentarias: Las personas activas que se encuentran en equilibrio energético pueden recabar de las grasas alimentarias hasta el 35 por ciento de su aporte energético total, si su aporte de ácidos grasos esenciales y de otros nutrientes es suficiente, y si el nivel de ácidos grasos saturados no supera el 10 por ciento de la energía que consumen. Los individuos que llevan a cabo una vida sedentaria no deberían consumir más del 30 por ciento de su energía en forma de grasas, especialmente si éstas son ricas en ácidos grasos saturados que proceden fundamentalmente de fuentes animales. Acidos grasos saturados e insaturados, y colesterol Los ácidos grasos saturados - láurico, mirístico y palmítico - elevan los niveles de colesterol y de las lipoproteínas de baja densidad (LDL) en el suero. El ácido esteárico no eleva los niveles séricos de colesterol o de LDL, aunque presenta otros efectos sobre la salud, hasta ahora indefinidos. El ácido linoleico, poliinsaturado, reduce moderadamente los niveles de colesterol y de LDL en el suero. El ácido oleico, monoinsaturado, presenta un comportamiento neutro respecto a las LDL, pero incrementa moderadamente el nivel de las lipoproteínas de alta densidad (HDL). El consumo de colesterol en la alimentación aumenta los niveles séricos de colesterol y de LDL, pero la magnitud de este aumento es muy variable. Recomendaciones sobre el consumo de ácidos grasos saturados e insaturados: La ingestión de ácidos grasos saturados no debería aportar más del 10 por ciento de la energía. La ingestión conveniente de ácido linoleico debería representar entre el 4 y el 10 por ciento de la energía. Se recomiendan consumos próximos al límite superior de esta gama cuando los consumos de ácidos grasos saturados y de colesterol sean relativamente elevados. Se aconseja una restricción razonable del consumo de colesterol (menos de 300 mg/día). Acidos grasos isoméricos A menudo, los aceites vegetales insaturados se hidrogenan parcialmente para producir grasas más sólidas, más plásticas o más estables. En este proceso se generan distintos isómeros en cis y en trans. A diferencia del ácido oleico, los isómeros en trans procedentes de aceites vegetales parcialmente hidrogenados tienden a elevar los niveles séricos de LDL y a reducir los de HDL. No es conveniente un consumo elevado de ácidos grasos en trans, pero hasta el momento no se sabe si es preferible utilizar ácidos grasos en trans o ácidos grasos saturados cuando se requiere este tipo de compuestos para la fabricación de productos alimenticios. Recomendaciones relativas a los ácidos grasos isoméricos: Los consumidores deberían sustituir con aceites líquidos y grasas blandas (esto es, aquellas que se mantienen blandas a temperatura ambiente) las grasas duras (más sólidas a temperatura ambiente), con el fin de reducir tanto los ácidos grasos saturados como los isómeros en trans de los ácidos grasos insaturados. Los elaboradores de alimentos deberían reducir los niveles de los isómeros en trans de los ácidos grasos que se generan en la hidrogenación. Los gobiernos deberían vigilar los niveles de ácidos grasos isoméricos en el abastecimiento de los alimentos. Los gobiernos deberían limitar declaraciones de propiedades relativas al contenido de ácidos grasos saturados de los alimentos que contienen cantidades apreciables de ácidos grasos en trans, y no deberían permitir que los alimentos con un contenido elevado de ácidos grasos en trans se etiqueten como productos con bajo contenido en ácidos grasos saturados. Sustancias relacionadas con las grasas y aceites Se dispone de datos fundados que indican que un consumo relativamente elevado de frutas y hortalizas -fuentes de varios antioxidantes, carotenoides y otros componentes no glicéricos-reducen el riesgo de enfermedades coronarias del corazón y de algunos tipos de cáncer. Basándose en los resultados actualmente disponibles, no se puede establecer todavía ninguna conclusión ni recomendación relativa a los beneficios generales de estas sustancias para la salud y al consumo conveniente de las mismas. Las técnicas de elaboración y refinado que se utilizan para eliminar o reducir las características negativas de los aceites comestibles también pueden conducir a la pérdida de varios componentes nutritivamente útiles, como los antioxidantes y los carotenoides. Sin embargo, los productores pueden minimizar dichas pérdidas utilizando unas técnicas adecuadas de elaboración, refinado y almacenamiento, y se les invita a hacerlo así. Recomendaciones sobre antioxidantes y carotenoides: En los países en que la carencia de vitamina A constituye un problema de salud pública, debe fomentarse la utilización de aceite de palma rojo, donde ya se disponga o sea posible adquirir. Si el aceite es refinado, se deben utilizar técnicas de elaboración que preserven el contenido de carotenoides y de tocoferol del aceite de palma rojo. Los niveles de tocoferol en los aceites comestibles deben ser suficientes para estabilizar los ácidos grasos insaturados presentes. Por lo tanto, los alimentos con alto contenido de poliinsaturados deben contener al menos 0,6 mg equivalentes de tocoferol por gramo de ácido graso poliinsaturado. En el caso de grasas ricas en ácidos grasos que contengan más de dos dobles enlaces tal vez se requieran niveles superiores. Acidos grasos esenciales Los ácidos grasos de n-6 y n-3 juegan papeles fundamentales en la estructura de la membrana y como precursores de los eicosanoides, que son compuestos potentes y muy reactivos. Diversos eicosanoides presentan efectos altamente divergentes, y frecuentemente opuestos, por ejemplo, sobre las células del músculo liso, la agregación plaquetaria, los parámetros vasculares (permeabilidad, contractibilidad) y sobre el proceso inflamatorio y el sistema inmunitario. Puesto que los ácidos grasos de n-6 y de n-3 compiten por las mismas enzimas pero tienen roles biológicos diferentes el equilibrio entre ellos en la alimentación puede ser considerablemente importante. Algunos estudios han mostrado que el consumo de alimentos (como pescados ricos en aceite) que contienen ácidos grasos de cadena larga de n-3, ácido eicosapentanoico (AEP) y (ADH), se asocia con una disminución del riesgo de enfermedades coronarias del corazón (ECC), probablemente debido a mecanismos que no se relacionan con el nivel de lipoproteínas en el suero. Los ácidos grasos esenciales son especialmente importantes para el crecimiento y desarrollo normales del feto y de los lactantes, y en particular, para el desarrollo del cerebro y de la agudeza visual. En mujeres bien nutridas, durante la gestación se depositan cada día aproximadamente 2,2 gramos de ácidos grasos esenciales en los tejidos materno y fetal. Recomendaciones relativas al consumo de ácidos grasos esenciales: La relación entre ácido linoleico y ácido -linolénico debería estar comprendida entre 5:1 y 10:1. A personas en que dicha relación sea superior a 10:1 debería estimularse a que consuman alimentos ricos en n-3, como hortalizas de hoja verde, legumbres, pescado, y mariscos. Se debería prestar especial atención a promover en las madres un consumo suficiente de ácidos grasos esenciales durante la gestación y la lactancia, a fin de recabar las cantidades necesarias para el desarrollo fetal y del lactante. Necesidades científicas y de programación Es necesario disponer de suficiente información sobre el estado nutricional, los aportes de la alimentación y la composición de los alimentos para elaborar y seguir de cerca programas de mejora de la nutrición, incluida la promoción de aportes adecuados de grasas y aceites en la alimentación. Los gobiernos y las autoridades sanitarias de todos los países deben conocer los riesgos en constante aumento de contraer enfermedades no transmisibles debidas a la adopción de prácticas dietéticas inadecuadas y de estilos de vida menos activos. Recomendaciones sobre la información dietética y sobre los requisitos de los programas: En los análisis sobre el contenido de ácidos grasos de los alimentos y en la elaboración de bases de datos de nutrientes deberían emplearse métodos normalizados y materiales de referencia. Debería disponerse y tenerse amplio acceso a datos apropiados de composición de los alimentos, identificándose cada partida mediante elementos descriptivos libres de ambigüedades. Debería utilizarse el factor de normalización de Atwater, de 9,0 kilocalorías (37,7 KJ) por gramo de grasa, para calcular el valor energético de las grasas en todas las encuestas de nutrición y tablas de composición de los alimentos. Es conveniente realizar encuestas periódicas sobre el estado del peso (índice de masa corporal) de los adultos en todos los países, con el fin de ayudar a identificar tendencias y poblaciones afectadas por situaciones de riesgo o expuestas a mayor riesgo de desnutrición, y enfermedades no transmisibles relacionadas con la alimentación, y para seguir de cerca los efectos de las intervenciones. Capítulo 2 - Composición de las grasas alimentarias Las grasas alimentarias incluyen todos los lípidos de los tejidos vegetales y animales que se ingieren como alimentos. Las grasas (sólidas) o aceites (líquidos) más frecuentes son una mezcla de triacilglicéridos (triglicéridos) con cantidades menores de otros lípidos. Los ácidos grasos presentes en varias moléculas de lípidos constituyen la parte con mayor interés nutritivo. Acidos grasos Los ácidos grasos más abundantes presentan cadenas lineales con un número par de átomos de carbono. Existe un amplio espectro de longitudes de cadena, que varían entre un ácido graso de la leche con cuatro átomos de carbono, y los ácidos grasos de algunos aceites de pescado, con 30 átomos de carbono. Son frecuentes los ácidos grasos con 18 átomos de carbono. Los dobles enlaces situados en la cadena de carbonos o los sustituyentes de la misma se designan químicamente asignando al carbono del grupo carboxilo la posición 1. Así, los dobles enlaces del ácido linoleico le proporcionan el nombre químico sistemático de ácido 9,12-octadecadienoico. Una abreviatura taquigráfica para designar el ácido linoleico sería 18:2 (18 átomos de carbono: dos dobles enlaces). Su último doble enlace se encuentra a seis átomos de carbono del metilo terminal, una característica importante para algunas enzimas. Este ácido se considera un ácido graso n-6 ó 6 (Figura 2.1). En este informe se utilizará la nomenclatura n-6. En el Cuadro 2.1 se presenta el nombre común (vulgar), el nombre químico sistemático y la abreviatura de varios ácidos grasos de la dieta. Los dobles enlaces de los ácidos grasos están en configuración cis. El primer miembro de la serie n-6 de los ácidos grasos es el ácido linoleico, y el primer miembro de la serie n-3 es el ácido linolénico (ácido 9, 12, 15-octadecatrienoico). Los ácidos grasos poliinsaturados n-6 y n-3 presentan dobles enlaces en cis separados por grupos metileno. Un doble enlace puede cambiar de configuración cis a trans (isomerización geométrica), o bien puede desplazarse a otra posición de la cadena de carbonos (isomerización posicional), según se ilustra en la Figura 2.2. El perfil de un ácido graso en trans es similar al de un ácido graso saturado. Como resultado de ésto, los ácidos grasos en trans presentan puntos de fusión más elevados que sus isómeros en cis. El isómero en trans puede considerarse como un intermedio entre el ácido graso insaturado en cis original, y un ácido graso completamente saturado. FIGURA 2.1 - Diagrama de ácidos grasos FIGURA 2.2 - Estructura en cis y en trans de los dobles enlaces Acilglicéridos. El tipo de ácido graso y la posición en la cual se esterifica a glicerol determinan las características de los acilglicéridos. Además de los glicéridos que presentan tres ácidos grasos esterificados, los diacilglícéridos (diglicéridos) y los monoacilglicéridos (monoglicéridos) también están presentes en los alimentos crudos o en los ingredientes de los alimentos (Figura 2.3). Se observan características específicas en cuanto a la posición que ocupan los ácidos grasos. Las grasas de reserva de origen animal tienden a presentar un ácido graso saturado en la posición 1 y un ácido graso insaturado en la posición 2. Los ácidos grasos de la posición 3 parecen presentar una distribución fortuita, aunque con frecuencia aquí se acumulan ácidos grasos poliinsaturados. CUADRO 2.1 Algunos ácidos grasos de los alimentos Nombre común cáprico láurico mirístico palmítico esteárico araquídico behénico lignocérico palmitoleico oleico gadoleico cetoleico erúcico nervónico linoleico -linolénico Nombre sistemático decanoico dodecanoico tetradecanoico hexadecanoico octadecanoico eicosanoico docosanoico tetracosanoico 9-hexadecenoico 9-octadecenoico 11-eicosaenoico 11-docasaenoico 13-docasaenoico 15-tetracosaenoico 9,12-octadecadienoico 9,12,15-octadecatrienoico -linolénico 6,9,12-octadecatrienoico dihomo- -linolénico 8,11,14-eicosatrienoico 5,8,11-eicosatrienoico araquidónico 5,8,11,14-eicosatetraenoico AEP 5,8,11,14,17-eicosapentaenoico adrénico 7,10,13,16-docosatetraenoico 7,10,13,16,19-docosapentaenoico ADP 4,7,10,13,16-docosapentaenoico ADH 4,7,10,13,16,19-docosahexaenoico Abreviatura Familia de ácido graso 10:0 12:0 14:0 16:0 18:0 20:0 22:0 24:0 16:1 n-7 18:1 n-9 20:1 n-9 22:1 n-11 22:1 n-9 24:1 n-9 18:2 n-6 18:3 n-3 18:3 n-6 20:3 n-6 20:3 20:4 20:5 22:4 22:5 22:5 22:6 n-9 n-6 n-3 n-6 n-3 n-6 n-3 Fosfolípidos Los fosfolípidos son componentes de la membrana que están presentes en los alimentos y aceites obtenidos por extracción. La estructura general de los fosfoglicéridos se muestra en la Figura 2.4. FIGURA 2.3 - Diagrama de acilglicéridos FIGURA 2.4 - Diagrama de fosfolípidos Normalmente, en la posición 1 se esterifica un ácido graso saturado, y en la posición 2 un ácido graso poliinsaturado. Los grupos polares que contienen fósforo y una base orgánica proporcionan a la molécula lipídica una región hidrofílica. Además de los fosfoglicéridos, los fosfolípidos incluyen esfingomielinas y cerebrósido, que se basan en la esfingosina en lugar del glicerol. Aunque los fosfolípidos constituyen sólo una pequeña fracción de la grasa total de la dieta, pueden constituir una fuente importante de ácidos grasos esenciales. Componentes no glicéridos La creciente constatación de la importancia de los componentes no glicéridos de los ácidos grasos, algunas veces denominados «constituyentes menores», obligó a incluir este tema en la consulta de expertos. Los componentes no glicéridos sólo son componentes menores en lo que se refiere a su concentración con respecto a los triacilglicéridos. La nueva información sobre estos constituyentes de las grasas procede de las mejoras en la capacidad de analizarlos y de los estudios de sus propiedades. Vitamina E. La vitamina E consiste en una mezcla de fenoles liposolubles caracterizados por una cabeza aromática de cromanol y una cadena lateral de 16 átomos de carbono. Los tocoferoles tienen una cola de hidrocarburo saturada, mientras que los tocotrienoles son sus análogos farnesilados y presentan una cola isoprenoide insaturada. El número y posición que los grupos metilo ocupan en el anillo de cromanol da lugar a los diferentes -, -, -, y -tocoferol y a los isómeros del tocotrienol (Figura 2.5). Los aceites vegetales y los productos elaborados con ellos contienen normalmente grandes cantidades de tocoferol, especialmente los isómeros , y . Además, algunos aceites vegetales, especialmente el aceite de palma (Qureshi et al., 1991a) y el aceite de salvado de arroz (Rogers et al., 1993), son fuentes muy ricas de tocotrienoles con una débil actividad como vitamina E, pero que actúan como antioxidantes y proporcionan estabilidad contra la oxidación. Carotenoides. Los carotenoides son hidrocarburos liposolubles altamente insaturados derivados del poliisopreno. Se sabe que en las grasas animales y vegetales están presentes más de 75 carotenoides diferentes. Los más frecuentes son los carotenos , y , la licopina, la luteína y las xantofilas (Figura 2.6). Los carotenoides y sus derivados son normalmente los que dan el color amarillo a rojo intenso a las frutas, hortalizas, cereales y aceite de palma bruto. Los carotenoides son los precursores de la vitamina A, presentando el -caroteno la mayor actividad de provitamina A. Vitaminas A y D. Una fuente tradicional de vitamina A es la grasa de la mantequilla. Los aceites de pescado constituyen la fuente normal de vitamina D. Las margarinas, que se enriquecen con vitaminas A y D por exigencias legales en la mayoría de los países, también contribuyen de forma importante a asegurar una ingestión adecuada de estos nutrientes. FIGURA 2.5 - Diagrama del tocoferol y del tocotrienol FIGURA 2.6 Diagrama del -caroteno y del -caroteno Otros componentes Esteroles. El colesterol es el principal esterol de los productos animales. Los principales esteroles de las plantas son el -sitosterol, el campesterol y el estigmasterol, aunque se sabe que existen algunos otros (Formo et al., 1979); en la Figura 2.7 se muestran las cadenas laterales del colesterol y de algunos esteroles de las plantas. Se encuentran en forma libre o bien esterificados con otros compuestos como los ácidos grasos, los glucósidos o el ácido ferúlico (oxizanol). El contenido de esterol de las grasas y aceites alimentarios oscila entre el 0,01 y el 2 por ciento (Itoh, Tamura y Matsumoto, 1973a). Alcoholes derivados del metilesterol y del triterpeno. Los esteroles metilados en la posición OH-4 están presentes en los aceites vegetales comunes en concentraciones del 0,01 al 0,4 por ciento, presentando el aceite de salvado de arroz y el aceite de sésamo los niveles más elevados (Itoh, Tamura y Matsumoto, 1973b). Las correspondientes concentraciones de alcoholes triterpénicos, incluidos los de cinco anillos de ciclohexano condensados, son del 0,01 al 1,2 por ciento. El aceite de salvado de arroz es el único que se encuentra en el nivel superior. Escualeno. El hidrocarburo predominante en las grasas alimentarias es el escualeno. Es un intermediario en la síntesis del esterol a partir del acetato, y se encuentra en cantidades particularmente elevadas en algunos aceites de pescado y en el aceite de oliva. En la mayoría de los aceites vegetales, la concentración se encuentra por debajo de 30 mg/100 g (Formo et al., 1979). Orizanoles. Los orizanoles son compuestos que constan de ácido ferúlico esterificado con varios esteroles vegetales y con alcoholes triterpénicos (Figura 2.8). Aunque se encuentran grandes cantidades en el salvado de arroz crudo y en el aceite de linaza, los orizanoles no se encuentran ampliamente distribuidos en otros aceites (Id.). FIGURA 2.7 - Colesterol y algunos esteroles vegetales FIGURA 2.8 - Estructura química del orizanol (ester 24-metilen-cicloartanol del ácido ferúlico) Capítulo 3 - Aspectos sobre la digestión y el metabolismo de las grasas Digestión, absorción y transporte La mayor parte de las grasas alimentarias se suministran en forma de triacilglicéridos, que se deben hidrolizar para dar ácidos grasos y monoacilglicéridos antes de ser absorbidos. En niños y en adultos, la digestión de las grasas se produce de forma eficaz y casi completa en el intestino delgado. En los recién nacidos, la secreción pancreática de lipasas es baja. En los bebés, la digestión de las grasas mejora gracias a las lipasas segregadas por las glándulas de la lengua (lipasa de la lengua) y una lipasa presente en la leche materna. El estómago interviene en el proceso de digestión de las grasas debido a su acción agitadora, que ayuda a crear emulsiones. Las grasas que entran en el intestino se mezclan con la bilis y posteriormente se emulsionan. La emulsión es entonces tratada por las lipasas segregadas por el páncreas. La lipasa pancreática cataliza la hidrólisis de los ácidos grasos de las posiciones 1 y 3, generando 2-monoacilglicéridos (Tso, 1985). Los fosfolípidos son hidrolizados por la fosfolipasa A2, y los principales productos son lisofosfolípidos y ácidos grasos libres (Borgstrom, 1974). Los ésteres del colesterol son hidrolizados por la hidrolasa de ésteres de colesterol pancreática. Los ácidos grasos libres y los monoglicéridos son absorbidos por los enterocitos de la pared intestinal. En general, los ácidos grasos con longitudes de cadena inferiores a 14 átomos de carbono entran directamente en el sistema de la vena porta y son transportados hacia el hígado. Los ácidos grasos con 14 o más átomos de carbono se vuelven a esterificar dentro del enterocito y entran en circulación a través de la ruta linfática en forma de quilomicrones. Sin embargo, la ruta de la vena porta también ha sido descrita como una ruta de absorción de los ácidos grasos de cadena larga (McDonald et al., 1980). Las vitaminas liposolubles (vitaminas A, D, E y K) y el colesterol son liberados directamente en el hígado como una parte de los restos de los quilomicrones. Las enfermedades que perjudican a la secreción biliar, como la obstrucción biliar o los trastornos de hígado, conducen a graves deficiencias en la absorción de las grasas, como también sucede con las enfermedades que afectan a la secreción pancreática de las enzimas con actividad de lipasa, como la fibrosis cística. Como resultado, los triglicéridos con longitudes de cadena medias pueden tolerarse mejor en las personas que presentan una absorción deficiente de las grasas, y frecuentemente se utilizan como fuente de energía en la alimentación. La absorción intestinal completa de los lípidos puede verse afectada marginalmente por cantidades elevadas de fibra en la dieta. La absorción de las grasas se ilustra en la Figura 3.1. FIGURA 3.1 - Influencia de las grasas alimentarias en el metabolismo de las lipoproteínas Los ácidos grasos son transportados en la sangre como complejos de albúmina o como lípidos esterificados en las lipoproteínas. Estas consisten en un núcleo de triacilglicéridos y ésteres ácidos grasos de colesterol, y un revestimiento formado por un estrato de fosfolípidos en el que se encuentran esparcidas moléculas de colesterol sin esterificar. Las cadenas plegadas de una o más apolipoproteínas se extienden por encima de la superficie y, con los fosfolípidos anfipáticos, permiten que los lípidos del núcleo sean transportados por la sangre. También regulan la reacción del conjunto lipídico con enzimas específicas, o unen las partículas a los receptores superficiales de las células. Los quilomicrones son partículas lipoproteicas que proceden de las grasas alimentarias y son empaquetadas por las células de la mucosa. Entran en el torrente sanguíneo a través de los vasos linfáticos. La lipasa de lipoproteínas, que se encuentra en la pared interior de los capilares sanguíneos, hidroliza los triglicéridos, liberando ácidos grasos. Estos entran en el tejido adiposo, donde se almacenan, y en los músculos, donde se utilizan como combustible. Los restos de los quilomicrones son depurados por el hígado durante las primeras horas que suceden a la ingestión de una comida que contiene grasas. Las lipoproteínas de muy baja densidad (VLDL) son partículas de gran tamaño ricas en triacilglicéridos que se producen en el hígado a partir de la grasa endógena, a diferencia de los quilomicrones, que transportan grasa exógena. Las VLDL son los principales portadores de triacilglicéridos que también son elaborados por la lipasa de lipoproteínas y proporcionan ácidos grasos a los tejidos adiposo y muscular. Las lipoproteínas de baja densidad (LDL) son los productos finales del metabolismo de las VLDL. Su núcleo está formado principalmente por ésteres de colesterol y su superficie sólo presenta un tipo de apolipoproteína, apoB. Cerca del 60-80 por ciento del colesterol plasmático es transportado por las LDL. Los valores medios de LDL varían entre distintas poblaciones debido a factores genéticos y ambientales, siendo sin embargo la alimentación el principal factor determinante de estos valores. Las lipoproteínas de alta densidad (HDL) transportan el 15-40 por ciento del colesterol del plasma. Probablemente se forman en el torrente circulatorio a partir de precursores generados en el hígado y en el intestino. La principal apolipoproteína de las HDL es apoA-1. En los seres humanos, las LDL conducen el colesterol al hígado, y las HDL pueden transferirlo a otras partículas LDL lipoproteicas. Existen pruebas de que las HDL protegen activamente las paredes de los vasos sanguíneos (Consenso del NIH, 1993). No se sabe si la manipulación de los niveles de HDL a través de la alimentación afecta al desarrollo de la aterosclerosis. La lipoproteína(a) o Lp(a) es un complejo de LDL con apolipoproteína(a). Esta apoproteína presenta una homología de secuencia con la proenzima plasminógeno, que interviene en la disolución de los coágulos de sangre (Scanu y Scandiani, 1991). La concentración de la Lp(a) viene determinada principalmente por factores genéticos. Metabolismo de los ácidos grasos Los ácidos grasos saturados y monoinsaturados pueden biosintetizarse a partir de hidratos de carbono y proteínas. Los ácidos grasos insaturados pueden ser sustratos de las desaturasas y de las elongasas, como se muestra en el esquema de conversión de las familias de ácidos grasos n-9, n-6 y n-3 (Figura 3.2). Los primeros miembros de cada familia de ácidos grasos (ácidos oleico, linoleico y linoleico) compiten por la misma 6-desaturasa, cuya velocidad de conversión aumenta con el número de dobles enlaces. Esta enzima limitante de la velocidad se encuentra bajo el control de muchos factores dietéticos y hormonales (Brenner, 1989; 1990), y se cree que es importante en la síntesis de 22:6 n-3. Este tipo de efecto puede explicar por qué las ingestiones elevadas de ácido linoleico reducen el nivel de 22:6 n-3. De un modo similar, la actividad 5-desaturasa está modulada por factores dietéticos y hormonales. Los miembros C20 y C22 de las familias n-6 y n-3 pueden inhibir antes la desaturación en la secuencia de la conversión de los ácidos grasos (Fisher, 1989). Parece que la desaturación de la posición 4 no implica ninguna otra desaturasa específica, sino una elongación seguida de la acción de la 6-desaturasa, ambos procesos microsomales, seguidos de una retroconversión por la ruta de la -oxidación peroxisomal (Voss et al., 1991). La desaturación es por tanto un proceso basado en la cooperación intracelular. El significado nutricional de este papel adicional de la 6- desaturasa todavía debe evaluarse. Las actividades de las elongasas parecen ser mayores que las de las desaturasas (Sprecher, 1989). FIGURA 3.2 - Secuencia de conversiones de los ácidos grasos insaturados Acidos grasos esenciales Los ácidos grasos esenciales son aquellos que deben suministrarse en la alimentación, e incluyen miembros tanto de la serie n-6 como de la serie n-3. Cuando en la alimentación hay deficiencia de ácido linoleico, el ácido graso insaturado más abundante en los tejidos, el oleico, es desaturado y elongado para dar ácido eicosatrienoico, n-9, del que normalmente sólo se encuentran trazas. La acumulación de este ácido graso se considera un indicio de deficiencia de ácidos grasos (Holman, 1970). Cuando la alimentación tiene un bajo contenido de ácidos grasos n-3, en relación con los n-6, se produce una reducción de 22:6 n-3 junto con una acumulación compensatoria de 22:5 n-6 en los tejidos (Galli, Agradi y Paoletti, 1974). El producto más abundante de la ruta n-6 es el ácido araquidónico que se encuentra en los glicerofosfolípidos, donde se esterifica selectivamente en la posición 2. Los alimentos que contienen grasas de origen animal proporcionan cantidades apreciables de ácido araquidónico preformado. Se ha puesto en duda la eficacia de la ruta n-3 en los seres humanos. Sin embargo, los estudios realizados en seres humanos sobre la conversión de ácidos linoleico y linolénico deuterados en sus derivados de cadena larga han mostrado que la eficiencia de la conversión de linoleico en araquidónico era del 2,3 por ciento, mientras que la conversión del -linolénico en su derivado de cadena larga era del 18,5 por ciento (Emken et al., 1992). Estos valores de conversión, medidos como productos acumulados en el plasma, se obtuvieron en personas que habían ingerido cantidades relativamente bajas de ácido linoleico (alrededor del 5 por ciento). Cuando la alimentación contenía alrededor del 9 por ciento de ácido linoleico, las conversiones se reducían al 1 por ciento en el caso del linoleato y al 11 por ciento en el del linolenato. Estos datos indican que en los adultos se produce la síntesis de los metabolitos de n-3 a partir de 18:3. El aceite de pescado, que en comparación con el aceite de linaza es rico en ácido eicosapentanoico, aumenta en gran medida la concentración de derivados de cadena larga en la sangre humana (Sanders y Roshanai, 1983). En las plaquetas y otras células de la sangre sólo se alcanzan niveles elevados de ácido eicosapentanoico y docosapentanoico cuando se ingieren como tales en la alimentación. Los ácidos grasos n-3, así como los ácidos grasos n-6, se incorporan a la posición 2 de los fosfolípidos de membrana. Los ácidos grasos poliinsaturados de los fosfolípidos de membrana proceden de los alimentos o de mentes endógenas. Su disponibilidad está influida por la desacilaciónreacilación, en particular en la posición 2 de los fosfolípidos (Lands et al., 1982), por la especificidad de las kinasas de diacilglicéridos en la síntesis de los fosfolípidos (McDonald et al., 1988), y por el remodelado de los fosfolípidos donadores y aceptores. En todos estos procesos, existe competición entre los ácidos grasos de las series n-6 y n-3. La importancia del ácido linoleico se demostró en estudios realizados con ratas. Cuando las ratas se alimentaban con alimentos carentes de grasas, empezaban a aparecer síntomas específicos que se evitaban suministrando ácido linoleico. La deficiencia en ácido linoleico, una condición poco común en los seres humanos, se había descrito en niños a los que se proporcionaban alimentos carentes de grasas (Hansen et al., 1963). En los niños, empezaban a aparecer trastornos de la piel similares a los que se producían en las ratas y se curaban por administración de ácido linoleico. Para evitar la acumulación de ácido eicosatrienoico (20:3 n-9), la cantidad de ácido linoleico que se requiere en la alimentación es de aproximadamente el 1 por ciento del aporte energético. Esto es aplicable a todas las especies animales probadas. Aportes comprendidos entre el 4 y el 10 por ciento de la energía son los consumidos normalmente por distintos grupos de población, y estos parecen ser compatibles con el estado de salud óptimo. La deficiencia de ácido linoleico puede surgir como condición secundaria de otras alteraciones, como desnutrición proteico-energética o absorción deficiente de las grasas, o como consecuencia de una nutrición parenteral total con aportes insuficientes de ácido linoleico. En condiciones de aporte adecuado de ácido linoleico, el cociente entre trieno y tetraeno está por debajo de 0,2 (Mohrhauer y Holman, 1963). La deficiencia de ácido linoleico se puede evaluar mejor mediante un perfil de todos los ácidos poliinsaturados del suero (Holman y Johnson, 1981). El ácido graso n-3, ácido docosahexanoico (ADH, 22:6), está presente en grandes concentraciones en el sistema nervioso central, en las membranas celulares y en el sistema visual (Tinoco, 1982; Neuringer et al., 1984; Bourre et al., 1989). Más adelante en este informe se discutirá el papel del ADH para tener una función neuronal óptima y agudeza visual, relacionándolo con las primeras etapas del desarrollo. El equilibrio entre los ácidos grasos n-6 y n-3 de la alimentación es importante dada su naturaleza competitiva y sus funciones biológicas esenciales y diferentes. Se ha sugerido que las cantidades relativas de ácido linoleico y -linolénico presentes en la alimentación deben estar por debajo de 10:1. Funciones biológicas Estructura de la membrana. Los ácidos grasos insaturados en los lípidos de membrana juegan un importante papel para mantener la fluidez (Lynch y Thompson, 1984). En la piel, el ácido linoleico tiene un papel específico, uniéndose a algunos ácidos grasos de cadena muy larga (C30-C34) en las acil-ceramidas. Estas forman una matriz intracelular para mantener la barrera de permeabilidad epidérmica (Hansen y Jensen, 1985). En las membranas, las interacciones entre lípidos y proteínas pueden depender de un ácido graso poliinsaturado específico. Este parece ser el caso de los segmentos externos de los bastoncillos de los mamíferos que son muy ricos en ácido docosahexanoico. Se han destacado tres ejemplos de interacciones entre lípidos y proteínas que controlan las funciones metabólicas de las membranas: el primero, las propiedades catalíticas de las proteínas de transporte; el segundo, actividades de enzimas como la Ca/Mg ATPasa del retículo sarcoplasmático, la adenilato ciclasa y la 5-nucleotidasa, en las que influyen los niveles de ácidos grasos n-6 y n-3 de los lípidos de membrana (Kinsella, 1990); y el tercero, las enzimas que intervienen en el ciclo de los fosfoinosítidos. Este ciclo, asociado con las respuestas de muchas células frente a una amplia gama de hormonas, neurotransmisores y factores de crecimiento celular, da lugar, a partir de la activación de una fosfolipasa C específica, a dos importantes segundos mensajeros: inositol 1,4,5-trifosfato (IP3), y diacilglicéridos. El IP3 es el encargado de modular los iones calcicos del citosol. El diacilglicérido, junto con los iones calcicos y la fosfatidil serina, interviene en la activación de una proteína kinasa C que fosforila varias proteínas intracelulares. Puesto que los polifosfoinosítidos son muy ricos en ácido araquidónico en la posición 2, el diacilglicérido generado a partir de ellos es también muy rico en este ácido graso. Una lipasa que actúe sobre el diacilglicérido puede en consecuencia liberar ácido araquidónico que podrá convertirse en eicosanoides. El ciclo de los fosfoinosítidos controla algunos procesos de la división celular. Por tanto, la modulación del ciclo influye en la tasa de división de las células en la respuesta inmunitaria y en el crecimiento tumoral. Los ácidos grasos poliinsaturados de la alimentación y la proporción de ácidos grasos n-6 y n-3 parecen afectar al ciclo de los fosfoinosítidos. Formación de los eicosanoides. Los ácidos grasos n-6 y n-3 que forman parte de los fosfolípidos de membrana ejercen un control metabólico a través de su papel de precursores de los eicosanoides. Estos compuestos altamente activos de 20 átomos de carbono son liberados en cantidades muy pequeñas para actuar rápidamente en su entorno inmediato. Tras ser degradados enzimáticamente, los productos derivados de los eicosanoides que se encuentran en la orina son un índice de la producción corporal. El primer paso de la biosíntesis de los eicosanoides consiste en la liberación de un ácido graso poliinsaturado de 20 átomos de carbono por acción de las fosfolipasas sobre los fosfolípidos, principalmente una fosfolipasa A2 o bien sobre los diacilglicéridos que se producen en el ciclo del fosfato de inositol. La secuencia de los eicosanoides consiste en derivados hidroxilados de los ácidos grasos poliinsaturados de 20 átomos de carbono: (a) productos cíclicos, generados por una ciclo-oxigenasa, incluyendo prostaglandinas, prostaciclinas y tromboxano; (b) productos de la lipoxigenasa como los derivados de la 12-lipoxigenasa, especialmente los productos de la 5-lipoxigenasa conocidos como leucotrienos; y (c), productos de la actividad del citocromo P450 (Figura 3.3). Los eicosanoides son en general muy potentes, sus efectos son muy diversos, y la acción de unos eicosanoides es con frecuencia contraria a la de otros diferentes. Además, los patrones de producción de los eicosanoides son diferentes en las distintas células y tejidos. Entre los eicosanoides más activos se encuentra el tromboxano A2 (TxA2), derivado del ácido araquidónico y producido en las plaquetas y otras células a través de la ruta de la ciclo-oxigenasa. Este eicosanoide es un agente proagregante de plaquetas y de contracción del músculo liso, y se inactiva rápidamente originando tromboxano B2. La prostaciclina, producida mediante la ciclo-oxigenasa en las células de las paredes de los vasos sanguíneos, es un agente anti-agregante de las plaquetas y vasodilatador. Otros productos de la ruta de la ciclo-oxigenasa (como PEG2 y PGF2a) ejercen diversos efectos sobre las células del músculo liso, sobre las células inmunocompetentes, y así sucesivamente. Entre los productos de la ruta de la lipoxigenasa, los leucotrienos, producidos fundamentalmente por los leucocitos, actúan sobre los parámetros vasculares (permeabilidad, contractibilidad), y presentan propiedades quimiotácticas. Intervienen en la modulación de los procesos inflamatorios e inmunitarios. FIGURA 3.3 - La secuencia de los eicosanoides Los ácidos grasos poliinsaturados de 20 átomos de carbono y distintos grados de insaturación dan lugar a eicosanoides con distinto número y patrones de insaturación, y con actividades biológicas algo diferentes. Puesto que el ácido araquidónico (20:4 n6) es el principal ácido graso poliinsaturado celular, la serie 2 de los eicosanoides es la más abundante y generalmente la más activa. Cuando se incorpora a los lípidos celulares un ácido graso poliinsaturado de 20 átomos de carbono con distinto número de dobles enlaces, por ejemplo, ácido di-homo-gamma linolénico (ADGL), 20:3 n-6, o ácido eicosapentanoico (AEP), 20:5 n-3, se producen respectivamente eicosanoides de la serie 1 o de la serie 3. Estos ácidos grasos también compiten con el ácido araquidónico por la ciclo-oxigenasa, y por lo tanto reducen la formación de eicosanoides de la serie 2. El AEP favorece la formación de eicosanoides de la serie 3 e inhibe la formación de eicosanoides de la serie 2. Efectos sobre otros intermediarios derivados de los lípidos. El resultado de la hidrólisis de determinados fosfolípidos celulares es la formación de otros compuestos biológicamente activos adicionales como el agente de activación de las plaquetas, FAP. Este compuesto deriva de la 1-alquil, 2-acil fosfatidil colina. El FAP es un agente proinflamatorio sumamente poderoso, y un potente activador de varios tipos de células además de las plaquetas. Aunque los datos sobre los efectos de varios ácidos grasos en la ruta del FAP son limitados, se ha demostrado que la incorporación del ácido araquidónico a los fosfolípidos celulares potencia la producción del FAP (Suga et al., 1991). Los distintos ácidos grasos poliinsaturados de la posición 2 de los fosfolípidos precursores pueden modificar la formación del FAP como se demostró con la reducida producción del FAP por los monocitos de individuos que habían recibido ácidos grasos n-3 (Sperling et al., 1987). Los efectos opuestos de los ácidos grasos n6 y n-3 pueden explicar algunas influencias de los ácidos grasos poliinsaturados sobre la función de ciertas células (Id.). Efectos sobre otros parámetros. Los ácidos grasos n-3 parecen afectar a muchos otros procesos, como la producción de citoquinas y de otros factores. Las citoquinas son una familia de proteínas producidas y liberadas por las células implicadas en los procesos inflamatorios y en la regulación del sistema inmunitario. Incluyen las interleukinas y los factores de necrosis tumoral. El mecanismo mediante el cual los ácidos grasos n-3 afectan a la síntesis de las citoquinas no está claro, pero algunos estudios han demostrado un efecto sobre los niveles de ARNm, lo que sugiere un nivel de acción pretraslacional. Los efectos de los ácidos grasos sobre la expresión de genes que codifican enzimas que intervienen en el metabolismo de los lípidos, así como sobre la expresión de genes que actúan en la regulación del crecimiento celular (genes de respuesta temprana inmediata) representan un importante aspecto adicional en los papeles biológicos de los ácidos grasos poliinsaturados. Parece que los ácidos grasos pueden interaccionar con un grupo de proteínas receptoras nucleares que se unen a ciertas regiones del ADN, alterando por tanto la transcripción de los genes reguladores. Gran parte de la literatura relacionada con los ácidos grasos de cadena larga n-3 trata sobre dosis farmacológicas o se refiere a las lipoproteínas y su relación con las enfermedades coronarias del corazón. Se deben estimular otros estudios clínicos y metabólicos adicionales. Oxidación de los ácidos grasos Los ácidos grasos que no se utilizan para sintetizar eicosanoides ni se incorporan a los tejidos se oxidan para producir energía. Los ácidos grasos proporcionan energía a través de la beta oxidación que tiene lugar en las mitocondrias de todas las células, excepto las del cerebro y las del riñon. Entran en la mitocondria en forma de los correspondientes derivados de acil carnitina. Los ácidos grasos saturados de cadena corta, media y larga se someten al primer paso de la beta oxidación con distintas deshidrogenasas. El proceso va generando sucesivamente moléculas de acetil-CoA que entran en el ciclo de los ácidos tricarboxílicos o en otras rutas metabólicas. El producto final de los ácidos grasos con un número par de átomos de carbono es el acetato. Los ácidos grasos insaturados requieren dos pasos enzimáticos más que los ácidos grasos saturados para cambiar los dobles enlaces en cis a trans y para desplazarlos de la posición alfa a la beta. Aún así, la oxidación de los ácidos grasos insaturados, incluidos el ácido linoleico, es tan rápida o más que la del ácido palmítico. La reacción de la oxidación inicial es realizada por una enzima distinta de la que se encuentra en las mitocondrias; el acil-CoA graso entra directamente en esta organela. El proceso no conduce a la producción completa de acetato, sino que a la mitocondria se transfiere un ácido graso acortado para completar la oxidación. Los ácidos grasos de cadena larga (>20C) son oxidados preferentemente por los peroxisomas; también los ácidos grasos con menos de 14C se oxidan mediante este sistema. La oxidación peroxisomal es normalmente menos eficaz que la mitocondrial y produce más calor. Este tipo de oxidación puede inducirse con alimentos de alto contenido en grasas, así como con una gran variedad de xenobióticos. Capítulo 4 - Tendencias globales sobre la disponibilidad de los aceites y grasas comestibles Los consumidores se ven con frecuencia atraídos por los alimentos cuyas texturas y sabores derivan de las grasas. Aunque existen diferencias según las regiones, la temporada y los hábitos alimentarios, normalmente los consumidores aumentan la proporción de grasas de su alimentación a medida que aumentan sus ingresos. El aumento de la cantidad y el cambio de la calidad de las grasas y aceites presentan importantes consecuencias en la nutrición. Al debatir las tendencias globales sobre la disponibilidad de las grasas alimentarias, los datos que aparecen en este capítulo se refieren a las cantidades de grasas y aceites disponibles para el consumo humano. Estos datos proceden de las Hojas de Balance de Alimentos de la FAO que se preparan basándose en estadísticas relacionadas con la producción, comercio, almacenamiento, y utilización no alimenticia. Consumo actual de grasas En 1990, la cantidad total de grasas alimentarias disponibles en todo el mundo se estimó en 68 gramos por persona y por día. Sin embargo, esta cifra media no revela las grandes disparidades entre regiones geográficas. Mientras que en Asia y Africa la cantidad total de grasas disponible era menor de 50 gramos por persona y por día, en Sudamérica era de 74 gramos por persona y por día. En la ex URSS, la cantidad de grasas disponible era de 107 gramos por persona y por día. En América del Norte y Central, la cantidad total de grasas disponible era de 126 gramos por persona y por día, mientras que en Europa era de 143 gramos por persona y por día. Por último, en Oceanía se disponía de 121 gramos por persona y por día (FAO, 1993b). Cuando los países se clasifican según el nivel de desarrollo económico, aparecen más claramente las diferencias en cuanto a la disponibilidad total de grasas entre los distintos grupos (Cuadro 4.1). En los países desarrollados, la disponibilidad diaria de grasas por persona era de 128 gramos, mientras que en los países en desarrollo no excedía de los 49 gramos. En Africa (excluyendo Egipto, Libia y Sudáfrica), la disponibilidad de grasas y aceites es baja, mientras que en América del Norte el nivel disponible de grasas es elevado. Dentro de cada uno de estos dos grupos económicos, existen grandes diferencias en la disponibilidad total de grasas según regiones y países. Países como Rwanda, Camboya y Bangladesh disponen de menos de 20 gramos por persona y por día, mientras que Irlanda, Dinamarca, Luxemburgo y Bélgica tienen más de 170 gramos por persona y por día (Id.). CUADRO 4.1 - Disponibilidad de grasas y relación grasas/energía según grupos económicos (1961-90) Región EN DESARROLLO Africa Lejano Oriente Cercano Oriente América Latina DESARROLLADOS Ex URSS Oceanía Europa América del Norte Grasas g/persona/día 1961 1990 28 50 38 43 22 45 46 72 51 75 93 128 69 107 125 138 104 143 124 151 Aumento entre 1961-90 % 78 13 105 56 47 38 55 10 37 22 Relación media grasas/energía 1961 1990 13 18 16 18 11 16 19 22 20 25 28 34 20 28 36 36 32 37 37 37 Fuente: Hojas de Balance de Alimentos de la FAO, Agrostat PC, 1993. En el Cuadro 4.2 se describe la situación en distintos países durante el período 198890. Setenta y dos países, que representan más del 63 por ciento de toda la población de la que se dispone de datos, disponían de menos de 60 gramos de grasas al día por habitante. La relación grasas/energía (RGE) es la proporción de energía alimentaria que proviene de la grasa total. En los distintos países, la REG varía entre el 7 y el 46 por ciento. En los cuadros 4.1 y 4.2 se muestran las medias de las RGE de los países pertenecientes a distintas regiones del mundo. Los datos precedentes de las encuestas sobre el consumo de alimentos tienden a confirmar estas tendencias y patrones de uso de las grasas, y en algunos casos demuestran situaciones incluso más extremas. En Viet Nam, por ejemplo, se vio que el consumo medio de grasas y aceites era muy bajo (FAO, 1990). La REG que se calculó basándose en las encuestas sobre el consumo era del 6 por ciento, mientras que según las Hojas de Balance de Alimentos era del 11 por ciento. En algunas zonas de Viet Nam (como las «Tierras Altas»), los datos de estas encuestas indican que el consumo de grasa y la RGE son incluso menores. Por otra parte, el proyecto MONICA indicó que en Alemania la RGE de los varones superaba el 50 por ciento, si se excluía el alcohol del aporte energético (Colling et al., 1989). CUADRO 4.2 - Grasas totales disponibles por persona y por día y relación media de grasas/energía en 165 países (1988-90) Número de Número de Categorías según grasas totales Relación media países 9 63 64 29 habitantes miles 299 164 3 035 746 1 197 754 752 318 por persona/día 1988-90 gramos <30 30-59,9 60-119,9 120 y más grasas/energía porcentaje 10 18 27 38 Fuente: Hojas de Balance de Alimentos y población de la FAO, Agrostat PC, 1993. Factores que explican las tendencias de consumo Las Hojas de Balance de Alimentos de la FAO muestran que la disponibilidad de grasas para el consumo humano ha aumentado rápidamente, tanto en los países desarrollados como en los que están en desarrollo (Figura 4.1). Entre 1961 y 1990, la disponibilidad total de grasas aumentó desde 49 hasta 68 gramos por persona y por día. En los países desarrollados, la cantidad de grasas disponible aumentó de 93 a 128 gramos, mientras que en los países en desarrollo el incremento fue de 28 a 49 gramos. Aun cuando el aumento de la disponibilidad de las grasas me el doble en los países en desarrollo que en los países desarrollados, seguía existiendo una gran diferencia en cuanto a la disponibilidad de grasas según el nivel de desarrollo económico. Dentro de las regiones en desarrollo, las tasas de aumento han variado (Cuadro 4.1). En 1961, la disponibilidad de grasas del Lejano Oriente era inferior a la de Africa. Desde entonces, la disponibilidad ha aumentado sensiblemente, y ahora es mayor que en Africa. La disponibilidad de grasas en Oceanía ya era elevada en 1961, y el aumento ha sido menor. Hace 30 años, la disponibilidad de grasas en Africa era baja, y su aumento ha sido bajo. Ingresos. El primer factor que explica estos cambios son los ingresos, indicador básico del desarrollo económico. La disponibilidad de grasas animales y vegetales está estrechamente relacionada con los ingresos (Perissé, Sizaret y François, 1969). En la Figura 4.2 se ilustra la influencia del Producto Interno Bruto (PIB) per capita en la disponibilidad de los alimentos en 134 países. FIGURA 4.1 - Disponibilidad de grasas por persona/día en los países desarrollados yen desarrollo* (1961-1990) En los países cuyos ingresos están comprendidos entre 150 y 350 dólares de EE.UU. anuales se ha producido un aumento constante de la disponibilidad de las grasas. En los países cuyos ingresos anuales per capita se encuentran entre 350 y 7 000 dólares de EE.UU. se ha producido un sensible aumento de la grasa total disponible, mientras que en los países cuyos ingresos por persona son de alrededor de 7 000 dólares de EE.UU., la disponibilidad de grasas se ha mantenido en los mismos niveles. En los países cuyos ingresos per capita son inferiores a 7 000 dólares de EE.UU., el consumo tanto de grasas animales como vegetales ha aumentado en tasas similares. Por encima de los 900 dólares de EE.UU., la disponibilidad de grasas animales ha aumentado rápidamente. En realidad, la disponibilidad de grasas vegetales disminuye cuando los ingresos per capita sobrepasan los 7 000 dólares de EE.UU. Las encuestas sobre el consumo de alimentos confirman esta tendencia, especialmente en países como Bangladesh (Hassan y Ahmad, 1992) o el Brasil [Instituto Brasileiro de Geografía e Estadistica (IBGE), 1978], en los que el PIB per cápita es bajo. En estos países, la pobreza es el principal factor que limita el consumo de grasas, especialmente las de origen animal. Estilos de vida urbanos. La urbanización está fuertemente relacionada con el consumo creciente de grasas en los países en desarrollo. Este es un fenómeno general que forma parte del cambio global en los hábitos alimentarios. En Bangladesh, por ejemplo, el consumo de grasas en las zonas urbanas es dos o tres veces mayor que en las zonas rurales (Hassan y Ahmad, 1992). Lo mismo sucede en Níger, donde el consumo de las zonas urbanas es dos o tres veces mayor que en las zonas rurales, dependiendo de la estación [Comité Inter-état de Lutte contre la Sécheresse dans le Sahel (CILSS), 1991]. En Níger, la RGE de los habitantes de las zonas rurales es del 7 por ciento, mientras que en los habitantes que se han desplazado recientemente de zonas rurales a zonas urbanas, es del 14 por ciento. Entre las personas que viven permanentemente en Niamey, la capital de Níger, es del 19 por ciento (Id.). Una encuesta realizada en el Brasil en 1974-75 (IBGE, 1978) muestra una clara relación entre la urbanización y el consumo de grasas, independientemente de las regiones climáticas (Figura 4.3). El aumento de la RGE, que normalmente se aprecia a medida que las zonas se van urbanizando, es sorprendente, ya que los aportes energéticos tienden a disminuir con la urbanización, debido a la reducción de la actividad física. FIGURA 4.2 - Grasas disponibles según los ingresos per capita de 134 países (1989) Otros factores. El entorno ambiental, la disponibilidad local de grasas y aceites, los hábitos alimentarios y el nivel educativo son otros factores que afectan al nivel de consumo de grasas. Otros factores personales y sociológicos afectan también al consumo de grasas. Las Hojas de Balance de Alimentos indican que durante la última década ha empezado a disminuir la disponibilidad de grasas de origen animal, especialmente en muchos países desarrollados del norte de Europa, América del Norte y Oceanía. Las encuestas sobre consumo de alimentos confirman esta evolución (Stephen y Wald, 1990; Den Hartog, 1992). FIGURA 4.3 - Relación grasas/energía en zonas rurales, suburbanas y metropolitanas de 5 regiones brasileñas Los análisis de los datos sobre el consumo de grasas revelan que en la mayoría de los países desarrollados, las personas pertenecientes a los grupos socioeconómicos más bajos consumen más alimentos grasos (Departamento de Salud de Nueva Escocia, 1993). Los estudios muestran que los hombres consumen más ácidos grasos que las mujeres, y que los jóvenes comen más alimentos grasos que las personas de edad (Hulshof et al., 1991; Read et al., 1989; Popkin, Haines y Patterson, 1992; Departamento de Salud de Nueva Escocia, 1993). Todos estos factores afectan a la cantidad total de grasas consumida. Además, en los países desarrollados la selección de los alimentos está cada vez más relacionada con el tipo de grasa contenido en ellos. Cambios en el consumo de grasas Según las Hojas de Balance de Alimentos de la FAO (FAO, 1993b), las grasas visibles aportan cerca de la mitad de la grasa disponible en el mundo (Cuadro 4.3). Además, los aceites de origen vegetal aportan un porcentaje considerablemente mayor de grasas visibles que los de origen animal. El porcentaje de grasas visibles de origen animal es superior en los países desarrollados, excepto en América del Norte (Canadá y Estados Unidos de América). Según los datos relativos a 165 países, la disponibilidad de grasas animales ha disminuido o se ha mantenido en el mismo nivel en 102 países. En los Emiratos Arabes Unidos, Noruega, Finlandia, Reino Unido, Irlanda, Canadá, Australia, Dinamarca, Estados Unidos de América y Países Bajos, se ha reducido el consumo de grasas animales. Esta tendencia se hace más acusada a finales de los años ochenta. Por el contrario, el aumento mayor (de 8 a 17 gramos por persona y por día) se ha registrado en los países de Europa oriental, Cuba, Bélgica, Luxemburgo, Italia, Francia y Cabo Verde. CUADRO 4.3 Contribución de grasas y aceites según grupos de alimentos en 1990 REGION Mundo Africa Lejano Oriente Cercano Oriente América Latina URSS Oceanía Europa América del Norte Porcentaje de las grasas totales Grasas totales Grasas visibles Grasas invisibles g/persona/día Vegetales Animales Carne Leche Cereales Cultivos Otros oleaginosos 68,3 36 11 23 9 8 5 8 43,1 48 4 9 5 16 10 8 44,6 35 6 24 6 13 9 7 72,3 49 7 11 7 13 4 9 75,4 43 9 22 10 7 3 6 106,8 137,8 142,8 151,0 25 20 30 39 22 18 20 9 26 40 28 27 12 13 12 14 5 2 3 2 1 2 1 3 9 5 6 6 Fuente: Hojas de Balance de Alimentos de la FAO, Agrostat PC, 1993. A nivel mundial, en 1990 las fuentes vegetales aportaron 24 gramos de aceite por persona y por día, mientras que los animales proporcionaron 6 gramos de grasa visible por persona y por día. De los 165 países, todos excepto 12 experimentaron aumentos en la disponibilidad de aceites vegetales a partir de 1961 (FAO, 1993). En 1990, 65 países disponían de más de 30 gramos de aceite vegetal por persona y por día, y otros 6 países (Malasia, Túnez, España, Italia, Israel y Grecia) disponían de más de 60 gramos por persona y por día. En la Figura 4.4 se muestra el cambio en la disponibilidad de aceites vegetales en distintas regiones del mundo. Si bien cada país presenta determinadas variedades de aceite, sólo algunos aceites tienen importancia mundial. Entre los principales aceites comerciales, el suministro de aceite de soja ha aumentado de 2,2 a 7 gramos por persona y por día, mientras que la disponibilidad de aceite de girasol ha aumentado de 1,3 a 3,5 gramos por persona y por día. El suministro de aceite de colza se incrementó de 0,9 a 3,4 gramos por persona y por día, y la disponibilidad de aceite de palma aumentó de 0,9 a 2,9 gramos por persona y por día. El suministro de aceite de cacahuete (maní) permaneció aproximadamente igual (2 gramos por persona y por día) durante las tres últimas décadas (FAO, 1993). El contenido de ácidos grasos esenciales es particularmente interesante. El aceite de soja contiene menos ácido linoleico que el aceite de girasol. Sin embargo, ambos aceites proporcionan cantidades suficientes de ácido linoleico. Por otra parte, los ácidos grasos esenciales de la familia n-3 pueden ser suministrados por los aceites vegetales que contienen ácido -linolénico, como los aceites de canola y de soja, y por los aceites de pescado que contienen ácidos grasos de cadena larga. Los aceites de pescado no se muestran como artículos independientes en las Hojas de Balance de Alimentos porque en muchos países se consumen como parte del pescado. Sólo algunos países disponen de cantidades significativas de aceites de pescado. Siete países presentan más de 2 gramos por persona y por día. FIGURA 4.4 - Cambios en la disponibilidad de aceites vegetales en las regiones desarrolladas y en desarrollo Conclusión Durante las tres últimas décadas ha aumentado constantemente la disponibilidad de grasas en el mundo, especialmente en los países en desarrollo. Sin embargo, en comparación con los países desarrollados, el consumo de grasas sigue siendo bajo en aquéllos. En los países en desarrollo, las familias rurales, que con frecuencia son los miembros más pobres de la sociedad, tienen una alimentación con bajo contenido de grasas, debido a sus bajos ingresos y a su limitado acceso a aportes diversificados de alimentos. La desnutrición constituye un problema crucial y el aumentar la cantidad de energía disponible debe constituir una prioridad. Las grasas y aceites juegan un papel fundamental para conseguir este aumento. Sin embargo, en los países en desarrollo las políticas diseñadas para favorecer este aumento pueden constituir un factor de riesgo para las poblaciones urbanas, que tienen una alimentación con exceso de grasas. En algunos países desarrollados, especialmente en Europa, la disponibilidad de ácidos grasos poliinsaturados es baja en comparación con los ácidos grasos saturados, porque la cantidad de grasas animales disponibles es más del doble que la de grasas vegetales. En 12 países, la disponibilidad de grasas animales es de más de 30 gramos por persona y por día. Los países más desarrollados han conseguido niveles de consumo de grasas muy elevados. Algunos de estos países muestran una tendencia a disminuir el consumo de grasas, fundamentalmente de grasas visibles de origen animal, que son ricas en ácidos grasos saturados. Esta nueva tendencia está ligada a las políticas aplicadas por los países más desarrollados (especialmente América del Norte y Europa septentrional), que pretenden mejorar los modelos de consumo actuales, especialmente reduciendo los consumos de ácidos grasos saturados y aumentando los de ácidos grasos poliinsaturados. En estos países, las grasas visibles proporcionan más de 70 gramos por persona y por día. Las políticas destinadas a mejorar la calidad de las grasas y aceites pueden ser eficaces con la colaboración de las industrias alimentarias. Capítulo 5 - Elaboración y refinado de aceites comestibles La elaboración puede eliminar los componentes de los aceites comestibles que menoscaban el sabor, la estabilidad, el aspecto o valor nutritivo. En la medida de lo posible, la elaboración debe conservar los tocoferoles y evitar cambios químicos en los triglicéridos. Producción rural de aceite vegetal La extracción rural de aceite se produce normalmente cerca de las zonas de producción de las materias primas. Esto supone productores en pequeña escala que tienen acceso a las materias primas, ayuda a asegurar que las semillas de aceite perecederas se elaboran rápidamente, y reduce los costos de transporte. En las comunidades rurales o urbanas pobres, los aceites vegetales sin refinar contribuyen considerablemente a la cantidad total de aceite consumido. Los aceites crudos son asequibles a los grupos con bajos ingresos y son una importante fuente de carotenos y tocoferoles. Para mantener la calidad de la materia prima, es necesario proceder con cuidado durante y después de la cosecha de los frutos oleaginosos perecederos y susceptibles de que sus grasas se descompongan. Las magulladuras en los frutos frescos de la palmera aceleran la actividad de las lipasas, conduciendo a la degradación de las grasas. Las semillas oleaginosas, como las nueces de butirospermo, tienden a enmohecerse durante el almacenamiento. Esto se frena con un tratamiento térmico: tratamiento con vapor o hervido, junto con secado al sol para reducir la humedad. Almacenamiento. La humedad de las semillas oleaginosas y nueces influye en gran medida en la calidad de las materias primas. En la mayoría de las operaciones rurales, el secado al sol reduce la humedad de las semillas de aceite por debajo del 10 por ciento. Una adecuada ventilación o aireación de las semillas o nueces durante el almacenamiento asegura que se mantengan niveles bajos de humedad y evita el desarrollo microbiano. Esto es importante en el almacenamiento del maní que es muy susceptible de contaminarse con aflatoxinas debidas al crecimiento de Aspergillus flavus. Puesto que las aflatoxinas y los plaguicidas no se eliminan con las técnicas de extracción rural, debe evitarse la contaminación microbiana y el empleo de insecticidas. Es necesario adoptar prácticas de almacenamiento que sean asequibles y disponibles para los productores en pequeña escala. Las materias primas perecederas, como los frutos de la palmera, deben elaborarse tan pronto como sea posible después de la cosecha. En los países en desarrollo húmedos, el secado al sol de las semillas oleaginosas que tienen una humedad elevada, como el coco maduro, es lento e ineficaz. Estas condiciones favorecen el crecimiento de mohos, lo que produce elevados niveles de ácidos grasos libres y características organolépticas pobres. El aceite de coco destinado al consumo humano debe obtenerse poco después de la cosecha. Pretratamiento. La primera operación después de la cosecha implica esterilización y tratamiento térmico con vapor o cocimiento, lo que inactiva las enzimas lipolíticas que pueden ocasionar una rápida degradación del aceite y facilita el flujo del mesocarpio para extraer el aceite. La pulpa de los frutos de la palmera «esterilizados» se extrae en un triturador o un mortero de madera, o en un digestor mecánico. El descortezado o pelado separa la porción portadora de aceite de la materia prima, y elimina las partes con poco o ningún valor nutritivo. Se puede disponer de peladoras mecánicas pequeñas para las almendras, pero sigue predominando el pelado manual. La mayoría de las semillas oleaginosas y nueces se someten a un tratamiento térmico de tostado para licuar el aceite presente en las células de la planta y facilitar su liberación durante la extracción. Todas las semillas oleaginosas y nueces se someten a este tratamiento excepto los frutos de la palmera, en los que la «esterilización» reemplaza este tratamiento. Para aumentar la superficie y optimizar el rendimiento en aceite, se reduce el tamaño de la parte portadora de aceite del maní, girasol, sésamo, coco, almendra de palma y semilla de butirospermo. En las operaciones rurales se suelen emplear molinos mecánicos de fricción por discos. Extracción. En la extracción del aceite, las semillas molidas se mezclan con agua caliente y se hierven para permitir que el aceite flote y sea recogido. Las semillas molidas se mezclan con agua caliente para hacer una pasta que se amasa a mano o a máquina hasta que el aceite se separa en forma de emulsión. En la extracción del aceite de maní, se suele añadir sal para hacer que las proteínas coagulen y favorecer la separación del aceite. Los grandes trituradores rotatorios en sistemas de mortero fijo pueden moverse mediante motor, hombres o animales, proporcionando fricción y presión a las semillas oleaginosas para liberar el aceite en la base del mortero. Hay otros sistemas tradicionalmente utilizados en la extracción rural de aceite que emplean piedras pesadas, cuñas, palancas y cuerdas retorcidas. Para presionar, se aprieta manualmente una placa o un pistón dentro de un cilindro perforado que contiene la masa de aceite molida o su pulpa por medio de un tornillo. El aceite se recoge debajo de la cámara perforada. Se han diseñado diversos expeledores mecánicos. La materia prima precalentada se alimenta en un cilindro horizontal mediante un estrangulador ajustable, la presión interna que se crea en el cilindro produce la ruptura de las células que contienen el aceite, y lo liberan. Deshidratación. Las trazas de agua presente en el aceite crudo se eliminan hirviéndolo en calderos poco profundos, después de depositarlo en ellos. Esto es frecuente en todas las técnicas rurales que reconocen el papel catalítico del agua en el desarrollo de rancidez y de características organolépticas pobres. Tortas de prensado. El subproducto de la elaboración, las tortas de prensado, puede resultar útil, dependiendo de la técnica de extracción que se emplee. Las tortas oleaginosas a las que se ha extraído el agua carecen normalmente de nutrientes. Otras técnicas tradicionales, como por ejemplo la que se utiliza con el maní y la copra, aseguran que los subproductos, si se manipulan con cuidado, sean idóneos para el consumo humano. Tecnologías tradicionales. En muchos países son muy importantes los procedimientos tradicionales para producir aceite, especialmente en las comunidades que tienen fácil acceso a las materias primas oleaginosas. La elaboración tradicional tiende a ser ecológicamente inocua, y la destreza que se requiere consiste en las actividades de una familia o grupo, en que intervienen sobre todo las mujeres. En un ambiente industrial cambiante, estos factores positivos han tenido menos peso que los aspectos negativos de la elaboración tradicional, como pequeña capacidad de producción, pobre economía de escala, altos desembolsos de energía y tiempo, y coste de transporte de los aceites a los mercados. Producción en gran escala Almacenamiento. Muchas de las fases de elaboración industrial tienen su origen en los procedimientos tradicionales. En las operaciones en gran escala, las semillas oleaginosas se secan hasta obtener una humedad inferior al 10 por ciento. Se pueden almacenar durante períodos prolongados de tiempo en condiciones adecuadas de aireación, tomando precauciones contra las infestaciones de insectos y roedores. Este tipo de almacenamiento reduce la infección por mohos y la contaminación con micotoxinas, y minimiza el proceso de degradación biológica que conduce a la aparición de ácidos grasos libres y de color en el aceite. Las frutas oleaginosas, como la aceituna y la palma, deben tratarse tan pronto como sea posible. La palma se esteriliza como primer paso de la elaboración. Los tejidos adiposos y las materias primas procedentes del pescado (esto es, el cuerpo o el hígado) se derriten durante las primeras horas haciéndolos hervir para destruir las enzimas y evitar el deterioro del aceite. Elaboración. Las semillas oleaginosas generalmente se limpian de sustancias extrañas antes de ser descortezadas. Las almendras se muelen para reducir su tamaño y se cuecen con vapor, y el aceite se extrae mediante un torno o una presa hidráulica. La torta de la prensa se desprende en escamas para la posterior extracción de las grasas residuales con disolventes, como el hexano «de uso alimentario». El aceite puede extraerse directamente con disolventes de los productos con bajo contenido en aceite, tales como la soja, el salvado de arroz y el maíz. Después de la esterilización, se extrae la pulpa (digestión) antes de someterla a presión mecánica a menudo en una prensa de torno. Las almendras de palma se extraen de la torta de prensado y se vuelven a elaborar para obtener el aceite. Los tejidos animales se reducen de tamaño antes de derretirlos con procesos secos o húmedos. Después de un tratamiento en autoclave, los tejidos de pescado se prensan y la suspensión aceite/agua se centrífuga para separar el aceite. Refinado del aceite. El refinado produce un aceite comestible con las características deseadas por los consumidores, como sabor y olor suaves, aspecto limpio, color claro, estabilidad frente a la oxidación e idoneidad para freír. Los dos principales sistemas de refinado son el refinado alcalino y el refinado físico (arrastre de vapor, neutralización destilativa), que se emplean para extraer los ácidos grasos libres. El método clásico de refinado alcalino comprende normalmente las siguientes etapas: 1a etapa Desgomado con agua para eliminar los fosfolípidos fácilmente hidratables y los metales. a 2 etapa Adición de pequeñas cantidades de ácido fosfórico o cítrico para convertir los restantes fosfolípidos no hidratables (sales de Ca, Mg) en fosfolípidos hidratables. 3a etapa Neutralización de los ácidos grasos libres con un ligero exceso de solución de hidróxido sódico, seguida de la eliminación por lavado de los jabones y de los fosfolípidos hidratados. a 4 etapa Blanqueo con tierras minerales naturales o activadas con ácido para adsorber los compuestos coloreados y para descomponer los hidroperóxidos. 5a etapa Desodorización para eliminar los compuestos volátiles, principalmente aldehídos y cetonas, con bajos umbrales de detección por el gusto y el olfato. La desodorización es fundamentalmente un proceso de destilación con vapor que se lleva a cabo a bajas presiones (2-6 mbares) y elevadas temperaturas (180-220 °C). En algunos aceites, como el de girasol o el de salvado de arroz, se obtiene un producto claro de mesa mediante una etapa de eliminación de las ceras o de cristalización de los ésteres de ceras a baja temperatura, seguida de una filtración o centrifugación. El proceso de neutralización alcalina tiene importantes inconvenientes, el rendimiento es relativamente bajo y se producen pérdidas de aceite debido a la emulsión y saponificación de los aceites neutros. También se genera una cantidad considerable de efluente líquido. Los jabones se disocian generalmente con ácido sulfúrico, recuperándose los ácidos grasos libres junto con sulfato sódico y vapor de agua ácida que contiene grasa. En el refinado físico, los ácidos grasos se eliminan mediante un procedimiento de destilación al vapor (arrastre) similar a la desodorización. La baja volatilidad de los ácidos grasos (que depende de la longitud de la cadena) requiere temperaturas más elevadas que las requeridas sólo para la desodorización. En la práctica, una temperatura máxima de 240-250 °C es suficiente para reducir el contenido de ácidos grasos libres a niveles de alrededor del 0,05-0,1 por ciento. Un requisito previo del refinado físico es que se eliminen los fosfátidos hasta un nivel inferior a los 5 mg de fósforo/kg de aceite. En el proceso de refinado clásico, este nivel se consigue fácilmente en la etapa de neutralización, pero se requiere un proceso especial de desgomado para el refinado físico de las semillas oleaginosas con alto contenido en fosfátidos. Estos procedimientos se basan en una hidratación mejorada de los fosfolípidos mediante un contacto íntimo entre el aceite y una solución acuosa de ácido cítrico, ácido fosfórico y/o hidróxido sódico, seguida de blanqueo (Segers y van de Sande, 1988). Es improbable que las condiciones de reacción suave empleadas durante el desgomado y la neutralización induzcan cambios significativos indeseables en la composición del aceite. Por el contrario, algunas impurezas, incluidos compuestos oxidados, trazas de metales y materiales coloreados se eliminan parcialmente por arrastre con los fosfolípidos y con el depósito de jabón. Estas impurezas se reducen posteriormente durante el blanqueo. La neutralización también contribuye considerablemente a eliminar contaminantes, tales como las aflatoxinas y los organofosforados. (Thomas, 1982). Los plaguicidas organoclorados y los hidrocarburos aromáticos policíclicos, si están presentes, deben eliminarse durante la etapa de desodorización/arrastre y mediante un tratamiento con carbón activo. Suelen producirse pérdidas de tocoferoles y esteroles durante la etapa de neutralización alcalina, pero, sin embargo, en condiciones bien controladas (minimizando el contacto con el aire) esta pérdida no supera el 5-10 por ciento (Gertz, 1988; Johansson y Hoffmann, 1979). Posibles reacciones secundarias durante el procesamiento a alta temperatura La posibilidad de que las elevadas temperaturas de la desodorización y arrastre tengan efectos negativos ha sido motivo de preocupación. En algunos estudios se emplearon unas condiciones extremas de temperatura y tiempo (incluso con libre acceso de aire) para generar resultados cuantitativos significativos. Sin embargo, los resultados de los estudios en modelos deberían estar relacionados con las condiciones prácticas de los procesos. Ya en 1967-79, la Sociedad Alemana de Investigación sobre las Grasas (DGF) definió los límites superiores de las condiciones de desodorización [240 °C para 2 horas, 270 °C para 30 min (Fremdstoff-Kommission, 1973; Gemeinschaftsarbeiten, 1992)]. Un buen hábito de manipulación también supone lo siguiente: empleo de equipos de acero inoxidable; deaireación cuidadosa a < 100 °C antes de calentar a la temperatura final de arrastre; utilización de corrientes libres de oxígeno; y especificaciones de alimentación estrictas (normalmente: 0,1 Fe, 0,01 Cu, 5P, tierras de blanqueo 5 mg/kg de aceite como máximo). Las investigaciones en las que se maltrataba el aceite en condiciones extremas (Rossel, Kochhar y Jawad, 1981; Jawad, Kochhar y Hudson, 1983a, b; 1984) determinaron los efectos de la temperatura (240-300 °C) y del tiempo (30-180 min.) en el refinado físico del aceite de soja (desgomado con ácido fosfórico y ligeramente blanqueado, pero conteniendo todavía 20 mg de P, 0,35 mg de Fe y 0,05 mg de Cu por kg de aceite). En la Figura 5.1 se muestra el fuerte efecto de la temperatura sobre la formación de ácidos grasos en trans y de compuestos polimíricos. El tiempo tiene también un efecto significativo. A 280-300 °C, hubo muestras de una apreciable inter o intraesterificación (aumento en el contenido de ácidos grasos saturados en la posición 2 de los triacilglicéridos); también se formaron cantidades importantes de ácidos grasos conjugados. Las áreas sombreadas indican la gama habitual de condiciones de elaboración requeridas para el refinado físico (270 °C para 30 min; 250 °C para 1 h; 240 °C para 2 h; 220 °C para 3 h). En estas condiciones, todos los cambios inducidos por el tratamiento a altas temperaturas parecen ser relativamente insuficientes. FIGURA 5.1 - Formación de diversos artefactos en el aceite de soja en condiciones extremas de tratamiento térmico Isomerización cis-trans. Uno de los parámetros más sensibles que se utiliza para detectar los cambios químicos resultantes de unas condiciones de elaboración severas es la isomerización cis-trans, especialmente en el ácido linoleico. El estudio más completo realizado sobre este tema ha sido el de Eder (1982), que investigó con varios aceites la formación de isómeros geométricos a escala de laboratorio, planta piloto, y de producción. A escala de laboratorio, con aceite de soja sin blanquear a 240 °C, la formación de los isómeros C18:3 (determinada por GLC) era insignificante (menos del 1 por ciento, incluso después de 5 h, frente al 3 por ciento a 260 °C). En la Figura 5.2 se describe el contenido total de isómeros trans (determinado por espectroscopia de infrarrojos) en diversos aceites desodorizados en equipo de acero inoxidable a escala de planta experimental. Los datos muestran un fuerte efecto de la temperatura, especialmente entre 240 y 270 °C, y confirman la tendencia general. Esto es, incluso en aceites altamente insaturados que contengan ácido linoleico, la formación de isómeros en trans es lenta en las condiciones recomendadas para la desodorización/refinado químico industrial (por ejemplo, 250 °C como máximo). En conclusión, en la gama de temperaturas de 240-250 °C, la cantidad de ácidos grasos en trans que se forman a partir de los aceites insaturados es de alrededor del 1 por ciento o menos por hora. Este dato concuerda con los que se han considerado anteriormente (Rossel, Kochhar y Jawad, 1981; Jawad, Kochhar y Hudson, 1983b). Calentar los aceites al aire, en condiciones de fritura simulada, ha conducido a tipos similares de ácidos grasos isomerizados (Grandgirard, Sebedio y Fleury, 1984; Grandgirard y Juillard, 1987; Sebedio, Grandgirard y Provost, 1988). FIGURA 5.2 - Formación de ácidos grasos en trans durante la desodorización a alta temperatura de diversos aceites No se ha descrito la formación de isómeros de posición (esto es, dobles enlaces desplazados a lo largo de la cadena de ácidos grasos) del ácido linoleico y linolénico en condiciones de desodorización/refinado físico. Dimerízación y polimerización. En la Figura 5.1 se han incluido datos cuantitativos sobre la formación de compuestos poliméricos en el aceite de soja blanqueado (Jawad, Kochhar y Hudson, 1983b). Hasta cerca de 260 °C, su tasa de formación parece ser baja; alrededor de 260 °C, el aumento es más rápido. Tendencias similares fueron observadas por Eder (1982). Sólo a 270 °C se observó un aumento rápido de la cantidad de triacilglicéridos. La desodorización del aceite de soja a escala comercial (2 x 51 min a 240 °C) dio como resultado un aumento entre el 0,5 y el 0,8 por ciento de los triacilglicéridos poliméricos. Cuando la temperatura se elevó a 270 °C en una de las bandejas del desodorizador, se encontró un 1,5 por ciento de polímeros. Esto sugiere que el contenido en dímeros y polímeros de triacilglicéridos de los aceites y grasas debidamente refinados normalmente no supera el 1 por ciento en peso. Strauss, Piater y Sterner (1982) realizaron estudios toxicológicos en ratones alimentados con concentrados (24 ó 96 por ciento) de dímeros (incluidos polímeros) de triacilglicéridos aislados a partir de aceite de soja que se había desodorizado a 220 °C durante 3,5 h y a 270 °C durante 1 h, y que contenía un 1,5 por ciento en peso de dímeros. Se vio que la toxicidad aguda era baja, con una DL50 de aproximadamente 18 g/kg de peso corporal. La administración del concentrado de dímeros durante un período largo de tiempo (12 meses, 15 por ciento en peso del concentrado al 24 por ciento en la dieta) no reveló ninguna diferencia significativa con respecto al grupo de control. Se vio que la absorción de los dímeros de ácidos grasos era bajo. Por lo tanto, la presencia de pequeñas cantidades de dímeros y polímeros en los aceites elaborados no parece presentar problemas fisiológicos. Pérdidas físicas Durante la desodorización o el refinado físico se eliminan los compuestos volátiles del aceite mediante la combinación de altas temperaturas, bajas presiones y arrastre con un gas inerte (vapor). El grado de eliminación depende de las propiedades físicas de los componentes (especialmente tensión de vapor) y de la temperatura y volumen de vapor que se hace pasar a través del aceite. Algunas pérdidas físicas son muy convenientes, tales como la eliminación de los malos olores, plaguicidas y compuestos aromáticos policíclicos, si existieran. Otras pérdidas de compuestos con valor nutritivo, como tocoferoles y esteroles, son potencialmente indeseables. Se han dado datos cuantitativos sobre la composición de los destilados del desodorizador y la eliminación de varios tipos de contaminantes de los aceites durante la desodorización (Chaudry, Nelson y Perkins, 1978; Larsson, Eriksson y Cervenka, 1987; Sagredos, Sintra-Roy y Thomas, 1988; Gemeinschaftarbeiten, 1990). Durante la desodorización a alta temperatura o el refinado físico, especialmente, las concentraciones de plaguicidas organoclorados (lindano, DDT, etc.), si se hallan presentes en el aceite de blanqueo, se reducen a niveles muy bajos. Los hidrocarburos aromáticos policíclicos (HAP) han constituido motivo de preocupación desde que se detectaron en algunos tipos de grasas y aceites sin refinar en los años sesenta. Un ejemplo de esto lo constituye el aceite de coco obtenido de la copra secado con gases de humos sin purificar. Según el número de anillos aromáticos, los hidrocarburos aromáticos policíclicos se pueden clasificar como ligeros (3-4 anillos) o pesados (5 o más anillos). Algunos de estos compuestos poseen propiedades carcinogénicas comprobadas, como el benzo- -pireno. Los hidrocarburos policíclicos ligeros pueden eliminarse en el proceso de desodorización o refinado físico, mientras que los hidrocarburos aromáticos policíclicos pesados sólo pueden eliminarse por adsorción sobre carbón activo (Chaudry, Nelson y Perkins, 1978; Larsson, Eriksson y Cervenka, 1987). Este tratamiento, que puede combinarse con el tratamiento de blanqueo, es eficaz para reducir la concentración de compuestos aromáticos policíclicos a niveles aceptables. Es inevitable que se produzcan algunas pérdidas por evaporación de tocoferoles y esteroles durante la desodorización y refinado físico a alta temperatura. Sin embargo, tienen pesos moleculares mayores y volatilidades inferiores a las de los ácidos grasos libres y a las de los hidrocarburos policíclicos aromáticos. En consecuencia, si se eligen bien las condiciones de elaboración, las pérdidas de tocoferoles y esterolesno tienen por qué ser severas. En algunos estudios en modelos se han empleado condiciones extremas para inducir efectos más drásticos. En la Figura 5.3 se ilustran los resultados característicos obtenidos con aceite de soja (Rossell, Kochhar y Jawad, 1981; Jawad, Kochhar y Hudson, 1984). Tras 2 h a 300 °C (un tratamiento drástico), los tocoferoles y esteroles desaparecían casi completamente, mientras que la reducción efectiva durante el refinado físico a 240 °C durante 120 min sólo es del 1520 por ciento. Las pérdidas totales del refinado (incluido el pretratamiento) son de aproximadamente el 25-35 por ciento. Muchos investigadores proporcionan datos similares para muchos aceites. Las pérdidas tienden a ser mayores en el refinado físico que en el alcalino debido a que son más elevadas las temperaturas de arrastre. En condiciones extremas, puede darse cierto grado de isomerización del -sitosterol, y cada tocoferol (, , , ) y esterol puede comportarse de diferente modo cuando se expone a altas temperaturas (Jawad, Kochhar y Hudson, 1984). Sin embargo, en condiciones más realistas estos fenómenos son menos importantes. La composición en tanto por ciento de las fracciones de tocoferol y esterol permanece prácticamente invariable durante la elaboración (Gemeinschaftarbeiten, 1990; Jung, Mood y Min, 1989). En los aceites refinados, como el de girasol, semilla de algodón, y colza, un límite superior del 30-35 por ciento de las pérdidas de tocoferoles durante la elaboración completa seguiría satisfaciendo el criterio generalmente aceptado de equivalentes de -tocoferol/ácido linoleico 0,6 mg/g (Jager, 1975). El aceite de soja, que tiene un elevado contenido de -tocoferol y por lo tanto se protege bien in vitro, tiene un contenido relativamente bajo de -tocoferol, y no puede alcanzar este valor. El -caroteno del aceite de palma es otro componente valioso que debe tenerse en cuenta en el proceso de refinado. Se están diseñando procesos especiales de retención. Los aceites de oliva y de sésamo se utilizan sin refinar, ya que los consumidores cuentan con su sabor específico. FIGURA 5.3 - Reducción del contenido de tocoferol (A) y esterol (B) del aceite de soja durante el blanqueo y tratamientos térmicos intensos (tiempo = 2 horas) Procesos de modificación de las grasas Hidrogenación. La hidrogenación de las grasas y aceites comestibles se ha realizado en gran escala desde principios de siglo. El proceso se lleva a cabo en un sistema trifásico (gas hidrógeno, aceite líquido y catalizador sólido), a temperaturas que varían desde unos 120 °C hasta unos 220 °C como máximo en las etapas finales de reacción. El catalizador consiste en pequeños cristales de níquel soportados por un óxido inorgánico, normalmente sílice o alúmina. Tras la reacción, se filtra el catalizador y se eliminan todas las trazas de níquel residual después del refinado, hasta conseguir un nivel de 0,1 mg/kg o inferior. La hidrogenación consiste en una serie de reacciones consecutivas con una cinética de reacción de pseudo primer orden: K3 K2 K1 18:3 18:2 18:1 18:0 en que K3, K2 y K1 son las constantes de velocidad de reacción de los ácidos linolénico, linoleico y oleico respectivamente. En casi todas las hidrogenaciones, el ácido linolénico se transforma en compuestos menos saturados. Dependiendo de las condiciones de reacción, puede cambiar considerablemente el llamado Cociente de Selectividad (K2/K1); así, con catalizadores de níquel, varía de aproximadamente 10 a bajas temperaturas a 50 ó 100 a altas temperaturas. Un cociente de selectividad elevado supone que se forma relativamente poco ácido saturado, y que los ácidos grasos monoinsaturados son el principal producto de reacción. Aparte de la reducción de la insaturación, durante la hidrogenación también se da una isomerización de los dobles enlaces: isomerización geométrica (cis-trans), y de posición. Los mecanismos de hidrogenación y de isomerización se relacionan estrechamente (Koritala y Dutton, 1973; Rozendaal, 1976). Inicialmente se forma un intermedio mediohidrogenado, en el que la molécula adsorbida a la superficie del catalizador con un enlace sencillo puede rotar libremente. La adición de un segundo átomo de hidrógeno saturaría el enlace, mientras que la sustracción de un átomo de hidrógeno del estado intermedio mediohidrogenado de la superficie del níquel produce o bien la molécula original o bien un isómero de posición o geométrico. La hidrogenación de los ácidos grasos polienoicos se produce, al menos parcialmente, a través de isómeros conjugados (por ejemplo, c9, t11 o t10, c12), que son muy reactivos y por tanto se convierten rápidamente en ácidos monoenoicos en cis o en trans sin acumularse. De la cantidad total de ácidos grasos en trans presentes en los aceites de grasas hidrogenados, la mayor parte son, con mucha diferencia, los monoenos en trans. Dada la importancia del papel de la hidrogenación en la producción de grasas plásticas, los ácidos grasos en trans se pueden encontrar en importantes cantidades en muchos productos. La cantidad de dienos cis, trans y trans,cis es mucho menor, y el nivel de dienos trans,trans raramente supera el 1 por ciento (Gottenbos, 1983). Aparte de la hidrogenación, existen otras dos importantes tecnologías de modificación de grasas. La primera es la interesterificación, el reordenamiento al azar de los ácidos grasos en la molécula del triglicérido, bajo la influencia de un catalizador moderadamente alcalino. Esto modifica el comportamiento de la grasa frente a la fusión, sin que cambie la naturaleza de sus ácidos grasos. La segunda es el fraccionamiento, la separación controlada de las fracciones de aceite/grasa a temperaturas bajas (fraccionamiento en seco) los disolventes (fraccionamiento con disolventes). En este proceso no se dan cambios en la naturaleza química de los ácidos grasos. El aceite de palma se fracciona en palmoleína y palmestearina. Interrelaciones entre las tecnologías de modificación de grasas. En la industria se emplean varios aceites y grasas intercambiables, conservando una calidad constante. Generalmente se elige la combinación menos cara de materias primas que sea compatible con la calidad requerida. La hidrogenación amplía en gran medida el número de grasas disponibles que poseen un comportamiento determinado frente a la fusión, lo que aumenta la capacidad de intercambio y disminuye los costos. En situaciones en que no se da hidrogenación, la combinación de la interesterificación, el fraccionamiento y la selección del aceite inicial pueden constituir soluciones aceptables para limitar la formación de isómeros en términos de calidad del producto, pero sin embargo los costos son mayores. Si bien las modificaciones específicas reales, como la hidrogenación o la interesterificación son relativamente baratas, los costos de las pérdidas de flexibilidad pueden ser considerablemente mayores. Los procesos de modificación de aceites pueden cambiar a medida que se pueda disponer de nuevas composiciones mediante la biotecnología de las plantas (Sommerville, 1993). Otras consideraciones Almacenamiento, transporte y embalado de aceites. Los aceites y grasas deben protegerse frente al deterioro oxidativo, la contaminación con agua, suciedad, o con otras grasas, la absorción de olores y sabores extraños, el deterioro térmico y la entrada de sustancias extrañas procedentes de los materiales de empaquetado y forrado. Los factores de deterioro son la temperatura, la presión de oxígeno, los productos de oxidación, las trazas de metales, las enzimas oxidativas y lipolíticas, la disminución de los antioxidantes naturales, y la luz ultravioleta y visible. El empleo de temperaturas de almacenamiento bajas, el envasado en vacío o en nitrógeno; evitar que el cobre y las aleaciones de hierro y cobre formen parte de los materiales de construcción de las cubas de almacenamiento; y el empleo de antioxidantes naturales o sintéticos y de secuestrantes metálicos como aditivos, contribuyen a evitar el deterioro del aceite durante el almacenamiento. Selección de la tecnología de elaboración de aceites. Son varios los factores que influyen en el empleo de la tecnología de elaboración de aceites y su aplicación a los productos. Así, la demanda de triglicéridos con ácidos grasos específicos en las posiciones 1, 2 y 3 de la molécula puede conseguirse mediante la transesterificación enzimática que emplea lipasas como catalizadores del proceso de intersesterificación. El ácido graso que más fácilmente se absorbe en la posición 2 puede generar triglicéridos específicos con utilidad médica. Por ejemplo, se pueden proporcionar ácidos grasos esenciales a pacientes con varios tipos de deficiencias en la absorción de grasas, o se puede proporcionar energía a los niños administrándoles ácido palmítico en la posición 2. Otro factor consiste en el aumento del uso del refinado físico debido a la presión de los consumidores que piden elaboraciones menos «químicas». Conclusiones El refinado en el medio rural de las plantas oleaginosas puede producir grasas y aceites de buena calidad que aportan la energía y las vitaminas liposolubles necesarias. El refinado comercial produce grasas y aceites con poco sabor, color limpio, buena calidad de conservación y estabilidad para freír. Las grasas y aceites refinados comercialmente carecen de los contaminantes conocidos que se extraen de las materias primas agrícolas. El refinado puede eliminar carotenoides con valor nutritivo para producir aceites con poco color, pero mantiene proporciones importantes de tocoles, y no cambia los ácidos grasos ni las composiciones de los triacilglicéridos. La temperatura, el tiempo y la presión deben controlarse cuidadosamente durante el refinado industrial. Los productos de los aceites deben almacenarse convenientemente, transportarse y empaquetarse para mantener la calidad, y los consumidores deben asumir la responsabilidad de no abusar de los aceites y grasas en sus familias. La industria puede diseñar prácticamente cualquier grasa o aceite para una aplicación específica empleando varios procesos de modificación, como la hidrogenación, interesterificación, fraccionamiento o mezcla. La hidrogenación normalmente reduce el contenido de ácidos grasos esenciales y crea diversos isómeros de ácidos grasos, tanto cis como trans. La gran flexibilidad de que dispone la industria para seleccionar materias primas y distintos procesos de modificación permite elaborar aceites con el menor costo posible, un aspecto importante de la producción de los alimentos. Capítulo 6 - Selección de usos de las grasas y de los aceites en la alimentación Las grasas son los principales constituyentes de las margarinas, grasas de mantequilla, grasas de repostería, y aceites para ensaladas y para cocinar. Además de la grasa visible que contienen los alimentos, las grasas y los aceites se encuentran en grandes cantidades en muchos productos de panadería, preparados para lactantes, y en productos lácteos y algunos dulces. Los aceites, la mantequilla y la margarina se emplean algunas veces directamente en los alimentos. Aceites de cocina El principal uso del aceite en la cocina es la fritura, donde funciona como medio transmisor de calor y aporta sabor y textura a los alimentos. Uno de los requisitos del aceite de cocina es que sea estable en las condiciones verdaderamente extremas de fritura por inmersión, esto es, altas temperaturas y humedad. En general, en la fritura el aceite debe mantenerse a una temperatura máxima de 180 °C. Si se fríen los alimentos a una temperatura demasiado baja, éstos atrapan más grasa. El agua, que es aportada por los alimentos que se fríen en el aceite, aumenta la disociación de los ácidos grasos que se produce durante el calentamiento. La hidrólisis genera un aceite de baja calidad con un punto de humo más bajo, un color más oscuro y un sabor alterado. Durante el calentamiento, los aceites también polimerizan, generando un aceite viscoso que se absorbe fácilmente por los alimentos y que genera un producto grasiento. Cuanto más saturados (sólidos) sean los aceites, más estables son frente a la disociación oxidativa e hidrolítica, y menos fácil es que polimericen. Los aceites ricos en ácido linolénico, como el de soja y el de canola, son particularmente susceptibles de sufrir estos cambios indeseables. Cuando el aceite de soja se hidrogena parcialmente a fin de reducir el ácido linolénico desde aproximadamente un 8 por ciento hasta valores inferiores al 3 por ciento, se genera un aceite de freír relativamente estable, que se utiliza en alimentos fritos elaborados, frituras en sartén y a la parrilla, y en salsas. La estabilidad puede aumentarse utilizando aceite de semilla de algodón, aceite de maíz, aceite de palma o palmoleína, o con un aceite de soja más hidrogenado. Los alimentos que se fríen y almacenan antes de comerlos, como por ejemplo los aperitivos, requieren un aceite aún más estable. Los aceites mas saturados mejoran la estabilidad, pero si la grasa de freír es sólida a temperatura ambiente se generará una desagradable superficie dura, indeseable en algunos productos fritos. Cuando los aceites se usan continuamente, como en los restaurantes, se necesita una grasa de freír que sea muy resistente. En estos casos se emplean mantecas más sólidas que maximicen la estabilidad de la grasa durante muchas horas de fritura. Los aceites de fritura obtenidos a partir del girasol y de cártamo presentan menor estabilidad dado su alto contenido en ácidos grasos poliinsaturados y su bajo contenido de -tocoferol; sin embargo, los aceites de cártamo y de girasol de plantas mejoradas genéticamente, con un alto contenido de ácido oleico, son aceites adecuados para freír. Para obtener un aprovechamiento optímo de los aceites de cocina, es necesario distinguir entre distintas condiciones de fritura. Los principales parámetros que se deben vigilar son la duración del uso y la naturaleza de los alimentos que se vayan a freír. Si en el aceite de fritura entran alimentos grasos, los componentes de estos alimentos podrían desestabilizar el aceite, y su contenido de agua podría influir en la operación de fritura. Tiene importancia el hecho de que el uso sea continuo o intermitente, ya que el uso continuado crea una capa de vapor de agua protectora frente a la oxidación. Por último, se debe tener en cuenta la temperatura. Generalmente se suele vigilar satisfactoriamente el uso industrial de las grasas y de los aceites. La operación de fritura en continua (que implica la adición constante de aceite fresco) y los requisitos de calidad de los productos aseguran normalmente un buen control de la calidad del aceite. En los hogares, donde los aceites se usan normalmente durante períodos de tiempo mucho más cortos y se desechan después de haberse utilizado una o dos veces, los problemas de estabilidad juegan un papel menos importante. La estabilidad de los aceites es un factor más importante en las operaciones de los servicios de comidas preparadas, donde el calentamiento es intermitente y los aceites pueden usarse durante largos períodos de tiempo. Margarinas Las margarinas deben tener una cierta estructura cristalina para mantener una consistencia semisólida a temperatura ambiente y a la temperatura de frigorífico. Se requiere que se derritan rápidamente a la temperatura corporal, por lo que la margarina se derretirá rápidamente en la boca sin dejar una sensación pegajosa. El ácido oleico se derrite a 16 °C, mientras que el ácido elaídico se derrite a 44 °C, por lo que la presencia de algunos isómeros en trans puede elevar considerablemente el punto de fusión y la estabilidad de un producto. Las margarinas en barra contienen un 10-29 por ciento de ácidos grasos en trans, mientras que las margarinas en tubo tienen 10-21 por ciento de ácidos grasos en trans. Además de la hidrogenación parcial, la consistencia adecuada de una margarina puede conseguirse mezclando grasas duras y blandas. Los productos para untar que contienen menos grasas, por ejemplo, del 40 por ciento o del 60 por ciento, tienen menos ácidos grasos en trans. Otro hecho importante en la solidificación de los aceites para obtener margarinas es el tipo de cristal que se forma. Las grasas son polimórficas, es decir, son capaces de formar varios tipos diferentes de cristales. Los cristales son los más pequeños, originan un cristal liso pero inestable. Los cristales ' tienen un tamaño medio, y siguen siendo los deseados para las margarinas porque proporcionan una textura lisa, son bastante estables y aseguran la plasticidad del producto. Los cristales de mayor tamaño son los de tipo , que son estables y granulados, y generalmente indeseables. Además, la forma se convierte fácilmente en una estructura dura y quebradiza. Productos tales como las mantecas líquidas y las grasas de recubrimiento requieren algunas veces el cristal . Las longitudes de los ácidos grasos y sus posiciones en la estructura del glicerol determinan el tipo de cristal que se forma. Los triglicéridos de una grasa determinada o de un aceite solidificado siempre forman el mismo tipo de cristales, excepto cuando se añaden otros ingredientes para alterar la formación del cristal. Para elaborar una margarina con una estabilidad ' mejorada, es necesario disponer de varios triacilglicéridos con ácidos grasos de distintas longitudes de cadena. El aceite de semilla de palma y el de semilla de algodón hidrogenado contienen una cantidad apreciable de C 16:0 y pueden añadirse a otros aceites para mejorar la estructura '. Grasas de repostería Las grasas de repostería son grasas semisólidas que proporcionan una textura tierna a los productos horneados, favorecen la aireación de los productos fermentados, y promueven una textura y sabor agradables. Cubren las proteínas del gluten de la harina que impiden el endurecimiento. Por el contrario, en productos levantados con levadura, es conveniente la dureza para proporcionar una textura masticable. En productos cuyas características estén entre las de los panes y las de los pasteles, como los buñuelos, la manteca modifica el gluten y añade riqueza al producto. En los productos horneados, se emplea la grasa de repostería concretamente para fermentar, añadir cremosidad y lubricar. En alcorzas y rellenos, ayuda a formar pequeñas burbujas de aire que crean una estructura ligera y suave. Estas grasas se emplean como grasas estables de freír que proporcionan un medio de calentamiento, y su estructura cristalina carece de importancia. Los requisitos de las grasas que tienen propiedades para la repostería dependen específicamente de los alimentos en que se utilicen. Las grasas de repostería para hornear deben tener una gama plástica la más amplia posible, esto es, la característica de fusión debe mantenerse constante en una determinada gama de temperaturas, a menudo 24-42 °C. Esta característica permite que la grasa se manipule fácilmente sin que se derrita a temperatura ambiente y favorece su capacidad de mezcla. Se puede conseguir una amplia gama plástica mezclando una partida parcialmente hidrogenada con un aceite completamente hidrogenado, como el de soja (cristal ) o el de semilla de algodón y el de palma (cristal '). Se suele preferir el cristal ' porque proporciona una textura más cremosa. Aceites para ensaladas El principal uso de los aceites para ensaladas es en los aliños. Los aliños tradicionales para ensaladas, algunos de los cuales son emulsiones, consisten en un sistema bifásico de aceite y agua con un 55-65 por ciento de aceite. El aceite de las ensaladas recubre sus ingredientes, distribuyendo el sabor del aliño que mejora el gusto de la ensalada. Otro uso importante de los aceites para ensaladas es en las mayonesas y aliños espesos para ensaladas, que contienen respectivamente un 80 y un 35-50 por ciento de aceite. El aceite de la mayonesa es lo que le confiere viscosidad, mientras que en los aliños espesos ayuda a modificar la sensación de la pasta de almidón en la boca, y espesa el producto. Un aceite para ensaladas no debe contener cristales sólidos que, al refrigerarlo, le confieran una textura pegajosa de sebo, rompan la emulsión formada entre el agua y el aceite, o den al producto un aspecto turbio. Los aceites pueden ser frigelizados, un proceso en el cual se eliminan los cristales sólidos que se forman a temperaturas del frigorífico. Normalmente, se emplea aceite de soja sin hidrogenar o parcialmente hidrogenado, de canola, de semilla de algodón frigelizado, de cártamo, de girasol y de maíz. El aceite de oliva tiene un sabor único, y aunque forma cristales a temperaturas de frigorífico, se suele servir a temperatura ambiente como aceite para ensaladas. Triglicéridos de cadena mediana (TCM) Además de las grasas comunes de la alimentación, las fracciones lipídicas tales como los triglicéridos de cadena media (aceite TCM) se utilizan en preparaciones terapéuticas especializadas. El aceite TCM es una fracción del aceite de coco que contiene triacilglicéridos con ácidos grasos de 8-10 átomos de carbono en triacilglicéridos. El aceite TCM se emplea en fórmulas para alimentación enteral y en la alimentación para pacientes con síndromes de mala absorción. Conclusión La gama de usos de los alimentos requiere gran variedad de grasas y aceites cuyas características se ajustan para satisfacer determinadas necesidades. Los esfuerzos para modificar la composición de las grasas y los aceites pueden verse limitados por estos diversos requisitos técnicos. Capítulo 7 - Los lípidos en las primeras etapas del desarrollo Nutrición materna Durante el embarazo, es necesario adquirir ácidos grasos poliinsaturados de cadena larga para el desarrollo de la placenta y del feto. Además, existen pruebas evidentes de que la nutrición y la salud maternas durante el período de la concepción tienen una importancia crucial. Los acontecimientos que preceden a la concepción influyen en el proceso fisiológico a largo plazo de acumulación de grasa y en la naturaleza de la grasa almacenada. Esta es la grasa que se tiene a disposición durante el período de la formación y la división celulares en el desarrollo embrionario y de la placenta durante el primer trimestre de gestación. A partir del momento de la concepción también se acumulan cantidades importantes de grasa para mantener el crecimiento fetal durante el tercer trimestre, así como para satisfacer las necesidades iniciales de la lactancia. Los datos obtenidos en los experimentos realizados con animales sugieren que la nutrición precedente y posterior al nacimiento presenta importantes efectos en la composición lipídica del cerebro y sobre el aprendizaje (Galli y Socini, 1983). Las carencias específicas de ácidos grasos n-3 influyen en la integridad neurológica (Budowski, Leighfieid y Crawford, 1987) y afectan selectivamente al aprendizaje y a la capacidad visiva (Wheeler, Benolken y Anderson, 1975; Lamptey y Walker, 1976; Bourre et al., 1989; Yamamoto et al., 1987). Los estudios realizados con primates no humanos confirman que la carencia de n-3 disminuye el desarrollo de la función retinal y de la agudeza visual (Neuringer, Anderson y Connor, 1988; Connor, Lin y Neuringer, 1990). Estudios recientes han reproducido estos resultados en niños, indicando que los ácidos grasos n-3 son esenciales y que es necesario incluir ácido docosahexanoico (ADH) en los alimentos para lactantes (Birch et al., 1992, 1993a, b; Carlson et al., 1993a, b; Uauy et al., 1990; Uauy, Birch y Birch, 1992). Aunque no existen estudios similares con el ácido araquidónico, los datos experimentales sugieren que los niveles bajos de ácido araquidónico se asocian a un crecimiento prenatal lento (Crawford et al., 1989; Leaf et al., 1992) y postnatal en los niños prematuros (Carlson et al., 1992). Por tanto, el ácido araquidónico debe considerarse un nutriente esencial durante las primeras etapas del desarrollo debido a que se encuentra en la leche humana (Sas et al., 1986; Koletzko, Thiel y Abiodun, 1992) junto con el ADH; la interacción entre las familias n-3 y n-6; las funciones específicas del ácido araquidónico en la función neural y vascular; el papel de sus eicosanoides en la regulación celular. Con los lactantes nacidos a término no se han realizado los mismos tipos de pruebas controladas y al azar que se han realizado con los niños prematuros. Sin embargo, los estudios preliminares en los que se comparan lactantes nacidos a término alimentados con leche materna con aquellos que se habían alimentado con preparados de bajo contenido de ácido linolénico, sugieren que el cerebro de los lactantes nacidos a término también puede responder a las influencias nutritivas externas (Birch et al., 1993b; Gibson et al., 1993). Los datos sobre la composición del cerebro permiten comparar a los niños alimentados con leche materna con los que se han alimentado con preparados y proporcionan pruebas adicionales de la influencia de los ácidos grasos en el cerebro en desarrollo de los lactantes nacidos a término (Farquharson et al., 1992). Nutrición antes de la concepción Los estudios embriológicos y clínicos demuestran que el estado nutricional de la madre durante el tiempo próximo a la concepción tiene más importancia en el peso del recién nacido (Caan et al., 1978; Villar y Riveria, 1988; Wynn et al., 1991), la prevención de los defectos del tubo neural (Wald et al., 1991) y los defectos congénitos no genéticos (Wynn y Wynn, 1981). que su estado nutricional durante la última parte del embarazo. Una nutrición materna o una condición metabólica pobre durante esta primera etapa presenta un riesgo importante de comprometer el desarrollo embrionario, la formación celular y la tasa de reproducción del ADN de modo tal que posteriormente no se puede compensar. Durante el embarazo, la placenta selecciona ácido araquidónico y docosahexanoico (ADH) a expensas del ácido linoleico, -linolénico y eicosapentanoico (AEP), resultando proporciones considerablemente elevadas de ácido araquidónico y ADH en la circulación fetal a medio plazo (Crawford et al., 1976) y al final (Olegard y Svennerholm, 1970). Esto no les sucede a los niños nacidos prematuramente. Los bajos pesos al nacer y los nacimientos prematuros están relacionados con un alto riesgo de trastornos e incapacidades del desarrollo neurológico (Wynn y Wynn, 1981; Dunn, 1986; Hack et al., 1991; Scottish Low Birth Weight Study Group, 1992a, b). Se ha descrito la incidencia de los trastornos en el desarrollo neurológico de los niños prematuros o nacidos con un peso bajo en el Reino Unido y Suecia, viéndose que ha aumentado al triple desde 1967 (Pharoah et al., 1990; Hagberg, Hagberg y Zetterstrom, 1989), haciendo urgente la necesidad de un mejor conocimiento de las necesidades nutricionales de estos niños. Bajo peso al nacer. En varios países en desarrollo, el bajo peso al nacer constituye un problema particular que está relacionado con la alta incidencia de mortalidad y morbilidad materna y perinatal. También constituye un problema en las zonas urbanas de los países desarrollados, especialmente en los grupos socioeconómicos más bajos. La OMS estima que el 17,4 por ciento de los bebés de todo el mundo nacen con bajo peso. Esto tiene importantes consecuencias a largo plazo para la salud y las capacidades de los niños (FAO/OMS, 1992). Los embarazos de las adolescentes plantean un problema especial, ya que el consumo nutricional de la madre necesita sostener tanto su propio crecimiento somático continuo como el del feto. La vulnerabilidad de las madres jóvenes y de sus descendientes se confirma por la elevada frecuencia de muertes perinatales, bajo peso al nacer y morbilidad y mortalidad maternas. Sin embargo, cuando las jóvenes embarazadas comen adecuadamente durante el embarazo, los partos pueden tener éxito. Aunque existe una relación entre la nutrición materna y el peso del recién nacido (Caan et al., 1978), las causas del bajo peso al nacer dependen de muchos factores, entre los que se incluye: bajo aporte calórico, escaso aumento del peso durante el embarazo, bajo peso antes del embarazo, pequeña estatura, y enfermedades (por ejemplo, malaria) (FAO/OMS, 1992). En los países desarrollados, fumar supone un factor adicional. Algunos nutrientes, con independencia de que se fume, se relacionan con pesos inferiores a los 3,0 kg (Doyle et al., 1990). Los datos retrospectivos sugieren que la nutrición fetal determina el riesgo de diabetes no dependiente de insulina y de enfermedades vasculares en etapas ulteriores de la vida (Barker et al., 1993). Este concepto se ve apoyado por los datos relativos a las carencias de ácido araquidónico, ADH y vitamina A en la circulación de los recién nacidos con bajo peso al nacer (Ongari et al., 1984; Crawford et al., 1989, 1990; Carlson et al., 1992; Leaf et al., 1992), así como por los datos de patologías vasculares en la placenta de recién nacidos de bajo peso al nacer (Althabe, Laberre y Telenta, 1985; Winick, 1983). Micronutrientes y acumulación de grasas. En muchos países en desarrollo, predomina todavía la carencia de vitamina A. En estas circunstancias, es importante que el consumo de grasas y de vitaminas liposolubles sea suficiente y se deben hacer esfuerzos para aumentar el porcentaje de la energía alimentaria que procede de las grasas hasta al menos el 20 por ciento en mujeres en edad fértil. Esta estrategia debería contribuir también a asegurar un aporte adecuado de ácidos grasos esenciales y de vitaminas liposolubles. La grasa corporal juega un papel especial, puesto que las mujeres con una alimentación de bajo contenido en grasas y en calorías, así como las atletas con entrenamientos intensos pueden no concebir, o bien puede ponerse en peligro el desarrollo embrionario y fetal de su descendencia (Frisch, 1977). El depósito de grasas de la madre durante la concepción puede ser importante para sus respuestas hormonales y para la nutrición del embrión. Igualmente, proporcionará las bases para la acumulación y utilización subsiguiente de las grasas durante el embarazo (FAO/OMS, 1978). Para asegurar una preparación nutritiva adecuada, las mujeres no deben someterse a un régimen de adelgazamiento, de bajo contenido de calorías o de grasas durante los tres meses que precedan a la concepción. El consumo de calorías y de nutrientes debe ser suficiente para satisfacer las recomendaciones generales para el primer trimestre de gestación, mientras que el consumo de ácidos grasos esenciales debe ser similar al que se mencionará más adelante para el embarazo, a fin de asegurar una calidad adecuada de las reservas de grasa. Se debe prestar atención a la necesidad de un nivel nutricional adecuado en lo que se refiere a calorías, vitaminas, minerales y oligoelementos antes de la concepción. Gestación. Durante los nueve meses de gestación surgen nuevas necesidades que afectan el contenido de grasas de la alimentación para proporcionar el depósito de grasas durante el primer trimestre y favorecer el crecimiento de los demás compartimentos durante los siguientes trimestres. Durante el primer trimestre, el desarrollo embrionario requiere una cantidad insignificante de ácidos grasos esenciales adicionales, pero la acumulación materna normal de grasas y el crecimiento uterino, así como la preparación del desarrollo de las glándulas mamarias, representan una demanda considerable. En el segundo y, sobre todo, en el tercer trimestre, la expansión del volumen sanguíneo y el crecimiento placental y fetal aumentan la demanda. Según datos fidedignos sobre estos compartimentos, una mujer bien nutrida adquiere en total durante un embarazo normal 600 g de ácidos grasos esenciales como media (aproximadamente 2,2 g/día). Una mayor utilización de la energía puede modificar esta necesidad. Esto concuerda con la recomendación de aumentar el consumo de energías alimentarias (OMS, 1985a) y permite mantener la relación entre el ácido linoleico y el -linolénico en unos valores comprendidos entre 1:5 y 1:10. Esta recomendación supone que existe una adecuada conversión de los ácidos grasos esenciales maternos en sus correspondientes ácidos grasos poliinsaturados de cadena larga. Sin embargo, los estudios recientes sugieren que durante el embarazo se produce una relativa carencia de los ácidos grasos poliinsaturados n-3 de cadena larga (Holman, Johnson y Ogburn, 1991). Las correlaciones existentes entre el ácido araquidónico y el peso del recién nacido, y entre el ADH y la edad de gestación (Leaf et al., 1992) concuerdan tanto con el indicador de la madurez como con el consumo de ADH. Hay datos que indican la relación existente entre el consumo abundante de pescado con embarazos más largos, mayores pesos al nacer, e incidencia reducida de nacimientos prematuros. Un estudio realizado con aceites de pescado indica que los ácidos grasos poliinsaturados n-3 son importantes (Olsen et al., 1992). Si estos datos se confirmaran, podrían indicar la necesidad de suministrar el ADH preformado para ayudar a prevenir los nacimientos prematuros y la hipertensión relacionada con el embarazo (OMS, 1985a). Lactancia. Durante la lactancia, aumentan las necesidades de nutrientes y energía. Suponiendo que durante el embarazo se han acumulado suficientes reservas de energía, la necesidad adicional durante la lactancia es de 500 kcal/día (OMS, 1985a). Si las reservas son limitadas, la necesidad energética puede llegar a ser de 800 kcal/día. El contenido de grasas es el componente de la leche que mayor variación presenta y depende, cuantitativa y cualitativamente, de la nutrición materna y de la secreción de prolactina. La alimentación de una madre bien nutrida aporta una gama de ácidos grasos insaturados que asegura al bebé el aporte de ácidos grasos esenciales. La energía total puede recabarse de cualquier mente, pero la composición de ácidos grasos esenciales depende exclusivamente de la alimentación y de las reservas maternas. Si una mujer se ha nutrido bien durante el embarazo, sus reservas de grasas pueden aportar aproximadamente un tercio de la energía y de los ácidos grasos esenciales necesarios durante los tres primeros meses de lactancia. Dependiendo de la composición de la leche de las mujeres omnívoras, la alimentación de la madre durante la lactancia debe aportar entre 3 y 4 g/día de ácidos grasos esenciales adicionales durante el primer trimestre de lactancia, que deben aumentarse a 5 g/día cuando las reservas de grasa hayan desaparecido (Koletzko, Thiel y Abiodun, 1992) (Cuadro 7.1). Esto debe ser posible aumentando la ingestión normal de alimentos. Nutrición de los lactantes Niños prematuros. Durante el último decenio se ha podido disponer de datos sobre la importancia de los ácidos grasos esenciales maternos y de los ácidos grasos poliinsaturados de cadena larga derivados de ellos en el crecimiento fetal y neonatal (Martínez, 1988). Las técnicas analíticas modernas han aportado datos importantes sobre la composición de los ácidos grasos de la leche materna (Id.). A los niños prematuros se les ha negado el aporte intrauterino de ácido araquidónico y de ADH. Además, nacen con pocas o ninguna reserva de grasas, lo que les hace depender completamente de la alimentación. A pesar del aporte de ácido linoleico y de la presencia de elevados niveles de ácido linoleico en el plasma, es evidente que la cantidad de ácido araquidónico y de otros ácidos grasos poliinsaturados disminuye rápidamente (Leaf et al., 1992). La evaluación actual de los niveles de ácidos grasos esenciales depende de la medida de la composición del plasma y la de los glóbulos rojos. Si bien existen pocos datos sobre los depósitos de los tejidos, los datos de los primates indican que existe una relación (Neuringer, Anderson y Connor, 1988). Las funciones retinal y cortical de la vista muestran los efectos de los niveles de ácidos grasos esenciales presentes en los tejidos. CUADRO 7.1 - Valores medios de los ácidos grasos de la leche humana madura en Europa y Africa Medianas y gamas Europa (14 estudios) Africa (10 estudios) Acidos grasos totales (% p/p) Saturados 45,2 (39,0-51,3) 53,5 (35,5-62,3) Monoinsaturados 38,8 (34,2-44,9) 28,2 (22,8-49,0) AGPI n-6 + n-3 13,6 (8,5-19,6) 16,6 (6,3-24,7) n-6 AGPI (% p/p) C18:2n-6 11,0 (6,9-16,4) 12,0 (5,7-17,2) C20:2n-6 0,3 (0,2-0,5) 0,3 (0,3-0,8) C20:3n-6 0,3 (0,2-0,7) 0,4 (0,2-0,5) C20:4n-6 0,5 (0,2-1,2) 0,6 (0,3-1,0) C22:4n-6 0,1 (0,0-0,2) 0,1 (0,0-0,1) C22:5n-6 0,1 (0,0-0,2) 0,1 (0,1-0,3) n-6 totales LCP 1,2 (0,4-2,2) 1,5 (0,9-2,0) AGPI n-3 (% p/p) C18:3n-3 0,9 (0,7-1,3) 0,8 (0,1-1,44) C20:5n-3 0,2 (0,0-0,6) 0,1 (0,1-0,5) C22:5n-3 0,2 (0,1-0,5) 0,2 (0,1-0,4) C22:6n-3 0,3 (0,1-0,6) 0,3 (0,1-0,9) n-3 totales LCP 0,6 (0,3-1,8) 0,6 (0,3-2,9) Fuente: Adaptado de Koletzko, Thiel y Abiodun, 1992. Varios estudios sobre los índices bioquímicos del nivel de ácidos grasos esenciales han documentado el efecto de la adición de ácidos grasos poliinsaturados de cadena larga en la alimentación (Koletzko et al., 1989; Carlson et al., 1992; Uauy, Birch y Birch, 1992; Makrides et al., 1993). Si se añade ácido araquidónico y ADH, puede mejorarse el descenso postnatal del nivel en el plasma sanguíneo. Si se complementa con aceite marino (AEP/ADH = 2:1), se corrige el nivel de ácido araquidónico, que según se había visto en un estudio, afectaba negativamente al crecimiento (Carlson et al., 1992). Existe una prueba convincente de que la complementación con ADH procedente de aceite marino mejora el desarrollo de los bastoncillos fotorreceptores y de la agudeza visual, medida de la respuesta del receptor a la luz, así como el de la corteza, asociada con la capacidad cognoscitiva de integrar la información (Uauy et al., 1990; Uauy, Birch y Birch, 1992; Birch et al., 1992; Carlson, 1993a). La preocupación inicial (Carlson et al., 1992) consistente en que el crecimiento lento, asociado con el aceite marino, iba unido a una disminución del nivel de ácido araquidónico, ha desaparecido utilizando un aceite marino con bajo contenido de AEP con una relación AEP/ADH de 1:10. Esto no compromete el aumento de peso, y tiene como resultado un aumento del índice de desarrollo mental de Bayley a los 12 meses (Carlson et al., 1993b). Los estudios de seguimiento realizados durante ocho años, en los que se comparaban niños prematuros alimentados con leche materna en biberón con otros alimentados con preparados mostraron un CI ocho puntos inferior en estos últimos (Lucas et al., 1992). Se dispone de pocos datos sobre el aumento de los ácidos grasos esenciales en los fetos normales y en niños sanos alimentados con leche humana, y de ningún dato cuantitativo sobre las conversiones metabólicas en el ser humano. Aunque en la alimentación materna hay variaciones, los datos sobre su composición obtenidos en mujeres omnívoras constituyen la base de las recomendaciones de esta consulta. Como orientación, los preparados para niños prematuros deben aportar una media de 700 mg de ácido linoleico, 50 mg de ácido -linolénico, 60 mg de ácido araquidónico y los ácidos grasos n-6 de cadena larga asociados, y 40 mg de ADH por kg de peso corporal. Esto es, el 5,6 por ciento de la energía en forma de ácidos grasos esenciales precursores y el 0,8 por ciento en forma de ácidos grasos poliinsaturados de cadena larga. Dada la conocida interferencia del ácido linoleico para los ácidos grasos poliinsaturados de cadena larga, el ácido linoleico no debe exceder del 10 por ciento de la energía total. Hasta que se pueda disponer de más datos, en particular de datos de respuesta frente a la dosis, los ácidos grasos anteriormente mencionados deben permanecer aproximadamente en el 30 por ciento del valor recomendado. Las recomendaciones sobre los demás ácidos grasos deben establecerse en función de su digestibilidad, carencia de interferencias con el metabolismo de los ácidos grasos esenciales y otras medidas de su función. En principio, una mezcla de ácido oleico con ácidos grasos saturados en la que predomine el ácido oleico parece reunir estos requisitos. Niños nacidos a término. Siempre que sea posible, la mejor fuente para la alimentación del lactante es la leche humana. Teniendo en cuenta este hecho, los programas de educación y de atención en salud deberían promover activamente la alimentación con leche materna. Además, dadas las interacciones nutritivas a largo plazo con la madre, incluso antes de la concepción, y sus profundas consecuencias en la salud pública, deberían emprenderse programas similares para las mujeres antes de la concepción, y durante el embarazo y la lactancia. Dichos programas mejorarán la salud materna, el desarrollo fetal, y la salud neonatal. Cuando se comparan niños nacidos a término que mueren por causas sin explicar, los niños que se habían alimentado con fórmulas de leche carentes de ácido araquidónico y de ADH presentaban bajos niveles de ADH en la corteza cerebral, y niveles de ácido docosapentanoico n-6 (un índice de carencia de ADH) mayores que los de los niños alimentados con leche materna (Farquharson et al., 1992). Tal como lo demuestran ahora los datos de los niños pre-término, es más ventajoso tanto para el bastoncillo fotorreceptor como para la función neural un aporte complementario con ácidos grasos poliinsaturados de cadena larga n-3; parece oportuno aportar tanto ácido araquidónico como ADH ya preformado en los preparados de leches para niños nacidos a término en proporciones similares a las de la leche materna de mujeres omnívoras bien nutridas. En los niños nacidos a término, el aporte por kg de peso corporal debe sumar 600 mg de ácido linoleico, 50 mg de ácido linolénico, 40 mg de ácido araquidónico y ácidos grasos n-6 asociados, y 20 mg de ácido docosahexanoico. Aunque todavía no se dispone de datos de pruebas controladas realizadas al azar con niños nacidos a término, se sugiere este aporte para aprovechar cuanto sea posible todo el potencial genético de desarrollo visual y neurológico. Como ya se ha explicado, la leche materna aporta ácidos grasos poliinsaturados de cadena larga preformados. Puesto que es evidente que los ácidos grasos poliinsaturados de cadena larga son muy eficaces en el desarrollo neurológico (Sinclair, 1975; FAO/OMS, 1978; Leyton, Drury y Crawford, 1987), y teniendo en cuenta los datos relativos a los niños inmaduros anteriormente examinados, en los preparados para lactantes deberían incluirse ácidos grasos poliinsaturados de cadena larga. Aportar ácidos grasos esenciales de origen que se supone optimizan la conversión en ácidos grasos poliinsaturados de cadena larga debería resultar válido para el desarrollo físico, vascular y mental, y debería contribuir a la normalidad biológica y funcional. El peso de las pruebas debería colocarse en aquellas que proponen que los preparados artificiales deberían ser, en principio, diferentes de la leche materna (Drury y Crawford, 1990). Estas recomendaciones para los niños nacidos a término y los pre-término concuerdan plenamente con las del Grupo Especial Británico de Nutrición sobre los Acidos Grasos Insaturados (BNF, 1992). Destete. La leche humana aporta el 50-60 por ciento de la energía en forma de lípidos, en que aproximadamente el 5 por ciento de la energía está constituida por ácidos grasos esenciales, de los cuales el 1 por ciento en forma de ácidos grasos poliinsaturados de cadena larga. Estudios de seguimiento de la lactancia durante seis meses por muestreo al azar mostraron que en madres bien nutridas el aporte de grasas de la leche se incrementaba desde 40-50 g/l en la tercera semana, hasta 60-70 g/l al cabo de 4-6 meses (OMS, 1985b; Sas et al., 1986). En los países en desarrollo con bajos aportes energéticos, el aumento del contenido en grasas de la leche era menor. Sin embargo, parecería especialmente inoportuno destetar lactantes con una alimentación deficiente en grasas. La Sociedad Europea de Gastroenterología y Nutrición Pediátrica (1991) recomendó que en los preparados de seguimiento el 40-55 por ciento de la energía alimentaria se aportara en forma de grasas (4,4-6,0 g/100 kcal). Durante el destete, los componentes grasos deberían aportar el 30-40 por ciento de la energía alimentaria, y los niveles de ácidos grasos esenciales deberían ser similares a los que se encuentran en la leche materna obtenidos de los alimentos adecuados al menos hasta la edad de dos años. En la práctica, esto significa que a medida que disminuyen los componentes de la leche materna los alimentos complementarios que se emplean durante el período del destete deben contener cantidades suficientes de grasas y aceites. Normalmente, tras el destete los niños de muchos países en desarrollo se alimentan a base de cereales o con biberones de baja densidad energética. En estos países es necesario reforzar los mensajes educativos sobre la utilización de aceites vegetales o de los alimentos que contienen aceites en la alimentación de los niños durante el destete, y de los niños pequeños. Fuentes Se reconoce que la leche humana es la mejor fuente de grasas y ácidos grasos poliinsaturados de cadena larga en la alimentación de los recién nacidos. Otras fuentes de ácidos grasos que han sido ensayados son los fosfoglicéridos de los huevos, aceites de pescado y fracciones de éstos. Las nuevas fuentes de grasas que se han perfeccionado incluyen fosfoglicéridos de los tejidos animales, y lípidos de algas y microorganismos. Debería ensayarse convenientemente la seguridad y eficacia de las nuevas fuentes antes de utilizarlas en los preparados para lactantes. Capítulo 8 - Salud, obesidad y valores energéticos de las grasas alimentarias El sobrepeso se define como un aumento mayor de lo normal del peso corporal en relación con la estatura. Se suele medir con el índice de Quételet o Indice de Masa Corporal (IMC), que es el peso en kilogramos dividido por el cuadrado de la estatura en metros (IMC = peso/estatura2). La obesidad se define como un porcentaje anormalmente elevado de grasa corporal. En los varones, la grasa corporal normal representa el 12-20 por ciento del peso corporal. En las mujeres normales, representa el 20-30 por ciento del peso corporal. Los patrones de peso para una población dada pueden establecerse dividiendo una muestra grande de la población según la distribución normal de sus pesos en relación con sus alturas. La dificultad inherente a este planteamiento consiste en que se asume que los pesos medios son pesos sanos. Un enfoque alternativo para determinar los patrones de pesos sanos consiste en utilizar pesos corporales asociados con el menor riesgo global de enfermedad. En algunos estudios prospectivos, la menor tasa de mortalidad se asociaba con un IMC próximo a 22 (Manson et al., 1987; Garrison y Kannel, 1993). Seguimiento longitudinal del peso. En varios estudios epidemiológicos se han examinado las condiciones del peso de varias poblaciones a lo largo del tiempo (Noppa y Hallstrom, 1981; Borkan et al., 1986; Williamson et al., 1990), y se ha visto un aumento progresivo del IMC en la mayoría de las poblaciones. Sin embargo, las condiciones del peso de un individuo desde la infancia y la niñez, pasando por la adolescencia, hasta la vida adulta sigue frecuentemente un camino desigual (Bradden et al., 1986; Charney et al., 1976; Khoury et al., 1983; Mossberg, 1989; Zack et al., 1979). Algunos estudios (Garn et al., 1986; Johnston y Mack, 1978; Melbin y Vuille, 1976), basándose en las. condiciones de peso de la infancia o de la adolescencia, han calculado el riesgo relativo de que al llegar a la edad adulta se esté en la categoría superior de peso. Cuando se compararon los jóvenes de menor peso con los más pesados, éstos tenían 1,6-2,5 más posibilidades de que al llegar a adultos tuvieran sobrepeso. Sin embargo, la investigación de los Estudios Longitudinales de Harvard sobre Salud y Desarrollo Infantil realizada durante 50 años descubrió que el IMC de las mujeres durante la niñez no tenía prácticamente ninguna relación con su IMC cuando alcanzaban la edad mediana (Casey et al., 1992). Había mayor correlación entre los IMC de las mujeres en la adolescencia y los de las mujeres de 50 años, aunque seguía siendo baja. El hecho de que no se pudiera demostrar el efecto del sobrepeso en la adolescencia sobre la mortalidad de las mujeres adultas puede deberse a esta baja correlación. Por otra parte, en los hombres la correlación entre el IMC de la niñez o de la adolescencia y el IMC a los 50 años era mayor, pero la continuación del peso de la niñez y de la adolescencia en la vida adulta sigue siendo de un orden bajo (Borkan et al., 1986). Los niños de las familias en que uno o los dos progenitores tienen sobrepeso corren mayor riesgo de ser adultos obesos. Si estos niños son considerablemente obesos durante los años escolares, puede ser aconsejable un programa de prevención. Así, llevar a cabo una vigilancia continua en los niños y adolescentes puede ayudar a identificar a los que están expuestos a este riesgo, y se les puede ayudar mediante un servicio preventivo. Riesgos de la salud relacionados con la obesidad El sobrepeso y la distribución de las grasas son útiles para hacer pronósticos sobre la mortalidad prematura y los riesgos de contraer enfermedades del corazón, hipertensión, diabetes mellitus no dependiente de insulina, enfermedades de la vesícula biliar y algunos tipos de cáncer. Sin embargo, si la grasa corporal fuera por sí sola el principal factor de riesgo relacionado con la mortalidad prematura, se podría concluir que las expectativas de vida de las mujeres obesas fuera más baja que la de los hombres obesos. Generalmente no sucede así, y ahora se reconoce que es la distribución de la grasa, fundamentalmente el aumento de la grasa abdominal y visceral, lo que sirve para hacer pronósticos sobre los riesgos de la salud relacionados con la obesidad. Por ejemplo, un aumento de más de 5 kg de peso en las mujeres durante su vida adulta puede comportar poco riesgo adicional, sobre todo si el peso que se añade se localiza en la región femoral. En la mayoría de los hombres, cualquier aumento de peso que se produzca después de los 20 años aumenta el riesgo, ya que esta grasa se deposita normalmente como grasa abdominal y visceral. En los estudios epidemiológicos, se ha visto que la relación entre los datos del IMC y los riesgos de contraer una determinada enfermedad sigue una línea curva, que se describe normalmente como curva en J o en U. Ello indica que la mortalidad y la morbilidad tienden a aumentar a medida que el IMC toma valores superiores a 25 o cae por debajo de 18,5. Las estadísticas de los seguros de vida de los Estados Unidos muestran que el exceso de peso está relacionado con el aumento de las tasas de mortalidad. Basándose en los datos de 1979 (Society of Actuaries and Association of Life Insurance and Medical Directors of America, 1980), se observa que a un peso corporal que se encuentra un 10 por ciento por encima del peso medio corresponde un aumento del 11 por ciento de exceso de mortalidad en los hombres, y del 7 por ciento en las mujeres. Si el peso corporal se encuentra un 20 por ciento por encima de la media, el exceso de mortalidad aumenta al 20 por ciento en los hombres y al 10 por ciento en las mujeres. Por el contrario, las tasas mínimas de mortalidad, tanto para hombres como para mujeres, se presentan en aquellos individuos que se encuentran aproximadamente un 10 por ciento por debajo del peso medio. Se han publicado más de seis estudios que muestran que la adiposidad central se relaciona directamente con el aumento de la mortalidad, así como con el riesgo de desarrollar enfermedades cardiovasculares, diabetes mellitus y ataques cardíacos (Lapidus et al., 1984; Larsson et al., 1984; Donahue et al., 1987; Ducimetiere, Richard y Cambien, 1986; Stokes, Garrison y Kannel, 1985). Entre los quintiles superiores de grasa corporal central, el riesgo relativo de infarto de miocardio era 8,2 veces superior al del quintil más bajo. En el caso de los ataques cardíacos y de la mortalidad en general, el riesgo relativo era 3,8 y 2,8 veces superior en las personas del quintil superior en comparación con las del quintil más bajo. Perder y ganar peso, los llamados ciclos de peso, también puede ser peligroso. Los datos del Estudio de la Compañía de Gas y Electricidad de Chicago (Hamm, Shekelle y Stamler, 1989) mostraron que las personas que ganaban y perdían peso corrían un riesgo de muerte por enfermedades cardiovasculares significativamente mayor que el grupo de personas que no variaban de peso. Más recientemente, se utilizaron los datos del estudio Framingham para mostrar que a los cambios sensibles de peso correspondía una mayor probabilidad de mortalidad (Lissner et al., 1991). Se insta a interpretar con cautela los datos relativos a los ciclos de peso como causa de cambios perjudiciales. La obesidad puede modificar algunos mecanismos intermedios como la función cardíaca, o el metabolismo de los lípidos o de la glucosa, para provocar la muerte o enfermedades. Sin embargo, incluso cuando el sobrepeso severo aumenta generalmente el riesgo de muerte, especialmente de muerte repentina, en muchos estudios no puede considerarse como una variable independiente. Existen dos problemas principales que afectan a la interpretación de los estudios en lo que se refiere a la obesidad como factor independiente (Manson et al., 1987). En primer lugar, muchos estudios no pueden separar los fumadores de los no fumadores. Puesto que los fumadores constituyen un grupo con tendencia a tener menores pesos corporales y mayores tasas de mortalidad, incluirlos en un estudio de población influye sobre las tasas de mortalidad y confunde la asignación de efectos al propio peso corporal. En segundo lugar, la mortalidad temprana puede tergiversar la interpretación de la influencia del nivel de peso en las expectativas de vida. Por ejemplo, las personas que han perdido o están perdiendo peso en el momento de la encuesta inicial pueden morir, y esto acentúa desmesuradamente el efecto de bajo peso corporal como causa de mortalidad. El no haber podido identificar la obesidad como un factor de riesgo independiente ha hecho que muchos sugieran que carece de importancia. Diabetes mellitus. Más del 90 por ciento de todos los diabéticos padecen una diabetes mellitus no dependiente de insulina (DMNDI). Por otra parte, el aumento excesivo de peso, así como el sobrepeso, son los principales factores nutricionales que aumentan el riesgo de desarrollar DMNDI. La importancia del peso corporal se demuestra por los bajos niveles de DMNDI existentes durante la Segunda Guerra Mundial y durante los períodos de hambruna. La DMNDI es prácticamente inexistente en individuos con un IMC igual o inferior a 20. Un IMC de 35 multiplica por 8 el riesgo de DMNDI en comparación con un IMC de 25. Otros tipos de diabetes mellitus son la dependiente de insulina (DMDI), la diabetes de la gestación, y una forma muy poco común, la diabetes mellitus ligada a desnutrición. La DMDI es una enfermedad inmunológica que destruye las células productoras de insulina. Los pacientes con esta enfermedad requieren insulina para sobrevivir. Se desconoce la naturaleza del estímulo autoinmunitario que produce la destrucción pancreática. No se ha determinado el papel de la alimentación en el desarrollo de esta enfermedad. El estudio de San Luis Valley en los Estados Unidos de América aportó algunos datos que apoyan la hipótesis de que una alimentación rica en grasas y baja en carbohidratos aumentaba el riesgo de contraer diabetes no dependiente de insulina (Marshall, Hamman y Baxter, 1991). Este estudio contenía análisis realizados con personas sin ninguna historia precedente de diabetes. Tras un ayuno de 24 horas se procedía a la prueba de tolerancia a la glucosa. Se observó que un consumo elevado de grasas comportaba un empeoramiento de la tolerancia a la glucosa, pero esto podría ser el resultado de un aumento de peso. Otros datos proceden de grupos que habían cambiado sus regímenes alimentarios. Estos estudios sugieren que el aumento del consumo de grasas en la dieta y/o Ja adquisición de peso debida a esos aumentos, pueden constituir un factor desencadenante de la diabetes no dependiente de insulina. Los aborígenes australianos eran propensos a adquirir la enfermedad cuando cambiaban su forma de vida tradicional por un estilo de vida urbano (O'Dea, White y Sinclair, 1988). El ligero aumento de triglicéridos del plasma y el brusco aumento de los niveles de insulina concordaban con la resistencia a la insulina. Se vio que un grupo procedente de Bangladesh que había emigrado al Reino Unido presentaba bajas concentraciones de colesterol en el plasma, un aumento de la resistencia a la insulina y una incidencia de diabetes tres veces superior a la habitual, así como una elevada tasa de mortalidad y morbilidad por enfermedades coronarias del corazón (McKeigue et al., 1988). El deterioro de la tolerancia a los carbohidratos y los cambios de los patrones lipoproteicos de los indios Pima y de los habitantes del Cáucaso también subrayan los problemas de la alimentación moderna rica en grasas y de la obesidad (Swinburn et al., 1991). Las diferencias étnicas en la respuesta frente al péptido C en relación con la respuesta frente a la insulina en las pruebas de tolerancia a la glucosa condujo a la conclusión provisional de que las grasas alimentarias tal vez intervienen en la determinación de la secreción de insulina y su eliminación en el hígado (Cruickshank et al., 1991). Sigue existiendo todavía más especulación que pruebas por lo que respecta a la relación entre el consumo de grasas y la diabetes no dependiente de insulina. Por ahora, la razón fundamental para modificar el consumo de grasas en la alimentación es la de reducir el riesgo de las enfermedades coronarias del corazón en los diabéticos. Causas de obesidad Equilibrio de nutrientes de los depósitos de grasa. La obesidad consiste en un fallo crónico de equilibrar la ingestión de nutrientes con su eliminación (oxidación) (Bray, York y Fisler, 1989). Hay varias causas de obesidad. En un extremo, la obesidad puede deberse simplemente a un exceso de consumo de alimentos (energía) en relación con los requisitos energéticos. En estos casos los factores hereditarios juegan un importante papel en la generación de la obesidad, que puede surgir incluso cuando la alimentación se compone principalmente de carbohidratos. En el extremo opuesto, están aquellos tipos de obesidad en los que la composición de la dieta, principalmente una elevada ingestión de grasas, es el eje central de la obesidad. Cualquiera dé estos tipos de obesidad puede controlarse modificando la alimentación, reduciendo el consumo de alimentos, o aumentando la oxidación de los nutrientes. Si bien el balance energético global es fundamental en la obesidad, el concepto de balance de macronutrientes también puede resultar práctico para comprender los factores que afectan a los aumentos o pérdidas excesivas de peso. En un adulto normal, la ingestión diaria de energía alimentaria en forma de carbohidratos debe estar entre el 50 y el 100 por ciento de las reservas totales de carbohidratos del cuerpo. Por el contrario, la ingestión de proteínas debe ser ligeramente superior al 1 por ciento de las reservas totales, mientras que la ingestión de grasas debe ser considerablemente menor del 1 por ciento de las que se almacenan en el cuerpo. El metabolismo del glucógeno (forma de almacenar los carbohidratos) está finamente regulado, y dependiendo del equilibrio entre ingestión de carbohidratos y oxidación, pueden darse grandes fluctuaciones en los depósitos de los carbohidratos, incluso en períodos de tiempo cortos. Este no es el caso de las reservas de proteínas y de grasas, en las que se tarda mucho más tiempo en detectar cambios apreciables. El proceso de regulación del equilibrio de nutrientes es complejo. El modelo de retroalimentación, por lo que respecta al equilibrio de nutrientes, se ha descrito como integrado por cuatro componentes (Bray, 1987). El primero es el «sistema controlado» que consiste en la ingestión, digestión, absorción, almacenamiento y metabolismo de los nutrientes de los alimentos. El segundo es el «controlador» localizado en el cerebro, el tercero consiste en las señales de retroalimentación que informan al controlador sobre el estado del sistema controlado y, por último, están los mecanismos que modulan la ingestión de nutrientes y la liberación de energía. En general, existen mecanismos eficaces de retroalimentación y control para regular y equilibrar el consumo y el balance de los carbohidratos (Flatt, 1988). Es más difícil volverse obeso consumiendo alimentos muy ricos en carbohidratos que alimentándose con alimentos ricos en grasas, por varias razones. En primer lugar, la cantidad (volumen) de alimentos con alto contenido en carbohidratos/fibras requerida es mucho mayor que la que se necesita con una dieta rica en grasas. Segundo, la capacidad de almacenamiento de los carbohidratos es limitada. Tercero, las rutas bioquímicas de conversión de los carbohidratos en grasas son limitadas y energéticamente caras, y son virtualmente insignificantes en las condiciones alimentarias normales de los seres humanos. Por último, la ingestión de carbohidratos estimula la oxidación de los mismos, por lo que se mantiene el equilibrio de los carbohidratos una vez que se llenan los depósitos de glucógeno, proceso que también es estimulado por el consumo de carbohidratos. También el equilibrio proteínico está bien regulado. Las reservas de proteínas aumentan gradualmente, y sólo en respuesta a otros estímulos que no sean el aumento de la ingestión de proteínas. La cantidad de proteínas que se consumen por encima de lo que se necesita para la construcción y reparación de los tejidos, así como para la formación de enzimas, se convierte en carbohidratos. Un balance positivo de proteínas puede contribuir también al balance general de energía, tal como sucede con el balance positivo de carbohidratos. Un desequilibrio crónico entre ingestión y oxidación de grasas puede producir cambios en las reservas de grasas de los tejidos adiposos. Para evitar el almacenamiento de las grasas consumidas en exceso se requiere que las grasas alimentarias se oxiden. En los estudios clínicos, las tasas bajas de oxidación del nivel base predicen un aumento del peso corporal (Zurlo et al., 1990). Sólo cuando la oxidación de las grasas iguala a la ingestión de las mismas se puede conseguir un peso corporal estable. Si bien la oxidación de los carbohidratos y de las proteínas varía según el nivel de proteínas y de carbohidratos consumidos, la oxidación de las grasas no se ve afectada por la ingestión de grasas, y la relación día a día entre balance e ingestión de grasas es precaria (Flatt, 1988). La oxidación de las grasas se relaciona más estrechamente con el balance energético (es decir, un balance energético negativo favorece la oxidación de las grasas) y también con el grado de grasa corporal (Schutz et al., 1992; Zurlo et al., 1990). Crear un balance energético negativo mediante el ejercicio o con restricciones en la dieta puede aumentar eficazmente la oxidación de las grasas, y también puede hacerse reduciendo el contenido en grasas de la alimentación. Sin embargo, a medida que se pierde peso también tiende a disminuir la oxidación de las grasas. Para evitar que una persona que ha perdido peso pueda volver a ganarlo, la ingestión de grasas debe reducirse a aproximadamente 20 g/día por cada 10 kg de grasa perdidos (Schutz et al., 1992). Se registran grandes diferencias entre las personas en cuanto a su capacidad de aumentar la oxidación de las grasas después de empezar una alimentación rica en grasas (Zurlo et al., 1990). Si bien gran parte de estas diferencias son genéticas, el ejercicio físico puede incrementar la oxidación de los ácidos grasos por parte del músculo y reducir la tendencia a ganar peso. Por este motivo, una actividad física debería formar parte de cualquier programa de control de peso. En algunos documentos se sostiene la existencia de una escasa relación directa entre la ingestión de grasas y el peso corporal (OMS, 1990; Romieu et al., 1988; Miller et al., 1990), en otros en cambio no. En muchos animales, una alimentación en que más del 30 por ciento de la energía procede de las grasas produce obesidad. Se ha visto que las mujeres que han disminuido el consumo de grasas han reducido el peso corporal, lo que aporta pruebas adicionales sobre la relación directa entre consumo de grasas y peso corporal. Sin embargo, en ensayos a más largo plazo el efecto ha sido pequeño, probablemente porque en los estudios a largo plazo no se logra respetar la dieta (Sheppard, Kristal y Kushi, 1991; Lissner et al., 1991; Lee-Han et al., 1988). Densidad energética de la alimentación. Es comúnmente aceptado que la energía alimentaria por cada 100 gramos de comida, llamada densidad energética, aumenta a medida que aumenta el contenido de grasas. El resultado de los regímenes alimentarios de bajo consumo de grasas en los estudios a corto plazo ha sido el de la pérdida de peso. Sin embargo, en los ensayos a largo plazo, los regímenes de bajo contenido de grasas adoptados por mujeres premenopáusicas ha dado lugar al consumo de un 19 por ciento de energía alimentaria adicional para mantener el peso (Prewitt, 1991). Se desconoce la variación efectiva a largo plazo, porque en estos estudios se suministraban los alimentos directamente a las personas. En cambio, a las personas de vida libre, es necesario estimularlas y motivarlas para conseguir que mantengan un régimen de bajo contenido de grasas. Teniendo en cuenta los datos disponibles, resulta claro que la obesidad es un problema crónico de muy difícil cura. Normalmente, con un tratamiento eficaz se consigue adelgazar; sin embargo, cuando termina el tratamiento es muy normal recuperar el peso. Esto concuerda con el curso de la mayoría de los problemas crónicos, e indica claramente que el mejor método para controlar la obesidad es la prevención. Valores energéticos de las grasas Los ácidos grasos son los componentes alimentarios que liberan la mayor cantidad de energía durante la oxidación de los lípidos. El glicerol, con el que están esterificados la mayoría de los ácidos grasos, es una molécula con tres átomos de carbono y tres de oxígeno. Aunque el glicerol constituye el 10 por ciento en peso de los triglicéridos, aporta sólo el 5 por ciento de su energía. Los ácidos grasos de los alimentos aportan el mayor valor energético con interés nutricional. El factor tradicional para calcular el contenido de grasa de la alimentación es de 9 kcal (37,7 kj)/g, a diferencia de las 4 kcal (16,7 kj)/g de los carbohidratos y de las proteínas (FAO/OMS, 1978). Originariamente, estos fueron los valores propuestos por Atwater, y se basan en las cantidades de energía que se liberan cuando estos macronutrientes se oxidan metabólicamente, considerando una absorción intestinal incompleta. Durante muchos decenios se ha empleado el factor 8,37 para convertir los gramos de grasas de los cereales, frutas y hortalizas en calorías (Merrill y Watt, 1955). La precisión de este número de tres dígitos carece de garantías, sobre todo teniendo en cuenta su origen. A finales de siglo, Atwater propuso factores para estimar el valor energético de los nutrientes. El calor de combustión de los triglicéridos se empleó con extractos de varios alimentos, pero para los cereales, frutas y hortalizas el valor «supuesto o calculado» que se dio fue de 9,30 calorías por gramo. Merrill y Watt (1955) copiaron este dato de una tabla creada en 1900 por Atwater y Bryant. Merrill y Watt escribieron: «Para la grasa que se encuentra en los cereales y otras fuentes vegetales, Atwater consideró que la digestibilidad aparente era del 90 por ciento, y hemos seguido con esta teoría. Se supone por lo tanto que el factor energético de las grasas en los alimentos vegetales es de 8,37 calorías por gramo». Como Atwater había utilizado un coeficiente de digestibilidad del 95 por ciento para la mantequilla, se aplicó también a las grasas separadas de origen vegetal. Así, el cálculo para las grasas y los aceites propiamente dichos era el 95 por ciento de 9,30 u 8,84 calorías por gramos. Estos factores se basan en una larga historia de suposiciones. Las correcciones relativas a la digestibilidad no son adecuadas para las grasas y aceites normalmente consumidos, y el factor de 9 para convertir gramos de todas las grasas alimenticias en calorías es el más adecuado y coherente. Sucedáneos de las grasas Los consejos relativos a la disminución del consumo de grasas y de energía han llevado a producir alimentos con menor contenido de grasas y a mejorar los sucedáneos de grasas. Existen dos enfoques principales respecto a la sustitución de las grasas alimentarias. El primero afecta a los carbohidratos hidratables y a las proteínas que producen sensación de grasa en la boca. El segundo es el de las sustancias sintéticas que no se absorben, con las propiedades físicas y la función técnica de las grasas en los alimentos. Se pueden producir materiales proteicos y de carbohidratos que aglutinan hasta tres veces su peso en agua y que crean partículas que imitan la sensación gustativa de las grasas. Cuando el material hidratado reemplaza a las grasas en los alimentos, la reducción calórica es de 9 kcal/g a 1 ó 2 kcal/g. Los carbohidratos que se utilizan son almidones de bajo peso molecular, dextranos, maltodextranos, y gomas (como la goma xantana), las proteínas que sustituyen a las grasas proceden fundamentalmente de la leche y de la clara de huevo. Como estas sustancias no se han alterado químicamente, se digieren, absorben y metabolizan como nutrientes corrientes (Vanderveen y Glinsmann, 1992). El otro grupo de sucedáneos de las grasas, que todavía no se ha comercializado, se produce por síntesis química a partir de una amplia gama de posibles estructuras con diferentes digestibilidades y efectos sobre la función gastrointestinal. Este tipo de sustancias sustituye a las grasas en una proporción de un gramo por cada gramo. La preocupación sobre algunas sustancias lipofílicas no absorbibles como los ésteres de ácidos grasos de los azúcares estriba en su efecto perjudicial en la absorción de los compuestos liposolubles, tanto vitaminas como fármacos. Por ejemplo, el uso prolongado de poliéster de sacarosa tuvo un efecto negativo en las reservas corporales de d-tocoferol (Jandacek, 1991). Se requieren evaluaciones individuales sobre la seguridad de cada tipo de sucedáneo de grasas de síntesis (Borzelleca, 1992; Vanderveen y Glinsmann, 1992). Queda por investigar el valor de estos tipos de productos, ya sea para reducir el consumo total de energía, o como ayuda en el tratamiento o prevención de la obesidad, o para modificar un tipo de grasa alimentaria. La evaluación de los sucedáneos de grasas debe incluir los efectos en la alimentación total y la redistribución de los micro y macronutrientes (Rolls y Shide, 1992). Tal vez sea inadecuado extrapolar a partir de los estudios animales, ya que los seres humanos pueden elegir sustituciones a partir de una gran variedad de alimentos. Se debe prestar especial atención al efecto de los sucedáneos de grasas en el consumo de micronutrientes, como las vitaminas A, D y E, ya que algunas grasas alimentarias son con frecuencia fuentes importantes de dichos nutrientes, y la cantidad de grasas alimentarias puede ser importante para la utilización de dichas sustancias. Conclusiones La obesidad y el exceso de grasa en las vísceras son condiciones que predisponen a las personas a padecer enfermedades crónicas. El exceso de grasa corporal es uno de los principales factores de riesgo de mortalidad y morbilidad en la mayoría de los países ricos, y cada vez más en los países en desarrollo. En los animales, el consumo elevado de grasa en la alimentación está relacionado con el aumento de la obesidad. En los seres humanos, es clara la relación entre la tasa de consumo de grasas y la oxidación, pero la relación entre ingestión de grasas como proporción energética y obesidad no es sólida. La prevención de la obesidad presupone la detección temprana, así como vigilancia, actividad física regular y, en los adultos, un modelo de consumo alimentario moderado. Capítulo 9 - Enfermedades coronarias del corazón y lipoproteínas Las enfermedades coronarias del corazón (ECC), caracterizadas por un aporte limitado de oxígeno al músculo del corazón, presentan manifestaciones clínicas que van desde la angina de pecho al infarto de miocardio (IM) y la muerte repentina. La principal causa de las ECC es la aterosclerosis coronaria (ATS), debida a lesiones causadas por depósitos ricos en lípidos en el revestimiento interior de las arterias coronarias. Este proceso empieza en las primeras etapas de la vida en forma de «estrías de grasa», y posteriormente se forman lesiones fibrosas, con frecuencia calcificadas y ulceradas, que reducen la luz arterial. Si a la lesión se le sobrepone un trombo, se puede precipitar el IM y sobrevenir la muerte repentina. Estos casos dependen de la lesión aterosclerótica y de una compleja interacción de factores hemostáticos. Aunque estos mecanismos sólo se están empezando a conocer, parece que los procesos que conducen a las ECC suponen el desarrollo de ATS, trombosis y reactividad vascular, así como la interacción entre ellas. Epidemiología y pruebas experimentales Desde los años cuarenta y cincuenta los estudios poblacionales, así como las comparaciones entre distintas culturas, proporcionaron pruebas abundantes de que los niveles elevados de colesterol en el suero comportan un mayor riesgo de ECC (Levy et al., 1979; Anderson, Castelli y Levy, 1987; Committee on Diet and Health, 1989; Pooling Project, 1978). Otros estudios recientes, como el Multiple Risk Factor Intervention Trial (Stamler, Wentworth y Neston, 1986) realizado en los Estados Unidos de América ha mostrado una relación constante, gradual y estadísticamente significativa entre los niveles de colesterol sérico y las tasas de mortalidad por edades al cabo de seis años, debidas a ECC tanto en personas con hipertensión como en personas con tensión normal, y tanto en fumadores como en no fumadores. No se pudo identificar un nivel umbral por debajo del cual el colesterol no influyera sobre el riesgo. Análogamente, en una población china que en general tenía bajos niveles de colesterol en el suero, se encontró una relación estadística significativa entre el colesterol sérico y la mortalidad por ECC (Chen et al., 1991), lo que indica que cualquier aumento del colesterol en el suero aumenta el riesgo de ECC. Estudios de varios países, como el Seven Countries Study (Keys et al., 1986; Keys, 1970) también mostraron un aumento gradual del riesgo de contraer ECC a medida que aumenta el nivel de colesterol en el suero. Estas asociaciones entre niveles séricos de colesterol se relacionan en primer lugar con niveles bajos de las lipoproteínas de baja densidad (LDL), los principales portadores de colesterol en la sangre. Las relaciones entre alimentación, niveles de colesterol en el suero y riesgo de ECC se han documentado muy bien en las comparaciones entre países (Keys et al., 1986; Levy et al., 1979; Committee on Diet and Health, 1989; Lewis et al., 1978). Las poblaciones en que el consumo de grasas, especialmente de grasa animal y de colesterol, es relativamente elevado, presentan niveles de colesterol relativamente altos en el suero y altas tasas de mortalidad debida a ECC en comparación con las poblaciones que tienen una alimentación con bajo contenido de grasas. Muchos estudios realizados con personas que habían inmigrado de poblaciones de bajo riesgo a poblaciones de alto riesgo (Nichaman et al., 1975; Halfon et al., 1982; Kato et al., 1973) demostraron que eran los factores ambientales, más que la susceptibilidad genética, lo que determinaba estas diferencias, y que consecuentemente la alimentación jugaba un papel primordial. Generalmente, las poblaciones de alto riesgo son las que tienen regímenes alimentarios de las sociedades ricas. Está aceptado que estas poblaciones se diferencian en muchos aspectos de las de bajo riesgo. Por ejemplo, la alimentación de las poblaciones de bajo riesgo no es únicamente de bajo contenido de grasas, sino que además tiene normalmente un alto contenido de fibras y otros componentes de origen vegetal. Además, las personas de estas sociedades llevan una vida menos sedentaria. Sin embargo, muchos datos experimentales, obtenidos tanto en animales como en el hombre, confirman que las grasas y el colesterol juegan un papel primordial en el control de los niveles de lípidos en el suero. Las comparaciones entre la alimentación y los niveles de colesterol en el suero en grupos de población en que la alimentación es relativamente homogénea puede o no tener una correlación entre el consumo de grasas y los niveles de colesterol en el suero (Morris, Marr y Clayton, 1977; Garcia-Palmieri et al., 1980; Jacobs, Anderson y Blackburn, 1979). Es bien sabido que el nivel de colesterol en el suero varía ampliamente en las personas, incluso manteniendo una alimentación constante (Keys, Anderson y Grande, 1959), y que a la variación de las grasas y el colesterol en la alimentación hay personas que «hipo responden» y otras que «hiper responden» (Katan y Beynen, 1987; Katan et al., 1988). Además, los métodos para estimar la ingestión y la composición de los alimentos consumidos por las personas son muy limitados y con frecuencia no son fidedignos (Jacobs, Anderson y Blackburn, 1979; Livingstone et al., 1990; Schoeller, 1990; Black et al., 1993). Así pues, no es sorprendente que determinados estudios relativos a una población no muestren apenas relación entre los lípidos séricos y las estimaciones del contenido de grasa de su alimentación. Los estudios de intervención en que se puede controlar la alimentación demuestran que pueden provocarse cambios sensibles en los lípidos del suero variando la ingestión de grasas y de colesterol, lo cual concuerda con los hallazgos epidemiológicos. Grasas y lípidos séricos Muchos estudios han demostrado que la cantidad y composición de las grasas de la alimentación son los principales determinantes de los niveles de colesterol de LDL del suero. Se ha concluido que, con respecto a los carbohidratos, los ácidos grasos saturados elevan el nivel de colesterol del suero, mientras que los ácidos grasos poliinsaturados (ácido linoleico) lo bajan, y los ácidos grasos monoinsaturados (ácido oleico) no presentan efectos estadísticamente significativos (Keys, Anderson y Grande, 1957; Hegsted et al., 1965). Si bien algunos estudios realizados en los últimos 30 años han obtenido resultados diversos, en conjunto los datos actuales (Hegsted et al., 1993) confirman estas conclusiones generales respecto a los efectos relativos de los ácidos grasos saturados, poliinsaturados y monoinsaturados en los niveles de colesterol del suero. La capacidad específica de los ácidos grasos saturados y poliinsaturados de modificar los niveles lipidícos del suero no se ha definido claramente en todas las condiciones, y probablemente no sea posible hacerlo. Al principio, Keys y sus colaboradores (1957) pensaron que la capacidad de elevar el nivel de colesterol en el suero de una combinación de ácidos grasos saturados era el doble de la de los ácidos grasos poliinsaturados de bajarlo; estudios posteriores realizados por Hegsted (1965) han atribuido mayor capacidad a los poliinsaturados. Sin embargo, estudios individuales realizados con pocas personas y regímenes alimentarios pueden mostrar importantes diferencias en los efectos observados. Los análisis combinados (Mensink y Katan, 1992; Hegsted et al., 1993) concuerdan en que el efecto del ácido linoleico para bajar el nivel de colesterol es de 2 a 3 veces menor que el de los ácidos saturados para subirlo. No obstante, indican importantes diferencias en cuanto a la capacidad relativa según los datos elegidos para el análisis. Es incierto si esto se debe a las características de los individuos, de la alimentación o a las grasas estudiadas, la calidad de los estudios, etc. Está claro que el contenido de grasa de la alimentación y su composición son los principales determinantes de los niveles de colesterol en el suero; que los ácidos grasos saturados y el colesterol de la alimentación elevan el colesterol sérico, y que los ácidos grasos poliinsaturados (ácido linoleico) presentan un moderado efecto reductor del nivel de colesterol con respecto a los hidratos de carbono. Acidos grasos específicos y colesterol Acidos grasos saturados. Los primeros estudios (Keys, Anderson y Grande, 1965; Hegsted et al., 1965) sugerían que varios ácidos grasos saturados presentaban diversos efectos en los niveles de colesterol del suero. Ciertas grasas con elevados niveles de ácido esteárico no parecían ser tan hipercolesterolémicas como era de suponer por su gran contenido de ácidos grasos saturados. Estas diferencias fueron estudiadas utilizando grasas transesterificadas, incorporando ácido láurico, mirístico, palmítico y esteárico dentro de los aceites de oliva y de cártamo (McGandy, Hegsted y Myers, 1970). Muchos de estos preparados parecían tener una capacidad similar para elevar el nivel de colesterol, lo que sugería que la posición de los ácidos grasos en el triacilglicérido también podía ser importante. Datos más recientes (Bonanome y Grundy, 1988) también han indicado que el ácido esteárico puede no elevar apreciablemente los niveles de colesterol del suero. En general, los datos indican que el ácido esteárico en la mayoría de las grasas naturales influye muy poco en el nivel de colesterol del suero. Debe hacerse notar sin embargo que se desconocen los efectos del ácido esteárico y de otros ácidos grasos saturados en la propensión a la hipertensión, el cáncer, la obesidad y otras enfermedades. Además, los datos sobre la actividad de los ácidos grasos saturados respecto a la actividad trombótica son insuficientes. Así pues, todavía no se puede asegurar que sea conveniente sustituir en la alimentación el estérate por otros ácidos grasos saturados. Sigue habiendo un considerable desacuerdo respecto a la actividad relativa de los demás ácidos grasos saturados -láurico, mirístico y palmítico-. Los primeros datos (Hegsted et al., 1965), que sugerían que el ácido mirístico era de todos los ácidos grasos saturados el que más elevaba el nivel de colesterol, podrían deberse al diseño de los estudios. La grasa de mantequilla y el aceite de coco, ambos fuente de ácido mirístico, eran las principales grasas saturadas estudiadas, de forma que la ingestión total de ácidos grasos saturados se correspondía con la ingestión de ácido mirístico. Una comparación directa del ácido mirístico con el palmítico mostró que ambos elevan el nivel de colesterol de las LDL con respecto al ácido oleico, pero que el ácido mirístico era algo más potente en este sentido (Zock, 1994). La mayoría de los demás estudios epidemiológicos no han descrito la ingestión específica de ácidos grasos saturados (Denke y Grundy, 1992; Doherty e Iacono, 1992; Sundram, Hayes y Siru, 1994). Algunos estudios en animales y en el hombre (Hayes et al., 1991; Ng et al., 1991) han descrito efectos mínimos del ácido palmítico, pero esto puede deberse a la alimentación específica utilizada (Hayes et al., 1991; Pronczuk, Khosla y Hayes, 1994). En los estudios realizados con monos cebús, se describió que el ácido palmítico sólo eleva los niveles de colesterol cuando la ingestión de colesterol es alta (Khosla y Hayes, 1993), pero los estudios metabólicos realizados con voluntarios normolipídicos mostraron que el ácido palmítico eleva fuertemente el colesterol total (Bonanome, 1988; Denke, 1992; Zock, 1994). El ácido palmítico es el principal ácido graso saturado en la mayoría de regímenes alimentarios y se considera que los ácidos láurico, mirístico y palmítico son los principales ácidos grasos que producen hipercolesterolemia, aunque pueden diferir en cuanto a la potencia. En la Figura 9.1 se resumen los resultados recientes relativos a los distintos ácidos grasos. FIGURA 9.1 - Efectos de los distintos ácidos grasos de la dieta en el colesterol total y lipoproteico del suero Acidos grasos poliinsaturados. Sustituir los ácidos grasos saturados tanto por ácido oleico como por ácido linoleico baja los niveles de colesterol en el suero. En muchos estudios específicos no fue posible determinar si lo que producía la reducción del colesterol sérico era la adición del ácido oleico y/o linoleico, o la disminución de la ingestión de ácidos grasos saturados. Las ecuaciones predictivas atribuyen los cambios del colesterol sérico a cambios en los ácidos grasos saturados y poliinsaturados, mientras que se ha observado que el ácido graso monoinsaturado (oleico) tiene un comportamiento neutro (Keys, Anderson y Grande, 1957; Hegsted et al., 1965; Mensink y Katan, 1992; Hegsted et al., 1993) o un menor efecto en la disminución del colesterol (Mensink y Katan, 1992). Es interesante observar que en algunos estudios el contenido de ácido linoleico de los tejidos adiposos, que es probablemente un mejor indicador de la ingestión habitual y prolongada de ácido linoleico que los datos de la dieta (van Staveren et al., 1986), así como el contenido de ácido linoleico de los fosfolípidos y de los ésteres de colesterol del suero, mostraron una relación inversa entre los niveles de ácido linoleico y la incidencia del infarto de miocardio (Wood et al., 1984; Logan et al., 1978; Valek et al., 1985; Riemersma et al., 1986). Esto puede sugerir que la función protectora de los ácidos grasos poliinsaturados no se basa en el efecto sobre los niveles de fosfolípidos (Renaud et al., 1986). Los estudios realizados con animales (Charnock et al., 1985; Charnock, Abeywardena y McLennon, 1986) indican que los ácidos grasos poliinsaturados, especialmente los ácidos grasos n-3, pueden proteger contra las arritmias cardíacas. AEP y ADH. En los últimos años, la constatación de que las poblaciones que consumen pescado presentan una incidencia baja de ECC ha despertado gran interés por los aceites de pescado, que son las principales fuentes de ácido eicosapentanoico (AEP) y de ácido docosahexanoico (ADH) (Dyerberg et al., 1978). Aunque este hecho es bastante controvertido, el consumo de estos aceites parece tener relativamente poco efecto en los niveles de las LDL y de las HDL (Leaf y Weber, 1988). Los datos epidemiológicos indican que existe un claro efecto protector que probablemente se debe a los efectos que produce en los mecanismos trombóticos o inmunológicos más que en las lipoproteínas séricas. Muchos de los datos experimentales se basan en los regímenes alimentarios en que los aceites de pescado eran la principal mente de grasa, y no es probable que los resultados puedan extrapolarse a los niveles normales de consumo. Este, por supuesto, no es el caso de los resultados epidemiológicos. Colesterol alimentario. Aunque durante mucho tiempo se ha creído que el colesterol alimentario elevaba el nivel de colesterol sérico, se ha discutido acerca de la forma de la curva dosis - respuesta. Está claro que las respuestas observadas ante los cambios en la ingestión de colesterol son muy variables y pueden depender, en parte, de la naturaleza de las grasas alimentarias, de la ingestión de colesterol, y quizás de otros constituyentes de la alimentación. (Hopkins, 1992). Así, al igual que sucede con los cambios en las grasas alimentarias, probablemente no sea posible una buena definición cuantitativa de la respuesta esperada frente a los cambios en la ingestión de colesterol en todas las condiciones. Es importante destacar que en el modelo del roedor hámster (Spady y Dietschy, 1985; Woollett el al., 1992) la actividad del ácido linoleico como reductor del colesterol sólo se manifestaba claramente cuando el receptor de la LDL se suprimía suficientemente con el colesterol y/o las grasas saturadas de la alimentación. Esto puede explicar en parte la potencia limitada del ácido linoleico que se ha descrito en seres humanos que se alimentaban con preparados dietéticos con bajo contenido de colesterol (Hegsted y Nicolosi, 1990). Ensayos de intervención. Los ensayos de intervención confirman generalmente los efectos de las grasas y del colesterol, aunque los cambios observados son frecuentemente menores que en las pruebas metabólicas en que se puede controlar mejor la alimentación. Por ejemplo, cuando la alimentación finlandesa habitual, de alto contenido de grasas saturadas y colesterol, se sustituía con una alimentación de bajo contenido de grasas animales y alto contenido de grasas poliinsaturadas (Ehnholm et al., 1982), se observa un descenso significativo del colesterol sérico. En el sur de Italia, en un estudio de tipo inverso, en que el aceite de oliva y los carbohidratos fueron sustituidos por grasa animal se observó que producía un aumento sustancial de colesterol sérico y de las LDL (Ferro-Luzzi et al., 1984). En algunos estudios de campo se han observado modificaciones relativamente pequeñas de los lípidos séricos (Hunninghake et al., 1993), debido indudablemente a las dificultades para obtener datos adecuados sobre el consumo de los alimentos, así como una buena observancia de la dieta en ensayos de gran envergadura. El Estudio del Hospital Mental Finlandés (Turpeinen et al., 1979) describió un descenso significativo de ECC en personas que se alimentaban con regímenes alimentarios ricos en ácidos grasos poliinsaturados. Cuando se resumieron los resultados de varios ensayos (Committee on Diet and Health, 1989; Smith, Song y Sheldon, 1993), muchos de los cuales incluían fármacos para bajar el colesterol, los resultados fueron variados pero congruentes: la dieta puede tener el efecto deseado de bajar el colesterol sérico. Algunos estudios (Blankenhorn et al., 1987; Ornish et al., 1990; Schuler et al., 1992) demostraron que una dieta severamente restringida puede limitar o invertir realmente el desarrollo de las lesiones ateroscleróticas. Estos efectos inmediatos de la modificación de la alimentación en el desarrollo de lesiones parece estar de acuerdo con los cambios en la alimentación de las poblaciones, como los que se observaron en algunos países europeos durante la Segunda Guerra Mundial (Schettler, 1979). En los últimos años se ha observado un gran descenso de la mortalidad por ECC en algunos países. Este fue mayor en países como los Estados Unidos de América y Australia, que apoyaron la modificación de la alimentación en toda la población (Dwyer y Hetzel, 1980). En general, los datos de los ensayos de campo respaldan las conclusiones epidemiológicas y metabólicas sobre la necesidad de modificar la alimentación para bajar los niveles de colesterol del suero (Stamler et al., 1993). Efectos de la alimentación en las lipoproteínas Las lipoproteínas de baja densidad (LDL) transportan la mayor parte del colesterol y se identifican como la principal causa de aterosclerosis. Los efectos de los diversos ácidos grasos y del colesterol alimentarios en los niveles de LDL son generalmente paralelos a los anteriormente descritos para el colesterol sérico total (Mensink y Katan, 1992; Hegsted et al., 1993). Los ácidos grasos saturados, supuestamente los ácidos láurico, mirístico y palmítico, elevan los niveles de LDL; el ácido linoleico baja los niveles de LDL; y el ácido oleico parece tener un comportamiento neutro o lo rebaja ligeramente con respecto a los hidratos de carbono. Recientemente se ha sugerido que las LDL oxidadas son la principal y quizás la causa de la aterosclerosis. Las LDL oxidadas son más fácilmente captadas por los monocitos que dan lugar a la placa aterosclerótica. Algunos estudios sugieren que varios antioxidantes limitan el desarrollo de la aterosclerosis en los animales y en el hombre (Steinberg et al., 1989; Frei, England y Ames, 1989; Jialal, Vega y Grundy, 1990; Riemersma et al., 1991). A la vitamina E, los carotenoides y la vitamina C se les ha prestado una atención especial, pero también pueden ser eficaces otros antioxidantes (Bjorkhem et al., 1991). Se han asociado los consumos elevados de vitamina E con una reducción del riesgo de las enfermedades coronarias del corazón tanto en hombres (Rimm et al., 1993) como en mujeres (Stampfer et al., 1993). Así, para evaluar el riesgo relativo de enfermedad, deben tenerse en cuenta la ingestión y los niveles circulantes de éste y quizás de otros antioxidantes. Posiblemente esto irá cobrando importancia a medida que se vaya progresando en este campo. No se dispone de datos suficientes que indiquen la importancia relativa de los niveles circulantes de LDL en comparación con los niveles de antioxidantes. Esto no quita valor a los datos convincentes de que los niveles elevados de LDL constituyen un grave riesgo de ECC. Dentro de las poblaciones, los niveles altos de HDL están fuertemente relacionados con un reducido riesgo de ECC (Wilson, Abbott y Castelli, 1988; Gordon y Rifkind, 1989; Gordon et al., 1989; Knuiman et al., 1987). Se cree que las HDL protegen activamente contra las ECC (NIH Consensus, 1993), probablemente mediante un transporte inverso de colesterol, esto es, transporte desde la periferia hacia el hígado, aunque ello no es seguro en los seres humanos. En las poblaciones, el nivel de HDL viene determinado en parte por factores genéticos y en parte por las condiciones ambientales. Los niveles de HDL se reducen con la obesidad, el tabaco y las hormonas masculinas, y aumentan con la actividad física, así como con el consumo de alcohol, grasas saturadas y colesterol. Sin embargo, el aumento de las HDL atribuible a las grasas saturadas y al colesterol pesa menos que los grandes aumentos de las LDL. No se dispone de datos de que la manipulación de los niveles de las HDL, mediante la alimentación o por otro medio cualquiera, modifique la propensión a las ECC, y se debe aclarar el significado de los cambios en los niveles de HDL inducidos por la alimentación. Los resúmenes de los datos actuales (Mensink y Katan, 1992; Hegsted et al., 1993) indican que las tres clases de ácidos grasos tienden a elevar los niveles de HDL, siendo los ácidos saturados los más poderosos y los ácidos linoleicos los que menos influyen. Por otra parte, se sabe que los regímenes alimentarios con bajo contenido de grasas, que protegen contra las ECC, reducen también los niveles de HDL (Denke y Breslow, 1988). Después de reducirse las HDL mediante una alimentación de bajo contenido de grasas, se modifica su metabolismo (Brinton, Eisenberg y Breslow, 1990). Sin embargo, hay pocas razones para creer que no se puedan aconsejar modificaciones de la alimentación que reducen los niveles de LDL, aunque reduzcan también en cierto grado los niveles de HDL. Acidos grasos en trans Los efectos de los ácidos grasos en trans ya se han discutido en este informe. Los datos disponibles indican que la respuesta de las lipoproteínas séricas frente a los ácidos grasos monoinsaturados en trans es similar a la que se da frente a los ácidos grasos saturados. Todavía queda por aclarar si presentan efectos específicos sobre las HDL, como indican los estudios de Mensink y Katan (1990), o no (Judd et al., 1994). Conclusión Existen numerosos datos que apoyan la conclusión de que los niveles elevados de colesterol en el suero y las LDL constituyen el principal riesgo de aterosclerosis y de enfermedades coronarias del corazón. El grado de riesgo puede modificarse con varios antioxidantes e interacciones complejas entre el grado de la aterosclerosis, trombótica y fibrolítica, y la reactividad vascular. Cuando se suministran varias grasas a seres humanos en condiciones controladas, las diferencias en la longitud de la cadena y en el número y geometría de los dobles enlaces de los ácidos grasos inducen notables diferencias en la concentración de lípidos y de lipoproteínas del suero sanguíneo. En relación con los hidratos de carbono, los ácidos grasos saturados - láurico, mirístico y palmítico - elevan tanto el colesterol de las HDL como el de las LDL, y reducen el colesterol de las VLDL, y los triglicéridos. En la mayoría de las grasas, el ácido esteárico parece presentar un efecto menor. El ácido linoleico reduce las LDL, mientras que el ácido oleico parece ser neutro. Los ácidos oleico y linoleico pueden elevar moderadamente los niveles de las HDL en relación con los hidratos de carbono, presentando el ácido linoleico el menor efecto. Los isómeros en trans del ácido oleico elevan los niveles de las LDL, y pueden reducir los de las HDL, mientras que hasta el momento no se está seguro sobre los efectos sobre otras lipoproteínas. Los ácidos grasos de los aceites de pescado reducen sensiblemente los triglicéridos del suero, pero parecen tener escaso efecto sobre los niveles de las LDL y las HDL. El colesterol alimentario también eleva los niveles de las LDL y, probablemente, los de las HDL. En general, los estudios metabólicos sobre los efectos de las grasas y del colesterol alimentarios en los lípidos y las lipoproteínas del suero concuerdan con los estudios epidemiológicos y de intervención, y con las tendencias observadas a lo largo del tiempo en varias poblaciones. Cada tipo de estudio concluye que las modificaciones de la alimentación que reducen los niveles de colesterol y de LDL en el suero disminuyen el riesgo de ECC. Capítulo 10 - Acidos grasos isoméricos En condiciones de hidrogenación parcial, un doble enlace puede cambiar de configuración cis a trans (isomerización geométrica) o cambiar de posición dentro de la cadena de átomos de carbono (isomerización posicional). Ambos tipos de isomerización se dan frecuentemente en un ácido graso sometido a hidrogenación. Los ácidos grasos en trans son ácidos grasos insaturados que tienen al menos un doble enlace en configuración trans. Los ácidos grasos en trans más frecuentes son los monoinsaturados, pero también pueden encontrarse isómeros diinsaturados con configuraciones cis, trans o trans, cis. En los ácidos grasos monoinsaturados en trans procedentes de aceites parcialmente hidrogenados, el doble enlace tiende a distribuirse normalmente entre las posiciones 9 y 11, con una gama de 5 a 15 (Dutton, 1979; Marchand, 1982). Presencia en los alimentos Las fuentes más frecuentes de ácidos grasos isoméricos son las margarinas y grasas de repostería que contienen aceites de pescado o vegetales parcialmente hidrogenados. Los productos lácteos y la carne de los rumiantes adquieren sus ácidos grasos isoméricos en el proceso de hidrogenación que se da en el rumen, donde las bacterias realizan una fermentación anaerobia. En la grasa de la leche, puede haber un doble enlace en trans entre las posiciones 6 y 16, con preferencia por la posición 11. Los ácidos grasos en trans representan aproximadamente el 5 por ciento del total de los ácidos grasos en productos de vacunos y ovinos, mientras que en las grasas hidrogenadas comercialmente pueden representar más del 50 por ciento (Gurr, 1990). Siempre que se consumen grasas parcialmente hidrogenadas, se ingieren tanto isómeros en cis como en trans, aunque suele utilizarse la presencia de ácidos grasos en trans para detectar grasas hidrogenadas. La hidrogenación de los ácidos grasos poliinsaturados aumenta el surtido de isómeros. Aunque los niveles de isómeros cis, trans y trans, cis del ácido linoleico de las margarinas sólidas representa una proporción de hasta el 7,6 por ciento de los ácidos grasos, y los ácidos grasos con dos dobles enlaces en trans un 2,8 por ciento, la mayoría se encuentra por debajo del 1 por ciento (Ratnayake, Hollywood y O'Grady, 1991). En el aceite de canola parcialmente hidrogenado, se vio que el principal isómero poliinsaturado era el ácido 9-cis,13-trans octadecadienoico (Ratnayake y Pelletier, 1992). El enlace en cis de la posición 9 del ácido linoleico se mantiene en la mayoría de sus isómeros. La presencia de isómeros de los ácidos grasos poliinsaturados puede controlarse en el proceso de elaboración del aceite. Unos buenos métodos de elaboración de aceites proporcionan aceites con concentraciones bajas de isómeros cis, trans y trans, cis. Se han hecho diversas estimaciones sobre los consumos de ácidos grasos en trans. El consumo medio que se dio para la población de los Estados Unidos de América, basándose en datos sobre el consumo aparente, fue de 7,6 g/día, y tras una revisión posterior, de 8,1 g/día (Hunter y Applewhite, 1986; 1991). Otros cálculos han sugerido un consumo medio de 13,3 g/día, basándose en hipótesis de que los servicios de comidas y las grasas de repostería industriales tienen un 40 por ciento de ácidos grasos en trans, y los aceites de cocina y de ensalada un 25 por ciento (Enig et al., 1990; Steinhart y Pfalzgraf, 1992, 1994). En Alemania occidental, el consumo de ácido trans-octadecenoico se estimó en 4,5 a 6,4 g/persona/día, con un 35-45 por ciento de productos procedentes de los rumiantes (Heckers et al., 1979). Para la población británica, se calculó un consumo medio de 7 g/día, con una gama de 5 a 27 g/día, dependiendo de la selección de alimentos (British Nutrition Foundation, 1987). En la India, el consumo medio de grasas hidrogenadas con un 55 por ciento de ácidos grasos en trans era de 2,04 g/día (National Council for Applied Economic Research, 1991). Un adulto que viva en los Estados Indios de mayor consumo puede tener un aporte de aproximadamente 11 gramos o el 4 por ciento de la energía alimentaria diaria en forma de ácidos grasos en trans. Los niveles medios aparentes del aporte pueden no ser tan importantes para la salud como los niveles superiores, y sería útil obtener estimaciones del percentil 90 del aporte de ácidos grasos en trans en cada zona geográfica. Se espera que el consumo de ácidos grasos isoméricos disminuya ulteriormente, a medida que las margarinas blandas y los productos con bajo contenido de grasa sigan reemplazando a los productos en barra o molde. La sustitución de la manteca de cerdo y del sebo con aceite parcialmente hidrogenado tendría, sin embargo, el efecto contrario. Se debe tener cuidado cuando se sustituyen las grasas, a fin de que una reducción de isómeros en un tipo de alimentos no conduzca a su aumento en otro alimento. Efectos metabólicos en los animales Al examinar las primeras publicaciones, se puede ver que muchos resultados que inicialmente se atribuyeron a los ácidos grasos en trans se debían en realidad a una deficiencia de ácidos grasos esenciales (Beare-Rogers, 1983; Gurr, 1983). Los ácidos grasos monoinsaturados isoméricos, así como los ácidos grasos saturados, tienden a ocupar la posición 1 de los fosfoglicéridos animales, y los ácidos poliinsaturados la posición 2. Los estudios sobre el modelo general de los ácidos grasos en los constituyentes de la membrana concluyen que, con los ácidos poliinsaturados adecuados, los ácidos monoinsaturados en trans no se acumulan en la posición 2 de los fosfoglicéridos ni afectan a la producción de eicosanoides. Una tasa de 2 en por ciento de energía de ácido linoleico en la alimentación es suficiente para evitar el efecto en la síntesis de eicosanoides (Zevenbergen y Haddeman, 1989). Cuando se alimentaban ratas con grandes dosis de ácidos grasos en trans, la evaluación del contenido de ácido linoleico necesario para prevenir cambios metabólicos dio la cifra de 5 por ciento en grasa o de 2 en por ciento de energía (Verschuren y Zevenbergen, 1990). Un contenido suficiente de ácidos grasos esenciales es, sin embargo, crítico para evitar los efectos específicos de los ácidos grasos isoméricos. Acidos grasos poliinsaturados en trans. En estudios realizados con isótopos deuterados, los isómeros trans-9, cis-12 se acumulaban en el hígado de los ratones de 2 a 4 veces más que los isómeros cis-9, trans-12 (Beyers y Emken, 1991). La actividad del isómero trans, cis para aumentar la desaturación de la posición 9 era similar a la que se observaba en animales con deficiencias de ácidos grasos. La posición del doble enlace en trans parece influir en varias actividades enzimáticas. En los animales, se ha estudiado extensamente el ácido trans-9, trans12 octadecadienoico (Kinsella et al., 1981). Este isómero es el que tiene mayor potencial para interferir en el metabolismo de los ácidos grasos esenciales y de los eicosanoides a nivel enzimático. Este isómero se genera en cantidades insignificantes, y se espera que se mantenga así. Estudios en el hombre Datos experimentales. La deposición de ácidos grasos isoméricos en los tejidos humanos ha despertado mucho interés. En el Reino Unido, se ha descrito que el contenido de ácidos grasos en trans del tejido adiposo es del 5 por ciento (Thomas et al., 1981). Los análisis de los tejidos durante las autopsias rutinarias en los Estados Unidos de América mostraron que los niveles de ácido trans-octadecenoico variaban entre el 0,4 y el 5 por ciento de los ácidos grasos totales, y reflejaba la distribución de isómeros de las grasas alimentarias (Ohlrogge, Emken y Gulley, 1981). La mayor concentración de isómeros en trans se presentaba en los tejidos adiposo, cardíaco y aórtico, con triacilglicéridos con patrones isoméricos similares a los de los aceites alimentarios e incorporación selectiva de fosfatidilcolina, si bien mucho menos que la que se da en los animales y en los experimentos in vitro (Ohlrogge, Gulley y Emken, 1982). Se observaba una tendencia a retener isómeros con el doble enlace próximo al grupo metilo terminal, sin que se acumulara ningún isómero. Los estudios han demostrado que en los varones adultos no se produce una discriminación en la absorción u oxidación de los distintos isómeros octadecenoicos marcados con deuterio y suministrados en forma de triacilglicéridos (Emken et al., 1979, 1980a, b; Emken, 1984). Tras una única comida que contenía estos triacilglicéridos, se midió la incorporación de los distintos isómeros en varios lípidos del plasma. El isómero cis-12 se había incorporado en la posición 2 de la fosfatidilcolina, pudiendo por tanto reemplazar al ácido araquidónico. Los ácidos grasos poliinsaturados en trans que más tiempo permanecen en el tejido adiposo humano parecen ser el ácido 9-cis, 12-trans octadecadienoico (Hudgins, Hirsch y Emken, 1991; Ratnayake y Pelletier, 1992). Se desconocen sus efectos en el metabolismo de los ácidos grasos esenciales y en los eicosanoides. Colesterol. Durante más de tres décadas, se han obtenido resultados diversos al tratar de relacionar los ácidos grasos en trans con las variaciones del colesterol total en el suero o en el plasma. Hunter (1992) y Wood (1992) los han revisado. Dos estudios publicados en el mismo año realizados con dietas a base de preparados líquidos llegaron a conclusiones opuestas. Cuando se suministró una dieta que contenía ácidos grasos monoinsaturados en trans a monjes y monjas trapenses blancas en Holanda, los niveles de colesterol sérico aumentaron en presencia de colesterol alimentario, pero no en su ausencia. Los niveles de colesterol del suero tras cuatro semanas de alimentación experimental eran mayores en el grupo que había recibido los ácidos grasos saturados (láurico y mirístico), seguido por el grupo que había recibido grasas con un 38 por ciento de ácidos grasos en trans y, por último, el grupo que había recibido ácido oleico. En comparación con los valores iniciales del período de alimentación experimental, los valores de colesterol del grupo que había recibido ácido oleico habían disminuido, y los del grupo que había recibido ácidos saturados habían aumentado ligeramente (Vergroesen, 1972; Vergroesen y Gottenbos, 1975). El otro gran estudio con dietas a base de preparados líquidos que contenían colesterol se realizó en los Estados Unidos de América con presidiarios que en su mayoría eran negros y procedentes de centros urbanos. La grasa de las dietas que contenían un 34 por ciento de ácidos grasos monoinsaturados en trans dio resultados diferentes de la grasa control, con un alto contenido de ácido oleico (Mattson, Hollenbach y Kligman, 1975). Un estudio posterior realizado a estudiantes universitarios indicaba que el aceite de soja ligeramente hidrogenado era menos eficaz que el aceite de soja sin hidrogenar para reducir el colesterol total y el de las proteínas de baja densidad (Laine et al., 1982). Lipoproteínas. Las primeras medidas sobre lipoproteínas realizadas en un estudio sobre los ácidos grasos en trans fueron descritas en 1990 (Mensink y Katan, 1990). Hombres y mujeres con niveles normales de colesterol consumieron una dieta de alimentos variados: un grupo recibió una dieta rica en ácido oleico, otro una dieta rica en ácidos monoinsaturados en trans, y el tercero consumió una dieta rica en ácidos grasos saturados para aportar el 10 por ciento de la energía total. Los ácidos grasos de la dieta se equilibraron de forma que el aporte de ácido esteárico (4,6 por ciento de energía) totales fueron similares en las dietas ricas en ácido oleico o en ácidos grasos en trans. En comparación con la dieta del ácido oleico, la dieta de los ácidos en trans aumentó el colesterol de LDL y redujo el colesterol de HDL, mientras que la dieta de los ácidos saturados aumentaba las LDL y no producía cambios en el colesterol de HDL al cabo de tres semanas. Tanto la dieta de los ácidos en trans como la de los ácidos saturados aumentaron los triacilglicéridos. Los resultados sobre las lipoproteínas equipararon los resultados de las LDL y de las HDL. El cociente LDL/HDL era mayor en la dieta de los ácidos en trans que en la dieta de los ácidos saturados. Los datos indicaron que los ácidos grasos en trans no presentaban ninguna ventaja sobre los ácidos grasos saturados. Aunque las grasas que se emplearon en este estudio eran grasas isomerizadas catalíticamente más que hidrogenadas comercialmente, contenían los isómeros en trans que son frecuentes en los regímenes alimentarios «occidentales». La mayor diferencia entre las grasas del ensayo y las de los regímenes alimentarios de los Estados Unidos de América pareció ser un isómero posicional en cis con un doble enlace en la posición 8 (Mensink y Katan, 1991). El mismo laboratorio realizó un segundo experimento con un nivel de ácidos grasos en trans menor, 7,7 por ciento en lugar del 10 o el 11 por ciento de la energía (Zock y Katan, 1992). La dieta de los ácidos grasos en trans se comparó con una rica en ácido linoleico y otra rica en ácido esteárico, un ácido graso del que no se sabe que eleve los niveles de colesterol. En comparación con el ácido linoleico, los ácidos grasos isoméricos elevan el LDL-colesterol y reducen el HDL-colesterol. Un estudio realizado en los Estados Unidos de América comparó los ácidos grasos saturados, el ácido oleico, y dos niveles (3,8 y 6,6 de energía) de isómeros en trans (Judd et al., 1994). Todas las dietas conteman al menos un 10 por ciento de energía de ácidos grasos saturados: ácidos láurico, mirístico y palmítico, y un 3 por ciento de energía de ácido esteárico. El ácido linoleico se mantuvo en un 6 por ciento de energía de la dieta. El experimento, estrictamente controlado, mostró diferencias en los efectos de los ácidos grasos monoinsaturados en cis y en trans, incluso cuando constituían menos del 4 por ciento de energía. Tras seis semanas con las dietas de ensayo, las dietas «moderadamente trans», «trans altas» y saturadas elevaron los niveles de colesterol. En consonancia con los resultados de Mensink y Katan (1990), una dieta que contenía ácidos grasos en trans elevaba el colesterol de LDL y la apoproteína B, y reducía el colesterol de HDL y, en menor grado, la apoproteína A-1, en comparación con la dieta oleica. Se observaron cambios estadísticamente significativos con niveles menores de aporte, puesto que la dieta saturada elevaba tanto el colesterol de LDL como el colesterol de HDL. La relación entre colesterol de LDL y HDL era menos favorable con la dieta del 6,6 por ciento de energía de ácidos grasos en trans que con la dieta saturada. La dieta que contenía el 6,6 por ciento de energía de ácidos grasos en trans, en comparación con las otras dietas estudiadas, elevaba también el nivel de triacilglicéridos en la sangre. Aunque los cambios globales eran pequeños, los ácidos grasos en trans y los ácidos grasos saturados presentaban efectos algo similares. Los cocientes LDL/HDL obtenidos en los experimentos de Mensink y Katan (1992-Exp. 1), Zock y Katan (1990-Exp. 2), y Judd et al. (1994) son indicativos respecto a la respuesta a la dosis de ácidos grasos en trans (Figura 10.1). Un estudio realizado con varones que padecían hipercolesterolemia ligera mostró que un aumento del 4 por ciento de los ácidos grasos monoinsaturados en trans no anulaba la capacidad de los aceites vegetales de reducir el nivel de las LDL cuando la concentración de ácido linoleico era aproximadamente tres veces mayor que la de ácido palmítico (Nestel et al., 1992). Considerando los patrones dietéticos más conocidos, este tipo de distribución es altamente improbable. Otros estudios emplearon grasas de ensayo que contenían ácidos grasos en trans en la alimentación de hombres de vida libre con valores normales de colesterol (Wood et al., 1993a, b). Una margarina blanda sin ácidos grasos en trans y rica en ácido linoleico reducía significativamente el colesterol total, el colesterol de LDL y la apolipoproteína B con respecto a otras dietas probadas. No había cambios en el colesterol de HDL en dietas con proporciones 1:1:2 de saturados, monoinsaturados y poliinsaturados. Las dietas con mantequilla elevaban el colesterol total del suero y el de las LDL, mientras que las margarinas duras producían resultados similares a los de las mezclas mantequilla - aceite de girasol y mantequilla - aceite de oliva. Las diferentes respuestas frente a las margarinas blandas y duras se atribuyeron principalmente a los ácidos grasos en trans y apoyaron los descubrimientos de Mensink y Katan (1990). FIGURA 10.1 - Influencia de los ácidos grasos en trans sobre los niveles de colesterol de las LDL y HDL La margarina con aceite de maíz hidrogenado que se había utilizado para sustituir al aceite de maíz sin hidrogenar en una dieta diseñada para reducir el colesterol plasmático produjo menos reducción del colesterol total, del colesterol de LDL y de la apoproteína B, pero no hubo diferencias en el colesterol de HDL ni en la Lp(a) (Lichtenstein et al., 1993). Las dietas eran ya de contenido bajo en ácidos grasos saturados y en colesterol. En laboratorios australianos y holandeses, la lipoproteína (a) [Lp(a)], que se considera un factor independiente del riesgo de las enfermedades cardiovasculares, aumentaba en las personas a las que se suministraban ácidos grasos en trans, aunque esto no se había detectado en los Estados Unidos de América. Se suministró una dieta rica en ácido elaídico, que probablemente contenía isómeros en trans distintos del isómero 9trans, con una ingestión de trans del 7 por ciento de la energía, en sustitución del ácido oleico (Nestel et al., 1992). Los niveles de LDL resultantes eran similares a los que producían los ácidos grasos saturados y eran mayores que los que se obtenían con el ácido oleico. Sólo la dieta que contenía los isómeros en trans produjo aumentos significativos de Lp(a). Análogamente, un examen de las muestras obtenidas en estudios previos sobre las grasas y las lipoproteínas de la dieta demostró que los ácidos grasos isoméricos iban asociados con un aumento de la Lp(a) (Mensink et al., 1992). El ácido oleico producía el efecto de disminuir la Lp(a) y el colesterol de las LDL. Parece improbable que los efectos de la dieta sobre el colesterol de LDL y la Lp(a) sean transmitidos por la misma vía. Se han empleado distintos protocolos en los diversos estudios para determinar el efecto de los ácidos grasos en trans sobre las lipoproteínas plasmáticas. La precisión lograda con el experimento puede haberse visto afectada por el hecho de que las personas recibieran alimentos de una dieta completa o la selección de alimentos no considerados para el ensayo. La parte de la dieta que no se controló pudo tener grandes variaciones en la composición de los ácidos grasos, y en concreto en el contenido de ácidos grasos isoméricos. Cabe señalar que en los estudios que muestran variaciones definidas tanto del colesterol de LDL como de HDL se prepararon las comidas para las personas del ensayo. Hasta el momento, sólo se han estudiado en investigaciones humanas controladas los ácidos grasos en trans que se encuentran en los aceites vegetales parcialmente hidrogenados. No se sabe qué efectos tienen los aceites de pescado parcialmente hidrogenados con ácidos grasos C20 y C22 en los perfiles de las lipoproteínas humanas. Datos epidemiológicos. Los estudios epidemiológicos han incluido diseños prospectivos de casos y de controles, y de muestras representativas. Las personas que en el Reino Unido han muerto de cardiopatía isquémica presentaban bajas concentraciones de ácidos grasos de cadena corta y mayores concentraciones de ácidos grasos en trans en la grasa del tejido adiposo, por lo que se pensó que habían consumido menos grasa animal de rumiantes y más grasa hidrogenada comercialmente (Thomas y Scott, 1981; Thomas, Winter y Scott, 1983). Un intento de estimar el aporte de ácidos grasos en trans en hombres adultos a partir de cuestionarios semicuantitativos de frecuencia de alimentos indicó que los percentiles 10 y 90 del aporte estaban en 2,1 y 4,9 g/día, respectivamente (Troisi, Willett y Weiss, 1992). Estas estimaciones tan bajas en comparación con la media de 8,1 g/día (Hunter y Applewhite, 1991) mostraron una escasa correlación positiva con el colesterol de LDL y una correlación inversa con el colesterol de HDL. En el Estudio Sanitario de las Enfermeras, los quintiles variaron desde el 1,3 hasta el 3,2 por ciento de energía, o de 2,4 a 5,7 g/día, y se encontraban por debajo de la gama de consumo medio esperado (Willett et al., 1993). Se emplearon alimentos como margarinas, bizcochos, galletas y pasteles y pan blanco para calcular los ácidos grasos en trans de la grasa vegetal hidrogenada. El riesgo relativo de padecer infartos del miocardio era 1,6 en comparación con aquéllas que presentaban los menores consumos. En un estudio transversal realizado con pacientes a quienes se les hizo angiografía coronaria (Siguel y Lerman, 1993) se observaron valores algo superiores de ácidos grasos en trans respecto a las personas de referencia (1,38 por ciento frente a 1,11 por ciento). Otros datos empleados para apoyar la hipótesis de que el consumo de aceites vegetales parcialmente hidrogenados puede contribuir a aumentar el riesgo de las enfermedades cardiovasculares procede de un estudio de caso y de controles en que los riesgos relativos de aumento de los quintiles del consumo de ácidos grasos en trans eran 1; 0,74; 0,43; 0,63 y 1,94 (Ascherio et al., 1994). Es interesante el hecho de que el tercer quintil representa menos de la mitad de riesgo que el primer quintil, y sólo el quintil superior estaba relacionado con el aumento del riesgo. Uno de los principales inconvenientes de estos estudios epidemiológicos es la media de la exposición a los ácidos grasos isoméricos. Incluso dentro de un grupo de alimentos, existe una gran variación en la concentración de ácidos grasos en trans (Ratnayake et al., 1993). Embarazo y lactancia Dependiendo de la alimentación de la madre, la leche humana puede contener diversas cantidades de ácidos grasos en trans. Koletzko (1991) detectó la transferencia de los ácidos grasos en trans a través de la placenta humana, y describió una relación inversa entre la exposición a los ácidos grasos en trans y el peso al nacer de los niños prematuros. Estudios posteriores indicaron que los ácidos grasos en trans de los lípidos del plasma de los recién nacidos se relacionaban negativamente con los ácidos araquidónico y docosahexaenoico (Koletzko, 1992). Se requieren más estudios en este sector. Si existe alguna posibilidad de deficiencia de los ácidos grasos esenciales durante el embarazo y la lactancia, como observaron Holman, Johnson y Ogburn (1991), el nivel de consumo de los ácidos grasos en trans podría tener importancia. Basándose en los experimentos con animales, el consumo de ácido linoleico tiene una importancia crítica cuando la alimentación contiene aceites parcialmente hidrogenados. Conclusiones En los estudios metabólicos controlados en los que se emplea ácido oleico como referencia, los ácidos grasos en trans procedentes de aceites parcialmente hidrogenados elevan el colesterol de LDL del plasma de forma similar a lo que se observa con los ácidos grasos saturados. Sin embargo, a diferencia de los ácidos grasos saturados, los ácidos grasos en trans no elevan el colesterol de HDL del plasma, y pueden bajar esta fracción lipídica en comparación con el ácido oleico. Así, el cociente entre colesterol total y HDL parece ser más desfavorable con los ácidos grasos en trans que con cantidades equivalentes, ya sea de ácido oleico o de ácidos grasos saturados. En dos estudios, los ácidos grasos saturados aumentaron los niveles de lipoproteína (a), otro factor de reconocida importancia en las enfermedades coronarias del corazón. Se pueden sacar varias conclusiones. En primer lugar, los ácidos grasos isoméricos de los aceites vegetales parcialmente hidrogenados parecen generar hipercolesterolemia, aunque la interpretación de los estudios epidemiológicos es insegura. En segundo lugar, cuando se reduce la ingestión de ácidos grasos saturados, parece oportuno reducir los ácidos grasos en trans para mejorar el perfil de las lipoproteínas plasmáticas. Se debe estimular a los consumidores a que sustituyan las grasas sólidas por aceites líquidos, margarinas blandas y derivados, siempre que sea posible. En tercer lugar, cuando exista posibilidad de deficiencia de ácidos grasos esenciales durante el embarazo y la lactancia, deben evitarse los aportes elevados de ácidos grasos en trans. En cuarto lugar, se estimula a los productores de alimentos a que reduzcan en lo posible la isomerización de los ácidos grasos. Es inaceptable que se utilicen mensajes publicitarios como «bajo en saturados» cuando un producto es rico en isómeros en trans (insaturados). En quinto lugar, los gobiernos deben vigilar el consumo de los isómeros de los ácidos grasos y regular las declaraciones de propiedades de los productos que los contienen. Capítulo 11 - El cáncer y las grasas alimentarias Los primeros estudios demostraron claramente que los ratones y las ratas que se habían alimentado con dietas ricas en grasas eran mucho más propensos al cáncer de piel y de mama que los animales alimentados con dietas de bajo contenido de grasas (Tannenbaum y Silverstone, 1953; Tannenbaum, 1959). No se prestó mucha atención a estos estudios hasta que los datos epidemiológicos demostraron que la incidencia de determinados tipos de cáncer era mucho mayor en los países con alimentación rica en grasas que en aquéllos con alimentación de bajo contenido de grasas (Carroll, 1975; Carroll y Khor, 1975). A partir de entonces, muchos datos experimentales han mostrado que alimentando a las ratas o ratones con alimentos ricos en grasas aumenta la propensión al cáncer de mama, piel, colon, páncreas y próstata. En estos estudios se utilizaron varios carcinógenos para inducir cáncer o, en algunos casos, tumores espontáneos. Muchas de las pruebas que relacionan la alimentación con el cáncer se han presentado y debatido en trabajos recientes (US Department of Health and Human Services, 1988; National Research Council, 1982, 1989). Epidemiología Se han descrito distintos tipos de datos epidemiológicos. Los primeros pueden incluirse en la categoría de correlaciones intranacionales e internacionales. Los datos recopilados por la OMS sobre incidencia del cáncer o mortalidad por éste se han clasificado por edades y normalizado (Kurihara y Aoki, 1984; Parken et al., 1992), y después se han comparado con los datos de consumo aparente de grasas recopilados por la FAO (FAO, 1980b). Los datos de consumo aparente de las grasas no tienen en cuenta los desechos y los primeros datos, expresados como gramos consumidos por personas y por día, sobreestimaron mucho el consumo efectivo. Sin embargo, cuando se expresa el contenido de grasas como porcentaje de la energía total, los valores se aproximan al consumo habitual y muestran una fuerte correlación positiva con la mortalidad por cáncer. Al ser las poblaciones comparadas de gran tamaño, estos estudios tienen en cuenta las variaciones de los hábitos alimentarios y los factores genéticos. Así, es probable que las diferencias observadas puedan atribuirse con seguridad a factores ambientales. Por otra parte, la precisión de los datos sobre mortalidad difiere según el país y el tipo de cáncer. Asimismo, la fiabilidad de los datos de consumo aparente de las grasas varía, y las estimaciones brutas del consumo de grasas no aportaron información sobre las prácticas alimentarias de las personas en que se desarrolla o no el cáncer. Se han presentado las comparaciones entre grupos dentro de un mismo país, como los estudios de los Estados Unidos de América en los que se comparan los Adventistas del Séptimo Día con la población general (Phillips et al., 1980) y los grupos étnicos de Hawaii (Kolonel et al., 1982). Estos estudios consideran grupos más pequeños que las comparaciones entre países, y las correlaciones con el consumo de grasas son generalmente bajas. Las tendencias en función del tiempo y los estudios de migraciones aportan un segundo tipo de datos epidemiológicos. Los diferentes patrones de alimentación y de cáncer dentro de los países o en grupos que han emigrado proporcionan algunas de las pruebas más sólidas de que son los factores ambientales, más que los hereditarios, los que determinan las diferencias geográficas en la incidencia del cáncer y en la mortalidad. Las mencionadas tendencias en el Japón (Hirayama, 1979) y entre emigrantes japoneses (Prentice y Sheppard, 1990), chinos y de varios países europeos (Gori, 1978; McMichael y Giles, 1988; Prentice y Sheppard, 1990) indicaron generalmente que el cambio de dietas con bajo contenido en grasas a dietas con alto contenido en grasas va acompañado de determinados tipos de cáncer, como el mamario y el de colon, que se correlacionan positivamente con los consumos de grasas de los datos internacionales. No existen informes sobre emigrantes cuya alimentación varíe de alimentación con alto contenido de grasas a una alimentación con bajo contenido de grasas, lo que tendría un interés considerable. Los estudios de casos y de controles aportaron un tercer tipo de prueba. Se ha comparado la alimentación de grupos de personas con determinado tipo de cáncer con la de otras personas de edades similares que no padecen cáncer. Generalmente, estos estudios no han podido indicar una conexión entre alimentación y cáncer. Estas comparaciones afectan a personas que son claramente propensas a padecer cáncer o que han sido expuestas a estímulos iniciadores adecuados; estos factores pueden no ser ciertos para las personas del grupo de control. Tales estudios dependen de la capacidad de las personas de mantener con exactitud sus hábitos alimentarios durante años, lo cual es probablemente poco realista. Por otra parte, puede que sus hábitos alimentarios normales varíen por la presencia de la enfermedad. Hay datos importantes que indican que las grasas alimentarias pueden actuar en primer lugar durante la etapa de favorecimiento de la carcinogénesis. Así, no es de sorprender que este tipo de datos no aporte datos sólidos de asociación entre alimentación y cáncer (Carroll, 1994). Un cuarto tipo de datos epidemiológicos viene de los estudios de cohorte. En estos estudios, se vigila durante un tiempo a un grupo de personas que no padecen la enfermedad, después de que se hayan evaluado su alimentación y otras características. Como en algunas de las personas se desarrolla el cáncer u otras enfermedades, se procura comparar las características de estas personas con las de las que no padecen la enfermedad. En comparación con los estudios de casos y de controles, este tipo de estudio presenta la ventaja de que no existe ningún medio de selección relativo a la propensión a la enfermedad. Además, la alimentación y otras características del presente pueden evaluarse posiblemente con más exactitud que otras características del pasado. Sin embargo, el grupo tiene normalmente prácticas alimentarias bastante homogéneas, y no es seguro que las técnicas disponibles puedan definir correctamente los hábitos alimentarios de las personas. Las correlaciones entre consumos de nutrientes evaluados con distintos métodos son relativamente escasas (Willett et al., 1985), y con frecuencia en este método se han observado limitaciones (Goodwin y Boyd, 1987; Freudenheim y Marshall, 1988; Hebert y Kabat, 1991: Hegsted, 1989). Estudios de intervención En las pruebas clínicas, los participantes son asignados al azar a un grupo «de control» o un grupo «de tratamiento»; al grupo «de tratamiento» se le asesora sobre la alimentación o el tratamiento adecuado, y al grupo «de control» se le dan consejos generales. Los grupos son objeto de seguimiento a lo largo del tiempo para determinar la observación de las disposiciones dietéticas y en quién se desarrolla la enfermedad. Muchos consideran este método como un medio adecuado para probar la eficacia de la alimentación o de otros métodos de tratamiento o prevención de la enfermedad. Sin embargo, los problemas de las pruebas de intervención alimentaria son enormes. Los grupos deben ser grandes, y los estudios son intensivos, caros, y deben prolongarse durante largos períodos de tiempo. Un importante problema consiste en la evaluación de las distintas prácticas alimentarias dentro de los grupos, especialmente cuando, en muchos casos, el público en general está recibiendo los mismos consejos que el grupo de tratamiento. Como se prevé que la enfermedad se desarrolle en relativamente pocas personas, se debe identificar la alimentación de las personas para averiguar el grado de observancia de las disposiciones dietéticas en aquéllas en las que se desarrolla o no la enfermedad. Los actuales métodos de evaluación de la ingestión muestran desviaciones respecto a los aportes energéticos descritos, al parecer independientemente de la metodología empleada (Livingstone et al., 1990; Schoeller, 1990; Black et al., 1993). Es claro que los participantes en los grupos de tratamiento se encuentran bastante presionados, por lo que describen patrones de consumo que se aproximan a las instrucciones. En los intentos sobre ensayos en gran escala de regímenes alimentarios de bajo contenido de grasas los participantes en los estudios describieron aportes energéticos excesivamente bajos, lo que plantea dudas sobre la fiabilidad de los datos de consumo de alimentos (Henderson et al., 1990; Hunninghake et al., 1993). Estos datos parecen confirmar la conclusión de que cuantos más consejos reciban los grupos, menos fidedignos se hacen los datos sobre consumo de alimentos (Mertz, 1992). Se pone en duda, por tanto, la utilidad o factibilidad de los ensayos de intervención para probar los efectos de la alimentación en la incidencia de las enfermedades. Los estudios experimentales con animales permiten un control absoluto de la alimentación, pueden realizarse a lo largo de toda la vida del animal, y se han utilizado para ensayar una amplia gama de productos carcinógenos y de tipos de alimentación. La cuestión es si los resultados obtenidos con animales pueden extrapolarse al hombre. Si los efectos de los constituyentes alimentarios concuerdan con las correlaciones epidemiológicas que se han observado, es verosímil que exista una relación causal entre alimentación y cáncer. Grasas alimentarias y cáncer mamario y de colon Datos epidemiológicos. El cáncer mamario y el de colon abarcan una gran proporción del total de cánceres de las poblaciones occidentales. En ambos se observa una fuerte correlación positiva con el consumo de grasas en los estudios comparativos entre países. Los estudios de las tendencias a largo tiempo y de las migraciones concuerdan con estos modelos. Sin embargo, en el Japón, al aumentar el consumo de grasas el cáncer de colon ha aumentado más rápidamente que el cáncer mamario (Figura 11.1). En los emigrantes también se ve un aumento más rápido del cáncer de colon (Berg, 1975) que del mamario. FIGURA 11.1 - Variación relativa de la ingestión de grasas y de la mortalidad por edades en el caso del cáncer mamario y de colon en el Japón En los estudios de casos y de controles, las grasas parecen estar relacionadas más fuertemente al cáncer de colon que al mamario (Carroll, 1994; Willett, 1989), lo que era de esperar dado el mayor período de latencia del cáncer de mama. Aunque en algunos estudios se observa una relación directa entre el cáncer mamario y las grasas alimentarias y en otros no, un análisis combinado de 12 estudios de casos y de controles indicó que existe una relación directa, estadísticamente significativa, entre consumo de grasas saturadas y cáncer mamario después de la menopausia (Howe, 1990). Los estudios de casos y de controles han mostrado generalmente una relación directa entre consumo de grasas y cáncer colorrectal (Whittemore et al., 1990). Los estudios de cohorte normalmente no han podido mostrar una relación entre grasas alimentarias y cáncer mamario (Howe et al., 1991; Van den Brandt et al., 1993; Willett et al., 1987, 1992). En su estudio sobre enfermeras americanas, Willett y sus colaboradores (1990) informaron de que el cáncer de colon se relacionaba directamente con la grasa alimentaria animal, con las grasas saturadas y con las grasas monoinsaturadas, pero las relaciones eran débiles y no eran significativas cuando se corregían según el consumo energético total (Figura 11.2). En este tipo de estudios se emplean estimaciones de alimentación efectiva y no se excluye la posibilidad de que una exposición a lo largo de la vida a regímenes alimentarios con bajo contenido de grasas pueda reducir la propensión a padecer cáncer de colon y de mama. FIGURA 11.2 - Riesgo relativo de cáncer de colon y mamario según el consumo de grasas animales Experimentos con animales Los estudios realizados con animales de experimentación han mostrado de forma bastante coherente que los regímenes alimentarios ricos en grasas elevan la incidencia y la producción de los cánceres de mama y de colon (National Research Council, 1982, 1989; Welsch, 1992). El efecto parece encontrarse en primer lugar en el estado de favorecimiento de la carcinogénesis (Carroll, 1975), aunque puede influir en cierto grado en la iniciación (Rogers y Lee, 1986). Los estudios con animales indican también que los materiales no lipidícos influyen en la incidencia del cáncer. Las ratas que se alimentaron con piensos comerciales presentaron menos tumores que las que se alimentaron con alimentos purificados con un contenido lipídico similar (Carroll, 1975; IP, 1987). Se tiene cada vez más datos de que las dietas ricas en fibra, frutas y verduras reducen el riesgo de cáncer en los seres humanos (National Research Council, 1982, 1989; Ziegler, 1989; Block, Patterson y Subar, 1992; Sandler et al., 1993; Hunter et al., 1993). Los experimentos con animales han permitido identificar varios agentes anticancerosos en las sustancias naturales (Birt y Bresnick, 1991; Wattenberg, 1992). Una reducción del consumo de grasas produce normalmente un aumento del consumo de constituyentes no grasos de la alimentación. Así, la diferencia en cuanto a la incidencia del cáncer y de la mortalidad en las poblaciones que consumen alimentos con alto o con bajo contenido de grasas puede deberse a otros componentes de la alimentación que no sean las grasas. Sin embargo, los estudios realizados para observar los efectos de las grasas alimentarias usando dietas purificadas implican claramente a las grasas. Los estudios experimentales demuestran que en el caso de los tumores de mama, se requieren grasas poliinsaturadas n-6. La producción de los tumores aumenta con la adición de ácido linoleico hasta un umbral del 4-5 por ciento de las calorías totales. Cuando se alcanza este umbral, aumentar las grasas totales ocasiona mayores aumentos de la incidencia y del volumen al parecer independientemente del tipo de grasa añadido (IP, 1987). El cáncer de colon también parece requerir la presencia del ácido linoleico, aunque este requisito parece ser menor que en el caso del cáncer mamario (Bull, Bronstein y Nigro, 1989). Se dispone de pocos estudios sobre los efectos, si los hubiera, de otros ácidos grasos específicos. Los aceites de pescado, que contienen principalmente ácidos grasos poliinsaturados n-3, no parecen favorecer el cáncer mamario cuando se suministran en grandes cantidades, aunque en pequeñas cantidades podrían tener un efecto estimulante (Carroll, 1989; Cave, 1991a, b). Los estudios realizados con mezclas de ácidos grasos n-3 y n-6 indican que el efecto estimulante de los ácidos grasos n-6 se puede neutralizar mediante una relación elevada de ácidos grasos n-3 respecto a los n-6, tanto en el caso del cáncer mamario como en el de colon (Cave, 1991a; Reddy, 1992). Se ha especulado mucho sobre los mecanismos que intervienen en la estimulación del cáncer mamario por las grasas. Se han considerado los sistemas endocrino e inmunitario; los cambios en la cantidad o composición del tejido adiposo; los cambios en la composición de los ácidos grasos de la membrana de las células cancerosas; y los efectos sobre los eicosanoides y la peroxidación de los lípidos (Welsch, 1987, 1992). Muchos han sugerido que el balance energético es más importante que el nivel de grasas alimentarias (Boutwell, 1992; Pariza, 1988; Welsch, 1992) puesto que el efecto estimulante de los regímenes alimentarios ricos en grasas puede corregirse con una restricción calórica. Sin embargo, el grado de la restricción calórica impuesta en la mayoría de los estudios experimentales no es realista en el caso de los seres humanos. La obesidad se relaciona frecuentemente con el aumento del riesgo del cáncer mamario (Dao y Hilf, 1992), sobre todo cuando la grasa está más localizada en la parte superior del cuerpo (Ballard-Barbash et al., 1990; Schapira et al., 1990). Se ha descrito que las atletas delgadas corren un riesgo bajo de padecer cáncer mamario (Frisch et al., 1992). Se ha sugerido que esto podría estar relacionado con la capacidad del tejido adiposo de convertir los andrógenos en estrógenos. En los animales, se ha descrito que el ejercicio puede tanto inhibir como aumentar el cáncer mamario, dependiendo de su intensidad y duración (Thompson, 1992). El estímulo del cáncer de colon mediante las grasas podría deberse a un aumento de la secreción de los ácidos biliares, y podría estar mediado por la proteína kinasa C y/o la ornitoína descarboxilasa. El hecho de que los aceites de pescado no estimulen el cáncer de colon puede relacionarse con los efectos sobre la producción de eicosanoides. Se ha visto que los inhibidores de la prostaglandina inhiben la carcinogénesis de colon (Reddy, 1992). Cáncer de otros órganos Se dispone de un número limitado de investigaciones sobre las relaciones entre las grasas y el cáncer en los siguientes órganos: páncreas, próstata, piel, ovarios, vejiga, cavidad bucal, linfoma no-Hodgkin y leucemia. Las correlaciones entre distintos países muestran que el cáncer de próstata se relaciona fuertemente con las grasas, mientras que en otros órganos la relación es más débil. En la Figura 11.3 se ilustran los coeficientes de correlación entre la disponibilidad de grasas y la tasa de mortalidad por edades debida a neoplasmas malignos en diferentes países. En la mayoría de los estudios de casos y de controles, el cáncer de la próstata se ha asociado positivamente con las grasas alimentarias (Carroll, 1994; Rose y Connolly, 1991). Los resultados han variado bastante con respecto a otros tipos de cáncer, pero los datos disponibles son muy limitados. Algunos estudios de cohorte han incluido el cáncer de páncreas (Mills et al., 1989) y de próstata (Mills et al., 1989; Severson et al., 1989) y no han mostrado ninguna relación con las grasas. Bosland (1988), sin embargo, concluyó que la alimentación rica en grasas influye en la etiopatogénesis del cáncer de próstata. Estudios experimentales. No se dispone de modelos animales para estudiar muchos tipos de cáncer. Los efectos de las grasas alimentarias se han estudiado en ratas tratadas con azaserina y en hámsteres tratados con N-nitrosobis(2-oxipropil)nitrosamina. Con una alimentación de elevado contenido de grasas aumentan los tumores en la etapa inicial (Roebuck, 1992). En el modelo de la rata, parece que existe una necesidad bastante elevada de ácido linoleico, 4-8 por ciento en una dieta con un contenido de grasas del 20 por ciento de la alimentación total. Los niveles elevados de aceite de pescado reducen las lesiones; cuando se suministran mezclas de aceites n3/n-6, el umbral parece encontrarse en un 3-6 por ciento de ácido linoleico. La restricción calórica también reduce las lesiones neoplásicas focales (Roebuck, 1992; Roebuck, Baumgartner y Mac Millan, 1993). Se está progresando en el desarrollo de un modelo animal para estudiar el cáncer de próstata, que está proporcionando pruebas de que los regímenes alimentarios de alto contenido de grasas aumentan el riesgo de este tipo de cáncer (Pollard y Luckert, 1986). FIGURA 11.3 - Relación entre las grasas alimentarias y el cáncer de órganos específicos Muchos de los primeros estudios con animales se ocuparon del cáncer de piel, y mostraron que existía relación con las grasas de la alimentación. En un modelo se describió que, contrariamente a los resultados obtenidos en el cáncer mamario, existía una relación inversa entre ácido linoleico y cáncer de piel (Fischer et al., 1992). El cáncer de piel puede inhibirse también mediante una restricción calórica (Birt et al., 1993). Conclusión Se dispone de muchos datos que demuestran que en los animales alimentados con regímenes alimentarios ricos en grasas se desarrollan tumores en la glándula mamaria, intestino, piel y páncreas más fácilmente que en los animales alimentados con regímenes de bajo contenido de grasas, aunque este efecto puede corregirse mediante una restricción calórica. Estos datos concuerdan con las comparaciones entre distintos países que relacionan las grasas alimentarias con el cáncer mamario, de colon, páncreas y próstata. Los estudios de casos o de control y de cohorte plantean algunas dudas sobre estas asociaciones, pero en estos tipos de estudios existen importantes limitaciones. En los resultados de los experimentos con animales influye el tipo de grasa alimentaria, especialmente el nivel y el tipo de ácidos grasos poliinsaturados. Sin embargo, los estudios con animales se han realizado a menudo con una mente única de grasa, una situación que no se da en las poblaciones humanas. Los estudios comparativos entre países indican que cuando los ácidos grasos n-6 se encuentran en una gama de aproximadamente el 4-8 por ciento de la energía, no parece existir correlación con el cáncer mamario (Carroll et al., 1986). Puede ponerse en duda la aplicabilidad de estos datos obtenidos con animales al hombre. Se dispone de pocos datos sobre los niveles de n-3 de los ácidos grasos en los regímenes alimentarios humanos y sobre su importancia en el cáncer en los seres humanos. Sin embargo, el contenido total de grasas de la alimentación parece tener más influencia en el cáncer de las poblaciones humanas que el tipo de grasas. La asociación de varios tumores con la obesidad da credibilidad a la posibilidad de que los efectos de la alimentación de elevado contenido de grasas sobre el cáncer pueda explicarse parcialmente por cambios en el balance energético. Las atletas delgadas parecen tener menos cáncer mamario. Se ha dicho que los regímenes alimentarios de bajo contenido de grasas están relacionados con un descenso del consumo energético y con la disminución de peso (Boyd et al., 1988; Henderson et al., 1990), mientras que la mayoría de los esfuerzos realizados para controlar la obesidad únicamente mediante restricción calórica fracasan. Además, las dietas con un bajo contenido de grasas tienen de por sí una mayor variedad de fuentes de hidratos de carbono, fibra y frutas y hortalizas, lo que parece aportar una protección adicional frente al cáncer. También es importante mantener un ejercicio físico adecuado para prevenir el cáncer, ya que forma parte de un estilo de vida generalmente sano. Se ha expresado cierta preocupación sobre la posibilidad de que los niveles bajos de colesterol en el suero puedan estar asociados con un aumento del riesgo de cáncer, concretamente del cáncer de colon (McMichael, 1991). Sin embargo, puesto que en las poblaciones que consumen alimentos con un bajo contenido de grasas y que tienen niveles bajos de colesterol en el suero no suele darse el cáncer de colon, es evidente que un nivel bajo de colesterol en el suero no aumenta por sí mismo el riesgo de cáncer. Capítulo 12 - Las grasas alimentarias y la respuesta inmunitaria El interés sobre la participación de los lípidos en la respuesta inmunitaria empezó cuando se reconoció su efecto modificador del sistema del retículo endotelial (Di Luzio, 1972). Un estímulo adicional para este interés fue la sugerencia de que podía darse una asociación entre algunos tipos de cáncer y la cantidad y calidad de los lípidos de la alimentación (Carroll y Khor, 1975; Tannenbaum y Silverstone, 1953). Además, se ha demostrado que las grasas influyen en la gravedad de las enfermedades autoinmunitarias, así como en la duración de la aceptación de homo-injertos (Mertin y Hunt, 1976; Ring et al., 1974). Además, la adición de ácidos grasos a los cultivos in vitro de linfocitos modificaban su respuesta mitogénica (Mertin y Hughs, 1975). Para la elaboración de una respuesta inmunitaria satisfactoria, es esencial la cooperación entre las distintas células del sistema inmunitario a través de diferentes lípidos y proteínas intermediarios. Los lípidos de la alimentación pueden afectar al sistema inmunitario influyendo en la disponibilidad del sustrato de la ciclooxigenasa y de la lipooxigenasa. Estos productos, a su vez, actúan como intermediarios lipidícos en el control del sistema inmunitario (Rola-Plaszczynski, 1985, y Goodwin, Messner y Peake, 1974). Por otra parte, las células del sistema inmunitario dependen en gran medida de la función de la membrana celular para realizar operaciones tales como secreción de linfoquinas y anticuerpos, recepción de antígenos, transformación de linfocitos y lisis por contacto. La importancia de los lípidos en el mantenimiento de la integridad de la membrana (Stubbs y Smith, 1984) indica que pueden ser nutrientes críticos en la regulación de la función inmunitaria. Metabolitos del ácido araquidónico (AA) Los metabolitos del ácido araquidónico (AA) intervienen en el control del sistema inmunitario. Los metabolitos del ácido araquidónico (AA), las prostaglandinas (PG), el ácido hidroxieicosatetraenoico (HETE) y los leucotrienos (LT) son producidos por las células mononucleares de la sangre periférica humana (CMSP) y por los esplenocitos del ratón en respuesta a los estímulos de los mitógenos o de los antígenos. También inhiben la subsiguiente proliferación de las células T. De manera similar, la inhibición in vitro de las PG aumenta la proliferación de las células T. Las respuestas inmunitarias celular y humoral se producen bajo el control negativo de las PG. In vitro, la PGE2 inhibe la proliferación de las células T. (Goodwin, Messner y Peake, 1974; Webb, Rogers y Nowowiejiski, 1980; Rola-Plaszczynski y Lemaire, 1985; Metzger, Hoffeld y Oppenheim, 1980; Fisher y Bostic-Bruton, 1982; Muscoplat, Rakich y Thoen, 1978), la producción de linfoquinas (Gordon, Bray y Morley, 1976), la generación de células citotóxicas (Plaut, 1979), y la actividad de las células asesinas naturales (AN) (Roder y Klein, 1979). Se ha demostrado que, además de la PGE2 los productos de la lipooxigenasa, esto es, LT y HETE, inhiben la proliferación de los linfocitos en los esplenocitos del ratón y en los linfocitos periféricos humanos (Goodman y Weigle, 1980). Este efecto puede estar mediado por un descenso de la proliferación de los linfocitos T ayudadores y por un aumento de la proliferación de las células T supresoras/citotóxicas (Payan MissirianBastian y Goetzl, 1984; Gualde et al., 1984). En algunos estudios, pero no en todos ellos, se ha demostrado que el LTB4 aumenta la producción de la interleuquina (IL)-1 así como la de la IL-2, y la proliferación de los linfocitos (Rola-Plaszczynski y Lemaire, 1985). Se ha visto que las lipoxinas (Lx), que son los productos de la 15-lipoxigenasa del AA, inhiben la actividad AN humana medida frente a las células diana K562 (Ramstedt et al., 1985). Por otra parte, se ha visto que el LTB4 aumenta la actividad AN humana (Rola-Plaszczynski, Gagnon y Sirois, 1983). El efecto de los metabolitos del AA sobre la inmunidad celular se esquematiza en la Figura 12.1 Acidos grasos poliinsaturados (AGPI) Algunos investigadores han evaluado el efecto de las grasas en la respuesta inmunitaria (Johnson y Marshall, 1984; Erickson, 1986). El examen de la bibliografía presenta un cuadro confuso debido principalmente a que el efecto de los AGPI en la respuesta inmunitaria varía dependiendo de diversos factores como son: concentración de las grasas; duración de la suplementación; variación genética; existencia de enfermedades infecciosas o autoinmunitarias e inflamatorias; edad del animal; niveles de otros nutrientes, como vitamina E, cuyas necesidades dependen del grado de saturación de los ácidos grasos; deficiencia o no de los ácidos grasos esenciales en la dieta de control; pruebas inmunológicas empleadas en el experimento; y serie de AGPI probadas, esto es, AGPI n-6 o n-3. AGPI (n-6) de origen vegetal. Recientemente se han revisado los efectos de los AGPI n-6 de origen vegetal en la respuesta inmunitaria (Meydani et al., 1991b; Dupont et al., 1990). En la mayoría de los estudios realizados con animales, los ácidos grasos esenciales eran necesarios para desempeñar una función inmunitaria normal. La carencia de ácidos grasos esenciales es perjudicial para las respuestas mediadas por las células B y T. Esta carencia se normaliza incluyendo ácidos grasos esenciales en la alimentación. Los regímenes alimentarios con gran contenido de grasas (alrededor del 45 por ciento), independientemente de su grado de saturación, suprimen los índices del sistema inmunitario tanto in vitro como in vivo. Con escasas excepciones, cuando los animales que no presentaban carencias de ácidos grasos se alimentaron con AGPI de origen vegetal (alto porcentaje de AG n-6), respondieron de forma similar a la de los animales que se habían alimentado con una concentración equivalente de ácidos grasos saturados de origen animal o vegetal. Esto es particularmente evidente con niveles moderados de grasa en la alimentación (alrededor de 22 por ciento). Con concentraciones mayores de grasa (alrededor de 45 por ciento), o cuando los ratones estaban expuestos a agentes infecciosos o carcinógenos químicos, los que se habían alimentado con AGPI tendían a dar respuestas más bajas frente a algunas pruebas inmunológicas, pero no frente a todas, que los ratones que se habían alimentado con la misma concentración de ácidos grasos saturados. Estas conclusiones no pueden extrapolarse fácilmente al ser humano porque los sistemas inmunitarios de distintas especies o estirpes dentro de una misma especie responden de diferente manera frente a las alteraciones de las grasas alimentarias. Se necesitan pruebas bien controladas en el hombre para determinar los efectos de las concentraciones y de la saturación de los ácidos grasos en las respuestas inmunitarias humanas. FIGURA 12.1 - Papel de los eicosanoides en la regulación de los procesos inmunológicos e inflamatorios Los escasos estudios realizados sobre los efectos de las grasas de la alimentación en la respuesta inmunitaria humana han sido estudios epidemiológicos retrospectivos. Los estudios de exploración sobre la esclerosis múltiple (EM), una posible enfermedad autoinmunitaria desmielinizante con cambios de lípidos (Bornstein, 1973), sugieren que se deba a carencia de los AGPI (Bernsohn y Stephanides, 1967; Mertin y Meade, 1977). Un estudio mostró que los pacientes con EM tenían menos ácido linoleico de lo normal en los lípidos de sus linfocitos, y que los pacientes de EM complementados con aceite de cártamo durante dos años presentaban recaídas menos frecuentes y menos graves que los complementados con aceite de oliva (Millar et al., 1973). Otro estudio mostró que los linfocitos de pacientes con EM daban respuestas mitogénicas inferiores que los individuos de control, y que la complementación con aceite de semillas de prímula (que contiene un 8 por ciento de ácido oleico, un 75 por ciento de linoleico, y un 9 por ciento de -linoleico C18:3n-6) durante 85 días mejoraba la respuesta mitogénica (Offner, Konat y Clausen, 1974). La suplementación de los pacientes con EM y de individuos sanos con 25 g/día de aceite de cártamo durante cinco semanas aumentó la aglutinación tanto de un antígeno del sarampión como de la concanavalina A (Con A), pero la suplementación con aceite de oliva no tuvo ningún efecto (Utermohlen et al., 1981). La suplementación con AGPI, combinada con una terapia inmunosupresora convencional, facilita la aceptación de los trasplantes de riñón en los seres humanos (Uldall, 1974). En un estudio transversal sobre la mitogénesis de los linfocitos frente a los mitógenos de las células B y T y a la actividad AN realizada en 94 personas de vida libre, no se encontró correlación entre el grado de insaturación de los ácidos grasos del tejido adiposo (que posiblemente sea el reflejo del consumo dietético) o las lipoproteínas del plasma y los índices inmunológicos (Berry et al., 1987). La variación entre distintas personas y la influencia de otros factores de la alimentación podría enmascarar un posible efecto de las grasas. Un estudio reciente mostró que los regímenes alimentarios con un contenido de grasas bajo y con moderado AGPI (n-6) (6 por ciento) no tenían ningún efecto en la respuesta de hipersensibilidad retardada (HSR) de la piel que puede medir in vivo las funciones mediadas por las células T en las personas sanas. Sin embargo, aumentó significativamente la respuestas proliferativa de los linfocitos frente a los mitógenos de las células T, la Con A y la producción ex vivo de IL-1. AGPI (n-3) de origen vegetal. El ácido linolénico (C18:3n-3) puede convertirse en AEP (C20:5n-3), que puede reemplazar al ácido araquidónico de los fosfolípidos de membrana y ser utilizado de modo preferente por la ciclooxigenasa. Esto ocasiona una producción reducida de PG de las dos series y de leucotrienos de las cuatro series. Así, se ha propuesto que el consumo de aceites que contienen C18:3n-3 podría estar asociado con cambios inmunológicos. Esta propuesta se ve apoyada por muchos estudios que han mostrado una modulación inmunológica tras el consumo de aceite marino. Existen muy pocos estudios inmunológicos sobre los aceites vegetales que contienen AGPI (n-3). Los aceites vegetales que contienen AGPI (n-3) incluyen al aceite de semilla de perilla que tienen el mayor contenido de AGPI (n-3) (64 por ciento), seguido por el aceite de linaza (62 por ciento), el aceite de canola (10 por ciento) y el aceite de soja (7 por ciento). Al extrapolar los resultados obtenidos con el AGPI (n-3) de los aceites marinos a los aceites que contienen C18:3n-3, se deben considerar dos aspectos: primero, cuál es la tasa de conversión de C18:3n-3 en AGPI (n-3) con cadenas más largas (esto es, C20:5n-3 y C22:6n-3); y segundo, ¿el porcentaje del AGPI (n-3) en el aceite es el adecuado para modificar el metabolismo del ácido araquidónico y, por consiguiente, los procesos inmunológicos e inflamatorios? Un examen bibliográfico reciente (Meydani et al., 1991b) indica que el consumo de aceites que contienen C18:3n-3 está relacionado con una ligera disminución de la producción de eicosanoides y carece de efecto estimulador alguno sobre la respuesta inmunitaria, o este efecto es muy débil. Los consumos a largo plazo de alimentos con contenido de grasas bajo y con un 1,8 por ciento de 18:3n-3 producen un descenso significativo del nivel de AA plasmático asociado a un aumento significativo de la respuesta mitógena de las células T frente a la Con A y la producción de IL1 (Meydani et al., 1993) en los seres humanos. No afectó a otros índices inmunológicos. AGPI (n-3) procedentes de aceites marinos. La PGE2 controla distintos aspectos de la respuesta inflamatoria e inmunológica celular. La producción de PGE2 disminuye tras consumir AGPI (n-3). Algunos investigadores han estudiado el efecto producido por un aumento del consumo de estos ácidos grasos sobre la producción de citoquinas y sobre las respuestas inmunitarias celulares. Los estudios en el ser humano han demostrado de manera coherente que la producción de citoquinas proinflamatorias disminuye cuando se ingieren por vía oral concentraciones entre moderadas y altas de AGPI (n-3) de origen marino (Meydani et al., 1993; Kremer et al., 1987; Meydani et al., 1991a; Endres et al., 1989). La disminución de la producción de citoquinas proinflamatorias y de eicosanoides contribuye al efecto beneficioso del aceite de pescado en la reducción de la patogénesis de las enfermedades inflamatorias y ateroscleróticas. Los primeros estudios epidemiológicos mostraron una incidencia baja de las enfermedades ateroscleróticas, inflamatorias y autoinmunitarias en los esquimales de Groenlandia que consumen alimentos ricos en AGPI (n-3) de origen marino. En los estudios sobre la artritis humana se ha comprobado un ligero efecto beneficioso de los aceites de pescado (Kremer et al., 1990). La suplementación con aceites de pescado redujo los síntomas clínicos de la psoriasis, una enfermedad inflamatoria de la piel (Ziboh et al., 1986). También se demostró un efecto ligeramente beneficioso en la colitis ulcerosa (Lorenz et al., 1989). Algunos estudios han evaluado el efecto de la suplementación con aceite de pescado sobre la inmunidad mediada por la célula. También se ha observado que la suplementación con aceite de pescado in vivo reduce la proliferación de las células T y B y la DTH, una medida de la inmunidad mediada por la célula in vivo (Meydani et al., 1991; Kramer et al., 1991; Santoli y Zurier, 1989; Virella et al., 1989). También se ha constatado el efecto inmunosupresor del aceite de pescado en personas (de más de 40 años de edad) que se alimentaban siguiendo las recomendaciones del National Cholesterol Education Panel (NCEP) (NCEP Etapa 2) enriquecidas con AGPI (n-3) procedentes de pescado (que aportaban el 0,54 por ciento de la energía o 1,23 g/día de AEP y ADH) durante seis meses (Meydani et al., 1993). Este consumo a largo plazo de la dieta de la Etapa 2 del NCEP enriquecida con pescado causó un pequeño, pero significativo, descenso del porcentaje de células T ayudadoras, mientras que el porcentaje de células T supresoras aumentó. Este cambio se acompañó de una reducción significativa del DHT y de la respuesta mitogénica frente a la concanavalina A. Se observó una correlación significativa entre los cambios en la DHT y los niveles plasmáticos de AEP. Como se había descrito en el caso de la suplementación con aceite de pescado, se reducía también la producción de citoquinas, IL-1, TNF- e IL-6 en las CMSP (Id.). Por el contrario, una alimentación prolongada con la dieta de la Etapa 2 del NCEP con bajo contenido de pescado (0,13 por ciento de la energía o 0,27 g/día de AEP y ADH, pero manteniendo el mismo nivel de los AGPI totales, esto es, el 10 por ciento) aumentó la respuesta mitogénica de las CMSP frente al mitógeno de las células T, de la concanavalina A, e incrementó la producción de IL-1 y TNF- pero no tuvo ningún efecto sobre la producción de la IL-6 ni de DTH. Aunque la dieta de la Etapa 2 del NCEP enriquecida con AGPI (n-3) procedentes de pescado producía un descenso significativo del cociente plasmático entre el tocoferol y los AGPI, la dieta de la Etapa 2 del NCEP con bajo contenido de pescado no produjo un descenso significativo de este cociente. Los resultados de este estudio, así como los que se habían obtenido en los estudios con animales anteriormente descritos, indican que el nivel de AGPI (n-3) y el de tocoferol son determinantes importantes de la naturaleza del efecto sobre la respuesta inmunitaria que se había observado tras consumir estos ácidos grasos. La reducida producción de citoquinas proinflamatorias y de eicosanoides proagregatorios puede resultar beneficiosa en los casos en que se produzcan niveles excesivos de estos intermediarios, por ejemplo, en el caso de las enfermedades inflamatorias. Sin embargo, en personas sanas o en aquellas que presentan un estado inmunitario comprometido, la reducción de la producción de citoquinas o de eicosanoides podría comprometer sus funciones biológicas normales, lo que perjudicaría a las defensas del huésped o a la agregación normal de las plaquetas. Esto puede comprenderse mejor si se tiene en cuenta la doble función de estos compuestos, esto es, el papel de regulación fisiológica, así como la contribución a la patogénesis de las enfermedades. A lo largo de estas líneas, se ha mostrado que la suplementación con aceite de pescado disminuye la producción de IL-2, la proliferación de las células T inducida por los mitógenos, y el DTH, tanto en modelos animales como humanos. También se ha observado un aumento de la hemorragia cerebral asociada al consumo de aceite de pescado. Además, la alimentación con aceite de pescado inhibe la capacidad de las células accesorias del ratón para presentar el antígeno a las células T ayudadoras (Fujikawa et al., 1992), y los ratones que habían sido alimentados con aceite de pescado tenían reducida la capacidad citotóxica de las células de los mastocitomas estimuladas con LPS o INF- (Hubbard, Somers y Erickson, 1991). Se ha demostrado que los consumos prolongados de niveles moderados de AGPI (n3) marinos disminuían el porcentaje de las células T ayudadoras, la respuesta mitogénica ante los mitógenos de las células T (alrededor de un 34 por ciento) y el DTH (alrededor del 50 por ciento) (Meydani et al., 1993). La disminución del DTH tiene un interés especial, ya que se ha visto que esta prueba se puede utilizar para pronosticar morbilidad y mortalidad. El significado clínico de este descubrimiento se ve apoyado por las observaciones respecto a que la alimentación con aceite de pescado reduce la resistencia natural de los ratones frente a la infección con Salmonella typhimurium (Chang et al., 1992), y las ratas alimentadas con dietas que contenían un 9 por ciento de aceite de menhaden tenían una vida más corta que las que se alimentaban con aceite de maíz o con sebo de buey (Berdanier et al., 1992). En los conejos a los que se había suministrado un suplemento rico en aceite de pescado o en aceite de cártamo (5 g/kg.d) durante los siete días siguientes al nacimiento, la eliminación por los pulmones de los Staphylococcus aureus inspirados disminuyó aproximadamente en un 50 por ciento, en comparación con el control salino o con la administración de pequeñas dosis de los aceites (0,22 g/dg.d) (D'Ambola et al., 1991). Las dietas ricas en aceite de pescado incrementaron también la respuesta broncoconstrictora no mediada por la histamina en la anafilaxis pulmonar (Lee et al., 1985). Se requieren estudios adicionales para determinar el efecto de la suplementación con aceite de pescado sobre la respuesta del huésped en los seres humanos. Sin una protección antioxidante adecuada, la sustitución de los ácidos grasos de la membrana con los AGPI (n-3) fácilmente oxidables de los aceites de pescado, esto es, AEP y ADH, puede potenciar la peroxidación de las membranas celulares. Se ha demostrado un aumento de la actividad de los radicales libres en animales de laboratorio alimentados con dietas de alto contenido de AGPI (n-3) (Nalbone et al., 1989; Herbert y Wills, 1987; Hu M-L et al., 1989). Estos compuestos pueden contribuir al efecto supresor de las funciones mediadas por las células T del aceite de pescado. Estos riesgos, asociados con el consumo de AGPI (n-3), pueden minimizarse mediante la ingestión de los niveles adecuados de un nutriente antioxidante como la vitamina E, sin que se vean comprometidos sus efectos beneficiosos. Conclusión Los estudios realizados con animales o cultivos de tejidos, así como los realizados con los seres humanos, indican que tanto el nivel como el grado de saturación de los lípidos de la alimentación influyen en las respuestas inflamatorias e inmunológicas. La naturaleza del efecto depende del tipo de ácido graso, la edad, el antioxidante y el estado de salud de la persona. Algunos de estos cambios inmunológicos están relacionados con efectos clínicos beneficiosos, como la reducción de la citoquina proinflamatoria con los AGPI (n-3) marinos. Otros pueden ser perjudiciales, como la disminución de la función de intermediario de las células T producida por los AGPI (n3) marinos en la gente de más edad. Así, deberían considerarse los efectos de los lípidos en la respuesta inmunitaria antes de recomendar que se cambien los lípidos de la alimentación para mejorar otros aspectos de la salud. Además, la recomendación de aumentar el consumo de AGPI debe acompañarse con las adecuadas recomendaciones para aumentar el consumo de antioxidantes, y en particular de vitamina E. En general, en individuos sanos, la recomendación de disminuir la ingesta de grasas totales, y la inclusión de cantidades moderadas de AGPI (n-6) y (n-3) junto con los nutrientes antioxidantes adecuados, debe mantener una respuesta inmunitaria competente. Capítulo 13 - Las grasas alimentarias, la hipertensión y los accidentes vasculares cerebrales Mientras el consumo de sal y la obesidad se han relacionado con la hipertensión, los estudios sobre el posible papel de las grasas en la regulación de la presión sanguínea y en la patogénesis de la hipertensión han mostrado resultados incongruentes (Beilin, 1987; Sacks, 1989; Iacono y Dougherty, 1993). Colesterol y grasa total En ratas propensas a los accidentes vasculares cerebrales, espontáneamente hipertensas, las dietas con alto contenido de grasas y ricas en colesterol hacían disminuir la tensión sanguínea y la incidencia de los accidentes vasculares cerebrales (Yamori, 1977). Esto puede deberse a la atenuación de la actividad vascular (Yamori, 1981). Los datos epidemiológicos concuerdan generalmente con los experimentos con animales, e indican que los regímenes alimentarios con un contenido de grasas muy bajo elevan la incidencia de determinados tipos de accidentes vasculares cerebrales (Jacobs et al., 1992). Las sociedades en las que se consumen pocas grasas y pocas proteínas de origen animal, como el Japón tradicional, tienden a presentar elevadas tasas de accidentes vasculares cerebrales hemorrágicos. En determinados sectores de la población japonesa con niveles bajos de colesterol sérico existe un elevado riesgo de accidentes vasculares cerebrales, especialmente en personas con una presión sanguínea alta (Komachi et al., 1976). En un grupo numeroso de hombres, examinado en los Estados Unidos de América, las personas que teman los niveles más bajos de colesterol sérico presentaban un alto riesgo de accidentes vasculares cerebrales hemorrágicos, a pesar de que los riesgos de accidentes vasculares cerebrales isquémicos, enfermedades coronarias del corazón y enfermedad cardiovascular total se relacionan directamente con el nivel sérico de colesterol (Kagan, Popper y Rhoads, 1980; Iso et al,, 1989). Aunque no se ha comprobado la causalidad, las tasas de accidentes vasculares cerebrales han disminuido mucho en el Japón a partir de principios de los años cincuenta, período durante el cual la cantidad de grasa consumida ha aumentado desde alrededor del 10 por ciento hasta el 25 por ciento de la energía total alimentaria. Este aumento se ha debido principalmente a un mayor consumo de grasa animal. En varios estudios epidemiológicos extensos (Kay, Sabry y Csima, 1980; Salonen, Tuomilehto y Tanskanen, 1983; Khaw y Barret-Conner, 1984; Gruchow, Sobocinsky y Barboriak, 1985; Elliott et al., 1987; Joffres, Reed y Yano, 1987) no se encontró ninguna asociación entre presión sanguínea y grasas alimentarias o colesterol. Sólo un estudio epidemiológico realizado con inmigrantes japoneses en Hawaii mostró que la presión sanguínea disminuía al aumentar la cantidad total de grasas de la alimentación y el colesterol (Reed et al., 1985). El estudio transversal de la OMS denominado CARDIAC, que se llevó a cabo a escala mundial, demostró una relación directa significativa entre los niveles séricos de colesterol y la presión diastólica sanguínea (Yamori et al., 1993). Aunque existen limitaciones metodológicas para determinar los efectos de las grasas alimentarias en la hipertensión, los datos actuales indican que el aumento crónico del colesterol plasmático está relacionado con el aumento de la presión sanguínea diastólica, probablemente como resultado de las alteraciones vasculares ateroscleróticas. Acidos grasos Grasas saturadas y ácidos grasos monoinsaturados. Dos encuestas dietéticas realizadas en Finlandia mostraron una relación inversa significativa entre los consumos de grasas saturadas y la presión sanguínea (Salonen, Tuomilehto y Tanskanen, 1983; Salonen et al., 1988), pero en muchos otros estudios no se encontró dicha relación (Gruchow, Sobocinski y Barboriak, 1985; Elliott et al., 1987; Joffres, Reed y Yano, 1987; Williams et al., 1987; Rubba et al., 1987). En algunas poblaciones estudiadas, el nivel de ácidos grasos saturados del tejido adiposo tendía a relacionarse inversamente con la presión sanguínea (Riemersma et al., 1986; Hudgins, Hirsch y Emken, 1991). Las pruebas controladas realizadas para examinar los efectos de varios ácidos grasos monoinsaturados de la alimentación no mostraron efectos significativos (Mensink, Janssen y Katan, 1988; McDonald et al., 1989). Acidos grasos poliinsaturados. La regulación de la presión sanguínea se ve alterada en los animales que presentan deficiencia de ácido linoleico. Cuando se hizo que dichos animales se volvieran hipertensos haciéndoles beber una solución salina durante 9 días, la adición de ácido linoleico a la dieta normalizó la presión sanguínea a pesar de que se les continuara administrando solución salina (Cox et al., 1982). Cuando no hay carencia, el ácido linoleico ejerce poco efecto en la presión sanguínea de los animales (Smith-Barbaro et al., 1980; McGregor, Morazain y Renaud, 1981; Mogenson y Box, 1982; Tobian et al., 1982; Singer et al., 1990; Shimamura y Wilson, 1991). Los resultados de los estudios transversales realizados en seres humanos proporcionan pocas pruebas de los efectos del consumo de los ácidos grasos n-6 en la presión sanguínea. Las encuestas del National Health and Nutrition Examination (NHANES) de adultos en los Estados Unidos de América indicaron que el factor nutritivo que más sólida y constantemente estaba relacionado con la presión sanguínea era el índice de masa corporal (Harían et al., 1984); el nivel de calcio en el suero se relacionaba directamente y el de fósforo indirectamente con la presión sanguínea sistólica. El estudio no pudo mostrar ninguna relación entre presión sanguínea diastólica y grasas alimentarias. En general, no se observa una correlación significativa entre los consumos de ácidos grasos y de grasa total, determinados según la historia dietética, y la presión sanguínea (Sacks, 1989). Además, existen pocas pruebas convincentes de que la cantidad o tipo de grasas tengan algún efecto sobre las personas con presión sanguínea normal o ligeramente elevada. Los estudios transversales de población son frecuentemente confusos a causa de la complejidad de la alimentación y de otras diferencias de estilos de vida. El estudio NI-HON-SAN descubrió que las grasas constituían el 15 por ciento del aporte energético en el Japón. Entre los japoneses de Hawaii y San Francisco, los aportes energéticos procedentes de las grasas eran del 33 y del 38 por ciento respectivamente. Las diferencias se debían principalmente a los consumos de grasas saturadas (Kagan, Marmot y Kato, 1980). Los niveles de colesterol en la sangre equiparaban los consumos de grasas entre los tres grupos. Mientras las presiones sanguíneas eran similares en los estudios del Japón y Hawaii, en San Francisco fueron superiores. La incidencia de los accidentes vasculares cerebrales, la hipertensión, la enfermedad cardíaca hipertensiva, y la hipertrofia del ventrículo izquierdo fueron mayores en el Japón que en las otras dos poblaciones, debido posiblemente al mayor consumo de sal y de alcohol y al menor consumo de proteínas. El cociente entre grasas poliinsaturadas y saturadas es generalmente mayor en los vegetarianos que en las personas que no lo son. Se ha visto que el consumo de alimentos de origen animal se relaciona estrechamente tanto con la presión sistólica como con la diastólica (Sacks, Rosner y Kass, 1974). Los vegetarianos Adventistas del Séptimo Día de Africa Occidental tienen presiones sanguíneas más bajas que los que no son vegetarianos, y presentan un gradiente de aumento de la presión sanguínea a medida que aumenta su consumo de huevos (Armstrong, van Merwjk y Coates, 1977). Con una dieta ovo-lacto-vegetariana, las personas de tensión normal muestran una disminución de la presión sanguínea (Rouse, Armstrong y Beilin, 1983). En relación con esto, se ha demostrado una caída de la presión sanguínea sistólica en personas ligeramente hipertensas que no recibían ningún tratamiento y que habían cambiado a una alimentación vegetariana (Margetts et al., 1986). Sin embargo, al sustituir las grasas saturadas por carbohidratos o aceites ricos en ácido linoleico, no se producía ningún cambio favorable en la presión sanguínea (Sacks et al., 1987). Los hábitos alimenticios vegetarianos influyen en muchos factores, y en consecuencia la interpretación de los estudios sobre este tipo de población se ve limitada. Incluso si existiera, sería difícil encontrar una relación entre las grasas alimentarias y la presión sanguínea, debido a la baja sensibilidad de los métodos dietéticos empleados, como el recordatorio de 24 horas y el registro de frecuencia de alimentación de 3-4 días. Sin embargo, el análisis bioquímico del cociente entre ácidos poliinsaturados y saturados en el tejido adiposo también mostró que no existía relación con la presión sanguínea (Berry y Hirsch, 1986; Riemersma et al., 1986; Ciocca et al., 1987; Rubba et al., 1987). Siete estudios han mostrado un descenso significativo de la presión sanguínea sistólica, hasta 13 mm Hg, y de la presión sanguínea diastólica, 7 mm Hg, en personas moderadamente hipertensas alimentadas con una alimentación enriquecida con n-6 (Iacono y Dougherty, 1993). Se identificaron otros siete estudios en los que no se producía ningún cambio significativo en la presión sanguínea de personas alimentadas con alimentos enriquecidos de modo similar. Las diferencias en la selección de las personas o en su observación de la dieta podrían explicar tal vez estas observaciones. Cinco estudios de intervención basados en comunidades de Finlandia, Italia y los Estados Unidos de América mostraron disminuciones de la presión sanguínea junto con un aumento del cociente entre grasas poliinsaturadas n-6 y grasas saturadas consumidas. Dos extensos estudios de cohorte realizados durante un período de cuatro años, en los que se exploraba a profesionales sanitarios de los Estados Unidos de América, uno referido a hembras (Witteman et al., 1989) y el otro a varones (Ascherio et al., 1992) no mostraron ninguna relación entre los ácidos grasos poliinsaturados de la alimentación y el desarrollo de la hipertensión. En dos extensos ensayos de intervención controlados llevados a cabo por el National Diet Heart Study Research Group (1968) y por el Research Committee to the Medical Research Council (1968), no se observó ninguna influencia significativa de las grasas alimentarias en la presión sanguínea de las personas de tensión normal. Acidos grasos n-3. El efecto de los ácidos grasos n-3, principalmente de los ácidos eicosapentanoico (AEP) y docosahexanoico (ADH), se ha examinado en muchos estudios experimentales. Las discrepancias en las observaciones sobre la presión sanguínea se pueden deber a la complejidad de los mecanismos de regulación. La síntesis de las prostaglandinas vasodilatadoras, como la prostaciclina y la PEG2 así como de los constrictores como el tromboxano A2 y el leucotrieno B2 queda suprimida como consecuencia de la producción de tres series de eicosanoides. El tromboxano A3 de los ácidos grasos n-3 no es tan activo como la serie 2 de los eicosanoides. El efecto de los ácidos grasos n-3 en la presión sanguínea se debe, sin embargo, al balance entre los eicosanoides vasodilatadores y vasoconstrictores en la pared vascular y en el riñon (Yin, Chu y Beilin, 1992; Shimokawa et al., 1987; Lorenz et al., 1983; Beilin, 1992). En un ensayo controlado, 50 ml de aceite de pescado (15 g de ácidos grasos n-3) disminuyeron la presión sanguínea sistólica y diastólica de personas moderadamente hipertensas, pero fueron ineficaces 10 mi de aceite de pescado (Knapp y Fitzgerald, 1989). En comparación con el ácido linoleico o con el ácido -linolenico, la suplementación de la alimentación con AEP más ADH también disminuía la presión sanguínea (Kestin et al., 1990). Cuando se comparó el consumo de pescado (100 g de caballa al día) con el de carne, no se apreció ningún efecto sobre la presión sanguínea, y el tiempo de sangramiento se prolongó considerablemente (Houwelingen et al., 1987). Una prueba en la que la suplementación se realizaba tanto con aceite que contenía AEP + ADH como con la misma cantidad de aceite de maíz indicó que la reducción de la presión sanguínea dependía del aumento de los ácidos grasos n-3 en los fosfolípidos plasmáticos (Bonaa et al., 1990). En los ancianos, se dio una reducción de la presión sanguínea con el aceite de pescado cuando se combinaba con un bajo consumo de sodio (Cobiac et al., 1992). Debe destacarse que entre los japoneses que comían pescado salado había una alta incidencia de hipertensión y de accidentes vasculares cerebrales hemorrágicos. El estudio transversal de la OMS denominado CARDIAC realizado en múltiples centros, que consideró 55 centros de 24 países, mostró que los niveles de colesterol sérico estaban relacionados directamente con la presión sanguínea diastólica de poblaciones de todo el mundo (Yamori et al., 1992). En un tratamiento eficaz de la hipertensión, la ingestión de ácidos grasos n-3 derivados de los alimentos sería generalmente demasiado elevada para emplearla en la práctica. Dicho empleo debería basarse en sus beneficios potenciales para prevenir las enfermedades ateroscleróticas o trombóticas. Conclusión La modificación de las grasas de la alimentación para bajar el nivel de lípidos de la sangre afecta indirectamente a la presión sanguínea, disminuyendo o invirtiendo el proceso aterosclerótico. Aunque los niveles elevados de los ácidos grasos n-6 y n-3 de cadena larga reducen la presión sanguínea elevada, su efecto es modesto, especialmente en comparación con los efectos de la disminución de peso o de restricción de sodio. Capítulo 14 - Constituyentes no glicéridos de las grasas Además de los triacilglicéridos, en las grasas alimentarias se encuentran gran variedad de componentes que son importantes para mantener la salud. Estos componentes no glicéridos de las grasas pueden explicar algunas de las incongruencias de los estudios epidemiológicos y experimentales. Vitaminas liposolubles La vitamina A y la vitamina D se encuentran principalmente en las mantecas y en los aceites de pescado. El aceite de palma rojo es una fuente rica de -caroteno, una provitamina A. En muchos países en desarrollo, especialmente en Africa occidental, el aceite de palma bruto es una importante fuente de -caroteno, que aporta gran parte de la vitamina A requerida por la población. Sin embargo, la elaboración de los aceites comestibles hace que con frecuencia se eliminen totalmente los carotenoides presentes en el aceite bruto. Por ejemplo, el aceite de palma bruto, una fuente rica en carotenoides (500-700 ppm) puede perderlos todos en el proceso de refinado. Sin embargo, se pueden utilizar técnicas suaves para elaborar el aceite de palma bruto que permiten conservar la mayor parte de los carotenoides a la vez que se eliminan los ácidos grasos libres y los peróxidos perjudiciales. El aceite de palma rojo resultante, con un alto contenido de carotenoides, puede convertirse en un importante componente dietético en la lucha contra la carencia de vitamina A en muchos países en desarrollo, y debe apoyarse su utilización. Muchos aceites vegetales y los productos fabricados con ellos contienen concentraciones apreciables de vitamina E (tocoferoles), que también pueden reducirse como consecuencia de algunos métodos de elaboración. Ubiquinonas No se sabe si la ubiquinona Q9 es biológicamente activa en los seres humanos, pero la ubiquinona Q10 actúa como transportador de electrones en las mitocondrias. La ubiquinona Q10, junto con el -tocoferol, parece proteger las lipoproteínas de baja densidad frente a la oxidación (Tribble et al., 1994). Antioxidantes Además de la vitamina E, otras sustancias actúan como antioxidantes, pero el tocoferol es el principal antioxidante liposoluble del cuerpo, y se encuentra en las lipoproteínas, especialmente en las LDL. Se encuentra en las membranas celulares, tanto en el interior como en el exterior de la célula, mejorando la protección de ésta frente al ataque de los radicales libres. La vitamina E mejora la función inmunitaria (Meydani et al., 1990) y puede intervenir en la reparación de las membranas dañadas (Newmark y Mergens, 1981; Bright-See y Newmark, 1983). Se ha supuesto que los antioxidantes alimentarios protegen contra diversos condicionantes relacionados con la edad, incluidas las enfermedades cardiovasculares y el cáncer. El papel que juegan el tocoferol y otros antioxidantes en la protección de los ácidos grasos frente a la oxidación cobró importancia cuando se reconoció que las LDL oxidadas podían intervenir en el proceso aterosclerótico (Jurgens et al., 1987). En las lesiones ateroscleróticas están presentes las LDL modificadas por oxidación, que parecen constituir el vínculo entre las LDL plasmáticas y el desarrollo de las primeras lesiones (Yla-Herttuala et al., 1989). Otras pruebas de que la oxidación lipídica podría ser un factor de aterosclerosis procedieron del descubrimiento de que la sensibilidad de las LDL ante la oxidación se correlacionaba con la severidad de la aterosclerosis en varones jóvenes que habían sobrevivido a un infarto de miocardio (Regnstrom et al., 1992). La suplementación con antioxidantes en varones con un nivel bajo de los mismos y un alto consumo de grasas redujo la capacidad de las plaquetas de agregar y de producir tromboxano A2 (Salonen et al., 1991). En relación con este descubrimiento, las muestras de suero de 16 grupos europeos aportaron la evidencia de la relación inversa entre los niveles de -tocoferol del plasma y las tasas de mortalidad a causa de las enfermedades coronarias del corazón (Gey et al., 1991). Cuando un grupo de voluntarios masculinos recibió suplementación con -tocoferol durante un período de tres meses, esto condujo al aumento de los niveles de -tocoferol en el plasma y en las LDL, y disminuyó la sensibilidad de las LDL frente a la oxidación, en comparación con la suplementación con un placebo (Jialal y Grundy, 1992). En dos grandes estudios de exploración, uno entre mujeres (Stampfer et al., 1993) y otro entre hombres (Rimm et al., 1993), la ingestión de vitamina E, en principio como suplemento, se asociaba con una reducción sustancial del riesgo de infarto de miocardio. Entre los hombres, el consumo de carotenoides se asociaba también a una disminución del riesgo, especialmente entre las personas que habían fumado cigarrillos antes o durante el estudio. Esta prueba sugiere que los antioxidantes juegan un importante papel en la prevención de las enfermedades coronarias del corazón, pero se necesita un apoyo científico mayor. Se ha pensado que los antioxidantes liposolubles, especialmente los carotenoides y el tocoferol, reducen el riesgo de varios tipos de cáncer. Los mejores datos indican que existe una relación entre la ingestión de carotenoides y el riesgo de procesos epiteliales malignos, especialmente cáncer de pulmón (Steinmetz y Potter, 1991). Existen relativamente pocos datos que relacionen el consumo de vitamina E con el riesgo de cáncer, debido en parte a la dificultad de evaluar el consumo de este nutriente. Sin embargo, los niveles sanguíneos de vitamina E (Knekt et al., 1988) y los complementos con vitamina E (Gridley et al., 1992) se han relacionado directamente con un menor riesgo de determinados cánceres. Además, se ha visto que la vitamina A, suministrada tanto preformada como en forma de precursor carotenoide, está inversamente relacionada con el riesgo de cáncer de mama (Hunter et al., 1993). A partir de los estudios epidemiológicos y con animales, existen pruebas de que el caroteno, y posiblemente el -caroteno, puedan tener propiedades anticancerosas. Los estudios epidemiológicos han mostrado congruentemente las relaciones entre consumos elevados de alimentos enriquecidos con -caroteno y una reducción del riesgo de determinados cánceres (Connett et al., 1989; Le Marchand et al., 1989; Peto et al., 1981). Tocotrienoles Aparte de su actividad como vitamina E, los tocotrienoles presentan ciertas propiedades fisiológicas que no se observan en los tocoferoles. Se ha descrito que cuando se suministran a través de la alimentación a los animales y a los humanos, los concentrados de tocotrienol presentan el efecto de disminuir el nivel de colesterol (Burger et al., 1984; Qureshi 1991a, b; Tan et al., 1991). Se ha sugerido que la capacidad de los tocotrienoles de reducir el colesterol puede estar mediada por su capacidad de reducir los niveles de actividad de la reductasa hepática GMH-CoA (Qureshi et al., 1986). Además, se ha visto que los tocotrienoles influyen sobre ciertos parámetros hemostáticos (Qureshi et al., 1991a), y reducen la incidencia de los tumores inducidos químicamente en ratas (Tan y Chu, 1991; Gould et al., 1991). Fitosteroles Los esteroles de las plantas no son bien absorbidos por los seres humanos, y pueden inhibir la absorción del colesterol y de los ácidos biliares. Pueden ejercer efectos apreciables sobre los niveles de colesterol de las LDL, incluso con consumos relativamente bajos (Grundy y Mok, 1977; Lees et al., 1977; Heinemann, Leiss y von Bergmann, 1986). Aunque no se ha establecido el principal mecanismo de acción de los fitosteroles, pueden influir sobre la solubilización de las micelas de colesterol (Child y Kuksis, 1986), así como la tasa de síntesis y degradación del colesterol (Bober, Akerlund y Bjorkhem, 1989; Ikeda y Sugano, 1983; Heinemann, Leiss y von Bergmann, 1986; Heinemann et al., 1991). Un grupo de ésteres del ácido ferúlico de los alcoholes triterpenos y esteroles vegetales ha mostrado también tener un efecto hipocolesterolémico, quizá inhibiendo la absorción del colesterol y favoreciendo la excreción del esterol y de los ácidos biliares (Nicolosi, Ausman y Hegsted, 1990, 1991a, b). El orizanol, un éster del ácido ferúlico, llega a constituir un 20 por ciento de la fracción no saponificable del aceite de salvado de arroz bruto (Rogers et al., 1993). Además, el ácido ferúlico es un potente antioxidante que estabiliza los aceites vegetales. Conclusiones Los datos actuales sobre los antioxidantes, específicamente tocoferol, sugieren un efecto protector frente a las enfermedades coronarias del corazón en los seres humanos. Sin embargo, estos datos no permiten todavía establecer recomendaciones específicas sobre su consumo. La hipótesis de que las LDL oxidadas constituyen un importante factor aterogénico se suele considerar atractiva. Aunque se han detectado LDL oxidadas en la placa aterosclerótica, todavía no se han aportado pruebas sólidas de que la oxidación de las lipoproteínas en los seres humanos se relacione causalmente con la aterosclerosis. Varios estudios parecen sostener la hipótesis de que los antioxidantes pueden prevenir la modificación de las LDL por oxidación. Sin embargo, antes de que se puedan extrapolar estos estudios a la aterosclerosis, hay que considerar varios puntos: primero, es difícil demostrar un efecto protector en los seres humanos porque las técnicas disponibles tienen una capacidad limitada de medir las peroxidaciones en curso de los lípidos; segundo, no están claras las consecuencias in vivo de las medidas de la oxidación de las LDL in vitro y tercero, la eficacia de cada antioxidante en la prevención de la aterosclerosis debe determinarse todavía en amplios estudios de intervención. Los alimentos con alto contenido de poliinsaturados podrían contener al menos 0,6 mg equivalentes de tocoferol por cada gramo de ácidos grasos poliinsaturados. Pueden ser necesarios niveles superiores en el caso de las grasas ricas en ácidos grasos que contienen más de dos dobles enlaces. La introducción de comidas con bajo contenido de grasas y de aliños reduce la ingestión de vitamina E. A la luz de la reciente evidencia de la importancia de la vitamina E, sería prudente mantener en los mencionados productos bajos en grasas, la misma cantidad de vitamina E por gramo de producto que la que existe en los correspondientes productos con alto contenido en grasas. Capítulo 15 - Etiquetado nutricional La información sobre el contenido de las materias alimenticias debe estar a la disposición de los consumidores. Hacer una lista con los ingredientes es una forma de identificar los alimentos consumidos, y otra forma consiste en marcarlos con una etiqueta que explique el contenido de nutrientes del producto. Se ha prestado una atención considerable al etiquetado de los productos con su composición lipídica debido a la demanda de los consumidores y a la cantidad de países que en la actualidad recomiendan que la población modifique su consumo de grasas. Aunque la conveniencia de esta estrategia y la capacidad de utilizar dicha información puede variar según los países, el estado sanitario de las personas, los objetivos de la sanidad pública, y los patrones alimenticios de los distintos grupos de población dentro de un mismo país, es de esperar que un aumento de la disponibilidad del etiquetado nutricional en los productos alimenticios mejore la salud pública. Características de la etiqueta de los alimentos. Las etiquetas de los alimentos describen su contenido en nutrientes, y van dirigidas al consumidor. Por tanto, la terminología empleada debe tener sentido y ser comprensible para el público en general. Probablemente, un formato simple y normalizado ayudaría a las personas a utilizar las etiquetas de los alimentos y a comparar alimentos. La información sobre nutrición proporcionada debe elegirse basándose en su coherencia con las recomendaciones dietéticas. La selección de los nutrientes específicos o de los componentes de los alimentos que vayan a figurar en la lista debe tener en cuenta el espacio de la etiqueta, la capacidad analítica para medir un componente alimentario particular dentro de la matriz de los alimentos, y los costos relativos de dichos análisis. Aplicación del etiquetado nutricional. Hay que hacer notar que el etiquetado de los alimentos puede ser cuestionable o irrelevante en determinadas circunstancias. En concreto, la etiqueta no será rentable ni apropiada cuando el principal problema de salud pública sea la falta de alimentos suficientes, donde los niveles educativos no sean los adecuados para permitir a los consumidores leer o comprender dicha información, y donde los métodos de empaquetado y distribución de los alimentos excluyan el empleo de etiquetas sobre o cerca de ellos. Sin embargo, es probable que en muchos países haya algunos sectores de la población que podrían beneficiarse de la información sobre los componentes lipidícos de los alimentos. En estos casos, los países deben considerar la necesidad de proporcionar los medios para un etiquetado adecuado y su presentación de acuerdo con las directrices y orientaciones existentes. A medida que los esfuerzos relacionados con el etiquetado de los alimentos han ido evolucionando, se han ido estableciendo distintas orientaciones y requisitos legales. Esto plantea dificultades a la hora de desarrollar y armonizar las listas con información nutricional que tienen amplias aplicaciones internacionales. Esto incluye consideraciones tales como el número de idiomas que se deben utilizar en la etiqueta; si la información se debe expresar cuantitativamente, con símbolos, o empleando términos como «alto», «medio», o «bajo»; y si la información nutricional se expresa en cantidades por 100 gramos de alimento o por dosis (raciones) específicas. A medida que sigan aumentando las pruebas científicas que relacionan el contenido de nutrientes de los alimentos con las condiciones de determinadas enfermedades crónicas, la política sanitaria y las orientaciones dietéticas públicas pueden modificarse y variar de un país a otro. Aunque dichas situaciones son con frecuencia inevitables, está claro que una mayor congruencia en las orientaciones sobre el etiquetado de los alimentos reducirá las barreras que impiden promover la armonización internacional y mayores beneficios para los consumidores. Comisión del Codex Alimentarius. La Comisión del Codex Alimentarius (CAC) se estableció para ejecutar el Programa Conjunto FAO/OMS de Normas Alimentarias. Las Directrices sobre el Etiquetado Nutricional elaboradas por el Codex se basan en el principio de que ningún alimento debe describirse o presentarse de forma falsa, o que induzca a error o a engaño (Comisión del Codex Alimentarius, 1992). Las directrices contienen disposiciones para realizar declaraciones voluntarias de nutrientes, el cálculo y la presentación de la información sobre los nutrientes. Las Directrices sobre Declaraciones de Propiedades de los Alimentos establecen los principios generales que se deben seguir y deja a las normativas nacionales la tarea de definir las declaraciones de propiedades específicas (Id.). La CAC ha sugerido la necesidad de ocuparse de los asuntos específicos sobre las declaraciones de propiedades sanitarias y nutricionales, puesto que se emplean normalmente. Actualmente se está elaborando un anteproyecto de directrices sobre declaraciones de propiedades específicas de los alimentos. Preocupaciones La información nutricional que se brinde debe ser fidedigna y no debe inducir a error a los consumidores. Al mismo tiempo, la reglamentación del etiquetado debe incentivar a los fabricantes a elaborar productos que mejoren la salud pública y a ayudar a los consumidores a seguir las recomendaciones respecto a la alimentación. Estas preocupaciones se extienden al empleo de declaraciones relacionadas con la salud o el contenido de nutrientes con respecto a las características deseables de los alimentos (como «bajo contenido de grasas» o «sin colesterol») que se hacen para promocionar ciertos tipos de alimentos. En muchas circunstancias, estas declaraciones pueden ayudar al consumidor; sin embargo, las declaraciones pueden ser problemáticas cuando sugieren que una marca particular de un alimento que de por sí es «de bajo contenido» o «exento» de grasas se ha formulado especialmente y presenta algún beneficio en comparación con otras marcas. Análogamente, cuando se formulan o se perfeccionan cambios en los alimentos para sugerir unas ventajas, éstas deben ser sustanciales. Sin embargo, esto puede variar según la categoría de los alimentos. Todas estas preocupaciones van dirigidas no sólo a las declaraciones formuladas en la etiqueta de los alimentos, sino también a la publicidad sobre productos alimenticios. Como la capacidad de comunicación rápida y extendida por todo el mundo crece junto con la aparición de marcas mundiales, las declaraciones publicitarias sobre las cualidades nutricionales de los alimentos tienen la posibilidad de emplearse extensamente. Se debe prestar atención a su reglamentación y a los procedimientos para hacer observar las normas. Además, la preocupación sobre las declaraciones de propiedad y su capacidad de inducir a error o a engaño a los consumidores puede extenderse a las actividades de los restaurantes y de los servicios de comidas. Sin embargo, las normas no deberían ser tan estrictas como para desincentivar a los fabricantes o proveedores a elaborar productos mejorados y comunicar al público esta información. Otra preocupación fundamental consiste en si las declaraciones sobre los componentes lipidícos de los alimentos que figuren en las etiquetas deben definirse para propósitos de etiquetado por sus estructuras químicas o sus aplicaciones fisiológicas. Desde el punto de vista de la formación del consumidor, las características fisiológicas presentan ventajas porque los consumidores pueden aplicar fácilmente dicha información. Sin embargo, los datos de apoyo para relacionar determinados componentes lipídicos de los alimentos con las aplicaciones fisiológicas específicas varía; algunos están bien establecidos y aceptados mientras que otros son sugestivos y especulativos. Por ejemplo, en la actualidad resultaría difícil definir las ventajas de declarar los niveles de «ácidos grasos que elevan el colesterol». Además, no existe un acuerdo universal sobre si resulta adecuado proporcionar a los consumidores información relativamente específica sobre los componentes de los ácidos grasos de los alimentos. Indudablemente, a medida que continúen acumulándose pruebas científicas, se irán aclarando las decisiones adecuadas en estas áreas. Conclusiones Deberían respaldarse los esfuerzos en materia de etiquetado nutricional, tanto voluntario como obligatorio, de los alimentos en general, y de los componentes lipídicos en particular. Estas sugerencias generales nacen de los considerables datos que vinculan las grasas alimentarias con las enfermedades crónicas, y de las recomendaciones sanitarias relativas a los niveles convenientes de los componentes grasos de la alimentación humana. Además, es útil tratar de conseguir una armonización internacional en este campo, y se deben apoyar los esfuerzos de la Comisión del Codex Alimentarius, que está elaborando y estableciendo directrices relativas al etiquetado nutricional y a declaraciones de propiedades de los alimentos. No obstante, cualquier esfuerzo para armonizar detalles va a ser muy complicado, y será mejor acogido en un pequeño foro, por ejemplo en una consulta de expertos o en grupos especiales de trabajo. Existen recomendaciones específicas sobre la información que debe figurar en la etiqueta. Debería declararse el contenido total de grasas, definido como la suma de todos los ácidos grasos que proporcionan energía. Esto concuerda con las directrices formuladas por el Codex Alimentarius y las disposiciones de la Comunidad Europea. Dichas declaraciones deben establecerse en incrementos de gramos. Debería declararse el contenido de grasas saturadas, definido como la suma de ácidos grasos sin dobles enlaces. También esto concuerda con las directrices del Codex Alimentarius y las disposiciones de la Comunidad Europea. Dichas declaraciones deberían establecerse también en incrementos de gramos. El contenido de colesterol debería declararse en incrementos de 10 miligramos. Ni el Codex Alimentarius ni la Comunidad Europea han formulado disposiciones respecto a este componente graso. Las declaraciones relativas a los ácidos grasos saturados de los alimentos deberían limitarse a los alimentos con niveles adecuadamente bajos o reducidos de isómeros en trans de los ácidos grasos. Hay considerable acuerdo sobre los efectos de los ácidos grasos en trans en los niveles de colesterol sérico. No sería oportuno sugerir las ventajas de un alimento para reducir el riesgo de enfermedades cardíacas, si contiene otros componentes que aumentan claramente dicho riesgo. Aunque todavía no se ha alcanzado un acuerdo global sobre la oportunidad o conveniencia del etiquetado, puede resultar útil considerar otros aspectos de interés relacionados con él. Por ejemplo, las declaraciones sobre la aportación calórica de las grasas contenidas en un alimento. Debería hacerse en calorías de la grasa, no en porcentaje de grasa. Otro aspecto de interés sería la declaración sobre la cantidad de isómeros en trans de los ácidos grasos de un alimento, ya sea en una lista independiente o formando parte de la lista de las grasas saturadas. Por último, deberían estudiarse las declaraciones de la cantidad de ácidos grasos monoinsaturados n-3 y n-6. Bibliografía Althabe, O., Laberre C., Telenta M. 1985. Maternal vascular lesions in placentae of small for gestational age infants. Placenta. 6: 265-276. Anderson, K.M., Castelli, W.P. and Levy, D. 1987. Cholesterol and mortality: 30 years of follow-up from the Framingham Study. Journal of the American Medical Association. 257: 2176-2180. Armstrong, B., van Merwyk, A.J. and Coates, H. 1977. Blood pressure in seventhday Adventist vegetarians. American Journal of Epidemiology. 105: 444-449. Ascherio, A., Rimm, E.B., Giovannucci, E.L., Colditz, G.A., Rosner, B., Willett, W.C., Sacks, R. and Stampfer, M.J. 1992. A prospective study of nutritional factors and hypertension among U.S. men. Circulation. 86: 1475-1484. Ascherio, A., Hennekens, C.H., Baring, J.E., Master, C., Stampfer, M.J. and Willett, W.C. 1994. Trans fatty acids intake and risk of myocardial infarction. Circulation. 89: 94-101. Ballard-Barbash, R., Schatzkin, A., Carter, C.L., Kannel, W.B., Kreger, B.E., D'Agostino, R.B., Splansky, G.L., Anderson, K.M. and Helsel, W.E. 1990. Body fat distribution and breast cancer in the Framingham Study. Journal of the National Cancer Institute. 82(4): 286-290. Barker, D.J.P., Gluckman, P.D., Godfrey, K.M., Harding, J.E., Owens, J.E. and Robinson, J.S. 1993. Fetal nutrition and cardiovascular disease. The Lancet. 341: 938-941. Beare-Rogers, J.L. 1983. Trans and positional isomers of common fatty acids. In H.H. Draper (ed.) Advances in Nutritional Research. Vol. 5 Plenum Press, New York, pp. 171-200. Beilin, L.J. 1987. State of the art lecture. Diet and hypertension: critical concepts and controversies. Journal of Hypertension. 5 (Suppl. 5): S447-S457. Beilin, L.J. 1992. Dietary fatty acids and blood pressure. In Sinclair, A., Gibson, R., (eds.) Essential Fatty Acids and Eicosanoids. p. 334-338. Bennet, C., Reed, G.W., Peters, J.C., Abumrad, N.J., Sun, M., and Hill, J.O. 1992. Short-term effects of dietary-fat ingestion on energy expenditure and nutrient balance. American Journal of Clinical Nutrition. 55: 1071-1077. Berdanier, C.D., Johnson, B., Hartle, D.K., Crowell, W. 1992. Life span is shortened in BHE/cdb rats fed a diet containing 9 % menhaden oil and 1 % corn oil. Journal of Nutrition. 122: 1309-1317. Berg, J.W. 1975. Can nutrition explain the pattern of international epidemiology of hormone-dependent cancer? Cancer Research. 35: 3345-3350. Bernsohn, J. and Stephanides, L.M. 1967. Aetiology of multiple sclerosis. Nature. 215: 821-823. Berry, E.M., Hirsch, J., Most J., McNamara, D.J. and Cunningham-Rundles, S. 1987. Dietary fat, plasma lipoproteins, and immune function in middle-aged American men. Nutrition and Cancer. 9 (2-3): 129-142. Berry, E.M. and Hirsch, J. 1986. Does dietary linolenic acid influence blood pressure? American Journal of Clinical Nutrition. 44: 336-340. Beyers, E.C. and Emken, E.A. 1991. Metabolites of cis, trans, and trans, cis isomers of linoleic acid in mice and incorporation into tissue lipids. Biochimica et Biophysica Acta. 1082: 275-284. Birch, D.G., Birch, E.E., Hoffman, D.R., and Uauy, R.D. 1992. Retinal development in very-low-birth-weight infants fed diets differing in omega-3 fatty acids. Investigative Ophthalmology and Visual Science 33(8): 2365-2376. Birch, E.E., Birch, D.G., Hoffman, D.R., and Uauy, R. 1992. Dietary essential fatty acid supply and visual acuity development. Investigative Ophthalmology and Visual Science. 33(11): 3242-3253. Birch, E.E., Birch, D. Hoffman, D., Hale, L., Everett, M. and Uauy, R. 1993. Breastfeeding and optimal visual development. Journal of Pediatric Ophthalmology and Strabismus. 30(1): 33-38. Birt, D.F. and Bresnick, E. 1991. Chemoprevention by nonnutrient components of vegetables and fruits. In Alfin-Slater, R.B. and Kritchevsky, D. (eds.). Human Nutrition. Vol.7. Cancer and Nutrition. Plenum Press, New York. pp. 221-260. Birt, D.F., Pinch, H.J., Barnett, T. Phan, A. and Dimitroff, K. 1993. Inhibition of skin tumor promotion by restriction of fat and carbohydrate calories in SENCAR mice. Cancer Research. 53(1): 27-31. Bjorkhem, I., Henriksson-Freyschuss, A., Breuer, O., Diczfalusy, U., Berglund, L. and Henriksson, P. 1991. Arteriosclerosis and Thrombosis. 11(1): 15-22. Black, A.E., Prentice, A.M., Goldberg, G.R., Jebb, S.A., Bingham, S.A., Livingstone, M.B.E. and Coward, W.A. 1993. Measurements of total energy expenditure provide insights into the validity of dietary measurements of energy intake. American Dietetic Association. Journal. 93(5): 572-579. Blankenhorn, D.H., Nessim, S.A., Johnson, R.L., Sanmarco, M.E., Azen, S.P. and Cashin-Hemphill, L. 1987. Beneficial effects of combined colestipol-niacin therapy on coronary atherosclerosis and coronary venous bypass grafts. J. of the American Medical Association. 257(23): 3233-3240. Block, G., Patterson, B and Subar, A. 1992. Fruit, vegetables and cancer prevention: A review of the epidemiologic evidence. Nutrition and Cancer. 18: 1-29. Bober, K.M., Akerlund, J.-E. and Bjorkhem, I. 1989. Effect of sitosterol on the ratelimiting enzymes in cholesterol synthesis and degradation. Lipids. 24: 9-12. Bonaa, K.H., Bjerve, K.S., Straume, B., Gram, I.T. and Thelle, D. 1990. Effect of eicosapentaenoic and docosahexaenoic acids on blood pressure in hypertension. A population-based intervention trial from the Tromso study. New England Journal of Medicine. 322(12): 795-801. Bonanome, A. and Grundy, S.M. 1988. Effect of dietary stearic acid on plasma cholesterol and lipoprotein levels. New England Journal of Medicine. 318: 1244-1248. Borgstrom, B. 1974. In Smyth, D.H. (ed.) Biomembranes. Vol. 4b. p. 555-60, Plenum Press, New York, N.Y; Borkan, G.A., Sparrow, D., Wisniewski, C. and Vokonas, P.S. 1986. Body weight and coronary disease risk: patterns of risk factor change associate with long-term weight change. American Journal of Epidemiology 124:410-419. Bornstein, M.B. 1973. The immunopathology of demyelinative disorders in organotypic culture of mammalian central nervous tissues. In Zimmerman, H.M. Progress in Neuropathology 11. New York: Gune and Statton. 69-90. Borzelleca, J.F. 1992. Macronutrient substitutes: safety evaluation. Regulatory Toxicology and Pharmacology. 16(3): 253-264. Bosland, M.C. 1988. The etiopathogenesis of prostatic cancer with special reference to environmental factors. Advances in Cancer Research. 51: 1-106. Bourre, J.M., Francois, M., Youyou, A., Dumont, O., Piciotti, M., Pascal, G. and Durand, G. 1989. The effects of dietary alpha-linolenic acid on the composition of nerve membranes, enzymatic activity, amplitude of electrophysiological parameters, resistance to poisons and performance of learning tasks in rats. Journal of Nutrition. 119(12): 1880-1892. Boutwell, R.K. 1992. Calorie intake, dietary fat level and experimental carcinogenesis. In Jacob, M.M. (ed.). Advances in Experimental Medical Biology. Vol. 322. Exercise, calories, fat and cancer. Plenum Press, New York. pp. 95-101. Boyd, N.F., Cousins, M., Beaton, M., Fishell, E., Wright, B., Fish, E., Kriukov V., Lockwood, G., Tritchler, D., Hanna, W. and Page, D.L. 1988. Clinical trial of low-fat, high-carbohydrate diet in subjects with mammographic dysplasia: report of early outcomes. Journal of the National Cancer Institute 80:1244-1248. Boyd, N.F. 1993. Nutrition and breast cancer. Journal of the National Cancer Institute. 45: 6-7. Bradden, F.E., Rodgers, B., Wadsworth, M.E. and Davies, J.M. 1986. Onset of obesity in the 36-year birth cohort study. British Medical Journal 293:299-303. Bray, G.A. 1987. Obesity and the heart. Modern Concepts of Cardiovascular Diseases 56(12):67-71. Bray, G.A., York, D. and Fisler, J. 1989. Experimental obesity: A homeostatic failure due to defective nutrient stimulation of the sympathetic nervous system. Vitamins and Hormones 45:1-125. Brenner, R.R. 1989. Factors influencing fatty acid chain elongation and desaturation, in the role of fats in human nutrition. 2nd edn. (eds A.J. Vergroesen and M. Crawford), Academic Press, London pp. 45-79. Brenner, R.R. 1990. Endocrine control of fatty acid desaturation. Biochemical Society Transactions. 18: 774. Bright-See, E. and Newmark, H.L. 1983. Potential and probable role of vitamins C and E in the prevention of carcinogenesis. In Meyskens, F.L. and Karger, K.N. (eds.) Modulation and mediation of cancer by vitamins. New York, pp. 95-103. Brinton, E.A., Eisenberg, S. and Breslow, J.L. 1990. A low-fat diet decreases high density lipoprotein (HDL) cholesterol levels by decreasing HDL apolipoprotein transport rates. Journal of Clinical Investigation. 85: 144-151. British Nutrition Foundation. 1987. Report of the task force on trans fatty acids. London: British Nutrition Foundation. British Nutrition Foundation. 1992. Unsaturated fatty acids. Nutritional and physiological significance. The Report of the British Nutrition Foundation's Task Force. Chapman & Hall, London. Budowski, P., Leighfield, M.J. and Crawford, M.A. 1987. Nutritional encephalomalacia in the chick: an exposure of the vulnerable period for cerebellar development and the possible need for both w6 and w3 fatty acids. British Journal of Nutrition. 58: 511 - 520. Bull, A.W., Bronstein, J.C. and Nigro, N.D. 1989. The essential fatty acid requirements for azoxymethane-induced intestinal carcinogenesis in rats. Lipids. 24: 340-436. Burger, W.C., Qureshi, A.A., Din, Z.Z., Abuirmeileh, N. and Elson, C.E. 1984. Suppression of cholesterol biosynthesis by constituents of barley kernel. Atherosclerosis. 51: 75-87. Caan, B., Horgen, D.M., Margen, S., King, J.C. and Jewell, N.P. 1978. Benefits associated with WIC supplemental feeding during the interpregnancy interval. American Journal of Clinical Nutrition. 45: 29-41 Carlson, S.E., Cooke, R.J., Werkman, S.H. and Tolley, E.A. 1992. First year growth of preterm infants fed standard compared to marine oil n-3 supplemented formula. Lipids. 27(11): 901-907. Carlson, S.E., Werkman, S.H., Rhodes, P.G. and Tolley, E.A. 1993a. Visual acuity development in healthy preterm infants: effect of marine-oil supplementation. American Journal of Clinical Nutrition. 58(1):35-42. Carlson, S.E., Werkman, S.H., Peeples, J.M., Cooke, R.J. and Tolley, E.A. 1993b. Arachidonic acid status correlates with first year growth in preterm infants. Proceedings of the National Academy of Sciences. (USA) 90(3): 1073-1077. Carlson, S.E., Werkman, S.H., Peeples, J.M., Wilson W.M. III. 1994. Growth and development of premature infants in relation to n-3 and n-6 fatty acid status. In: Fatty acids and lipids from cell biology to human disease. Proceedings of the International Society for the Study of Fatty Acids and Lipids, Basel, Switzerland, S. Karger. In press. Carroll, K.K. and Khor, H.T. 1975. Dietary fat in relation to tumorigenesis. Progress in Biochemical Pharmacology. 10: 308-353. Carroll, K.K. 1975. Experimental evidence of dietary factors in hormone-dependent cancers. Cancer Research. 35: 3374-3383. Carroll, K.K., Braden, L.M., Bell, J.A. and Kalamegham, R. 1986. Fat and cancer. Cancer. 58(8 Suppl.): 1818-1825. Carroll, K.K. 1989. Fish oils and cancer. In Chandra, R.K. (ed.). Health Effects of Fish and Fish Oils. ARTS Biomedical Publishers and Distributors, St. John's, Newfoundland, pp. 395-408. Carroll, K.K. 1991b. Evaluation of publicly available scientific evidence regarding certain nutrient-disease relationships. Lipids and Cancer. 10. Life Science Research Office. Federation of American Societies of Experimental Biology. Bethesda, Maryland. Carroll, K.K. and Parenteau, H.I. 1991. A proposed mechanism for effects of diet upon mammary cancer. Nutrition and Cancer. 16: 79-83. Carroll, K.K. 1994. Lipids and cancer. In Carroll, K.K. and D. Kritchevsky (eds.) Nutrition and Disease Update, Cancer, AOCS Press, Champaign, Illinois, pp. 235-296. Casey, V.A., Dwyer, J.T., Coleman, K.A. and Valadian, I. 1992. Body mass index from childhood to middle age: a 50-year follow-up. American Journal of Clinical Nutrition 56:14-18. Cathcart, E.S. and Gonnerman, W.A. 1991. Fish oil fatty acids and experimental arthritis. Rheumatic Disease Clinics of North America. 17: 235-242. Cave, W.T., Jr. 1991a. Dietary n-3 (@-3) polyunsaturated fatty acid effects on animal tumorigenesis. Federation of American Societies for Experimental Biology Journal. 5: 2160-2166. Cave, W.T, Jr. 1991b. Omega-3 fatty acid diet effects on tumorigenesis in experimental animals. World Review of Nutrition and Dietetics. 66: 462-476. Chang, H.R., Dulloo, A.G., Vladoianu, I.R., Piguet, P.F., Arsenijevic, D., Girardier, L. and Pechere, J.C. 1992. Fish oil decreases natural resistance of mice to infection with salmonella typhimurium. Metabolism. 41(1): 1-2. Charney, E., Goodman, H.C., McBride, M., Lyon, B. and Pratt, R. 1976. Childhood antecedents of adult obesity. New England Journal of Medicine 295:6-9. Charnock, J.S., McLennon, P.L., Abeywardena, M.Y. and Russel, G.R. 1985. Altered levels of n-6/n-3 fatty acids in rat heart and storage fat following dietary intake of linoleic acid. Annals of Nutrition and Metabolism. 29: 278-288. Charnock, J.S., Abeywardena, M.Y. and McLennon, P.L. 1986. Comparative changes in fatty acid composition of rat cardiac phospholipids after long-term feeding of sunflower seed oil- or tuna fish oil- supplemented diets. Annals of Nutrition and Metabolism. 30: 393-406. Chaudry, M.M., Nelson, A.I., Perkins, E.G. 1978. Distribution of chlorinated pesticides in soyabeans, soyabean oil and its byproducts during processing. Journal of the American Oil Chemists' Society. 55: 851-853. Chen, J., Campbell, T.C., Junyao, L., Peto, R. 1987. The diet, lifestyle and mortality characteristics of 65 rural populations in the People's Republic of China. Oxford Univ. Press, Oxford. Chen, Z.M., Peto, R., Collins, R., MacMahon, S., Lu, J., Li, W. 1991. Serum cholesterol concentration and coronary heart disease in a population with low cholesterol concentrations. British Medical Journal. 303(6797): 276-282. Child, P. and Kuksis, A. 1986. Investigation of the role of micellar phospholipid in the preferential uptake of cholesterol over sitosterol by dispersed rat jejunal villus cells. Biochemistry and Cell Biology. 64: 847-853. Ciocca, S., Area, M., Montali, A., Fazio, S., Bucci, A., Angelico, F. and the Roman Group for Epidemiology and Prevention of Cholelithiasis (GREPO). 1987. Lack of association between arterial blood pressure and erythrocyte fatty acid composition in an Italian population sample. Scandinavian Journal of Clinical and Laboratory Investigation. 47: 105-110. CILSS. 1991. L'impact de l'urbanisation sur les modèles de consommation alimentaire de base au Niger (The impact of urbanization on the staple food consumption patterns in Niger). Rapport final. Dir. Statistiques et Informatique Min. du Plan Niamey (Niger). Istituto Italo-Africano, Rome (Italic). Cobiac, L., Nestel, P.J., Wing, L.M.H. and Howe, P.R.C. 1992. A low-sodium diet supplemented with fish oil lowers blood pressure in the elderly. Journal of Hypertension. 10: 87-92. Comisión Codex Alimentarius (CAC). 1992. Requisitos Generales, Vol. 1, 2a edición. Roma, FAO/OMS. Colditz, G.A., Willett, W.C., Stampfer, M.J., London, S.S., Segal M.D., and Speizer, F.E. 1990. Patterns of weight change and their relation to diet in cohortal healthy women. American Journal of Clinical Nutrition. 51: 1100-1105. Colling, M., Weggemann, S., Doring, A., Keil, U. and Wolfram, G. 1989. Nutrition survey of adults using a 7-day protocol - a pilot study in the Augsburg MONICA project. Offentl Gesundheitswes. 51(2): 94-97. (German; Non-English). Committee on Diet and Health. 1989. Diet and health: Implications for reducing chronic disease risk. Food and Nutrition Board. National Research Council, National Academy Press, Washington, D.C. Connett J.E., Kuller L.H., Kjelsberg, M.O., Polk, B.F., Collins, G., Rider, A. and Hulley, S.B. 1989. Relationship between carotenoids and cancer: the Multiple Risk Factor Intervention Trial (MRFIT) Study. Cancer. 64: 126-134. Cox, J.W., Rutecki, G.W., Francisco, L.L. and Ferris, T.F. 1982. Studies of the effects of essential deficiency in the rat. Circulation Research. 51: 694-702. Crawford, M.A., Hassam, A.G., Williams, G. and Whitehouse, W. 1976 Essential fatty acids and fetal brain growth. The Lancet (i) 452-453. Crawford, M.A., Doyle, W., Drury, P.J., Lennon, A., Costeloe, K. and Leighfield, M. 1989. n-6 and n-3 fatty acids during early human development. Journal of Internal Medicine. 225: suppl. 1: 159-169. Crawford, M.A., Costeloe, K., Doyle, W., Leighfield, M.J., Lennon, E.A., Meadows, N. 1990. Potential diagnostic value of the umbilical artery as a definition of neural fatty acid status of the fetus during its growth. Biochemical Society Transactions. 18: 761-766. Cruickshank, J.K., Cooper, J., Burnett, M., MacDuff, J., Drubra, U. 1991. Ethnic differences in fasting plasma C-peptide and insulin in relation to glucose tolerance and blood pressure. The Lancet. 338(8771): 842-7. D'Ambola, J.B., Aeberhard, E.E., Trang, N., Gaffar, S., Barrett, C.T., Sherman, M.P. 1991. Effect of dietary (n-3) and (n-6) fatty acids on in vivo pulmonary bacteral clearance by neonatal rabbits. Journal of Nutrition. 121: 1262-1269. Dao, T.L. and Hilf, R. 1992. Dietary fat and breast cancer: a search for mechanisms. Advances in Experimental Medicine and Biology. 322: 223-237. Den Hartog, A.P. 1992. Dietary change and industrialization: the making of the modem Dutch diet (1850-1985). Ecology of Food and Nutrition. Vol. 27 pp. 307-318. Denke, M.A. and Grundy, S.M. 1992. Comparison of effects of lauric acid and palmitic acid on plasma lipids and lipoproteins. American Journal of Clinical Nutrition. 56: 895898. Denke, M.A. and Breslow, J.L. 1988. Effects of a low fat diet with and without intermittent saturated fat and cholesterol ingestión on plasma lip id, lipoprotein and apolipoprotein levels in normal volunteers. Journal of Lipid Research. 29: 963-970. Di Luzio, N.R. 1972. Employment of lipids in the measurement and modification of cellular, humoral, and immune responses. In Paoletti, R. and Kritchevsky, D. Advances in Lipid Research. New York: Academic Press. 43-88. Donahue, R.P., Abbott, R.D., Bloom, E., Reed, D.M. and Yano, K. 1987. Central obesity and coronary heart disease in men. The Lancet 1:821-824. Donato, K. and Hegsted, D.M. 1985. Efficiency of utilization of various sources of energy for growth. Proceedings of the National Academy of Sciences. USA. 82: 48664870. Doyle, W., Crawford, M.A., Wynn, A.H., Wynn, S.W. 1990. The association between maternal diet and birth dimensions. Journal of Nutritional Medicine. 1: 9-17. Drury, PJ. and Crawford, M.A. 1990. Essential fatty acids in human milk In Clinical Nutrition of the Young Child. Raven Press, New York. 302-312. Ducimetiere, P., Richard, J. and Cambien, F. 1986. The pattern of subcutaneous fat distribution in middle-aged men and the risk of coronary heart disease: the Paris Prospective Study. International Journal of Obesity 10:229-240. Dunn, H.G., ed. 1986. Sequelae of low birthweight: The Vancouver Study. Blackwell Scientific Publications, Oxford. Dupont, J., White, P.J., Carpenter, M.P., Schaefer, E.J., Meydani, D.V.M., Elson, C.E., Woods, M. and Gorbach, S. L. 1990. Food uses and health effects of corn oil. American College of Nutrition Journal. 9(5):438-470. Dutton, H.Y. 1979. Hydrogenation of fats and its significance in geometric and positional fatty acid isomers. Emken, E.A., and Dutton, M.J. (eds.) AOCS, pp 1-16. Dwyer, T. and Hetzel, B.S. 1980. A comparison of trends of coronary heart disease mortality in Australia, U.S.A. and England and Wales with reference to three major risk factors - hypertension, cigarette smoking and diet. International Journal of Epidemiology. 9: 65-71. Dyerberg, J., Bang, H.O., Stoffersen, E. Moneada, S. and Vane, J.R. 1978. Eicosapentaenoic acid and prevention of thrombosis and atherosclerosis? The Lancet. 2(8081):117-119. Eder, S.R. 1982. Über die Bildung von Artefakten bei der Dämpfung von Speiseölen und-fetten. (Development of artifacts during processing of food oils and fats) Fette Seifen Anstrichmittel (Fat-science technology). 84: 136-141. Ehnholm, C., Huttunen, J.K., Pietinen, P., Leino, U., Mutanen, M., Kostiainen, E., Pikkarainen, J., Dougherty, R. Iacono, J. and Puska, P. 1982. Effect of diet on serum lipoproteins in a population with a high risk of coronary heart disease. New England Journal of Medicine. 307(14): 850-855. Elliott, P., Fehily, A.M., Sweetnam, P.M. and Yarnell, J.W.G. 1987. Diet, alcohol, body mass, and social factors in relation to blood pressure: the Caerphilly Heart Study. Journal of Epidemiology and Community Health. 41: 37-43. Emken, E.A., Adolf, R.O., Rohwedder, W.K. and Gulley, R.M. 1980a. Incorporation of deuterium-labelled trans-and cis-13-octadecenoic acids in human plasma. Journal of Lipid Research. 24: 34-46. Emken, E.A., Dutton, H.J., Rohwedder, W.K., Rakoff, H. and Adolf, R.O. 1980b. Distribution of deuterium-labelled cis- and trans-12-octadecenoic acids in human plasma and lipoprotein lipids. Lipids. 15: 864-871. Emken, E.A., Rohwedder, W.K., Dutton, H.J., DeJarlais, W.J., Adolf, R.O., Mackin, J., Dougherty, R.M. and Iacono, J.M. 1979. Incorporation of deuterium labeled cisand trans-9-octadecenoic acid in humans: Plasma, erythrocyte and platelet neutral lipids. Metabolism. 28: 575-583. Emken, E. A. 1984. Nutrition and biochemistry of trans and positional fatty acid isomers in hydrogenated oils. Annual Reviews of Nutrition. 4: 339-376. Emken, E.A., Adolf, R.O., Rohwedden, W.K. and Gulley, R.M. 1992. Comparison of linoleic and linolenic metabolism in men. Influence of dietary linoleic acid. pp 2325, In A. Sinclair and R. Gibson (eds.) Essential Fatty Acids and Eicosanoids. American oil Chemists' Society, Champaign, Illinois. Endres, S., Ghorbani, R., Kelley, V.E., Georgilis, K., Lonnemann, G., van der Meer, J.W., Cannon, J.G., Rogers, T.S., Klempner, M.S., Weber, P.C., Schaefer, E.J., Wolff, S.M. and Dinarello, C.A. 1989. The effect of dietary supplementation with n-3 polyunsaturated fatty acids on the synthesis of interleukin-1 and tumor necrosis factor by mononuclear cells. New England Journal of Medicine. 320(5):265-271. Endres, S., Eisenhut, T., Sinha, B. 1993. n-3 fatty acid and cytokines. In De Caterina, R., Endres, S., Kristensen, S.D., Schmidt, E.B. (eds.). N-3 Fatty Acids and Vascular Disease. Springer-Verlag, Berlin-Heidelberg, pp. 31-3 8. Enig, M.G., Atal, S., Keeney, M and Sampugna, J. 1990. Isomeric trans fatty acids in the U.S. diet. Journal of the American College of Nutrition. 9: 471-486. Erickson, K.L. 1986. Dietary fat modulation of immune response. International Journal of Immunopharmacology. 8: 529-543. European Society of Paediatric Gastroenterology and Nutrition. 1991. Committee on Nutrition: Comment on the content and composition of lipids in infant formulas. Acta Paediatrica. 297-301. FAO. 1980a. Las grasas y aceites en la nutrición humana. Informe de una consulta de expertos (21-30 de septiembre de 1977), (versión revisada). FAO, Roma. FAO. 1980b. Hojas de balances de alimentos 1975-77. FAO, Roma. FAO. 1990. Consumo de alimentos y estado nutritivo en Viet Nam. Serie de Informes de Consultas sobre Nutrición. No. 82. Roma. FAO. FAO. 1993a. Agrostat MainFrame, World Bank. Socio-economic Indicators. WSI. FAO. 1993b. Agrostat PC, Computerized information series. Food balance sheets. FAO/OMS. 1978. Las grasas y aceites en la nutrición humana. Informe de una consulta de expertos (21-30 de septiembre de 1977). FAO, Roma. FAO/OMS. 1992. Nutrición y desarrollo: una evaluación mundial. FAO, Roma. Farquharson, J., Cockburn, F., Patrick, A.W., Jamieson, E., Logan, R.W. 1992. Infant cerebral cortex phospholipid fatty-acid composition and diet. The Lancet 340(8823): 810-813. Ferro-Luzzi, A., Strazzullo, P., Scaccini, C., Siani, A., Sette, S., Mariani, M.A., Mastranzo, P., Dougherty, R.M., Iacono, J.M. and Mancini, M. 1984. Changing the Mediterranean diet: effects on blood lipids. American Journal of Clinical Nutrition. 40(5): 1027-1037. Fischer, S.M., Leyton, J., Lee, M.L., Locniskar, M., Belury, M.A. Maldve, R.E., Slaga, T.J. and Bechtel, D.H. 1992. Differential effects of dietary linoleic acid on mouse skin-tumor promotion and mammary carcinogenesis. Cancer Research. 52(7 Suppl.): 2049s-2054s. Fisher, R.I., Bostick-Bruton, F. 1982. Depressed T-cell proliferative responses in Hodgkin's disease: role of monocyte-mediated suppression via prostaglandins and hydrogen peroxide. Journal of Immunology. 129(4): 1770-1774. Fisher, S. 1989. Dietary poorly unsaturated fatty acids and eicosanoid formation in humans. Advances in Lipid Research. 23: 169-198. Flatt.J.P. 1987. Dietary fat, carbohydrate balance and weight maintenance: effects of exercise. American Journal of Clinical Nutrition. 45: 296-306. Flatt, J.P. 1988. Importance of nutrient balance in body weight regulation. Diabetes/Metab. Rev. 4:571-581. Formo, M.W., Jungermann, E., Norris, F.A., Sonntag, N.O. 1979. Chapter 1, Bailey's Industrial Oil and Fat Products. Volume 1, Fourth Edition. Edited by Daniel Swem. New York: John Wiley and Sons, pp. 1-98. Frei, B., England, L. and Ames, B.N. 1989. Ascorbate is an outstanding antioxidant in human blood plasma. Proceedings of the National Academy of Sciences USA. 86: 6377-6381. Fremdstoff-Kommission Deutsche Forschungsgemeinschaft. 1973. Bad Godesberg 1967, Bonn-Bad Godesberg. Freudenheim, J.L. and Marshall, J.R. 1988. The problem of profound mismeasurement and the power of epidemiologic studies of diet and cancer. Nutrition and Cancer 11: 243-250. Frisen, R.E. 1977. In Vigersky, R. (ed.) Anorexia Nervosa. Raven Press N.Y. Frisch, R.E., Wyshak, G., Albright, N.L., Albright, T.E., Schiff, I. and Witschi, J. 1992. Former athletes have a lower lifetime occurrence of breast cancer and cancer of the reproductive system. In Jacobs, M.M. (ed.) Exercise, calories, fat and cancer. Advances in Experimental Medicine and Biology. 322, 29-39. New York, Plenum Press. Fujikawa, M., Yamashita, N., Yamazaki, K., Sugiyama, E., Suzuki, H. and Hamazaki, T. 1992. Eicosapentaenoic acid inhibits antigen-presenting cell function of murine splenocytes. Immunology. 75: (2) 330-5. Galli, C. and Socini, A. 1983. Dietary lipids in pre- and post-natal development. In Perkins, E.G. and Visek, W.J. (eds.) Dietary Fats and Health. Proceedings of American Oil Chemists Society Conference. Chicago, USA. 16: 278-301. Galli, C. Agradi, E. and Paoletti, R. 1974. The n-6 pentaene/n-3 hexaene fatty acid ratio as an index of linolenic acid deficiency. Biochimica et Biophysica Acta. 369: 142145. Garcia-Palmieri, M.R., Sorlie, P., Tillotson, J., Costas Jr., R., Cordero, E. and Rodriguez, M. 1980. Relationship of dietary intake to subsequent coronary heart disease incidence: the Puerto Rico Heart Health Program. American Journal of Clinical Nutrition. 33(8): 1818-1827. Garn, S.M., LaVelle, M., Rosenberg, K.R. and Hawthorne, V.M. 1986. Maturational timing as a factor in female fatness and obesity, American Journal of Clinical Nutrition 43:879-883. Garrison, R.J. and Kannel, W.B. 1993. A new approach for estimating healthy body weights. Int. J. Obes. Relat. Metab. Disord., 17:417-423. Gemeinschaftsarbeiten der DGF (German Society for Fat Research), 117. 1990. Mitteilung. Fat-Science Technology. 92: 459-462. Gemeinschaftsarbeiten der DGF (German Society for Fat Research), 125. 1992. Mitteilung. Fat-Science Technology. 94: 1-8. Gertz, C. 1988. Untersuchung und lebensmittelrechtliche Beurteilung von raffinierten und nicht raffinierten pflanzlichen Speiseölen und Fetten. Fat-Science Technology. 90: 45-50. Gey, K.F., Puska, P., Jordan, P. and Moser, U.K. 1991. Inverse correlation between plasma vitamin E and Mortality from ischemic heart disease in cross-cultural epidemiology. American Journal of Clinical Nutrition. 53: 326s-334s. Goodman, M.G., Weigle, W.O. 1980. Modulation of lymphocyte activation I. Inhibition by an oxidation product of arachidonic acid. Journal of Immunology. 125: 593-600. Goodwin, J.S., Messner, R.P., Peake, G.T. 1974. Prostaglandin suppression of mitogen stimulated leukocytes in culture. Journal of Clinical Investigation. 4: 368-378. Goodwin, P.J. and Boyd, N.F. 1987. Critical appraisal of the evidence that dietary fat is related to breast cancer risk in humans. Journal of the National Cancer Institute. 79: 473-485. Gordon, D., Bray, M., Morley, J. 1976. Control of lymphokine secretion by prostaglandins. Nature. 262: 401-402. Gordon, D.J. and Rifkind, B.M. 1989. High-density lipoprotein - the clinical implications of recent studies. New England Journal of Medicine. 321: 1311-1316. Gordon, D.J., Probstfield, J.L., Garrison, R.J., Neaton, J.D., Castelli, W.P., Knoke, J.D., Jacobs, D.R. Jr., Bangdiwala, S. and Tyroler, H.A. 1989. High-density lipoprotein cholesterol and cardiovascular disease. Four prospective American studies. Circulation. 79(1): 8-15. Gori, G.B. 1978. Diet and nutrition in cancer causation. Nutrition and Cancer. 1: 5-8. Gottenbos, J.J. 1983. Biological effects of trans fatty acids. In Dietary fats and health. AOCS, Champaign, Illinois (Perkins, E.G., Visek, W.J. eds.) pp 375-390. Gould, M.N., Haag, J.D., Kennan, W.S., Tanner, M.A. and Elson, C.E. 1991. A comparison of tocopherol and tocotrienol for the chemoprevention of chemically induced rat mammary tumours. American Journal of Clinical Nutrition. 53: 1068s1070s. Grandgirard, A., Sebedio, J.L., Fleury, J. 1984. Geometrical isomerisation of linolenic acid during heat treatment of vegetable oils. Journal of American Oil Chemists' Society. 61: 1563-1568. Grandgirard, A. and Julliard, F. 1987. Influence de divers paramètres sur la degradation d'huiles végétales au cours du chauffage (Influence of different parameters on vegetable oils degradation during heating). Revue Française des Corps Gras. 34: 213-219. Gridley, G., Mclaughlin, J.K., Block, G., Blot, W.J., Gluch, M., Fraumini, J.F. Jr. 1992. Vitamin supplement use and reduced risk of oral and pharyngeal cancer. American Journal of Epidemiology. 135: 1083-1092. Gruchow, H.W., Sobocinski, K.A. and Barboriak, J.J. 1985. Alcohol, nutrient intake and hypertension in U.S. adults. Journal of the American Medical Association. 253: 1567-1570. Grundy, S.M. and Mok, H.Y.I. 1977. Determination of cholesterol absorption in man. Journal of Lipid Research. 18:263-268. Gualde, N., Mexmain, S., Aldigier, J.C., Goodwin, J.S., Rigaud, M.I.T-D., Acrastes de Paulet, H., Paoleti, R. (eds.) 1984. Effect of eicosatetraenoic acids on lymphocyte proliferation in vitro, In Eicosanoids and Cancer. Raven Press. New York: 155-168. Gurr, M.I. 1983. Trans fatty acids: Metabolic and nutritional significance. Bulletin of the International Dairy Federation. Document 166: 5-18. Gurr, M.I. 1990. Trans fatty acids and health - an update. Lipid Technology 2: 105-107. Hack, M., Breslau, N., Weisman, B., Aram, D., Klein, N. and Borawski, E. 1991. Effect of very low birthweight and subnormal head size on cognitive abilities at school age. New England Journal of Medicine. 325: 231-237. Hagberg, B., Hagberg, G. and Zetterstrom, R. 1989. Decreasing perinatal mortality increase in cerebral palsy morbidity. Acta Paediatrica Scandinavica. 78: 664 - 670. Halfon, S.T., Rifkind, B.M., Harlap, S., Kaufmann, N.A., Baras, M., Slater, P.E., Halperin, G., Eisenberg, S., Davies, A.M. and Stein, Y. 1982. Plasma lipids and lipoproteins in adult Jews of different origins: The Jerusalem Lipid Research Clinic prevalence study. Israel Journal of Medical Science 18(11): 1113-1120. Hallag, H., Smith, T.W. & Leaf, A. 1992. Modulation of dihydropyridine-sensitive calcium channels in heart cells by fish oil fatty acids. Proceedings of the National Academy of Sciences (USA) 89: 1760-1764. Hallag, H., Sellmayer, A., Smith, T.W. and Leaf, A. 1990. Protective effect of eicosapentaenoic acid on ouabain toxicity in neonatal rat cardiomyocytes. Proceedings of the National Academy of Sciences. (USA) 87: 7834-7838. Hamm, P., Shekelle, R.B. and Stamler, J. 1989. Large fluctuations in body weight during young adulthood and twenty-five-year risk of coronary death in men. American Journal of Epidemiology 129:312-318. Hansen, A.E., Wiese, H.F., Boelsche, A.N., Haggard, M.E., Adam, D.J.D., and Davies, H. 1963. Role of linoleic acid in infant nutrition. Clinical and chemical study of 428 infants fed on milk mixtures varying in kind and amount of fat. Pediatrics. 31: 171192. Hansen, H.S. and Jensen, B. 1985. Essential function of linoleic acid esterified in acylglucosylceramide and acylceramide in maintaining the epidermal water permeability barrier. Biochimica et Biophysica Acta. 834: 357 Harlan, W.R., Hull, A.L., Schmouder, R.L., Landis, J.R,, Thompson, F.E. and Larkin, F.A. 1984. Blood pressure and nutrition in adults. American Journal of Epidemiology 120: 17-28. Hassan, N. and Ahmad, K.U. 1992. Studies on food and nutrient intake by urban population of Bangladesh: comparison between intakes of 1962-64 and 198586. Ecology of Food and Nutrition 28:131-148. Hayes, K.C., Pronczuk, A., Lindsey, S. and Diersen-Schade, D. 1991. Dietary saturated fatty acids (12:0, 14:0, 16:0) differ in their impact on plasma cholesterol and lipoprotein in nonhuman primates. American Journal of Clinical Nutrition 53: 491-498. Hebert, J.R. and Kabat, C.C. 1991. Distribution of smoking and its association with lung cancer: Implications for studies in the association of fat and cancer. Journal of the National Cancer Institute 83: 872-874. Hegsted, D.M. and Nicolosi, R.J. 1990. Do formula diets attenuate the serum cholesterol response to dietary fats? Journal of Vascular and Medical Biology. 1: 68-73. Hegsted, D.M. 1986. Serum-cholesterol response to dietary cholesterol: a reevaluation. American Journal of Clinical Nutrition. 44: 299-305. Hegsted, D.M., Ausman, L.M., Johnson, J.A. and Dallal, G.E. 1993. Dietary fat and serum lipids: an evaluation of the experimental data. American Journal of Clinical Nutrition. 57: 875-883. Hegsted, D.M. 1989. Errors of measurement. Nutrition and Cancer. 12: 105-107. Hegsted, D.M., McGandy, R.B., Myers, M.L. and Stare, F.J. 1965. Quantitative effects of dietary fat on serum cholesterol in man. American Journal of Clinical Nutrition. 17: 281-295. Heinemann, T., Leiss, O. and von Bergmann, K. 1986. Effect of low dose sitostanol on serum cholesterol in patients with hypercholesterolemia. Atherosclerosis 61: 219225. Heinemann, T., Kullak-UbIick, G.-A., Pietruck, B. and von Bergmann, K. 1991. Mechanisms of action of plant sterols on the inhibition of cholesterol absorption. Comparison of sitosterol and sitostanol. European Journal of Clinical Pharmacology. 40: 59s-63s. Henderson, M.M., Kushi, L.H., Thompson. D.J., Gorbach, S.L., Clifford, C.K., Insull, W. Jr, Moskowitz, M. and Thompson, R.S. 1990. Feasibility of a randomized trial of a low-fat diet for the prevention of breast cancer: Dietary compliance in the Women's Health Trial Vanguard Study. Preventive Medicine. 19(2): 115-133. Herbert, K.E., Wills, E.D. 1987. Platelet function and tissue lipid peroxidation in rats fed polyunsaturated fatty acids. Biochemical Society Transactions. 15: 410-411. Hinds, A. and Sanders, T.A.B. 1993. The effect of increasing levels of dietary fish oil rich in eicosapentaenoic and docosahexaenoic acids on lymphocyte phospholipid fatty acid composition and cell-mediated immunity in the mouse. British Journal of Nutrition. 69: 423-429. Hirayama, T. 1979. Diet and cancer. Nutrition and Cancer. 1: 67-81. Holman, R.T. and Johnson, S.B. 1981. Changes in essential fatty acid profile of serum phospholipids in human disease. Progress in Lipid Research. 20: 67-73. Holman, R.T. 1970. Biochemical activities of and requirements for polyunsaturated fatty acids. Progress in Chemical Fats and Lipids. 9: 607-87. Holman, R.T., Johnson, S.B. and Ogburn, P.L. 1991. Deficiency of essential fatty acids and membrane fluidity during pregnancy and lactation. Proceedings of the National Academy of Sciences (U.S.A.) 88: 4835-4839. Hopkins, P.N. 1992. Effects of dietary cholesterol on serum cholesterol: a metaanalysis and review. American Journal of Clinical Nutrition. 55: 1060-1070. Houwelingen, R.V., Nordoy, A., van der Beek, E., Houtsmuller, U., de Metz, M. and Hornstra, G. 1987. Effect of a moderate fish intake on blood pressure, bleeding time, hematology, and clinical chemistry in healthy males. American Journal of Clinical Nutrition. 46: 424-436. Howe, G.R., Friedenreich, C.M., Jain, M. and Miller, A.B. 1991. A cohort study of fat intake and risk of breast cancer. Journal of the National Cancer Institute. 83(5):336340. Howe, G.R., Hirohata, T., Hislop, T.G., Iscovich, J.M., Yuan, J.M., Katsouyanni, K., Lubin, F., Marubini, E., Modan, B., Rohan, T., Toniolo, P. and Yu, S. 1990. Dietary factors and risk of breast cancer: Combined analysis of 12 case-control studies. Journal of the National Cancer Institute 82(7):561-569. Hu, M-L., Frankel, E.N., Leibovitz, B.E., Tappel, A.L. 1989. Effect of dietary lipids and vitamin E on in vitro lipid peroxidation in rat liver and kidney homonogenates. Journal of Nutrition. 119: 1574-1582. Hubbard, N.E., Somers, S.D., Erickson, K.L. 1991. Effect of dietary fish oil on development and selected functions of murine inflammatory macrophages. Journal of Leukocyte Biology. 49(6): 592-598. Hudgins, L.C., Hirsch, J. and Emken, E.A. 1991. Correlation of isomeric fatty acids in human adipose tissue with clinical risk factors for cardiovascular disease. American Journal of Clinical Nutrition. 53: 474-482. Hulshof, K.F., Löwik, M.R.H., Kok, F.J., Wdel, M., Brants, H.A.M., Hermus, R.J.J. and ten Hoor, F. 1991. Diet and other life-style factors in high and low socio-economic groups (Dutch Nutrition Surveillance System). European Journal of Clinical Nutrition. 45(9):441-450. Hunninghake, D.B., Stein, E.A., Dujovne, C.A., Harris, W.S., Feldman, E.B., Miller, V.T. Tobert, J.A., Laskarzewski, P.M., Quiter, E., Held, J., Taylor, A.M., Hopper, S., Leonard S.B. and Brewer, B.K. 1993. The efficacy of intensive dietary therapy alone or combined with lovastatin in outpatients with hypercholesterolemia. New England Journal of Medicine 328(17): 1213-1219. Hunter, J.E. and Applewhite, T.H. 1991. Reassessment of trans fatty acid availability in the U.S. diet. American Journal of Clinical Nutrition. 54: 363-369. Hunter, J.E. 1992. Safety and health effects of isomeric fatty acids. In: Chow, C.K., (ed.) Fatty acids in foods and their health implications. Marcel Dekker, Inc., New York, N.Y. pp. 857-867. Hunter, D.J., Manson, J.E., Colditz, G.A., Stampfer, M.J., Rosner, B., Hennekens, C.H., Speizer, F.E. and Willett, W.C. 1993. A prospective study of the intake of vitamins C, E and A and the risk of breast cancer. New England Journal of Medicine. 329(4): 234-240. Hunter, J.E. and Applewhite, T.H. 1986. Isomeric fatty acids in the U.S. diet: levels and health perspectives. American Journal of Clinical Nutrition. 44: 707-717. Iacono, J.M. and Dougherty, R.M. 1993. Effects of polyunsaturated fats on blood pressure. Annual Reviews of Nutrition. 13: 243-260. IBGE (Institute Brasileiro de Geografia e Estadística). 1978. Brazil, Data base on "Estudo Nacional da Despesa Familiar" (ENDEF). Ikeda, I. and Sugano M. 1983. Some aspects of mechanism of inhibition of cholesterol absorption by -sitosterol. Biochimica et Biophysica Acta. 732: 651-658. Ip, C. 1987. Fat and essential fatty acids in mammary carcinogenesis. American Journal of Clinical Nutrition. 45: (Suppl): 218s-224s. Iso, H., Jacobs Jr., D.J., Wentworth, D. and Neaton, J.D. 1989. Serun cholesterol levels and six-year mortality from stroke in 350,977 menscreened for the multiple risk factor intervention trial. New England Journal of Medicine. 320: 904-910. Itoh, T., Tamura, T., Matsumoto, T. 1973a. Sterol composition of 19 vegetable oils. Journal of American Oil Chemists' Society. 50: 122-125. Itoh, T.H., Tamura, T., Matsumoto, T. 1973b. Methylsterol compositions of 19 vegetable oils. Journal of American Oil Chemists' Society. 50: 300-303. Jacobs, D.R., Blackburn, H.M., Reed, D., Iso, H., McMillan, G., Neaton, J., Rifkind, B., Rossouw, J. and Shekelle, R. 1992. Report of the conference on low blood pressure: mortality associations. Circulation. 86: 1046-1060. Jacobs, D.R., Anderson, J.T. and Blackburn, H.M. 1979. Diet and serum cholesterol: Do zero correlations negate the relationship? American Journal of Epidemiology. 110: 77-87. Jager, F.C. 1975. Linoleic acid intake and vitamin E requirement. In The role of fats in human nutrition (ed. Vergroesen, A.J.) pp 381-425, Academic Press, London. Jandacek, R.J. 1991. Developing a fat substitute. Chemical Technology. 21(7): 398402. Jawad, I.M., Kochhar, S.P., Hudson, B.J.F. 1983a. Quality characteristics of physically refined soyabean oil. Journal of Food Technology. 18: 353-360. Jawad, I.M., Kochhar, S.P., Hudson, B.J.F. 1983b. The physical refining of edible oils: 1. Effect on component fatty acids and on triglycerides. Lebens. Wiss Technol. 17: 289-293. Jawad, I.M., Kochhar, S.P., Hudson, B.J.F. 1984. The physical refining of edible oils 2. Effect on unsaponifiable components. Lebens. Wiss Technol. 17: 155-159. Jialal, I. and Grundy, S.M. 1992. Effect of dietary supplementation with alphatocopherol on the oxidative modification of low density lipoprotein. Journal of Lipid Research. 33: 899-906. Jialal, I., Vega, G.L. and Grundy, S.M. 1990. Physiologic levels of ascorbate inhibit the oxidative modification of low density lipoprotein. Atherosclerosis 82: 185-191. Joffres, M.R., Reed, D.M. and Yano, K. 1987. Relationship of magnesium intake and other dietary factors to blood pressure: the Honolulu Heart Study. American Journal of Clinical Nutrition. 45: 469-475. Johansson, A. and Hoffmann, I. 1979. The effect of processing on the content and composition of free sterols and sterol esters in soyabean oil. Journal of American Oil Chemists' Society. 56: 886-889. Johnson, D.V. and Marshall, L.A. 1984. Dietary fat, prostaglandins and the immune response. Progress in Food and Nutrition Science. 8: 3-25. Johnston, F.E. and Mack, R.W. 1978. Obesity in urban black adolescents of high and low relative weight at 1 year of age. American Journal of Diseases of Children 123:862864. Judd, J.T., Clevidence, B.A., Muesing, R.A., Wittes, J., Sunkin, M.E. and Podczasy, J.J. 1994. Dietary trans fatty acids: effects on plasma lip ids and lipoproteins of healthy adult men and women. American Journal of Clinical Nutrition. 59: 861-868. Jung, M.Y. Yoon, S.H., Min, D.B. 1989. Effects of processing steps on the contents of minor components and oxidation of soybean oil. Journal of American Oil Chemists' Society. 66: 118-120. Jurgens, G.H., Hoff, H., Chisolm, G. and Esterbauer, H. 1987. Modification of human serum LDL by oxidation: characterization and pathophysiological implications. Chemistry and Physics of Lipids 45: 315-336. Kagan, A., Popper, J.S. and Rhoads, G.G. 1980. Factors related to stroke incidence in Hawaii Japanese men: The Honolulu Heart Study. Stroke 11: 14-21. Kagan, A., Marmot, M.G. and Kato, H. 1980. The ni-hon-san study of cardiovascular disease epidemiology. In Kesteloot, H., Joosens, J.V. and Martinus, N. (eds.) Epidemiology of Arterial Blood Pressure. The Hague: pp. 423-436. Katan, M.B., Zock, P.L. and Mensink, R.P. 1993. Efectos de los ácidos grasos individuales sobre el colesterol sérico total y el de las lipoproteínas (datos procedentes de varias fuentes) Grasas y lipoproteínas sricas. Borrador para la consulta. Katan, M.B. and Beynen, A.C. 1987. Characteristics of human hypo- and hyperresponders to dietary cholesterol. American Journal of Epidemiology 125: 387399. Katan, M.B., Berns, M.A., Glatz, J.F., Knuiman, J.T., Nobels, A. and de Vries, J.H. 1988. Congruence of individual responsiveness to dietary cholesterol and to saturated fat in humans. Journal of Lipid Research 29(7): 883-892. Kato, H., Tillotson, J., Nichaman, M.Z., Rhoads, G.G. and Hamilton, H.B. 1973. Epidemiologic studies of coronary heart disease and stroke in Japanese men living in Japan, Hawaii and California: Serum lip ids and diet. American Journal of Epidemiology 97(6): 372-385. Kay, R.M., Sabry, Z.I. and Csima, A. 1980. Multivariate analysis of diet and serum lipids in normal men. American Journal of Clinical Nutrition. 33: 2566-2572. Kendall, A., Levitsky, D.A., Strupp, B.J. and Lissner, L. 1991. Weight loss on a lowfat diet: consequences of the imprecision of the control of food intake in humans. American Journal of Clinical Nutrition. 53: 1124-1129. Kestin, M., Clifton, P., Belling, G.B. and Nestel, P.J. 1990. n-3 Fatty acids of marine origin lower systolic blood pressure and triglycerides but raise LDL cholesterol compared with n-3 and n-6 fatty acids from plants. American Journal of Clinical Nutrition. 51: 1028-1034. Keys, A., Anderson, J.T. and Grande, F. 1957. Prediction of serum-cholesterol response of man to changes in fats in the diet. The Lancet. 2: 959-966. Keys, A., Menotti, A., Karvonen, M.J., Aravanis, C., Blackburn, H. Buzina, R. Djordjevic, B.S., Dontas, A.S., Fidanza, F., Keys, M.H., Kromhout, D., Nedeljkovic, S., Punsar, S., Seccareccia, F. and Toshima, H. 1986. The diet and 15-year death rate in seven countries study. American Journal of Epidemiology 124(6): 903-915. Keys, A., Anderson, J.T. and Grande, F. 1965. Serum cholesterol response to changes in the diet. IV. Particular saturated fatty acids in the diet. Metabolism. 14: 776787. Keys, A. 1970. Coronary heart disease in seven countries. Circulation. 41:1-211 (Suppl. 1) Keys, A., Anderson, J.T. and Grande, F. 1959. Serum cholesterol in man: Diet, fat and intrinsic responsiveness. Circulation. 19: 201-214. Khaw, K.T. and Barrett-Conner, E. 1984. Dietary potassium and blood pressure in a population. American Journal of Clinical Nutrition. 39: 963-968. Khosla, P. and Hayes, K.C. 1993. Dietary palmitic acid raises plasma LDL and cholesterol relative to oleic acid only at a high intake of cholesterol. Biochimica et Biophysica Acta. 1210: 13-22. Khoury, P., Morrison, J.A., Mellies, M.J. and Glueck, C.J. 1983. Weight change since age 18 years in 30 to 55 year-old whites and blacks. Journal of the American Medical Association 250:3179-3187. Kinsella, J.E., Bruckner, G., Mai, J. and Shimp, J. 1981. Metabolism of trans fatty acids with emphasis on the effects of trans, trans-octadecadienoate on lipid composition, essential fatty acid and prostaglandins: an overview. American Journal of Clinical Nutrition. 34: 2307-2318. Kinsella, J.E. 1990. Possible mechanisms underlying the effects of n-3 polyunsaturated fatty acids. Omega-3 News, V, 1-5. Knapp, H.R. and Fitzgerald, G. 1989. The antihypertensive effects of fish oil: A controlled study of polyunsaturated fatty acid supplements in essential hypertension. New England Journal of Medicine. 320: 1037-1043. Knekt, P., Aromaa, A. Maatela, J., Aaron, R.K., Nikkari, T., Hakama, M., Hakulinen T. Peto, R., Saxen, E. and Teppo, L. 1988. Serum Vitamin E and risk of cancer among Finnish men during a 10 year follow-up. American Journal of Epidemiolgy. 127: 28-41. Knuiman, J.T., West, C.E., Katan, M.B. and Hautvast, J.G.A.J. 1987. Total cholesterol and high density lipoprotein cholesterol levels in populations differing in fat and carbohydrate intake. Arteriosclerosis. 1: 612-619. Koletzko, B. 1992. Trans fatty acids may impair biosynthesis of long-chain polyunsaturates and growth in man. Acta Paediatrica. 81: 302-306. Koletzko, B., Schmidt, E., Bremer, H.J., Haug, M. and Harzer, G. 1989. Effects of dietary long-chain polyunsaturated fatty acids on the essential fatty acid status of premature infants. European Journal of Pediatrics. 148(7): 669-675. Koletzko, B. 1991. Zufuhr, Stoffwechsel und biologische Wirkungen trans-isomerer Fettsäuren bei Säuglingen (Intake, metabolism and biological effects of trans-isomeric fatty acids on infants). Die Nahrung. 35: 229-283. Koletzko, B., Thiel, I:, Abiodun, P.O. 1992. The fatty acid composition of human milk in Europe and Africa. The Journal of Pediatrics. 120(4):S62-S70. Kolonel, L.N., Hankin, J.H., Lee, J., Chu, S.Y., Nomura, A.M. and Hinds, M.W. 1982. Nutrient intakes in relation to cancer incidence in Hawaii. British Journal of Cancer. 44(3): 332-339. Komachi, Y., Iida, M., Shimamoto, T., Chikayama, Y., Takahashi, H.,Konishi, M. and Tominaga, S. 1976. Geographic and occupational comparisons of risk factors in cardiovascular diseases in Japan. Japanese Circulation Journal. 55: 189-207. Koritala, S. and Dutton, H.J. 1973; Deuteration of methyl cis 9, cis 15 octadecadienoate with nickel catalyst. Journal of American Oil Chemists' Society. 50: 307-309. Kramer, T.R., Schoene, N., Douglass, L.W., Judd, J.T., Ballard-Barbash, R. Taylor, P.R., Bhagavan, H.N. and Nair, P.P. 1991. Increased vitamin E intake restores fishoil-induced suppressed blastogenesis of mitogen-stimulated T lymphocytes. American Journal of Clinical Nutrition. 54(5): 896-902. Kremer, J.M., Lawrence, D.A., Jubiz, W., DiGiacomo, R., Rynes, R., Bartholomew, L.E. and Sherman, M. 1990. Dietary fish oil and olive oil supplementation in patients with rheumatoid arthritis: Clinical and immunologic effects. Arthritis and Rheumatism. 33(6): 810-820. Kremer, J.M., Jubiz, W., Michalek, A., Rynes, R.I., Bartholomew, L.E., Bigaouette, J., Timchalk, M., Beeler, D. Lininger, L. 1987. Fish oil fatty acid supplementation in active rheumatoid arthritis. A double-blinded, controlled, crossover study. Annals of Internal Medicine. 106(4): 497-503. Kurihara, M. and Aoki, K. 1984. Cancer mortality statistics of the world. University of Nagoya Press, Nagoya, Japan. Laine, D.C., Snodgrass, C.M., Dawson, E.A., Ener, M.A., Kuba, K. and Frantz, I.D. 1982. Lightly hydrogenated soy oil versus other vegetable oils as a lipid-lowering dietary constituent. American Journal of Clinical Nutrition. 35: 683-690. Lamptey, M.S. and Walker, B.L. 1976. A possible essential role for dietary linolenic acid in the development of the young rat. Journal of Nutrition. 10:86-89. Lands, W.E.M., Inoue, M., Segiura, Y. and Okuyama, H. 1982. Selective incorporation of polyunsaturated fatty acids into phosphatidylcholine by rat liver microsomes. Journal of Biological Chemistry. 237: 14968-72. Lapidus, L., Bengtsson, C., Larsson, B., Pennert, K., Rybo, E. and Sjostrom, L. 1984. Distribution of adipose tissue and risk of cardiovascular disease and death: a 12 year follow-up of participants in the population study of women in Gothenburg, Sweden. British Medical Journal 289:1257-1261. Larsson, B., Svardsudd, K., Welin, L., Wilhelmsen, L., Bjorntorp, P. and Tibblin, G. 1984. Abdominal adipose tissue distribution, obesity, and risk of cardiovascular disease and death: 13 year follow-up of participants in the study of men born in 1913. British Medical Journal 288:1401-1404. Larsson, B.K., Eriksson, A.T., Cervenka, M. 1987. Polycyclic aromatic hydrocarbons in crude and deodorized vegetable oils. Journal of American Oil Chemists' Society. 365-370. Leaf, A.A., Leighfield, M.J., Casteloe, K.L. and Crawford, M.A. 1992. Factors affecting long-chain polyunsaturated fatty acid composition of plasma choline phosphoglycerides in preterm infants. Journal of Pediatric Gastroenterology and Nutrition. 14: 300-308. Leaf, A. and Weber, P.C. 1988. Cardiovascular effects of n-3 fatty acids. New England Journal of Medicine 318: 549-557. Leatherhead Food Research Association. 1992. The role of tocopherols in inhibiting oxidation and rancidity in oils. Surrey, UK. Lee, T.H., Hoover, R.L., Williams, J.D., Sperling, R.I., Ravalese, J. 3d, Spur, B.W., Robinson, D.R., Corey, E.J., Lewis, R.A. and Austen, K.F. 1985. Effect of dietary enrichment with eicosapentaenoic and docosahexaenoic acids on in vitro neutrophil and monocyte leukotriene generation and neutrophil function. New England Journal of Medicine. 312(19): 1217-1224. Lee-Han, H., Cousins, M., Beaton, M., McGuiro, V., Kriukov, V. Chipman, M. and Boyd, N. 1988. Compliance in a randomized clinical trial of dietary fat reduction in patients with breast dysplasia. American Journal of Clinical Nutrition. 48(3):575-586. Lees, A.M., Mok, H.Y., Lees, R.S., McCluskey, M.A. and Grundy, S.M. 1977. Plant sterols as cholesterol-lowering agents: Clinical trials in patients with hypercholesterolemia and studies of sterol balance. Atherosclerosis. 28(3): 325-338. Leibel, R.L., Hirsch, J., Appel, B.E. and Checani, G.C. 1992. Energy intake required to maintain body weight is not affected by wide variation in diet composition. American Journal of Clinical Nutrition. 55: 350-355. LeMarchand, L., Yoshizawa, C.N., Kolonel, L.H. and Goodman, M.T. 1989. Vegetable consumption and lung cancer risk: a population-based case-control study in Hawaii. Journal of the National Cancer Institute. 81: 1158-1164. Levy, R.I., Rifkind, B.M., Dennis, B.H. and Ernst, N.D. eds. 1979. Nutrition, Lipids and Coronary Heart Disease: A Global View. Raven Press, New York. Lewis, B., Chait, A., Sigurdsson, G.,1978. Serum lipoproteins in four European communities: A quantitative comparison. European Journal of Clinical Investigation 8(3):165-173. Leyton, J., Drury, P.J. and Crawford, M.A. 1987. Differential Oxidation of saturated and unsaturated fatty acids in vivo in the rat. British Journal of Nutrition. 57: 383-393. Lichtenstein, A.H., Ausman, L.M., Carrasco, W., Jenner, J.L., Ordovas, J.M. and Schaefer, E.J. 1993. Hydrogenation impairs the hypolipidemic effect of corn oil in humans. Arteriosclerosis and Thrombosis 13: 154-161. Lissner, L., Levitsky, D.A., Strupp, B.J., Kalkwarf, H.J. and Roe, D.A. 1987. Dietary fat and the regulation of energy intake in human subjects. American Journal of Clinical Nutrition. 46: 886-892. Lissner, L., Odell, P.M., D'Agostino, R.B., Stokes, J. 3rd, Kreger, B.E., Belanger, A.J. and Brownell, K.D. 1991. Variability of body weight and health outcomes in the Framingham population. New England Journal of Medicine 324: 1839-1844. Livingstone, M.B., Prentice, A.M., Strain, J.J., Coward, W.A., Black, A.E., Barker, M.E., McKenna, P.G. and Whitehead, R.G. 1990. Accuracy of weighed dietary records in studies of diet and health. British Medical Journal. 300(6726):708-712. Logan, R.L., Riemersma, R.A., Thomson, M., Oliver, M.F., Olsson, A.G., Walldius, G., Rossner, S., Kaijser, L., Callmer, E., Carlson, L.A., Lockerbie, L. and Lutz, W. 1978. Risk factors for ischaemic heart-disease in normal men aged 40: Edinburgh-Stockholm Study. The Lancet. 1(8071): 949-954. Lorenz, R., Spengler, U., Fischer, S., Duhm, J. and Weber, P. 1983. Platelet function, thromboxane formation and blood pressure control during supplementation of the western diet with cod-liver oil. Circulation. 67(3): 504-511. Lorenz, R., Weber, P.C., Szimnau, P., Heldwein, W., Strasser, T., Loeschke, K. 1989. Supplementation with n-3 fatty acids from fish oil in chronic inflammatory bowel disease: a randomized, placebo-controlled, couble-blind cross-over trial. Journal of Internal Medicine. 225 (suppl. 2): 223-232. Lucas, A., Morley, R., Cole, T.J., Lister, G. and Leeson-Payne. 1992. Breast milk and subsequent intelligence quotient in children born pre-term. The Lancet 339: 261264. Lynch, D.V. and Thompson, G.A. 1984. Re-tailored lip id molecular species: a tactical mechanism for modulating membrane properties. Trends in Biochemical Sciences. 9: 442-445. Makrides, M., Simmer, K,. Goggin, M. and Gibson, R.A. 1993. Erythrocyte docosahexaenoic acid correlates with visual response of healthy, term infants. Pediatric Research. 33(4 Pt I): 425-427. Manson, J.E., Stampfer, M.J., Hennekens, C.H., and Willett, W.C. 1987. Body weight and longevity. A reassessment. Journal of the American Medical Association 257:353-358. Marchand, C.M. 1982. Positional isomers of trans-octadecenoic acids in margarine. Canadian Institute of Food Science and Technology Journal. 15: 196-199. Margetts, B.M., Beilin, L.J., Vandongen, R. and Armstrong, B.K. 1986. Vegetarian diet in mild hypertension: A randomized controlled trial. British Medical Journal. 293: 1468-1471. Marshall, J.A., Hamman, R.F., Baxter, J. 1991. High-fat, low-carbohydrate diet and the etiology of non-insulin-dependent diabetes mellitus: the San Luis Valley Diabetes Study. American Journal of Epidemiology 134(6): 590-603. Martinez, M. 1988. Developmental profiles of polyunsaturated fatty acids in the brain of normal infants and patients with peroxisomal diseases: Severe deficiency of docosahexaenoic acid in Zeilweger's and pseudo-Zellweger's syndromes. World Review of Nutrition and Dietetics. 66: 87-102. Mattson, F.H., Hollenbach, E.J. and Kligman, A.M. 1975. Effect of hydrogenated fat on the plasma cholesterol and triglyceride levels of man. American Journal of Clinical Nutrition. 28: 726-731. McDonald, M.L., Mack, K.F., Williams, B.W., King, W.C. and Glomset, U.A. 1988. A membrane-bound diacylglycerol kinase that selectively phosphorylates arachidonoyldiacylglycerol. Journal of Biological Chemistry. 263: 1584-92. McDonald, B.E. Gerrard, J.M. Bruce, V.M. and Corner, E.J. 1989. Comparison of the effect of canola oil and sunflower oil on plasma lipids and lipoproteins on in vivo thromboxane A2 and prostacyclin production in healthy young men. American Journal of Clinical Nutrition, 50: 1382-1388. McDonald, G.B., Saunders, D.R., Weidman, M. and Fisher, L. 1980. Portal venous transport of long chain fatty acids absorbed from rat intestine. American Journal of Physiology. 239: G141-G150. McGandy, R.B., Hegsted, D.M. and Myers, M.L. 1970. Use of semi-synthetic fats in determining effects of specific fatty acids on serum lipids in man. American Journal of Clinical Nutrition. 23: 1288-1298. McGregor, L., Morazain, R. and Renaud, S. 1981. Platelet functions and fatty acid composition of platelet phospholipids in spontaneously hypertensive rats fed saturated or polyunsaturated fats. Atherosclerosis. 38: 129-136. McKeigue, P.M., Marmot, M.G., Syndercombe-Court, Y.D., Cottier, D.E., Rahman, S. and Riemersma, R.A. 1988. Diabetes, hyperinsulinaemia, and coronary risk factor in Bangladeshis. Br. Heart Journal. 60,5, 390-396. McMichael, A.J. 1991. Serum cholesterol and human cancer. In Alfin-Slater, R.B. and Kritchevsky, D. (eds.) Human Nutrition, vol.7. Nutrition and Cancer. Plenum Press, New York. pp. 141-158. McMichael, A.J. and Giles, G.C. 1988. Cancer in migrants to Australia: extending the descriptive epidemiologic data. Cancer Research. 46: 751-756. Melbin, T. and Vuille, J.C. 1976. Weight gain in infancy and physical development between 7 and 10 1/2 years of age. British Journal of Preventive Social Medicine 30:233-238. Mensink, R.P., Janssen, M.C. and Katan, M.B. 1988. Effect on blood pressure of two diets differing in total fat but not in saturated and polyunsaturated fatty acids in healthy volunteers. American Journal of Clinical Nutrition. 47: 976-980. Mensink, R.P., Zock, P.L., Katan, M.B. and Hornstra, G. 1992. Effect of dietary cisand trans-fatty acids on serum lipoprotein[a] levels in humans. Journal of Lipid Research. 33: 1493-1501. Mensink, R.P. and Katan, M.B. 1991. Letter to the editor. New England Journal of Medicine. 324: 339-340. Mensink, R.P. and Katan, M.B. 1990. Effect of dietary trans fatty acids on high-density and low-density lipoprotein cholesterol levels in healthy subjects. New England Journal of Medicine. 323: 439-445. Mensink, R.P. and Katan, M.B. 1992. Effects of dietary fatty acids on serum lipids and lipoproteins: A meta-analysis of 27 trials. Arteriosclerosis and Thrombosis. 12: 911919. Merrill, A.L. and Watt, B.K. 1955. Energy value of foods - basis and derivation. United States Department of Agriculture. Handbook No. 74 (revised 1973). Mertin, J. and Hughs, D. 1975. Specific inhibitory action of polyunsaturated fatty acids on lymphocyte transformation induced by PHA and PPD. International Archives of Allergy and Applied Immunology. 15: 203-210. Mertin, J. and Stackpoole, A. 1981. Prostaglandin precursors and cell-mediated immune response. Cellular Immunology. 62: 293-300. Mertin, J. and Hunt, R. 1976. Specific inhibitory action of polyunsaturated fatty acids on lymphocyte transformation induced by PHA and PPD. Proceedings of the National Academy of Sciences. USA. 73: 928-931. Mertin, J. and Meade, C.J. 1977, Relevance of fatty acids in multiple sclerosis. British Medical Bulletin. 33: 67-71. Mertz, W. 1992. Food intake measurements: Is there a "gold standard"? American Dietetic Association. Journal. 92: 1463-1465. Metzger, Z., Hoffeld, J.T., Oppenheim, J.J. 1980. Macrophage mediated suppression I. Evidence for participation of both hydrogen peroxide and prostaglandin in suppression of murine lymphocyte proliferation. Journal ofImmunology. 124: 983-988. Meydani, S.N., Barklund, M.P., Liu S., Meydani, M., Miller R., Cannon, J., Morrow, F., Rocklin, R. and Blumberg J. 1990. Effect of vitamin E supplementation on immune responsiveness of healthy elderly subjects. Federation of American Societies for Experimental Biology Journal. 3: A1057. Meydani, S.N. 1990. Dietary modulation of cytokine and biological functions. Nutrition Reviews 48:361-367. Meydani, S.N., Endres, S., Woods, M.N., Goldin, B.R., Soo, C., MorrillLabrode, A., Dinarello, C.A., and Gorbach, S.L. 1991a. Oral (n-3) fatty acid supplementation supresses cytokine production and lymphocyte proliferation: Comparison between young and older women. Journal of Nutrition. 121(4): 547-555. Meydani, S.N., Lichtenstein, A.H., Cornwall, S., Meydani, M., Goldin, B.R., Rasmussen, H., Dinarello, C.A. and Schaefer, E.J. 1993. Immunologic effects of national cholesterol education panel step-2 diets with and without fish-derived N-3 fatty acid enrichment. Journal of Clinical Investigation. 92(1): 105-113. Meydani, S.N., Lichtenstein, A.H., White, P.J., Goodnight, S.H., Elson, C.E., Woods, M., Gorbach, S.L. and Schaefer. 199 Ib. Food use and health effects of soybean and sunflower oils. American College of Nutrition Journal. 10(5): 406-428. Millar, J.H., Zilkha, K.J., Langman, M.J., Wright, H.P., Smith, A.D., Belin, J. and Thompson, R.H. 1973. Double-blind trial of linoleate supplementation of the diet in multiple sclerosis. British Medical Journal. 1(856): 765-768. Miller, W.C., Lindeman, A.K., Wallace, J. and Niederpruem, M. 1990. Diet composition, energy intake, and exercise in relation to body fat in men and women. Americal Journal of Clinical Nutrition 52:426-430. Mills, P.K., Beeson, W.L., Abbey, D.E., Fraser, G.E. and Philips, R.L. 1988. Dietary habits and past medical history as related to fatal pancreas cancer incidence among Seventh-Day Adventists. Cancer 61:2578-2585. Mills, P.K., Beeson, W.L., Phillips, R.L. and Fraser, G.E. 1989. Cohort study of diet, lifestyle, and prostate cancer in Adventist men. Cancer 64(3): 598-604. Mogenson, G.J. and Box, B.M. 1982. Physiological effects of varying dietary linoleic acid in spontaneously hypertensive rats. Annals of Nutrition and Metabolism. 26: 232239. Mohrhauer, H. and Holman, R.T. 1963. The effect of dose levels of essential fatty acids upon fatty acid composition of the rat liver. Journal of Lipid Research. 4: 151-9. Morris, J.N., Marr, J.W. and Clayton, D.G. 1977. Diet and heart: a postscript. British Medical Journal. 2: 1307-1314. Mossberg, H.O. 1989. 40-Year follow-up on overweight children. The Lancet 491-493. Muscoplat, C.C., Rakich, P.M., Thoen, C.O. 1978. Enhancement of lymphocyte blastogenic and delayed hypersensitivity skin responses by indomethacin. Infec. Immunol. 20: 627-631. Nalbone, G., Leonardi, J., Termine, E., Portugal, H., Lechene, P., Pauli, A.M. and Lafont, H. 1989. Effects of fish oil, corn oil and lard diets on lipid peroxidation status and glutathione peroxidase activities in rat heart. Lipids. 24(3): 179-186. National Council for Applied Economic Research. 1991. Market Information Survey of Households 1985-1990. New Delhi, India. National Diet-Heart Study Research Group. 1968. The National Diet-Heart Study Final Report. Circulation. 37(3 Suppl.): 11-428. National Research Council. 1982. Committee on Diet, Nutrition and Cancer. National Academy Press, Washington, D.C. National Research Council. 1989. Diet and Health: Implications for reducing chronic disease risk. National Academy Press, Washington, D.C. Nestel, P.J., Noakes, M., Belling, G.B., McArthur. R., Clifton, P., Janus, E. and Abbey, M. 1992. Plasma lipoprotein lipid and Lp[a] changes with substitution of elaidic acid for oleic acid in the diet. Journal of Lipid Research. 33: 1029-1036. Neuringer, M., Anderson, G.J. and Connor, W.E. 1988. The essentiality of n-3 fatty acids for the development and function of the retina and brain. Annual Reviews of Nutrition. 8: 517-541. Neuringer, M., Connor, W.E., van Petten, C. and Barstad, L. 1984. Dietary omega-3 fatty acid deficiency and visual loss in infant rhesus monkey. Journal of Clinical Investigation. 73: 272-276. Newmark, H.L. and Mergens, W.J. 1981. Alpha tocopherol (vitamin E) and its retationship to tumor induction and development, pp. 127-168. In M.S. Zedeck and M. Lipkin (eds). Inhibition of tumor induction and development. Plenum Press, New York. Ng, T.K.W., Hassan, K., Lim, J.B., Lye, M.S. and Ishak, R. 1991. Nonhypercholesterolemic effects of palm oil diet in Malaysian volunteers. American Journal of Clinical Nutrition. 53 (4 suppl.): 1015S-1020S. Nichaman, M.Z., Hamilton, H.B., Kagan, A., Grier, T., Sacks, T. and Syme, S.L. 1975. Epidemiologic studies of coronary heart disease and stroke in Japanese men living in Japan, Hawaii and California: distribution of biochemical risk factors. American Journal of Epidemiology. 102(6): 491-501. Nicolosi, R.J., Ausman, L.M. and Hegsted, D.M. 1991a. Rice bran oil lowers serum total and low density lipoprotein cholesterol and apo B levels in nonhuman primates. Atherosclerosis. 88: 133-142. Nicolosi, R.J. and Liang, S. 1991b. Comparative effects of rice bran oil, soybean oil and coconut oil on lipoprotein levels, low density lipoprotein oxidizability and fatty streak formation in hypercholesterolemic hamsters. Arteriosclerosis. 11: 1603. Nicolosi, R.J., Ausman, L.M. and Hegsted, D.M. 1990. Comparative cholesterol lowering effects of rice bran oil, cañóla oil and corn oil. Circulation. 82:7109. NIH Consensus conference. 1993. Triglyceride, high-density lipoprotein, and coronary heart disease. NIH Consensus Development Panel on Triglyceride. Journal of the American Medical Association. 269(4): 505-10 Noppa, H. and Hallstrom, T. 1981. Weight gain in adulthood in relation to socioeconomic factors, mental illness and personality traits: a prospective study of middle-aged women. Journal of Psychosomatic Research 25:83-89. Nova Scotia Department of Health. 1993. Report of the Nova Scotia Nutrition Survey. Halifax. O'Dea, K., White, N.G., Sinclair, A.J. 1988. An investigation of nutrition-related risk factors in an isolated Aboriginal community in northern Australia: advantages of a traditionally-oriented life-style. Med. J. Aust. 148(4): 177-80. Offner, H., Konat, G., Clausen, J. 1974. Effect of phytohemagglutinin, basic protein and measles antigen on myo-(2-3H)-inositol incorporation into phosphatidylinositol of lymphocytes from patients with multiple sclerosis. Acta Neurologica Scandinavica. 50: 791-800. Ohlrogge, J.B., Gulley, R.M. and Emken, E.A. 1982. Occurrence of octadecenoic fatty acid isomers from hydrogenated fats in human tissue lipid classes. Lipids. 17: 551-557. Ohlrogge, J.B., Emken, E.A. and Gulley, R.M. 1981. Human tissue lipids: Occurrence of fatty acid isomers from dietary hydrogenated oils. Journal of Lipid Research. 22: 955-960. Olegard, R. and Svennerholm, L. 1970. Fatty acid composition of plasma and red cell phosphoglycerides in full term infants and their mothers. Acta Paediatrica Scandinavica 59: 637-647. Olsen, F.O., Sorensen, J.D., Secher, N.J., Hedegaard, M., Henriksen, T.B., Hansen, H.S. and Grant, A. 1992. Randomised controlled trial of effect of fish-oil supplementation on pregnancy duration. The Lancet. 339: 1003-1007. Ongari, M.A., Ritter, J.M., Orchard, M.A., Waddell, K.A., Blair, I.A., Lewis, P.J. 1984. Correlation of prostacyclin synthesis by human umbilical artery with status of essential fatty acid. American Journal of Obstetrics and Gynecology. 149: 455-460. Ornish, D., Brown, S.E., Scherwitz, L.W., Billings, J.H., Armstrong, W.T., Ports, T.A., McLanahan, S.M., Kirkeeide, R.L., Brand, R.J. and Gould, K.L. 1990. Can lifestyle changes reverse coronary heart disease? The Lifestyle Heart Trial. The Lancet. 336(8708): 129-133. Pariza, M.W. 1988. Dietary fat and cancer risk: Evidence and research needs. Annual Reviews of Nutrition. 8: 167-183. Parkin, D., Muir, C.S., Whelan, S.L., Gao, T., Ferlay, J. and Powell, J. 1992. Cancer incidence in five continents. Vol. 6. International Agency for Research in Cancer, Lyon, France. Payan, D.G., Missirian-Bastian, A., Goetzl, E.J. 1984. Human T-lymphocyte subset specificity of the regulatory effects of leukotriene B. Proceedings of the National Academy of Sciences. USA. 81: 3501-3505. Périssé, J., Sizaret, F. and François, P. 1969. The Effect of income on the structure of the diet. Reprinted from FAO Nutrition Newsletter. Vol. 7, No. 3 July-September. Peto, R., Doll, R., Buckley, J.D. and Sporn, M.B. 1981. Can dietary beta-carotene materially reduce human cancer rates? Nature. 290: 201-208. Pharoah, P.D., Cooke, T., Cooke, R.I. and Rosenbloom, L. 1990. Birthweight specific trends in cerebral palsy. Archives of diseases in childhood. 65: 602-606. Phillips, R.L., Garfinkel, L., Kuzma, J.W., Beeson, W.L., Lotz, T. and Brin, B. 1980. Mortality among California Seventh-Day Adventists for selected cancer sites. Journal of the National Cancer Institute. 65(5): 1097-1107. Plaut, M. 1979. The role of cyclic AMP in modulating cytotoxic T lymphocytes. Journal of Immunology. 123:692-701. Pollard, M. and Luckert, P.H. 1986. Promotional effects of testosterone and high fat diet on the development of autochthonous prostate cancer in rats. Cancer Letters. 32: (2) 223-227. Pooling Project Research Group. 1978. Relationship of blood pressure, serum cholesterol, smoking habit, relative weight and ECG abnormalities incidence of major coronary events: final report of the Pooling Project. Journal of Chronic Diseases. 31(4): 201-306. Popkin, B.M., Haines, P.S. and Patterson, R.E. 1992. Dietary changes in older Americans, 1977-1987. In American Journal of Clinical Nutrition, pp. 823-830. Prentice, R.L. and Sheppard, L. 1990. Dietary fat and cancer: Consistency of the epidemiologic data and disease prevention that may follow from a practical reduction in fat consumption. Cancer Causes and Control. 1: 81-97. Prewitt, T.E., Schmeisser, D., Bowen, P.E., Aye, P., Dolecek, T.A., Langenberg, P., Cole, T. and Brace, L. 1991. Changes in body weight, body composition, and energy intake in women fed high- and low-fat diets. American Journal of Clinical Nutrition. 54: 304-310. Pronczuk, A., Khosla, P. and Hayes, K.C. 1994. Dietary lyristic, palmitic and linoleic acids modulate cholesterolemia in gerbils and hansters. (In Press). Qureshi, A.A., Burger, W.C., Peterson, D.M. and Elson, C.E. 1986. The structure of an inhibitor of cholesterol biosynthesis isolated from barley. Journal of Biological Chemistry. 261: 10544-10550. Qureshi, A.A., Qureshi, N., Wright, J.J.K., Shen, Z., Kramer, G., Gapor, A., Chong, Y.H., DeWitt, G., Ong, A.S.H., Peterson, D.M. and Bradlow, B.A. 1991a. Lowering of serum cholesterol in hypercholesterolemic humans by tocotrienols (palmvitee). American Journal of Clinical Nutrition. 53(4 suppl.):1021S-1026S. Qureshi, A.A., Qureshi, N. Hasler-Rapacz, J.O., Weber, F.E., Chaudhary, V., Crenshaw, T.D., Gapor, A., Ong, A.S.H., Chong, Y.H., Peterson, D. and Rapacz, J. 1991b. Dietary tocotrienols reduce concentrations of plasma cholesterol, apolipoprotein B, thromboxane B2, and platelet 4 in pigs with inherited hyperlipidemias. American Journal of Clinical Chemistry. 53(4 suppl.):1042S-1047S. Ramstedt, U.N.J., Wigzell, H., Sermhan, C.N., Samuelsson, B. 1985. Action of novel eicosanoids lipoxin A and B on human natural killer cell cytotoxicity: effects on intracellular camp and target cell binding. Journal of Immunology. 135: 3434-3438. Ratnayake, W.M.N., Hollywood, R., O'Grady, E. and Pelletier, G. 1993. Fatty acids in some common food items in Canada. Journal of the American College of Nutrition. 12:651-660. Ratnayake, W.M.N., Hollywood, R. and O'Grady, E. 1991. Fatty acids in Canadian margarines. Journal of the Canadian Institute of Food Science and Technology. 24: 8186. Ratnayake, W.M.N. and Pelletier, G. 1992. Positional and geometrical isomers of linoleic acid in partially hydrogenated oils. Journal of the American Oil Chemists' Society. 69: 95-105. Read, M.H., Fisher, K.A., Bendel, R., Bhalla, V.J., Bock, M.A., Harrill, I., Mitchell, M., Schutz, H., Shehan, E. and Standal, B. 1989. Dietary fat intake: Demographics. American Dietetic Association Journal. 89(6): 830-831. Reddy, B.S. 1992. Dietary fat and colon cancer: Animal model studies. Lipids. 27: 807813. Reed, D., McGee, D., Yano, K. and Hankin, J. 1985. Diet, blood pressure and multicollinearity. Hypertension. 1:405-410. Regnstrom, J., Nilsson, J., Tornvall, P., Landou, C. and Hamsten, A. 1992. Susceptibility to low-density lipoptotein oxidation and coronary atherosclerosis in man. The Lancet. 339: 1183-1186. Renaud, S., Morazain, R., Godsey, F., Dumont, E., Thevenon, C., Martin, J.L. and Mendy, F. 1986. Nutrients, platelet function and composition in nine groups of French and British farmers. Atherosclerosis. 60(1): 37-48. Research Committee to the Medical Research Council. 1968. Controlled trial of soya-bean oil in myocardial infarction. The Lancet. 2: 693-699. Riemersma, R.A., Wood, D.A., Butler, S., Elton, R.A., Oliver, M., Salo, M., Nikkari, T., Vartiainen, E., Puska, P., Gey F. et al. 1986. Linoleic acid content in adipose tissue and coronary heart disease. British Medical Journal. 292(6533): 1423-1427. Riemersma, R.A., Wood, D.A., Macintyre, C.C.A., Elton, R.A., Gey, K.F. and Oliver, M.F. 1991. Risk of angina pectoris and plasma comcentrations of vitamin A,C and E and carotene. The Lancet. 337: 1-5. Riemersma, R.A., Wood, D.A., Butler, S., Elton, R.A., Oliver, M., Salo, M. 1986. Linoleic acid content in adipose tissue and coronary heart disease. British Medical Journal. 292: 1423-1427. Rimm, E.B., Stampfer, M.J., Ascherio, A., Giovannucci, E. Colditz, G.A. and Willett, W.C. 1993. Vitamin E consumption and the risk of coronary heart disease in men. New England Journal of Medicine. 328(20): 1450-1456. Ring, J., Seifert, J., Mertin, J., Brendel, W. 1974. Letter: Prolongation of skin allografts in rats by treatment with linoleic acid. The Lancet. 2: 1331. Robinson, D.R. 1991. Alleviation of autoimmune disease by dietary lipids containing omega-3 fatty acids. Rheumatic Disease Clinics of North America. 17: 213- 222. Roder, J.C. and Klein, M. 1979. Target-effector interaction in the natural killer cell system. IV. Modulation by cyclic nucleotides. Journal of Immunology. 123: 2785-2790. Roebuck, B.D. 1992. Dietary fat and the development of pancreatic cancer. Lipids. 27: 804-806. Roebuck, B.D., Baumgartner, K.J. and MacMillan, D.L. 1993. Caloric restriction and intervention in pancreatic carcinogenesis in the rat. Cancer Research 53: 46-52. Rogers, E.J., Rice, S.M., Nicolosi, R.J., Carpender, D.R., McClelland, C.A. and Romanczyk, Jr., L.R. 1993. Identification and quantitation of -oryzanol components and simultaneous assessments of tocols in rice bran oil. Journal of American Oil Chemists' Society. 70: 301-307. Rogers, A.E. and Lee, S.Y. 1986. Chemically-induced mammary gland tumours in rats: Modulation by dietary fat. Progress in Clinical and Biological Research. 222: 255282. Rola-Plaszczynski, M. and Lemaire, I. 1985. Leukotrienes augment interleukin 1 production by human monocytes. Journal of Immunology. 135: 3958-3961. Rola-Plaszczynski, M. 1985. Immunoregulation by leukotrines and other lipoxygenase metabolites. Immunology Today. 6: 302-307. Rola-Plaszczynski, M., Gagnon, M. and Sirois, P. 1983. Leukotriene B4 augments human natural cytotoxic cell activity. Biochemica et Biophysica Acta. 1983: 531-537. Rolls, B.J. and Shide, D.J. 1992. The influence of dietary fat on food intake and body weight. Nutrition Reviews. 50: 283-290. Romieu, I., Willett, W.C., Stampfer, M.J., Colditz, G.A., Sampson, L., Rosner, B., Hennekens, C.H. and Speizer, F.E. 1988. Energy intake and other determinants of relative weight. American Journal of Clinical Nutrition 47:406-412. Rose, D.P. and Connolly, J.M. 1992. Dietary fat, fatty acids and prostate cancer. Lipids. 27(10): 798-803. Rossell, J.B., Kochhar, S.P. and Jawad, I.M. 1981. Chemical changes in soy oil during high temperature processing. Proceedings Second ASA Symp. Soyabean Processing, Antwerp. Rouse, I.L., Armstrong, B.K. and Beilin, L.V. 1983. The relationship of blood pressure to diet and lifestyle in two religious populations. Journal of Hypertension. 1: 65-71. Rozendaal, A. 1976. New trends in heterogeneously catalysed hydrogenation of oils and fats. Proceedings of 13th ISF World Congress, Marseille., pp 43-70. Rubba, P., Mancini, M., Fidanza, F., Gautiero, G., Salo, M., Nikkari, T., Elton, R. and Oliver, M.F. 1987. Adipose tissue, fatty acids and blood pressure in middle aged men from southern Italy. International Journal of Epidemiology. 16: 528-531. Sacks, F.M., Stampfer, M.J., Munoz, A., McManus, K., Canessa, M., Kass, E.H. 1987. Effect of linoleic and oleic acids on blood pressure, blood viscosity, and erythrocyte cation transport. Journal of the American College of Nutrition. 6: 179-185. Sacks, F.M., Rosner, B., Kass, E.H. 1974. Blood pressure in vegetarians. American Journal of Epidemiology. 100: 390-398. Sacks, F.M. 1989. Dietary fats and blood pressure: A critical review of the evidence. Nutrition Reviews. 47: 291-299. Sagredos, A.N., Sintra-Roy, D. and Thomas, A. 1988. Zur Bestimmung, zum Vorkommen und zur Zusammensetzung von polyzyklischen aromatischen Kohlenwasserstoffen in Ölen und Fetten (Categorization, occurrence and composition of polycyclic, aromatic hydrocarbons in oils and fats). Fat-Science Technology. 90: 7681. Salonen, J.T., Salonen, R., Ihanainen, M., Parviainen, M., Seppanen, R., Kantola, M., Sappanen, K. and Rauramaa, R. 1988. Blood pressure, dietary fats and antioxidants. American Journal of Clinical Nutrition. 48: 1226-1232. Salonen, J.T., Salonen, R., Seppanen, K., Rinta-Kiikka, S., Kuukka, M., Korpela, H., Alfthan, G., Kantola, M. and Schalch, W. 1991. Effects of antioxidant supplementation on platelet function: a randomized pair-matched, placebo-controlled, double-blind trial in men with low antioxidant status. American Journal of Clinical Nutrition. 53: 1222-1229. Salonen, J.T., Tuomilehto, J., Tanskanen, A. 1983. Relation of blood pressure to reported intake of salt, saturated fats and alcohol in healthy middle-aged population. Journal of Epidemiology and Community Health. 37: 32-37. Sanders, T.A. and Roshanai, F. 1983. The influence of different types of omega-3 polyunsaturated fatty acids on blood lipids and platelet function in healthy volunteers. Clinical Science. 64(1): 91-99. Sandier, R.S., Lyles, C.M., Peipins, L.A., McAuliffe, C.A., Woosley, J.T. and Kupper, L.L. 1993. Diet and risk of colorectal adenomas: macronutrients, cholesterol, and fiber. Journal of the National Cancer Institute. 85(11): 884-891. Santoli, D. and Zurier, R.B. 1989. Prostaglandin E precursor fatty acids inhibit human IL-2 production by a prostaglandin E-dependent mechanism. Immunology. 143: 13031309. Sas, M., Gellen, J.J. Tunkeyoon, M., Chalapati, S., Crawford, M.A., Drury, P.J., Lenihan, T., Ayeni, O. and Pinol, A. 1986. An investigation on the influence of steroidal contraceptives on milk lipid and fatty acids in Hungary and Thailand. WHO Special Programme of Research, Development and Research Training in Human Reproduction. Task Force on oral Contraceptives. Contraception. 33(2): 159-178. Scanu, A.M. and Scandiani, L. 1991. Lipoprotein (a): structure, biology, and clinical relevance. Adv. Intern. Med. 36: 249-70. Schapira, D.V., Kumar, N.B., Lyman, G.H. and Cox C.E. 1990. Abdominal obesity and breast cancer risk. Annals of Internal Medicine. 112: 182-186. Schettler, G. 1979. Cardiovascular diseases during and after World War II: a comparison of the Federal Republic of Germany with other European countries. Preview of Medicine. 8: 581-90. Schoeller, D.A. 1990. How accurate is self-reported dietary energy intake? Nutrition Reviews. 48(10): 373-379. Schuler, G., Hambrecht, R., Schlierf, G., Grunze, M. Methfessel, S., Hauer, K. and Kubler, W. 1992. Myocardial perfusión and regression of coronary artery disease in patients on a regimen of intensive physical exercise and a low fat diet. Journal of the American College of Cardiology. 19(1): 34-42. Schutz, Y., Tremblay, A., Weinsier, R.L. and Nelson, K.M. 1992. Role of fat oxidation in the long-term stabilization of body weight in obese women. American Journal of Clinical Nutrition 55:670-674. Scottish Low Birthweight Study Group. 1992a. The Scottish low birthweight study: I. Survival, growth, neuromotor and sensory impairment. Archives of Diseases in Childhood. 67: 675-681. Scottish Low Birthweight Study Group. 1992b. The Scottish low birthweight study: II. Language attainment, cognitive status, and behavioural problems. Archives of Diseases in Childhood. 67: 682-686. Sebedio, J.L., Grandgirard, A. And Provost, J. 1988. Linoleic acid isomers in heattreated sunflower oils. Journal of American Oil Chemists' Society. 65: 362-366. Segers, J.C. and van de Sande, R. 1988. Degumming theory and practice. Proceedings AOCS World Conference on Edible Fats and Oils Processing. Maastricht pp 88-83. Severson, R.K., Nomura, A.M. Grove, J.S. and Stemmermann, G.N. 1989. A prospective study of demographics, diet and prostate cancer among men of Japanese ancestry in Hawaii. Cancer Research 49(7): 1857-1860. Sheppard, L., Kristal, A.R., Kushi, L.H. 1991. Weight loss in women participating ina randomized trial of low-fat diets. American Journal of Clinical Nutrition. 54:(5) 821-828. Shimamura, T. and Wilson, A.C. 1991. Influence of dietary fish oil on aortic, myocardial and renal lesions of SHR. Journal of Nutritional Science and Vitaminology. 37: 581-590. Shimokawa, H., Lam, J.Y.T., Chesebro, J.H., Bowie, E.J.W. and Vanhoutte, P.M. 1987. Effects of dietary supplementation with cod-liver oil on endotheliumdependent response in porcine coronary arteries. Circulation. 76: 898-905. Siguel, E.N. and Lerman, R.H. 1993. Trans fatty acid patterns in patients with angiographically documented coronary artery disease. American Journal of Cardiology. 71: 916-920. Sinclair, A.J. 1975. The incorporation of radioactive polyunsaturated fatty acids into the liver and brain of the developing rat. Lipids. 10: 175-184. Singer, P., Moritz, V., Wirth, M., Berger, I. and Forster, D. 1990. Blood pressure and serum lipids from SHR after diets supplemented with evening primrose, sunflower seed or fish oil. Prostaglandins, Leukemia and Essential Fatty Acids. 40: 17-20. Smith, G.D., Song, F. and Sheldon, T.A. 1993. Cholesterol lowering and mortality: the importance of considering initial level of risk. British Medical Journal 306(6889): 1367-1373. Smith-Barbaro, P., Fisher, H., Quinn, M.R. and Hegsted, D.M. 1980. The effect of varying polyunsaturated to saturated fat ratios on salt induced hypertension in rats. Nutrition Reports International. 22: 759-770. Society of Actuaries and Association of Life Insurance Medical Directors of America 1980. Society of Actuaries Build Study of 1979. Chicago, USA. Sommerville, C.R. 1993. Future prospects for genetic modification of the composition of edible oils from higher plants. American Journal of Clinical Nutrition. 58 (suppl.): 270s-275s. Spady, D.K. and Dietschy, J.M. 1985. Dietary saturated triacylglycerols suppress hepatic low density lipoprotein receptor activity in the hamster. Proceedings of the National Academy of Sciences. U.S.A. 82: 4526-4530. Sperling, R.I., Robin, J.L., Kylander, K.A., Lee, T.H., Lewis, R.A. and Alisten, K.F. 1987. The effect of n-3 polyunsaturated fatty acids on the generation of plateletactivating factor-A by human monocytes. Journal of Immunology 138:4186-4191. Sprecher, H. 1989. N-3 and n-6 fatty acid metabolism. In Dietary omega-3 and omega6 fatty acids. Biological effects and nutritional essentiality (ed. Galli, C. and Simopoulos, A.P.) Life Sciences. Vol. 171. Plenum Press, New York and London pp. 69-79. Stamler, J., Wentworth, D.S. and Neaton, J.D. 1986. Is the relationship between serum cholesterol and risk of premature death from coronary heart disease continuous and graded? Findings in 356,222 primary screens in the Multiple Risk Factor Intervention Trial (MRFIT). Journal of the American Medical Association. 256: 28232828. Stamler, J., Stamler, R., Brown, W.V., Gotto, A.M., Greenland, P., Grundy, S., Hegsted, D.M., Leupker, R.V., Neaton, J.D., Steinberg, D., Stone, N., Van Home, L. and Wisler, R.W. 1993. Serum Cholesterol: Doing the Right Thing. Editorial. Circulation 88:1954-1960. Stampfer, M.J., Hennekens, C.H., Manson, J.E., Colditz, G.A., Rosner, B. and Willett, W.C. 1993. Vitamin E consumption and the risk of coronary disease in women. New England Journal of Medicine. 328(20): 1444-1449. Steinberg, D., Parthasarathy, S., Carew, T.E., Khoo, J.C. and Witzum, J.L. 1989. Beyond cholesterol: Modifications of low-density lipoproteins that increase its atherogenicity. New England Journal of Medicine. 320: 915-924. Steinmetz, K.A. and Potter, J.D. 1991. Vegetables, fruit, and cancer. I. Epidemiology. Cancer, Causes and Control. 2(5): 325-357. Stephen, A.M. and Wald, N.J. 1990. Trends in individual consumption of dietary fat in the United States, 1920-1984. In: American Journal of Clinical Nutrition pp. 457-469. Stokes, J. Ill, Garrison, R.J. and Kannel, W.B. 1985. The independent contributions of various indices of obesity to the 22-year incidence of coronary heart disease: the Framingham Heart Study. In: Vague J., Bjorntorp, P., Guy-Grand, B., Rebuffe-Scrive, M., Vague, P. (eds): Metabolic Complications of Human Obesities. Excerpta Medica 49-57. Amsterdam. Strauss, H.J., Piater, H. and Sterner, W. 1982. Fütterungsversuch mit dimeren. Triglyceriden aus Sojaölraffinat (Feeding experiment with dimeric triglycerides of refined soybean oil). Fette Seifen Anstrichmittel. 84: 199-203. Stubbs, C.D. and Smith, A.D. 1984. The modification of mammalian membrane polyunsaturated fatty acid composition in relation to membrane fluidity and function. Biochimica et Biophysica Acta. 779: 89-137. Suga, K., Kawasaki, T., Blank, M.L. and Snyder, F. 1991. An arachidonoyl (polyenoic) specific phosphollpase A2 activity regulates the synthesis of plateletactivating factor in granulocytic HL-60 cells. Journal of Biological Chemistry. 265: 12363-12367. Sundram, K., Hayes, K.C. and Siru, O.S. 1994. Dietary palmitic acid results in lower serum cholesterol than does a lauric-myristic combination in normolipemic humans. American Journal of Clinical Nutrition. 59:841-846. Swinburn, B.A., Boyce, V.L., Bergman, R.N., Howard, B.V., Bogardus, C. 1991. Deterioration in carbohydrate metabolism and lipoprotein changes is induced by modem, high fat diet in Pima Indians and Caucasians. Journal Clin. Endocrin. Metab. 1991. 73, 1 156-165. Tan, B. and Chu, F.L. 1991. Effects of palm carotenoids in rat hepatic cytochrome P450-mediated benzo(a)pyrene metabolism. American Journal of Clinical Nutrition. 53: 1071s-1075s. Tan, D.T.S., Khor, H.T., Low, W.H.S., Ali, A. and Gapor, A. 1991. Effect of palm-oilvitamin E concentrate on the serum and lipoprotein lip ids in humans. American Journal of Clinical Nutrition. 53: 1027s-1030s. Tannenbaum A., Silverstone H. 1953. Nutrition in relation to cancer In: Advances in Cancer Research. New York: Academic Press. 1:451-501. Tannenbaum, A. 1959. Nutrition and Cancer. In Homburger, F. (ed.). The Physiopathology of Cancer. 2nd edition. Hoeber-Harper Press, New York. pp. 517-582. Thomas, L.H., Winter, J.A. and Scott, R.G. 1983. Concentration of trans-unsaturated fatty acids in the adipose body tissue of decedents dying of ischaemic heart disease compared with controls. Journal of Epidemiology and Community Health. 37: 22-24. Thomas, L.H., Jones, P.R., Winter, J.A. and Smith, H. 1981. Hydrogenated oils and fats: the presence of chemically-modified fatty acids in human adipose tissue. American Journal of Clinical Nutrition. 34: 877-886. Thomas, L.H. and Scott, R.G. 1981. Ischaemic heart disease and the proportions of hydrogenated fat and ruminant-animal fat in adipose tissue at post-mortem examination: a case-control study. Journal of Epidemiology and Community Health. 35: 251-255. Thomas, A. 1982. Über die Entfernung von Schadstoffen bei der Dämpfung von Speiseölen und fetten (Removal of pollutants during the steam treatment of oils and fats). Fette Seifen Anstrichmittel: 84: 133-136. Thompson, H.J. 1992. Effect of amount and type of exercise on experimentally induced breast cancer. In Jacobs, M.M. (ed.) Exercise, calories, fat and cancer. Advances in Experimental Medicine and Biology. 322, 61-71. New York, Plenum Press. Tinoco, J. 1982. Dietary requirements and functions of alpha-linolenic acid in animals. Progress in lipid research 21:1-45. Tobian, L., Ganguli, M., Johnson, M.A. and Iwai, J. 1982. Influence of renal prostaglandins and dietary linoleate on hypertension in Dahl S rats. Hypertension 11 (Suppl. II): 149-153. Tribble D.L., Jeroen, J.M., van den Berg, J.M., Motchnik, P.A., Ames, B.N., Lewis, D.M., Chait, A. and Krauss. 1994. Oxidative susceptibility of low density lipoprotein subfractions is related to ubiquinol-10 and tocopherol content. Proceedings of the National Academy of Science. USA. 91: 1183-1187. Troisi, R., Willett, W.C. and Weiss, S.T. 1992. Trans-fatty acid intake in relation to serum lipid concentrations in adult men. American Journal of Clinical Nutrition. 56: 1019-1024. Tso, P. 1985. Gastrointestinal digestion and absorption of lipid. Advances in Lipid Research. 21: 143-186. Turpeinen, O., Karvonen, M.J., Pekkarinen, M., Miettinen, M., Elosuo, R. and Paavilainen, E. 1979. Dietary prevention of coronary heart disease: the Finnish Mental Hospital Study. International Journal of Epidemiology. 8(2): 99-118. Uauy, R,. Birch, E. and Birch, D. 1992. Visual and brain function measurements in study of n-3 fatty acid requirements of infants. Journal of Pediatrics. 120: l68-180. Uauy, R.D., Birch, D.G., Birch, E.E., Tyson, J.E. and Hoffman, D.R. 1990. Effect of dietary omega-3 fatty acids on retinol function of very low-birthweight neonates. Pediatric Research. 28: 485-492. Uldall, P.R., Wilkinson, R. and McHugh, M.I., Field, E.J., Shenton, B.K., Taylor, R.M. and Swinney, J. 1974. Letter: Unsaturated fatty acids and renal transplantation. The Lancet. 2(879):514. U.S Department of Health and Human Services. 1988. The Surgeon General's Report on Nutrition and Health. D.H.H.S. (PAS) Publ. No. 88-50210. United States Printing Office, Washington, D.C. pp. 177-247. Utermohlen, V., Coniglio, J., Mao, D., Sierra, J., Smith, R., Besner, G., Hutchins, S., Spitzer, K., Tomasso, J. and Boyar, A. 1981. Unsaturated fatty acids and human mononuclear cell function. Progress in Lipid Research. 20: 739-741. Valek, J., Hammer, J., Kohout, M., Grafnetter, D., Vondra, K. and Topinka, V. 1985. Serum linoleic acid and cardiovascular death in postinfarction middle-aged men. Atherosclerosis. 54(1): 111-118. Van Staveren, W.A., Deurenberg, P., Katan, M.B., Burema, J., de Groot, L.C. and Hoffmans, M.D. 1986. Validity of the fatty acid composition of subcutaneous fat tissue microbiopsies as an estimate of the long-term average fatty acid composition of the diet of separate individuals. American Journal of Epidemiology. 123(3): 455-463. Van den Brandt, P.A., van't Veer, P. Goldbohm, R.A., Dorant, E., Volovics, A., Hermus R.J. and Sturmans, F. 1993. A prospective cohort study on dietary fat and the risk of postmenopausal breast cancer. Cancer Research. 53(1): 75-82. van der Heide, J.J., Bilo, H.J. Donker, J.M., Wilmink, J.M., Tegzess, A.M. 1993. Effect of dietary fish oil on renal function and rejection in cyclosporine- treated recipients of renal transplants. New England Journal of Medicine. 329(11): 769-773. Vanderveen, J.E. and Glinsmann, W.H. 1992. Fat substitutes: A regulatory perspective. Annual Reviews of Nutrition. 12: 473-487. Veerkamp, J.H. and Zevenbergen, J.L. 1986. Effect of dietary fat on total and peroxisomal fatty acid oxidation in rat tissues. Biochimica et Biophysica Acta. 878: 102109. Vergroesen, A.J. and Gottenbos, J.J. 1975. The role of fats in human nutrition: an introduction. In Vergroesen, A.J. (ed.) The Role of Fats in Human Nutrition. Academic Press, New York pp. 1-32. Vergroesen, A.J. 1972. Dietary fat and cardiovascular disease: possible modes of action of linoleic acid. Proceedings of the Nutrition Society. 31: 323-329. Verschuren, P.M. and Zevenbergen, J.L. 1990. Safety evaluation of hydrogenated oils. Food Chemical Toxicology. 28: 755-757. Villar, J. and Rivers, J. 1988. Nutritional Supplementation during two consecutive pregnancies and the interim lactation period: effect on birth weight. Pediatrics. 81: 5157. Virella, G., Kilpatrick, J.M., Rugeles, M.T., Hyman, B. and Russell, R. 1989. Depression of humoral responses and phagocytic functions in vivo and in vitro by fish oil and eicosapentaenoic acid. Clinical Immunology and Immunopathology. 52: 257270. Voss, A., Reinhart, M., Sankarappa, S. and Sprecher, H. 1991. The metabolism of 7, 10, 13, 16, 19 docosapentaenoic acid to 4, 7, 10, 13, 16, 19 docosahexaenoic acid in liver is independent of 4-desaturates. Journal of Biological Chemistry. 266, 1999520000. Wald, N., Sneddon, J., Densem, J., Frost, C. and Stone, R. 1991. Prevention of neural tube defects: Results of the Medical Research Council Vitamin Study. The Lancet. 338: 131-137. Wattenberg, L.W. 1992. Inhibition of carcinogenesis by minor dietary constituents. Cancer Research. 52: (Suppl.): 2085s-2091s. Webb, D.R., Rogers, T.J. and Nowowiejiski, I. 1980. Endogenous prostaglandin synthesis and the control of lymphocyte function. Proceedings of New York Academy of Sciences. 332: 260-270. Welsch, C.W. 1987. Enhancement of mammary tumourogenesis by dietary fat: Review of potential mechanisms. American Journal of Clinical Nutrition. 45: 192-202. Welsch, C.W. 1992. Relationship between dietary fat and experimental mammary tumourigenesis: A review and critique. Cancer Research. 52: (Suppl.): 2040s-2048s. Wheeler, T.G., Benolken, R.M. and Anderson, R.E. 1975. Visual membranes: Specificity of fatty acid precursors for the electrical response to illumination. Science. 188: 1312. Whittemore, A.S., Wu-Williams, A.H., Lee, M., Zheng, S., Gallagher, R.P., Jiao, D.A., Zhou, L., Wang, X.H., Jung, D., Chong, Z.T., Ling, C., Xu, J.Y., Paffenbarger, R.S. and Henderson, B.E. 1990. Diet, physical activity and colorectal cancer among Chinese in North America and China. Journal of the Netherlands Cancer Institute. 82(11): 915-926. OMS. 1985a. Recomendaciones sobre los consumos energéticos durante la gestación. OMS, Ginebra. OMS. 19850. La cantidad y calidad de la leche materna. Segundo Informe del Estudio de Colaboración. OMS, Ginebra. OMS. 1990. Informe de un grupo de estudio de la OMS. Dieta, nutrición y prevención de las enfermedades crónicas, Serie de Informes Técnicos de la OMS 797, Ginebra. Willett, W.C., Sampson, L., Stampfer, M.J., Rosner, B., Bain, C., Witschi, J., Hennekens, C.H. and Speizer, F.E. 1985. Reproducibility and validity of a semiquantitative food frequency questionaire. American Journal of Epidemiology. 122(1): 51-65. Willett, W.C., Stampfer, M.J., Colditz, G.A., Rosner, B.A., Hennekens, C.H. and Speizer, F.E. 1987. Dietary fat and the risk of breast cancer. New England Journal of Medicine. 316(1): 22-28. Willett, W.C. 1989. The search for the cause of breast and colon cancer. Nature. 338: 389-393. Willett, W.C., Stampfer, M.J., Colditz, G.A., Rosner, B.A. and Speizer, F.E. 1990. Relation of meat, fat and fiber intake to the risk of colon cancer in a prospective study among women. New England Journal of Medicine. 323(24): 1664-1672. Willett, W.C., Hunter, D.J., Stampfer, M.J., Colditz, G., Manson, J.E., Spiegelman, D., Rosner, B., Hennekens, C.H. and Speizer, F.E. 1992. Dietary fat and fiber in relation to risk of breast cancer. An 8-year follow-up. Journal of the American Medical Association. 268(15): 2037-2044. Willett, W.C., Stampfer, M.J., Manson, J.E., Colditz, G.A., Speizer, F.E., Rosner, B.A., Sampson, L.A. and Hennekens, C.H. 1993. Intake of trans fatty acids and risk of coronary heart disease among women. The Lancet. 341: 581-585. Williams, P.T., Fortmann, S.P., Terry, R.B., Garay, S.C., Vranizan, K.M., Ellsworth, N. and Wood, P.D. 1987. Associations of dietary fat, regional adiposity and blood pressure in men. Journal of the American Medical Association. 257: 3251-3256. Williamson, D.F., Kahn, H.S., Remington, P.L. and Anda, R.F. 1990. The 10-year incidence of overweight and major weight gain in US adults. Archives of Internal Medicine 150(3):665-672. Wilson. P.W.F., Abbott, B.M. and Castelli, W.P. 1988. High density lipoprotein cholesterol and mortality. Arteriosclerosis. 8: 737-741. Winick, M. 1983. Nutrition, intrauterine growth retardation and the placenta. Trophoblast Research. 1: 7-14. Witteman, J.M., Willett, W.C., Stampfer, M.J., Colditz, G.A., Sacks, F.M., Speizer, F.E., Rosner, B. and Hennekens, C.H. 1989. A prospective study of nutritional factors and hypertension among U.S. women. Circulation. 80: 1320-1327. Wood, R. 1992. Biological effects of geometrical and positional isomers of monounsaturated fatty acids in humans. In Chow, C.K. (ed.) Fatty acids in foods and their health implications. Marcel Dekker, Inc., New York, N.Y. pp. 663-688. Wood, R., Kubena, K., O'Brien, B., Tseng, S. and Martin, G. 1993a. Effect of butter, mono- and polyunsaturated fatty acid-enriched butter, trans fatty acid margarine, and zero trans fatty acid margarine on serum lipids and lipoproteins in healthy men. Journal of Lipid Research. 34: 1-11. Wood, R., Kubena, K., Tseng, S., Martin, G. and Crook, R. 1993b. Effect of palm oil, margarine, butter and sunflower oil on the serum lipids and lipoproteins of normocholesterolemic middle aged men. Journal of Nutritional Biochemistry. 4: 1-12 Wood, D.A., Butler, S., Riemersma, R.A., Thomson, M., Oliver, M.F., Fulton, M., Birthwhistle, A. and Elton, R.A. 1984. Adipose tissue, platelet fatty acids and coronary heart disease in Scottish men. The Lancet. 2(8395):117-121. Woollett, L.A., Spady, D.K. and Dietschy, J.M. 1992. Saturated and unsaturated fatty acids independently regulate low density lipoprotein receptor activity and production rate. Journal of Lipid Research. 33: 77-88. Wynn, M. and Wynn, A.H.A. 1981. The Prevention of Handicap of Early Pregnancy Origin. The Foundation for Education and Research in Child Bearing, London. Wynn, A.H.A., Crawford, M.A., Doyle, W. and Wynn, S.W. 1991. Nutrition of women in anticipation of pregnancy. Nutrition and Health. 7: 69-88. Yamamoto, N., Saitoh, M., Moriuchi, A., Nomura, M., and Okuyama, H. 1987. Effect of dietary alpha-linolenate/linoleate balance on brain lipid composition and learning ability in rats. Journal of Lipid Research. 28: 144-151. Yamori, Y. 1977. Hypertensive strains of rat. In Inoue, E. and Nishimura, H. (eds.) Gene-environment interaction in common diseases. University of Tokyo Press, p.141-154. Yamori, Y. 1981. Environmental influences on the development of hypertensive vascular diseases in SHR and related models, and their relation to human disease. In Worcel, M., Bonvalet, J.P., Langer, S.Z., Menard, J. and Sassard, J. (eds.). New trends in arterial hypertension. Elsevier, Amsterdam, p.305-320. Yamori, Y., Nara, Y., Mizushima, S., Murakami, S., Ikeda, K., Sawamura, M., Nabika, T. and Horie, R. 1992. Gene-environment interaction in hypertension, stroke and atherosclerosis in experimental models and supportive findings from a world-wide cross-sectional epidemiological survey: A WHO-CARDIAC Study. Clinical and Experimental Pharmacology and Physiology. 19 (suppl. 20): 43-52. Yamori, Y., Nara, Y., Mizushima, S., Mano, M. and Horie, R. 1993. Dietary risk factors for high blood pressure: main result from WHO-CARDIAC (core) Study. 3rd International Conference on Preventive Cardiology. No. 190 (Abstract). Yin, K., Chu, Z.M. and Beilin, L.J. 1992. Blood pressure and vascular reactivity changes in spontaneously hypertensive rats fed fish oil. British Journal of Pharmacology. 102: 991-997. Yla-Herttuala, S., Palinski, W., Rosenfeld, M., Parthasarathy, S., Carew, T.E., Butler, S., Witztum, J. and Steinberg, D. 1989. Evidence for the presence of oxidatively modified LDL in atherosclerotic lesions of rabbit and man. Journal of Clinical Investigation. 284: 1086-1095. Zack, P.M., Harlan, W.R., Leaverton, P.E. and Cornoni-Huntley, J. 1979. A longitudinal study of body fatness in childhood and adolescence. Journal of Pediatrics 95:126-130. Zevenbergen, J.L. and Haddeman, E. 1989. Lack of effects of trans fatty acids on eicosanoid biosynthesis with adequate intakes of linoleic acid. Lipids. 24: 555-563. Ziboh, V.A., Cohen, K.A., Ellis, C.N., Miller, C., Hamilton, T.A., Kragballe, K., Hydrick, C.R. and Voorhees, J.J. 1986. Effects of dietary supplementation of fish oil on neutrophil and epidermal fatty acids. Modulation of Clinical course of psoriatic subjects. Archives of Dermatology. 122(11): 1277-1282. Ziegler, R.G. 1989. A review of the epidemiologic evidence that carotenoids reduce the risk of cancer. Journal of Nutrition. 119: 116-122. Zock, P.L. and Katan, M.B. 1992. Hydrogenation alternatives: effects of trans fatty acid and stearic acid versus linoleic acid on serum lipids and lipoproteins in humans. Journal of Lipid Research. 33: 399-410. Zock, P.L., de Vries, J.H. and Katan, M.B. 1994. Impact of myristic acid versus palmitic acid on serum lipid and lipoprotein levels in healthy women and men. Arterioscl. Thromb. 14:567-575. Zurlo, F., Lillioja, S., Esposito-Del Puente, A., Nyomba, B.L., Raz, I., Saad, M.F., Swinburn, B.A., Knowler, W.C., Bogardus, C. and Ravussin, E. 1990. Low ratio of fat to carbohydrate, oxidation as predictor of weight gain: study of 24-h RQ. American Journal of Physiology 259(5 Pt. 1):E650-657. Anexo - Indices nacionales de suministro de grasas alimentarias La siguiente tabla proporciona información sobre las medias nacionales de energía alimentaria y de grasas disponibles para el consumo humano en 1988-90. Las cifras se basan en los datos de las Hojas de Balance de Alimentos de la FAO, y hay que considerar los requisitos necesarios para asegurar que se interpreten y utilicen correctamente. Primero, debe insistirse en que reflejan medias globales de disponibilidad de alimentos y de grasas, y no representan consumos dietéticos reales. Segundo, hay que destacar que la distribución y consumo de los alimentos disponibles en un país, incluidas las grasas alimentarias, se encuentran a menudo muy sesgados, normalmente conforme a las líneas socioeconómicas y entre zonas urbanas y rurales. Esto significa, por ejemplo, que incluso en países en que las cifras de disponibilidad total de grasas y los cocientes grasa/energía son bajos, muchas personas o grupos pueden tener consumos de grasas normales o altos. Por el contrario, en los países que tienen altos índices de disponibilidad de alimentos y de grasas, mucha gente no puede acceder a la cantidad de alimentos que se ha juzgado adecuada en este informe. CLASIFICACION DE LOS PAISES SEGUN LA RELACION GRASAS ENERGIA DEL SUMINISTRO ALIMENTARIO NACIONAL, 1988-90 (Hojas de Balance de Alimentos de la FAO) País RWANDA CAMBOYA BANGLADESH UGANDA VIET NAM COREA RDP BURUNDI NEPAL MALAWI NIGER TANZANIA LAOS MADAGASCAR ZAMBIA ETIOPIA ZAIRE MYANMAR LESOTHO MALDIVAS FILIPINAS INDIA YEMEN TAILANDIA CHINA PERU INDONESIA BOTSWANA GUATEMALA NICARAGUA MARRUECOS GUYANA HAITI GHANA TOGO COMORAS SWAZILANDIA BENIN RGEa (%) 7 8 9 11 11 11 12 12 12 12 12 13 13 14 14 14 14 14 14 15 15 15 16 16 16 16 17 17 17 17 17 17 17 17 17 18 18 Grasas totalesb (g) 15 19 20 26 27 36 25 29 28 31 31 34 32 31 26 34 39 34 39 38 38 38 40 47 37 47 42 42 42 57 47 38 41 43 34 52 47 Grasa animal/grasas totalesc (%) 23 41 15 34 56 40 13 34 16 23 29 58 52 19 28 9 18 28 34 45 27 32 35 53 47 11 48 20 38 22 41 22 12 14 15 33 13 SEA (kcals) 1 913 2 122 2 038 2 177 2 216 2 843 1 948 2 205 2 049 2 240 2 195 2 465 2 156 2 016 1 699 2 130 2 454 2 121 2 400 2 341 2 229 2 230 2 280 2 645 2 037 2 605 2 260 2 254 2 235 3 031 2 495 2 006 2 144 2 268 1 760 2 634 2 383 SRI LANKA AFGANISTAN COTE D'IVOIRE GUINEA BURKINA FASO GABON ANGOLA GAMBIA CAMERUN PAPUA N. GUINEA MOZAMBIQUE ALBANIA NIGERIA MALI KENYA CHAD SURINAME IRAN LIBERIA COREA, REP. DE NAMIBIA IRAQ DJIBOUTI MAURICIO EGIPTO BOLIVIA MAURITANIA CHILE EL SALVADOR CONGO ARGELIA COLOMBIA ZIMBABWE GUINEA-BISSAU SUDAFRICA PAKISTAN SEYCHELLES HONDURAS JORDANIA TRINIDAD Y TOB. SINGAPUR ISLAS SALOMON SAN VINCENTE Y LAS GRAN. REP. DOMINICANA BRUNEI DARUSALAM CUBA COSTA RICA JAMAICA 18 18 18 18 18 18 18 18 19 19 19 19 19 19 19 19 19 19 20 20 20 20 20 20 21 21 21 21 21 21 21 21 21 21 21 22 23 23 23 23 23 23 23 23 24 24 24 24 45 35 52 45 45 49 38 47 46 53 37 54 47 48 44 37 52 66 49 61 44 69 53 65 76 46 56 57 54 53 69 58 53 53 75 57 59 56 69 71 79 58 63 600 75 83 72 68 13 39 15 10 14 29 31 15 20 33 9 59 7 24 42 24 40 28 10 44 44 22 35 33 28 62 52 53 38 16 30 47 22 23 40 34 33 30 34 42 71 25 41 31 54 58 41 36 2 246 1 766 2 569 2 242 2 219 2 443 1 880 2 290 2 208 2 589 1 805 2 587 2 200 2 259 2 064 1 735 2 436 3 022 2 259 2 826 1 969 3 096 2 362 2 897 3 310 2 013 2 447 2 484 2 331 2 295 2 944 2 453 2 256 2 235 3 133 2 280 2 356 2 210 2 711 2 770 3 121 2 278 2 459 2 310 2 858 3 129 2 711 2 558 ARABIA SAUDITA TURQUIA SENEGAL REP. CENTRO AFRICANA REUNION JAPON PANAMA SIRIA PARAGUAY BRASIL KIRIBATI TUNEZ BELICE RUMANIA VENEZUELA DOMINICA MEXICO GUADALUPE MARTINICA SIERRA LEONA LIBANO FUI GRANADA SANTA LUCIA SUDAN TONGA ANTIGUA URSS GUAYANA FR. NUEVA CALEDONIA EMIRATOS A. U. BAHAMAS LIBIA ANTILLAS HOLANDESAS YUGOSLAVIA MONGOLIA POLYNESIA FR. BULGARIA ECUADOR SOMALIA MALASIA BARBADOS ARGENTINA URUGUAY MACAO KUWAIT POLONIA ALEMANIA ANTIGUA Y BARBUDA 24 24 24 25 25 25 25 25 25 26 26 26 26 26 26 26 27 27 27 28 28 28 28 28 28 28 28 28 29 29 29 30 30 30 30 30 31 31 31 31 31 31 31 32 32 32 33 33 79 87 63 51 85 81 63 87 76 78 72 90 74 90 71 85 93 84 84 58 97 86 74 75 63 93 106 89 94 106 91 108 88 117 78 92 126 82 64 93 111 107 93 81 108 123 135 85 38 19 20 28 50 48 48 34 48 39 20 19 71 58 35 47 45 57 52 6 31 35 44 58 38 47 67 69 45 58 64 29 63 59 90 54 59 30 60 28 60 63 76 53 47 79 73 58 2 930 3 197 2 322 1 846 3 082 2 921 2 269 3 122 2 684 2 730 2 516 3 122 2 575 3 081 2 555 2 911 3 062 2 776 2 768 1 899 3 142 2 769 2 400 2 424 2 043 2 967 3 380 2 804 2 909 3 285 2 776 3 291 2 681 3 545 2 361 2 757 3 695 2 399 1 874 2 671 3 217 3 068 2 668 2 294 3 044 3 426 3 710 2 307 SAMOA PORTUGAL CHECOSLOVAQUIA OCEANIA ISLANDIA MALTA ISRAEL HONG KONG AUSTRALIA ST. KITTS Y NEVIS VANUATU HUNGRIA FINLANDIA ITALIA NORUEGA NUEVA ZELANDIA GRECIA CANADA ESTADOS UNIDOS DE AMERICA ALEMANIA, R.F. DE SUECIA BERMUDAS REINO UNIDO IRLANDA HOLANDA SANTO TOME Y PRINCIPE AUSTRIA FRANCIA ESPAÑA SUIZA BELGICA-LUXEMBURGO DINAMARCA 33 34 34 34 34 34 35 35 37 37 37 37 37 37 38 38 38 38 38 97 125 135 121 132 121 126 112 135 99 113 150 127 146 135 146 160 137 154 36 47 70 69 73 56 33 57 73 34 36 76 77 46 64 79 46 59 52 2 621 3 342 3 574 3 172 3 473 3 169 3 220 2 860 3 302 2 435 2 737 3 608 3 067 3 498 3 221 3 460 3 775 3 242 3 642 38 38 39 39 39 40 40 41 42 42 44 44 46 147 127 127 142 173 135 95 159 168 164 171 192 185 69 67 59 68 66 60 5 62 66 55 65 73 80 3 472 2 977 2 960 3 270 3 951 3 078 2 153 3 486 3 593 3 473 3 508 3 925 3 639 a Relación grasas/energía - proporción del suministro de energía alimentaria procedente de las grasas. b Media de los gramos de grasas disponibles por persona y día. c Proporción de las grasas totales disponibles de origen animal. d Suministro de energía alimentaria - media de las kilocalorías totales disponibles por persona y día. Cuadernos técnicos de la FAO ESTUDIOS FAO: ALIMENTACION Y NUTRICION 1/1 1/2 Review of food consumption surveys 1977 -Vol. 1. Europe, North America, Oceania, 1977 (I) Review of food consumption surveys 1977 -Vol. 2. Africa, Latin America, Near East, Far East, 1979 (I) 2 3 Informe de la conferencia mixta FAO/OMS/PNUMA sobre micotoxinas, 1977 (E F I) Informe de una consulta de expertos FAO/OMS sobre las grasas y aceites en la nutrición humana, 1978 (E F I) 4 JECFA specifications for identity and purity of thickening agents, anticaking agents, antimicrobials and emulsifiers, 1978 (I) 5 JECFA - guide to specifications, 1978 (F I) 5 Rev. JECFA - guide to specifications, 1983 (F I) 1 5 Rev. JEFCA - guide to specifications, 1991 (I) 2 6 Los comedores obreros en los países en desarrollo, 1978 (E I) 7 JECFA specifications for identity and purity of food colours, enzyme preparations and other food additives, 1978 (F I) 8 La función de la mujer en la producción y distribución de alimentos, y en la nutrición, 1979 (E F I) 9 Arsenic and tin in foods: reviews of commonly used methods of analysis, 1979 (I) 10 Prevención de las micotoxinas, 1979 (E F I) 11 The economic value of breast-feeding, 1979 (F I) 12 JECFA specifications for identity and purity of food colours, flavouring agents and other food additives, 1979 (F I) Perspectiva sobre micotoxinas, 1982 (E F I) Manuales de control de la calidad de los 13 alimentos: 14/1 Food control laboratory, 1979 (Ar I) 14/1 El laboratorio de control de los alimentos, 1993 (E I) Rev. 1 14/2 Additives, contaminants, techniques, 1980 (I) 14/3 Commodities, 1979 (I) 14/4 Análisis microbiológico, 1981 (E F I) 14/5 Manual de inspección de los alimentos, 1984 (Ar E I) 14/6 Alimentos para la exportación, 1979 (E I) 14/6 Alimentos para la exportación, 1991 (E I) Rev. 1 14/7 Food analysis: general techniques, additives, contaminants and composition, 1986 (C I) 14/8 Food analysis: quality, adulteration and tests of identity 1986 (I) 14/9 Introducción a la toma de muestras de alimentos, 1989 (Ar C E F I) 14/10 Capacitación en análisis de micotoxinas, 1991 (E I) 14/11 Management of food control programmes, 1991 (I) 14/12 Quality assurance in the food control microbiological laboratory, 1992 (E F I) 14/13 Pesticide residues analysis in the food control laboratory, 1993 (I F) 14/14 Quality assurance in the food control chemical -laboratory, 1993 (I) 14/15 Imported food inspection, 1993 (F I) 15 Los carbohidratos en la nutrición humana, 1980 (E F I) 16 Análisis de datos de encuestas de consumo alimentario, 1981 (E F I) 17 JECFA specifications for identity and purity of sweetening agents, emulsifying agents, flavouring agents and other food additives, 1980 (F I) 18 Bibliography of food consumption surveys, 1981 (I) 18 Bibliography of food consumption surveys, 1984 (I) Rev. 1 18 Bibliography of food consumption surveys, 1987 (I) Rev. 2 18 Bibliography of food consumption surveys, 1990 (I) Rev. 3 19 JECFA specifications for identity and purity of carrier solvents, emulsifiers and stabilizers, enzyme preparations, flavouring agents, food colours, sweetening agents and other food additives, 1981 (F I) 20 Las leguminosas en la nutrición humana, 1982 (E F I) 21 Mycotoxin surveillance - a guideline, 1982 (I) 22 Guidelines for agricultural training curricula in Africa, 1982 (F I) 23 Gestión de programas de alimentación de grupos, 1984 (E F I P) 23 La alimentación y la nutrición en la gestión de programas de alimentación de grupos, Rev. 1 1995 (E F I) 24 Evaluation of nutrition interventions, 1982 (I) 25 JECFA specifications for identity and purity of buffering agents, salts; emulsifiers, thickening agents, stabilizers; flavouring agents, food colours, sweetening agents and miscellaneous food additives, 1982 (F I) 26 Food composition tables for the Near East, 1983 (I) 27 Review of food consumption surveys 1981, 1983 (I) 28 JECFA specifications for identity and purity of buffering agents, salts, emulsifiers, stabilizers, thickening agents, extraction solvents, flavouring agents, sweetening agents and miscellaneous food additives, 1983 (F I) 29 Post-harvest losses in quality of food grains, 1983 (F I) 30 FAO/WHO food additives data system, 1984 (I) 30 FAO/WHO food additives data system, 1985 (I) Rev. 1 31/1 JECFA specifications for identity and purity of food colours, 1984 (F I) 31/2 JECFA specifications for identity and purity of food additives, 1984 (F I) 32 Residuos de medicamentos veterinarios en los alimentos, 1985 (E/F/I) 33 Nutritional implications of food aid: an annotated bibliography, 1985 (I) 34 JECFA specifications for identity and purity of certain food additives, 1986 (F** I) 35 Review of food consumption surveys 1985, 1986 (I) 36 Guidelines for can manufacturers and food canners, 1986 (I) 37 JECFA specifications for identity and purity of certain food additives, 1986 (F I) 38 JECFA specifications for identity and purity of certain food additives, 1988 (I) 39 Control de calidad en la elaboración de frutas y hortalizas, 1989 (E F I) 40 Directory of food and nutrition institutions in the Near East, 1987 (I) 41 Residues of some veterinary drugs in animals and foods, 1988 (I) 41/2 Residues of some veterinary drugs in animals and foods. Thirty-fourth meeting of the joint FAO/WHO Expert Committee on Food Additives, 1990 (I) 41/3 Residues of some veterinary drugs in animals and foods. Thirty-sixth meeting of the joint FAO/WHO Expert Committee on Food Additives, 1991 (I) 41/4 Residues of some veterinary drugs in animals and foods. Thirty-eighth meeting of the joint FAO/WHO Expert Committee on Food Additives, 1991 (I) 41/5 Residues of some veterinary drugs in animals and foods. Fourtieth meeting of the Joint FAO/WHO Expert Committee on Food Additives, 1993 (I) 41/6 Residues of some veterinary drugs in animals and foods. Forty-second meeting of the Joint FAO/WHO Expert Committee on Food Additives, 1994 (I) 41/7 Residues of some veterinary drugs in animals and foods. Forty-third meeting of the Joint FAO/WHO Expert Committee on Food Additives, 1994 (I) 41/8 Residues of some veterinary drugs in animals and foods, 1996 (I) 42 Traditional food plants, 1988 (I) 42/1 43 44 45 46 47/1 47/2 47/3 47/4 47/5 47/6 47/7 47/8 48 49 50 51 52/1 52/2 52 Add. 1 52 Add. 2 52 Add. 3 52 Add. 4 53 54 55 56 57 58 59 60 61 62 Edible plants of Uganda. The value of wild and cultivated plants as food, 1989 (I) Guidelines for agricultural training curricula in Arab countries, 1988 (Ar) Review of food consumption surveys 1988, 1988 (I) Exposure of infants and children to lead, 1989 (I) La venta de alimentos en las calles, 1990 (E/F/I). Utilización de alimentos tropicales: cereales, 1990 (E F I) Utilización de alimentos tropicales: raíces y tubérculos, 1990 (E F I) Utilización de alimentos tropicales: árboles, 1990 (E F I) Utilización de alimentos tropicales: frijoles tropicales, 1990 (E F I) Utilización de alimentos tropicales: semillas oleaginosas tropicales, 1991 (E F I) Utilización de alimentos tropicales: azúcares, especias y estimulantes, 1990 (E F I) Utilización de alimentos tropicales: frutos y hojas, 1990 (E F I) Utilización de alimentos tropicales: productos animales, 1990 (E F I) Número sin atribuir JECFA specifications for identity and purity of certain food additives, 1990 (I) Traditional foods in the Near East, 1991 (I) Protein quality evaluation. Report of the joint FAO/WHO Expert Consultation, 1991 (F I) Compendium of food additive specifications -Vol. 1, 1993 (I) Compendium of food additive specifications -Vol. 2, 1993 (I) Compendium of food additive specifications -Addendum 1, 1992 (I) Compendium of food additive specifications -Addendum 2, 1993 (I) Compendium of food additive specifications -Addendum 3, 1995 (I) Compendium of food additive specifications -Addendum 4, 1996 (I) Meat and meat products in human nutrition in developing countries, 1992 (I) De próxima publicación Sampling plans for aflatoxin analysis in peanuts and corn, 1993 (I) Body mass index - A measure of chronic energy deficiency in adults, 1994 (I) Grasas y aceites en la nutrición humana, 1997 (E F I) La utilización de los principios del análisis de riesgos y de los puntos críticos de control en el control de alimentos, 1995 (E F I) Educación en nutrición para el publico, 1996 (E F I) Food fortification - Technology and quality control, 1996 (I) Biotechnology and food safety, 1996 (I) Nutrition education for the public - Discussion papers of an FAO Expert Consultation, 1996 (I) Disponibilidad: enero de 1997 Ar Arabe C Chino E Español F Francés I Inglés P Portugués Multil Multilingue * Agotado ** En preparación En su labor por mejorar la nutrición, la Organización de las Naciones Unidas para la Agricultura y la Alimentación y la Organización Mundial de la Salud convocan consultas de expertos para asesorar a los países en desarrollo y desarrollados. En la presente publicación Grasas y aceites en la nutrición humana se examina la información científica más reciente sobre este tema decisivo y se recojen las recomendaciones de la consulta de expertos celebrada en Roma del 19 al 26 de octubre de 1993. También se estudian los factores fundamentales que pueden influir en el consumo, la salud, la producción y la elaboración de alimentos, su comercialización y la educación en materia de nutrición. El informe contiene recomendaciones acerca de las dosis de ingestión mínimas y máximas de grasas más convenientes; la nutrición materna e infantil; los ácidos esenciales; ácidos grasos saturados, insaturados e isómeros; antioxidantes; y necesidades científicas y programáticas. Se incluye también una extensa bibliografía.