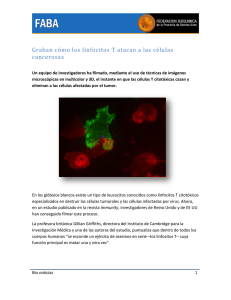
Cátedra de Inmunología Andrei Lahore INMUNIDAD CELULAR Se entiende inmunidad celular como un sistema dinámico y articulado cuyo fin es proteger al huésped de patógenos que superan las barreras y mecanismos de defensa de la inmunidad innata. Además se encarga de eliminar o reprimir clones autorreactivos a fin de evitar respuestas autoinmunes. Este sistema está mediado por linfocitos y las citoquinas que estos liberan. Algunas de sus características son: - Discriminación de lo propio y extraño. Mecanismos de defensa intercelulares más eficaces. Respuesta especializada. Desarrollo de memoria inmunológica. Respuesta rápida al reingreso del patógeno. Características de los Linfocitos T Se originan en la médula ósea y maduran en el timo. Son activados por un estímulo antigénico. Se diferencian en subpoblaciones de CD4 y CD8 positivas. - CD4: helper o “ayudadores”, desempeñan dos funciones; producen citoquinas y estimulan a los linfocitos B a producir Ac. - CD8: al activarse se convierten en células efectoras citotóxicas, capaces de destruir células tumorales o infectadas por virus. TCR (Receptor de linfocitos T) Es el receptor de membrana de los linfocitos T, está compuesto por dos cadenas: - αβ (alfa-beta): incapaz de reconocer Ag en su forma natural, captura solamente péptidos intracelulares presentados por las moléculas HLA-I y extracelulares, presentados por moléculas HLA-II. - γδ (gamma- delta): reconoce glicolípidos y fosfolípidos, presentados por moléculas CD1. - El TCR se debe unir a la molécula CD3 para poder transmitir señales de activación. - El CD3 posee 3 cadenas diferentes: γ (gamma), δ (delta) y ε (epsilon), asociados de esta manera: εδ y γε. - A la unión TCR+CD3 se asocia el CD247 (ζ: dseta), las cadenas de todos estos poseen moléculas intracitoplasmáticas dependientes de tirosina que, al ser fosforiladas inician la activación de los linfocitos T. - Cuando se unen las cadenas del TCR, CD3 y el CD247 se forma el complejo del TCR. - La diversidad de TCR en humanos es de 2 x 107. Desarrollo de la inmunidad celular Para que se inicie la respuesta celular, el linfocito T “virgen” (que no ha entrado en contacto con ningún Ag) debe cumplir las siguientes etapas a lo largo de 1 a 2 semanas: - Búsqueda del Ag (1). - Activación de los linfocitos T (2). - Expansión clonal de los linfocitos activados (3). - Diferenciación en subpoblaciones especializadas (4). - Migración hacia el sitio de inflamación o infección. 1. Búsqueda del Antígeno: los linfocitos vírgenes deben migrar a los órganos linfoides secundarios para poder encontrar a las células presentadoras de antígenos (cel. dendríticas, macrófagos y Linf. B) y así encontrar un Ag para poder activarse. Los linfocitos expresan una molécula de adhesión denominada selectina L, que actúa en la unión inicial al endotelio de las vénulas post-capilares de los ganglios o placas de Peyer. Para completar la adhesión, son necesarias otras moléculas de adhesión celular (CAM, por sus siglas en inglés) como las adresinas: PNAd (adresina de nodo periférico) y MAdCAM-1 (adresina de mucosa, molécula de adhesión celular-1). En los ganglios, los linfocitos hacen contacto con varios células dendríticas buscando a su Ag específico, este contacto puede ser pasajero o estable con diferencia de minutos a horas. 2. Activación de los linfocitos T: para que los linfocitos vírgenes sean activados y se diferencien en células efectoras se requieren dos señales. - Interacción TCR-péptido presentado por HLA (primera señal). - Señalización por medio de moléculas co-estimuladoras (segunda señal). Primera señal: reconocimiento del Ag Cuando el linfocito entra en contacto con la célula presentadora de Ag (cel. dendrítica) la zona de unión de ambas membranas celulares pasa a llamarse sinapsis inmunológica, que consiste en un complejo molecular dividido en 3 zonas: a. Zona central (A): aquí se ubica el complejo TCR-AgHLA I/II, CD4/CD8, CD80/CD86. b. Zona periférica (A): se encuentran aquí las moléculas de adherencia LFA1-ICAM-1, CD2-LFA3, que dan estabilidad a la unión de las células. c. Zona distal (B): conformada por la F-actina y la fosfatasa CD45. Una vez habiendo reconocido el antígeno y formado la sinapsis inmunológica se da lugar a un proceso de señalización que se puede dividir en 8 pasos: 1. El TCR reconoce el Ag. 2. La fosfatasa CD45 activa a las tiroquinasas Fyn y Lck y a los correceptores CD4/CD8. 3. Estas tiroquinasas se autofosforilan y fosforilan los ITAM del CD247 (ζ), atrayendo así a la molécula ZAP-70. 4. La molécula ZAP-70 puede unirse a la PLCγ1 (fosfolipasa Cγ1) o puede unirse a la proteína LAT, generando así 3 cascadas de señalización, dos de las cuales derivan de su unión con la PLCγ1 y la cascada restante de la unión con la LAT. 5. La primera cascada inicia cuando la PLCγ1 convierte el fosfatidilinositol bifosfato (PIP2) en dos compuestos: inositol trifosfato (IP3) y diacilglicerol (DAG). El IP3 induce liberación de calcio (Ca2+) hacia el citosol, el aumento de calcio intracelular estimula a la calmodulina que activa a su vez a la calcineurina, que produce desfosforilización del NF-AT (factor de transcripción nuclear) para que este pueda ingresar al núcleo y se codifique, entre otros, la Il-2. 6. La segunda cascada inicia cuando el DAG activa la proteína quinasa C (PKC), a esto se suma el reclutamiento del complejo IKK que, al activarse fosforila a los inhibidores de kB (IϰB), liberando así al FN-ϰB (factor nuclear kappa B) para que este ingrese al núcleo. 7. La última cascada de señalización inicia cuando la molécula ZAP-70 se une a la proteína LAT, esta proteína recluta nucleótidos (GDP a GTP) para activar unas proteínas llamadas Ras, que por fosforilación activan a las MAP quinasas, estas últimas activan también a al factor de transcripción AP-1 para su ingreso al núcleo. 8. Los factores de transcripción NF-AT, FN-ϰB y AP-1 inducen la secreción de la Il-2, secreción de su receptor α (Il-2Rα), expresión de integrinas, liberación de gránulos citotóxicos de linfocitos T CD8+ y la producción de proteínas antiapoptóticas. Segunda señal: co-estimulación Si bien las moléculas co-estimuladoras no son capaces de activar linfocitos por sí solas, estas amplifican o disminuyen la señalización inducida por el complejo TCR. Son, entonces, indispensables para la producción de Il-2. Entre otras funciones, estas moléculas - Prolongan la vida de los linfocitos T. - Expresan moléculas de adherencia. - Inducen la producción de factores de crecimiento y citoquinas que promueven la proliferación y desarrollo de los linfocitos T. 3. Expansión clonal Es llevada a cabo mediante la Il-2, ya que esta interleucina junto con las Il-15 e Il-21 activan y participan de la blastogénesis que da origen a nuevos linfocitos T. 4. Generación de subpoblaciones de Linfocitos TCD4: Diversos factores influyen en la diferenciación de las subpobaciones, algunos pueden ser: - Naturaleza y concentración del Ag. - Tipo de célula presentadora de Ag. - Estado de activación. - Microambiente de las citoquinas. - Presencia y cantidad de moléculas co-estimuladoras. Entre las subpoblaciones más importantes destacan: - - - - - Th1: generado por Il-12, Il-18, IFN α y β, inductoras del factor Tbet que dará origen a la diferenciación de este tipo celular. Estos linfocitos T producen IFN γ, α y β junto con Il-2Función: defensa contra patógenos intracelulares. Th2: es generado por citoquinas Il-4, Il-11, Il-25 e Il-33. Estas inducen al factor GATA-3 que, estimula la producción de Il-4, Il-5, Il-10, Il-13, Il-25. Promueven un cambio de isotipo de la IgE para activar mastocitos y basófilos que degranulan histmina, heparina y serotonina entre otros que generan contracción del músculo liso, además por medio de la Il-4 e Il-13 el Th2 induce la producción de moco. Función: reclutamiento de mastocitos, eosinofilia, producción de moco e hiperrespuesta de la vía aérea. Th9: generado por TGFβ (factor de crecimiento transformante β) e Il-4. Estimula la producción de Il-9 e Il-10. Función: reclutamiento de mastocitos, eosinofila, producción de moco y contracción muscular. Th17: generados por TGFβ, Il-6, Il-21 e Il-23. Los Th17 se encuentran principalmente en las mucosas pulmonar y digestiva, atraen a PMN al lugar de la infección y estimulan la producción de proteínas antimicrobianas, producen además Il-6, Il-9, Il-17A, Il-17F, Il-21, Il-22 y TNF-α Función: producción de citoquinas y neutrofilia. Th 22: generado por Il-6 y TNF-α. El factor de transcripción de este tipo celular es el AHR, que induce la producción de Il-13, Il-22, FGF (factor de crecimiento de fibroblastos) y TNF-α Función: en la piel promueve la proliferación de queratinocitos e inhibe su diferenciación. TFH (Helper Folicular): o “ayudadores foliculares”, se generan por medio de Il-6, Il-12 e Il-21. El factor de trascripción de este tipo celular es el BCL-6, que induce la producción de Il-4, Il-10 e Il-21. Función: formación de centros germinales, transformación de linfocitos B en células plasmáticas. producción de linfocitos B de memoria y producción de Ac. - Treg: generado por TGFβ e Il-10. El factor de transcripción de este tipo celular es el FOXP3, que induce la producción de Il-9, Il-10, Il-35 y FGFβ. Mutaciones en el gen FOXP3 producen el síndrome IPEX. Función: regular la respuesta inmune, inhibir la proliferación y activación de linfocitos T y células dendríticas e inducir apoptosis en ambos tipos celulares. Linfocitos T CD8 Al desarrollar sus funciones efectoras, un CD8, se convierte en citotóxico, capaz de destruir células malignas o infectadas por virus, ejerce sus función al inducir apoptosis en sus células diana, gracias a la liberación de gránulos citotóxicos. Los gránulos citotóxicos contienen las siguientes proteínas: - Perforinas (citolisinas): proteínas que producen poros en la membrana de la célula blanco, permitiendo la entrada de agua y granzimas, generando un desequilibrio osmótico. Granzimas (fragmentinas) fragmentan el ADN. Granulolisinas: degradan lípidos de membrana. Calreticulina y Catepsina G: inhibidores de perforinas, protegen al linfocito T citotóxico de autolisis. Finalización de la activación Una vez cumplida la función de defensa esta es desactivada por la producción de Il-10 y la generación de Linfocitos T reguladores (Treg), que frenan a los T helper I y II. La CTLA-4 (CD152) es una molécula que controla otro mecanismo de desactivación, debido a que es un regulador negativo de la respuesta de los linfocitos T. Rebaja también la producción de varias citoquinas, especialmente la Il-2 con lo que frena la producción del ciclo celular. Desarrollo de la memoria inmunológica Los linfocitos T de memoria surgen como subpoblaciones de linfocitos T vírgenes durante una respuesta primaria. Son células pequeñas que permanecen en reposo durante mucho tiempo. Estos linfocitos poseen menos requerimientos para ser activados, retienen complejos de ciclinas pre-sintetizados y ensamblados en el citoplasma por lo que se reduce el tiempo entre el reconocimiento y la división celular. Además, expresan un número creciente de proteínas anti-apoptóticas BCL-2, este aumento y mantenimiento de proteínas es posible gracias a la Il-7, mientras que la Il-15 permite un recambio lento de los linfocitos T de memoria.