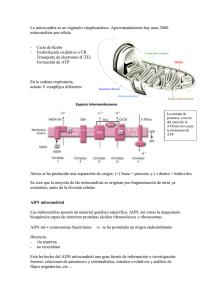
Águila Xóchihua Paola Verónica Asunto: Investigación ADN MITOCONDRIAL Y ENFERMEDADES EN EL SER HUMANO La mitocondria es un orgánulo cilíndrico rodeado de membrana de longitud y que son las encargadas de proporcionar energía a la célula gracias al proceso de fosforilación oxidativa. El ADN mitocondrial fue descubierto por Margit M. K.Nass y Slvan Nass utilizando microscopia electrónica y un sensitivo al ADN mitocondrial. El ADN mitocondrial (mtADN) es una pequeña estructura circular de doble cadena de aproximadamente 16 500 pb. El genoma mitocondrial (ADNmt o mADN) se reproduce por sí mismo semi-autónomamente cuando la célula eucariota se divide. En mamíferos, el mtADN constituye aproximadamente el 1% del ADN total de la célula. La mitocondria contiene múltiples copias de ADN, normalmente distribuidas en varias agrupaciones .La secuencia de mtADN humano consiste en 16 569 pb y contiene 37 genes. Treinta genes codifican proteínas que son subunidades de factores esenciales para el mantenimiento de la síntesis de ATP mitocondrial. Los 24 genes restantes codifican el ARN específicos de la mitocondria: dos ribosomas y 22 ARN de transferencia son capaces de leer todo el código genético, y 13 polipéptidos que forman parte de cuatro de los cinco complejos multienzimáticos del sistema de fosforilación oxidativa (sistema Oxphos), etapa terminal de la ruta de producción de ATP. Estos péptidos corresponden a siete subunidades (ND1, 2, 3, 4, 4L, 5, 6) del di nucleótido de nicotinamida y adenina reducido (NADH): ubiquinona óxido-reductasa (complejo I); una subunidad (cyt b) de la ubiquinol: citocromo c óxido-reductasa (complejo III); tres subunidades (CO I, II, III) de la citocromo c oxidasa (complejo IV), y dos subunidades de la ATP si ntetasa (complejo V). El resto de los polipéptidos componentes de estos complejos, así como el complejo II completo, están codificados en el DNA nuclear. La biogénesis de este sistema constituye un caso único en la célula ya que para su formación se requiere la expresión coordinada de los dos sistemas genéticos. Las dos cadenas del mtADN reciben el nombre de cadena L (ligera o light) y cadena H (pesada o heavy) atendiendo a su coeficiente de sedimentación. La mayor parte de las secuencias codificantes (28 genes) se encuentran en la cadena H. Estas secuencias se distribuyen en esta cadena de forma muy compactada, llegando incluso Imagen I. ADN mitocondrial tiene una estructura de cadena circular compuesta (normalmente) por 16.569 asolaparse. eslabones de bases nucleicas. Estas bases nucleicas (o simplemente bases) pueden ser cuatro tipos de moléculas, llamadas adenina, citosina, timina y guanina, y representadas por sus iniciales A, C, T y G. Así, cuando se quiere representar la secuencia completa del ADN mitocondrial de una persona, se indica la posición y la base, por ejemplo, 1G 2A 3T 4C 5A 6C 7A 8G 9G 10T... La región mayor no codificante, conocida como región control o D-Loop, ocupa 1122 pares de bases y se sitúa entre el gen que codifica para el RNA de transferencia de la prolina y el de la fenilalanina. En la región control se localizan el origen de replicación de la cadena H, los promotores para la transcripción de las dos hebras (PL y PH), dos lugares de unión de factores de transcripción (Tfam), tres bloques de secuencias conservados asociados con el inicio de la replicación (CSBI, II y III) y las secuencias asociadas a la terminación de cadenas (TAS). Tres características convierten al mtADN en una herramienta especialmente útil en la reconstrucción del pasado reciente de las poblaciones humanas: - La Poliplasmia: Elevado número de copias de mtADN que existe en cada mitocondria y, por extensión, en la célula. En el interior de la mitocondria el ADN mitocondrial se encuentra unido a ciertas proteínas (binding proteins), formando un complejo denominado nucleoide. Una mitocondria puede contener entre 2 y 10 de esas estructuras, por lo que el número de copias de mtADN por célula oscila entre 1000 y 10000. - Herencia materna: El DNA mitocondrial se transmite de forma no mendeliana por línea materna. En hombres y mujeres lo tienen, son únicamente las mujeres quienes lo transmiten a la descendencia. Esto se debe a que el citoplasma celular del zigoto, donde se localizan las mitocondrias, procede del óvulo. Los espermatozoides contienen un gran número de mitocondrias en la cola, pero raramente sobreviven a la primera división celular. - Elevada tasa de cambio molecular: Su tasa de evolución es mucho más rápida hasta 10 veces que la del genoma nuclear (BROWN 1980). Usos: El ADN mitocondrial puede ser usado para identificar individuos junto con otra evidencia. También es usado por laboratorios forenses para identificar viejas muestras de esqueleto humano. Distinto que el ADN nuclear, el ADN mitocondrial no sirve para identificar individuos, pero si para identificar grupos de individuos, es usado entonces para aceptar o rechazar comparaciones entre personas perdidas y restos no identificados. La herencia del ADN mitocondrial. Imagen II. Secuencia del ADN mitocondrial por vía materna La herencia del ADN mitocondrial ocurre estrictamente por vía materna, es decir, que el ADN mitocondrial que todos los humanos tenemos es el de nuestra madre. Esto es porque en la fecundación, al fusionarse el óvulo materno y el espermatozoide paterno, sólo el óvulo tiene mitocondrias (el espermatozoide las tiene en la cola, que se queda fuera del óvulo al fecundarlo).Hay un fragmento en este genoma de 400pb (pares de bases) que son altamente polimórfico, podemos considerar que este ADN permanece inalterable por esta vía durante muchísimos años. Este ADN se puede obtener de muestras de cualquier tejido, incluso de la sangre y del tejido óseo. Si se puede obtener de huesos; podríamos obtener este genoma de individuos ya muertos desde hace muchos años. El análisis de éste se usa para estudiar las relaciones filogenéticas; y no sólo en humanos sino, también en muchos otros organismos; por lo que se podría utilizar para determinar variabilidad en poblaciones naturales (para ver si hay o no endogamia), utilizándose también en conservación de especies en peligro de extinción. La secuencia de nuestro ADN mitocondrial es idéntica a la de nuestra madre, y a la de la madre de nuestra madre, y a la de nuestros hermanos y hermanas, las hermanas y hermanos de nuestra madre... y cualquier otro pariente que tengamos por línea materna. El ADN mitocondrial se utiliza a menudo para determinar parentescos por línea materna. ENFERMEDADES DEL ADN MITOCONDRIAL EN EL SER HUMANO Las enfermedades mitocondriales son anormalidades en el metabolismo energético que se han relacionado a alteraciones del ácido desoxirribonucleico de la mitocondria (ADNmt).Son caracterizadas por un fenotipo complejo en el que la mayoría de los pacientes presentan encefalopatía y pueden afectarse los músculos y otros órganos como corazón, hígado, riñones, retina, médula ósea, nervios periféricos y páncreas. Luft en 1962 describió las anormalidades mitocondriales y del metabolismo energético, y Gottfried Schatz de la Universidad de Basilea, Suiza, descubriera en 1963 el ADNmt. En 1988 se describieran las primeras enfermedades causadas por daños en el mtADN, se han encontrado más de 150 mutaciones asociadas a enfermedades humanas. Las enfermedades originadas por daños en el genoma mitocondrial tienen en común el estar producidas por una deficiencia en la biosíntesis de ATP, ya que toda la información que contiene este DNA está dirigida a la síntesis de proteínas componentes del sistema Oxphos. Las manifestaciones de estas enfermedades son muy variadas y pueden afectar a todos los órganos y tejidos, ya que la síntesis de ATP se produce en todos ellos y a cualquier edad. La mayor parte de los casos, principalmente en edad pediátrica, los síntomas son muy poco informativos y es sólo la presencia de anormalidades neurológicas, a veces acompañadas de aumento de ácido láctico y de otros síntomas clínicos secundarios que afectan a diversos órganos, lo que da alguna orientación en el diagnóstico de una enfermedad mitocondrial. Entre las manifestaciones clínicas más comunes se encuentran una o varias de las siguientes: desórdenes motores, accidentes cerebrovasculares, convulsiones, demencia, intolerancia al ejercicio, ptosis, oftalmoplejia, retinopatía pigmentaria, atrofia óptica, ceguera, sordera, cardiomiopatía, disfunciones hepáticas y pancreáticas, diabetes, defectos de crecimiento, anemia sideroblástica, pseudo obstrucción intestinal, nefropatías, acidosis metabólica y otras más secundarias. La presencia de uno o más de estos síntomas requiere a continuación de un estudio morfológico, histoquímico y bioquímico para asegurar la naturaleza de estas enfermedades. Así, con mucha frecuencia se encuentran: fibras rojo-rasgadas (acumulación de mitocondrias anormales en tamaño y número) en biopsias musculares teñidas con tricromo de Gomori y fibras no reactivas a la tinción histoquímica de la citocromo c oxidasa; defectos en uno o varios complejos de la cadena respiratoria; y desarreglos metabólicos con elevación de lactato, piruvato o una aminoaciduria generalizada causados por una disfunción de la cadena respiratoria que conlleva un aumento de equivalentes reductores en la mitocondria y citoplasma, y una alteración del funcionamiento del ciclo de Krebs debido al exceso de NADH, lo que provoca una acumulación de piruvato y su posterior conversión a lactato que difunde a la sangre. Su diagnóstico requiere del reconocimiento previo de la presentación clínica y se apoya fundamentalmente en la biopsia de músculo y los estudios moleculares para buscar las mutaciones en el ADNmt. Imagen III. Enfermedades causantes por la mutación del AD mitocondrial. ENFERMEDAD DE PARKINSON (EP): Cuadro clínico descrito en 1817 por James Parkinson en su Ensayo sobre la Parálisis Agitante merece el nombre de enfermedad de Parkinson. La presencia simultánea de hipertonía de un tipo especial la presencia simultánea de hipertonía de un tipo especial, de acinesia y de temblor en reposo, que aparece típicamente en la segunda mitad de la vida, su evolución es de progresión lenta y se producen lesiones anatómicas que van a afectar selectivamente a la SN del mesencéfalo. Su diagnóstico es clínico y su confirmación es anatomopatológica. Macroscópicamente con la despigmentación de la SN y microscópicamente con los depósitos de Fe en dicho núcleo y la presencia de cuerpos de inclusión citoplásmicos, los llamados cuerpos de Lewy que tienen como principal componente una proteína malformada y agregada, la α-sinucleina. Los síntomas son disminución de movimientos automáticos; dificultad para deglutir y babeo; alteración del equilibrio y la marcha; falta de expresión facial; dolores musculares; problemas con el movimiento; rigidez muscular con resistencia en rueda dentada; temblores; habla más tranquilo y lento; postura encorvada; seborrea; depresión, ansiedad, estrés y tensión, confusión y demencia. El líquido cefalorraquídeo (LCR) se encuentra una disminución en los sistemas de defensa antioxidante y bajo contenido de glutatión reducido (GSH). ENFERMEDAD DE ALZHEIMER : Es un síndrome de deficiencia cognoscitiva definido por los criterios del DSM-IV como un deterioro de la memoria y al menos una de las siguientes alteraciones: trastornos del lenguaje o afasia, pérdida de adquisiciones motoras o apraxia, del reconocimiento de texturas, sonidos, formas, caras o agnosia y finalmente de las funciones ejecutivas que son abstracción, secuenciación y planeación. Su progresión se asocia a cambios bioquímicos como el déficit colinérgico, el daño metabólico neuronal derivado de la excito toxicidad por glutamato y el estrés oxidativo. La característica neuropatológica de la enfermedad es la presencia de agregados extra neuronales de β amiloide, las cuales forman a las placas seniles (PS) o placas neuríticas y además las estructuras interneuronales, llamadas marañas neurofibrilares o NFT´s, que son el resultado de la fosforilación anormal de la proteína tau, la cual se encuentra asociada a los microtúbulos. Imagen V. (ELA). Esclerosis lateral amiotrófic a Imagen IV. Forma especializada de tomografía por emisión de positrones utiliza un marcador químico llamado Compuesto de Pittsburg (PiB) que se inyecta en una vena del brazo antes de la exploración. Una vez que el compuesto ingresa al cerebro, se une a los depósitos de amiloide, el signo revelador del cerebro de la enfermedad de Alzheimer a la derecha, de una persona con la enfermedad. La prueba puede ser útil para el diagnóstico más rápido de la enfermedad de Alzheimer, las exploraciones de (PiB).www.health.harvard edu / brain-imaging ESCLEROSIS LATERAL AMIOTRÓFICA (ELA) Es una enfermedad neurodegenerativa de progresión rápida con pérdida de motoneuronas superiores e inferiores la cual es considerada la principal característica patológica y la causa de los signos clínicos que presentan los pacientes. El cuadro clínico de ELA se caracteriza por debilidad muscular combinada con espasticidad, hiperreflexia y signo de Babinski debida a la afectación de motoneuronas superiores, amiotrofia, calambres y faciculaciones por afectación de motoneuronas inferiores. La muerte en estos pacientes se produce fundamentalment e por colapso de la función respiratoria, incluyendo hipoxia, arritmias cardíacas e infecciones bronco-pulmonares , aproximadamente tres años posteriores a la aparición de los síntomas. En la actualidad, el diagnóstico de ELA se define como probable, posible o definido (cierto) a partir de los criterios revisados en “El Escorial”. Estos criterios se basan en la presencia de signos clínicos o electrofisiológicos de afección de las motoneuronas central o periférica (también llamada superior o inferior) en cuatro diferentes territorios: bulbar, cervical, torácico y lumbar. Enfermedad de Huntington: Es un trastorno neurodegenerativo, autosómico dominante caracterizado por movimientos involuntarios como la corea, así como anomalías del movimiento voluntario. Hay pérdida cognoscitiva y trastornos psiquiátricos. Las neuronas espinosas medianas del estriado son las que degeneran y tiende a generalizarse con el paso de los años. La atrofia estriatal determinada por estudios de neuroimagen apoya el diagnóstico. Imagen VI. Resonancia magnética .Estas imágenes pueden revelar cambios estructurales en lugares particulares del cerebro afectados por la enfermedad de Huntington que proporcionan imágenes detalladas de las estructuras del cerebro. Neuropatía óptica hereditaria de Leber. La neuropatía óptica hereditaria de Leber (LHON) se caracteriza por la pérdida bilateral de la visión central, originada por atrofia del nervio óptico. Aparece en la segunda o tercera década de la vida y afecta a más hombres que a mujeres. Aunque normalmente sólo la visión está afectada, hay casos en los que también aparecen trastornos en la conducción cardiaca, neuropatía periférica y ataxia cerebelar. El diagnóstico se basa en un examen oftalmoscópico. También son signos de la LHON: inflamación de la papila óptica, tortuosidad vascular, telangiectasias peri papilares, microangiopatía y escotomas centrales en estudio del campo visual. Imagen VII. Tomografía de coherencia óptica (TCO) confirma la inflamación de la capa de fibras nerviosas de la retina. Síndrome de neuropatía, ataxia y retinopatía pigmentaria. Este síndrome está caracterizado por debilidad muscular neurogénica, ataxia y retinitis pigmentosa. Suele ir acompañado de demencia, convulsiones y neuropatía sensorial axonal, presenta una herencia materna y se ha asociado a una mutación puntual, T8993G, en el gen de la subunidad 6 de la ATPasa (cuadro I). La mutación aparece normalmente en forma heteroplásmica y en todos los tejidos estudiados: leucocitos, fibroblastos, músculo, riñón y cerebro. Existe una alta correlación entre la proporción del DNA mutado y la severidad de la enfermedad. Síndrome de Leigh de herencia materna. El síndrome de Leigh de herencia materna (MILS) es una enfermedad muy heterogénea que se puede presentar asociada a diferentes tipos de herencia, autosómica recesiva, ligada al cromosoma X o materna (mitocondrial) según el gen que esté dañado. Es una enfermedad devastadora que se caracteriza por trastornos degenerativos multisistémicos que aparecen en el primer año de vida, disfunciones del tallo cerebral y de los ganglios basales, desmielinización, regresión psicomotora, retraso en el desarrollo, ataxia, convulsiones, neuropatía periférica. El diagnóstico se confirma por la presencia de lesiones necróticas cerebrales focales en el tálamo, tallo cerebral y núcleo dentado. La forma de la enfermedad, que se hereda por vía materna, está producida por la mutación en el gen de la subunidad 6 de la ATPasa, T8993G, la misma que produce el síndrome de neuropatía, ataxia y retinopatía pigmentaria, pero con un porcentaje de la mutación superior a 90%. Imagen VIII. Resonancia magnética del cerebro que muestra las lesiones en los ganglios basales y el tronco cerebral, a menudo asociadas con anormalidades de la sustancia blanca del cerebro (leucodistrofia) y atrofia cerebral, o una tomografía computadorizada mostrando áreas de baja densidad (hipodensidades) simétricas y a los dos lados, en estructuras del cerebro llamadas ganglios basales . Imagen IX. Biopsia muscular, que revela la presencia de fibras musculares negativas a la citocromo c-oxidasa y de fibras rojas rasgadas. Síndrome de epilepsia mioclónica con fibras rojo-rasgadas (MERRF). Este síndrome de herencia materna, caracterizado por epilepsia mioclónica, convulsiones generalizadas y miopatía con presencia de fibras rojorasgadas. Otros síntomas clínicos son demencia, sordera, neuropatía, atrofia óptica, fallo respiratorio y cardiomiopatía. Aparece tanto en la infancia como en edad adulta y es de curso progresivo. Está asociado a la presencia de mutaciones en el gen del mtADN para el tRNALys. Síndrome de encefalomiopatía mitocondrial con acidosis láctica y episodios de accidentes cerebro-vasculares (MELAS). Encefalomiopatía mitocondrial, de herencia materna, caracterizada por accidentes cerebrovasculares producidos a edad temprana que provocan una disfunción cerebral subaguda y cambios en la estructura cerebral, y por acidosis láctica. Estos caracteres suelen ir acompañados de convulsiones generalizadas, dolor de cabeza, sordera, demencia y, a veces, presenta fibras rojo-rasgadas. Esta enfermedad ha sido asociada fundamentalmente con mutaciones en el gen del tARNLeu (UUR) del mtADN. Al igual que en la epilepsia mioclónica, las mutaciones en el Tarn dañan la síntesis de proteínas mitocondriales. Diabetes de herencia materna con sordera. Está producida por la mutación en el gen del tARNLeu(UUR), la descrita para el síndrome de (MELAS). La frecuencia de diabetes y sordera es aproximadamente de un 1.5% de la población diabética total 74.La diabetes es una de las enfermedades que se han descrito asociadas a otros síndromes mitocondriales como la encefalomiopatía mitocondrial, oftalmoplejia progresiva externa crónica, Kearns-Sayre, Pearson y diabetes insípida, diabetes mellitus, atrofia óptica y sordera (DIDMOAD). Enfermedades asociadas a reorganizaciones en el DNA mitocondria Las mutaciones puntuales, el mtADN puede sufrir otro tipo de daños como son la pérdida de parte del mismo o la adición de un nuevo fragmento del DNA (duplicaciones), que afectan a la biogénesis del sistema Oxphos y, a la síntesis de ATP. Este tipo de mutaciones suelen ser espontáneas, probablemente causadas por daños en genes nucleares que controlan la replicación del mtADN, aunque hay descritos casos de herencia materna. Síndrome de médula ósea-páncreas de Pearson. Enfermedad que aparece en los primeros años de vida y que afecta a la hematopoyesis y a la función pancreática exocrina. Las características clínicas más comunes son anemia sideroblástica con vacuolización de precursores de la médula ósea que se manifiesta con una anemia macrocítica, trombocitopenia y neutropenia. Los niños afectados suelen morir antes de los tres años de edad y los que sobreviven suelen desarrollar posteriormente el fenotipo de Kearns-Sayre. Oftalmoplejia progresiva externa crónica: Esta enfermedad está caracterizada por oftalmoplejia, ptosis bilateral de los párpados y miopatía. Se caracteriza por intolerancia al ejercicio y debilidad muscular. En el músculo se encuentran fibras rojo-rasgadas COX negativas. Es una enfermedad benigna que suele aparecer en la adolescencia o en adultos jóvenes. Síndrome de Kearns-Sayre: Este síndrome es, por otra parte, una enfermedad multisistémicos progresiva caracterizada clínicamente por CPEO, retinopatía pigmentaria atípica, ataxia, miopatía mitocondrial, bloqueo de la conducción cardiaca, elevados niveles de proteína CSF (fluido cerebro espinal, por sus siglas en inglés), sordera y demencia. Aparece antes de los 20 años de edad. Zhang, H., J. M. Pompey y U. Singh (2011), “RNA Interference in Entamoeba Histolytica: Implications for Parasite Biology and Gene Silencing”, Future Microbiology, 6, 103-117. Playán A. Diagnóstico molecular de enfermedades del DNA mitocondrial (tesis Doctoral). Zaragoza: Universidad de Zaragoza, 1999. Johns DR, Neufeld MJ, Park RD. An ND-6 mitochondrial DNA mutation associated with Leber hereditary optic neurtopathy. Biochem Biophys Res Commun 1992; 187:15511557. Brown MD, Voljavec AS, Lott MT, Torrini A, Yang CC, Wallace DC. Mitochondrial DNA complex I and III mutations associated with Leber's hereditary optic neuropathy. Genetics1992; 130:163-173. Jun AS, Brown MD, Wallace DC. A mitochondrial DNA mutation at nucleotide pair 14459 of the NADH dehydrogenase subunit 6 gene associated with maternally inherited Leber hereditary optic neuropathy and dystonia. Proc Natl Acad Sci USA 1994; 91:6206-6210.