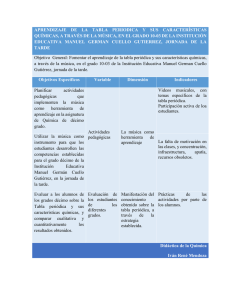
CONTENIDO 1. MOTIVACIÓN. 2. OBJETIVOS. 3.PRIMERAS CLASIFICACIONES DE LOS ELEMENTOS. 3.1. TRIADAS DE DOBEREINER. 3.2.OCTAVAS DE NEWLANDS. 4.TABLA PERIODICA DE MENDELEIEV. 5.TABLA PERIÓDICA MODERNA. 6. CONFORMACIÓN DE LA TABLA PERIODICA MODERNA. 7. TIPOS DE ORBITALES EN LA TABLA PERIÓDICA MODERNA. 8. PERIODOS. 9.DISEÑEMOS UNA TABLA PERIODICA. SABIAS QUE… EL ELEMENTO MÁS ANTIGUO DESCUBIERTO FUÉ EL COBRE EN EL 9000 AC. 2. OBJETIVOS Conocer la evolución de la tabla periódica a través del tiempo.. Entender que la tabla periódica moderna nos brinda mucha información valiosa acerca de las propiedades físicas y químicas de los elementos. Resolver problemas y ejercicios utilizando de forma correcta la tabla periódica. 4 3.PRIMERAS CLASIFICACIONES DE LOS ELEMENTOS. En el año 1830 ya se habían descubierto el 50% de los elementos químicos conocidos en la actualidad; sus propiedades físicas y químicas y sus combinaciones con otros elementos para formar compuestos habían sido estudiadas por muchos científicos ERA NECESARIO CLASIFICAR 3.1. TRIADAS DE DOBEREINER. Johann W. Döbereiner (1780-1849) Grupos de tres elementos que tenían propiedades físicas y químicas muy parecidas. Con base en sus observaciones clasificó los elementos en grupos de tres y los llamó tríadas. Mostró también que el peso atómico del elemento central de cada tríada era aproximadamente el promedio aritmético de los pesos de los otros dos. 3.2. OCTAVAS DE NEWLANDS. La Medalla Davy (Davy Medal) es una medalla de bronce que es otorgada desde 1877 por la Royal Society, de Londres. 4. TABLA PERIÓDICA DE MENDELEIEV. Ivanovich Dimitri Mendeleiev (1834-1907) Lothar Meyer (1830-1895) publicaron por separado tablas periódicas prácticamente coincidentes, en las que clasificaban los 63 elementos conocidos hasta esa fecha (entre 1830 y 1869). La clasificación de Mendeleiev hacía especial énfasis en las propiedades químicas de los elementos; mientras Meyer hacía hincapié en las propiedades físicas. 4. TABLA PERIÓDICA DE MENDELEIEV. ``Las propiedades de los elementos químicos no son arbitrarias, sino que varían con el peso atómico de una manera periódica. `` orden creciente de sus pesos atómicos en filas y columnas de modo que los elementos que quedaban en la misma columna tenían propiedades semejantes. No dudó en dejar espacios en la tabla, en invertir elementos e incluso llegó a predecir con éxito las propiedades de los elementos que algún día ocuparían los espacios vacíos. Colocó los elementos en desorden para que coincidieran las propiedades , por ejemplo colocó el telurio (masa atómica menor) antes que el yodo. 4. TABLA PERIÓDICA DE MENDELEIEV. FALLAS ? Resultó que el argón (Ar), tenía un peso atómico superior al del potasio (K), mientras que los restantes gases nobles tenían pesos atómicos inferiores a los elementos siguientes. Era evidente que no resultaba totalmente aceptable el aumento de peso atómico como referencia para ubicar los elementos en el sistema periódico. 7. TABLA PERIÓDICA MODERNA En 1913, Henry G. J. Moseley (1887-1915) sugirió que los elementos se ordenaran de acuerdo con su número atómico en forma creciente. 5. TABLA PERIÓDICA MODERNA ‘Las propiedades físicas y químicas de los elementos son función periódica de sus números atómicos’. 6. TIPOS DE ORBITALES EN LA TABLA PERIÓDICA MODERNA. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 He H s1 s2 p1 p2 p3 p4 p5 p6 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 Bloque “s” Bloque “d” Bloque “p” Bloque “f” f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 7. CONFORMACIÓN DE LA TABLA PERIÓDICA MODERNA 118 elementos que se conocen actualmente. FILAS O PERÍODOS GRUPO S O FAMILIAS 7. CONFORMACIÓN DE LA TABLA PERIÓDICA MODERNA. Grupo A 7 filas horizontales: periodos. 18 columnas verticales: grupos. Grupo A Grupo B Lantánida y Actínida 8. LOS PERIODOS El primer período representa la ocupación del primer nivel energético (n =1); el segundo período representa la ocupación del segundo nivel (n = 2) y así sucesivamente; por lo tanto, un período se caracteriza por el número cuántico principal (n). PERIODO 1 Este elemento se encuentra en abundancia en las estrellas y los planetas gaseosos gigantes. Las nubes moleculares de H2 están asociadas a la formación de las estrellas. El hidrógeno también juega un papel fundamental como combustible de las estrellas por medio de las reacciones de fusión nuclear entre núcleos de hidrógeno. Galaxia del triangulo, enorme región de hidrógeno ionizado. TAMBIEN ENCONTRAMOS EL HELIO, SEGUNDO ELEMENTO MÁS ABUNDANTE EN EL UNIVERSO. 8. LOS PERIODOS El segundo período: consta de ocho elementos; comienza con el litio (Li) (Z = 3) y termina con el neón (Ne) (Z =10). En este período se ubican el oxígeno (O) y el nitrógeno (N), gases fundamentales en la composición del aire que respiramos, y el carbono (C), materia prima fundamental de los seres vivos. Metal blando que se oxida rápidamente con el aire o agua es el elemento sólido más ligero y más brillante. Sus sales se emplean en el tratamiento de la manía y la depresión bipolar. PEGMATITAS ESPODUMENAS 8.1. SEGUNDO PERIODO El Berilio es un elemento alcalinotérreo, tóxico, de color gris, duro, ligero y quebradizo. El berilio tiene uno de los puntos de fusión más altos entre los metales. Tiene una conductividad térmica excelente, es no magnético y resiste el ataque con ácido nítrico. En condiciones normales de presión y temperatura el berilio resiste la oxidación del aire, aunque la propiedad de rayar al cristal se debe probablemente a la formación de una delgada capa de óxido. 8.1. SEGUNDO PERIODO Las moléculas formadas por un solo elemento y que poseen distinta estructura molecular se llaman alótropos. Oxígeno Puede existir como oxígeno atmosférico (O2) y como ozono (O3). 8.2. TERCER PERIODO. El tercer período: tiene igualmente ocho elementos; se inicia con el sodio (Na) (Z = 11) y termina con el argón (Ar) (Z1= 8). El sodio (del italiano soda, "sosa") fue aislado en 1807 por sir Humphry Davy por medio de la electrólisis de la sosa cáustica. Es un metal alcalino oblando. En la Europa medieval se empleaba como remedio para las jaquecas un compuesto de sodio denominado sodanum. El símbolo del sodio (Na) proviene de natrón (o natrium, del griego nítron), nombre que recibía antiguamente el carbonato sódico. 8.2. TERCER PERIODO. El magnesio es el séptimo elemento más abundante en la corteza terrestre, sin embargo no se encuentra libre, aunque entra en la composición de más de 60 minerales, siendo los más importantes industrialmente los depósitos de dolomía, dolomita, magnesita, brucita, carnalita y olivino. En este período aparece el fósforo (P) y el azufre (S), elementos importantes para la síntesis de los ácidos nucleicos y las proteínas. Debido a su reactividad, el fósforo no se encuentra nativo en la naturaleza, pero forma parte de numerosos minerales. La apatita es una importante fuente de fósforo, existiendo importantes yacimientos en Marruecos, Rusia, Estados Unidos y otros países. 8.2. TERCER PERIODO. Primera estatua construida de aluminio, ubicada en Picadilly- Londres, construida en 1893. Durante toda la Edad Media se vinculó a Satanás con los olores sulfurosos (relacionados con los volcanes, que se suponían eran entradas a los infiernos subterráneos). 8.2. TERCER PERIODO. El gas cloro, también conocido como Bertholita, fue usado como un arma en la Primera Guerra Mundial por Alemania el 22 de abril de 1915, en la Segunda Batalla de Ypres. Como lo describieron los soldados, tenía un olor distintivo de una mezcla entre pimienta y piña. También tenía gusto metálico y pungía el fondo de la garganta y el pecho. El cloro puede reaccionar con el agua en la mucosa de los pulmones para formar ácido clorhídrico, un irritante que puede ser letal. El 17 de marzo de 2007, EN IRAK, por ejemplo, tres tanques cargados con cloro fueron detonados en la provincia de Ámbar, matando a dos personas, y enfermando a más de 350. El uso en gran escala más antiguo del argón es en lámparas eléctricas o bombillas. 8.3. CUARTO PERIODO. El cuarto período: comprende un total de 18 elementos, comienza con el potasio (K) (Z 5 19) prolongándose hasta el kriptón (Kr) (Z = 36). En este período se encuentran metales como el titanio (Ti), el cromo (Cr), el hierro (Fe), el cobalto (Co), el níquel (Ni), el cobre (Cu) y el zinc (Zn) ampliamente utilizados en la industria. Es un metal ligero y liviano; es un sólido blando que se corta con facilidad con un cuchillo, tiene un punto de fusión muy bajo, arde con llama violeta y presenta un color plateado en las superficies expuestas al aire, en cuyo contacto se oxida con rapidez, lo que obliga a almacenarlo recubierto de aceite. •El potasio metal se usa en células fotoeléctricas. •El cloruro y el nitrato se emplean como fertilizantes. •El peróxido de potasio se usa en aparatos de respiración autónomos de bomberos y mineros. •El nitrato se usa en la fabricación de pólvora y el cromato y dicromato en pirotecnia. 8.3. CUARTO PERIODO. Las únicas fuentes concentradas conocidas del metal escandio , que no se encuentra en estado nativo, son minerales poco abundantes de Escandinavia y Madagascar como euxenita, gadolinita y thortveitita. Ti lámparas de vapor de mercurio se consigue una luz solar artificial de muy alta calidad. a mitad de las cromitas se extraen de Sudáfrica. También se obtienen en grandes cantidades en Kazajistán, India y Turquía capacidad de soportar temperaturas moderadamente altas sin deformarse 8.3. CUARTO PERIODO. El núcleo de la Tierra está formado principalmente por hierro y níquel en forma metálica, generando al moverse un campo magnético. Es el metal más pesado que puede producir la fusión en el núcleo de estrellas masivas; los elementos más pesados que el hierro solo pueden crearse en supernovas. 8.3. CUARTO PERIODO. El galio es un metal blando, grisáceo en estado líquido y plateado brillante al solidificar, que funde a temperaturas cercanas a la del ambiente como, el cesio, mercurio y rubidio e incluso cuando se sostiene en la mano por su bajo punto de fusión (29,7646 °C). ¿PUEDES ENCONTRAR CURIOSIDADES EN LOS TEXTOS PARA LOS ELEMENTOS QUE FALTARON? ESCRIBELAS EN TU CIADERNO, NOTA DE CUADERNO 8.4. QUINTO PERIODO. El quinto período: también con 18 elementos, comienza con el rubidio (Rb) (Z = 37) hasta el xenón (Xe) (Z = 54). En esta serie se destaca el yodo (I) por su valor biológico. El yodo es un elemento químico esencial. La glándula tiroides fabrica las hormonas tiroxina y triyodotironina, que contienen yodo. El déficit en yodo produce bocio y mixedema. Hay 37 isótopos de yodo, pero solo el I-127 es estable. El radioisótopo artificial yodo-131 (un emisor betay gamma) con un periodo de semidesintegración de 8 días se ha empleado en el tratamiento de cáncer y otras patologías de la glándula tiroidea. 8.5. SEXTO PERIODO. El sexto período: con 32 elementos, se inicia con el cesio (Cs) (Z 5 55) y termina en el radón (Ra) (Z 5 86). Se destacan el oro (Au) y el platino (Pt) como metales preciosos y el mercurio (Hg) que es el único metal líquido que existe en la naturaleza. El mercurio se utiliza principalmente para la fabricación de productos químicos industriales o para aplicaciones eléctricas y electrónicas. Se emplea en algunos termómetros, especialmente los que se usan para medir temperaturas elevadas. Una cantidad cada vez mayor se usa como mercurio gaseoso en lámparas fluorescentes, mientras que la mayoría de las otras aplicaciones se están eliminando lentamente debido a las regulaciones de salud y seguridad, siendo reemplazado en algunas aplicaciones por materiales menos tóxicos, pero considerablemente más caros. 8.6. SEPTIMO PERIODO. TRANSMUTACIÓN: conversión de un elemento químico en (Z= otro. 87) hasta el elemento El séptimo período: se extiende desde el francio (Fr) 118, ununoctio (Uuo). Este período incluye como el anterior un conjunto de 14 elementos, desde el torio (Th) (Z=90) hasta el laurencio (Lr) (Z = 103), llamados serie de los actínidos . Son elementos muy radiactivos. 8. DISEÑEMOS UNA TABLA PERIODICA. (NOTA PROCEDIMENTAL) CONSTRUIR UNA RECICLABLES. TABLA PERIÓDICA CON MATERIALES ELABORA UN PROYECTO QUE CONTENGA EL PROCEDIMIENTO, EL MATERIAL, LOS COLORES Y EL FORMATO DEL ELEMENTO A CONSTRUIR. UN ELEMENTO POR PERSONA, ADEMÁS EL PROYECTO DEBE CONTENER: AÑO DE DESCUBRIMIENTO DEL ELEMENTO, PROPIEDADES FÍSICAS Y QUÍMICAS DEL ELEMENTO, APLICACIONES EN LA ACTUALIDAD, EFECTOS SOBRE LA SALUD Y EL MEDIO AMBIENTE. 1. NOMBRE DEL PROYECTO 2. INTEGRANTES. 3. ELEMENTOS ESCOGIDOS QUE NO SE REPITAN (130). 4. MATERIALES 5. PROCEDIMIENTO 6. HISTORIA DE LOS ELEMENTOS.