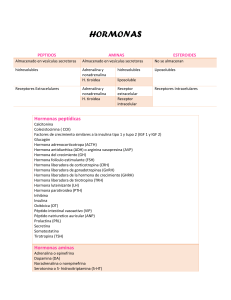
UNIVERSIDAD INDUSTRIAL DE SANTANDER ESCUELA DE INGENIERIA QUIMICA MICROBIOLOGIA INDUSTRIAL TALLER DE BIOMOLECULAS 1. Para verificar la comprensión que ud ha desarrollado durante esta segunda unidad. Elabore un diagrama circular sobre biomoléculas en donde describa la definición, clasificación y las principales características de cada una. 2. Que son las bases de schiff. y como se forman? En que ensayos de laboratorio se utiliza este fundamento? (explique). 3. Los compuestos que tienen grupos hidroxilo en carbonos adyacentes sufren una escisión en el enlace C – C, cuando se tratan con peryodato (IO4-). ¿Cómo podría utilizarse esta reacción para diferenciar los compuestos piranósicos de los furanósicos? 4. ¿Cuáles son los principales análisis que se utilizan para realizar determinaciones de aceites y grasas y cuáles son los principales métodos de extracción de los mismos? 5. Suponer que una Proteína posee seis sitios posibles de N – glicosilación. Cuantas proteínas diferentes se podría generar, según cuales sean los sitios realmente glicosilados? No tener en cuenta el efecto producido por la diversidad de carbohidratos añadidos. 6. Escribir la estructura aniónica predominante en cada uno de los siguientes amino ácidos: glicina, Treonina, Aspartato, Lisina, Serina y Prolina. 7. Cuál es la carga neta a pH 7,0; cuál sería el pI del siguiente péptido: Phe-Lys-His-Leu-Lys-Thr-Glu-Ala-Glu-Met-Lys-Ala-ser-Glu-Asp 8. La digestión de un péptido que contiene 25 residuos con BrCN genera el siguiente juego de péptidos: Lys-Asp-Arg-Gln-HSL Phe-Asp-Trp-Ser-Ala Asn-Arg-Ile-Glu-HSL Trp-Val-Arg-Leu-HSL Asp-Glu-Tyr-Lys-HSL ¿Cuál sería la carga de cada péptido a pH 7,0?. ¿Qué pasos deberíamos tomar para determinar la secuencia del péptido original? 9. UN péptido tiene la siguiente composición de amino ácido: Ala, Arg, Asp2, Glu2, Gly3, Leu, Val3. Los siguientes péptidos se aislaron después de una hidrólisis acida parcial y se determinó su secuencia: Asp-Glu-Val-Gly-Gly-Glu-Ala Val-Asp-Val-Asp-Glu Val-Asp-Val Glu-Ala-Leu-Gly-Arg Val-Gly-gly-glu-Ala-Leu-Gly-Arg Leu-Gly-Arg. Cuales la secuencia de amino ácidos del péptido inicial? 10. la fumarasa cataliza la reacción de hidratación que transforma el fumarato en L-malato. Cuando se utilizó como sustrato el fumarato, una concentración de enzima 2x10-6 M y se midió la velocidad inicial de la reacción de hidratación a pH 5,7 y a 25º C se obtuvieron los siguientes datos: Fumarato 2,0 3,3 5,0 10,0 velocidad de formación del producto (Mmol.litro-1min-1) 2,5 3,1 3,6 4,2 Calcular el valor de Km y Vmax para dichas condiciones. 11. Se mide la cinética de una enzima como función de la concentración de sustrato en presencia y ausencia del inhibidor (I), concentración a 2mM. (S) M 3 5 10 30 90 Velocidad (mol/min) sin inhibidor con inhibidor 10,4 4,1 14,5 6,4 22,5 11,3 33,8 22,6 40,5 33,8 a. Calcule los valores de Km y Vmax en ausencia y presencia del inhibidor b. De qué tipo de inhibición se trata? 12. El sitio activo de la lisozima contiene dos residuos de amino ácidos esenciales para la catálisis: Glu35 y Asp52 el Pk para el grupo el carboxilo son 5,9 y 4,5. Cuál es el estado de ionización para cada residuo a pH 5,2 (pH óptimo)? cómo puede el estado de ionización de estos residuos explicar el perfil de actividad- pH de la lisozima?