Neumonía Nosocomial: Factores de Riesgo, Diagnóstico y Tratamiento
Anuncio

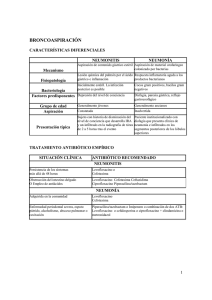
La neumonía nosocomial se refiere a la neumonía adquirida mientras que en un hospi- tal (de la palabra latina nosocomium, que significa “el hospital”). Se divide clásicamente en neumonía adquirida en el latina nosocomium, que significa “el hospital”). Se divide clásicamente en neumonía adquirida en el latina nosocomium, que significa “el hospital”). Se divide clásicamente en neumonía adquirida en el hospital (HAP) y la neumonía asociada a la ventilación mecánica (NAV), pero recientemente se ha aplicado también a la neumonía asociada a cuidados sanitarios (HCAP). la Sociedad American Thoracic Society y Enfermedades Infecciosas de América directrices para la gestión de HAP, VAP, y HCAP designan las siguientes exposiciones ambulatorios como factores de riesgo para infecciones tantes tencia y aconsejó empíricamente el manejo de estos pacientes de una manera similar a la HAP : terapia antimicrobiana dentro de los 90 días anteriores; hospitalización por 2 o más días dentro de los 90 días anteriores; residencia en un hogar de ancianos o centro de atención prolongada; crónico hemodiálisis; infusiones caseras de antibióticos o la quimioterapia; enfermedad inmunosupresiva, tratamiento, o ambos; cuidado de heridas casa; un miembro de la familia con patógeno multirresistente; y una reciente visita a un hospital o clínica de hemodiálisis Algunas series de casos documentan Staphylococcus aureus resistente a la meticilina (MRSA), Pseudomonas, Acinetobacter y patógenos gramnegativos entéricos hasta en un 40%_58% de los pacientes con HCAP positivos para cultivo. Otras series, sin embargo, documentaron estos patógenos solo en raras ocasiones (3% a 12% de pacientes cultivo positivo)o en números intermedios de pacientes (22% a 30% de pacientes con cultivo positivo). 8-12 Staphylococus aureus, Enterobacteriaceae, Pseudomonas, y especies de Acinetobacter . La probabilidad de que estos organismos sean la resistencia a los medicamentos aumenta constantemente con el tiempo en un hospital, la exposición a antimicrobianos y severidad de la enfermedad. Orogástrica y nasogástrica los tubos de alimentación rompen el esfínter esofágico inferior y aumentan riesgo de aspiración de contenido gástrico Simultáneamente, la presencia de un tubo endotraqueal interrumpe la depuración ciliar normal de secreciones bronquiales y afecta la capacidad de los pacientes para toser. Secreciones por lo tanto, acumularse por encima del manguito del tubo endotraqueal y filtrarse intermitentemente alrededor de pliegues en el manguito, particularmente si el manguito está inflado demasiado o si se desplaza durante el movimiento del paciente o reposicionamiento. Biofilm comienza a forma tanto dentro como fuera del tubo endotraqueal dentro de un día de colocación y sirve como un depósito bacteriano dentro de la tráquea y 51 52 orofaringe Aspiración o instilación de aerosoles a través de el tubo traqueal puede movilizar y embolizar bacterias de la biopelícula en los pulmones. Enfermedad crítica, mala nutrición e inmovilización pueden aumentar la susceptibilidad de los pacientes a la infección. Estos factores interactúan y reforzar entre sí para aumentar el riesgo de microaspiración y la probabilidad de que la colonización del parénquima pulmonar conduzca a la infección invasiva. 50 53 FACTORES DE RIESGO Factores que aumentan el riesgo de aspiración aumenta la probabilidad de infección Estos incluyen factores mecánicos tales como intubación de emergencia, reintubación, duración de la intubación, posición supina, alimentación enteral mediante el uso de tubos orogástrica o nasogástrica , uso de agentes paralíticos y desinflado del manguito de tubo endotraqueal ; factores que afectan el estado mental como el nervioso central enfermedad del sistema, nivel de conciencia y nivel de sedación; factores que aumentan la carga microbiana bacteriana en las vías respiratorias superiores y tractos orogástricos, como la duración de la hospitalización, la intubación nasogástrica, exposiciones prolongadas a los antibióticos y el uso de inhibidores de la bomba de protones u otros supresores del ácido gástrico; factores que aumentan manejo o ruptura del circuito del ventilador, como el agonista β inhalado terapia, o ambos; y factores del paciente como la edad, el pulmón preexistente enfermedad y severidad de la enfermedad. el transporte fuera de la UCI para imágenes de diagnóstico o procedimientos son factores de riesgo adicionales Pacientes quirúrgicos en general, y quemadura y pacientes con trauma en particular, tienen mayores tasas de VAP que los médicos pacientes. Diagnostico Definiendo VAP como un nuevo infiltrado radiográfico y dos signos adicionales: leucocitosis, fiebre o secreciones respiratorias purulentas-era 65% sensible y 36% específico. Definir VAP más estrictamente requiriendo infiltrados radiográficos y los tres signos leucocitosis, fiebre y las secreciones respiratorias purulentas aumentaron la especificidad al 91% pero cayeron sensibilidad al 16%. Además, requiere cultivos positivos (aspiración traqueal cultivo con organismo patógeno, sin umbral mínimo de crecimiento) elevó la especificidad de las definiciones tanto estrictas como estrictas al 93% y 99%, respectivamente, pero con un costo adicional en sensibilidad. Pacientes hospitalizados en general, y con ventilación crítica 66,67 pacientes en particular, están en riesgo de una gran cantidad de complicaciones pulmonares incluyendo edema pulmonar, atelectasia, enfermedad tromboembólica, síndrome de dificultad respiratoria aguda (SDRA), reacciones de hipersensibilidad y hemorragia además de la neumonía. Todos estos plicaciones tienden a presentarse con alguna combinación de un común conjunto básico de signos clínicos: fiebre, leucocitosis, alteración de la oxigenación, cambios en el carácter y la cantidad de producción de esputo, y infiltrados radiográficos Fisiopatologia El sello histológico de VAP es la heterogeneidad. Los pulmones de los pacientes tratados con frecuencia son notables en áreas dispersas de la inflamación Las áreas dependientes tienden a verse afectadas más a menudo que las áreas no dependientes. Diferentes organismos pueden ser cultivados de diferentes segmentos pulmonares del mismo paciente en 25% a 37% de casos. Culturas de segmentos pulmonares de histológico benigno a menudo son positivos Los factores microbiológicos, estructurales y humorales se combinan para aumentar el riesgo de neumonía en pacientes críticamente enfermos RECOMENDACIONES PARA EL DIAGNOSTICO La mejor evidencia disponible sugiere que el examen clínico puede alertar médicos a la posibilidad de VAP pero que es insuficiente para definitivamente gobernar o descartar la neumonía. Examen de esputo o Las muestras BAL pueden ayudar a refinar las sospechas clínicas. La ausencia de organismos en la tinción de Gram o menos del 50% de neutrófilos en líquido BAL ayudar a excluir el diagnóstico. La ausencia de nuevos infiltrados hace que la neumonía sea poco probable, pero su presencia no es específica. Ninguno de estos hallazgos son lo suficientemente poderosos para establecer o refutar un diagnóstico de VAP definitivamente. Los médicos que atienden a pacientes con ventilación con una síndrome clínico compatible con VAP debe tener un umbral bajo para considerar diagnósticos adicionales e investigaciones adicionales, particularmente si una prueba empírica de antibióticos no mejora en 48 a 72 horas. Evaluación microbiológica 47,48 aspecto 98 Es importante tratar de establecer un diagnóstico microbiológico para asegurar la cobertura del patógeno (s) activo y minimizar la exposición a agentes innecesarios. Terapias Inadecuadas o tardías aumenta el riesgo de mortalidad. Los cultivos de sangre y respiratorios se indican en todos los pacientes. Los virus pueden representar hasta un tercio de los casos de neumonía grave y puede ser transmitida en los hospitales Por lo tanto, los estudios virales se indican en los períodos de endemicidad, en pacientes inmunocomprometidos, y en pacientes con difusas en vidrio deslustrado en la TC Muestreo del tracto respiratorio Hay disponibles varias opciones para el muestreo del tracto respiratorio, incluyendo aspirados endotraqueales, BAL y cepillo de especímenes protegidos. Estos a su vez pueden analizarse cualitativa o cuantitativamente. Ahi ha habido una gran controversia sobre si los clínicos deberían adquirir muestras con técnicas invasivas (BAL o procepillos para muestras) o técnicas no invasivas (endotraqueal aspirados). Esta pregunta ahora ha sido evaluada en cinco asignaturas aleatorias, Todos menos uno no encontraron diferencias en las tasas de mortalidad. Un metanálisis de todos cinco ensayos tampoco encontraron diferencias en el resultado de ningún paciente, incluido la frecuencia de los cambios antibióticos. El muestreo invasivo se reservará en consecuencia para pacientes con aspiración endotraqueal negativa. 111 muchos pacientes hospitalizados tienen pulmones anormales en la admisión que complica aún más la interpretación de las radiografías, alteración del oxígenación y producción anormal de esputo. Estos incluyen cánceres, cicatrices de cirugías previas, bronquiectasias, enfermedad pulmonar obstructiva, pulmonary fibrosis, y, en el caso de pacientes traumáticos, contusiones, laceraciones, hemorragia pulmonar, lesiones por inhalación o una combinación de estos.