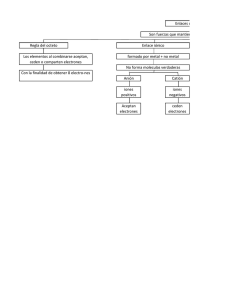
INTRODUCCIÓN Un enlace es la unión entre los átomos de un compuesto. La unión o enlace entre los átomos tiene su origen en la estructura electrónica de los mismos. La actividad química de los elementos radica en su tendencia a adquirir, mediante su unión con otros átomos, la configuración de gas noble (ocho electrones en la capa más externa, salvo el helio que sólo tiene dos), que es muy estable. Es corriente distinguir tres tipos principales de enlaces químicos: iónico, covalente y metálico; de los cuales se hablará más extensamente después. Aunque dichos enlaces tienen propiedades bien definidas, la clasificación no es rigurosa, existiendo una transición gradual de uno a otro, lo que permite considerar tipos de enlace intermedios. Gracias a estos enlaces se forman los compuestos químicos, por ejemplo, la sal. La sal común es una sustancia bien conocida. Es utilizada para conservar y aderezar alimentos. Nuestra sangre posee casi la misma proporción de sal que el agua del mar, y es fundamental para mantener muchas de nuestras funciones vitales. Está formada por un no metal, el cloro y un metal alcalino, el sodio. Ambos en estado puro son extremadamente peligrosos para el hombre, sin embargo, forman juntas una sustancia, la sal común, que es inocua en pequeñas cantidades. Se dice por tanto que han formado un compuesto químico, una sustancia muy diferente de los elementos que la componen. Muchas de las sustancias que conocemos están formadas por uniones de distintos elementos. El azúcar, por ejemplo, está formado por oxígeno, hidrógeno y carbono. Estos átomos que pierden o ganan electrones para unirse se transforman en iones, átomos con carga eléctrica. Estos iones se unen para formar compuestos químicos, y la forma de unirse entre ellos se denomina enlace químico, del cual se va a hablar en este trabajo. OBJETIVOS • • Determinar atreves de sus propiedades el tipo de enlace químico que mantiene unido a los átomos y las fuerzas intermoleculares existen. Predecir en los compuestos problemas de tipo de enlace químico y fuerza intermolecular utilizando las leyes y experiencias dentro del laboratorio. MARCO TEORICO Según valencia. (2016) afirma. Que “desde los comienzos de la química como una ciencia, ha emprendido el cambio para comprender por qué y cómo se unen los átomos para general sustancias químicas, al igual de por qué ciertos elementos una reactividad casi nula, los cuales fueron llamados gases nobles o inertes”. Se vuelven natural a tendencia de los átomos por adquirir dicha una configuración cuando se alcanza entre sí, lo que les permite existir como sustancia pura al ceder, recibir o compartir electrones. Tipos de enlaces químicos Enlace iónico: formado por enlaces metálicos y no metálicos Enlace covalente: formado por enlaces no metales. ENLACE IÓNICO el enlace iónico consiste en la unión entre un elemento no metal y metal. Para justificar este concepto tomaremos en consideración lo que conceptualizan Picado & Álvarez (2008) mencionan que “El enlace iónico es el que se forma por transferencia total de uno o más electrones entre los átomos”. Con esto entendemos que son enlaces iónicos o electrovalentes son aquellos elementes que tienden ganar o perder electrones. ENLACE COVALENTE Los enlaces covalentes son distintos de los enlaces iónicos, en los que ocurre una transferencia de electrones y que dan entre elementos metálicos. Esto último además forman moléculas cargadas eléctricamente con iones llamados también aniones negativos y cationes positivos. A este concepto podemos agregar lo que menciona Adkins (2006) menciona que “el enlace covalente es el comportamiento d electrones entre elemento no metálicos”. Con esto nos hace entender de que los elementos que comparten electrones tienden a ser mas estables en su enlace. SOLUBILIDAD La solubilidad es una medida de la capacidad de una determinada sustancia para disolverse en otra. Puede expresarse en moles por litro, en gramos por litro, o en porcentaje de soluto; en algunas condiciones se puede sobrepasarla, denominándose a estas soluciones sobresaturadas. El método preferido para hacer que el soluto se disuelva en esta clase de soluciones es calentar la muestra. La sustancia que se disuelve se denomina soluto y la sustancia donde se disuelve el soluto se llama disolvente. No todas las sustancias se disuelven en un mismo solvente, por ejemplo en el agua, se disuelve el alcohol y la sal. El aceite y la gasolina no se disuelven. En la solubilidad, el carácter polar o apolar de la sustancia influye mucho, ya que, debido a estos la sustancia será más o menos soluble; por ejemplo, los compuestos con más de un grupo funcional presentan gran polaridad por lo que no son solubles en éter etílico. MATERIALES, REACTIVOS Y EQUIPOS MATERIALES: ➢ ➢ ➢ ➢ ➢ ➢ ➢ 09 tubos de ensayo 10 y 100 ml. 02 gradillas. 03 probetas de 10 ml. 04 pipetas de 5 ml Vasos de precipitados de 100 ml. 03 probetas de 50 ml. 02 pipetas. REACTIVO: ➢ ➢ ➢ ➢ ➢ ➢ 5 ml de agua destilada. 0.5 g de yoduro de potasio. 0.5 g de cloruro de sodio. 0.5 g bromuro de potasio. 5 ml de tetracloruro de potasio. 5 ml de etanol. EQUIPO: ➢ Balanza. PROCEDIMIENTO: 1. Numerar los tubos de ensayo de 1 al 9 y colocar en cada una 0.5 g de las siguientes sustancias. Tubos Reactivos 1 2 3 5 ml de agua destilada 4 5 6 5 ml de tetracloruro de carbono 7 8 9 5 ml de etanol 2. Agregar a cada fila de tubos enumerados 0.5 g de NaCl, KBr y KI. Tubos Reactivos 1 6 9 0.5 g de NaCl 2 5 8 0.5 g de KBr 3 4 7 0.5 g de KI 3. Agitar cada una de los tubos de ensayo y observar si se disolvió el sólido registrado. 4. Registra los resultados experimentales en la tabla como muy soluble poco soluble o nada soluble. RESULTADO Disolvente solido NaCl KBr KI Agua destilada (e.c) poco soluble Muy soluble Poco soluble Tetracloruro de carbono (e.cp) Nada soluble Nada soluble Nada soluble Etanol(e.ca) Muy soluble Poco soluble Muy soluble En los resultados que obtuvimos notamos que algunas soluciones mostraron las capacidades de solubilizarse o no solubilizarse dependiendo al tipo de enlace que pudimos identificarlos como enlace covalente polar, covalente apolar u iónico, los cuales los reactores tuvieron una solubilidad parcial o total con solventes utilizados en la determinación de enlaces mediante la solubilidad. DISCUCIONES Según Valenzuela. (1994) afirma Que “el enlace químico se puede definir, de manera elemental, como la energía responsable de la unión entre entidades químicas. Dado que tanto los átomos como las moléculas, son entidades químicas, cabe distinguir dos tipos generales de enlace: enlaces interatómicos y enlaces intermoleculares”. Con esto nos aseguramos de que algunos elementos o sustancias tienden a solubilizarse con facilidad gracias a los catalizadores, como es el caso de la agitación de las soluciones preparadas, em algunos casos de solubilidad de diferentes enlaces pueden necesitar ayuda de otros factores para la unión de átomos de disolventes con los solventes ya sean orgánicos o inorgánicos. Según Andrés & Beltrán. (2000) afirma. Que una molécula está formada por un conjunto de núcleos atómicos (cargas positivas) inmerso en un mar de electrones (cargas negativas) que están deslocalizados alrededor de los núcleos según la correspondiente función de onda eléctrica de la molécula. Las interacciones electrostáticas entre las partículas cargadas son la causa fundamental de la cohesión de las moléculas. La posición relativa de los núcleos y la distribución de los electrones entre ellos determinan el conjunto de enlace de molécula. Esto proceso ocurre gracias a la unión de iones de los elementes permitiéndoles así una solubilidad un poco más fácil de CONCLUCION • No siempre se cumple que los compuestos covalentes sean insolubles en agua destilada o con sustancias iónicas , tal es el caso del tetracloruro de carbono y el metanol, ya que, al poder disolverse en agua destilada, se disocian liberando iones H+ junto con cloruro de sodio y yoduro de potasio respectivamente. Lo cual favorece la solubilidad parcial o total, quedando así demostrado que es incorrecto afirmar al 100% que los compuestos covalentes son insolubles con enlaces iónicos. • En conclusión, pudimos demostrar la solubilidad de enlaces covalentes polar , apolar y iónico siguiendo los conceptos de enlaces iónicos para luego proceder con la experimentación de laboratorio y sacar resultados para entender mejor el enlace químico y su capacidad de solubilizarse con algunas excepciones. CUESTIONARIO ¿Qué tipo de enlaces presenta utilizados?¿explique cada uno? cada uno de los reactivos el agua es u enlace covalente común, mientras que el tetracloruro de carbono es un tipo de enlace covalente polar y el etanol tiene un enlace covalente apolar, podemos decir que los tres reactivos son de enlaces covalentes de diferentes características. ¿Cómo se forman los enlaces metálicos? El enlace metálico se produce cuando se combinan metales entre sí. Los átomos de los metales necesitan ceder electrones para alcanzar la configuración de un gas noble. En este caso, los metales pierden los electrones de valencia y se forma una nube de electrones entre los núcleos positivos. Realice un cuadro de diferencias d enlace iónico y covalente Enlace iónico Hay perdida de electrones o ganancia de electrones No se forman moléculas aisladas, se forman redes cristalinas Se da entre elementos de electronegatividad muy diferentes Enlace covalente Comparten electrones Se forman moléculas Se da entre elementos de electronegatividad muy parecidas y altas La unión se mantiene por la fuerza de La unión se mantiene por la atracción atracción entre cargas negativas y entre las cargas positivas de los positivas que se forman núcleos y las cargas negativas de los electrones que se comparten ¿Por qué las sustancias se mezclan o son solubles? Se mezclan o solubilizan debido a que los enlaces que posee cada sustancia, ya sea iónico, covalente o metálico, varían dependiendo alos factores o cambios que se presentan durante la solubilidad o mezcla de determinadas sustancias. BIBLIOGRAFÍA ❖ Anda Cardenas , (2006). QUIMICA 1. Mexico: SOCIO editorial ❖ Andres, J., & Beltran, J. (2000). COMPUTACIONAL. fotocopias libres. QUIMICA TERORICA Y ❖ Valenzuela Calahorro, C. (1994). QUIMICA GENERAL. Madrid: ROGAR editorial. ❖ Peter William Atkins, Loretta Jones (2006).PRINCIPIOS DE QUÍMICA; 3ª edición; panamericana editorial; universidad de Oxford.pag.52 ❖ Ana Beatriz picado & Milton Álvarez.(2008).QUÍMICA I ;1ª edición ;EUNED editorial; costa rica san José;pag.245-253 Bibliografía Anda Cardenas , P. (2006). QUIMICA 1. Mexico: SOCIO. Andres, J., & Beltran, J. (2000). QUIMICA TERORICA Y COMPUTACIONAL. fotocopias libres. Valenzuela Calahorro, C. (1994). QUIMICA GENERAL. Madrid: ROGAR. Valenzuelas Calahorro, C. (1994). Quimica General. Madrid: ROGAR.