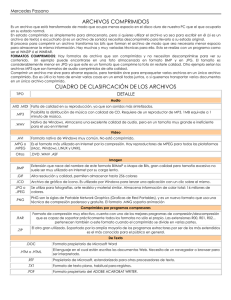
anticoncepción y cáncer de cérvix
Anuncio

Boletín Oficial Nº 20 Diciembre 2012 SOCIEDADE GALEGA DE CONTRACEPCION CONTENIDOS 1.-ANTICONCEPCIÓN CON SÓLO GESTÁGENO ................................................................. 3 2.-ANTICONCEPCIÓN Y CÁNCER DE CÉRVIX .................................................................... 6 3.-MIGRACIÓN DE IMPLANTE ANTICONCEPTIVO. CASO CLÍNICO .................................... 11 4.-¿AFECTAN LOS ANTICONCEPTIVOS HORMONALES AL DESEO SEXUAL ...................... 13 5.-ANTICONCEPCIÓN Y CÁNCER DE MAMA ..................................................................... 19 6.-S.O.P. SÍNDROME METABÓLICO. CÁNCER GINECOLÓGICO .......................................... 21 7.-NOVEDADES DE LOS ÚLTIMOS DIEZ AÑOS EN ANTICONCEPCIÓN ............................... 27 8.-TRATAMIENTO HORMONAL DE LA ENDOMETRIOSIS ................................................... 30 SOCIEDADE Edita: SO.GA.C. I.S.S.N. N.º 1699-8464 Colegio Oficial de Médicos de Pontevedra C/ Echegaray nº 8 36002 Pontevedra Directiva SOGAC Presidente: Vicepresidente: Tesorero: Secretario: Vocales: Javier Valdés Pons Javier Castrillo Gutiérrez David Gómez Sánchez Martina Freire Comedeiro Cándido Amorín Fiuza Concepción Moreno López Rafaela Dopazo Rodríguez Luís Miguel González Seijas Comité Editorial: Eduardo Yáñez González Martina Freire Comedeiro Javier Valdés Pons Cándido Amorín Fiúza Eva García Calvo Javier Castrillo Gutierrez David Gómez Sánchez GALEGA DE CONTRACEPCION Saluda Queridos socios, en este número veinte de nuestro boletín, os presentamos, además de otros trabajos que teníamos pendientes de publicar, algunas ponencias del V Congreso de la SOGAC , celebrado en Ribeira , A Coruña, los días 28 y 29 de Septiembre. Nos enorgullece decir que el Congreso transcurrió con una gran asistencia, gran número de inscritos y una alta calidad científica donde destacamos ponentes como Rafael Sánchez Borrego,Iñaki Lete Lasa,José Eloy Moral Santamarina, Jose Luis Doval Conde, amén de otros compañeros que presentaron sus trabajos con una gran profesionalidad como Luis Miguel González Seijas Jaime Dapena, Paulino Pérez Pérez,Vanesa Buján Costas,Fracisco de la Fuente Pozas,Elba Carballo, Jorge Cameselle Teijeiro,Isolina Bonacho Paniagua, Maria Jose Carballo, Pilar Lorenzo Vilar, Paula Gonzalez Gil, Manuel Genaro Gutiérrez, Margarita Gil Andrés, Alberto Ribera Fernández , Maria Pilar Santiago Miniño, Eva Guldrís Nieto,destacando entre nuestros asociados al presidente de la SOGAC Javier Valdés y al veterano expresidente Eduardo Yáñez que dirigió un interesante taller práctico sobre implantes anticonceptivos. Agradecemos a todos su colaboración. Anunciamos un nuevo formato para nuestro boletín en los próximos números de manera que siga avanzando en la manera en que también lo hace nuestra Sociedad. Os animamos a todos a participar de ella en próximos proyectos y reuniones de manera que pueda servir como vehículo de formación e información sobre salud sexual y reproductiva. Luís Miguel González Seijas El comité editorial SOGAC : N.I.F. G- 36064848/001 La SOGAC no se hace responsable de las opiniones expresadas en los artículos. Imprime: Gráf. ANDURIÑA D.L.: PO 36-2002 2 SOCIEDADE GALEGA DE CONTRACEPCIÓN ANTICONCEPCIÓN SÓLO GESTÁGENOS. Evidencias científicas actuales Vanesa Buján Costas. Complexo hospitalario Universitario de Vigo. V Congreso SOGAC. Riveira 2012. -Reducción de la dismenorrea y el dolor pélvico en endometriosis (DIU-LNG) (2). Introducción La planificación familiar es un aspecto que trasciende los aspectos reproductivos y tiene influencia sobre la salud física, mental y social de las mujeres. El personal sanitario tiene la responsabilidad de dar la información adecuada a la mujer para que ella misma pueda participar en el proceso de selección de su método anticonceptivo ideal. Los métodos sólo gestágenos van a ser métodos adecuados para cualquier mujer que desee una anticoncepción eficaz y que acepte las alteraciones en el ciclo que puedan producirse con el uso de los mismos. La única situación en la que el empleo de métodos sólo gestágenos va a estar completamente contraindicado es en la presencia de cáncer de mama actual (Categoría 4). En la tabla 2 se encuentran aquellas situaciones médicas consideradas como categoría 3 para el empleo de métodos sólo gestágenos. • Lactancia materna >6 sem postparto. • Múltiples FR cardiovascular. AMPD/NE. Los mecanismos de actuación abarcan desde la supresión de la ovulación con la inhibición de la LH, el espesamiento del moco cervical, la reducción de la movilidad espermática, la inhibición de la capacitación espermática, la reducción de la movilidad tubárica y la atrofia endometrial. Los métodos sólo gestágenos de los que disponemos son la píldora de desogestrel, gestágeno inyectable, dispositivo intrauterino de levonorgestrel y el implante subcutáneo. Todos ellos van a ser métodos muy eficaces ya que su índice de Pearl es inferior a la unidad (Tabla 1). Método anticonceptivo • AP cáncer de mama sin evidencia de recaída en 5 años. • HTA sist.>160-100/enfermedad vascular. • Cirrosis descompensada. AMPD/NE. • Nefro/neuro/retinopatía diabética. AMPD/NE. • Adenoma hepatocelular o tumoración hepática maligna. • Tratamiento concomitante con antirretrovirales con • TEV/TEP aguda. inhibidores de la proteasa / anticonvulsivantes / rifampicina • Hª personal de ictus. (Continuación). o rifabutina. PP. • LES con Ac antifosfolípido + • Migraña con aura. (Continuación). Tabla 2. OMS Medical eligibilityty criteria for contraceptive use (3). AMPD: acetate medroxiprogesterona depot. NE: noretisterona. Píldora sólo gestágeno Índice de Pearl Gestágeno inyectable 0,3 DIU-LNG 0,1 Implantes subcutáneos 0,08 Píldora de Desogestrel 0,41 • Sangrado vaginal inexplicado, con sospecha de patologia grave (antes de evaluación). Está compuesta por 75mg de desogestrel. Produce una inhibición de la ovulación en el 97% de los casos. Dada su poca acción androgénica va a tener un escaso impacto en el metabolismo de los lípidos y en la tensión arterial. Por su administración oral los fármacos inductores enzimáticos van a presentar interacción ya que experimenta primer paso hepático. Las alteraciones menstruales van a ser la causa más frecuente de abandono del método. Tabla 1.-Índice de Pearl de los diferentes métodos anticonceptivos. Implante subcutáneo Los métodos sólo gestágenos van a poder ser empleados por cualquier mujer fundamentalmente en aquellas situaciones en las que los estrógenos no estén recomendados como en pacientes con migraña, en el postaborto tanto precoz como tardío, en el postparto, en fumadoras de edad superior a 35 años, en patologías como hipertensión arterial o valvulopatías. También van a poder ser empleados durante la lactancia. El empleo de acetato de medroxiprogesterona puede reducir las crisis de dolor en pacientes con drepanocitosis (1) . De todos los métodos sólo gestágeno es el más eficaz ya que presenta el índice de Pearl más bajo. Se dispone de dos implantes: el compuesto de levonorgestrel, finalizada su comercialización en 2010, y el de etonorgestrel. El primero presenta dos varillas de 75mg de levonorgestrel, su duración es de cinco años, no es radiopaco y el peso de la paciente influye en la concentración sérica de levonorgestrel de tal forma que se recomienda su retirada a los cuatro años si el peso es superior a los 80kg. Los métodos de sólo gestágeno que han probado tener algún beneficio no contraceptivo son: el dispositivo liberador de levonorgestrel (DIU-LNG), el acetato de medroxprogesterona depot (AMPD) y los implantes subdérmicos, en las siguientes indicaciones: En el caso del implante de etonorgestrel en la actualidad disponemos de un dispositivo que permite una mayor facilidad y seguridad en su inserción. Su duración es de tres años y es radiopaco y el peso no afecta a su eficacia. -Reducción de la menorragia e hipermenorrea (DIULNG, AMPD, implante). Inyectables -Protección del endometrio en Terapia hormonal (DIULNG). Está compuesto 150mg de acetato de medroxiprogesterona en disolución. La pauta de administración es cada 3 SOCIEDADE GALEGA DE CONTRACEPCIÓN En el episodio agudo pueden emplearse sin que exista una evidencia clara anticonceptivos orales combinados de forma continuada o cíclica durante un periodo máximo de tres meses, siempre que no esté desaconsejado el empleo de estrógenos. 12 semanas e intramuscular aunque podría retrasarse hasta 4 semanas su administración sin perder eficacia. No presenta interacciones pero si modifica el patrón de sangrado. Es un tratamiento eficaz, seguro, cómodo y de bajo coste en el dolor pélvico en endometriosis (4). Otras posibilidades serían el empleo de progesterona a altas dosis también durante un periodo máximo de tres meses, el uso de antiinflamatorios o la la doxiciclina. Como inconvenientes está descrita una variación en el peso de hasta 2 kg en 2 años, provoca una disminución de la masa ósea que suele ser reversible con el cese del tratamiento, la recuperación de la fertilidad puede demorarse hasta un año mientras que en los otros métodos sólo gestágeno la recuperación es inmediata. Se ha planteado el empleo de mifepristona sóla o en combinación con etinilestradiol aunque su uso no está autorizado y podría comprometer la eficacia del método ya que la mifepristona es un antiprogestágeno (8). Controversia. Evidencias No están descritos quistes foliculares como en los otros gestágenos. 1.-Lactancia materna Existe en otros países la presentación subcutánea de acetato de medroxiprogesterona. Tiene una dosis de 104mg de acetato de medroxiprogesterona y tiene la ventaja de poder ser autoadministrada por la paciente. Está aprobada para el manejo del dolor en la endometriosis. Los métodos sólo gestágeno durante la lactancia presentan una eficacia superior al 99%. El patrón de sangrado es más aceptable en esta circunstancia ya que la mayor parte de las mujeres se encuentran en amenorrea. Dispositivo intrauterino liberador de levonorgestrel La OMS recomienda no iniciar el uso de estos métodos antes de las seis semanas postparto aunque la evidencia muestra que estos fármacos no afectan a la calidad ni volumen de la leche y no afectan al desarrollo del lactante (3). Ampliamente utilizado en nuestro medio. Consta de un depósito de 52mg de levonorgestrel con membrana de silastic. Su duración es de cinco años. No afectan a la efectividad fármacos inductores enzimáticos, su inserción puede realizarse en cualquier momento del ciclo El DIU de levonorgestrel puede emplearse desde las cuatro semanas postparto (4). Es seguro en mujeres con sangrado uterino disfuncional, síndrome premenstrual, dismenorrea, y/o endometriosis. Por lo que la mujer con adecuado asesoramiento podría emplear los métodos sólo gestágeno antes de las seis semanas postparto. Ofrece numerosas ventajas en la disminución de la dismenorrea, como tratamiento de primera elección en menorragia (5,6), reduce el riesgo de embarazo ectópico y de enfermedad inflamatoria pélvica, si se produce gestación no hay evidencia de efectos teratógenos y proporciona protección endometrial en tratamiento hormonal substitutivo con estrógenos. 2.-Cáncer de mama No hay evidencia de que aumente el riesgo de cáncer de mama con el empleo de anticonceptivos sólo gestágeno. Se ha observado un ligero incremento en mujeres jóvenes que habían iniciado el tratamiento antes de los 25 años o aquellas con diagnóstico de cáncer de mama antes de los 35 años. Entre sus efectos secundarios se encuentra la alteración del patrón de sangrado y los efectos hormonales secundarios (tensión mamaria, cambios de humor, acné). En el subgrupo de mujeres con uso reciente de métodos sólo gestágenos (menos de cinco años) también se ha observado un ligero aumento del riesgo aunque no mayor que con el uso de anticonceptivos combinados. En cuanto a los quistes de ovario se ha visto una frecuencia aumentada en los tres primeros meses de uso aunque una revisión sistemática no identificó un aumento de riesgo de quistes de ovario en usuarias de DIU-LNG a los cinco años comparado con usuarias de DIU de cobre (RR 1.5: 95% IC 0.51-4.4)(7). El aumento del riesgo relativo en estos subgrupos tiene una difícil interpretación y puede representar un sesgo de revisión (9). Manejo del patrón de sangrado El cese del tratamiento se asoció con un descenso del riesgo de cáncer de mama. La alteración en el patrón de sangrado se produce fundamentalmente en los primeros meses de uso que generalmente se resuelve sin tratamiento. La mayor parte de los métodos sólo gestágeno producen una reducción del sangrado al año. 3.-Otros cánceres ginecológicos Está demostrado que el empleo de métodos sólo gestágeno reduce el riesgo de cáncer de endometrio. Incluso en el caso del empleo de acetato de medroxiprogesterona esta reducción alcanza el 80%(10). Por lo que se recomienda realizar una anamnesis orientada y tranquilizar e informar a la paciente (2). 4 SOCIEDADE GALEGA DE CONTRACEPCIÓN gesterona depot ya que no está aumentado el riesgo de hematoma en lugar de inyección ni de sangrado vaginal (3). No aumenta el riesgo de cáncer de cérvix. No aumenta el riesgo de cáncer de ovario. Estudios a gran escala realizados por el Centro para el Control de las Enfermedades de EE.UU. y el RCGP indican que la supresión de la ovulación causada por los anticonceptivos orales protege contra el desarrollo del cáncer epitelial ovárico. 6.-Interacciones medicamentosas La píldora sólo gestágeno y el DIU de levonorgestrel no parecen tener efecto sobre la DMO (9). Los anticonvulsivantes (fenitoína, carbamazepina, barbitúricos, primidona, topiramato, oxcarbazepina) son considerados categoría 1 para el inyectable de acetato de medroxiprogesterona, categoría 2 para el DIU de levonorgestrel y categoría 3 para la píldora de desogestrel. El uso prolongado de acetato de medroxiprogesterona depot se asocia con pérdida de masa ósea que suele ser reversible tras la discontinuación del tratamiento. Pueden emplearse sin restricciones en el caso de uso concomitante de lamotrigina o antibióticos de amplio espectro. Deben recomendarse normas de estilo de vida que favorezcan el mantenimiento de la masa ósea (dieta saludable, ejercicio físico, cese hábito tabáquico). Rifampicina/Rifabutina pueden reducir la eficacia de la píldora sólo gestágeno. 4.-Efecto sobre la densidad mineral ósea (DMO) En el caso de los antirretrovirales y empleo de métodos sólo gestágeno se consideran seguros y eficaces aunque debe recomendarse igualmente el empleo de preservativo para evitar la transmisión del VIH. Se aconseja prudencia en el uso en el caso de que existan factores de riesgo como en el caso de pacientes fumadoras, atletas, anorexia nerviosa, perimenopausia o terapia prolongada con corticoides (11). Conclusiones En la gráfica uno se observa la evolución de la DMO con el empleo y cese del tratamiento con el inyectable de acetato de medroxiprogesterona. Debemos asegurar que al suspender el tratamiento la paciente dispone de tiempo suficiente para recuperar su masa ósea, por ejemplo en pacientes perimenopáusicas. • Útiles en cualquier demanda anticonceptiva • Si contraindicación estrógenos • Eficaces y seguros • Efectos beneficiosos no contraceptivos. Bibliografía Discontinuer of DMPA Nonuser Spine BMD (g/cm2) (1) Manchikanti A, Grimes DA, Lopez LM, Schulz KF. Steroid hormones for contraception in women with sickle cell disease. Revisión Cochrane 2007. (2) Conferencia de Consenso Madrid 2011. (3) OMS Medical eligibiliyty criteria for contraceptive use 2009 (3). (4) Vercellini P, De Giorgi O, Oldani S, Cortesi I, Panazza S, Crosignani PG Depot medroxyprogesterone acetate versus an oral contraceptive combined with very-low-dose danazol for long-term treatment of pelvic pain associated with endometriosis. 1996 Aug;175(2):396-401 Current users of DMPA (5) Stewart A, Cummins C, Gold L, Jordan R, Phillips W. The effectiveness of the levonorgestrel-releasing intrauterine system in menorrhagia: a systematic review. BJOG. 2001 Jan;108(1):74-86. 36 months Time Gráfica 1. Anticonceptivo inyectable y densidad mineral ósea (12). (6) FFPRHC Guidance 2004 No existe evidencia de riesgo de osteoporosis ni aumento del riesgo de fractura con el empleo de métodos sólo gestágenos (9,13). (7) French RS, Cowan FM, Mansour DJA et al: Implantable contraceptives (subdermal implants and hormonally impregnated intrauterine systems) versus other forms of reversible contraceptives: two systematic reviews to assess relative effectiveness , acceptability, tolerability and costeffectiveness(Review). Health Technol Assess 2000; 4:i-iv, 1-107. (8) Weisberg E. A randomized study of the effect of Mifepristone alone or in conjuction with estradiol on ovarían function in women using the etonorgestrel-realiasing subdermal implant. Contraception 84 (2011) 5.-Riesgo cardiovascular y cerebrovascular Los métodos sólo-gestágenos deben ser considerados como opciones anticonceptivas para las mujeres con una historia anterior de TEV, o para mujeres que están en mayor riesgo de infarto de miocardio o ictus. (9) Conferencia de Consenso Aranjuez 2005 (10) Kaunitz AM. Depot medroxyprogesterone acetate contraception and the risk of breast and gynecologic cancer. J Reprod Med 1996;41(Suppl 5):41927 En las mujeres con trombofilia probada, deben usarse preparados con sólo-gestágenos con cautela. (Calidad de Evidencia B) (9). (11) Gbolade BA: Depo-Provera and bone density. FFPRHC. J Fam Plann Reprod Health Care, 2002; 28(1):7-11 (12) Scholes D, LaCroix Z, Ichikawa LE, Barlow WE, Ott SM. Injectable hormone contraception and bone density: results from a prospective study. Epidemiology. 2002 Sep;13(5):581-7. Las pacientes en terapia anticoagulante e historia previa de quistes ováricos hemorrágicos puden beneficiarse del uso del inyectable de acetato de medroxipro- (13) Curtis KM, Martins SL. Progestogen-only contraception and bone mineral density:a systematic review. Contraception 2006 May;73(5):470-87. 5 SOCIEDADE GALEGA DE CONTRACEPCIÓN ANTICONCEPCIÓN Y CÁNCER DE CÉRVIX GULDRÍS NIETO, E.M. Servicio de Ginecología y Obstetricia. Complejo Hospitalario Universitario de Vigo. CARBALLO NÚÑEZ, E. Servicio de Ginecología y Obstetricia.Complejo Hospitalario Universitario de Ourense. INTRODUCCIÓN El cáncer de cuello es el segundo cáncer más común en mujeres en el mundo, con casi 490.000 nuevos casos y 250.000 muertes por año. En Europa ocupa el quinto lugar en orden de frecuencia. (Figuras 1, 2). Aunque el cáncer de cérvix es una enfermedad mundial, las mayores tasas de incidencia se encuentran en países en vías de desarrollo incluyendo América Central y América del Sur, África oriental, Asia Meridional y Sudoriental. (Figura 3). Fig. 3.-Tasa de incidencia mundial de cáncer cervicouterino por 100.000 mujeres (de todas las edades), normalizadas según la edad con respecto a la población estándar en la OMS (2005). Guía de Control del Cáncer Cervicouterino OMS. En 1976, el médico y científico, Harald zun Hausen publicó la hipótesis de que el virus del papiloma humano jugaba un papel importante en la causa del cáncer de cuello de útero y sus estudios supusieron una revolución en el mundo del cáncer puesto que su descubrimiento ha relacionado el cáncer con virus oncogénicos y ha permitido el desarrollo posterior de las actuales vacunas contra el HPV1-2. El virus del papiloma humano (HPV siglas en inglés de human papilloma virus) pertenece a la familia papillomaviridae e infecta a distintos animales desde pájaros hasta mamíferos incluyendo al hombre. Se clasifican en función de su riesgo de transformación neoplásica en virus de alto riesgo (16,18) y bajo riesgo. Hoy en día se considera causa necesaria, no suficiente de cáncer de cérvix3. COFACTORES EN LA CARCINOGÉNESIS CERVICAL Aunque la infección por HPV es muy frecuente en la población, la mayoría la aclaran y no progresan a cáncer de cuello. Por lo tanto es necesario que otros co-factores intervengan en el proceso de carcinogénesis cervical una vez establecida la infección4-7. Los 3 grupos de cofactores potenciales son: 1.-Co-factores medioambientales o exógenos incluyendo el uso prolongado de anticonceptivos hormonales, hábito tabáquico, alta paridad y co-infección con otras enfermedades de transmisión sexual como VIH, Chlamydia Trachomatis o Virus Herpes Simple tipo 2. 2.-Co-factores virales como infección por tipos específicos, variantes de HVP, carga viral e integración viral. 3.-Co-factores del huésped, incluyendo hormonas endógenas, factores genéticos y otros factores relacionados con la respuesta inmunitaria. Fig. 1.-Incidencia y mortalidad global en mujeres por cáncer. Globocan 2008. Fig. 2.-Incidencia y mortalidad en Europa en mujeres por cáncer. Globocan 2008. 6 SOCIEDADE MÉTODOS ANTICONCEPTIVOS Y CÁNCER DE CÉRVIX GALEGA DE CONTRACEPCIÓN mo. En las mujeres que utilizaron los anticonceptivos durante <5 años no se detectó un incremento de riesgo. A partir de estos datos, se estima que el riesgo por cada año de utilización se multiplica por 1,07. No se encontró ninguna relación con otros factores relacionados con los anticonceptivos como la edad de inicio de la toma. Los autores concluyen que el consumo de anticonceptivos orales incrementa el riesgo de sufrir un cáncer de cérvix aunque el riesgo disminuye a medida que transcurre el tiempo desde su abandono. Esta relación puede ser causal o mediada por determinados factores de confusión como determinados factores conductuales asociados al consumo de anovulatorios o la no utilización de métodos de barrera, que podría favorecer la infección por VPH. Sin embargo, la relación se mantiene a pesar de que el análisis se controle por varios posibles factores de confusión, lo que va a favor de una relación causal22. PRESERVATIVO MASCULINO O CONDÓN Al igual que en otras enfermedades de transmisión sexual como el VIH, el preservativo ha demostrado su eficacia en la prevención de la infección del virus HPV. Su uso continuado ha demostrado disminuir un 70 % el riesgo de infección. Además su uso favorece la regresión de las neoplasias cervicales y favorece el aclarado de la 8-10 infección . DISPOSITIVO INTRAUTERINO (DIU) Durante años el DIU se asoció a un aumento del riesgo de infección por HPV y por tanto del riesgo de cáncer de cuello. Recientemente un grupo de investigación contra el cáncer ha encontrado que el uso del dispositivo intrauterino reduce el riesgo de cáncer de cuello y que este actuaría como un factor protector, con una Odds Ratio de 0.55 (IC 95 % 0.42-0.70) p<0.0001. Las hipótesis de actuación que postulan los autores serían el desarrollo de una respuesta inflamatoria crónica en el cuello uterino o el arrastre de las lesiones establecidas con la inserción y retirada del mecanismo11. Se han propuesto distintas hipótesis para explicar la relación entre el uso de anticonceptivos y el cáncer de cérvix23: 1. Las hormonas esteroideas contribuyen a la ectopia cervical y favorecen la adquisición de HPV. En muchas poblaciones las mujeres que usan anticonceptivos son más activas sexualmente y por este motivo estas pacientes pueden estar expuestas a relaciones de riesgo. El trabajo de Marks et al estimó el riesgo de detección de HPV (nuevos casos) y persistencia en una cohorte de 1135 mujeres entre 20-37 años en Thailandia seguidas durante 18 meses. Al momento de la inclusión se realizó una citología en medio líquido y un test para detección de ADN para HPV con visitas cada 6 meses. “Nueva detección” fue definida como el primer resultado positivo durante el seguimiento tras un resultado negativo previo. Durante el seguimiento observaron un pequeño incremento pero no significativo en la detección de DNA HPV y observaron que las usuarias de ACO tuvieron significativamente menor tasa de aclaramiento de HPV24. ANTICONCEPTIVOS HORMONALES La relación entre el uso de anticonceptivos hormonales y el riesgo de cáncer de cuello es un tema controvertido desde hace años, mientras que algunos estudios abogan por una relación directa entre la duración de uso de los AHC otros autores no encuentran esta relación12-20. Con intención de aclarar la relación entre el uso de anticonceptivos hormonales y el cáncer de cérvix la Agencia Internacional de Investigación del Cáncer (IARC) encargó un meta-análisis donde se reunieron 28 trabajos (4 estudios de cohortes y 24 casos y controles) incluyendo a 12.531 mujeres con cáncer de cérvix o carcinoma in situ. El riesgo relativo de cáncer de cérvix asociado con la duración de uso de anticonceptivos orales fue menos de 5 años, entre 5-9 años, y más de 10 años; 1.1 (95 % IC 1.1-1.2), 1.6 (95 % IC 1.4-1.7) y 2.2 (95 % IC 1.9-2.4) respectivamente21. La zona de transformación del cuello uterino es la región donde surgen la mayor parte de tumores premalignos y cánceres. La zona de transformación es más grande durante la pubertad y el embarazo, así como en las mujeres que han tomado anticonceptivos orales durante largo tiempo, lo cual puede aumentar la exposición al VPH. Esto puede explicar por qué la actividad sexual precoz, los embarazos múltiples y, en menor grado, el uso a largo plazo de anticonceptivos orales son cofactores del desarrollo posterior de cáncer cervicouterino25-26. De los tres estudios transversales que estudiaron directamente la relación entre ectopia cervical y prevalencia de HPV solo este ha mostrado una asociación significativa23. Años más tarde se publicó otro gran estudio avalado por la IARC que incluía a más de 16.500 pacientes con intención de estudiar la relación entre el cáncer de cérvix y el patrón de consumo de anticonceptivos hormonales. Se incluyeron 24 estudios epidemiológicos, 3 de ellos internacionales. Se incluyeron más de 11 mil casos de cáncer invasivo y más de 5000 casos de CIN 3 o carcinoma in situ y más de 35.000 controles. La edad media en el diagnóstico de cáncer invasivo fue 45 años y para CIN 3 35 años. El consumo de anticonceptivos orales combinados fue más frecuente en las mujeres procedentes de países desarrollados, en las que se habían hecho alguna citología, en las que tenían más parejas sexuales, las que las habían iniciado a una edad más temprana, las que habían tenido algún hijo, las que tenían mayor nivel educativo y las que eran o habían sido fumadoras. En el análisis multivariante el riesgo de padecer un cáncer de cérvix se relacionó directamente con la duración del uso de los anticonceptivos y de forma inversa con el tiempo transcurrido desde que se había abandonado su consu- 2. Los esteroides sexuales modulan la respuesta inmune y favorecen la persistencia de HPV. Puesto que la persistencia viral es la clave para el desarrollo de un cáncer de cuello es posible que los anticonceptivos jueguen un papel a este nivel. Las concentraciones más altas de estradiol y progesterona en embarazadas se correlaciona con concentraciones más altas de IgG, AgA, e IL 1B en el moco cervical recogidos en 7 SOCIEDADE GALEGA DE CONTRACEPCIÓN 2.-Gissmann, L., et al., Human papillomavirus types 6 and 11 DNA sequences in genital and laryngeal papillomas and in some cervical cancers. Proceedings of the National Academy of Sciences, 1983. 80(2): p. 560-563. cada trimestre de embarazo lo que sugiere cambios en el 27 microambiente inmunológico cervical . También se han encontrado diferencias en la respuesta celular entre embarazadas y no embarazadas. Las mujeres en tratamiento con terapia hormonal tienen menor concentración de IL 6, IL 2, TNF alfa y reducción en la actividad de las células Natural Killer. Encontramos que el estradiol y la progesterona sola, en concentraciones similares a los anticonceptivos orales regulan la respuesta a las partículas HPV 16 en células cultivadas in vitro de sangre periférica de mujeres sanas28. 3.-Muñoz, N., et al., Chapter 1: HPV in the etiology of human cancer. Vaccine, 2006. 24, Supplement 3(0): p. S1-S10. 4.-Castellsagué, X. and N. Muñoz, Chapter 3: Cofactors in Human Papillomavirus Carcinogenesis—Role of Parity, Oral Contraceptives, and Tobacco Smoking. JNCI Monographs, 2003. 2003(31): p. 20-28. 5.-Castellsagué, X., et al., Worldwide Human Papillomavirus Etiology of Cervical Adenocarcinoma and Its Cofactors: Implications for Screening and Prevention. Journal of the National Cancer Institute, 2006. 98(5): p. 303-315. 6.-Farivar, T.N., et al., Lack of association between herpes simplex virus type 2 infection and cervical cancer--Taq Man realtime PCR assay findings. Asian Pac J Cancer Prev. 13(1): p. 339-42. 7.-Memiah, P., et al., Prevalence and Risk Factors Associated with Precancerous Cervical Cancer Lesions among HIV-Infected Women in Resource-Limited Settings. AIDS Res Treat. 2012: p. 953743. 3. Los esteroides sexuales aumentan el riesgo de desarrollo lesiones precancerosas y progresión a cáncer invasivo. 8.-Winer, R.L., et al., Condom Use and the Risk of Genital Human Papillomavirus Infection in Young Women. New England Journal of Medicine, 2006. 354(25): p. 26452654. A pesar de que existen numerosos estudios experimentales para el estudio del efecto de los esteroides sexuales en el cáncer de cérvix, los resultados son contradictorios. Au et al publicó un estudio in vitro sobre una línea de cáncer de cuello bloqueando los receptores de estrógeno. Para ello bloquearon los receptores de estrógeno en una línea celular de cáncer de cuello, usando un vector adenoviral que llevaba un gen dominante de bloqueo de receptor de estradiol. Observaron que este mecanismo causa una inhibición del ciclo celular e induce a la apoptosis celular29. Otro estudio experimental evaluó el efecto de los estrógenos y progesterona sobre la expresión del RNAm de los oncogenes E6 y E7 de células HPV 16 + y observaron que no existen cambios significativos en su expresión30. 9.-MANHART, L.E. and L.A. KOUTSKY, Do Condoms Prevent Genital HPV Infection, External Genital Warts, or Cervical Neoplasia?: A Meta-Analysis. Sexually Transmitted Diseases, 2002. 29(11): p. 725-735. 10.-Hogewoning, C.J.A., et al., Condom use promotes regression of cervical intraepithelial neoplasia and clearance of human papillomavirus: A randomized clinical trial. International Journal of Cancer, 2003. 107(5): p. 811-816. 11.-Castellsagué, X., et al., Intrauterine device use, cervical infection with human papillomavirus, and risk of cervical cancer: a pooled analysis of 26 epidemiological studies. The Lancet Oncology. 12(11): p. 1023-1031. 12.-Andolsek, L., et al., Oral contraceptives and cervical cancer. Lancet, 1983. 2(8362): p. 1310. 13.-Brinton, L.A., et al., Long-term use of oral contraceptives and risk of invasive cervical cancer. Int J Cancer, 1986. 38(3): p. 339-44. 14.-Chang, A.R., Hormonal contraceptives, human papillomaviruses and cervical cancer; some observations from a colposcopy clinic. Aust N Z J Obstet Gynaecol, 1989. 29(3 Pt 2): p. 329-31. 15.-Ebeling, K., P. Nischan, and C. Schindler, Use of oral contraceptives and risk of invasive cervical cancer in previously screened women. Int J Cancer, 1987. 39(4): p. 427-30. CONCLUSIÓN 16.-Edelman, D.A. and W.A. van Os, Combined oral contraceptives and the risk of cervical cancer. Int J Gynaecol Obstet, 1997. 56(1): p. 57-8. Mientras algunos estudios de casos y controles argumentan una acción directa de los esteroides sexuales en la carcinogénesis, otros estudios son inconsistentes. La existencia de factores de confusión, como el uso de preservativo a lo largo de la vida sexual puede ser un factor fundamental y a tener en cuenta en el efecto de los anticonceptivos hormonales. La mayoría de los trabajos actuales, incluidos grandes meta-análisis tienen grandes sesgos que tienen que ser tenidos en cuenta. 17.-Grant, E.C., Cervical cancer and oral contraceptives. Lancet, 1983. 1(8323): p. 528. 18.-La Vecchia, C. and C. Bosetti, Oral contraceptives and cervical cancer: public health implications. Eur J Cancer Prev, 2003. 12(1): p. 1-2. 19.-Marks, M., et al., The association of hormonal contraceptive use and HPV prevalence. International Journal of Cancer. 128(12): p. 2962-2970. 20.-Miller, K., P. Blumenthal, and K. Blanchard, Oral contraceptives and cervical cancer: critique of a recent review. Contraception, 2004. 69(5): p. 347-51. 21.-Smith, J.S., et al., Cervical cancer and use of hormonal contraceptives: a systematic review. Lancet, 2003. 361(9364): p. 1159-67. 22.-Appleby, P., et al., Cervical cancer and hormonal contraceptives: collaborative reanalysis of individual data for 16,573 women with cervical cancer and 35,509 women without cervical cancer from 24 epidemiological studies. Lancet, 2007. 370(9599): p. 1609-21. En Junio de 2005 la IARC reunió expertos y científicos para aclarar la evidencia sobre el efecto carcinogénico en humanos de AHC y de la terapia hormonal sustitutiva en menopausia y concluye que el uso de AHC modifica ligeramente el riesgo de cáncer, incrementándolo en algunos lugares (mama, cérvix) y disminuyéndolo en otros (ovario, endometrio) pero los beneficios sobre la salud superan los riesgos. Actualmente no existe evidencia que justifique la retirada de un método hormonal en pacientes con infección por HPV aunque es necesario individualizar cada caso, informar adecuadamente sobre la evidencia actual y siempre recomendar el uso de preservativo para evitar reinfecciones y favorecer el aclarado del virus. 23.-Marks M.A, K.S.L., Gravitt P.E, Hormonal contraception and HPV: a tale of differing and overlapping mechanisms. Journal: Open Access Journal of Contraception, 2011(2): p. 161-174. 24.-Marks, M., et al., Combined Oral Contraceptive Use Increases HPV Persistence but Not New HPV Detection in a Cohort of Women From Thailand. Journal of Infectious Diseases. 204(10): p. 1505-1513. 25.-Monroy, O.L., et al., Prevalence of human papillomavirus genotypes, and mucosal IgA anti-viral responses in women with cervical ectopy. Journal of clinical virology: the official publication of the Pan American Society for Clinical Virology, 2010. 47(1): p. 4348. 26.-Rocha-Zavaleta, L., et al., Human papillomavirus infection and cervical ectopy. International journal of gynaecology and obstetrics: the official organ of the International Federation of Gynaecology and Obstetrics, 2004. 85(3): p. 259-266. 27.-Kutteh, W.H. and R.D. Franklin, Quantification of immunoglobulins and cytokines in human cervical mucus during each trimester of pregnancy. American Journal of Obstetrics and Gynecology, 2001. 184(5): p. 865-874. 28.-Marks, M.A., et al., Progesterone and 17 B-Estradiol Enhance Regulatory Responses to Human Papillomavirus Type 16 Virus-Like Particles in Peripheral Blood Mononuclear Cells from Healthy Women. Clinical and Vaccine Immunology. 17(4): p. 609-617. BIBLIOGRAFÍA 29.-Au, W.W., S. Abdou-Salama, and A. Al-Hendy, Inhibition of growth of cervical cancer cells using a dominant negative estrogen receptor gene. Gynecologic Oncology, 2007. 104(2): p. 276-280. 1.-Dürst, M., et al., A papillomavirus DNA from a cervical carcinoma and its prevalence in cancer biopsy samples from different geographic regions. Proceedings of the National Academy of Sciences, 1983. 80(12): p. 3812-3815. 30.-Ruutu, M., et al., Effects of 17β-estradiol and progesterone on transcription of human papillomavirus 16 E6/E7 oncogenes in CaSki and SiHa cell lines. International Journal of Gynecological Cancer, 2006. 16(3): p. 1261-1268. 8 Para mujeres que saben lo que necesitan... Drosure DRO-01-02-12 0,03 mg de etinilestradiol/3 mg de drospirenona ¨ Drosurelle ¨ 0,02 mg de etinilestradiol/3 mg de drospirenona La eficacia y experiencia en una NUEVA ETAPA PARA LA MUJER Financiado por el 1. NOMBRE DEL MEDICAMENTO. Drosure 0,03 mg/3 mg comprimidos recubiertos con película EFG. Drosure Diario 0,03 mg/3 mg comprimidos recubiertos con película EFG. Drosurelle 0,02 mg/3 mg comprimidos recubiertos con película EFG. Drosurelle Diario 0,02 mg/3 mg comprimidos recubiertos con película EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Drosure y Drosure Diario: Comprimidos amarillos (comprimidos activos): Cada comprimido recubierto con película contiene 0,03 mg de etinilestradiol y 3 mg de Drospirenona. Excipientes: 62 mg de lactosa monohidrato. Drosure Diario: Comprimidos amarillos (comprimidos activos): Cada comprimido recubierto con película contiene 0,03 mg de etinilestradiol y 3 mg de Drospirenona. Excipientes: 62 mg de lactosa monohidrato. Comprimidos blancos (comprimidos placebo): El comprimido no contiene principios activos. Excipiente: 89,5 mg de lactosa anhidra. Drosurelle y Drosurelle Diario: Comprimidos rosas (comprimidos activos): Cada comprimido recubierto con película contiene 0,02 mg de etinilestradiol y 3 mg de Drospirenona. Excipiente:44 mg de lactosa monohidrato. Drosurelle Diario: Comprimidos rosas (comprimidos activos): Cada comprimido recubierto con película contiene 0,02 mg de etinilestradiol y 3 mg de Drospirenona. Excipiente:44 mg de lactosa monohidrato. Comprimidos blancos (comprimidos placebo): El comprimido no contiene principios activos. Excipiente: 89,5 mg de lactosa anhidra. Para consultar la lista completa de excipientes, ver sección 6.1. 3. FORMA FARMACÉUTICA. Comprimido recubierto con película. Drosure/Drosure Diario: Comprimidos activos: Comprimidos recubiertos con película, amarillos, redondos. Comprimidos placebo: Comprimidos recubiertos con película, blancos, redondos. Drosurelle/Drosurelle Diario: Comprimidos activos: Comprimidos recubiertos con película, rosas, redondos. Comprimidos placebo: Comprimidos recubiertos con película, blancos, redondos. 4. DATOS CLÍNICOS. 4.1Indicaciones terapéuticas. Anticoncepción oral. 4.2 Posología y forma de administración. Vía de administración: uso oral. Cómo tomar Drosure/ Drosurelle. Los comprimidos deben tomarse todos los días aproximadamente a la misma hora, con un poco de líquido si es necesario, en el orden que se indica en el blíster. Se debe tomar un comprimido de Drosure/Drosurelle diariamente durante 21 días consecutivos. Cada nuevo envase se empieza tras un intervalo de 7 días sin comprimidos, tiempo durante el cual se produce la hemorragia por deprivación. Esta hemorragia suele dar comienzo 2–3 días después de tomar el último comprimido y es posible que no haya cesado antes de empezar el siguiente envase. Cómo tomar Drosure Diario/Drosurelle Diario. Los comprimidos deben tomarse todos los días aproximadamente a la misma hora, con un poco de líquido si es necesario, en el orden que se indica en el blíster. La toma de comprimidos de Drosure Diario/Drosurelle Diario es continua. Se debe tomar un comprimido diariamente durante 28 días consecutivos. Cada nuevo envase se empieza al día siguiente de terminar el último comprimido del envase anterior. La hemorragia por deprivación suele dar comienzo 2–3 días después de empezar a tomar los comprimidos placebo (última fila) y es posible que no haya cesado antes de empezar el siguiente envase. Cómo comenzar a tomar Drosure, Drosure Diario, Drosurelle y Drosurelle Diario. Si no se ha usado ningún anticonceptivo hormonal (en el mes anterior). Los comprimidos se empezarán a tomar el día 1 del ciclo natural de la mujer (es decir, el primer día de la hemorragia menstrual). Para sustituir otro método anticonceptivo oral combinado (AOC). La mujer debe empezar a tomar Drosure/Drosurelle al día siguiente de finalizar el intervalo habitual sin toma de hormonas (intervalo sin comprimidos o con comprimidos placebo) de su método anticonceptivo oral combinado previo. En caso de uso de un anillo vaginal o parche transdérmico, debe empezar a tomar Drosure preferentemente el día de su extracción, o a más tardar cuando se hubiera tenido que volver a aplicar el parche o anillo. -Para sustituir un método basado exclusivamente en progestágenos (píldora, inyección o implante basado sólo en progestágenos) o un dispositivo intrauterino de liberación de progestágenos (DIU). La mujer puede sustituir cualquier día la píldora basada sólo en progestágenos (si se trata de un implante o de un DIU, se sustituirá el mismo día de su extracción y si se trata de un inyectable, el día que corresponda la siguiente inyección) pero, en todos estos casos, se debe recomendar el uso adicional de un método de barrera durante los 7 primeros días de la toma de comprimidos. • Tras un aborto en el primer trimestre. La mujer puede empezar inmediatamente. En tal caso, no es necesario que tome medidas anticonceptivas adicionales. • Tras el parto o un aborto en el segundo trimestre. Se debe recomendar a la mujer que empiece entre 21 y 28 días después del parto o del aborto en el segundo trimestre. Si lo hace más tarde, se aconsejará a la mujer que utilice adicionalmente un método de barrera durante los 7 primeros días. No obstante, si ya ha mantenido relaciones sexuales, hay que descartar que se haya producido un embarazo antes de iniciar el uso de AOC, o bien esperar hasta su primer período menstrual. Para mujeres en período de lactancia, ver sección 4.6. Procedimiento a seguir en caso de no tomar algún comprimido. El olvido de la toma de los comprimidos de Drosure Diario/Drosurelle Diario de la última fila del blíster (comprimidos placebo) no tiene consecuencias. No obstante, éstos deben ser desechados para evitar prolongar de forma no intencionada la fase de comprimidos placebo. La siguiente advertencia se refiere al olvido de de la toma de los comprimidos activos (filas 1 a 3 del blister): Si se retrasa menos de 12 horas en la toma de algún comprimido activo, la protección anticonceptiva no se ve reducida. La mujer debe tomar el comprimido tan pronto como se acuerde e ingerir los comprimidos siguientes a la hora habitual. Si se retrasa más de 12 horas en la toma de algún comprimido activo, la protección anticonceptiva puede verse reducida. La pauta a seguir en caso de olvido de comprimidos se rige por estas dos normas básicas: 1. Nunca se debe suspender la toma de comprimidos durante más de 7 días consecutivos. 2. Se requiere tomar los comprimidos de forma ininterrumpida durante 7 días para conseguir una supresión adecuada del eje hipotálamo–hipófisis–ovario. En consecuencia, en la práctica diaria se puede recomendar lo siguiente: Semana 1. La mujer debe tomar el último comprimido olvidado tan pronto como se acuerde, incluso si esto significa tomar dos comprimidos a la vez. Posteriormente seguirá tomando los comprimidos restantes a su hora habitual. Además, durante los 7 días siguientes debe utilizar un método de barrera, como un preservativo. Si la mujer ha mantenido relaciones sexuales en los 7 días previos, se debe considerar la posibilidad de un embarazo. Cuantos más comprimidos hayan sido olvidados y cuanto más cerca estén del período de 7 días de descanso sin comprimidos o 7 días de comprimidos placebo, mayor es el riesgo de embarazo. Semana 2. La mujer debe tomar el último comprimido olvidado tan pronto como se acuerde, incluso si esto significa tomar dos comprimidos a la vez. Posteriormente seguirá tomando los comprimidos restantes a su hora habitual. Siempre que en los 7 días anteriores al primer comprimido olvidado la mujer haya tomado los comprimidos correctamente, no es necesario utilizar medidas anticonceptivas adicionales. Sin embargo, si ha olvidado tomar más de un comprimido, se le aconsejará que tome precauciones anticonceptivas adicionales durante los 7 días siguientes. Semana 3. El riesgo de reducción de la fiabilidad anticonceptiva es inminente debido a la cercanía del período de 7 días de descanso sin comprimidos o 7 días de comprimidos placebo. No obstante, ajustando el calendario de toma de comprimidos, aún se puede prevenir la reducción de la protección anticonceptiva. Por consiguiente, si sigue una de las dos opciones siguientes, no necesitará adoptar precauciones anticonceptivas adicionales, siempre que en los 7 días anteriores al primer comprimido olvidado la mujer haya tomado todos los comprimidos correctamente. Si este no es el caso, se le aconsejará que siga la primera de estas dos opciones, y que además tome precauciones anticonceptivas adicionales durante los 7 días siguientes. La mujer debe tomar el último comprimido olvidado tan pronto como se acuerde, incluso si esto significa tomar dos comprimidos a la vez. Drosure / Drosurelle: Posteriormente seguirá tomando los comprimidos restantes a su hora habitual. El siguiente envase se debe empezar inmediatamente después de finalizar el envase actual, es decir, sin dejar un intervalo entre los envases. Drosure Diario / Drosurelle Diario: Posteriormente, seguirá tomando los comprimidos a su hora habitual hasta acabar los comprimidos activos. Los 7 comprimidos de la última fila (comprimidos placebo) deben ser desechados. El siguiente envase se debe empezar inmediatamente. Probablemente no haya una hemorragia por deprivación hasta el final de la toma de los comprimidos del segundo envase, pero puede presentarse manchado o hemorragia por deprivación en los días de toma de comprimidos. Drosure y Drosurelle: También se puede recomendar a la mujer que deje de tomar los comprimidos del envase actual. A continuación, debe seguir un período de descanso sin comprimidos de 7 días como máximo, incluidos los días en que olvidó los comprimidos, y continuar con el siguiente envase. Drosure Diario y Drosurelle Diario: También se debe recomendar a la mujer que deje de tomar los comprimidos activos del envase actual. A continuación, debe tomar los comprimidos de la última fila (comprimidos placebo) durante 7 días como máximo, incluidos los días en que olvidó los comprimidos, y continuar con el siguiente envase. Si la mujer olvida tomar varios comprimidos y posteriormente no presenta hemorragia por deprivación en el primer período normal de descanso sin comprimidos, o en la fase de comprimidos placebo se debe considerar la posibilidad de embarazo. Recomendación en caso de trastornos gastrointestinales. En caso de alteraciones gastrointestinales graves (por ejemplo, vómitos o diarrea grave), la absorción puede no ser completa, y se deben tomar medidas anticonceptivas adicionales. Si se producen vómitos en las 3–4 horas siguientes a la toma del comprimido, se debe tomar un nuevo comprimido lo antes posible. El nuevo comprimido se debe tomar, si es posible, no más de 12 horas después de la hora habitual a la que se toman los comprimidos. Si han transcurrido más de 12 horas, se deberán seguir las recomendaciones referentes al olvido de la toma de comprimidos, tal como se expone en la sección 4.2. Si la mujer no desea cambiar su pauta normal de toma de comprimidos, deberá tomar el/los comprimido/s activos adicional/es necesario/s de otro envase. Cómo retrasar una hemorragia por deprivación. Para retrasar un período, la mujer debe continuar con otro envase de Drosure o Drosurelle sin un período de descanso sin comprimidos, o continuar con otro envase de Drosure Diario o Drosurelle Diario sin tomar los comprimidos placebo del envase actual. Puede mantener esta extensión tanto como desee hasta que se terminen los comprimidos del segundo envase. Durante la extensión, la mujer puede experimentar manchado o hemorragia por deprivación. Posteriormente, la toma regular de Drosure, Drosure Diario, Drosurelle o Drosurelle Diario, se reanuda tras el período habitual de 7 días de descanso sin comprimidos o tras la fase de comprimidos placebo. Para cambiar sus períodos a otro día de la semana al que la mujer está acostumbrada, se le puede aconsejar que acorte el siguiente período de descanso sin comprimidos tantos días como desee o que acorte el siguiente período de comprimidos placebo tantos días como desee. Cuanto más corto sea, mayor es el riesgo de que no tenga hemorragia por deprivación, y de que experimente manchado y hemorragia por deprivación durante la toma del envase siguiente (igual que cuando se retrasa un período). 4.3 Contraindicaciones. Los anticonceptivos orales combinados (AOC) no se deben emplear en presencia de cualquiera de los cuadros que se indican a continuación. Si cualquiera de estos cuadros aparece por primera vez durante el uso de AOC, se debe suspender inmediatamente el tratamiento. • Presencia o antecedentes de trombosis venosa (trombosis venosa profunda, embolia pulmonar). • Presencia o antecedentes de trombosis arterial (p. ej., infarto de miocardio) o afecciones prodrómicas (p. ej., angina de pecho o accidente isquémico transitorio). • Presencia o antecedentes de accidente cerebrovascular. • Presencia de uno o más factores de riesgo, graves o múltiples, de trombosis arterial: -Diabetes mellitus con síntomas vasculares. - Hipertensión grave. - Dislipoproteinemia grave. - Predisposición hereditaria o adquirida a padecer trombosis venosas o arteriales, como resistencia a la proteína C activada, déficit de antitrombina III, déficit de proteína C, déficit de proteína S, hiperhomocisteinemia y anticuerpos antifosfolípidos (anticuerpos anticardiolipina, anticoagulante del lupus). • Presencia o antecedentes de pancreatitis, si se asocia a hipertrigliceridemia grave. • Presencia o antecedentes de enfermedad hepática grave, siempre que los valores de las pruebas de función hepática no se hayan normalizado. • Insuficiencia renal grave o fallo renal agudo. • Presencia o antecedentes de tumores hepáticos (benignos o malignos). • Procesos malignos, conocidos o sospechados dependientes de los esteroides sexuales (por ejemplo, de los órganos genitales o de las mamas). • Hemorragia vaginal no diagnosticada. • Antecedentes de migraña con síntomas neurológicos focales. • Hipersensibilidad a los principios activos o a alguno de los excipientes de Drosure, Drosure Diario, Drosurelle o Drosurelle Diario. 4.4 Advertencias y precauciones especiales de empleo. Advertencias. Si alguno de los cuadros/factores de riesgo que se mencionan a continuación está presente, deben valorarse los beneficios del uso de AOC frente a los posibles riesgos para cada mujer en particular, y comentarlos con ella antes de que decida empezar a usar el medicamento. Si alguno de estos cuadros o de estos factores de riesgo se agrava, se exacerba o aparece por primera vez, la mujer debe consultar al médico. El médico entonces deberá decidir si se debe suspender el uso del AOC. Trastornos circulatorios. En estudios epidemiológicos se ha observado que la incidencia de trombolia venosa (TEV) en usuarias de anticonceptivos orales combinados de dosis bajas de estrógenos (< 50 µg de etinilestradiol) (incluido Drosure, Drosure Diario, Drosurelle y Drosurelle Diario), oscila entre 20 y 40 casos por 100 000 mujeres–año, si bien la estimación del riesgo varía en función del progestágeno. En comparación, la incidencia en no usuarias es de 5 a 10 casos por 100 000 mujeres–año. El uso de cualquier anticonceptivo oral combinado lleva asociado un incremento del riesgo de TEV, comparado con la no utilización. El aumento del riesgo de TEV es mayor durante el primer año en que una mujer utiliza un anticonceptivo oral combinado por primera vez. Se estima que la incidencia de TEV asociada al embarazo es de 60 casos por 100.000 embarazos. La TEV tiene un desenlace mortal en el 1%-2% de los casos. En estudios epidemiológicos también se ha asociado el uso de los AOC a un aumento del riesgo de tromboembolia arterial (infarto de miocardio, accidente isquémico transitorio). En usuarias de píldora anticonceptiva, se han notificado de forma extremadamente rara casos de trombosis en otros vasos sanguíneos, por ejemplo en venas y arterias hepáticas, mesentéricas, renales, cerebrales o retinianas. No existe consenso acerca de si la aparición de estos acontecimientos se asocia al empleo de anticonceptivos hormonales. Los síntomas de los episodios trombóticos/tromboembólicos venosos o arteriales, o de un accidente cerebrovascular, pueden incluir: • dolor y/o inflamación inusual y unilateral en los miembros inferiores. • dolor torácico intenso repentino, independientemente de que se irradie o no al brazo izquierdo. • disnea de aparición repentina. • episodios de tos de inicio repentino sin una causa clara. • cualquier cefalea no habitual, intensa y prolongada. • pérdida repentina de visión, parcial o completa. • diplopía • habla confusa o afasia • vértigo • colapso con convulsiones focales o sin ellas • debilidad o entumecimiento intenso que afecta de forma repentina a un lado o una parte del cuerpo. • trastornos motores • abdomen agudo. • El riesgo de que se produzcan complicaciones tromboembólicas venosas en usuarias de AOC aumenta con: - la edad. - los antecedentes familiares positivos (algún caso de tromboembolia venosa en un hermano o un progenitor a una edad relativamente temprana). Si se sospecha que existe una predisposición hereditaria, la mujer debe ser remitida a un especialista antes de tomar la decisión de usar un AOC. • la inmovilización prolongada, la cirugía mayor, cualquier intervención quirúrgica en los miembros inferiores o un traumatismo grave. En estas circunstancias, es aconsejable suspender la toma de la píldora (en caso de cirugía programada, al menos con cuatro semanas de antelación) y no reanudarla hasta dos semanas después de que se recupere completamente la movilidad. Se deberá considerar un tratamiento antitrombótico si no se ha suspendido con antelación la toma de la píldora. • la obesidad (índice de masa corporal superior a 30 kg/m²). • no hay consenso acerca del posible papel de las venas varicosas y la tromboflebitis superficial en la aparición o progresión de la trombosis venosa. El riesgo de que se produzcan complicaciones tromboembólicas arteriales o un accidente cerebrovascular en las usuarias de AOC aumenta con: - la edad. - el tabaquismo (se debe advertir encarecidamente a las mujeres mayores de 35 años que no fumen si desean usar un AOC). • la dislipoproteinemia. • la hipertensión. • la migraña. • la obesidad (índice de masa corporal superior a 30 kg/m²).• la enfermedad valvular cardíaca. • la fibrilación auricular. La presencia de un factor de riesgo grave o de varios factores de riesgo de enfermedad venosa o arterial también puede constituir una contraindicación. Asimismo, hay que tener en cuenta la posibilidad de utilizar un tratamiento anticoagulante. Debe aconsejarse específicamente a las usuarias de AOC que se pongan en contacto con su médico en caso de que observen posibles síntomas de trombosis. Si se sospecha o confirma una trombosis, se debe suspender el uso de AOC. Se instaurará un método de anticoncepción alternativo debido a la teratogenicidad del tratamiento anticoagulante (cumarinas). Es preciso tener en cuenta el aumento de riesgo de tromboembolia en el puerperio (para información sobre “Embarazo y lactancia”, ver sección 4.6). Otras afecciones que se han asociado a acontecimientos vasculares adversos incluyen la diabetes mellitus, lupus eritematoso sistémico, síndrome hemolítico-urémico y la enfermedad intestinal inflamatoria crónica (enfermedad de Crohn o colitis ulcerosa) y anemia drepanocítica. Un aumento de la frecuencia o la intensidad de las migrañas durante el uso de AOC (puede ser el pródromo de un acontecimiento cerebrovascular) puede motivar la discontinuación inmediata de los AOC. • Tumores. En algunos estudios epidemiológicos se ha asociado un aumento del riesgo de cáncer cervicouterino al uso de AOC durante largos períodos de tiempo; sin embargo, sigue existiendo controversia acerca de hasta qué punto este hallazgo puede ser atribuido a factores relacionados con la conducta sexual u otros factores como el virus del papiloma humano (VPH). En un metaanálisis de 54 estudios epidemiológicos se observó que existe un ligero aumento del riesgo relativo (RR = 1,24) de que se diagnostique cáncer de mama en mujeres que están tomando AOC. Este aumento del riesgo desaparece gradualmente en los 10 años siguientes a la discontinuación de los AOC. Dado que el cáncer de mama es raro en las mujeres de menos de 40 años, el aumento de casos diagnosticados de cáncer de mama en las mujeres que toman AOC o que los han tomado recientemente es pequeño en relación con el riesgo total de cáncer de mama. Estos estudios no aportan datos sobre las causas. El patrón observado de aumento del riesgo puede deberse a que el diagnóstico de cáncer de mama es más precoz en usuarias de AOC, a los efectos biológicos de los AOC o a una combinación de ambos factores. Los cánceres de mama diagnosticados en mujeres que han usado un AOC en alguna ocasión suelen estar menos avanzados, desde el punto de vista clínico, que los diagnosticados en quienes nunca los han tomado. En raros casos se han notificado tumores hepáticos benignos, y aún más raramente malignos, en usuarias de AOC. En casos aislados, estos tumores han dado lugar a hemorragias intraabdominales potencialmente mortales. Se debe considerar la posibilidad de que exista un tumor hepático en el diagnóstico diferencial en mujeres que toman AOC y que presentan dolor intenso en la parte superior del abdomen, hepatomegalia o signos de hemorragia intraabdominal. • Otras situaciones: El componente progestágeno de Drosure, Drosure Diario, Drosurelle y Drosurelle Diario, es un antagonista de la aldosterona con propiedades ahorradoras de potasio. En la mayoría de los casos no es de esperar un aumento de los niveles de potasio. No obstante, en un estudio clínico realizado en pacientes con insuficiencia renal leve o moderado y uso concomitante de medicamentos ahorradores de potasio, los niveles séricos de potasio aumentaron de forma leve, aunque no significativa, durante la toma de drospirenona. Por lo tanto, se recomienda monitorizar el potasio sérico durante el primer ciclo de tratamiento en pacientes que presenten insuficiencia renal y niveles séricos de potasio previos al tratamiento en el límite superior de los valores de referencia, principalmente durante el uso concomitante de medicamentos ahorradores de potasio. Ver sección 4.5. Las mujeres con hipertrigliceridemia, o con antecedentes familiares de dicho trastorno, pueden tener mayor riesgo de pancreatitis cuando usan AOC. Aunque se han notificado pequeños aumentos de la presión arterial en muchas mujeres que toman AOC, son raros los casos con relevancia clínica. La discontinuación inmediata del uso de AOC sólo está justificada en estos casos raros. Si durante el uso de un AOC en pacientes con hipertensión preexistente se observan valores constantemente elevados de la presión arterial o un aumento significativo de ésta que no responden adecuadamente al tratamiento antihipertensivo, debe retirarse el AOC. Si con el tratamiento antihipertensivo se alcanzan valores normales de presión arterial, puede reanudarse la toma de AOC si se considera apropiado. Se ha notificado que las siguientes afecciones pueden aparecer o empeorar tanto durante el embarazo como durante el uso de AOC, pero los datos relativos a su asociación con los AOC no son concluyentes: ictericia y/o prurito relacionado con la colestasis, cálculos biliares, porfiria, lupus eritematoso sistémico, síndrome hemolítico urémico, corea de Sydenham, herpes gestacional, perdida de la audición relacionada con la otosclerosis. En las mujeres con angioedema hereditario, los estrógenos exógenos pueden inducir o exacerbar los síntomas de angioedema. Las alteraciones agudas o crónicas de la función hepática pueden requerir la discontinuación del uso de AOC hasta que los marcadores de la función hepática retornen a valores normales. La recurrencia de una ictericia colestásica y/o un prurito asociado a colestasis que se hayan manifestado previamente durante un embarazo, o durante el uso previo de esteroides sexuales requiere la discontinuación de los AOC. Aunque los AOC pueden afectar a la resistencia periférica a la insulina y la tolerancia a la glucosa, no existen datos que indiquen que sea necesario alterar la pauta terapéutica en diabéticas que usan AOC a dosis bajas (con < 0,05 mg de etinilestradiol). En cualquier caso, las mujeres diabéticas deben ser vigiladas cuidadosamente, especialmente durante la etapa inicial del uso de AOC. Durante el uso de AOC se ha notificado empeoramiento de la depresión endógena, de la epilepsia, de la enfermedad de Crohn y de la colitis ulcerosa. Ocasionalmente puede aparecer cloasma, especialmente en las mujeres con antecedentes de cloasma gravídico. Las mujeres con tendencia al cloasma deben evitar la exposición al sol o a la radiación ultravioleta mientras están tomando AOC. Exploración/consulta médica. Antes de iniciar o reanudar el tratamiento con Drosure, Drosure Diario, Drosurelle o Drosurelle Diario, es necesario determinar los antecedentes médicos completos (incluidos los antecedentes familiares) y descartar un posible embarazo. Se debe medir la presión arterial y realizar una exploración física guiada por las contraindicaciones (ver sección 4.3) y las advertencias (ver sección 4.4). También hay que indicar a la paciente que lea cuidadosamente el prospecto y siga las instrucciones que en él se proporcionan. La frecuencia y la naturaleza de las exploraciones deben basarse en las recomendaciones clínicas establecidas y se adaptarán a cada caso concreto. Se debe advertir a las usuarias que los anticonceptivos orales no protegen frente a la infección por VIH (SIDA) ni frente a otras enfermedades de transmisión sexual. Disminución de la eficacia. La eficacia de los AOC puede disminuir, por ejemplo, en caso de olvido de la toma de los comprimidos (ver sección 4.2), trastornos gastrointestinales, como vómitos o diarrea grave (ver sección 4.2) o uso de medicación concomitante (ver sección 4.5). Reducción del control de los ciclos. Todos los AOC pueden dar lugar a sangrados irregulares (manchado o hemorragia por deprivación), especialmente durante los primeros meses de uso. Por lo tanto, la evaluación de cualquier sangrado irregular sólo es significativa tras un intervalo de adaptación de unos tres ciclos. Si las irregularidades en el sangrado persisten o se producen tras ciclos previos regulares, deberán tenerse en cuenta posibles causas no hormonales, y están indicadas medidas diagnósticas adecuadas para excluir un tumor maligno o un embarazo. Éstas pueden incluir el legrado. En algunas mujeres puede no producirse la hemorragia por deprivación durante la fase de descanso sin comprimidos/ o la fase de comprimidos placebo. Si el AOC se ha tomado siguiendo las instrucciones descritas en la sección 4.2, es poco probable que la mujer esté embarazada. Sin embargo, si el AOC no se ha tomado siguiendo estas indicaciones antes de producirse la primera falta de hemorragia por deprivación, o si faltan dos hemorragias por deprivación, se debe descartar un embarazo antes de continuar tomando el AOC. Cada comprimido activo de color amarillo de Drosure o Drosure Diario contiene 62 mg de lactosa y y los comprimidos blancos placebo de Drosure Diario contienen 89,5 mg. Cada comprimido activo de color rosa de Drosurelle o Drosurelle Diario contiene 44 mg de lactosa por comprimido, y los comprimidos blancos placebo contienen 89.5 mg. Los pacientes con intolerancia hereditaria a la galactosa, insuficiencia de lactasa Lapp (insuficiencia observada en ciertas poblaciones de Laponia) o malabsorción de glucosa o galactosa no deben tomar este medicamento.4.5 Interacción con otros medicamentos y otras formas de interacción. Nota: deben consultarse las fichas técnicas de los medicamentos concomitantes con el fin de identificar interacciones potenciales. Influencia de otros medicamentos sobre Drosure/Drosure Diario/Drosurelle/Drosurelle Diario. Las interacciones entre anticonceptivos orales y otros medicamentos pueden producir hemorragia por deprivación y/o fallo de la anticoncepción. Las siguientes interacciones han sido comunicadas a través de la literatura médica. Esto se ha confirmado con hidantoínas, barbitúricos, primidona, carbamazepina y rifampicina; también existe sospecha de que esto ocurra con: oxcarbazepina, topiramato, felbamato, ritonavir, griseofulvina y la planta medicinal hierba de San Juan (Hypericum perforatum). Parece que el mecanismo de esta interacción se basa en las propiedades inductoras de enzimas hepáticas de estos fármacos. Habitualmente la inducción enzimática máxima no se observa hasta que transcurren 2–3 semanas, pero puede mantenerse al menos hasta 4 semanas después de la discontinuación del tratamiento. También se han notificado fallos de los anticonceptivos con los antibióticos como ampicilinas y tetraciclinas. No se ha dilucidado el mecanismo de este efecto. Las mujeres tratadas durante períodos cortos (hasta de una semana) con cualquiera de los grupos de medicamentos mencionados anteriormente, o con los principios activos individuales, deben usar temporalmente un método de barrera además del AOC, es decir, durante el tiempo de administración concomitante de los medicamentos y en los 7 días siguientes a la discontinuación. Las mujeres tratadas con rifampicina deben utilizar un método de barrera además del AOC mientras dure la administración de rifampicina y durante los 28 días siguientes a su discontinuación. Si la administración concomitante del medicamento dura más que los comprimidos del envase de AOC, se debe iniciar el siguiente envase de AOC sin la habitual fase de descanso sin comprimidos. En mujeres sometidas a tratamiento a largo plazo con principios activos inductores de las enzimas hepáticas, los expertos recomiendan incrementar las dosis de esteroides anticonceptivos. Si no se desea incrementar la dosis de anticonceptivos o si dicho incremento resulta ser insatisfactorio o poco fiable, p. ej., en el caso de hemorragia por deprivación, se debe recomendar la utilización de otro método anticonceptivo no hormonal. Los principales metabolitos de drospirenona en plasma humano se generan sin la participación del sistema del citocromo P450. Por lo tanto, es poco probable que los inhibidores de este sistema enzimático influyan sobre el metabolismo de drospirenona. • Influencia de Drosure/Drosure Diario/Drosurelle/Drosurelle Diario sobre otros medicamentos. Los anticonceptivos orales pueden influir en el metabolismo de otros principios activos. En consecuencia, los niveles plasmáticos y tisulares pueden aumentar (p. ej., ciclosporina) o disminuir (p. ej., lamotrigina). Basándose en estudios de inhibición in vitro y en estudios de interacción in vivo, realizados en voluntarias que empleaban omeprazol, simvastatina y midazolam como sustrato marcador, se establece que es poco probable que se produzca una interacción de drospirenona a dosis de 3 mg con el metabolismo de otros principios activos. • Otras interacciones: En pacientes sin insuficiencia renal, el uso concomitante de drospirenona e inhibidores de la ECA o AINE no mostró un efecto significativo sobre los niveles séricos de potasio. No obstante, no ha sido estudiado el uso concomitante de Drosure con antagonistas de la aldosterona o diuréticos ahorradores de potasio. En este caso, debe monitorizarse el potasio sérico durante el primer ciclo de tratamiento. (Ver sección 4.4). • Pruebas de laboratorio. El uso de esteroides anticonceptivos puede afectar a los resultados de ciertas pruebas de laboratorio, como son los parámetros bioquímicos de la función hepática, tiroidea, suprarrenal y renal, los niveles plasmáticos de proteínas (transportadoras), por ejemplo la globulina transportadora de corticoesteroides y las fracciones lípido/lipoproteínas, los parámetros del metabolismo de los hidratos de carbono y los parámetros de la coagulación y la fibrinólisis. Por lo general, los cambios permanecen dentro de los límites normales. Drospirenona produce un aumento de la actividad de la renina plasmática y de la aldosterona plasmática, inducido por su leve actividad antimineralcorticoide. 4.6 Embarazo y lactancia. Drosure/Drosure Diario/Drosurelle/Drosurelle Diario no están indicados durante el embarazo. Si se produjera un embarazo durante el tratamiento con alguno de ellos, debe suspenderse su administración inmediatamente. Algunos estudios epidemiológicos extensos no han revelado ni un aumento del riesgo de defectos congénitos en niños nacidos de madres usuarias de AOC antes del embarazo, ni un efecto teratogénico cuando los AOC fueron tomados de forma inadvertida durante el embarazo. No se han realizado este tipo de estudios con Drosure/Drosurelle. En estudios con animales se han observado efectos adversos durante el embarazo y la lactancia (ver sección 5.3). En función de estos datos en animales, no se pueden descartar las reacciones adversas debidas a la acción hormonal de los principios activos. Sin embargo, la experiencia general con AOC durante el embarazo no proporciona datos indicativos de una reacción adversa en humanos. Los datos disponibles acerca del uso de Drosure/Drosurelle durante el embarazo son demasiado limitados para extraer conclusiones relativas a las reacciones adversas de Drosure sobre el embarazo y la salud del feto o del recién nacido. Hasta la fecha de hoy, no se dispone de datos epidemiológicos relevantes. La lactancia puede resultar afectada por los AOC, dado que éstos pueden reducir la cantidad de leche materna y alterar su composición. Por consiguiente, en general no debe recomendarse el uso de AOC hasta que la madre haya cesado completamente la lactancia de su hijo. Durante el uso de AOC pueden eliminarse a través de la leche pequeñas cantidades de esteroides anticonceptivos y/o de sus metabolitos. Estas cantidades pueden afectar al lactante. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas. No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. No se han observado efectos sobre la capacidad para conducir y utilizar máquinas en usuarias de AOC. 4.8 Reacciones adversas. Los efectos adversos graves de los AOC se indican en la sección 4.4 Se han descrito las siguientes reacciones adversas durante el uso de Drosure/Drosurelle: La siguiente tabla enumera las reacciones adversas según la clasificación por órganos y sistemas de MedDRA (MedDRA SOCs). Drosure/Drosure Diario: Clasificación por órganos y sistemas. Frecuencia de las reacciones adversas: Frecuentes (≥ 1/100 a < 1/10); Poco frecuentes (≥ 1/1000 a < 1/100); Raras(≥ 1/10 000 a < 1/1000). Trastornos del sistema inmunológico: Raras: Asma. Trastornos endocrinos: Frecuentes: Trastornos menstruales, Hemorragia intermenstrual, Dolor de mama. Raras: Secreción mamaria. Trastornos del sistema nervioso: Frecuentes: Cefalea, Estado de ánimo depresivo. Poco frecuentes: Cambios de la libido. Trastornos del oído y del laberinto: Raras: Hipoacusia. Trastornos vasculares: Frecuentes: Migrañas. Poco frecuentes: Hipertensión, Hipotensión. Raras: Tromboembolia. Trastornos gastrointestinales: Frecuentes: Náuseas. Poco frecuentes: Vómitos. Trastornos de la piel y del tejido subcutáneo: Poco frecuentes: Acné, Eccema, Prurito. Trastornos del aparato reproductor y de la mama: Frecuentes: Leucorrea, Candidiasis vaginal. Poco frecuentes: Vaginitis. Trastornos generales y alteraciones en el lugar de administración: Poco frecuentes: Retención de líquidos, Cambios en el peso corporal. Drosurelle/Drosurelle Diario: Clasificación por órganos y sistemas. Frecuencia de las reacciones adversas: Frecuentes (≥ 1/100 a < 1/10); Poco frecuentes (≥ 1/1000 a < 1/100). Infecciones e infestaciones: Poco frecuentes: Candidiasis, Herpes simple. Trastornos del sistema inmunológico. Poco frecuentes: Reacción alérgica. Trastornos del metabolismo y de la nutrición. Poco frecuentes: Aumento del apetito. Trastornos psiquiátricos. Frecuentes. Inestabilidad emocional. Poco frecuentes. Depresión, Nerviosismo,Trastornos del sueño, Disminución de la libido. Trastornos del sistema nervioso. Frecuentes: Cefalea. Poco frecuentes: Parestesia, Mareo. Trastornos oculares: Poco frecuentes: Molestias visuales. Trastornos cardíacos. Poco frecuentes: Extrasístoles, Taquicardia. Trastornos vasculares. Poco frecuentes: Embolia pulmonar,Hipertensión, Migrañas, Venas varicosas. Trastornos respiratorios, torácicos y mediastínicos. Poco frecuentes. Faringitis. Trastornos gastrointestinales. Frecuentes: Dolor abdominal. Poco frecuentes. Náuseas, Vómitos, Gastroenteritis, Diarrea, Estreñimiento, Trastornos gastrointestinales. Trastornos de la piel y del tejido subcutáneo. Frecuentes. Acné; Poco frecuentes: Angioedema, Alopecia, Prurito, Exantema, Sequedad cutánea, Seborrea, Trastornos de la piel. Trastornos musculoesqueléticos y del tejido conjuntivo. Poco frecuentes: Dolor de cuello, Dolor en las extremidades, Calambres musculares. Trastornos renales y urinarios. Poco frecuentes: Cistitis. Trastornos del aparato reproductor y de la mama. Frecuentes: Dolor de mama, Aumento del tamaño de las mamas, Dismenorrea, Metrorragia. Poco frecuentes: Neoplasia de mama, Mastopatia fibroquística, Galactorrea, Quiste ovárico, Sofocos, Trastornos menstruales, Amenorrea, Menorragia, Candidiasis vaginal, Vaginitis,Flujo vaginal, Trastorno vulvovaginal, Sequedad vaginal, Dolor pélvico, Frotis de Papanicolau anormal. Trastornos generales y alteraciones en el lugar de administración. Poco frecuentes: Edema, Astenia, Dolor, Sed excesiva, Aumento de la sudoración. Exploraciones complementarias. Frecuentes: Aumento de peso; Poco frecuentes. Pérdida de peso. Se han notificado los siguientes acontecimientos adversos graves en las mujeres usuarias de AOC, que se detallan en la sección 4.4: • Trastornos tromboembólicos venosos; • Trastornos tromboembólicos arteriales; • Hipertensión; • Tumores hepáticos; • Aparición o deterioro de cuadros en los que la asociación con un AOC no resulta concluyente: enfermedad de Crohn, colitis ulcerosa, epilepsia, migraña, endometriosis, mioma uterino, porfiria, lupus eritematoso sistémico, herpes gestacional, corea de Sydenham, síndrome hemolítico urémico, ictericia colestásica; • Cloasma; • Los trastornos agudos o crónicos de la función hepática pueden requerir la discontinuación del uso de AOC hasta que los marcadores de la función hepática retornen a la normalidad. En mujeres con angioedema hereditario, los estrógenos exógenos pueden inducir o exacerbar los síntomas de angioedema. La frecuencia del diagnóstico de cáncer de mama entre usuarias de AOC es ligeramente mayor. Dado que el cáncer de mama es raro en mujeres menores de 40 años, este aumento es pequeño con relación al riesgo global de cáncer de mama. Se desconoce la causalidad relacionada con el uso de AOC. Para más información, ver las secciones 4.3 y 4.4. 4.9 Sobredosis. No se han notificado casos de sobredosis con Drosure/Drosure Diario/Drosurelle/Drosurelle Diario . Según la experiencia general con los anticonceptivos orales combinados, los síntomas que posiblemente pueden producirse en caso de sobredosis de comprimidos activos son: náuseas, vómitos y, en las chicas jóvenes, hemorragia vaginal leve. No existe antídoto y el tratamiento debe ser sintomático. 6. DATOS FARMACÉUTICOS. 6.1 Lista de excipientes. Drosure: Núcleo del comprimido: Lactosa monohidrato, Almidón de maíz, Almidón de maíz pregelatinizado, Crospovidona, Povidona, Polisorbato 80, Estearato de magnesio, Cubierta: Alcohol polivinílico parcialmente hidrolizado, Dióxido de titanio (E171), Macrogol 3350, Talco, Óxido de hierro amarillo (E172). Drosure Diario: Comprimidos activos (comprimidos amarillos): Núcleo del comprimido: Lactosa monohidrato, Almidón de maíz, Almidón de maíz pregelatinizado, Crospovidona, Povidona, Polisorbato 80, Estearato de magnesio. Cubierta: Alcohol polivinílico parcialmente hidrolizado, Dióxido de titanio (E171), Macrogol 3350, Talco, Óxido de hierro amarillo (E172). Comprimidos placebo (comprimidos blancos): Núcleo del comprimido: Lactosa anhidra, Povidona, Estearato de magnesio. Cubierta: Alcohol polivinílico parcialmente hidrolizado, Dióxido de titanio (E171), Macrogol 3350, Talco. Drosurelle: Núcleo del comprimido: Lactosa monohidrato, Almidón de maíz pregelatinizado, Povidona, Croscarmelosa sódica, Polisorbato 80, Estearato de magnésio. Cubierta: Alcohol polivinílico parcialmente hidrolizado, Dióxido de titanio (E171) Macrogol 3350, Talco, Óxido de hierro amarillo (E172), Óxido de hierro rojo (E172), Óxido de hierro negro (E172). Drosurelle Diario: Comprimidos activos (comprimidos rosas): Núcleo del comprimido: Lactosa monohidrato, Almidón de maíz pregelatinizado, Povidona, Croscarmelosa sódica, Polisorbato 80, Estearato de magnésio, Cubierta: Alcohol polivinílico parcialmente hidrolizado, Dióxido de titanio (E171), Macrogol 3350, Talco, Óxido de hierro amarillo (E172), Óxido de hierro rojo (E172), Óxido de hierro negro (E172). Comprimidos placebo (comprimidos blancos): Núcleo del comprimido: Lactosa anhidra, Povidona, Estearato de magnésio. Cubierta: Alcohol polivinílico parcialmente hidrolizado, Dióxido de titanio (E171), Macrogol 3350, Talco. 6.2 Incompatibilidades: No procede. 6.3 Período de validez: 3 años. 6.4 Precauciones especiales de conservación: Este medicamento no requiere condiciones especiales de conservación. 6.5 Naturaleza y contenido del envase: Blísteres con lámina de aluminio de apertura mediante presión y película de PVC/PVDC. Drosure: Tamaños de envase: 1 x 21 comprimidos recubiertos con película; 3 x 21 comprimidos recubiertos con película. Drosure Diario: Tamaños de envase: 1 x 28 comprimidos recubiertos con película (21 activos y 7 placebo); 3 x 28 comprimidos recubiertos con película (21 activos y 7 placebo). Drosurelle: Tamaños de envase: 1 x 21 comprimidos recubiertos con película; 3 x 21 comprimidos recubiertos con película. Drosurelle Diario: Tamaños de envase: 1 x 28 comprimidos recubiertos con película (21 activos y 7 placebo); 3 x 28 comprimidos recubiertos con película (21 activos y 7 placebo). 6.6 Precauciones especiales de eliminación y otras manipulaciones: Ninguna especial. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN: Laboratorios Effik, S.A. C/ San Rafael , 3- 28108 Alcobendas (Madrid) España. 8. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN: Drosure 0,03 mg/3 mg comprimidos recubiertos con película EFG: 72.031; Drosure Diario 0,03 mg/3 mg comprimidos recubiertos con película EFG: 72.037; Drosurelle 0,02 mg/3 mg comprimidos recubiertos con película EFG: 72.028; Drosurelle Diario 0,02 mg/3 mg comprimidos recubiertos con película EFG: 72.039. 9. FECHA DE LA PRIMERA AUTORIZACIÓN: 28 de Marzo de 2011. 10. FECHA DE LA REVISIÓN DEL TEXTO: Febrero 2011. PRESENTACIONES Y PVP: Drosure 0,03 mg/3 mg comprimidos recubiertos con película EFG: 1 x 21: PVL 6,34 €, PVP 9,52 €, PVP IVA 9,90 €; 3x 21: PVL 17,92 €, PVP 26,90 €, PVP IVA 27,97 €. Drosure Diario 0,03 mg/3 mg comprimidos recubiertos con película EFG: 1 x 28: PVL 6,34 €, PVP 9,52 €, PVP IVA 9,90 €; 3x 28: PVL 17,92 €, PVP 26,90 €, PVP IVA 27,97 €. Drosurelle 0,02 mg/3 mg comprimidos recubiertos con película EFG: 1x21: PVL 6,34 €, PVP 9,52 €, PVP IVA 9,90 €; 3x21: PVL 17,92 €, PVP 26,90 €, PVP IVA 27,97 €. Drosurelle Diario 0,02 mg/3 mg comprimidos recubiertos con película EFG: 1 x 28: PVL 6,34 €, PVP 9,52 €, PVP IVA 9,90 €; 3x 28: PVL 17,92 €, PVP 26,90 €, PVP IVA 27,97 €. Medicamento sujeto a prescripción médica. MEDICAMENTO INCLUIDO EN LA PRESTACIÓN FARMACÉUTICA DEL SNS. Aportación normal. SOCIEDADE GALEGA DE CONTRACEPCIÓN CASO CLÍNICO: DESPLAZAMIENTO (MIGRACIÓN) DE IMPLANTE SUBDERMICO ANTICONCEPTIVO EDUARDO ENRIQUE YÁÑEZ GONZÁLEZ Ginecólogo. Jefe de Sección de Ginecología. Complexo Hospitalario Universitario de Vigo. COF-CIOIA. Sin antecedentes personales ni familiares de interés, destaca que adelgazó 36 Kg. en 18 meses, ya que pesaba 120 Kg. y está a tratamiento con Diazepam, prescrito por su Psicólogo. Refiere “alergia al Augmentine” INTRODUCCION Desde la aparición del implante subdérmico anticonceptivo hace 10 años aproximadamente, su uso está aumentando considerablemente, hasta el punto de que hay más de un millón de usuarias de éste método en todo el mundo. Aporta analítica, rigurosamente normal. A la exploración clínica, se aprecia sangre fresca procedente de cavidad, UTERO en anteversoflexión, de características normales y ANXS normales. A medida que aumenta la experiencia de su uso, los profesionales estamos aprendiendo a descubrir pequeñas alteraciones, efectos secundarios o complicaciones que hasta ahora no se habían visto, y a buscarles solución. El FROTIS EN FRESCO, hemorrágico, sin signos de infección/ inflamación y en la ECOGRAFIA VAGINAL, el útero es regular con cavidad dilatada (5,9 mm), ocupada pos sangre/coágulos., OVARIO DERECHO de características normales y OVARIO IZQUIERDO, con pequeño quiste de 17 mm. Una de estas complicaciones es la migración (desplazamiento) del implante desde el lugar de inserción original, a zonas próximas o alejadas del mismo. Hay registrados casos de inserciones sin seguir las indicaciones de la ficha técnica, lo que da lugar a un fracaso del método, o de mala técnica de inserción, lo cual da lugar a implantaciones anómalas, no subdérmicas, demasiado profundas, como inserción en músculo bíceps no siendo palpable y siendo necesario el usar técnicas especiales de diagnóstico, como la RNM o la radiografía, habiendo mejorado considerablemente dicha localización, con el nuevo Implanón NXT, al ser radiopaco . Se palpa el implante, una sola varilla, en el 1/3 superior del brazo izquierdo, cara interna, palpándose su extremo distal alejado del punto de inserción a 4 cms y en posición oblicua respecto al eje longitudinal del brazo ( Fig. 1). Al inicio de su uso, se tiene insertado el implante en abdomen, muslo o cara externa del brazo no dominante, lo cual era motivo del desplazamiento. Los estudios realizados , concluyeron que el mejor lugar para la inserción, era el surco interbicipital del brazo no dominante, a unos 8 - 10 cms del cóndilo interno del húmero, disminuyendo así el número de desplazamientos. Sin embargo, nuevas causas ajenas a la técnica comenzaron a aparecer, y aunque hay que seguir observando estas primeras impresiones, el razonamiento lógico nos lleva a pensar que vamos por el buen camino para descubrir los motivos. Fig. 1 CASO CLINICO El peso es de 83 Kg., T: 1.62 m (IMC: 32, corresponde a obesidad de tipo I) y TA 123/ 91 mmHg. Presentamos un caso real de una paciente de 23 años que demanda consulta por ser usuaria del implante subdérmico anticonceptivo de una sola varilla (Implanón), insertado en la localidad portuguesa de Barcelos el 2 de febrero de 2011. Se retira el implante sin dificultad (Fig 2), pudiéndose apreciar la zona “recorrida” por el implante desde el punto inicial de inserción (Fig. 3) La paciente decide no usar ningún otro método, ya que “prefiere descansar”, después de esta experiencia, para ella, tan traumática. Desde su inserción tiene pérdidas de sangre continuas, sintiéndose cada vez peor en su estado general, refiere que no palpa el implante en su lugar de inserción y siente mareos, lo que motiva el deseo de extraer el implante. 11 SOCIEDADE GALEGA DE CONTRACEPCIÓN Los otros trabajos encontrados sobre este tema, se refieren sobretodo, a técnicas de localización del implante desplazado, concluyendo que la ecografía y la Resonancia Magnética (RNM), son los medios diagnósticos mas eficaces. Por todo ello, podemos decir que aportamos un caso más de Desplazamiento de Implante Subdérmico Anticonceptivo de una sola varilla (Implanón), con una migración craneal de 4 cms, la mayor descrita hasta ahora en la literatura, y cuya causa, suponemos, sea la pérdida de peso, al disminuir la grasa subcutánea donde se encontraba el implante. Esto da lugar a alteraciones endometriales que se manifiestan por pérdidas sanguíneas, lo cual es el efecto adverso más frecuente y motivo de abandono del método, si la paciente no tiene una buena información sobre este síntoma. Fig. 2 Los demás efectos secundarios observados en este caso, (malestar general, etc), posiblemente se deban a la coexistencia de un estado de nerviosismo de origen distinto al método, sugerido por su tratamiento psicológico, lo cual refuerza el motivo de abandono, por lo que “reclama un descanso”. Recordar que el implante anticonceptivo subdérmico es un método de alta eficacia (> 99%), indicado para aquella mujer con deseo de una anticoncepción muy segura de larga duración, que no quiera o pueda usar estrógenos, y que comprenda el patrón de sangrado y los beneficios no anticonceptivos del mismo. REFERENCIAS 1.-Rafael Gerardo Buitron Figueroa; Alejandro Rodríguez- Báez; Juan González de la Cruz; Armando vargas Domínguez; Roger Lara-Ricalde; Braulio Otero Flores: Localización difícil de implante anticonceptivo subdérmico de varilla única. Informe de dos casos. Cirugía y cirujanos. Cir Cir 2011;79:182-185. Fig. 3 DISCUSION La Literatura sobre desplazamiento del implante anticonceptivo subdérmico, es escasa, estando descrito como poco frecuente, siendo este desplazamiento de tipo craneal (como en nuestro caso) el más frecuente, y caudal, menos habitual. 2.-Macarenhas L: Insertion and renoval of Implanón: practical considerations. Eur J Contracept Reprod health care 2000. 3.-Bensouda-Grimaldi L et al: Insertion problems, renoval problems, and contraception failures with Implanón. Gynecol Obstet Fertil. 2005; 33(12):986-90. 4.-Evans R et al: Migration of Implanon: Two cases reports, J Fam Plann Reprod Health Care. 2005;31(1): 71-2. La mayoría de los casos eran desplazamientos de hasta 2 cms, tanto craneales, como caudales, y en pocos estudios se observaron migraciones de más de 2 cms, siendo dicho desplazamiento de tipo craneal. 5.-Ismail H, Mansour D, Sing M. :Migration of Implanon. Central Family Planic Clinic, Norfolk and Norwich University Hospital, Norwich, [email protected] Bensonda y Grimaldi et al, describen un análisis de un estudio de vigilancia nacional sobre implantes para los Centros Regionales franceses de Vigilancia Farmacológica y Drogas y a Organon SA, entre mayo del año 2001 y Septiembre del año 2002, informando de 28 migraciones con algunos casos de embarazo y problemas tanto en la inserción, como en la extracción. Evans et al, estudian casos de migración de implantes subdérmicos, realizando una amplia revisión de la literatura, concluyendo, que “la migración del implante es rara” 12 SOCIEDADE GALEGA DE CONTRACEPCIÓN ¿AFECTAN LOS ANTICONCEPTIVOS HORMONALES AL DESEO SEXUAL? David Gómez Sánchez. Servicio de Obstetricia y Ginecología. Hospital de Verín. La sexualidad constituye un aspecto central de la calidad de vida de la mujer, siendo un reflejo de su nivel de bienestar físico, psicológico y social. La aparición de la anticoncepción hormonal en los años 60 supuso un gran cambio en la sexualidad femenina al ofrecer la posibilidad de mantener relaciones sexuales sin el temor a un posible embarazo. mucosa de los labios menores y de la región vestibular, provocando un empeoramiento del dolor durante las relaciones sexuales. Argumentos en contra Diversos estudios, como el de Davis con 1423 muje11 res australianas , no han podido establecer una relación entre los bajos niveles de andrógenos y una disminución del deseo sexual. A pesar de observarse una disminución de los niveles de testosterona total y libre con la toma de ACO, distintos estudios no han observado dife12,13 rencias en la función sexual , mientras que otros han 14,15 observado una mejoría . Desde sus inicios, la píldora anticonceptiva ha estado rodeada de mitos y polémica sobre sus posibles efectos secundarios. Uno de los menos estudiados ha sido la posible disminución del deseo sexual. Curiosamente, en los primeros años de uso el temor era el efecto contrario: muchos medios de comunicación de la época alertaban de que podía llevar a las mujeres a la “anarquía sexual”1. Otro argumento en contra del peso de los andrógenos en la función sexual de la mujer es el hecho de que, mientras los niveles de testosterona total en una mujer desde los 20 a los 40 años se reducen a la mitad, su capacidad sexual suele mejorar. En un estudio sueco de 2005 con 325 mujeres a las que se le realizó histerectomía por enfermedad benigna, se observó que las mujeres a las que se realizó doble anexectomía con THS posterior tenían una mejor función sexual que las que realizaron histerectomía simple, secundaria a una mejor percepción de los beneficios de la cirugía sobre su calidad 16 de vida . Por otra parte, la mayor parte de las mujeres con el síndrome de insensibilidad completa a andrógenos (debido a una mutación en el receptor), no muestran alteraciones en la esfera sexual. En la actualidad, se calcula que existen unas 100 millones de usuarias de anticoncepción hormonal en el mundo1, y la polémica persiste, hasta el punto de que algunas corrientes feministas norteamericanas afirman irónicamente que la píldora es el mejor método anticonceptivo, porque disminuye radicalmente la frecuencia de actividad sexual2. Argumentos a favor La existencia de un posible componente biológico parte de los estudios con primates, en los que se observó que la administración de anticonceptivos a chimpancés hembra disminuía la frecuencia de cópulas, debida a una menor hinchazón anogenital (característica del período ovulatorio, debida posiblemente a una elevación de los niveles plasmáticos de estradiol y que sirve para señalar su período fértil). No obstante, estos efectos negativos eran mucho menos acusados en las parejas que previamente parecían más compatibles y copulaban 3 con mayor frecuencia . El nuevo modelo circular de respuesta sexual femeni17,18 na propuesto por Basson , establece que el principal estímulo en la mujer para desencadenar la respuesta sexual es la intimidad y la cercanía emocional con su pareja, siendo el deseo espontáneo poco frecuente en las mujeres que tienen una relación estable en el tiempo. Por tanto, la sexualidad femenina es sumamente compleja, viéndose afectada por múltiples factores (autoestima, percepción corporal y de la propia salud, relación de pareja, factores psicológicos, sociales...), siendo muy difícil poderlos valorar conjuntamente en un estudio clínico. Se ha relacionado el posible efecto de disminución del deseo sexual secundario a la toma de anticonceptivos con el aumento de la síntesis hepática de la SHBG (globulina transportadora de esteroides sexuales), y el consiguiente descenso de los niveles de andrógenos circulantes, testosterona total y libre4,5. Un aspecto a tener cuenta es el concepto de nocebo: si las mujeres son informadas de posibles efectos adversos, pueden referir estos síntomas como consecuencia del poder de sugestión. Un ejemplo lo tenemos en el célebre estudio de Framingham: las mujeres que creían que tenían un riesgo incrementado de infarto de miocardio tenían cuatro veces más probabilidades de sufrir un evento coronario, independiente de sus factores de riesgo 19 conocidos . Desde finales de los años sesenta empezaron a aparecer trabajos que relataban unos porcentajes variables (5-32%) de disminución de deseo sexual1. Posteriormente, diversos estudios, entre los que se incluyen dos ensayos clínicos controlados con placebo6,7, han mostrado una disminución de la libido en usuarias de ACO8,9. Por otra parte, algunos trabajos han relacionado la toma de ACO con un aumento de riesgo de vulvodinia, al disminuir los estrógenos el umbral de sensibilidad de la 1 mucosa al dolor mecánico . Un reciente trabajo de Bata10 glia , relaciona la toma de 30mcgEE/3mg drospirenona durante 3 meses con una disminución del espesor de la Es bastante común el miedo en las nuevas usuarias a los posibles efectos secundarios, lo que puede llevar a la aparición de los mismos. Las quejas de salud inespecíficas, entre ellas la falta de deseo sexual, son muy especí- 13 SOCIEDADE GALEGA DE CONTRACEPCIÓN ficas en la población general, y a veces son muy difíciles de distinguir de verdaderos efectos secundarios. cada dominio, siempre menores a medio punto, no alcanzasen significación clínica. Estos síntomas somáticos inespecíficos son mucho más frecuentes en pacientes con ansiedad y depresión. Así, un estudio publicado este año con 354 mujeres relaciona el estrés y el estado de ánimo deprimido al inicio de la toma de ACO con una mayor percepción de cambios de humor y de peso atribuidos a la toma de anticonceptivos, factores ambos que influyen en la respuesta 20 sexual . En cuanto a los métodos con sólo gestágenos, algunos estudios han asociado el acetato de medroxiprogesterona inyectable con aumento de la sequedad vaginal por descenso de los niveles de estrógenos y consecuente dispareunia, encontrando en torno al 5% de descenso 1 de libido . Sin embargo, otros estudios no han hallado diferencias en la función sexual. Un estudio reciente con 50 mujeres que compara el acetato de medroxiprogesterona inyectable (DMPA) con la toma de ACO, no encontró diferencias clínicamente significativas en ambos grupos, a pesar de que el grupo de mujeres con ACO tenían concentraciones más altas de estradiol y niveles plasmá24 ticos inferiores de testosterona total y libre . En cuanto al implante de levonorgestrel (Implanon), un estudio de Gezginc con 80 mujeres indica que el 2,5 % lo retiraron por 25 una disminución de la libido . Últimos estudios En 2010, Wallwiener21 aplicó el cuestionario Índice de Función Sexual Femenina (FSFI) a 1086 estudiantes de medicina alemanas, encontrando puntuaciones significativamente inferiores en las usuarias de ACO (28,3) con respecto a las no usuarias de métodos anticonceptivos (29,5) y a las que usaban métodos anticonceptivos no hormonales (31,0). No se encontraron diferencias significativas entre los distintos progestágenos, ya fuesen androgénicos o antiandrogénicos, ni entre las formulaciones con 20, 30 o >30 mcg etinilestradiol. Con respecto al DIU Mirena, los últimos estudios lo han relacionado con una mejora discreta de la respuesta sexual, posiblemente asociadas a la mejora de la calidad de vida debida a una mejora del patrón de sangrado y a 26,27 una anticoncepción eficaz . Strufaldi22, en otro ensayo clínico randomizado con 101 nuevas usuarias de ACO publicado ese mismo año, encontró que el grupo de mujeres de 30mcg EE/150 mg LNG presentaba mayores niveles en plasma de SHBG y menores concentraciones de testosterona total y libre en comparación con las usuarias de 20mcg EE/100 mg LNG. Sin embargo, ambos grupos presentaban mejores valores en el cuestionario FSFI a los 6 meses de uso, alcanzando en el grupo de 20 mcg/100mg LNG significación estadística en el dominio deseo. Un nuevo enfoque Una de las incógnitas que los investigadores tratan de resolver es por qué algunas mujeres podrían ser más sensibles a los cambios hormonales producidos por los anticonceptivos. Una respuesta podría estar en la sensibilidad genética a los andrógenos. Oionen, en 2009, halló que las mujeres con un bajo cociente entre la longitud del segundo y del cuarto dedo (un marcador antropométrico de la exposición a andrógenos, encontrado frecuentemente en hombres) sufrían con más frecuencia efectos negativos emocionales y sexuales con la toma 28 de ACO . A la hora de interpretar estos estudios, debemos diferenciar significación estadística de significación clínica. El test FSFI, desarrollado y validado por Rosen en el año 2000, consta de 19 preguntas y avalúa la sexualidad en 6 dominios: deseo, excitación, lubricación, orgasmo, dolor y satisfacción. Su puntuación oscila de 1 a 36 puntos, por lo que es improbable que una diferencia de 1 punto represente una diferencia clínica. Métodos hormonales alternativos a los ACO La sensibilidad a andrógenos podría estar mediada por el gen del receptor de andrógenos (AR), localizado 29 en el brazo corto del cromosoma X (Xq11-12) . El número de repeticiones del trinucleótido CAG podría estar relacionado con la actividad del receptor. Con respecto al anillo vaginal, Guida15, en un ensayo clínico de 75 mujeres, observó que las usuarias del anillo tenían un aumento de interés sexual, fantasías y complicidad de la pareja respecto a las usuarias de ACO y las pacientes del grupo control. Estos efectos positivos no se pudieron comprobar en un estudio más reciente en 500 mujeres que comparaba los efectos del parche y del anillo en usuarias previas de ACO23. Al aplicar el cuestionario FSFI a los 3 meses de uso, se observó que las mujeres del grupo del anillo tenían puntuaciones significativamente menores en los dominios excitación, lubricación y dolor, mientras que las usuarias del parche mostraban mejores puntuaciones en 5 de los 6 dominios. Para los autores estos resultados podían deberse al hecho de que el 37% de las usuarias del anillo declaraban notarlo en sus relaciones sexuales, aunque las diferencias en Así, un estudio de la Universidad de Gante publicado en 2012 estudió la respuesta sexual en 55 parejas usuarias de ACO, píldora de sólo gestágenos y anillo vaginal de forma consecutiva. Las mujeres que tenían mayor número de repeticiones CAG (homocigotas LL) demostraron tener un mayor deseo sexual durante el uso del anillo vaginal. Los investigadores establecen la hipótesis de que las mujeres de este grupo tienen un receptor de andrógenos más activo, por lo que son menos sensibles a la reducción de la testosterona libre inducida por los anticonceptivos. Aunque las puntuaciones tendían a disminuir a lo largo del estudio independientemente del método anticonceptivo utilizado, el factor más determinante era el nivel de deseo al inicio del estudio, señalando que el deseo sexual femenino es una variable intrapersonal característica bastante estable. 29 14 SOCIEDADE GALEGA DE CONTRACEPCIÓN 10.-Battaglia C, Battaglia B, Mancini F, Busacchi P, Paganotto MC, Morotti E, Venturoli S. Sexual behavior and oral contraception: A pilot study. J Sex Med 2012;9:550–7. Por otra parte, también se está estudiando el papel que pueden tener los estrógenos en la modulación de los neurotransmisores cerebrales, hecho que podría afectar al deseo sexual. Un estudio realizado en 2009 con 150 mujeres a tratamiento con inhibidores selectivos de la recaptación de serotonina (ISRS), puso de manifiesto que las mujeres con variante 5HTTLPR ll en el gen del transportador de serotonina, tenían 8 veces más riesgo de desarrollar una disfunción sexual si usaban anticonceptivos. Sin embargo, si no se realizaba el análisis por genotipos, en conjunto las usuarias de anticonceptivos no mostraron un mayor riesgo de disfunción sexual30. 11.-Davis SR, Davison SL, Donath S, Bell RJ. Circulating androgen levels and self-reported sexual function in women. JAMA 2005;294:91-6. 12.-Greco T, Graham CA, Bancroft J, Tanner A, Doll HA. The effects of oral contraceptives on androgen levels and their relevance to premenstrual mood and sexual interest: a comparison of two triphasic formulations containing norgestimate and either 35 or 25μg of ethinyl estradiol. Contraception 2007;76:8-17. 13.-Graham CA, Bancroft J, Doll HA, Greco T, Tanner A. Does oral contraceptive-induced reduction in free testosterone adversely affect the sexuality of mood in women. Psychoeuroendocrinology 2007;32:246-55. 14.-Caruso S, Agnello C, Intelisano G, Farina M, Di Mari L,Sparacino L, Cianci A. Prospective study on sexual behaviour of women using 30 microg ethinylestradiol and 3 mg drospirenone oral contraceptive. Contraception 2005;72:19-23. Conclusión Las revisiones más recientes de la literatura concluyen que la anticoncepción hormonal tiene efectos mixtos sobre el deseo sexual: mientras que en un pequeño porcentaje de casos aumenta o disminuye, en la mayor 1,18,31 parte éste no se ve afectado . 15.-Guida M, Di Spiezio Sardo A, Bramante S, Sparice S, Acunzo G, Tommaselli GA, Di Carlo C, Pellicano M, Greco E, Nappi C. Effects of two types of hormonal contraception-oral versus intravaginal-on the sexual life of women and their partners. Hum Reprod 2005;20:1100-6. Hasta la fecha, no se ha demostrado que exista un tipo de anticonceptivo, dosis o vía de administración que afecte con mayor severidad a la esfera sexual, ni se ha conseguido identificar a un subtipo de población más susceptible de sufrir este efecto. 17.-Basson R. Female sexual response: the role of drugs in the management of sexual dysfunction. Obstet Gynecol. 2001;98:350-3. Nuestro objetivo debe ser conseguir una anticoncepción segura y que favorezca la salud sexual de la mujer. A la hora de prescribir un método anticonceptivo, debemos tener en cuenta su posible efecto sobre la sexualidad. En las visitas de control, no debemos tener miedo a preguntarle a la mujer sobre su vida sexual, dada su gran repercusión, tanto en el cumplimiento del método 18 como en su calidad de vida . 20.-Hall KS, White KO, Rickert VI, Reame N, Westhoff C. Influence of depressed mood and psychological stress symptoms on perceived oral contraceptives side effects and discontinuation in young minority women. Contraception 2012;86:518-525. 16.-Aziz A, Brännström M, Bergquist C, Silverstolpe G. Perimenopausal androgen decline after oophorectomy does not influence sexuality or psychological well-being. Fertil Steril 2005; 83(4):1021-8. 18.-Shah MB, Hoffstetter S. Contraception and sexuality Minerva Ginecol 2010;62: 331-47 19.-Grimes DA, Schulz KF. Nonspecific side effects of oral contraceptives: nocebo or noise? Contraception 2011;83:5-9. 21.-Wallwiener M, Wallwiener LM, Seeger H, Mueck AO, Zipfel S, Bitzer J, Wallwiener CW. Effects of sex hormones in oral contraceptives on the female sexual function score: A study in German female medical students. Contraception 2010; 82:155–9. 22.-Strufaldi R, Pompei LM, Steiner ML, Cunha EP, Ferreira JA, Peixoto S, Fernandes CE. Effects of two combined hormonal contraceptives with the same composition and different doses on female sexual function and plasma androgen levels. Contraception 2010;82:147-54. NOTAS: 23.-Gracia CR, Sammel MD, Charlesworth S, Lin H, Barnhart KT, Creinin MD. Sexual function in first-time contraceptive ring and contraceptive patch users. Fertil Steril 2010;93:21–8. 1.-Burrows LJ, Basha M, and Goldstein AT. The effects of hormonal contraceptives on female sexuality:A review. J Sex Med 2012;9:2213–23. 2.-Lertxundi R.¿Disminuye la libido el uso de la contracepción hormonal? 24.-Schaffir JA, Isley MM, Woodward M. Oral contraceptives vs injectable progestin in their effect on sexual behavior. Am J Obstet Gynecol 2010;203:545.e1-5. Libro de la Conferencia de consenso de la Sociedad Española de Contracepción sobre Actualización en el manejo clínico de la anticoncepción hormonal, intrauterina y de urgencia. Madrid, 26-27 noviembre 2011. Pag 118-125. 25.-Gezginc K, Balci O, Karatayli R, Colakoglu MC. Contraceptiveefficacy and side effects of Implanon. Eur J Contracept Reprod Health Care 2007;12:362–5. 3.-De la Llave, A. Conocimientos biomédicos y farmacológicos fundamentales para el estudio de la sexualidad. Salud sexual. Fundación UNED. Madrid: Ed. Dykinson ;2011.p.131. 26.-Skrzypulec V, Drosdzol A. Evaluation of quality of life and sexual functioning of women using levonorgestrel-releasing intrauterine contraceptive system-Mirena. Coll Antropol 2008;32:1059-68. 4.-Bancroft J, Sherwin B, Alexander G, Davison H. Walker A. Oral contraceptives, androgens and the sexuality of young women: II. The Role of androgens. Arch Sex Behav 1991;20:121-35. 27.-Bastianelli C, Farris M, Benagiano G. Use of the levonorgestrel-releasing intrauterine system, quality of life and sexuality. Experience in an Italian family planning center. Contraception 2011;84:402-8. 5.-Coenan C, Thomas C, Borm G, Hollanders J, Rolland R. Changes in androgen during treatment with four low dose contraceptives. Contraception 1996;53:171-6. 28.-Oionen KA. Putting a finger on potential predictor of oral contraceptive side effects: 2D:4D and middle-phalangeal hair. Psyconeuroendocrinology 2009;34:713.26. 6.-Graham CA, Sherwin BB. The relationship between mood and sexuality in women using an oral contraceptive as a treatment for premenstrual symptoms. Psychoneuroendocrinology 1993;18:273–81. 29.-Elaut E, Buysse A, De Sutter P, De Cuypere G, Gerris J, Deschepper E, T'Sjoen G. Relation of androgen receptor sensitivity and mood to sexual desire in hormonal contraception users. Contraception 2012; 85:470-9. 7.-Graham CA, Ramos R, Bancroft J, Maglaya C, Farley TM. The effects of steroidal contraceptives on the well-being and sexuality of women: A doubleblind, placebo-controlled, two centre study of combined and progestogen-only methods. Contraception 1995;52:363–9. 30.-Bishop JR, Ellingrod VL, Akroush M, Moline J. The association of serotonin transporter genotypes and selective serotonin reuptake inhibitor (SSRI)associated sexual side effects: possible relationship to oral contraceptives. Hum Psychopharmacol Clin Exp 2009;24:207-15. 8.-Sanders SA, Graham CA, Bass JL, Bancroft J. A prospective study of the effects of oral contraceptives on sexuality and well-being and their relationship to discontinuation. Contraception 2001;64:51–8. 31.-Hormonal contraception and sexual desire: a critical review. J Sex Marital Ther 2006;32(4):305-14. 9.-Panzer C, Wise S, Fantini G, Kang D, Munarriz R, Guay A, Goldstein I. Impact of oral contraceptives on sex hormone binding globulin and androgen levels: A retrospective study in women with sexual dysfunction. J Sex Med 2006;3:104–13. 15 Toda mujer tiene un Nuevo Anticonceptivo Oral Monofásico con propiedades únicas Potente actividad antiandrogénica 1,2, F.T. Excelente control del ciclo 3,4 Buen perfil de seguridad y bien tolerado 3,5 BIBLIOGRAFÍA: 1. Foster RH, Wilde MI. Dienogest. Drugs 1998 Nov; 56 (5): 825-833. 2. Wiegratz, et al. Effect of Dienogest-containig oral contraceptives on lipid metabolism. Contraception 2002:65;223-229. 3. Zimmermann T, Wisser K.-H, Dietrich H. Effects of the dienogest-containing oral contraceptive Valette® on skin and hair. Results of a postmarketing surveillance study. Drugs of Today 1999, 35 (Suppl.C): 97-104. 4. Fruzzeti F, Bitzer J. Review of clinical experience with estradiol in combined oral contraceptives. Contraception 81 (2010) 8-15 5. Golbs S, Kuhl H, Moore C. Focus on Ethinylestradiol/Dienogest. Medicine on line. http://priory.com/focus16htm 1. NOMBRE DEL MEDICAMENTO. DONABEL, comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Cada comprimido recubierto con película contiene 2 mg de dienogest y 0,03 mg de etinilestradiol. Excipientes: monohidrato de lactosa (54,6 mg), glucosa (0,085 mg) y lecitina de soja (0,031 mg). Para la lista completa de excipientes, ver sección 6.1. 3. FORMA FARMACÉUTICA. Comprimidos recubiertos con película. Comprimidos recubiertos con película de color blanco o marfil, redondo, biconvexo. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas. Anticoncepción hormonal. 4.2 Posología y forma de administración Aplicación de Donabel. Los comprimidos recubiertos con película se toman diariamente a la misma hora (si es necesario con algunos líquidos), de conformidad con el orden impreso en el blister. Un comprimido recubierto con película al día, se toma durante 21 días consecutivos. Cada envase posterior se inicia después de 7 días sin toma de comprimidos, por lo general se produce la hemorragia en este período. Normalmente, comienza a los 2-3 días después de la última píldora y puede aún continuar cuando tome el primer comprimido recubierto con película del próximo blister. Cómo iniciarDonabel .Sin tratamiento anticonceptivo hormonal (en el último mes) Un comprimido recubierto con película debe tomarse a partir del primer día del ciclo menstrual (el primer día de la menstruación se cuenta como día 1). Cambio de un anticonceptivo combinado (anticonceptivo oral combinado, anillo vaginal, parche transdérmico), a los anticonceptiv anticonceptivos orales. La mujer debe comenzar con Donabel, al día siguiente de tomar el último comprimido habitual o placebo o el día después del último comprimido activo de su AOC anterior. En el caso de haber utilizado un anillo vaginal o parche transdérmico, la mujer debe empezar a utilizar Donabel preferentemente el día en que se lo retira, pero a más tardar, cuando la siguiente aplicación deba tener lugar. Cambio a partir de un anticonceptivo solo con progestágeno (minipíldora, inyección, implante) o de un progestágeno-sistema intrauterino liberador (SIU) Las mujeres que toman solo minipildoras de progestágeno pueden cambiar en cualquier momento a los anticonceptivos orales combinados. Los que utilizan implantes o SIU pueden comenzar el día en que se retira el implante o SIU. Las mujeres que reciben inyecciones pueden empezar a tomar comprimidos recubiertos con película cuando le corresponda la siguiente inyección. Pero en todos estos casos , se deben tomar precauciones anticonceptivas adicionales durante los primeros 7 días. Utilización después de un aborto en el primer trimestre El producto se puede tomar de inmediato, no son requeridas precauciones anticonceptivas adicionales. Aplicación en el Post-parto y el uso después de un aborto en el segundo trimestre: El producto puede empezarse de 21-28 días después del parto o de un aborto en el segundo trimestre. Si el comienzo del producto se retrasa se deben tomar precauciones anticonceptivas adicionales (por ejemplo, los métodos de barrera) que serán necesarios para los primeros 7 días de la toma de la píldora. Sin embargo, si el acto sexual ya ha precedido, la existencia de un embarazo debe ser excluido, o el inicio del tratamiento debería demorarse para el próximo ciclo menstrual. Consejos en caso de olvido en la toma de comprimidos. Si se olvida tomar el comprimido dentro de las 12 horas siguientes, no son necesarias precauciones, el producto debe tomarse tan pronto como sea posible y continuar según el horario habitual. Si el comprimido se olvida durante más de 12 horas, la protección anticonceptiva puede reducirse. En este caso deben ser aplicadas las siguientes normas: 1. La toma del comprimido recubierto no debería ser interrumpida más de 7 días. 2. Para una buena inhibición del sistema hipotálamo-hipófisis-ovario los comprimidos deben ser tomados durante 7 días sin interrupción. Basado en estos, se pueden dar los siguientes consejos para la práctica cotidiana: Primera semana El paciente debe tomar el último comprimido olvidado, incluso si esto significa tomar dos comprimidos en un día y luego seguir tomando en el tiempo normal. Precauciones anticonceptivas adicionales (por ejemplo, preservativo) debe usarse durante los 7 días siguientes. Sin embargo, si el acto sexual ya ha precedido en los últimos 7 días, el embarazo no puede excluirse. El riesgo de quedar embarazada es proporcional al número de comprimidos olvidados y se incrementa según se acerca “el período perdido” al periodo de descanso. Segunda semana El paciente debe tomar el último comprimido olvidado, incluso si esto significa tomar dos comprimidos en un día y luego seguir tomando los comprimidos de la forma habitual. Si ella ha tomado los comprimidos con regularidad en los últimos 7 días, no hay necesidad de tomar precauciones anticonceptivas. Sin embargo, si se ha olvidado más de un comprimido o ella no ha tomado los comprimidos con regularidad, se deben tomar precauciones anticonceptivos adicionales durante los próximos 7 días. Tercera semana En este periodo el riesgo por una contracepción incompleta es muy elevado por lo cercano al periodo de descanso. Sin embargo, algún tipo de anticoncepción puede garantizarse mediante la modificación del calendario de los comprimidos. Mediante el uso de los siguientes protocolos, no hay necesidad de tomar precauciones adicionales de anticonceptivos, habida cuenta de que la mujer ha tomado los comprimidos con regularidad en los últimos 7 días. Si no es así, el primer protocolo deberá ser seleccionado y adicionalmente se deben tomar anticonceptivos como precaución para los próximos 7 días. 1. La paciente debe tomar el último comprimido olvidado, incluso si esto significa tomar dos comprimidos en un día y luego seguir tomando comprimidos de la forma habitual. El siguiente envase debe iniciarse tan pronto como el actual haya finalizado, es decir, no debe haber descanso entre los envases. No es probable que el paciente tenga un sangrado por privación hasta el final del segundo envase cuando la paciente podría experimentar algunas manchas o sangrado. 2. La segunda posibilidad es que no se continúe con el envase que ya está en uso, pero se debe observar un período de siete días de descanso sin el comprimido (los días que se dejó de tomar el comprimido deberían ser contados), y después continuar con un nuevo envase. Si se olvidaron varios comprimidos del actual envase y no hay sangrado en el período de descanso la existencia de un embarazo no puede excluirse. Alteración Gastro-intestinal. En caso de vómitos o diarrea dentro de las 3-4 horas siguientes a la toma del comprimido, podría ser que el comprimido no se absorba correctamente por el organismo. En este caso, debe tomarse un comprimido tan pronto como sea posible. Después de más de 12 horas, deben seguirse las indicaciones de la sección 4.2 para tomar los comprimidos olvidados. Si la paciente no quiere perturbar el orden de los comprimidos en el envase actual, tiene que tomar un comprimido (o más) de un envase de repuesto. Retrasar o modificar el tiempo de sangrado menstrual. Para retrasar la hemorragia después de terminar el envase anterior, la toma de Donabel debería continuar sin un intervalo de descanso. Durante la toma del segundo envase las pacientes podrían experimentar algún manchado o sangrado en los días que toma el comprimido. Después de terminar el segundo envase de comprimidos tienen que transcurrir 7 días sin tomar el comprimido, y a continuación puede comenzar, la toma de Donabel. Si ella quiere tener el inicio del ciclo menstrual en otro día de la semana, se puede disminuir la duración del periodo de descanso, según sea necesario. Sin embargo, cuanto más corto es el periodo de descanso, mayor es la probabilidad de manchado o sangrado durante la toma del segundo envase. (Es similar al caso en que el ciclo menstrual se retrasa). 4.3 Contraindicaciones. El uso de anticonceptivos orales combinados está contraindicado en el caso de la existencia de las siguientes enfermedades. En caso de que aparezcan por primera vez alguna de las enfermedades siguientes, mientras se está tomando anticonceptivos orales combinados, debe detenerse inmediatamente la toma de los mismos:El uso de Donabel está contraindicado: - Hipersensibilidad a cualquiera de los ingredientes activos y excipientes del comprimido; Existencia de trombosis venosa (trombosis venosa profunda, embolia pulmonar) o antecedentes del paciente; - Existencia de trombosis arterial (cerebrovasculares, infarto de miocardio) o antecedentes del paciente o incluso la presencia de episodios prodrómicos (tales como angina de pecho y accidente isquémico transitorio); - La presencia de un factor de riesgo grave o múltiples factores de riesgo de trombosis arterial: - Diabetes mellitus con participación vascular; - Hipertensión grave; - Dislipidemia grave; - Factores bioquímicos que pueden ser indicativos de predisposición hereditaria o adquirida para la trombosis venosa o arterial, incluyendo resistencia proteína C activada (APC), la resistencia, hiperhomo- cisteinemia, la deficiencia de antitrombina-III, deficiencia de proteína C, deficiencia de proteína S, anticuerpos antifosfolípidos anticuerpos anticardiolipina , el lupus anticoagulante); - Enfermedad hepática grave o paciente con antecedentes, si las pruebas de función hepática no se han normalizado todavía; - Tumor hepático activo (benigno o maligno) o una paciente con antecedentes; - Si se sabe o se sospecha de tumores esteroide-dependiente, (tumores de los órganos genitales o los senos); - Sangrado vaginal de origen desconocido; - Migraña con síntomas neurológicos focales en la historia del paciente; - Pancreatitis o una historia del mismo si se asocia con hipertrigliceridemia grave; - Insuficiencia renal grave o insuficiencia renal aguda. 4.4 Advertencias y precauciones especiales para su uso Advertencias. Si alguna de las enfermedades que figuran a continuación está presente, los beneficios del uso de anticonceptivos orales combinados deben sopesarse contra posibles riesgos individualmente, con cada mujer y discutirlo con ella antes de que ella decida empezar a utilizarlo. El paciente debe ser advertido, que en caso de aparición o agravamiento de cualquiera de estas afecciones médicas debe buscarse el asesoramiento sin demora. El médico debe entonces decidir si el uso de Donabel debe interrumpirse. Enfermedades vasculares. Debido a la posibilidad de graves daños para la salud (ver sección 4.8) la persistencia de los factores de riesgo (tales como varices, estados avanzados de flebitis y trombosis, la existencia de enfermedades del corazón, obesidad, trastornos de la coagulación sanguínea), debe sopesarse cuidadosamente el uso de anticonceptivos orales combinados frente a los posibles riesgos, antes del inicio de Donabel. El uso de cualquier anticonceptivo oral combinado (AOC) conlleva un mayor riesgo de tromboembolismo venoso (TEV) en comparación con su no uso. El riesgo de TEV es mayor durante el primer año, de uso de un AOC. Este aumento del riesgo es menor que el riesgo de TEV asociado con el embarazo, cuya estimación es de 60 por 100.000 embarazos. TEV puede ser fatal en el 1-2% de los casos. No se sabe cómo influye Donabel en el riesgo de TEV en comparación con otros anticonceptivos orales Sistema Orgánico Frecuencia de las reacciones adversas combinados. Los estudios epidemiológicos han demostrado que la incidencia de TEV en las usuarias de los anticonceptivos orales con bajo contenido de Frecuentes Poco frecuentes Raros estrógeno (<50 µg etinilestradiol), oscilan entre unos 20 a 40 casos por 100.000 Trastornos del sistema nervioso Dolor de cabeza Migrañas, calambres en las piernas mujer-año, pero esta estimación del riesgo varía en función del progestágeno. Esto se compara con 5 a 10 casos por 100.000 mujer-año para las no usuarias. Trastornos psiquiátricos Estado de ánimo depresivo, Anorexia, disminución de la líbido, Los estudios epidemiológicos han asociado el uso de los AOCs con un mayor nerviosismo reacciones agresivas, indiferencia riesgo de tromboembolismo. arterial (infarto de miocardio, ataque isquémico Trastornos oculares Trastornos oftalmológicos Molestias en la visión, Conjuntivitis, transitorio). La incidencia de TEV en las usuarias de los anticonceptivos orales intolerancia a las lentes de contacto con 30 µg de etinilestradiol y levonorgestrel, es de hasta 20 casos por 100 000 mujeres-año. Los estudios no muestran datos acerca de los diferentes riesgos Trastorno del oído y laberinto Pérdida audicción asociados con el uso de Dienogest / Etinilestradiol en comparación con los Trastornos cardiacos Alta o baja presión arterial Taquicardia y problemas cardiacos anticonceptivos que contienen levonorgestrel. Muy rara vez se ha producido trombosis en otras venas o arterias, por ejemplo, hepáticas, mesentéricas, Trastornos vasculares Trastornos de las venas Tromboflebitis trombosis/embolismo renales, cerebrales o de la retina en las usuarias de anticonceptivos orales pulmonar, hematoma, trastornos combinados. No hay consenso en cuanto a si la existencia de esos casos está cerebrovasculares asociada con el uso de anticonceptivos orales combinados. Los síntomas de la trombosis arterial o venosa son: - Dolor inusual o hinchazón de pierna (s); Trastornos de la sangre y del Anemia Repentino dolor en el pecho, irradiado o no al brazo izquierdo; - Disnea súbita; sistema linfático - Tos repentina; - Cualquier dolor de cabeza grave inusual, prolongado; Trastornos respiratorios, Sinusitis, asma, infecciones de vías Repentina pérdida parcial o completa de la visión; - Diplopía; - Discurso borroso torácicos y mediastínicos aéreas superiores o afasia; - Vértigo; - Colapso con o sin epilepsia focal; - Debilidad o entumecimiento muy marcado que afecta repentinamente un lado o una parte Trastornos gastrointestinales Dolor abdominal Náuseas, vómitos Diarreas del cuerpo;- Molestias motoras; - Abdomen agudo; Las mujeres que toman Trastornos de la piel y del tejido Acné/acne como dermatitis, Eritema multiforme, prurito anticonceptivos orales combinados tienen mayor riesgo de complicaciones subcutáneo exantema, eccema, molestias en la tromboembólicas venosas en presencia de lo siguiente: - El aumento de la edad; piel, cloasma, pérdida de pelo - Una historia familiar de tromboembolismo venoso (en un hermano o padre a una edad relativamente temprana). Si la mujer sospecha de predisposición Trastornos endrocrinos Hipertricosis, virilismus hereditaria, debe referirlo al especialista para asesoramiento antes de decidir acerca de cualquier uso de anticonceptivos orales combinados; - Inmovilización Trastornos renales y urinarios Infecciones del tracto urinario prolongada, cirugía mayor, cualquier intervención quirúrgica en las piernas, o Trastornos del sistema Inflamación Sangrados irregulares, ausencia Hipomenorrea, mastitis, mama traumatismos graves. En estas situaciones es aconsejable suspender el uso de reproductor y de la mama o dolor en los de hemorragia, dismenorrea, fibroquística, secreción de los senos, anticonceptivos orales combinados (en el caso de cirugía electiva por lo menos senos inflamación de los senos, desarrollo leiomioma, endometritis, salpingitis con cuatro semanas de antelación) y no reanudar hasta dos semanas después de de quistes ováricos, dispareunia, terminar la inmovilización. Si no se puede detener el uso de anticonceptivos vaginitis/vulvovaginitis, cambios en orales combinados en el momento adecuado, se debería tomar una profilaxis la secreción vaginal de trombosis; - Obesidad (índice de masa corporal> 30 kg / m2). No hay consenso sobre el posible papel de las venas varicosas y la tromboflebitis superficial en el Infecciones e infectaciones Candidiasis vaginal u otras desarrollo o evolución de la trombosis venosa profunda. Las mujeres que toman infecciones por hongos anticonceptivos orales combinados tienen mayor riesgo de complicaciones Trastornos generales y Sofocos, cansancio/debilidad, Reacciones alérgicas, síntomas de tromboembólicas arteriales en presencia de lo siguiente: - El aumento de la alteraciones en el lugar de indisposición, Dolores de espalda, gripe edad; - Dislipoproteinemia; - Hipertensión; - Enfermedad cardíaca valvular; administración variación en peso corporal, Fibrilación auricular; - Migraña; - Antecedentes familiares (tromboembolismo aumento del apetito, edema arterial incluso en un hermano o padre en edad relativamente temprana). Si se sospecha de una predisposición hereditaria, la mujer debe referirlo al especialista para asesoramiento antes de decidir acerca de cualquier uso AOC; - Obesidad (índice de masa corporal de más de 30 kg / m²); - Tabaco: fumar cigarrillos aumenta el riesgo de graves reacciones adversas cardiovasculares (como ataque cardíaco, derrame cerebral), para uso de anticonceptivos orales. Con un mayor volumen de tabaco y el aumento de la edad, el riesgo aumenta aún más. Se recomienda encarecidamente a las mujeres mayores de 35 años que usan anticonceptivos orales que no fumen. Si no deja de fumar, deben utilizar otros métodos anticonceptivos, sobre todo, si también están presentes otros factores de riesgo. La presencia de factor/factores de riesgo graves que conducen al desarrollo de trastornos venosos o arteriales pueden contraindicar la utilización de Donabel. Debe de considerarse el uso de un tratamiento anticoagulante. Las mujeres que toman anticonceptivos orales combinados deben ser advertidas de que si experimentan probables signos de trombosis debe buscarse atención médica sin demora. En caso de sospecha o diagnóstico de la trombosis usando AOC debe finalizarse el tratamiento y utilizarse otros métodos de anticoncepción por el efecto teratogénico de los anti-coagulantes (derivados de la cumarina). Cabe señalar también que el riesgo de tromboembolismo se incrementa en el período posterior al parto (ver sección 4.6). Otras condiciones médicas que se han asociado con efectos vasculares adversos incluyen diabetes mellitus, lupus eritematoso sistémico, síndrome hemolítico urémico, y enfermedades inflamatorias crónicas del intestino (enfermedad de Crohn o colitis ulcerosa). Un aumento en la frecuencia o gravedad de la migraña durante el uso de anticonceptivos orales combinados (que puede ser prodrómicos de un episodio cerebrovascular) puede ser una razón para la interrupción inmediata de los anticonceptivos orales combinados. Cáncer. Se ha observado en algunos estudios, que el uso de los anticonceptivos orales combinados durante largo plazo, aumenta el riesgo de cáncer de cuello uterino, pero sigue existiendo controversia acerca de la medida en que ello es atribuible a otros efectos (como el comportamiento sexual, la incidencia de la infección por el virus del papiloma humano, etc.). Un meta-análisis de 54 estudios epidemiológicos concluyó que existe un ligero aumento del riesgo relativo (RR = 1,24) de tener diagnosticados cáncer de mama en mujeres que están usando actualmente anticonceptivos orales combinados. El incremento del riesgo disminuye en 10 años después de finalizar el tratamiento con los anticonceptivos orales combinados. Para más información, véase la sección 4.8. El cáncer de mama pertenece al tipo de tumores hormono-dependiente. Algunas condiciones, como la menarquia temprana, menopausia tardía (después de 52 años de edad), ser nulipara, ciclos anovulatorios, etc, han sido reconocidos como factores de riesgo en el desarrollo del cáncer de mama. Estos factores de riesgo aumentan la posibilidad de efectos hormonales en la patogénesis del cáncer de mama. Los receptores hormonales desempeñan un papel central en la biología tumoral del cáncer de mama. Algunos de ellos inducen los factores de crecimiento, tales como la transformación del factor de crecimiento alfa (TGF-alfa). Los estrógenos y gestágenos influyen en la proliferación de células del cáncer de mama. Entre otros es este el tumor con receptor positivo susceptible de tratamiento farmacológico, cáncer de mama postmenopausico. Varios estudios epidemiológicos investigaron la conexión entre el uso de anticonceptivos orales combinados y el cáncer de mama, conociéndose que el desarrollo del cáncer de mama en mujeres de edad media está relacionado con el comienzo temprano y el uso extendido de los anticonceptivos orales combinados. Sin embargo, esto es sólo un factor entre otros posibles factores En muy raras ocasiones se ha dado casos de tumores malignos hepáticos en usuarias con tratamiento anticonceptivo oral de larga duración. En casos aislados, estos tumores son motivo de riesgo para la vida debido a hemorragias abdominales. Un tumor hepático debe considerarse en el diagnóstico diferencial cuando aumenta el dolor abdominal, aumenta el hígado o existen síntomas de hemorragia intra-abdominal. Otras causas. Si la hipertrigliceridemia está presente en el paciente o familiares, el uso de anticonceptivos orales combinados puede aumentar el riesgo de desarrollo de pancreatitis. Aunque el aumento de la presión arterial es común en mujeres que toman anticonceptivos orales combinados, la hipertensión clínica es un raro hallazgo. Sin embargo, si la hipertensión se desarrolla mientras se está tomando anticonceptivos orales combinados, el tratamiento debe interrumpirse y la presión arterial inicial se reducirá. Tras un exitoso tratamiento contra la hipertensión, se puede iniciar de nuevo el tratamiento con anticonceptivos orales combinados, si el médico considera que este es seguro. Si durante el uso de un AOC en preexistente hipertensión, continúan elevados los valores de la presión arterial o existe un aumento significativo de la presión arterial y no responden adecuadamente a tratamiento antihipertensivo, el AOC debe ser retirado. Cuando se considere apropiado, se reanudará el uso de AOC si se logran los valores normotensos con la terapia antihipertensiva. Aunque no hay relación causal se ha demostrado, que las siguientes enfermedades/empeoran las condiciones con el uso de los anticonceptivos orales combinados y el embarazo: ictericia colestásica y / o prurito, cálculos biliares, porfiria, lupus eritematoso sistémico, síndrome hemolítico urémico, corea Sydenham, herpes gestacional, problemas de audición provocada por otosclerosis en el oído medio. Si está activa o presenta una enfermedad crónica del hígado, la aplicación de anticonceptivos orales combinados debería suspenderse hasta que las pruebas de función hepática sean normales. Si la ictericia debido al embarazo o por el uso de esteroides produce o desarrolla prurito colestásico, el uso de anticonceptivos hormonales debe ser suspendido. Los anticonceptivos orales combinados podría disminuir la tolerancia a la glucosa y el aumenta la necesidad de insulina en tejidos periféricos, sin embargo, generalmente no es necesario cambiar el régimen del tratamiento anti-diabético en mujeres que toman anticonceptivos orales combinados. Sin embargo, su situación se debe vigilar estrechamente, sobre todo cuando empiezan con la píldora. El desarrollo de la enfermedad de Crohn y la colitis ulcerosa se ha descrito en mujeres que toman anticonceptivos orales combinados. El cloasma puede ocurrir ocasionalmente, especialmente en mujeres con antecedentes de cloasma gravídico. Las mujeres con una tendencia a cloasma deben evitar la exposición al sol o a la radiación ultravioleta, mientras se toma esta preparación. En mujeres con angioedema hereditario, estrógenos exógenos puede inducir o exacerbar los síntomas de angioedema. Un empeoramiento de la depresión endógena o la epilepsia se ha detectado durante el uso de AOC. El uso de estrógenos en las mujeres puede causar el cierre prematuro de las epífisis resultando una disminución de la altura final adulta. Compuestos que contienen progesterona pueden tener propiedades antagonistas de la aldosterona que puede tener un impacto importante en el nivel de potasio. Exámenes médicos. La evaluación de la mujer antes de comenzar o volver a tomar Donabel, debería incluir un detallado historial médico personal (y familiar). El embarazo debe ser excluido. La presión arterial debe ser medida y el examen físico debe guiarse por este y por las secciones 4.3 y 4.4. Las mujeres que toman Donabel deberían ser animadas a leer el prospecto cuidadosamente y seguir sus instrucciones. La frecuencia y naturaleza de estas evaluaciones deben basarse en las directrices pertinentes y debería adaptarse a cada mujer. Las mujeres deberían ser advertidas de que tomar la píldora no protege contra la infección por el VIH (SIDA) u otras enfermedades de transmisión sexual. La revisión médica periódica es también importante, porque pueden aparecer algunas contraindicaciones o factores de riesgo al principio durante el uso AOC. La reducción de la fiabilidad. La fiabilidad de los anticonceptivos orales combinados puede verse reducida en las siguientes circunstancias: si el paciente no toma los comprimidos regularmente, si existen vómitos o diarrea severa (véase la sección 4.2), o debido a la interacción con otros medicamentos (ver sección 4.5). Cambio en el patrón de sangrado. Los anticonceptivos orales combinados pueden provocar hemorragia irregular (manchado o sangrado) especialmente en los primeros meses de tratamiento. Por lo tanto, la investigación del sangrado irregular debería pasar hasta que se desarrolla el equilibrio hormonal, por lo general esto ocurre a los tres ciclos. Si se presenta sangrado irregular después de ciclos regulares, o persiste el sangrado, las causas no hormonales, tales como el embarazo y la presencia de un tumor maligno deben ser excluidas, esto podría diagnosticar un legrado. Ocasionalmente, podría ocurrir que no hubiera sangrado. Si los comprimidos se han tomado correctamente (según la sección 4.2), el embarazo es muy poco probable. Si no se produce la hemorragia al final de un segundo envase, o si no sigue las indicaciones anteriores, el embarazo debe descartarse antes de continuar con el siguiente envase. Interacciones metabólicas conducen a un aumento de los esteroides sexuales pudiendo provocar una hemorragia o conducir a una disminución del potencial anticonceptivos (ver sección 4.5). El remedio de hierbas de San Juan (Hypericum perforatum) no debe tomarse concomitantemente con Donabel, ya que esto podría potencialmente llevar a una pérdida de efecto (ver sección 4.5). Donabel Este medicamento contiene lactosa, glucosa y lecitina de soja. Los pacientes con problemas hereditarios raros de intolerancia de la galactosa, deficiencia de lactasa de Lapp, mala absorción de glucosa-galactosa, o es alérgico a los cacahuetes y la soja no deben tomar este medicamento. 4.5 Interacción con otros medicamentos y otras formas de interacción Interacción con medicamentos. Varios medicamentos que aumentan la eliminación de los esteroides sexuales pueden provocar la pérdida de actividad anticonceptiva. Estos efectos se han demostrado en el caso de hidantoina, barbitúricos, primidona, carbamazepina y rifampicina. Esto también es posible en rifabutina, efavirenz, nevirapina, oxcarbazepina, topiramato, felbamato, ritonavir, nelvinafir, griseofulvina y plantas medicinales que contengan Hierba de San Juan (Hypericum perforatum). Estos medicamentos aumentan la inducción de enzimas hepáticas. Se sospecha que algunos antibióticos (como la ampicilina o tetraciclina), pueden reducir la eficacia de los anticonceptivos orales combinados. La razón de este efecto secundario no se conoce todavía. Las mujeres que reciban un tratamiento corto (tiempo máximo una semana), de los productos arriba indicados, deberían tomar precauciones anticonceptivas adicionales a la toma de Donabel (por ejemplo, método de barrera), durante el tiempo de medicación concurrente y durante los 7 días siguientes. En el caso de toma de rifampicina deben tomarse precauciones anticonceptivas adicionales (por ejemplo, método de barrera) durante el tiempo de la medicación concurrente y continuar durante 4 semanas después de finalizar el tratamiento. Si se termina un envase, mientras se están tomando otros medicamentos, el siguiente envase debe ser iniciado sin el habitual intervalo de descanso. La dosis de anticonceptivos esteroídicos debería aumentarse durante el tratamiento a largo plazo con medicamentos inductores del sistema enzimático del hígado. Si dicho aumento de dosis da lugar a efectos secundarios indeseables (por ejemplo, sangrado irregular), o si resulta ineficaz, deberían ser administrados otros métodos anticonceptivos no hormonales. Los anticonceptivos orales pueden afectar el metabolismo de otros principios activos. En consecuencia, las concentraciones en plasma y tejidos puede aumentar (por ejemplo, ciclosporina) o disminuir (por ejemplo, lamotrigina). El progestageno puede interaccionar con los inhibidores de la ECA, antagonistas de los receptores de la angiotensina II, diuréticos moderadores de potasio, los antagonistas de la aldosterona, y los antiinflamatorios no esteroideos. En los estudios in vitro dienogest no inhibe la función de citocromo sistema enzimático P450 en la dosis administrada, por lo tanto, no existe interacción con otros medicamentos implicados en este sistema. Las pruebas de laboratorio. El uso de esteroides puede influir en los resultados de ciertas pruebas de laboratorio. Entre estos se encuentran: los parámetros bioquímicos del hígado, tiroides, la función suprarrenal y renal, niveles plasmáticos de proteínas (tales como corticosteroides vinculante a las globulinas) y lípidos / fracciones de lipoproteínas, el metabolismo de los carbohidratos, y los parámetros de la coagulación y la fibrinolisis. Sin embargo, estos cambios se mantienen dentro del rango normal. Nota: La información de prescripción de medicamentos concomitantes deberían ser consultados para identificar las posibles interacciones. 4.6 Embarazo y lactancia. Donabel no está indicado durante el embarazo. Si el embarazo se produce durante el tratamiento con medicamentos anticonceptivos orales, debe retirarse el medicamento inmediatamente. Basado en extensos estudios epidemiológicos, los descendientes de las mujeres que toman anticonceptivos orales combinados antes de su embarazo, no están amenazados por el aumento de riesgo de malformaciones congénitas, ni ejercen los anticonceptivos orales combinados efectos teratogénicos sobre los hijos cuando se toma en la fase temprana del embarazo o antes de que ocurra el embarazo. Estos estudios no se han llevado a cabo con Donabel. Dado que sólo hay datos limitados sobre el uso de Donabel durante el embarazo, su efecto negativo sobre el embarazo o en el feto y el recién nacido no puede ser establecido, no se dispone de datos epidemiológicos sobre este tema. Los estudios en animales han revelado toxicidad durante el embarazo y lactancia (ver sección 5.3). Los efectos sobre los seres humanos son desconocidos. Basado en los estudios disponibles tomar anticonceptivos orales combinados durante el embarazo no muestra efectos teratogénicos. El uso de anticonceptivos orales combinados durante la lactancia, puede dar lugar a una reducción en el volumen de leche producido y a un cambio en su composición. Pequeñas cantidades de las sustancias activas y / o excipientes son excretados con la leche, que posiblemente afecten a los recién nacidos. A las madres que están en periodo de lactancia se les aconseja no tomar Donabel. 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas. No se ha observado ningún efecto sobre la capacidad para conducir y utilizar máquinas. 4.8 Reacciones adversas. Existe un mayor riesgo de tromboembolismo venoso y arterial (por ejemplo, trombosis venosa, embolia pulmonar, derrame cerebral, ataque al corazón) para las mujeres que toman anticonceptivos orales combinados. Algunos factores como el tabaquismo, la hipertensión, los trastornos de la coagulación sanguínea y el metabolismo lipídico, obesidad severa, las venas varicosas, flebitis y trombosis avanzada pueden aumentar el riesgo de tromboembolismo venoso y arterial. Para los efectos secundarios graves en mujeres que toman anticonceptivos orales combinados ver sección 4.4. En la siguiente tabla se enumeran en orden decreciente de frecuencia los efectos adversos de dienogest 2 mg / etinilestradiol 0,03 mg comprimidos. Estas son las frecuencias de los efectos secundarios observados en ensayos clínicos con dienogest 2 mg / etinilestradiol 0,03 mg comprimidos (un total de 3.590 mujeres participaron en estos estudios), la aparición de estos efectos secundarios pueden ser relacionadas con el uso de Donabel. Dado que todos los efectos secundarios fueron de una frecuencia menor a 1 / 10, ninguna de las reacciones adversas que se produjeron eran “muy frecuentes”. La siguiente clasificación fue utilizada para especificar la frecuencia de efectos secundarios: Muy frecuentes (³ 1 / 10) Frecuentes (³1 / 100 y <1 / 10) Poco frecuentes (³ 1/1.000 y <1 / 100) Raros (³1/10.000 y <1/1.000) Muy raros (<1/10.000), no conocidas (no puede estimarse a partir de los datos disponibles). Las siguientes reacciones adversas se notificaron durante los estudios realizados con dienogest 2 mg / etinilestradiol 0,03 mg Donabel: En mujeres que toman anticonceptivos orales combinados se han detectado las siguientes reacciones adversas: - Tromboembolismo venoso o arterial; - Hipertensión; - Tumores hepáticos; - El desarrollo o empeoramiento de trastornos con la administración de anticonceptivos orales combinados, tales como la enfermedad de Crohn, colitis ulcerosa, porfiria, lupus eritematoso sistémico, Herpes gestacional o penfigoide gestacional, Sydenham-corea, síndrome hemolítico urémico, ictericia colestática; - Cloasma. El riesgo de cáncer de mama ha aumentado ligeramente en mujeres que toman anticonceptivos orales combinados. Sin embargo, el riesgo de desarrollo de cáncer de mama por debajo de la edad de 40 años es pequeña, en comparación con el riesgo total. Para más información, véase las secciones 4.3 y 4.4. En mujeres con angioedema hereditario, estrógenos,exógenos puede inducir o agravar los síntomas de angioedema. Para más información, véase la sección 4.3 y 4.4. 4.9 Sobredosis. La toxicidad oral aguda de dienogest y etinilestradiol es pequeña. Cuando un niño pequeño ha tomado una cantidad considerable de Donabel, la posibilidad de que desarrolle síntomas tóxicos es pequeña. Una sobredosis puede causar náuseas, vómitos y, en chicas jóvenes, sangrado. No hay necesidad de un tratamiento especial. Si es necesario, debe administrarse un tratamiento sintomático 5. DATOS FARMACÉUTICOS. 5.1 Lista de excipientes. Comprimido básico Monohidrato de lactosa, estearato de magnesio, almidón de maíz, Povidóna 30, Talco Película de recubrimiento. Opaglos 2 clear, contienen: croscarmelosa de sodio, glucosa, maltodextrina, citrato de sodio dihidrato, lecitina de soja 5.2 Incompatibilidades. No procede. 5.3 Periodo de validez. 3 años. 5.4 Precauciones especiales de conservación. Este medicamento no requiere condiciones especiales de conservación. 5.5 Naturaleza y contenido del recipiente. PVC / PVDC / aluminio blister, los tamaños de los envases: 21, 3x21 y 6x21 comprimidos recubiertos con película. No todos los tamaños de envase pueden estar comercializados. 5.6 Precauciones especiales de eliminación No hay requisitos especiales. 6. PRESENTACIONES Y PVP (IVA). Donabel 1 X21; 14,04 14,04€.. Donabel 3 X 21; 35,12€. 7. TITULAR DE LA AUTORIZACIÓN. Laboratorios 35,12 aboratorios Effik, S. S.A.. Calle San Rafael, 3.28018 Alcobendas lcobendas (Madrid). 8. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN (S). 71.833. 9. FECHA DE LA PRIMERA AUTORIZACIÓN /RENOVACIÓN DE LA AUTORIZACIÓN. Enero de 2010. 10. FECHA DE LA REVISIÓN DEL TEXTO. Enero de 2010. SOCIEDADE GALEGA DE CONTRACEPCIÓN ANTICONCEPCIÓN Y FACTORES DE RIESGO EN RELACIÓN CON EL PERFIL GENÉTICO DEL CÁNCER DE MAMA Jorge F. Cameselle Teijeiro, M.D. Ph.D. Grupo Investigación Oncológico ADICAM (Cangas), IPATIMUP (Oporto). María-Emilia Cortizo Torres M.D. Ph.D. Centro de Saúde Vigo-Centro. Javier Valdés Pons, M.D. Ph.D. Complexo Hospitalario Universitario de Vigo. Departamento de Ginecología y Obstetricia. F.C. Schmitt, M.D. Ph.D. IPATIMUP (Oporto). cuales probablemente representen genotipos de alto riesgo, evidenciamos una programación genética que determina una simultaneidad en el tiempo de comienzo del carcinoma. En base a estos hallazgos hemos propuesto (Breast J 2003; 9:443-444 y Rev Clin Esp 2006; 206:60-61.) que en estas familias con intensa agregación de CM se aborde la cronobiología como una nueva variable clínica en el estudio del CM hereditario. En Febrero de 1989, un miembro de nuestro grupo de investigación leyó su Tesis Doctoral sobre “Epidemiología y factores de riesgo del cáncer de mama en el sur de Galicia” y en una de las conclusiones de este trabajo podemos leer: “No hay correlación, en nuestro estudio, entre el uso de anticonceptivos orales (ACO) y el incremento del riesgo de cáncer de mama (CM). Como podemos observar en la tabla que mostramos a continuación, el porcentaje de tratamientos previos de ACO fue similar entre el grupo de enfermas de CM y el grupo control (p > 0,05). En el único subgrupo etáreo en el que los porcentajes diferían fue entre las mujeres con edades comprendidas entre 50-59 años, un 21 % de uso previo de ACO en el grupo control frente al 6 % de las enfermas de CM (p = 0,05); lo que nos indica que no existe relación y de haberla la tendencia sería contraria. Algo que no se suele señalar en la bibliografía médica y que nosotros creemos de gran importancia es que el peso de estos factores de riesgo varía según la edad de las enfermas. Al analizar en profundidad el patrón menstrual y la historia obstétrica, pudimos comprobar, que sólo el número de hijos y edad de la mujer en el primer parto influían de manera significativa (p < 0,05) en el riesgo de CM. Pero este efecto concreto sólo alcanza relevancia clínica en las edades medias de la vida (50-60 años). Estos hallazgos, fueron también observados por otros investigadores y sirvieron de base para que el grupo de investigación dirigido por la pareja de investigadores Russo J y Russo IH (Oncol Res 1999; 11(4): 169-178) estableciera la hipótesis de que probablemente el mecanismo subyacente que determina esta protección de un embarazo temprano radique en la diferenciación del lobulillo mamario que se alcanza con la gestación. Entre los factores de riesgo encontrados en las enfermas de CM postmenopáusicas destacamos los tratamientos hormonales sustitutivos “prolongados en años” y la obesidad medida a través del Índice de Masa Corporal. La Tesis Doctoral, a la que hemos hecho referencia, concluía además que la etiología del CM es multifactorial, y que si excluimos los dos factores de riesgo principales (edad y sexo), la mayoría de las mujeres que son diagnosticadas no tienen otros factores de riesgo significativos. En ese momento, ya nos llamó la atención el peso de la agregación familiar del cáncer de mama y del cáncer en general. Posteriormente, otros estudios de nuestro grupo nos permitieron lograr establecer y publicar nuevas definiciones clínicas del CM Familiar (Breast J 2001, 7:70-71) y del CM Hereditario (Breast J 2002; 8:402-303) que pueden ser usadas con sencillez para identificar a estas familias. Demostramos como el patólogo (Rev Senología y Patol Mam 2001; 14:29-35) puede aportar una excelente información que ayude en la identificación del CM hereditario, que representa menos del 10% del total de los CM. En la actualidad la identificación del patrón de mutaciones en los genes BRCA1 y BRCA2 en cada población es relevante para ayudar a decidir las mejores estrategias de prevención. Siguiendo nuestra metodología, conseguimos realizar la primera descripción (Rev Clin Esp 2002; 202(5):259-263) del tipo mutaciones BRCA1 y BRCA2 en las enfermas gallegas con CM. De esta primera investigación, nos quedó claro que todavía sabemos muy poco sobre la carcinogénesis del CM, y que los factores genéticos y el estilo de vida parecen ser los factores claves en la etiología del cáncer. Este último viene a explicar la gran variabilidad de la incidencia del CM en el mundo. También observamos, que en no pocas ocasiones, algunas afirmaciones se repiten – se copian unos a otros en publicaciones científicas -, y no se comprueban. Un buen ejemplo de ello es el caso de la edad precoz de la menarquia que siempre aparece recogida como un factor de riesgo de CM. Probablemente, una edad cada vez más temprana en la edad media de la menarquia esté relacionada con mejoras en la alimentación y con la anticipación de la ganancia del peso crítico que dispara la menarquia. De ahí, que por ejemplo en Galicia la edad media de la menarquia venga descendiendo paulatinamente durante la últimas décadas hacia edades cada vez más precoces. Este hecho refleja más la influencia de la dieta y de la alimentación sobre el CM, que la influencia de la propia edad de la menarquia en sí. Nuestros datos de Vigo, en este sentido, coincidieron con los hallazgos de una investigación similar en Cádiz, a cargo del Prof. A. Senra-Varela, uno de los más prestigiosos investigadores de la carcinogénesis en Europa. Estudiando la concordancia en el momento del diagnóstico de casos de nuestra serie y de parejas de gemelas monocigóticos publicadas en la literatura internacional, las 19 SOCIEDADE Animados por esta primera experiencia en 1989, aprendimos que si queríamos seguir investigando sobre el CM precisábamos de datos propios, rigurosos, fiables y obtenidos mejor de manera prospectiva. Con este objetivo creamos – poco a poco - un equipo multidisciplinario, buscando siempre el apoyo de expertos y siguiendo siempre criterios basados en una metodología científica. Englobamos todos estos objetivos en un proyecto teórico que logramos poner en práctica y al que denominamos Proyecto Águeda-VigoCáncer de Mama. Afortunadamente, creado en 1989 seguimos manteniendo vivo en 2012. Desde el principio hemos tenido claro que para investigar el CM necesitamos ampliar al máximo las fuentes de información clínica y creamos una serie de bases de datos (cáncer de mama, cáncer en general y registros de mortalidad). En algunos de estos registros, la colaboración del Servicio de Anatomía Patológica está siendo fundamental. Nosotros mantenemos esta colaboración permanente, así como la de muchos médicos y enfermeros de atención primaria y de especializada. La reevaluación de los carcinomas mamarios con aplicación de nuevas técnicas y ayuda de expertos es esencial. En este sentido, tenemos el honor de contar con el apoyo del Profesor FC Schmitt – experto de reconocido prestigio internacional – y del Instituto de Patología e Inmunología Molecular (IPATIMUP) de la Universidad de Oporto. Una base de datos con más de 3500 enfermas de CM a muchas de las cuales las hemos podido entrevistar personalmente para historiarlas en profundidad, y una base de datos de mortalidad con más de 120.000 registros del área sur de la provincia de Pontevedra, nos han permitido estudios de supervivencia desde diferentes perspectivas. En el gráfico que se muestra a continuación, se puede ver la curva de supervivencia de más 3500 enfermas de CM seguidas a lo largo de 35 años. GALEGA DE CONTRACEPCIÓN Nuestra impresión, basándonos en nuestros hallazgos y en la revisión de la bibliografía internacional es que los anticonceptivos actuales – por si mismos - no incrementan de manera significativa el riesgo de cáncer de mama. Los anticonceptivos - potencialmente - modifican el riesgo de cáncer de mama en la medida que contribuyen a “retrasar” la edad del primer parto y/o contribuyen a disminuir el número de hijos. Estamos pendientes de evaluar los resultados de una nueva Tesis de un miembro de nuestro grupo que aborda el estudio de los Factores de Riesgo del CM teniendo en cuenta los subtipos moleculares. De momento, si sabemos que los perfiles genéticos nos separan el cáncer de mama en subtipos moleculares con diferente pronóstico como se puede observar en uno de los gráficos de nuestra serie: los CM luminal A tienen mejor pronóstico frente a los subtipos de CM que sobreexpresan HER2 y CM de tipo basal que muestran peor pronóstico. Los datos preeliminares de nuestro estudio parecen indicar que estos diferentes subtipos moleculares de CM tienen diferentes factores de riesgo. De momento, llamamos la atención sobre como el CM de tipo basal tiene una “dependencia estrogénica” diferente al resto de los CM. De hecho, en el CM de tipo basal, la edad del primer hijo o el número de hijos no son un factor de riesgo del CM. Además de numerosas publicaciones científicas en revistas nacionales e internacionales, hemos logrado concluir un buen número de Tesis Doctorales, algunas de las cuales señalamos a continuación. Después de todos estos años de investigación, qué podemos responder a la pregunta que daba pié a esta ponencia: ¿Anticoncepción y riesgo de cáncer de mama? 20 SOCIEDADE GALEGA DE CONTRACEPCIÓN SÍNDROME DE OVARIO POLIQUÍSTICO. SÍNDROME METABÓLICO. CÁNCER GINECOLÓGICO Dra. Paula González Gil Servicio de Obstetricia y Ginecología del Complejo Hospitalario Universitario de Vigo. SÍNDROME METABÓLICO • Resistencia a la Insulina (captación de glucosa por debajo del P25 en clamp.). El síndrome metabólico (SM) -conocido también como síndrome plurimetabólico, síndrome de resistencia a la insulina o síndrome X- es una entidad clínica controvertida que aparece, con amplias variaciones fenotípicas, en personas con una predisposición endógena, determinada genéticamente y condicionada por factores ambientales. Se caracteriza por la presencia de insulinoresistencia e hiperinsulinismo compensador asociados a trastornos del metabolismo hidrocarbonato, cifras elevadas de presión arterial, alteraciones lipídicas (hipertrigliceridemia, descenso del cHDL, presencia de LDL tipo B, aumento de ácidos grasos libres y lipemia postprandial) y obesidad, con un incremento de la morbimortalidad de origen ateroesclerótico, aunque aún no se ha determinado con certeza el riesgo absoluto conferido por el síndrome metabólico en las diferentes poblaciones. (D) • Otros parámetros: –Presión arterial ≥ a 140-90 mmHg –Dislipemia (TG> a 150 mg/dl y/o colesterol HDL <35 -39 mg/dl en hombres y mujeres –Obesidad (índice cintura/cadera >0.9-0.85 en hombres y mujeres respectivamente y/o índice de masa corporal > 30 kg/m2) –Microalbuminuria (excreción urinaria de albúmina ≥ 20 mg/min). La OMS señala que es indispensable para el diagnóstico de Síndrome Metabólico (SM) la presencia de resistencia a la insulina y/o alteración en la tolerancia a la glucosa. A esto debe sumarse al menos dos de los siguientes: hipertensión arterial, dislipemia, obesidad, microalbuminuria. Es importante destacar que la microalbuminuria es, para la OMS un importante predictor de riesgo cardiovascular. Clínicamente la resistencia a la insulina (RI) se define como la incompetencia de una determinada concentración de insulina para conseguir el control de la glucosa y, aunque es la base fisiopatológica de la diabetes, no unificaría todos los aspectos etiológicos en el SM. Es una anormalidad celular compleja que implica fundamentalmente al tejido adiposo, al hígado y al músculo esquelético. Además de la susceptibilidad genética precisa de la presencia de otros factores ambientales: Debido a que es necesario la aplicación de técnicas de alto costo, complejas, y de no tan sencilla aplicación, esta definición es una herramienta poco aplicable en la práctica médica diaria, resultando útil en investigación. Síndrome metabólico según NCEP (ATP III.)Año 2001 • Obesidad central o abdominal. • Obesidad abdominal (circunferencia abdominal > 102 cm en hombres y >88 cm en mujeres • Sedentarismo. • TG ≥150 mg/dl • Dieta hipercalórica rica en grasas y carbohidratos. • HDL colesterol < 40 mg/dl en hombres y < 50 mg/dl en mujeres. • Tabaquismo. Otros factores relacionados con la RI y el SM son: • Presión arterial ≥ 130-85 mmHg • Hiperuricemia o gota. • Glicemia basal en ayunas ≥ 110 mg/ • Hipercoagulabilidad y defectos de la fibrinolisis. La definición de la National Colesterol Education Program (NCEP) se basa en la coexistencia de cualquier combinación de tres alteraciones: en la distribución de grasa corporal, presión arterial, triglicéridos, HDL, y glicemia en ayunas. • Hiperleptinemia o resistencia a la leptina. • Y también: homocisteína (papel controvertido en la RI), leucocitosis, elevación de la VSG, PAI-1 elevado, hiperandrogenismo, hígado graso, cálculos biliares, osteoporosis, acantosis nigricans, síndrome del ovario poliquístico. Múltiples evidencias demuestran la mayor probabilidad de desarrollar diabetes mellitus en los pacientes que presentan un SM (A). También se ha demostrado una mayor asociación con la cardiopatía isquémica y la progresión de la enfermedad cardiovascular. A diferencia de lo establecido por la OMS, la NCEP no recomienda una medición rutinaria de la insulinemia por no considerarla esencial para el diagnóstico de SM. Se tienen en cuenta parámetros clínicos mucho más accesibles y costo efectivo. Así, se puede arribar a un diagnóstico con tan sólo una cinta métrica y un tensiómetro. Síndrome Metabólico según la OMS. (Año 1998) Síndrome metabólico según AAEC. (Año 2002) • Alteración de la regulación de la glucosa (glicemia en ayunas ≥ a 110mg/dl y/o 2 hs poscarga ≥ a 140 mg/dl). Criterios mayores • Resistencia a la Insulina (medida por hiperinsulinemia dependiente de los niveles de glucosa 21 SOCIEDADE • Acantosis nigricans GALEGA DE CONTRACEPCIÓN –Acné y alopecia aislados no están relacionados necesariamente con hiperandrogenismo y no son buenos marcadores. • Obesidad abdominal (circunferencia abdominal >102 cm en hombres y > de 88 cm en mujeres). –El hirsutismo debería ser evaluado bioquímicamen- • Dislipemia (colesterol HDL < 45 mg/dl en mujeres y < 35 mg/dl en hombres o TG › 150 mg/dl) te. –Para documentar la efectividad de la terapia médica es necesario un tratamiento prolongado (> 6 meses). • Hipertensión arterial –No se conoce un tratamiento eficaz para la alopecia. • Intolerancia a la glucosa o diabetes mellitus tipo II –No se deben usar antiandrógenos sin anticoncepción eficaz. • Hiperuricemia Criterios menores –Flutamida es de valor limitado, debido a su hepatotoxicidad dosis-dependiente. • Hipercoagulabilidad –Drospirenona en las dosis usadas en algunos ACOs no es antiandrogénica. • Síndrome del ovario poliquístico • Disfunción endotelial IRREGULARIDADES MENSTRUALES • Microalbuminuria Nivel de evidencia B: • Enfermedad cardíaca coronaria –Tanto las mujeres amenorreicas como oligomenorreicas pueden ovular ocasionalmente. En el año 2002 la Asociación Americana de Endocrinólogos Clínicos (AAEC) amplió aún más el concepto, sumándole algunas situaciones clínicas como el Síndrome de ovario poliquístico, Acantosis Nigricans, el Higado Graso no alcohólico, entre otros. –Los ciclos menstruales en mujeres con SOP pueden hacerse más regulares con el tiempo. –Los ciclos irregulares se asocian con riesgo metabólico aumentado. SÍNDROME DE OVARIO POLIQUÍSTICO –Cuanto mayor irregularidad severidad en el fenotipo de SOP. SOP es el desorden endocrino más común en mujeres, con una prevalencia del 6-10% (15% si se aplican los criterios de Rotterdam). menstrual, mayor CONTRACEPCIÓN Las mujeres con SOP que no desean gestación deben usar contracepción. No hay métodos anticonceptivos contraindicados en el SOP (Contraindicaciones absolutas de ACOs: tabaquismo mayor de 15 cigarrillos / día en mujeres de más de 35 años, disfunción hepática, hipertensión >160/100 mmHg, trombosis venosa rofunda, enfermedad cardíaca isquémica, ACV y cáncer de mama). De todas maneras, alguna de las características asociadas a SOP (tales como obesidad o resistencia insulínica) pueden representar una contraindicación relativa para el uso de ACOs. Por otra parte, el control del ciclo menstrual se consigue habitualmente con ACOs en estas pacientes. La etiología no es bien conocida, y la variabilidad de la expresión fenotípica constituye un desafío para el cuidado clínico y la investigación. Criterios de Rotterdam (2003) para el diagnóstico de SOP: Deben estar presentes 2 de los 3 siguientes síntomas o signos • Oligo y/o anovulación • Signos clínicos y/o bioquímicos de hiperandrogenismo ACOs suprimen la secreción de LH y conducen a un descenso en la producción androgénica del ovario. El componente estrogénico aumenta los niveles de SHBG, lo cual conduce a un descenso en los niveles circulantes de T libre. Los gestágenos en la píldora pueden competir por 5alfa-reductasa en el receptor androgénico. ACOs además disminuyen la producción adrenal de andrógenos por un mecanismo todavía no claro, posiblemente debido a un descenso en la producción de ACTH. • Ovarios poliquísticos y exclusión de otras etiologías (hiperplasia adrenal congénita, tumores productores de andrógenos, síndrome de Cushing ). HIRSUTISMO / ACNÉ / ALOPECIA El hirsutismo está presente en aprox. 70% de las mujeres con SOP, pero debe evaluarse la presencia de hiperandrogenemia bioquímicamente en todas las mujeres en las que se sospeche SOP. En comparación, acné y alopecia no se asocian comúnmente con hiperandrogenemia, y no deberían ser considerados como evidencia de la misma. Una revisión Cochrane, basada en evidencia limitada, concluyó que el uso de ACOs no aumenta el riesgo metabólico. Hallazgos en pequeños estudios sugieren que la resistencia a la insulina empeora durante el curso natural del SOP, pero el uso prolongado de ACOs no cambia o incluso mejora los parámetros de riesgo cardiometabólico, incluyendo resistencia insulínica, perfil lipoproteico y posiblemente la distribución de la grasa corporal. Nivel de evidencia B: –El hirsutismo, teniendo en cuenta las diferencias étnicas, es un buen marcador de hiperandrogenismo. 22 SOCIEDADE GALEGA DE CONTRACEPCIÓN mayores que en aquellas mujeres sin hiperandrogenismo. Nivel de evidencia B: –Los beneficios de los ACOs sobrepasan a los riesgos en la mayoría de las pacientes con SOP. –Los hijos de mujeres con SOP pueden tener mayor morbimortalidad. –No hay evidencia de diferencias en efectividad y riesgo entre los distintos gestágenos, ni la combinación con 20 o 30 microg. de estrógenos. OBESIDAD Existe una gran variabilidad en la prevalencia de sobrepeso y obesidad en las mujeres con SOP en los distintos países. Del mismo modo, la prevalencia de obesidad es mayor que la de sobrepeso en pacientes con SOP. Nivel de evidencia C: –Las mujeres con SOP tienen más probabilidad de tener contraindicaciones para el uso de ACOs que las mujeres normales. –En ausencia de otros factores de riesgo, no hay evidencia de que las mujeres con SOP tengan mayor riesgo por el uso de ACOs que mujeres normales. Las mujeres con SOP (tanto obesas como no obesas) son más propensas a tener una distribución troncular de la grasa corporal, comparado con controles del mismo peso. La mayor adiposidad abdominal o visceral se asocia con mayor resistencia a la insulina, lo cual podría exacerbar las anormalidades reproductivas y metabólicas en el SOP. Con menos potencia estadística se ha visto que la obesidad visceral presenta niveles más bajos de SHBG y niveles más altos de testosterona, al igual que más proporción de oligomenorrea, niveles más altos de insulina en ayunas, mayor área bajo la curva de insulina y mayor insulin-resistencia (HOMA). También se asoció con niveles más altos de triglicéridos y posiblemente con niveles más bajos de HDL colesterol. –La fertilidad posterior no se ve afectada por el uso de ACOs. –No hay evidencia definitiva que el tipo de ACOs determine la eficacia del control del hirsutismo. CALIDAD DE VIDA Nivel de evidencia B: –Existe una prevalencia aumentada de desórdenes psicológicos en mujeres con SOP. Nivel de evidencia C: –Debería considerarse la presencia de problemas psicológicos, debido a la evidencia que sugiere la prevalencia aumentada de los mismos, y comorbilidad asociada. Es posible que haya diferencias funcionales en el tejido adiposo de las mujeres con SOP, por ejemplo, los adipocitos de las mujeres con SOP son más grandes y tienen defectos en la acción insulínica y la lipólisis. Además, los adipocitos viscerales de las mujeres con SOP tienen tasas más altas de lipólisis lo que conduciría a niveles más elevados de ácidos grasos a nivel portal. –No está claro si la prevalencia aumentada de trastornos psicológicos se debe al desorden mismo o a sus manifestaciones (obesidad, hirsutismo, ciclos irregulares, infertilidad). Mayor IMC se asocia a: niveles elevados de T total, T libre e índice androgénico libre, descenso de SHBG, niveles más elevados de Ins en ayunas, mayor resistencia a insulina, niveles más altos de LDL, triglicéridos, colesterol total, niveles más bajos de HDL y niveles más altos de TA. –Debe ofrecerse consejo psicológico apropiado e intervención psicológica si lo precisan. EMBARAZO Nivel de evidencia A: –Las tasas de aborto no están aumentadas en gestaciones espontáneas en mujeres con SOP, independientemente de la obesidad. Las tasas de aborto tras inducción de la ovulación son similares a aquellas en otras poblaciones infértiles. Nivel de evidencia A: –Intervenciones en el estilo de vida conducen a una pérdida de peso y mejoran los marcadores secundarios de síndrome metabólico (redistribución de grasa corporal, disminución de los niveles de testosterona total y mejora en la puntuación Ferriman-Gallwey de hirsutismo. Disminuyeron los niveles de Ins en ayunas y mejoraron los resultados en el test de tolerancia oral de glucosa). –No hay evidencia de mejora en las tasas de nacidos vivos o descenso en las complicaciones gestacionales con el uso de metformina tanto antes de la concepción como durante el embarazo. Nivel de evidencia B: Nivel de evidencia B: –Las mujeres con SOP que desean embarazo pueden tener riesgo aumentado de resultados gestacionales adversos, y esto puede estar exacerbado por obesidad y/o resistencia a la insulina. –La prevalencia de obesidad está aumentando, y tiene una importante relación con el fenotipo de SOP. –Algunos estudios sugieren que un mayor IMC se asocia con mayor prevalencia de irregularidad menstrual, hiperandrogenemia e hirsutismo, pero se necesitan más estudios para confirmarlo. –Las mujeres con SOP deberían ser controladas de cerca durante el embarazo, dado que pueden presentar riesgo aumentado de desarrollar diabetes gestacional, hipertensión gestacional y las complicaciones asociadas. –El aumento de IMC y adiposidad visceral se asocian con mayor resistencia a insulina al igual que en la población general, pero su efecto en la irregularidad menstrual e hirsutismo todavía permanecen poco claros. –Los riesgos asociados a la gestación en mujeres diagnosticadas por los criterios clásicos (NIH) son 23 SOCIEDADE GALEGA DE CONTRACEPCIÓN RESISTENCIA A LA INSULINA Y SÍNDROME METABÓLICO In vivo existe un aumento en la producción de andrógenos por estimulación ovárica con insulina y/o LH. La RI es un hallazgo prevalente en obesos en general, y en mujeres con SOP. Es más prevalente y severa en aquellas diagnosticadas con los criterios clásicos (NIH), implicando hiperandrogenismo y anovulación crónica. La RI y la hiperinsulinemia compensadora afecta al 65-70% de las mujeres con SOP, 70-80% de las obesas y 20-25% de las delgadas. Nivel de evidencia B: –Los desórdenes metabólicos asociados a SOP son predictores mayores de prediabetes, diabetes y síndrome metabólico en mujeres en edad reproductiva. –No todos los fenotipos de SOP tienen el mismo riesgo metabólico. La combinación de hiperandrogenemia y oligomenorrea presentan el grupo de mayor riesgo. Los mecanismos celulares y moleculares de RI en SOP son diferentes de aquellos en otros estados de RI como obesidad y DMT2. La acción in vivo de la insulina está profundamente disminuida en el músculo esquelético secundariamente a defectos de señalización postreceptor, pero la resistencia insulínica hepática sólo está presente en mujeres obesas con SOP. Hay un efecto sinérgico negativo sobre la acción de la insulina en tener SOP y obesidad. La disfunción de las células beta pancreáticas también está presente en SOP, pero puede estar más en relación con factores de riesgo de DMT2, dado que esta disfunción es más severa en mujeres con un familiar de primer grado con DMT2. (Ambos, RI y disfunción de las células beta pancreáticas parecen ser necesarias para la progresión a DMT2, al igual que en otros estados de RI). DIABETES TIPO 2 La RI es una característica prominente del SOP. Hay evidencia convincente de datos epidemiológicos que el SOP está asociado con riesgo aumentado de intolerancia a la glucosa, diabetes gestacional (el triple que en la población general) y DMT2. El cribado bioquímico con test de tolerancia oral a la glucosa está indicado en mujeres obesas con SOP, y en aquellas con adiposidad visceral aumentada medida por circunferencia abdominal. El riesgo de intolerancia a la glucosa o diabetes es mayor en mujeres que tienen oligo-ovulación o anovulación e hiperandrogenismo, y el riesgo se aumenta aún más por la obesidad (aunque la RI puede encontrarse también en mujeres delgadas) y en mujeres con AF de intolerancia a la glucosa o DMT2. Estudios de poblaciones clínicas muestran que entre un 10-45% de las mujeres con SOP presentan intolerancia a glucosa o DMT2 manifiesta. Existen datos que sugieren que incluso en ausencia de RI, la respuesta ovárica a insulina puede ser anormal en el SOP. Se postula un origen genético tanto de SOP como de DMT2. Hay amplia evidencia para una base genética del SOP, y está claro que las anormalidades de la homeostasis glu/Ins son más comunes en familiares de primer grado de mujeres con SOP que en la población general. Es lógico considerar que genes que han sido recientemente identificados como contributores al genotipo y fenotipo de DMT2 puedan estar también asociados a la etiología del SOP, pero esto es un punto todavía conflictivo. Se desconoce si el hiperandrogenismo y la RI en SOP reflejan el mismo defecto genético con distinta expresividad, genes asociados próximamente o anormalidades con relación causal. La hiperinsulinemia induce un exceso en la producción de andrógenos por las células de la teca, y actúa también como una cogonadotropina, aumentando el efecto del estímulo aumentado de la LH observado en las pacientes con SOP. Existe amplia evidencia de que la hiperinsulinemia contribuye directamente a la disfunción reproductiva en SOP. Las mujeres con SOP clásico (hiperandrogenismo y/o anovulación) tienen tasas significativamente más altas de síndrome metabólico comparado con mujeres normales de edad y peso similares (el hiperandrogenismo puede ser un contributor independiente al riesgo de síndrome metabólico. El bloqueo de la acción androgénica o la mejora de la sensibilidad a insulina puede mejorar los rasgos de sd. metabólico en SOP. Gambineri A, Patton L, Vaccina A, Cacciari M; Morselli-Labate AM, Cavazza C, et al. Treatment with flutamide, metformin, and their combination added to a hypocaloric diet in overweight-obese women with polycystic ovary syndrome: a randomized, 12-month, placebo-controlled study. J Clin Endocrinol Metab 2006; 91: 3970-80). El manejo de mujeres en riesgo de DMT2 debería incluir dieta y mejora del estilo de vida como tratamiento de primera línea. La metformina está indicada en aquellas con intolerancia a la glucosa que no responden adecuadamente a la restricción calórica y cambios en el estilo de vida. En aquellas con diabetes, la metformina es segura y efectiva, además, el uso de tiazolidindionas y análogos de glucagon-like péptido1 está discutido en mujeres en edad reproductiva. In vitro: concentraciones fisiológicas de insulina aumentan la producción de andrógenos en células cultivadas (SOP), significativamente mayor que en células de mujeres normales. LH + insulina en concentraciones fisiológicas aumentan la producción de andrógenos de manera sinérgica, tanto en SOP como en mujeres normales. LH e insulina poseen distintos mecanismos intracelulares para aumentar la esteroidogénesis en las células de la teca, lo cual implica interacciones entre ambas vías. Metformina activa la vía AMP-AMPK a nivel postreceptor, reduciendo la producción hepática de glucosa y aumentando las sensibilidad a insulina en tejidos periféricos, con beneficios adicionales disminuyendo los niveles de ácidos grasos libres en plasma. Disminuye peso, mejora perfil lipídico, disminuye la incidencia de DMT2, asociado con ACOs disminuye de manera sinérgica los niveles de andrógenos. Las tiazolidindionas producen aumento de peso, 24 SOCIEDADE riesgo aumentado de ECV y posiblemente un aumento de riesgo de cáncer de vejiga. GALEGA DE CONTRACEPCIÓN Los fenotipos más severos de SOP se asocian con mayor riesgo de ECV, y esto se ha encontrado en mujeres obesas y no obesas. Estudios preliminares acerca de la eficacia de la cirugía bariátrica en revertir las anormalidades metabólicas y endocrinas en mujeres con SOP han producido resultados alentadores. Los cambios en triglicéridos, LDL y no-HDL colesterol son mayores comparados con mujeres que no tienen SOP. Esto refleja ratios más aterogénicas de ApoB/Apo A. Las diferencias son mayores cuando el SOP se diagnostica usando los criterios NIH. Valorar la circunferencia de la cintura y colesterol no-HDL parecen ser los indicadores clínicos más útiles en esta alteración metabólica. La inflamación sistémica asociada con disfunción endotelial vascular y alteración metabólica están presentes comúnmente en mujeres con SOP. En estas mujeres circulan en exceso numerosos marcadores bioquímicos inflamatorios y trombóticos de riesgo de ECV. Alguno de estos marcadores se correlaciona con resistencia a la insulina. No está claro si los niveles aumentados de marcadores inflamatorios y trombóticos de riesgo de ECV aportan poder predictivo adicional más allá del uso de los factores de riesgo clásicos de ECV para asesorar el riesgo individual de ECV. Nivel de evidencia A: –SOP es un factor de riesgo mayor para desarrollar intolerancia a la glucosa y DMT2. –La obesidad es un factor exacerbante en el desarrollo de intolerancia a la glucosa y DMT2 en SOP. –Puede usarse la metformina para intolerancia a glucosa y DMT2. Nivel de evidencia B: –El aumento de la prevalencia de obesidad en la población sugiere que habrá un mayor aumento de diabetes en SOP. –La dieta y la mejora del estilo de vida son de primera elección para mejorar la fertilidad y prevención de la diabetes. Nivel de evidencia B: –SOP a cualquier edad se caracteriza por mayor frecuencia de elevación de marcadores de riesgo de ECV. La elevación de los marcadores de riesgo sucede sin obesidad, y se magnifica con la misma. Nivel de evidencia C: –El cribado de intolerancia a la glucosa y DMT2 debería hacerse mediante sobrecarga oral de glucosa (75g. – 2 horas). No es útil la medición de insulina en la mayoría de los casos. –Dislipemia, intolerancia a glucosa y DMT2 (factores de riesgo clásicos para ECV y aterosclerosis) son más prevalentes en mujeres con SOP, incluso en estudios pareados por peso con mujeres normales. –Debería llevarse a cabo el cribado en los siguientes casos: hiperandrogenismo con anovulación, acantosis nigricans, obesidad, historia familiar de diabetes gestacional o DMT2. –Niveles alterados de triglicéridos, HDL, LDL y noHDL (reflejando metabolismo alterado ApoB/ApoA) son prevalentes en mujeres con SOP y son más severos en mujeres con hiperandrogenismo. MARCADORES DE ENFERMEDAD CARDIOVASCULAR La enfermedad cardiovascular (ECV) está causada por influencias genéticas y del estilo de vida. –Todos los marcadores reflejan una mayor magnitud de riesgo cuando las mujeres se diagnostican con los criterios NIH que con los criterios de Rotterdam. La disfunción metabólica en las mujeres con SOP conduce a un riesgo aumentado de ECV con la edad. Los marcadores de riesgo de ECV reflejan la disfunción metabólica. Puede haber cambios sin obesidad, y son magnificados con la obesidad. Existe más obesidad central en mujeres no obesas con SOP. La severidad de RI se relaciona con la cantidad de la obesidad abdominal incluso en mujeres con IMC normal. Esto contribuye a las anormalidades en los marcadores clásicos de riesgo de ECV (intolerancia a glucosa, síndrome metabólico, DMT2, dislipemia). –La depresión y la ansiedad, riesgos mayores de ECV, son comunes en mujeres con SOP. Nivel de evidencia C: –No-HDL colesterol y medida de la cintura parecen ser los mejores indicadores clínicos de riesgo de ECV. –La valoración de riesgo de ECV recomendada a cualquier edad consta de: valoración del stress psicosocial, TA, glucosa, perfil lipídico (colesterol, triglicéridos, HDL, LDL y no-HDL colesterol), circunferencia abdominal, actividad física, nutrición y tabaquismo. Factores de riesgo ECV: hipertensión, diabetes, obesidad abdominal, factores psicológicos, tabaquismo, alteración en la ratio ApoB/Apo A circulante. Factores protectores: ejercicio, consumo adecuado de frutas y verduras y alcohol. CONSECUENCIAS DE LA ENFERMEDAD CARDIOVASCULAR La disfunción metabólica de larga duración en mujeres con SOP exagera el riesgo de ECV con la edad, particularmente tras la menopausia. Esta disfunción metabólica se basa en la RI, que sucede en la mayor parte de las mujeres con SOP y es independiente pero aditiva a la obesidad. En consecuencia, comenzando en la adolescencia, la intolerancia a la glucosa y DMT2 son muy prevalentes en SOP (odds ratio de aproximadamente 4:1) y suceden en aproximadamente el 40% de las La frecuencia de estos indicadores de riesgo de ECV es aproximadamente 3 veces mayor en mujeres con SOP comparado con mujeres sin SOP y en estudios emparejados por IMC la frecuencia es aproximadamente el doble, esta diferencia se mantiene en todos los grupos de edad. La prevalencia de estos marcadores de riesgo de ECV aumentados difiere por regiones geográficas. 25 SOCIEDADE GALEGA DE CONTRACEPCIÓN En cuanto al cáncer de endometrio, las mujeres con SOP que padecen oligo/amenorrea tienen mayor riesgo de desarrollar hiperplasia endometrial y cáncer de endometrio. Se piensa que este aumento del riesgo está relacionado con el estímulo endrogénico endógeno no opuesto por progesterona, pero también puede estar relacionado con los niveles elevados de andrógenos. Las medidas preventivas de cáncer de endometrio incluyen el diagnóstico y tratamiento de estrógenos sin oposición, con progesterona cíclica o bien vigilancia mediante biopsia de endometrio o ultrasonografía a aquellas con periodos extensos de amenorrea. Se recomienda que las mujeres deberían tener por lo menos 4 episodios de hemorragia de deprivación al año. mujeres en la cuarta década de la vida, con la edad y la ganancia de peso empeorando el control glucémico. Mujeres con RI y SOP tienen disfunción vascular, que se asocia con adiposidad abdominal. Las mujeres con SOP además tienen más enfermedad vascular subclínica que mujeres normales. La severidad del engrosamiento medio de la íntima carotídea, calcificación de arterias coronarias y en menor grado la calcificación aórtica son mayores en mujeres con SOP (NIH) que en controles, independientemente de la edad y del IMC. Sin embargo, la evidencia de mayor morbilidad y mortalidad por ECV en mujeres con SOP diagnosticado con los criterios de Rotterdam y/o NIH no es concluyente. No es posible diagnosticar apropiadamente SOP tras la menopausia. De cualquier forma, mujeres postmenopáusicas con hiperandrogenemia e irregularidades menstruales en la premenopausia tienen mayor número de eventos cardiovasculares que los controles, a pesar del reto que supone técnicamente medir adecuadamente niveles bajos de andrógenos circulantes en este grupo de edad. En el grupo de mujeres postmenopáusicas no diabéticas, con ovarios intactos, además, la ECV aterosclerótica se asocia con características de SOP, incluyendo irregularidad menstrual premenopáusica, hirsutismo e hiperandrogenismo bioquímico postmenopáusico. Con respecto al cáncer de ovario solamente un estudio evaluó la asociación de cáncer epitelial ovárico en mujeres con SOP, que mostró una odds ratio de 2,52 (1,08 – 5,89), que se traduce en un riesgo de 17,4 a 44 por 100000 mujeres. Se sabe que el uso de ACOs es una medida preventiva del riesgo de cáncer de ovario. El tratamiento de esterilidad con resultado de niño vivo también se piensa que es preventivo. No se recomienda seguimiento de rutina para la detección de cáncer de ovario en SOP. No se encuentra asociación entre SOP y cáncer de mama, aunque hay factores asociados a ambos como la nuliparidad y la obesidad. No hay recomendaciones específicas en cuanto al cribado de cáncer de mama en mujeres con SOP. Nivel de evidencia B: –La disfunción metabólica a lo largo de toda la vida en mujeres con SOP incrementa el riesgo de ECV, causando un posible aumento en eventos de ECV con la edad, especialmente tras la menopausia. Nivel de evidencia B: –Hay datos de moderada calidad que apoyen que mujeres con SOP tienen 2,7 veces (IC 95% 1,0-7,3) más riesgo de cáncer de endometrio. La mayor parte de los cánceres de endometrio son bien diferenciados y tienen buen pronóstico. –Todos los marcadores secundarios de riesgo cardiovascular son mayores en SOP (ajustados por edad e IMC), pero la asociación de esos marcadores con eventos cardiovasculares en SOP permanece poco clara. –Hay pocos datos que no apoyan la conclusión de que las mujeres con SOP tienen riesgo aumentado de cáncer de ovario. –La disfunción endotelial en SOP se relaciona con obesidad abdominal y RI. –La calcificación de las arterias coronarias y el engrosamiento de la íntima carotídea también se encuentran aumentados en mujeres con SOP, comparado con controles apareados. –Existen pocos datos que no apoyan la conclusión de que las mujeres con SOP tienen riesgo aumentado de cáncer de mama. –En el grupo de mujeres postmenopáusicas no diabéticas con ovarios intactos, la ECV aterosclerótica se asocia con rasgos de SOP, tales como exceso androgénico relativo e historia de irregularidades menstruales. RIESGO DE CÁNCER SOP es un desorden reproductivo común que resulta en una disrupción de la fisiología reproductiva normal. Esta condición puede asociarse con un riesgo aumentado de desarrollar cáncer de endometrio, ovario y / o mama, tanto directamente como mediado por sus alteraciones metabólicas. Hay poco publicado que demuestre la asociación de SOP con el desarrollo de cáncer de los órganos reproductivos. Cuando se habla de la asociación de SOP con el riesgo de cáncer, es difícil separar el riesgo de cáncer asociado con otros factores de riesgo reconocidos tales como nuliparidad, infertilidad, tratamientos de infertilidad, anovulación y obesidad. 26 SOCIEDADE GALEGA DE CONTRACEPCIÓN LAS NOVEDADES EN ANTICONCEPCIÓN DE LOS ÚLTIMOS DIEZ AÑOS ¿QUÉ APORTAN A LA SALUD DE LA MUJER? Dra. Isolina Bonacho Paniagua Ginecóloga del Centro de Orientación Familiar Municipal - SERGAS de A Coruña. Se utiliza para evaluar los síntomas la escala de COPE y los resultados muestran más mejoría en el total de la escala de COPE en el grupo que tomó el anticonceptivo. Desglosando la escala de COPE por grupos de factores donde hubo diferencia significativa fue en el factor 3 que evalúa el acné y apetito, en el resto de factores hubo más mejoría pero no estadísticamente significativa. En los últimos 10 años se han comercializado en España nuevos preparados en anticoncepción hormonal combinada oral que contienen moléculas nuevas de gestágenos (Drospirenona, Acetato de Clormadinona y Dienogest) y una molécula de estrógeno, nueva en anticoncepción el Valerato de Estradiol. Hay que destacar que los anticonceptivos que contienen estas moléculas son tan eficaces y seguros como los otros anticonceptivos comercializados y suponen un importante beneficio para la mujer. Concluyen los autores que puede ser útil en el tratamiento del SPM pero es necesario realizar estudios mejores que determinen la eficacia clínica en el tratamiento de SPM. La exposición está basada en el análisis de las características de los preparados utilizando como hilo conductor la información que se ha utilizado para la promoción del producto. Brown et al realizan un estudio retrospectivo poblacional que tiene como objetivo evaluar los cambios premenstruales en mujeres tomando 30mcg de EE+3 mg de Drospirenona. DROSPIRENONA: Hay comercializados diferentes preparados unos contienen 30 mcg de Etinilestradiol y 3 mg Drospirenona pauta de 21/7 y 20 mcg de Etinilestradiol y 3 mg Drospirenona pauta de 24/4. En este estudio todas las mujeres mejoraron los síntomas relacionados con la retención de líquidos y los síntomas afectivos. Los autores consideran necesario hacer estudios con placebo para confirmar estos hallazgos, esta es la limitación principal de este estudio. “La Drospirenona ejerce un efecto beneficioso sobre el acné leve o moderado” Borenstein J et al. basándose en la hipótesis de que la combinación EE 30 mcg y Drospirenona 3mg tendría un impacto significativo en la sintomatología premenstrual realizan un estudio de cohorte con mujeres que toman este preparado. Realizan encuestas después de 2 meses tomando EE 30 mcg y Drospirenona 3 mg. Este efecto beneficioso sobre la piel mejorando acné leve y moderado se atribuye a las propiedades antiandrogénicas de la Drospirenona. La Drospirenona es un gestágeno síntético análogo a la Espironolactona, su perfil farmacológico es similar a la progesterona natural tiene dos de sus propiedades la antimineralocorticoide y la antiandrogénica. Según los resultados el uso de EE 30 mcg y Drospirenona 3 mg estuvo asociado a una mejoría de varios síntomas físicos y mentales comúnmente asociados al SPM así como mejoría de la sensación general de bienestar. El efecto beneficioso sobre la piel está argumentado en dos estudios ensayos randomizados, doble ciego (Koltun Wet al.; Maloney JM), realizados en EEUU en mujeres de 14-45 años con acné vulgaris moderado. Comparan con placebo y observan que es significativamente más efectiva la combinación de Etinilestradiol(EE) y Drospirenona que el placebo en el tratamiento del acné vulgaris moderado y estos efectos antiacné se observaron en el tercer ciclo. Hay dos estudios que comparan Drospirenona con Levonorgestrel y Desogestrel: El estudio comparativo que realizan Sangthawan M et al. tiene como objetivo principal comparar la prevalencia de síntomas premenstruales durante 6 ciclos en mujeres que tomaron 30 mcg de Etinilestradiol y 3 mg Drospirenona y 30 mcg de Etinilestradiol y 150 mg de Levonorgestrel. Realizan el cuestionario Women's Health Assessment Questionnaire (WHAQ) a 104 mujeres. En los resultados se observa en las mujeres que tomaron 30mcg de Etinilestradiol y 3 mg Drospirenona una mejoría de los síntomas de ansiedad, irritabilidad y sentimientos de tristeza durante la fase premenstrual. “Mejoría de los síntomas físicos y emocionales premenstruales” Los buenos resultados de la Drospirenona se basan en la hipótesis de que tiene una estructura similar a la Espirinolactona que le aporta la actividad antimineralocorticoide, lo que puede teóricamente proporcionar un beneficio adicional en el tratamiento del Síndrome Premenstrual (SPM) similar al que se observa con la Espirinolactona. Foidart JM et al. en un estudio multicentrico y una muestra de 900 mujeres comparan 30 mcg de Etinilestradiol y 3 mg Drospirenona con 30 mcg de Etinilestradiol y 150 mg de Desogestrel durante 26 ciclos. En este estudio se observó una mínima reducción de los síntomas premenstruales con 30 μg de Etinilestradiol y 3 mg Drospirenona. El primer estudio (Freman E et al.) para determinar la eficacia en el SPM con el anticonceptivo oral combinado (AOC) que contiene EE 30 mcg y Drospirenona 3 mg es un ensayo multicéntrico doble ciego, randomizado y controlado. Una muestra de 82 mujeres entre 18-40 años. Toman el anticonceptivo 42 mujeres y 40 son placebo. Hay dos estudios que analizan el resultado en el tra- 27 SOCIEDADE GALEGA DE CONTRACEPCIÓN Describen los resultados de un ensayo aleatorizado, simple ciego, multicéntrico que compara EE 30 mcg/ACM 2 mg con EE 30 mcg y Levonorgestrel 150 mg/día para el tratamiento de mujeres con acné facial papulopustulosos leve a moderado. Hubo una disminución significativa en el número de lesiones en cara al llegar al 12 ciclo en el grupo de ACM. tamiento del Síndrome Premenstrual con 20 mcg de Etinilestradiol y 3 mg de Drospirenona en régimen de 24/4 Kimberly et al. realizan un estudio multicéntrico, doble ciego randomizado para evaluar los síntomas asociados a la fase premenstrual mediante la escala Daily Record of Severity of Problems. Los resultados son una mejoría de los síntomas relacionados con el humor, síntomas físicos y síntomas de conducta en el grupo que tomó Drospirenona. Realizan un estudio prospectivo observacional randomizado Sabatini R, et al. a 156 adolescentes de 14-19 años. Comparan dos preparados Etinilestradiol 30 mcg y acetato de Clormadinona 2 mg y Etinilestradiol 30 mcg y Drospirenona 3 mg. Objetivos observar los efectos de las dos combinaciones durante 6 meses en sangrado intermenstrual, dismenorrea, acné y problemas de pelo y piel. Concluyen los autores que ambas preparaciones son efectivas como anticonceptivos, tienen buen control del ciclo y efectos beneficiosos en desordenes de piel y pelo sin efectos sobre el peso. Aunque el mejor resultado se obtuvo con Etinilestradiol 30 mcg y acetato de Clormadinona 2 mg con diferencias estadísticamente significativas. El segundo estudio se trata de un ensayo dobleciego, randomizado, placebo controlado realizado por Pearlstein TB et al. Objetivo del estudio analizar la eficacia de la pauta 20mcg de EE y 3 mg de Drospirenona en régimen de 24/4 para el tratamiento del Síndrome Premenstrual. Concluyen los autores que esta formulación fue más efectiva que el placebo reduciendo los síntomas premenstruales y mejorando la calidad de vida de las mujeres con SPM. ACETATO DE CLORMADINONA (ACM): Los preparados comercializados contienen 30mcg de Etinilestradiol y 2 mg Acetato de Clormadinona. DIENOGEST (DNG): Hay dos tipos de anticonceptivos comercializados que contienen Dienogest uno asociado con Etinilestradiol y otro con valerato de Estradiol. “Beneficios sobre la piel grasa y el cabello” Estos beneficios se atribuyen a las propiedades antiandrogénicas del acetato de Clormadinona que es un derivado de 17α Hidroxiprogesterona. La promoción del anticonceptivo que contiene 30 mcg de Etinilestradiol y 2 mg de Dienogest dice: Scharamann G et al. realizan un estudio multicentrico observacional de evaluación clínica, de 12 ciclos con EE 0,03 mg/ACM 2 mg cuyos objetivos entre otros fue valorar la influencia de esta combinación en enfermedades androgénicas. “Potente actividad antiandrogénica” “El 97% de las mujeres evalúa positivamente los efectos en piel y cabellos grasos” Estas propiedades se atribuyen al tipo de gestágeno. Dienogest es un derivado de la 19-nortestosterona que combina propiedades de la familia de la 19nortestosterona y de los derivados de la progesterona. Posee una marcada actividad antiandrogénica por su acción directa a nivel del receptor de andrógenos, no tiene afinidad por SHBG y por tanto no compite con la testosterona libre, no tiene actividad androgénica. Otra característica de este gestagéno Participaron 2620 pacientes. En el estudio más del 80% de todas las mujeres con problemas de piel al principio del estudio observaron efectos beneficiosos durante el tratamiento. El número de mujeres con pelo graso o muy graso disminuyó más del 75% después de 12 ciclos. Concluyen que este estudio observacional confirma la eficacia, alta estabilidad del ciclo, excelente tolerabilidad durante un año de tratamiento, a lo que se añaden beneficios adicionales en piel y pelo por las propiedades antiandrogenicas de la CMA. Es su fuerte acción endometrial con potente efecto antiproliferativo sobre el endometrio. Golbs, S et al. realizan un estudio multicentrico no controlado cuyo objetivo secundario entre otros era observar efectos dermatológicos de la combinación 30 mcg de Etinilestradiol y 2 mg de Dienogest. Se estudian N=557 mujeres sanas de 18-35 años, durante 12 ciclos. Debido a las propiedades antiandrogenicas del DNG se observa mejoría en pelo graso, manchas de la piel y acné vulgaris. De 108 mujeres con acné que participaron en el estudio el 57% mejoró la sintomatología a los 6 ciclos observándose la tendencia a mejorar hasta los 12 ciclos. El porcentaje de personas que notaron mejoría aumentó con el tiempo de tratamiento. En este artículo los autores Zahradnik HP et al. mediante un estudio no controlado desean valorar la eficacia y tolerabilidad de EE 30mcg/ACM 2 mg durante 24 meses. El investigador documenta la presencia y grado de signos de acné, seborrea, alopecia e hirsutismo. La mayoría de las mujeres completaron el tratamiento durante 24 ciclos apreciándose una mejoría de los síntomas de androgenización después de 6 ciclos. Hay que destacar el número bajo de mujeres con acné en el estudio. Hay dos estudios que comparan acetato de Clormadinona con Levonorgestrel y Drospirenona Palombo-Kinne E realiza un ensayo multicentrico, multinacional, doble ciego, aleatorizado. Mujeres de 16 a 45 años con acné facial leve a moderado. Comparan el efecto de 30 mcg de Etinilestradiol y 2 mg de Dienogest con 35 mcg de Etinilestradiol y 2 mg de acetato de Ciproterona y con placebo durante 6 ciclos. Objetivo demos- Curran et al hacen una revisión de las propiedades farmacodinámicas y farmacocinéticas de la combinación EE 30 mcg/ACM 2mg. Hacen también una revisión de diferentes estudios que tratan trastornos relacionados con los andrógenos. 28 SOCIEDADE GALEGA DE CONTRACEPCIÓN Fraser et al. realizan un ensayo doble ciego. Seleccionan a mujeres sanas con sangrado menstrual fuerte, prolongado y frecuente sin patología orgánica reconocida. Comparan el efecto del tratamiento con el preparado cuatrifásico y con placebo durante 196 días. En el grupo que realizó tratamiento con el anticonceptivo cuatrifásico hubo mayor reducción del volumen de sangrado y aumento del nivel sanguíneo de hierro que en el grupo placebo. Concluyen que el preparado cuatrifásico es eficaz en el tratamiento de mujeres con sangrado menstrual fuerte y/o prolongado sin patología orgánica. trar que el preparado con Dienogest es superior al placebo y no inferior a acetato de Ciproterona. Concluye el autor que la combinación 30 mcg de Etinilestradiol y 2 mg de Dienogest fue superior a placebo e igual de eficaz que 35 mcg de Etinilestradiol y 2 mg de acetato de Ciproterona en el tratamiento del acné de leve a moderado y resultó una opción válida para el tratamiento del acné en mujeres que desean anticoncepción hormonal oral. El preparado que contiene Dienogest más valerato de Estradiol tiene una dosificación denominada dinámica: 2 comprimidos con 3 mg de valerato de Estradiol, 5 comprimidos con 2 mg valerato de Estradiol + 2 mg Dienogest, 17 comprimidos con 2 mg valerato de Estradiol + 3 mg Dienogest y 2 comprimidos con 1 mg valerato de Estradiol. BIBLIOGRAFÍA -Koltun W, Lucky AW, Thiboutot D et al. Efficacy and safety of 3mg drospirenone/20mcg ethinylestradiol oral contraceptive administered in 24/4 regimen in the treatment of acne vulgaris: A randomized, double-blind, placebo-controlled trial. Contraception 2008,77:249-256 El valerato de Estradiol se transforma en 17beta estradiol (E2) tras la administración oral por lo que es el primer anticonceptivo que aporta el estradiol idéntico al producido en el ovario de forma endógena. El Estradiol a diferencia del Etinilestradiol está asociado con una menor inducción de síntesis de proteínas hepáticas. -Maloney JM. Treatment of acne using a 3-Milligram Drospirenone/20-Microgram Ethiyl Estradiol oral contraceptive administered in a 24/4 Regimen. A Randomized controlled trial. Obstet Gynecol 2008;112:773-8192 -Freman E, Kroll R, Rapkin A et al. Evaluation of a unique oral contraceptive in the treatment of premenstrual dysphoric disorder. J Women Health&Gender Based Medicine 2001;10:561-9 -Brown C, Ling F, Wan J. A new monophasic oral contraceptive contining drospirenone. Effect on premenstrual symptoms. J Reprod Med 2002;47:14-22 Se ha pensado que la asociación de Dienogest con valerato de Estradiol ofrece potencialmente mayor seguridad debido a que es un estrógeno más débil con menos efectos en las proteínas estrógeno dependientes hepáticas, sin embargo es necesario realizar estudios que demuestren este potencial beneficio. -Borenstein J, Yu HT, Wade S, Chiou CF, Rapkin A. Effect of an oral contraceptive containing ethinyl estradiol and drospirenone on premenstrual symptomatology and health-related quality of life. J Reprod Med 2003;48:79-85 -Sangthawan M, Taneepanichskul S. A comparative study of monophasic oral contraceptives containintg either drospirenone 3mg or levonorgestrel 150microg on premenstrual symptoms. Contraception 2005;71:1-7 -Foidart JM,Wuttke W, Bouw GM, Gerlinger C,Heithecker R. A comparative investigation of contraceptive reliabity, cycle control and tolerance of two monophasic oral contraceptives containing either drospirenone or desogestrel. Eur J Contracept Reprod Health Care 2000;5:124. El régimen cuatrifásico, dinámico fue desarrollado para minimizar el pobre control del ciclo asociado al Estradiol. -Kimberly A, Yonkers KA, Brown C, Pearlstein TB et al. Efficacy of a new low-dose oral contraceptive wit drospirenone in premenstrual dysphoric disorder. Obstet Gynecol 2005;106(3):492-501 Con este régimen de dosificación se conseguiría una dominancia estrogénica en la primera parte del ciclo que aseguraría una proliferación endometrial inicial y una sensibilidad para la acción del progestágeno y en la mitad y segunda parte del ciclo una dominancia progestogénica para conseguir una estabilidad del estroma endometrial y un buen control del sangrado -Pearlstein TB, Bachmann GA, Zacur HA et al. Treatment of premenstrual dysphonic disorder with a new drospirenone containing oral contraceptive formulation. Contraception 2005;72(6):414-21 -Scharamann G, Steffens D. A 12.month evaluation of CMA-containing oral contraceptive Belara: efficacy, tolerability and anti-androgenic properpies. Contraception. 2003;67(4):305-312 -Zahradnik HP, Hanjalic-Beck A. Efficacy, safety and sustainability of treatment continuation and results of an oral contraceptive containing 30mcg ethinyl estradiol and 2mg chlormadinone acetae, in long-term usage (up to 45 cycles):An open-label, prospective, noncontrolled, office-based Phase III study. Contraception. 2008;77:337-343. “Primer y único anticonceptivo oral indicado en el tratamiento del sangrado menstrual abundante sin ninguna patología orgánica” -Curran M P, Wagstaff A J. Ethinyilestradiol/chlormadinone acetate. Drugs. 2004;64(7):751-760 En el ensayo randomizado, doble-ciego, multicentrico realizado por Ahrendt et al comparan el preparado cuatrifásico con la combinación de 20 mcg de Etinilestradiol y 100 mg de Levonorgestrel. Mujeres sanas de 18-50 años durante 7 ciclos. Los resultados muestran que hubo una significativa menor cantidad y duración de sangrado en el grupo de la combinación cuatrifásica. Los autores concluyen que el preparado cuatrifásico esta asociado a un perfil de sangrado aceptable comparable a preparados que contienen Etinilestradiol. -Sabatini R, et al. Non contraceptive benefts of two combined oral contraceptives with antiandrogenic properties among adolescents. Contraception 2007;76:342347 Jensen et al en el ensayo randomizado, doble ciego, multicentrico, estudian a 190 mujeres mayores de 18 años con sangrados menstruales prolongados, frecuentes y abundantes, las comparan con otro grupo placebo. Concluyen que la combinación cuatrifásica es altamente eficaz comparada con placebo en el tratamiento de mujeres con sangrado menstrual prolongado y/o abundante sin patología orgánica. -Jensen JT et al. Effective treatment of heavy menstrual bleeding with estradiol valerate and dienogest: a randomized controlled trial. Obstet Gynecol 2011; 117(4): 777-87 Golbs, S et al. Clinical Findings with the oral Contraceptive Combination ethinylestradiol/dienogest in the Czech Republic. Methods Find Exp Clin Pharmacol 2002, 24(10):689-696 -Palombo-Kinne E. Efficacy of a combined oral contraceptive containing 0,030mg ethinylestradiol/2mg dienogest for the treatment of papulopustular acne in comparison with placebo and 0,035mg ethinyilestradiol/2mg cyproterone acetate. Contraception 79 (2009) 282-289 -Ahrendt HJ et al. Bleeding pattern and cycle control with and estradiol-based oral contraceptive: a seven cycle, randomized comparative trial of estradiol vateratye/dienogest and ethinyl estradiol/levonorgestrel. Contraception 2009 Nov; 80 (5): 436-44. Epub 2009 May 13. -Frasaer IS, Römer T, Parke S et al.Effective treatment of heavy and/or prolonged mentrual blleding with an oral contraceptive containing estradiol vaterate and dienogest: a randomized, double-blind Phase III trial. Human Repro 2011; 26(10):2698-2708. 29 SOCIEDADE GALEGA DE CONTRACEPCIÓN TRATAMIENTO HORMONAL DE LA ENDOMETRIOSIS Dr. Eloy Moral Santamarina, Dra. María Fernández Ríal Congreso de la SOGAC. Ribeira 2012. cos en genitales internos o en otros órganos a distancia como el pulmón, piel, cerebro… DEFINICIÓN La endometriosis es una enfermedad crónica benigna y habitualmente recurrente caracterizada por la presencia y proliferación de glándulas endometriales funcionantes y estroma fuera de la cavidad uterina. Según la teoría de la transformación metaplásica, la endometriosis se originaría por transformación del tejido celómico embrionario presente en multitud de estructuras pélvicas y extrapélvicas. Por otra parte, la predisposición genética y los factores inmunológicos juegan un papel importante en esta enfermedad. Se sospechaun patrón de herencia poligénico / multifactorial ya que existe mayor afectación en parientes de primer grado de mujeres afectadas que en la población general. Además en los tejidos endometriósicos se han identificado alteraciones en la inmunidad celular y humoral relacionados con la extensión de la enfermedad, que afectan a macrófagos, células NK y linfocitos peritoneales frenadores entre otros. Su frecuencia es difícil de estimar, ya que muchas mujeres permanecen asintomáticas. Se calcula que afecta al 10% de mujeres en edad fértil y se objetiva en el 45 % de las laparoscopias diagnósticas realizadas por cualquier causa. Además el 25-40% de mujeres infértiles y el 97% de las mujeres con dolor pélvico crónico estarán afectadas por esta enfermedad. FISIOPATOLOGÍA Es una enfermedad estrógeno dependiente con respuesta trófica similar, aunque no idéntica, al endometrio eutópico. Las glándulas de la endometriosis son irregulares en su crecimiento y en su respuesta al estímulo hormonal ya que poseen mecanismos de producción estrogénica y resistencia a la inhibición del estímulo estrogénico en el propio implante endometriósico, lo que garantiza su persistencia y crecimiento. Diversas publicaciones le atribuyen capacidad de respuesta a estímulos naturales y hormonas exógenas, incluso el 15 % de los focos residuales pueden proliferar nuevamente si cuentan con el estímulo adecuado. Por todo ello se recomienda tratamiento hormonal con estrógenos y progesterona para evitar exacerbaciones de enfermedad residual y desarrollo de adenocarcinoma en el tejido endometriósico. CLÍNICA La presentación es muy variable y algunas mujeres se encuentran asintomáticas al diagnóstico, pero generalmente presentan dolor en forma de dismenorrea, dispareunia, disuria, disquecia, dolor pélvico no cíclico y dolor ovulatorio que acarrea disminución de la calidad de vida. La endometriosis es además, una de las causas más frecuentes de esterilidad. DIAGNÓSTICO Aunque la sospecha es clínica y el diagnóstico diferencial comprende multitud de entidades con sintomatología común, el diagnóstico definitivo requiere visualización directa vía laparoscópica y biopsia. TEORÍAS ETIOPATOGÉNICAS Se desconoce la causa definitiva de la endometriosis, pero se han propuesto varias teorías que tratan de explicar su origen y desarrollo, fundamentalmente la teoría de la diseminación de tejido endometrial y la teoría de la transformación metaplásica. TRATAMIENTO El tratamiento ha de ser individualizado y a largo plazo, informando correctamente a la paciente y haciéndola partícipe en la toma de decisiones. La elección de tratar o no depende de factores como la edad, los deseos actuales de gestación, la duración de la infertilidad, el estadio de la enfermedad, el tipo y severidad de síntomas y los tratamientos previos a los que se ha sometido la paciente. Es importante Dentro de los mecanismos de diseminación de tejido endometrial estarían englobadas la menstruación retrógrada y el transplante linfático o hemático que explicarían la aparición de focos endometriósi30 SOCIEDADE informar de que aunque disponemos de tratamientos médicos y quirúrgicos, todavía no existe ninguno curativo y de que en ausencia de sintomatología y/o deseo gestacional no es obligado tratar. GALEGA DE CONTRACEPCIÓN que se reducen los efectos secundarios con ACO. Por lo tanto se consideran como primera opción para tratamientos prolongados. Entre los gestágenos destaca el dienogest, progestágeno sintético oral con elevada selectividad por el receptor de progesterona con potente efecto progestacional y moderado efecto supresor gonadotrópico, induciendo un estado de hipoestrogenismo. Además, no presenta actividad androgénica, glucocorticoide o mineralocorticoide, no altera el perfil lipídico ni carbohidrato como los 19 nor-derivados y tiene efecto antiinflamatorio, antiproliferativo y antiangiogénico. Cuenta con un perfil de seguridad superior a ACOs tradicionales, otros gestágenos y análogos de GnRH. Como efectos secundarios destacan la metrorragia (71,9%), cefalea (18,5%) y estreñimiento (10,4%) definidos como leves o tolerables. El 72,5% de las pacientes refieren mejoría o supresión del dolor tras 24 semanas de tratamiento y el 90,6% tras 52 semanas de tratamiento. Además en el 82% de las pacientes tratadas, después de 52 semanas de tratamiento se ha documentado una reducción del tamaño del quiste en más del 25% de su tamaño. Tratamiento médico Los tratamientos médicos actuales se dividen en analgésicos y tratamientos hormonales que tienen como objetivo inducir un estado hipoestrogénico y anovulación con la consiguiente atrofia y decidualización de los implantes, asociado a un mayor número de glándulas inactivas, es decir, un “pseudoembarazo”. Como tratamientos de 1ª línea en mujeres con dismenorrea o dolor pélvico leve disponemos de AINEs (ibuprofeno, naproxeno, ácido mefenámico) que mejoran el 80% de las dismenorreas por disminución de las prostaglandinas endometriales que participan en el dolor e inflamación de la endometriosis. No existen datos suficientes que demuestren una eficacia superior de un fármaco en el tratamiento del dolor causado por endometriosis. Dentro de este grupo encontramos también tratamientos hormonales como anticonceptivos combinados en régimen cíclico o continuo y progestágenos solos. Al igual que los AINES, ningún tratamiento hormonal se ha demostrado superior a otro en cuanto alivio del dolor, reducción de extensión de las lesiones, tasa de embarazo posterior o tasa de recurrencia tras el cese del tratamiento. Por lo tanto la elección se basará en la relación coste/ efectos secundarios. Otros gestágenos disponibles serían el acetato de medroxiprogesterona a dosis altas (50 mg/día durante 4 meses) que se ha demostrado eficaz para el dolor pélvico crónico por endometriosis (grado de recomendación B), el acetato de noretisterona a 515 mg/día (grado de recomendación B) que se ha demostrado eficaz en el 94% de las pacientes con dolor pélvico crónico pero con más efectos secundarios, entre los que destacan sangrado irregulares, ganancia de peso, acné y labilidad emocional y con una eficacia del 75% en lesiones del tabique rectovaginal tras cirugía incompleta. El tratamiento hormonal tendría utilidad en la endometriosis profunda o endometriosis del tabique recto-vaginal administrado previo a cirugía y reduce la recidiva del dolor si se administra una vez realizada la intervención quirúrgica. De la misma manera han demostrado control del dolor en el 75-82% de las pacientes. Es válida cualquier pauta, mejor los de estrógenos naturales y baja dosis. Su mecanismo de acción consiste en disminuir la secreción de gonadotropinas y la secreción ovárica de estrógenos, inhibiendo la ovulación, disminuyendo el flujo menstrual, decidualizando los implantes endometriósicos y aumentando la apoptosis del endometrio ectópico. Existen pocas publicaciones de calidad a pesar de su amplio uso en la práctica clínica. Sólo un estudio compara ACO con análogos de la GnRh en pacientes con dolor pélvico crónico por endometriosis en el cual no se encuentran diferencias significativas tras 6 meses de finalizar el tratamiento aun- Los gestágenos intrauterinos serían la alternativa de primera elección en el tratamiento sintomático de endometriosis leve y moderada sin deseo inmediato de fertilidad. Se caracterizan por la liberación continua de 20 mcg/día de levonorgestrel en la cavidad uterina, con una reducción del flujo menstrual entre 70-90% y eficacia similar a los análogos de GnRh en alivio del dolor pélvico a largo plazo así como también son eficaces en endometriosis del tabique rectovaginal tras cirugía incompleta. Por vía laparoscópica, hay evidencia de disminución del tamaño de las lesiones y menor recurrencia del dolor moderado/severo en el postoperatorio. En cuanto a los gestágenos inyectables, en un estudio piloto del implante liberador de etonorgestrel IMPLANON subcutáneo, 41 mujeres que pre31 SOCIEDADE sentaban dolor pélvico y endometriosis se randomizaron a recibir el implante o acetato de medroxiprogesteronadepot 150 mg im cada 3 meses durante 1 año. Ambos tratamientos fueron iguales reduciendo el dolor pélvico. El sangrado uterino irregular es común cuando se usa el implante como tratamiento de la endometriosis. Uno de los objetivos importantes es conseguir amenorrea u oligomenorrea. GALEGA DE CONTRACEPCIÓN finalizar su administración entre 53 y 73% en casos de enfermedad severa. En general estarían indicados en pacientes que no han respondido a anticonceptivos orales o antiinflamatorios no esteroideos. Tratamientos en investigación En la actualidad se está investigando el papel de otros fármacos como antagonistas de GnRh, RU486 (mifepristona), inhibidores de la aromatasa (letrozol, anastrozol), reguladores de los receptores de progesterona, inmunofármacos (interleukina 2 e interferón) e inhibidores de la angiogénesis en el tratamiento de la endometriosis. Dos grandes estudios que engloban 550 pacientes muestran que el acetato de medroxiprogesterona 150 mg depot im cada 3 meses es equiparable a dosis de 3,75 mg mensuales durante 3 meses de leuprolidedepot en la resolución de la dismenorrea, dispareunia y dolor pélvico crónico en mujeres con endometriosis. Además los métodos anticonceptivos con solo gestágenos como el DIU de levonorgestrel, el acetato de medroxiprogesteronadepot y los implantes subdérmicos tienen una serie de beneficios no contraceptivos como mayor reducción del flujo menstrual y tendencia a amenorrea, mayor protección frente a hiperplasia de endometrio y cáncer, reducción de desarrollo de miomas y adenomiosis, pueden utilizarse en pacientes epilépticas y reducen la dismenorrea y el dolor pélvico en endometriosis. Tratamiento quirúrgico Danazol y análogos de GnRH como tratamiento de 2ª línea. Conclusión En cuanto al tratamiento quirúrgico es de vital importancia obtener el consentimiento informado y plantear la cirugía cuando el resto de alternativas han fracasado ya que tratamientos innecesarios o excesivos pueden ser la principal fuente de problemas y puede requerir una nueva intevención quirúrgica en el 35 % de los casos. En la endometriosis, el tratamiento hormonal juega un papel importante a falta del conocimiento exacto de la etiología de esta enfermedad. Dentro de estos fármacos, los dispositivos con gestágenos intrauterinos y los anticonceptivos orales con dienogest a dosis de 2 mg/día, así como aquellos con gestágenos de tercera generación y drospirenona constituyen una buena opción de tratamiento en aquellas pacientes con dolor pélvico. El danazol es un andrógenos derivado de la 19 nortestosterona con efectos similares a los de la progesterona. Inhibe la secreción de gonadotropinas, la esteroidogénesis e incrementa el aclaramiento de estradiol y progesterona induciendo una “pseudomenopausia”. Resulta efectivo en casos leves/moderados, observándose una mejoría del dolor en el 85% de las pacientes. Se administra vía oral a dosis de 400 mg/día (200 mg/12 horas) que pueden incrementarse hasta 800 mg diarios durante 6 meses. Es un fármaco poco utilizado por sus efectos secundarios: aumento de peso, retención de líquidos, acné, hirsutismo, sofocos, atrofia vaginal, reducción mamaria, reducción de la líbido, nauseas, disminución de HDL, aumento de enzimas hepáticas y depresión. Además el tratamiento hormonal oral conlleva una serie de beneficios adicionales como menor riesgo de cáncer de ovario y endometrio, reducción del riesgo de enfermedad inflamatoria pélvica, disminución del sangrado y anemia, regulación de la duración del ciclo, protección contra quiste de ovario, reducción del riesgo de embarazo ectópico y mastopatías benignas a los que hay que añadir el beneficio aportado según el tipo de gestágeno que contenga que van desde la reducción de síntomas premenstruales hasta menor retención hídrica y mejoría de acné, seborrea e hirsutismo entre otras y asociado sobre todo a gestágenos que forman parte de los últimos preparados comercializados. Los análogos de GnRh son altamente eficaces en la reducción del dolor asociado a endometriosis. Sin embargo, no son superiores a otros métodos como como los anticonceptivos orales como primera línea. Además, tiene importantes efectos secundarios como sofocos, sequedad vaginal y osteopenia reversible. Se consideran tratamientos NO definitivos con una tasa de recurrencia a los 5 años de 32 Daylette ® Anticoncepción oral con Drospirenona + Etinilestradiol con régimen 24+4 Cambiamos la reglas del juego Los primeros en lanzar la combinación de drospirenona + etinilestradiol en régimen 24 + 4 a menor precio (1,2) 45,7% menor que YAZ ® *(1,2) % 5 , 2 4 • Mejora de la calidad de vida y de la capacidad funcional (4) Mayor cumplimiento frente a los regímenes de 21 días (5,6) (*)Laboratorio Titular y marca registrada por: BAYER HISPANIA S.L. (1) Basado en la comparación de precios (PVP+IVA) publicados por el Consejo General de Colegios Oficiales de Farmacéuticos disponibles en https://botplusweb.portalfarma.com. (2). Ficha técnica Daylette. (3). Klipping C, et al. Suppression of ovarian activity with a drospirenone-containing oral contraceptive in a 24/4 regimen. 2008 Contraception 78; 16–25. (4) Kimberly A. et al. Efficacy of a New Low-Dose Oral Contraceptive With Drospirenone in Premenstrual Dysphoric Disorder. Obstetrics & Gynecology 2005. Vol 106, nº 3. (5) G. Bachmann et al. Drospirenone/ethinyl estradiol 3 mg/20mcg (24/4 day regimen): hormonal contraceptive choices- use of a fourth-generation progestin. Patient Preference and Adherence 2009:3 259-264. (6) Lesley L Breech, Paula K Braverman. Safety, efficacy, actions, and patient acceptability of drospirenone/ethinyl estradiol contraceptive pills in the treatment of premenstrual dysphoric disorder. International Journal of Women’s Health 2009:1 85-95. ahorro DAY04-07/2012 - RGD:76346/ES/1 PRECIO Menos días de intervalo libre de hormonas (3) • Mayor margen de seguridad anticonceptiva (3) 1. NOMBRE DEL MEDICAMENTO Daylette 0,02 mg / 3 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 24 comprimidos blancos o blanquecinos recubiertos con película: Cada comprimido recubierto contiene 0,02 mg de etinilestradiol y 3 mg de drospirenona. Excipiente: 48,53 mg de lactosa monohidrato y 0,070 mg de lecitina de soja. 4 comprimidos verdes de placebo (inactivos) recubiertos con película: El comprimido no contiene principios activos. Excipiente: 37,26 mg de lactosa anhidra y 0,003 mg de amarillo atardecer (E110). Para consultar la lista completa de excipientes ver sección 6.1. 3. FORMA FARMACÉUTICA Comprimido recubierto con película. Comprimido de color blanco o blanquecino, redondo, biconvexo, recubierto con película, de unos 6 mm de diámetro. En una cara tiene grabada la inscripción “G73”, en la otra cara no tiene grabado nada. El comprimido de placebo es verde, redondo, biconvexo, recubierto con película, de unos 6 mm de diámetro, sin nada grabado. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas Anticoncepción oral. 4.2 Posología y método de administración Forma de administración: vía oral. Cómo tomar Daylette Los comprimidos deben tomarse cada día aproximadamente a la misma hora, si es necesario con un poco de líquido, en el orden que se muestra en el blíster. Los comprimidos se toman de forma continua. Se debe tomar un comprimido al día durante 28 días. Cada blíster posterior debe iniciarse después del último comprimido del blíster previo. El sangrado de retirada suele empezar el día 2-3 después empezar a tomar los comprimidos de placebo (última fila) y puede no haber concluido antes de empezar el siguiente blíster. Cómo empezar a tomar Daylette Cuando no se han utilizado anticonceptivos hormonales previamente (en el último mes) Los comprimidos deben empezar a tomarse el día 1 del ciclo menstrual natural (es decir, el primer día del sangrado menstrual). Cuando se cambia desde otro anticonceptivo hormonal combinado (anticonceptivo oral combinado (AOC), anillo vaginal o parche transdérmico): Es preferible que la mujer empiece a tomar Daylette el día después del último comprimido activo (el último comprimido que contiene principios activos) del AOC previo, y como muy tarde el día posterior al intervalo habitual sin hormonas del AOC previo. Cuando se haya utilizado un anillo vaginal o de un parche transdérmico, la mujer debe empezar a utilizar Daylette de forma preferente el día de su retirada, y como muy tarde cuando debería haberse producido la siguiente aplicación. Cuando se cambia desde un método que sólo tiene progestágenos (anticonceptivo oral, inyección o implante que sólo contienen progestágenos) o desde un dispositivo intrauterino (DIU) que libera progesterona: La mujer puede cambiarse cualquier día desde el anticonceptivo que sólo contiene progestágeno (desde un implante o el DIU el día de su retirada, desde un inyectable cuando tocase la siguiente inyección) pero en todos estos casos debe aconsejarse la utilización adicional de un método de barrera los primeros 7 días que tome los comprimidos. Después de un aborto en el primer trimestre La mujer puede empezar a tomarlo inmediatamente. Si lo hace así, no es necesario que tome medidas anticonceptivas adicionales. Después del parto o de un aborto en el segundo trimestre A la mujer se le debe aconsejar que empiece a tomar Daylette el día 21-28 después del parto o del aborto en el segundo-tercer trimestre. Si empieza más tarde, a la mujer también se le debe recomendar que utilice de forma adicional un método de barrera durante los primeros 7 días. No obstante, si ya ha mantenido relaciones sexuales, se debe excluir el embarazo antes de empezar a tomar el AOC, o la mujer debe esperar a su primer periodo menstrual. En el caso de mujeres lactantes, ver la sección 4.6. Procedimiento a seguir en caso de no tomar algún comprimido Los comprimidos de placebo de la última (4ª) fila del blíster pueden ignorarse. No obstante deben desecharse para evitar prolongar involuntariamente la fase de toma de comprimidos de placebo. Las siguientes recomendaciones sólo son aplicables cuando se olvida tomar comprimidos activos: Si la usuaria se retrasa menos de 12 horas al tomar cualquier comprimido, la protección anticonceptiva no se reduce. La mujer debe tomar el comprimido tan pronto como se acuerde, y el resto de los comprimidos los debe tomar a la hora habitual. Si se demora más de 12 horas al tomar cualquier comprimido, la protección anticonceptiva puede reducirse. En caso de que se olviden comprimidos se deben seguir estas dos reglas básicas: 1. la toma de comprimidos nunca debe interrumpirse por un periodo de más de 4 días; 2. son necesarios 7 días de toma ininterrumpida de comprimidos para obtener una supresión adecuada del eje hipotálamo-hipofisario-ovárico. Según esto, en la práctica diaria se pueden dar los siguientes consejos: Día 1-7 La usuaria deberá tomar el último comprimido que haya olvidado tan pronto como se acuerde, incluso si esto significa tomar dos comprimidos al mismo tiempo. Después, seguirá tomando los comprimidos a la hora habitual. Además, durante los siguientes 7 días debe utilizar un método de barrera como el preservativo. Si en los 7 días previos ha mantenido relaciones sexuales, la posibilidad de un embarazo se debe tener en cuenta. Cuantos más comprimidos haya olvidado y cuanto más cerca estén de la fase de los comprimidos de placebo, mayor es el riesgo de embarazo. Día 8-14 La usuaria deberá tomar el último comprimido que haya olvidado tan pronto como se acuerde, incluso si esto significa tomar dos comprimidos al mismo tiempo. Después, seguirá tomando los comprimidos a la hora habitual. Siempre que los comprimidos se hayan tomado correctamente durante los 7 días anteriores al primer comprimido olvidado, no es necesario tomar precauciones anticonceptivas adicionales. Sin embargo, si se ha olvidado más de 1 comprimido, se le debe recomendar a la mujer que utilice métodos adicionales durante 7 días. Día 15-24 El riesgo de reducción de la fiabilidad es inminente por la proximidad de la fase de toma de los comprimidos de placebo. Sin embargo, puede evitarse el riesgo de reducción de la protección anticonceptiva ajustando la toma de comprimidos. Por consiguiente, si la mujer sigue una de las dos opciones siguientes, no será necesario utilizar precauciones anticonceptivas adicionales, siempre que la mujer los haya tomado correctamente durante los 7 días previos al comprimido olvidado. Si éste no es el caso, la mujer debe seguir la primera de las dos opciones y utilizar un método anticonceptivo adicional durante los 7 días siguientes. 1. La mujer deberá tomar el último comprimido que haya olvidado tan pronto como se acuerde, incluso si esto significa tomar 2 comprimidos al mismo tiempo. Después, seguirá tomando los comprimidos a la hora habitual. Los 7 comprimidos de la última fila (comprimidos de placebo) deberán desecharse. Se debe empezar a tomar inmediatamente el siguiente blíster. Es probable que la mujer tenga su sangrado de retirada antes del final del segundo blíster, pero puede presentar spotting (manchado) o sangrado por disrupción mientras esté tomando los comprimidos. 2. La mujer también puede dejar de tomar los comprimidos activos del blíster actual. En este caso, deberá tomar los comprimidos de la última fila del blíster (comprimidos de placebo) durante un máximo de 7 días, incluidos los días en que olvidó tomar los comprimidos, y después continuar con el siguiente blíster. Si la mujer olvida tomar varios comprimidos y después no tiene su sangrado de retirada en la fase de toma de comprimidos de placebo, se debe considerar la posibilidad de un embarazo. Recomendaciones en caso de trastornos gastrointestinales. En caso de problemas gastrointestinales severos (por ejemplo, vómitos y diarrea), la absorción puede que no sea completa y se deben utilizar métodos anticonceptivos adicionales. Si aparecen vómitos 3-4 horas después de tomar el comprimido activo, se debe tomar un nuevo comprimido (de sustitución) tan pronto como sea posible. El nuevo comprimido debe tomarse si es posible en las 12 horas posteriores a la toma habitual del comprimido. Si han pasado más de 12 horas, debe seguir los consejos que se dan en relación con los comprimidos olvidados, tal como aparecen en la sección 4.2 Si la mujer no quiere modificar su programa normal de toma de comprimidos, debe tomar los comprimidos adicionales que necesite de otro blister. Cómo retrasar una hemorragia por privación Para retrasar un periodo, la mujer debe continuar con el siguiente blíster de Daylette sin tomar los comprimidos de placebo del blíster actual. Esta extensión puede mantenerse todo lo que se desee hasta el final de los comprimidos activos del segundo blíster. Durante la extensión la mujer puede presentar sangrado intermenstrual o manchado Después de la fase de comprimidos de placebo se debe restablecer la toma normal de Daylette. Para cambiar su periodo a otro día de la semana distinto del habitual en la pauta actual, se le puede aconsejar a la mujer que acorte el siguiente periodo de comprimidos de placebo el número deseado de días. Cuanto más corto sea el intervalo, mayor será el riesgo de que no presente sangrado por privación, y de que tenga sangrado intermenstrual o manchado mientras tome el segundo blíster (como ocurre cuando se retrasa un periodo). 4.3. Contraindicaciones Los anticonceptivos orales combinados (AOCs) no se deben utilizar en ninguna de las siguientes situaciones. Si alguna de ellas apareciese por primera vez mientras se están tomando AOCs, su utilización se debe suspender inmediatamente. Trombosis venosa actual o en los antecedentes (trombosis venosa profunda, embolismo pulmonar). Trombosis arterial actual o en los antecedentes (p. ej., infarto de miocardio) o situaciones prodrómicas (p. ej., angina de pecho e isquemia cerebral transitoria); Accidente cerebrovascular actual o en los antecedentes. Presencia de uno o múltiples factores de riesgo para la trombosis arterial: diabetes mellitus con síntomas vasculares, hipertensión grave, dislipoproteinemia grave. Predisposición hereditaria o adquirida para la trombosis venosa o arterial, como resistencia a la APC, déficit de antitrombina III, déficit de proteína C, déficit de proteína S, hiperhomocisteinemia y anticuerpos antifosfolípido (anticuerpos anticardiolipina, anticoagulante lúpico). Pancreatitis, o antecedentes de ella, si se asocia con hipertrigliceridemiagrave. Presencia o antecedentes de enfermedad hepática grave mientras los valores de función hepática no hayan vuelto a la normalidad. Insuficiencia renal grave o fallo renal agudo. Presencia o antecedentes de tumores hepáticos (benignos o malignos). Tumores malignos que se sepa o se sospeche que se vean influidos por esteroides sexuales (p. ej., de los órganos genitales o de las mamas). Sangrado vaginal no diagnosticado. Antecedentes de migraña con síntomas neurológicos focales. Hipersensibilidad a los principios activos o a cualquiera de los excipientes de Daylette. 4.4. Advertencias y precauciones especiales de empleo Advertencias Si cualquiera de las situaciones/factores de riesgo que se mencionan debajo está presente, se deben sopesar los beneficios de utilizar AOCs y los posibles riesgos para cada mujer individual y se deben comentar con la mujer antes de que decida empezar a utilizarlos. Se le debe aconsejar a la mujer que se ponga en contacto con su médico en caso de agravamiento, exacerbación o aparición por primera vez de cualquiera de estas situaciones o factores de riesgo. Entonces el médico tendrá que decidir si se debe suspender la utilización de los AOCs. Trastornos circulatorios La utilización de cualquier anticonceptivo oral combinado conlleva un aumento del riesgo de tromboembolismo venoso (TEV) en comparación con la no utilización. El exceso de riesgo de TEV es mayor durante el primer año que una mujer utiliza por primera vez un anticonceptivo oral combinado Estudios epidemiológicos han mostrado que la incidencia de TEV en mujeres con ningún factor de riesgo conocido para el TEV que toman anticonceptivos orales combinados con dosis bajas de estrógenos (<0,05 mg de etinilestradiol) va desde unos 20 casos por 100.000 años-mujer (para los AOCs de “segunda” generación que contienen levonorgestrel) a 40 casos por 100.000 años-mujer (para los AOCs de “tercera” generación que contienen desogestrel/gestrodeno). Esto hay que compararlo con los 5-10 casos por 100.000 años-mujer en las que no los toman y con los 60 casos por 100.000 embarazos. El TEV es mortal en el 1-2% de los casos. Datos de un estudio de cohortes, prospectivo, de gran tamaño y 3 brazos han demostrado que la incidencia de TEV en mujeres con o sin otros factores de riesgo para el TEV que utilizaron etinilestradiol/drospirenona 0,03 mg/3 mg está en el mismo rango que el de las usuarias de anticonceptivos orales que contienen levonorgestrel y de otros AOCs (otras marcas de AOCs). Actualmente se desconoce el riesgo de TEV con Daylette. Estudios epidemiológicos también han asociado la utilización de los AOCs con un aumento del riesgo de tromboembolismo arterial (infarto de miocardio, ataque isquémico transitorio). Es extremadamente infrecuente, pero se ha informado de la aparición de trombosis en otros vasos sanguíneos, p. ej., en las venas y arterias hepáticas, mesentéricas, renales, cerebrales o retinianas. No existe consenso respecto a que la aparición de estos acontecimientos se asocie con la utilización de anticonceptivos hormonales. Entre los síntomas de acontecimientos trombóticos/tromboembólicos venosos o arteriales o de accidente cerebrovascular pueden estar: dolor y/o hinchazón unilateral inusual en las piernas, dolor severo en el pecho de inicio súbito, se irradie o no al brazo izquierdo, falta de aliento súbita, tos de aparición súbita, cualquier cefalea inusual, grave y prolongada, pérdida súbita parcial o total de la visión, diplopía, discurso poco correcto o afasia, vértigo, desvanecimiento con o sin crisis focal, debilidad o pérdida de la sensibilidad muy marcada que afecten súbitamente a un lado o a una parte del cuerpo, alteraciones motoras, abdomen “agudo”, El riesgo de complicaciones de tromboembolismo venoso en usuarias de AOCs aumenta con: la edad, una historia familiar positiva (tromboembolismo venoso alguna vez en un hermano o progenitor a una edad relativamente temprana). Si se sospecha una predisposición hereditaria, se debe remitir a la mujer a un especialista antes de que decida si utilizar cualquier AOC, inmovilización prolongada, cirugía mayor, cualquier operación en las piernas o traumatismo importante. En estos casos es recomendable dejar de tomar anticonceptivos orales (en caso de cirugía programada al menos con cuatro semanas de antelación) y no volver a tomarlos hasta dos semanas después de la completa recuperación de la movilidad. Se debe plantear la utilización de tratamiento antitrombótico si el anticonceptivo no se ha retirado previamente, la obesidad (índice de masa corporal por encima de 30 kg/m²), no existe consenso acerca del posible papel de las varices y de la tromboflebitis superficial en la aparición o progresión de la trombosis venosa. El riesgo de complicaciones tromboembólicas arteriales o de un accidente cerebrovascular en usuarias de AOCs aumenta con: la edad, el hábito de fumar (a las mujeres de más de 35 años se les debe recomendar encarecidamente que no fumen si quieren utilizar un AOC), la dislipoproteinemia, la hipertensión la migraña La obesidad (índice de masa corporal por encima de 30 kg/m²), los antecedentes familiares positivos (tromboembolismo arterial alguna vez en un hermano o en un progenitor a una edad relativamente temprana). Si se sospecha una predisposición hereditaria, se debe remitir a la mujer a un especialista para que le aconseje antes de que decida utilizar cualquier AOC, la enfermedad valvular cardiaca, la fibrilación auricular.La presencia de un factor de riesgo grave o de múltiples factores de riesgo para la enfermedad venosa o arterial, respectivamente, puede constituir también una contraindicación. También hay que tener en cuenta la posibilidad de emplear un tratamiento anticoagulante. A las usuarias de AOCs se les debe emplazar a que se pongan en contacto con su médico si aparecen síntomas de posible trombosis. En caso de que se sospeche o se confirme la trombosis, se debe suspender la utilización de AOCs. Se debe iniciar una alternativa anticonceptiva adecuada debido a la teratogenicidad del tratamiento anticoagulante (cumarinas). Debe tenerse en cuenta el aumento del riesgo de tromboembolismo en el puerperio (para más información acerca del “Embarazo y lactancia” –ver sección 4.6). Otras enfermedades médicas que se han asociado con acontecimientos adversos vasculares son: diabetes mellitus, lupus eritematoso sistémico, síndrome hemolítico-urémico, enfermedad inflamatoria intestinal crónica (enfermedad de Crohn o colitis ulcerosa) y anemia de células falciformes. Un aumento de la frecuencia o de la severidad de las migrañas mientras se utilizan AOCs (que puede ser prodrómico de una enfermedad cerebrovascular) puede ser causa para la inmediata retirada de los AOCs. Tumores En algunos estudios epidemiológicos se ha informado de un aumento del riesgo de cáncer cervical en usuarias de AOCs durante periodos prolongados (> 5 años), pero sigue existiendo controversia acerca de hasta qué punto este hallazgo es atribuible a los efectos de confusión de la conducta sexual y a otros factores como el virus del papiloma humano (VPH). Con la utilización de los AOCs con las dosis más altas (50 µg de etinilestradiol) se reduce el riesgo de cáncer de endometrio y de ovario. Todavía no se ha confirmado si esto también es aplicable a los AOCs con las dosis más bajas. Un metaanálisis de 54 estudios epidemiológicos mostró que existe un riesgo relativo levemente aumentado (RR = 1,24) de que se diagnostique cáncer de mama en mujeres que están tomando actualmente AOCs. El exceso de riesgo desaparece gradualmente durante los 10 años posteriores a la suspensión del uso de AOCs. Como el cáncer de mama es raro en mujeres menores de 40 años, el exceso en el número de diagnósticos de cáncer de mama en mujeres que toman actualmente o que tomaron recientemente anticonceptivos orales es pequeño comparado con el riesgo total de cáncer de mama. Estos estudios no proporcionan evidencia de que exista una relación causal. El patrón observado de un riesgo aumentado puede deberse al diagnóstico más temprano del cáncer de mama en las usuarias de AOCs, a los efectos biológicos de los AOCs o a una combinación de ambos. Los cánceres de mama diagnosticados en mujeres que han tomado alguna vez AOCs tienden a estar menos avanzados clínicamente que los cánceres diagnosticados en mujeres que nunca los han tomado. Raramente, en usuarias de AOCs se ha informado de casos de tumores hepáticos benignos, y más raramente aún, de tumores hepáticos malignos. En casos aislados, estos tumores han dado lugar a hemorragias intraabdominales que pusieron en peligro la vida de la paciente. En mujeres que tomen AOCs se debe plantear la posibilidad de un tumor hepático dentro del diagnóstico diferencial cuando aparezca dolor severo en la parte alta del abdomen, en caso de hepatomegalia, o si aparecen signos de hemorragia intraabdominal. Otras situaciones El componente progestágeno de Daylette es un antagonista de la aldosterona con propiedades ahorradoras de potasio. En la mayoría de casos, no se debe esperar un aumento de potasio. No obstante, en un estudio clínico en algunas pacientes con insuficiencia renal leve o moderada y utilización concomitante de medicamentos ahorradores de potasio, los niveles séricos de potasio aumentaron levemente, pero no de una forma significativa, durante la administración de drospirenona. Por lo tanto, se recomienda analizar el potasio sérico durante el primer ciclo de tratamiento en pacientes que presentan insuficiencia renal y un potasio sérico previo al tratamiento que se encuentre en la parte alta del rango de referencia, y especialmente durante la utilización concomitante de medicamentos ahorradores de potasio.Ver sección 4.5. Las mujeres con hipertrigliceridemia o con antecedentes familiares de padecerla pueden tener un riesgo aumentado de pancreatitis cuando toman AOCs. Aunque se ha informado de incrementos leves en la presión sanguínea de muchas mujeres que toman AOCs, los aumentos clínicamente significativos son raros. Sólo en estos casos raros está justificada una suspensión inmediata del AOC. Si, durante la utilización de un AOC en una hipertensión preexistente, unos valores de presión sanguínea elevados de forma continua, o un aumento significativo en la presión sanguínea no responden adecuadamente al tratamiento antihipertensivo, el AOC debe retirarse. Si se considera que es adecuado, la utilización de AOCs se puede reanudar cuando se alcancen valores normotensivos con el tratamiento antihipertensivo. Se ha informado de que las siguientes patologías pueden aparecer o agravarse tanto durante el embarazo como mientras se toman AOCs, pero la evidencia de que exista una relación con la utilización de AOCs no es concluyente: ictericia y/o prurito en relación con colestasis; formación de cálculos en la vesícula; porfiria; lupus eritematoso sistémico; síndrome hemolítico-urémico; corea de Sydenham; herpes gestacional; perdida de audición debida a otosclerosis. En mujeres con angioedema here- ditario, los estrógenos exógenos pueden inducir o exacerbar síntomas de angioedema Trastornos agudos o crónicos de la función hepática pueden hacer necesario suspender la utilización de los AOCs hasta que los marcadores de función hepática vuelvan a la normalidad. La recurrencia de ictericia colestásica y/o el prurito relacionado con la colestasis, aparecidos previamente durante el embarazo o durante la utilización previa de esteroides sexuales, hace necesario suspender los AOCs. Aunque los AOCs pueden tener un efecto sobre la resistencia periférica a la insulina y sobre la tolerancia a la glucosa, no hay evidencia que demuestre que es necesario alterar el régimen terapéutico en diabéticas que utilizan AOCs de dosis baja (los que contienen <0,05 mg de etinilestradiol). No obstante, a las diabéticas se les debe observar atentamente, en especial al principio de utilizar AOCs. Se ha informado del empeoramiento de la depresión endógena, la epilepsia, la enfermedad de Crohn o la colitis ulcerosa, durante la utilización de AOCs. El cloasma puede aparecer ocasionalmente, especialmente en mujeres con antecedentes de cloasma gravídico. Las mujeres con tendencia al cloasma deben evitar exponerse a la radiación solar o ultravioleta mientras toman AOCs Los comprimidos recubiertos activos contienen 48,53 mg de lactosa monohidrato y los inactivos contienen 37,26 mg de lactosa anhidra por comprimido. Las pacientes con intolerancia hereditaria a la galactosa, insuficiencia de lactasa de Lapp (insuficiencia observada en ciertas poblaciones de Laponia) o malabsorción de glucosa o galactosa no deben tomar este medicamento. Los comprimidos recubiertos de placebo contienen “amarillo atardecer” que puede causar una reacción alérgica. No debe utilizarse en caso de alergia al cacahuete o a la soja. En personas alérgicas a la soja la lecitina de soja tiene un efecto alérgico menor. Exploración/consulta médica Antes de iniciar o de reinstaurar Daylette debe recogerse una historia médica completa (que incluya los antecedentes familiares) y se debe descartar un embarazo. Se debe medir la presión sanguínea y se debe realizar un examen físico, guiado por las contraindicaciones (ver sección 4.3) y las advertencias (ver sección 4.4). También se debe instruir a la mujer para que lea cuidadosamente el prospecto y siga los consejos que da. La frecuencia y las características de los exámenes deben basarse en las directrices prácticas establecidas y adaptarse a la mujer individual. A la mujer se le debe informar de que los anticonceptivos orales no protegen contra las infecciones por VIH (SIDA) y otras enfermedades de transmisión sexual. Disminución de la eficacia La eficacia de los AOCs puede verse reducida en caso de, p. ej., comprimidos olvidados (ver sección 4.2), alteraciones gastrointestinales mientras se toman los comprimidos activos (ver sección 4.2) o medicación concomitante (ver sección 4.5). Disminución del control de los ciclos Con todos los AOCs pueden aparecer sangrados irregulares (manchado –spotting– o sangrado por disrupción), especialmente durante los primeros meses de utilización. Por lo tanto, sólo será importante evaluar cualquier sangrado irregular después de un periodo de adaptación de aproximadamente tres ciclos. Si las irregularidades en los sangrados persisten o aparecen después de ciclos previos regulares, se debe pensar entonces en causas no hormonales, y está indicado tomar las precauciones diagnósticas adecuadas para excluir un tumor maligno o un embarazo. Entre ellas se puede incluir un legrado. En algunas mujeres puede que no se produzca un sangrado de retirada durante el periodo sin comprimidos. Si el AOC se ha tomado según las instrucciones descritas en la sección 4.2, es poco probable que la mujer esté embarazada. Sin embargo, si el AOC no se ha tomado de acuerdo con estas instrucciones antes del primer sangrado de retirada que no se ha producido, o si no se han producido dos sangrados de retirada, se debe excluir el embarazo antes de seguir tomando el AOC. 4.5. Interacción con otros medicamentos y otras formas de interacción Nota: deberá consultarse la información de prescripción de medicaciones concomitantes para identificar interacciones potenciales. Influencia de otros medicamentos sobre Daylette Las interacciones entre los anticonceptivos orales y otros medicamentos pueden dar lugar a sangrado por disrupción y/o fracaso anticonceptivo. En la literatura se ha informado de las siguientes interacciones. Metabolismo hepático Se pueden producir interacciones con fármacos inductores de las enzimas hepáticas que pueden dar lugar a un aumento del aclaramiento de hormonas sexuales (p. ej., fenitoína, barbitúricos, primidona, carbamazepina y rifampicina), bosentán y medicación contra el VIH (p. ej., ritonavir, nevirapina) y también se sospecha que puedan hacerlo oxcarbazepina, topiramato, felbamato, griseofulvina y productos que contienen el remedio herbal hierba de San Juan (Hypericum perforatum). El mecanismo de esta interacción parece que se basa en las propiedades de inducción enzimática de estos principios activos. La inducción enzimática máxima generalmente no se observa a los 10 días pero puede mantenerse durante al menos 4 semanas después de interrumpir el tratamiento farmacológico. Interferencia con la circulación enterohepática También se ha informado de fallos en la anticoncepción con antibióticos, como las penicilinas y las tetraciclinas. El mecanismo de este efecto no ha sido aclarado. Manejo Las mujeres con tratamiento de corta duración (hasta una semana) con cualquiera de las clases de medicamentos antes mencionadas o de los principios activos individuales (medicinas inductoras de las enzimas hepáticas) aparte de rifampicina deberán utilizar temporalmente un método de barrera además del AOC, es decir, durante el tiempo que se administre de forma simultánea el otro medicamento y durante 7 días después de su retirada. Las mujeres tratadas con rifampicina deben utilizar un método de barrera además del AOC durante el tiempo que se administre rifampicina y durante 28 días después de su retirada. Las mujeres tratadas con antibióticos (aparte de rifampicina, ver más arriba) deben utilizar el método de barrera hasta 7 días después de retirado el fármaco. Si la administración concomitante del medicamento persiste más allá del final de los comprimidos activos del blíster actual del AOC, los comprimidos de placebo deben ser desechados y se debe empezar inmediatamente el siguiente blíster del AOC. En las mujeres que reciben tratamiento crónico con principios activos que son inductores de las enzimas hepáticas, se recomienda utilizar otro método anticonceptivo fiable no hormonal. Los principales metabolitos de drospirenona en el plasma humano se generan sin la participación del sistema citocromo P450. Por lo tanto, es improbable que los inhibidores de este sistema enzimático influyan en el metabolismo de drospirenona. Influencia de Daylette sobre otros medicamentos Los anticonceptivos orales pueden afectar al metabolismo de determinados principios activos. Por consiguiente, las concentraciones plasmáticas y tisulares pueden aumentar (p. ej., ciclosporina) o disminuir (p. ej., lamotrigina). Según los estudios de inhibición in vitro y los estudios de interacción in vivo en mujeres voluntarias que tomaban omeprazol, simvastatina y midazolam como sustratos marcados, es improbable que se produzca una interacción de drospirenona a dosis de 3 mg con el metabolismo de otros principios activos. Otras interacciones En pacientes sin insuficiencia renal, la utilización concomitante de drospirenona y de los inhibidores de la ECA o los AINEs no dio lugar a un efecto significativo sobre el potasio sérico. No obstante, no se ha estudiado la utilización concomitante de antagonistas de aldosterona o de diuréticos ahorradores de potasio. En este caso, debe analizarse el potasio sérico durante el primer ciclo de tratamiento. Ver también la sección 4.4. Pruebas de laboratorio La utilización de esteroides anticonceptivos puede influir en los resultados de algunas pruebas de laboratorio, entre las que se encuentran los parámetros bioquímicos de función hepática, tiroidea, suprarrenal y renal, los niveles plasmáticos de proteínas (transportadoras), p. ej., la globulina transportadora de corticoides y las fracciones lipídicas o de lipoproteínas, los parámetros del metabolismo de carbohidratos y los parámetros de la coagulación y la fibrinolisis. Las alteraciones suelen mantenerse dentro del rango de referencia normal para los valores de laboratorio. Drospirenona da lugar a un incremento de la actividad plasmática de renina y en la aldosterona plasmática inducido por su leve actividad antimineralocorticoide. 4.6. Embarazo y lactancia Embarazo Daylette no está indicado durante el embarazo. Si se produce un embarazo durante la utilización de Daylette, el medicamento deberá retirarse inmediatamente. Estudios epidemiológicos muy extensos no han mostrado un riesgo aumentado de defectos congénitos en niños nacidos de mujeres que tomaban AOCs antes del embarazo, ni tampoco ningún efecto teratogénico cuando los AOCs se tomaron sin darse cuenta durante el embarazo. Estudios en animales han encontrado reacciones adversas durante el embarazo y la lactancia (ver sección 5.3). Basándonos en estos datos en animales, no se pueden excluir las reacciones adversas debidas a la acción hormonal de los principios activos. No obstante, la experiencia general con los AOCs durante el embarazo no proporcionó evidencia de que existan reacciones adversas en humanos. Los datos de que disponemos respecto a la utilización combinada de drospirenona y etinilestradiol durante el embarazo son demasiado escasos para permitir extraer conclusiones respecto a los efectos negativos de Daylette sobre el embarazo, la salud del feto o del neonato. Hasta la fecha, no disponemos de datos epidemiológicos de relevancia. Lactancia La lactancia puede verse afectada por los AOCs, ya que éstos pueden reducir la cantidad y modificar la composición de la leche materna. Por tanto, la utilización de AOCs no se deberá recomendar hasta que la madre lactante haya destetado completamente a su hijo. Pequeñas cantidades de esteroides anticonceptivos y/o de sus metabolitos pueden excretarse con la leche durante la utilización de AOCs. Estas cantidades pueden afectar al niño. 4.7. Efectos sobre la capacidad para conducir y utilizar máquinas No se han realizado estudios acerca de los efectos sobre la capacidad para conducir y utilizar máquinas. No se han observado efectos sobre la capacidad para conducir y utilizar máquinas en usuarias de AOCs. 4.8. Reacciones adversas Durante la utilización combinada de drospirenona y etinilestradiol se ha informado de las siguientes reacciones adversas farmacológicas: La siguiente tabla recoge las reacciones adversas según la clasificación de órganos del sistema MedDRA (MedDRA SOCs). Las frecuencias se basan en datos de ensayos clínicos. El término MedDRA más apropiado, sus sinónimos y las situaciones relacionadas se utiliza para describir una determinada reacción.Reacciones adversas farmacológicas que se han asociado con la utilización combinada de drospirenona y etinilestradiol como anticonceptivo orales o en el tratamiento de acné vulgar moderado según el sistema de órganos MedDRA y los términos MedDRA Sistema de órganos (MedDRA versión 12.0) Infecciones e infestaciones Trastornos de la sangre y del sistema linfático Trastornos del sistema inmunológico Trastornos endocrinos Trastornos del metabolismo y de la nutrición Trastornos psiquiátricos Trastornos del sistema nervioso Trastornos oculares Trastornos cardiacos Trastornos vasculares Trastornos gastrointestinales Frecuentes ( >1/100 a <1/10) Infrecuentes (>1/1.000 a <1/100) Labilidad emocional Cefalea Náuseas Trastornos hepatobiliares Trastornos de la piel y del tejido subcutáneo Trastornos musculoesqueléticos y del tejido conectivo Trastornos del sistema reproductor y de las mamas Trastornos generales y del lugar de administración Exploraciones Dolor mamario, Metrorragia*, Amenorrea Raras (>1/10.000 a <1/1.000) Candidiasis Anemia, Trombocitopenia Reacción alérgica Trastorno endocrino Aumento de apetito, Anorexia, Hiperpotasemia, Hiponatremia Depresión, Disminución de la libido, NerviosisAnorgasmia, Insomnio mo, Somnolencia Mareo, Parestesias Vértigo, Temblor Conjuntivitis, Ojo seco, Trastornos de los ojos Taquicardia Migraña,Varices, Hipertensión Flebitis, Trastorno vascular, Epistaxis, Síncope Dolor abdominal,Vómitos, Dispepsia, Flatulencia, Aumento de tamaño del abdomen, Trastorno gastrointestinal, Gastritis, Diarrea Plenitud gastrointestinal, Hernia de hiato, Candidiasis oral, Estreñimiento, Boca seca Dolor biliar, Colecistitis Acné, Prurito, Exantema Cloasma, Eczema, Alopecia, Dermatitis acneiforme, Piel seca, Eritema nodoso, Hipertricosis, Trastorno cutáneo, Estrías cutáneas, Dermatitis de contacto, Dermatitis por fotosensibilidad, Nódulo cutáneo Dolor de espalda, Dolor en una extremidad, Calambres musculares Candidiasis vaginal, Dolor pélvico, Aumento Dispareunia Vulvovaginitis, Sangrado después de mantener del tamaño de las mamas, Mama fibroquística, relaciones sexuales, Sangrado por interrupción, Quiste mamario, Sangrado uterino/vaginal*, Flujo vaginal, Sofocos, Hiperplasia de mama, Neoplasia de mama, Pólipo cervical, AtroVaginitis, Trastorno de la menstruación, Dismefia endometrial, Quiste ovárico, Aumento del tamaño del útero norrea, Hipomenorrea, Menorragia, Sequedad vaginal, Tinción de Papanicolau sospechosa Astenia, Aumento de la sudoración, Edema (ede- Malestar ma generalizado, edema periférico, edema facial) Aumento de peso Disminución de peso *Las irregularidades del sangrado suelen desaparecer al mantener el tratamiento de forma continuada. En mujeres que tomaban AOCs se ha informado de los siguientes efectos adversos graves, que se comentan en la sección 4.4: trastornos tromboembólicos venosos; trastornos tromboembólicos arteriales; hipertensión; tumores hepáticos; aparición o empeoramiento de trastornos para los que la asociación con la utilización de AOCs no es concluyente: enfermedad de Crohn, colitis ulcerosa, epilepsia, migraña, mioma uterino, porfiria, lupus eritematoso sistémico, herpes gestacional, corea de Sydenham, síndrome hemolítico urémico, ictericia colestásica; cloasma; alteraciones agudas o crónicas de la función hepática pueden hacer necesario suspender la utilización de AOCs hasta que los marcadores de la función hepática regresen a la normalidad; en mujeres con angioedema hereditario, los estrógenos exógenos pueden inducir o exacerbar los síntomas de angioedema. La frecuencia del diagnóstico de cáncer de mama se ve incrementada muy levemente entre las usuarias de anticonceptivos orales. Como el cáncer de mama es raro en mujeres menores de 40 años, el exceso de casos es pequeño en relación con el riesgo global de cáncer de mama. Se desconoce si existe relación causal con la utilización de AOCs. Para más información, ver las secciones 4.3 y 4.4. 4.9. Sobredosis No se ha tenido todavía ninguna experiencia de sobredosis con drospirenona y etinilestradiol. Basándonos en la experiencia general con los anticonceptivos orales combinados, los síntomas que posiblemente podrían producirse si se tomara una sobredosis de comprimidos activos son: náuseas, vómitos y, en chicas jóvenes, un sangrado vaginal leve. No existen antídotos y el tratamiento deberá ser sintomático. 6. DATOS FARMACÉUTICOS 6.1 Lista de excipientes Núcleo del comprimido (activo): Lactosa monohidrato Almidón de maíz Almidón de maíz pregelatinizado Copolímero de alcohol polivinílico y macrogol Estearato de magnesio. Recubrimiento pelicular (activo): Alcohol polivinílico Dióxido de titanio (E171) Talco Macrogol 3350 Lecitina (soja) Núcleo del comprimido (placebo): Celulosa microcristalina Lactosa anhidra Almidón de maíz pregelatinizado Estearato de magnesio Sílice coloidal anhidra. Recubrimiento pelicular (placebo): Alcohol polivinílico Dióxido de titanio (E171) Macrogol 3350 Talco Índigo carmín (E132) Amarillo de quinolina (E104) Óxido de hierro negro (E172) Amarillo atardecer FCF (E110). 6.2 Incompatibilidades No procede. Periodo de validez 2 años 6.4 Precauciones especiales de conservación Conservar a menos de 25°C. Conservar en el envase original para protegerlo de la luz. 6.5 Naturaleza y contenido del envase Blísteres de PVC/PE/PVDC-Al. Los blísteres están envasados en una caja de cartón y en cada caja se incluye un prospecto y un bolsa de almacenamiento. Tamaños de envase: 1×28 comprimidos recubiertos con película 3×28 comprimidos recubiertos con película 6×28 comprimidos recubiertos con película 13×28 comprimidos recubiertos con película Puede que no se comercialicen todos los tamaños de envase. 6.6 Precauciones especiales de eliminación y otras manipulaciones La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local. 7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Gedeon Richter Plc. 1103 Budapest, Gyömröi út 19-21 Hungría REPRESENTANTE LOCAL Gedeon Richter ibérica S.A., c/ Sabino Arana, nº 28, 4º-2, 28028 Barcelona, tfno. +34 93 2934300 8. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN Registro Nº 74497 9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN Diciembre de 2011 10. FECHA DE LA REVISIÓN DEL TEXTO Noviembre de 2010 11. Con Receta Médica. PVP(IVA) : Daylette 1 blíster (24+4) comprimidos recubiertos con película: 9,32_[CN 682590]; Daylette 3 blíster (24+4) comprimidos recubiertos con película: 27,97_[CN 682592] Para mayor información consulte la ficha técnica completa SOCIEDADE GALEGA DE CONTRACEPCIÓN SOCIEDADE GALEGA DE CONTRACEPCION BOLETIN DE INSCRIPCIÓN DE LA SO.GA.C Colegio de Médicos de Pontevedra- c/ Echegaray nº 8 - Pontevedra Sr. Presidente Nombre Profesión Especialidad C.P. Dirección Tel. N.I.F. ruega a ud. que en la próxima reunión de la Junta Directiva, me E-mail admitan como socio nº Fecha Fdo. Sr. Director Banco Oficina Dirección , los recibos que la Sociedade Galega de agradeceré carguen en mi cuenta Nº Contracepción envíe a mi nombre. Nombre Cuota anual: 35 euros. N.I.F. Fdo. Si quereis colaborar con nosotros tenéis que dirigiros a nuestra sede (Colegio Médico) o a “[email protected]” 36