Diapositiva 1
Anuncio
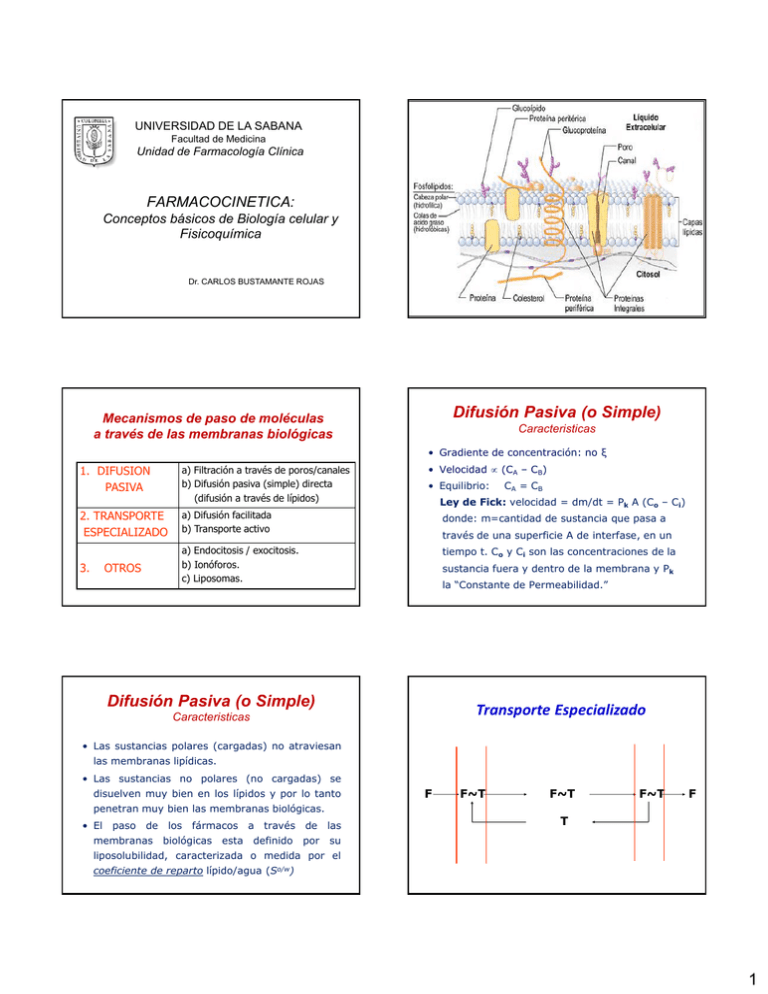
UNIVERSIDAD DE LA SABANA Facultad de Medicina Unidad de Farmacología Clínica FARMACOCINETICA: Conceptos básicos de Biología celular y Fisicoquímica Dr. CARLOS BUSTAMANTE ROJAS Difusión Pasiva (o Simple) Mecanismos de paso de moléculas a través de las membranas biológicas Caracteristicas • Gradiente de concentración: no ξ 1. DIFUSION PASIVA a) Filtración a través de poros/canales b) Difusión pasiva (simple) directa (difusión a través de lípidos) 2. TRANSPORTE ESPECIALIZADO a) Difusión facilitada b) Transporte activo 3. a) Endocitosis / exocitosis. b) Ionóforos. c) Liposomas. OTROS • Velocidad (CA – CB) • Equilibrio: C A = CB Ley de Fick: velocidad = dm/dt = Pk A (Co – Ci) donde: m=cantidad de sustancia que pasa a través de una superficie A de interfase, en un tiempo t. Co y Ci son las concentraciones de la sustancia fuera y dentro de la membrana y Pk la “Constante de Permeabilidad.” Difusión Pasiva (o Simple) Transporte Especializado Caracteristicas • Las sustancias polares (cargadas) no atraviesan las membranas lipídicas. • Las sustancias no polares (no cargadas) se disuelven muy bien en los lípidos y por lo tanto penetran muy bien las membranas biológicas. • El paso de los fármacos a través membranas biológicas esta definido de las por su F F~T F~T F~T F T liposolubilidad, caracterizada o medida por el coeficiente de reparto lípido/agua (So/w) 1 Coeficiente de reparto S o/w S o/w= Saceite < 1 = más hidrosoluble Sagua > 1 = más liposoluble. Sustancia Solubilidad: Cantidad de S A o/w soluto que es capaz de Urea 0.0016 Etanol 0.03 disolverse completamente Morfina 0.4 Barbital 1.4 Fenobarbital 5.9 en un solvente. Coeficiente de reparto S o/w Barbital 0,7 12% Fenobarbital 4,8 20% Butarbital 10,5 23% Ciclobarbital 13,9 24% Pentobarbital 28 30% So/w 1.0 4.0 B 1.0 0.25 4.0 C 0.001 0.00025 4.0 Concepto de ÁCIDOS y BASES • 1887 Savane Arrhenius Ácido es una sustancia que se disocia produciendo H+. Base es una sustancia que se disocia produciendo iones hidróxido, OH- Efecto del coeficiente de partición So/w sobre el % de absorción de los barbituricos Porcentaje absorbido So/w Sw 4.0 Describe la proporción entre las solubilidades pero no detalla como es cada una por separado. Ejemplo % de Abs. So 40% • 1923 Johannes Brönsted y Thomas Lowry Ácido es una sustancia capaz de ceder un protón (a una base). Base es una sustancia capaz de aceptar un protón (de un ácido) 30% 20% 10% 0% 0 10 20 30 Coeficiente de partición So/w • 1923 Gilbert Lewis Ácido es una sustancia que puede aceptar un par de electrones y una base es aquella que puede donarlos. Concepto de pH (potencial de Hidrógeno) Sörensen , 1909 • En disoluciones acuosas , las concentraciones de los iones H+ y OH- están ligadas a través del producto iónico del agua (Kw = [H+][OH-]= 10-14), por lo que basta expresar sólo una de ellas para que la otra quede automáticamente determinada. Normalmente , se suele utilizar la concentración de iones H+ pH = Grado de Disociación (o Ionización) - log [H+] pOH = - log [OH-] pH + pOH= 14 2 Efecto del pH sobre la Absorción (y Distribución) de los fármacos Qué es un ELECTROLITO? Disociable (electrolito) Soluble Fuerte Débil No disociable (no electrolito) Insoluble La mayoría de los fármacos son ELECTROLITOS DÉBILES (ácidos o bases) Ecuación de Henderson-Hasselbach Efecto del pH sobre la Absorción (y Distribución) de los fármacos • Para los AD: • Un ácido débil (como la aspirina) aumentará el número de moléculas sin disociar a medida que se incremente la acidez del medio y por lo tanto atravesara mejor las membranas • Los ácidos débiles se absorben bien en el estómago y duodeno • Las bases débiles incrementan su fracción no ionizada en medios alcalinos y por esa razón se absorben mejor en el intestino delgado (segmentos distales) CONSTANTES DE IONIZACIÓN DE FÁRMACOS ACIDOS DÉBILES Acetaminofén Aspirina Ampicilina Ciprofloxacina Fenitoína Metildopa Teofilina Warfarina pKa 9.5 3.5 2.5 6.1 8.3 2.2 8.8 5.0 BASES DÉBILES Adrenalina Amiodarona Cocaína Imipramina Kanamicina Morfina Propranolol Tebutalina • La mayoría de los fármacos son ácidos o bases débiles y por lo tanto están pobremente ionizados (predomina la forma no disociada) • Solo puede atravesar las membranas biológicas la fracción no ionizada (la liposoluble) • La relación entre las fracciones ionizada y no ionizada del fármaco esta fuertemente influenciada por el pH del medio. • La ecuación de Henderson-Hasselbalch define matemáticamente dicha relación. H+ + A[HA] pH = pKa – log ------[A-] HA ↔ • Para las BD: B + H+ ↔ BH+ [BH+] pH = pKa – log ------[B] pKa = valor de pH al que un electrolito débil se encuentra disociado en un 50%. Trampa iónica pKa 8.7 6.6 8.5 9.5 7.2 7.9 9.4 10.1 • Hace referencia a la utilización del efecto del pH sobre la absorción y distribución de los fármacos. • En la intoxicación con barbitúricos (ácidos débiles) la acidez de la orina favorece la forma no ionizada y por lo tanto la reabsorción tubular; una medida terapéutica es alcalinizar la orina con bicarbonato para favorecer su eliminación. • En la intoxicación con benzodiacepinas (bases débiles) una medida terapéutica es la acidificación de la orina con acido ascórbico para favorecer su eliminación. 3