(g).
Anuncio

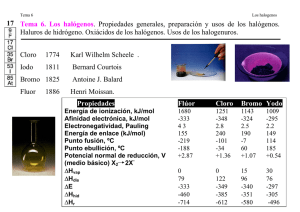
17 Tema 3. Los halógenos. Propiedades generales, preparación y usos de los halógenos. Haluros de hidrógeno. Oxácidos de los halógenos. Usos de los halogenuros. Cloro 1774 Iodo 1811 Bromo 1825 Karl Wilhelm Scheele . Bernard Courtois Antoine J. Balard Fluor Henri Moissan 1886 Propiedades Flúor 1680 -333 43 155 -219 -188 Energía de ionización, kJ/mol Afinidad electrónica, kJ/mol Electronegatividad, Pauling Energía de enlace (kJ/mol) Punto fusión, ºC Punto ebullición, ºC Potencial normal de reducción, V (medio básico) X2 2X+2.87 ∆Hvap 0 ∆Hdis 79 ∆E -333 ∆Hhid -460 ∆Hr -714 Cloro 1251 -348 2.8 240 -101 -34 Bromo 1143 -324 2.5 190 -7 60 Yodo 1009 -295 2.2 149 114 185 +1.36 0 122 -349 -385 -612 +1.07 15 96 -340 -351 -580 +0.54 30 76 -297 -305 -496 Halogenos Generadores de sales •En el estado elemental forman moléculas diatómicas, X2. •En la naturaleza, sin embargo, debido a su alta reactividad, los halógenos se encuentran siempre combinados con otros elementos. Forman un gran número de compuestos. •El cloro, el bromo y el yodo se encuentran como halogenuros en el agua de mar. •El flúor se encuentra en minerales como fluorita (CaF2) y criolita (Na3AlF6). •El Yodo también se encuentra como iodato en el nitrato de chile Preparación y propiedades generales de los halógenos Como el flúor y el cloro son agentes oxidantes fuertes, deben prepararse por oxidación (electroquímica)de los iones fluoruro y cloruro. La electrólisis de disoluciones acuosas de fluoruros es inadecuada porque el flúor es un agente oxidante más enérgico que el oxígeno. El flúor se prepara electrolizando fluoruro de hidrógeno líquido que contiene fluoruro de potasio para aumentar su conductividad, a 70°C aproximadamente Ánodo 2F- F2(g) + 2e- Cátodo 2H+ + 2eReacción global 2HF(l) H2(g) H2(g) +F2(g) Preparación de Cl2(g). •Electrólisis de NaCl fundido •Electrólisis de una disolución acuosa de NaCl concentrada (llamada salmuera). Método cloro-alcali. 2NaCl(ac) + 2H2O(l) 2NaOH(ac) + H2(g) + Cl2(g) Hay que separar los productos: 2NaOH(ac) + Cl2(g) NaOCl(ac) + NaCl(ac) + H2O(l) H2(g) + Cl2(g) 2HCl(g) Bromo molecular y yodo se preparan a partir del agua de mar por oxidación con cloro. Cl2 + 2XX= Br ó I X2 + 2Cl- En el laboratorio, el cloro, el bromo y el yodo se pueden preparar por reacción de cloruros alcalinos (NaCl, KBr o KI) con óxido de manganeso(IV) en medio ácido: MnO2(s) + 2H2SO4(ac) +2NaCl(ac) MnSO4(ac) + Na2SO4(ac)+ 2H2O(l)+Cl2(g) Reactividad •Los números de oxidación de los halógenos pueden variar desde -1 hasta + 7. La única excepción es el flúor. Como es el elemento más electronegativo, solo puede tener dos números de oxidación, (0) (como en F2) y -1 en sus compuestos. •Los halogenuros ya han sido comentados Singularidad del Flúor Debilidad del enlace F–F: el flúor fue el último de los halógenos en ser obtenido debido fundamentalmente a su gran reactividad. •El Flúor es el más reactivo de entre los reactivos halógenos. Uno de los factores que explican esa elevada reactividad es la debilidad del enlace F–F. Energía de enlace (kJ/mol) Flúor 158 Cloro 243 Bromo 193 Yodo 151 • Las moléculas X2 sitúa de 6 pares de electrones solitarios a muy corta distancia lo que origina repulsiones interelectrónicas que se suavizan al aumentar la distancia internuclear y hacerse más difusos los orbitales que los alojan. • En el caso de sustancias iónicas, el pequeño tamaño del fluoruro da lugar a redes iónicas muy estables. Por ello las reacciones con los metales son muy favorables. Energía reticular (kJ/mol) NaF 915 NaCl 781 NaBr 743 NaI 699 En el caso de compuestos covalentes En. enlace (kJ/mol) F Cl Br I XX 158 243 193 151 HX 574 428 363 294 BX3 645 444 368 272 AlX3 582 427 360 285 CX4 456 327 272 239 NX3 272 201 243 -- La reactividad del flúor se debe a la debilidad del enlace F-F y a la fortaleza del enlaces F-X. Otros factores Falta de electrones d accesibles energéticamente: Elevada electronegatividad: lo que permite por una parte que el F forme los enlaces por puentes de hidrógeno. Halogenuros de hidrógeno •Se pueden formar por la combinación directa de los elementos: H2(g) + X2(g) 2HX(g) •El cloruro de hidrógeno se prepara en forma industrial como subproducto en la manufactura de hidrocarburos clorados: C2H6(g) + Cl2(g) C2H5Cl(g) + HCl(g) •En el laboratorio, se pueden preparar por reacción de los halogenuros metálicos con ácido sulfúrico concentrado: H2SO4(ac) CaF2(s) + H2SO4(ac) 2HF(g) + CaSO4(s) 2NaCl(s) + H2SO4(ac) 2HCl(g) + Na2SO4(ac) NaCl •El bromuro de hidrógeno y el yoduro de hidrógeno se oxidan a bromo y yodo elemental. Por ejemplo, la reacción entre NaBr y H2SO4 es: 2NaBr(s) + 2H2SO4(ac) Br2(l) + SO2(g) + Na2SO4(ac) + 2H2O(l) •Yoduro y bromuro de hidrógeno se preparan por hidrólisis de halogenuros covalentes: P4(s) + 6Br2(l) PBr3(l) + 3H2O(l) 4PBr3(l) 3HBr(g) + H3PO3(ac) HCl(g) •La alta reactividad del HF se demuestra por el hecho de que ataca la sílice y los silicatos: 6HF(ac) + SiO2(s) H2[SiF6](ac) + 2H2O(l) •Esta propiedad confiere al HF utilidad para marcar el vidrio y por esta razón el HF debe guardarse en recipientes de plástico o de metales inertes (por ejemplo, Pt). •El fluoruro de hidrógeno se usa en la manufactura de los freones, por ejemplo: CCl4(l) + HF(g) CFCl3(g) + HCl(g) CFCl3(g) + HF(g) CF2Cl2(g) + HCl(g) •El cloruro de hidrógeno se usa en la preparación de ácido clorhídrico, cloruros inorgánicos y en varios procesos metalúrgicos. •Las disoluciones acuosas de los halogenuros de hidrógeno son ácidas. La fuerza de los hidroácidos aumenta como sigue: HF < HCl < HBr < Hl Oxoácidos de los halógenos Los halógenos forman una serie de oxoácidos con las siguientes fórmulas generales: •El ácido cloroso, HClO2, es el único ácido haloso conocido. Todos los halógenos excepto el flúor, forman ácidos hálico y perhálico. •Las estructuras de Lewis de los oxoácidos son: :O: H:O:X H:O:X:O: H:O:X:O: :O: H:O:X:O: :Ö: HOX ácido hipohaloso, HXO2 ácido haloso, HXO3 ácido hálico y HXO4 ácido perhálico •Para un halógeno dado, la fuerza del ácido disminuye del ácido perhálico al ácido hipohaloso •Los ácidos del yodo en mayor estado de oxidación tienen estequiometria distinta debido al mayor volumen del yodo. Compuestos interhalógenos •Los compuestos interhalógeno son derivados formados entre dos diferentes elementos halógeno XY, XY3 XY5 y XY7 •X y Y son dos halógenos diferentes y X es el átomo más grande de los dos. •Muchos de estos compuestos se pueden preparar por combinación directa: Cl2(g) + F2(g) Cl2(g) + 3F2(g) Br2(l) + 3F2(g) 2CIF(l) 2ClF3(g) 2BrF3(g) •Otros requieren rutas indirectas KCl(s) + 3F2(g) KF(s) + CIF5(g) KI(s) + 4F2(g) KF(s) + IF7(g) •Los compuestos interhalógeno son inestables y reaccionan violentamente con el agua. •Todas las moléculas interhalógeno violan la regla del octeto Usos de los halógenos Flúor. •Los halógenos y sus compuestos encuentran muchas aplicaciones en la industria, en el cuidado de la salud y en otras áreas. (Adición de NaF al agua potable para reducir las caries dentales. •El hexafluoruro de uranio, UF6 que es esencial en el proceso de difusión gaseosa para la separación de los isótopos de uranio (U-235 y U-218). •El flúor se usa para producir politetrafluoroetileno, un polímero mejor conocido como Teflón: [CF2-CF2]n •El teflón se usa en aislantes eléctricos, plásticos de alta temperatura, utensilios de cocina, etc. Cloro. •El cloro se usa ampliamente en la industria como agente blanqueador de papeles y textiles. El blanqueador ordinario(lejía) que se emplea en el lavado doméstico contiene el ingrediente activo hipoclorito de sodio (un 5% en masa) Cl2(g) + 2NaOH(ac) NaCl(ac) + NaOCl(ac) + H2O(l) •El cloro también se usa para purificar agua y desinfectar piscinas. Cuando el cloro se disuelve en agua, se lleva a cabo la siguiente reacción: Cl2(g). + H2O(l) HCl(ac) + HOCl(ac) •Los derivados orgánicos clorados, tetracloruro de carbono y el cloroformo, son útiles como disolventes orgánicos. •El cloro también se usa para producir polímeros como el cloruro de polivinilo PVC. Bromo. •Se usa para preparar dibromuro de etileno (BrCH2CH2Br), necesario para evitar el depósito del plomo en los motores de gasolina. •Bromuro de plata (AgBr), que se usa en las películas fotográficas. Yodo. •Una disolución alcohólica al 50% de yodo (en masa). se conoce como tintura de yodo y se usa en medicina como antiséptico. •La sal de mesa yodada que se vende por lo general contiene 0.01% de KI o NaI, que es más que suficiente para satisfacer el requerimiento de 1mg de yodo p or semana para la formación de tiroxina en el cuerpo humano. •Un compuesto de yodo que merece mención es el yoduro de plata, AgI. Un sólido amarillo pálido que se oscurece cuando se expone a la luz. Este comportamiento es similar al del bromuro de plata. •El yoduro de plata se puede usar en la siembra de nubes. La ventaja de usar el yoduro de plata es que se puede formar un enorme número de núcleos (esto es, pequeñas partículas sobre las que se pueden formar cristales de hielo). •Unos 1010 núcleos se producen a partir de 1g de AgI por la vaporización de una disolución de yoduro de plata en acetona en un lecho caliente. Entonces los núcleos se dispersan en las nubes desde un aeroplano