Relación de problemas 6
Anuncio

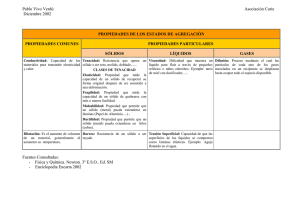
ENLACE QUIMICO Y ESTRUCTURA DE LA MATERIA PRIMERO DE INGENIERIA QUIMICA Relación de problemas VI / VII 1.- Emparejar cada expresión de la izquierda con su definición de la derecha: a) Orbital σ A) Orbital híbrido b) Par de electrones solitario B) Orbital molecular enlazante c) Orbital sp2 C) Orbital atómico * d) Orbital σ D) Orbital molecular no enlazante e) Orbital 2s E) Orbital molecular antienlazante Sol.: a-B, b-D, c-A, d-E, e-C. 2.- Calcular la densidad de probabilidad electrónica en el punto medio de los hidrógenos en el para los estados descritos por a) , b) para la distancia internuclear R= 106 pm = 2a0. Compare el resultado de a) con el resultado de considerar los átomos por separado. 0,1353 2 Sol.: a) φ + 2 = 0,16976 = 0,363 ⋅ 10 + 30 m −3 ; b) φ + 2 = 0 ; 1s A = = 0 ,291 ⋅ 10 + 30 m − 3 πa 03 πa 03 3.- A partir de las configuraciones de los estados fundamentales de las siete moléculas homonucleares diatómicas Li2 a F2, indique cuáles de dichas configuraciones se adaptan a las siguientes características: a) Presenta un enlace triple b) Presenta un doble enlace c) Presenta un solo enlace y es de tipo σ d) Presenta un solo enlace y es de tipo π e) No existe la molécula diatómica f) Presenta electrones desapareados Sol.: a) N2 ; b) C2 y O2 ; c) Li2 y F2 ; d) B2 ; e) Be2 ; f) B2 y O2. 4.- Explique y escriba la configuración molecular de las diferentes parejas de moléculas. Indique para cada pareja cuál es de esperar que tenga mayor energía de enlace. b) Be2 y Be2+ c) N2 y N2+ a) F2 y F2+ d) NO y NOe) BN y BO f) NF y NO + + Sol.: Mayor energía de enlace: a) F2 ; b) Be2 ; c) N2 ; d) NO ; e) BO ; f) No se puede decidir. 5.- ¿Cuántos electrones desapareados existen en las moléculas siguientes : a) O2-, b) O2+, c) BN y d) NO- ? Sol.: a) 1, b) 1, c) 0, d) 2. 6.- La primera energía de ionización de la molécula de O2 es más pequeña que la del átomo de O, ¿por qué? 7.- Sabiendo que de las moléculas BCl3 , NH3 y BeH2 solamente es polar el NH3. Indicar: a) el número de pares electrónicos sin compartir de cada átomo; b) la hibridación (si la hay) del átomo central; c) la forma geométrica de cada molécula. Sol.: a) BCl3: 0, NH3: 1, BeH2: 0 ; b) BCl3: sp2, NH3: sp3, BeH2: sp ; c) BCl3: plana triangular, NH3: Piramidal, BeH2: lineal. 8.- Describa los enlaces y la formación de las siguientes moléculas, a partir de la información que se le adjunta : a) CO2 , sabiendo que es una molécula lineal y con momento dipolar nulo. b) F-N=N-F, sabiendo que es plana, que presenta isómeros cis-trans y que el ángulo del enlace N-F es 120º. c) CH3CN, sabiendo que los enlaces C-C-N se encuentran en la misma línea, mientras que los enlaces H-C-C no ; y los enlaces C-H son idénticos. d) O3 , sabiendo que es una molécula plana y no cíclica ; y los enlaces O-O-O son equivalentes con carácter parcial de doble enlace y forman un ángulo de 117º. Sol. parcial: a) C hibridación sp; b) los 2 N hibridación sp2; c) C (de CH3) hibridación sp3,C (de CN) hibridación sp ; d) O central hibridación sp2 y OM π deslocalizados. 9.- Señalar de entre los siguientes sistemas los que cabe esperar que conduzcan la corriente eléctrica, razonando la respuesta : He(g), H2(g), Mg(l), Cu (s), NaCl(s), Li2(g), KCl(l), SO2(g), CH3CH2OH(l),CsF(g), diamante(s). Indique, también, al tipo de sólido al que pertenecerá cada una de las sustancias indicadas más arriba. Sol.: Conducen: Mg(l), Cu (s), KCl(l); no conducen: He(g), H2(g), NaCl(s), Li2(g), SO2(g), CH3CH2OH(l),CsF(g), diamante(s). Sólido iónico: KCl, NaCl, CsF ; sólido molecular: He, H2, SO2, CH3CH2OH; sólido atómico: diamante ; sólido metálico: Mg, Cu, Li. 10.- ¿Qué tipo de enlace entre átomos se dará en las siguientes sustancias: KF, Al, N2, (NH4)2SO4, CCl4, C (diamante), C4H9OH. Sol.: KF,iónico ; Al,metálico ; N2,covalente ; (NH4)2SO4, covalente e iónico ; CCl4, covalente ; C, covalente ; C4H9OH, covalente. 11.- Para cada uno de los siguientes pares de moléculas, establecer cuál de ellas tiene mayor polarizabilidad: a) He o Ne ; b) H2 o He ; c) F2 o Cl2 ; d) H2S o Ar. Sol.: a) Ne ; b) H2 ; c) Cl2 ; d) H2S. 12.- La temperatura de ebullición de los siguientes alcoholes es : C2H5OH (etanol)=78ºC CH3OH (metanol)= 65ºC C3H7OH (propanol)=98ºC C4H9OH (butanol)=117ºC Explicar la razón fundamental del aumento gradual del punto de ebullición observado. Sol.: Aumento de la masa molecular... 13.- Indique en cuáles de los siguientes compuestos deben existir enlaces de hidrógeno : FH, H2O2 , NH3 , PH3, SiH4, SH2, CH3-NH2, CH3-O-CH3, CH3-CHOH-CH3, CH3-CO-CH3 y CH3-COOH. Sol.: FH, H2O2 , NH3 , CH3-NH2, CH3-CHOH-CH3, CH3-COOH. 14.- Para cada uno de los pares de sustancias indique y razone cuál presentará mayor punto de fusión. a) Kr o Xe b)H2O o H2S c) C2H5OH o (CH3)2O d) Cu o K Sol.: a) Xe ; b) H2O ; c) C2H5OH ; d) Cu. 15.- A partir de los datos de la tabla, razonar la veracidad o falsedad de las siguientes afirmaciones: a) Las fuerzas de van der Waals entre las moléculas de N2 son muy débiles. b) El punto de ebullición del nitrógeno es menor que el del tetracloruro de carbono, porque su energía de enlace es mucho mayor. c) Las fuerzas de van der Waals se hacen mayores al aumentar la masa molecular. d) No hay relación alguna entre las fuerzas intermoleculares y las energías de enlace de las moléculas correspondientes. Molécula Punto de ebullición (ºC) -196 N2 77 CCl4 Sol.: a) V, b) F, c) V, d) V. Energía de enlace (kJ/mol) 940 N-N 335 C-Cl 16.- Ordenar de menor a mayor punto de fusión las siguientes sustancias: ClF, NaCl, Cl2, CaCl2, ClBr, SiO2 (cuarzo). Razone su respuesta. Sol.: Cl2 < ClBr < ClF < NaCl < CaCl2 < SiO2. 17.- Entre las siguientes sustancias: SiO2 (cuarzo), Na, ClK, CH4 y H2O, escoger la que corresponda a lo enunciado: a) Un sólido de alta conductividad eléctrica que funde alrededor de los 100ºC. b) Un sólido covalente de punto de fusión muy elevado. c) Un sólido molecular con muy bajo punto de fusión y que en condiciones ambientales está en estado gaseoso. d) Un sólido que no conduce la electricidad, pero que al fundirse se convierte en conductor de electricidad. e) Un sólido molecular con enlaces de hidrógeno y que no conduce la electricidad. Sol.: a) Na ; b) SiO2 ; c) CH4 ; d) ClK ; e) H2O. 18.- Clasificar las siguientes sustancias según el tipo de sólido al que pertenecen: Cl2, CaO, Cr, CsI, Ne, CSi (carburo de silicio), C6H6, Au. Además, indicar: a) El de menor punto de fusión; b) El de mayor punto de fusión; c) El de mayor dureza; d) Los que sean conductores de la electricidad en estado sólido; e) Los que sean conductores de la electricidad en estado fundido. Sol.: Sólidos iónicos: CsI, CaO ; sólidos atómicos: CSi ; sólidos moleculares: Cl2, Ne, C6H6 ; sólidos metálicos: Cr, Au. a) Ne ; b) Csi ; c) Csi ; d) Cr, Au ; e) Cr, Au, CsI, CaO.