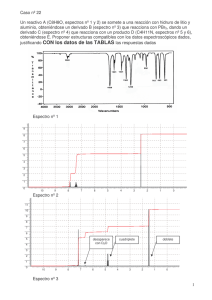
DACTILOCICLINA A Y DACTILOCICLINA B(ES2053697)
Anuncio

k OFICINA ESPAÑOLA DE PATENTES Y MARCAS 19 k ES 2 053 697 kInt. Cl. : C12P 1/06 11 N.◦ de publicación: 5 51 ESPAÑA A61K 35/66 //(C12P 29/00 C12P 1:06 C12R 1:01) k TRADUCCION DE PATENTE EUROPEA 12 kNúmero de solicitud europea: 88121311.0 kFecha de presentación : 20.12.88 kNúmero de publicación de la solicitud: 0 322 717 kFecha de publicación de la solicitud: 05.07.89 T3 86 86 87 87 k 54 Tı́tulo: Dactilociclina A y dactilociclina B. k 73 Titular/es: E.R. Squibb & Sons, Inc. k 72 Inventor/es: Aklonis, Carol Ann; k 74 Agente: Elzaburu Márquez, Fernando 30 Prioridad: 24.12.87 US 137635 Lawrenceville-Princeton Road Princeton New Jersey 08543-400, US 45 Fecha de la publicación de la mención BOPI: 01.08.94 45 Fecha de la publicación del folleto de patente: 01.08.94 Aviso: k k Ax, Helen Anne; O’Sullivan, Joseph; Tymiak, Adrienne Anne; Wells, Jerry Scott y Kirsch, Donald R. k En el plazo de nueve meses a contar desde la fecha de publicación en el Boletı́n europeo de patentes, de la mención de concesión de la patente europea, cualquier persona podrá oponerse ante la Oficina Europea de Patentes a la patente concedida. La oposición deberá formularse por escrito y estar motivada; sólo se considerará como formulada una vez que se haya realizado el pago de la tasa de oposición (art◦ 99.1 del Convenio sobre concesión de Patentes Europeas). Venta de fascı́culos: Oficina Española de Patentes y Marcas. C/Panamá, 1 – 28036 Madrid 1 2 053 697 cubando a 70◦ C durante 20 minutos. Seguidamente la suspensión se coloca en una placa en un medio nutriente que ha sido completado con cicloheximida. La composición del medio es: DESCRIPCION El cultivo de una cepa del microorganismo Dactylosporangium sp., que ha sido depositado en “The American Type Culture Collection” como A.T.C.C. n◦ 53693, produce la sustancia antibiótica EM5586. EM5586 ha sido analizada y se ha encontrado que está compuesta por cuatro componentes. Uno de los componentes es 7 - cloro - 4 - dimetilamino - 8 - metoxi 1,4,4a,5,5a,6,11,12a - octahidro - 3,4a,6,10,12,12a - hexahidroxi - 6 - metil - 1,11 - dioxo - 2 - naftacenocarboxamida (denominado en lo sucesivo “4a - hidroxi - 8 - metoxi - CTC”), un compuesto descrito en la solicitud PCT publicada WO87/00832, publicada el 12 de febrero de 1987. Dos componentes adicionales, Dactilociclina A y Dactilociclina B, son activos contra bacterias gram positivas, incluyendo bacterias resistentes a la tetraciclina. La figura 1 muestra el espectro de infrarrojos de Dactilociclina A en bromuro de potasio. La figura 2 muestra el espectro de masas por bombardeo con átomos rápidos de Dactilociclina A en el modo de ion positivo. La figura 3 muestra el espectro de masas por bombardeo con átomos rápidos de Dactilociclina A en el modo de ion negativo. La figura 4 muestra el espectro RMN de C13 a 67,5 MHz de Dactilociclina A en metanol deuterado. La figura 5 muestra el espectro RMN de H1 a 400 MHz de Dactilociclina A en metanol deuterado. La figura 6 muestra el espectro de infrarrojos de Dactilociclina B en bromuro de potasio. La figura 7 muestra el espectro de masas por bombardeo con átomos rápidos de Dactilociclina B en el modo de ion positivo. La figura 8 muestra el espectro de masas por bombardeo con átomos rápidos de Dactilociclina B en el modo de ion negativo. La figura 9 muestra el espectro RMN de H1 a 400 MHz de Dactilociclina B en metanol deuterado. El microorganismo El microorganismo utilizado para producir la sustancia antibiótica EM5586 es una cepa de Dactylosporangium aislada a partir de restos de hojas encontrados en aguas pantanosas. Un subcultivo del microorganismo puede ser obtenido a partir de la colección permanente de la “American Type Culture Collection”, Rockville, Maryland. Su número de acceso en esta autoridad de depósito es A.T.C.C. n◦ 53693. Además del microorganismo especı́fico descrito y caracterizado en la presente memoria descriptiva, debe entenderse que mutantes del microorganismo (por ejemplo, mutantes producidos a través de la utilización de Rayos X, radiación ultravioleta, manipulación genética o iperita nitrogenada) pueden ser cultivados también para producir EM5586. El aislamiento de Dactylosporangium sp. A.T.C.C. n◦ 53693 de los restos de hojas en los que está presente puede efectuarse poniendo en suspensión en primer lugar los restos de hojas en un diluyente estéril (por ejemplo, solución salina tamponada que contiene 0,01% de gelatina) e in2 2 5 K2 HPO4 KH2 PO4 MgSO4 .7H2 O FeSO4 .7H2 O ZnSO4 .7H2 O MnCl2 .4H2 O Agar Quitina coloidal∗ 10 15 Agua destilada Cicloheximida∗∗ Gramos 0,7 0,3 0,21 0,01 0,02 0,0015 20 40 ml de una solución al 1,25% 960 ml 0,1 20 ∗ 25 30 35 40 45 50 55 60 65 Preparada según se describe por Mekkar, N.S. y T. Cross, J. Appl. Bacteriol., 52:209-218, 1982. ∗∗ Esterilizada con filtración y añadida al medio que ya ha sido esterilizado a 121◦ C durante 30 minutos. Después de 8 dı́as de incubación a 28◦ C, las colonias de Dactylosporangium sp. A.T.C.C. n◦ 53693 son aisladas de la muestra de la placa y se transfieren a un medio en agar compuesto por: Glucosa Almidón soluble Extracto vacuno Triptona Extracto de levadura CaCO3 Agua potable Gramos 1 24 3 5 5 4 1 litro El medio es esterilizado por tratamiento con autoclave a 121◦C durante 20 minutos. El Dactylosporangium sp. A.T.C.C. n◦ 53693 se caracteriza por la producción de esporangios cortos en forma de dedo que se originan directamente a partir del micelio vegetativo en la superficie del agar. Los esporangios se producen abundantemente en agar de malato de calcio (Waksman, S.A., en “The Actinomycetes: a Summary of Current Knowledge.” Ronald Press, New York 1967) y agar de extracto de suelo (Waksman, S.A., en “The Actinomycetes.” Vol. II. Clasificación, identificación y descripción de géneros y especies. Williams & Wilkins Co., Baltimore, 1961). Cada esporangio contiene una hilera recta de 3 a 4 esporas que son móviles. El cultivo produce también cuerpos globulares surgidos lateralmente en el micelio vegetativo. Un examen microscópico de estos cuerpos globulares revela una masa amorfa en cuyo interior no se produce un desarrollo en forma de esporas. Las auténticas esporas son predominantes en agar de malato de calcio y agar de extracto de suelo; pocos cuerpos globulares se observan es estos medios. Un hidrolizado ácido de células completas contiene ácido meso-diaminopimélico y glicina, que 3 2 053 697 se originan en la pared celular. Xilosa y arabinosa son los restos de azúcares predominantes de la pared celular. Esta composición es indicativa de una pared celular de Tipo II, según se describe por Lechevalier y Lechevalier (Intern. J. Syst. Bacteriol., 20:435-443, 1970). Las caracterı́sticas morfológicas, es decir, la producción de esporangios en forma de dedo y cuerpos globulares asociados a una pared celular de Tipo II sitúan este organismo en el género Dactylosporangium, un miembro de la familia Actinoplanaceae de acuerdo con la descripción del género dada por Thiemann et al. (Thiemann, J., H. Pagani y G. Baretta, Archiv. fur Mikrobiol., 58:42, 1967). Producción del antibiótico El antibiótico EM5586 puede ser producido cultivando Dactylosporangium sp. A.T.C.C. n◦ 53693 a 28◦C o aproximadamente a esta temperatura, bajo condiciones de inmersión aeróbica en un medio nutriente acuoso que contiene una fuente asimilable de carbono y una fuente asimilable de nitrógeno. La fermentación se lleva a cabo hasta que ha tenido lugar la producción sustancial de la sustancia antibiótica deseada, habitualmente aproximadamente de 120 a 144 horas. Esto puede determinarse mediante un ensayo diseñado para medir la inhibición de la sı́ntesis de proteı́nas, es decir, la inhibición de la sı́ntesis de novo de β-lactamasa por inducción mediante penicilina G. Los procedimientos de aislamiento posteriores pueden controlarse también mediante esta técnica. La Dactilociclina A y Dactilociclina B pueden ser aisladas mediante técnicas reconocidas en el estado de la técnica a partir tanto del caldo sobrenadante como de la masa celular después de su separación por centrifugación. Para recuperar los antibióticos del caldo sobrenadante, el pH es ajustado a aproximadamente 5 y seguidamente se extrae la materia activa con acetato de etilo. El extracto orgánico se concentra in vacuo para dar un residuo aceitoso que seguidamente es purificado en resinas de intercambio catiónico y aniónico y a continuación mediante cromatografı́a por centrifugación en contracorriente para producir los componentes EM5586 puros de Dactilociclina A y Dactilociclina B. La primera etapa de adsorción con resina es con la resina de intercambio catiónico R R AGMP-50 (Bio-Rad AGMP-50: reBio-Rad sina copolı́mera de estireno-divinilbenceno macrorreticular con grupos -CH2 N+ (CH3 )3 enlazados, Laboratorios Bio-Rad, Richmond, CA.) en la forma H+ , de la que son eluidos los componentes activos con piridina-acetonitrilo-agua. El producto eluido activo se adsorbe seguidamente en la resina de intercambio aniónico Bio-Rad AGMPR AGMP-1: resina de copolı́mero 1 (Bio-Rad estireno-divinilbenceno macrorreticular con grupos -SO3 enlazados, Laboratorios Bio-Rad, Richmond, CA.) en la forma Cl− , y la elución se efectúa con ácido acético-acetonitrilo-agua. R LHUna cromatografı́a posterior en Sephadex R 20 (Sephadex LH-20: perlas de gel de dextrano reticulado alquilado, Pharmacia Fine Chemical AB, Uppsala, Suecia) con acetonitrilo-agua-ácido 5 10 15 20 25 30 35 4 trifluoroacético, separa los componentes EM5586 de Dactilociclina A, Dactilociclina B y Dactilociclina C del compuesto conocido, 4a-hidroxi8 -metoxi-CTC. Una cromatografı́a por centrifugación en contracorriente con la fase inferior de cloroformo-metanol-agua sirve para separar los compuestos nuevos, Dactilociclina A, Dactilociclina B y Dactilociclina C. Dactilociclina A, Dactilociclina B y Dactilociclina C pueden obtenerse también a partir de la masa celular mediante extracción con metanol. El extracto metanólico es concentrado in vacuo. La solución acuosa resultante se ajusta a pH 5 y la materia activa se recupera mediante extracción con acetato de etilo. Seguidamente se efectúa otra purificación según se describió anteriormente mediante cromatografı́a en resinas de intercambio catiónico y aniónico, cromatografı́a LH20 y cromatografı́a por centrifugación en contracorriente. Dactilociclina A y Dactilociclina B son activas contra bacterias gram-positivas, incluyendo bacterias resistentes a la tetraciclina. Cada una de ellas puede ser utilizada para tratar infecciones bacterianas gram-positivas en especies de mamı́feros, tal como seres humanos. El siguiente ejemplo ilustra la invención más en detalle. Ejemplo Preparación de Dactilociclina A y Dactilociclina B Cultivos inclinados en agar compuestos por 2% de harina de avena y 2% de pasta de tomate en agua potable fueron sembrados con Dactylosporangium sp. A.T.C.C. n◦ 53693 y se incubaron durante 14 dı́as a 28◦C. El producto crecido resultante fue utilizado para inocular porciones de 100 ml de un medio acuoso contenido en matraces Erlenmeyer de 500 ml. La composición del medio de germinación fue: 40 45 Glucosa Almidón soluble Extracto vacuno Triptona Extracto de levadura CaCO3 Agua potable frı́a hasta 1000 ml Gramos 1 24 3 5 5 4 50 55 60 65 El medio, ajustado a pH 7,0, fue esterilizado a 121◦C durante 30 minutos antes de su utilización. Los matraces germinadores inoculados fueron incubados a 28◦ C en un agitador rotatorio durante 96 horas. El agitador funcionó a una velocidad de 300 rpm con un recorrido de 5,04 cm. Se hizo una transferencia de un 1% de los matraces de germinación a porciones de 100 ml de reciente aportación del mismo medio contenidos en matraces Erlenmeyer de 200-500 ml. Los matraces inoculados fueron incubados a 28◦C durante 144 horas en un agitador rotatorio que funcionó a 300 rpm con un recorrido de 5,04 cm. La producción de materia bioactiva se midió mediante un ensayo diseñado para medir la inhibición de sı́ntesis de proteı́nas de novo, por ejemplo, βlactamasa. En este ensayo, la muestra a ensayar 3 5 2 053 697 (250 µl) se añade a 2 ml de Caldo de Ensayo Antibiótico (BBL Laboratories, Cockeysville, Md.) en un tubo estéril. También se añaden 0,5 ml de un cultivo durante una noche en Caldo de Ensayo Antibiótico de Bacillus licheniformis SC 9262 de la “Squibb Culture Collection” y 100 µl de una solución de penicilina G (100 µg/ml). Después de incubación a 37◦ C durante 2,5 horas, 30 µl de una solución que contiene 50 mg de una cefalosporina cromogénica, y se añade también ácido (6R-trans)-3-[2-(3,4-dinitrofenil) -etenil]-8-oxo-7[(fenilacetil)amino]-5-tia-1-azabiciclo[4, 2,0]oct-2eno-2-carboxı́lico, disuelto en 5 ml de dimetilsulfóxido y diluido con 95 ml de solución tampón de fosfato 50 mM de pH 7,0. Un cambio de color rápido de amarillo a rosa indica la hidrólisis de la cefalosporina cromogénica por la enzima inducida, β-lactamasa. La inhibición del cambio de color es una medida de la producción de los antibióticos de esta invención ya que los mismos inhiben la producción de la enzima, β-lactamasa. En la recolección, los contenidos de los matraces fueron reunidos y los caldos reunidos se centrifugaron para producir aproximadamente 16 litros de un lı́quido sobrenadante y 5,5 kg de células húmedas. El lı́quido sobrenadante, ajustado a pH aproximadamente 5, fue extraı́do con tres porciones de 6,7 litros de acetato de etilo. Los extractos de un total de 54 litros de caldo sobrenadante fueron combinados y concentrados in vacuo para dar un sólido aceitoso (3,46 g). El sólido fue disuelto en acetonitrilo-agua, 1:1 (70 ml) y fue aplicado a una columna de AGMP-50, resina H+ , malla 200 -400 (1,5 x 13 cm), rellena con el mismo disolvente. Después de lavar la columna con 180 ml del disolvente, los antibióticos fueron eluidos con 215 ml de un disolvente compuesto por piridinaacetonitrilo-agua 8:46:46. El producto eluido se hizo pasar a través de una columna de 1,5 x 10 cm de AGMP-1, resina de Cl−, malla 100-200, rellena con acetonitrilo-agua 1:1. Después de un lavado inicial de la resina con 225 ml de este disolvente, los antibióticos fueron eluidos con 175 ml de disolvente que consiste en ácido acéticoacetonitriloagua, 2:49:49. El producto eluido activo fue concentrado in vacuo para dar un sólido marrón, 0,28 gramos. Una porción de 0,14 gramos del sólido, disuelta en 2 ml de acetonitrilo-agua-ácido trifluoroacético, 66:33:0,1, fue sometida a cromatografı́a en una columna de 2,5 x 40 cm de Sephadex LH-20, rellena con la misma mezcla disolvente. Las primeras fracciones activas fueron recogidas, reunidas y concentradas in vacuo para producir 37 mg del complejo de Dactilociclina. La segunda parte con un valor máximo de materia activa a eluir fue también recogida y concentrada in vacuo para dar 75 mg del compuesto conocido, 4a-hidroxi-8 -metoxi-CTC. El complejo de Dactilociclina (115 mg), obtenido según se describió anteriormente, fue disuelto en 4 ml de una mezcla disolvente difásica compuesta por cloroformo-metanol -agua, 7:13:8 y se sometió a cromatografı́a en este sistema disolvente en un Separador-Extractor de Espiral Multi-Capas Ito (P.C. Inc., Potomac, Md.) que funcionaba a 800 rpm utilizando una espiral de tubos (1,6 mm d.i.) de teflón multicapas con un 4 5 10 15 20 25 30 35 40 45 50 55 60 65 6 volumen de 330 ml. La elución se efectuó con la fase móvil superior. Después de la recogida de 565 ml de fase móvil, la fase inferior fue recuperada y las fracciones se combinaron según el bioensayo. Se recuperaron cuatro partes con valores máximos de materia activa, siendo tres de Dactilociclina A, Dactilociclina B y Dactilociclina C y la siendo la cuarta 4a-hidroxi-8-metoxi-CTC residual. El orden y la cantidad de cada producto recuperado fueron: Dactilociclina C (2,7 mg, 110115 ml), Dactilociclina A (26,3 mg, 125 -150 ml), 4a-hidroxi-8-metoxi-CTC (11 mg, 355-485 ml) y Dactilociclina B (13,7 mg, 785-885 ml). La Dactilociclina A tiene unos valores máximos de absorción ultravioleta en metanol (E1% ) a 369(160), 261(170) y 238(200) nm además de la absorción final. No se detectan cambios en los valores máximos de absorción por adición de un ácido. Los valores máximos de la absorción cambian a 386(150), 279(170) y 243(210) nm por adición de una base. El espectro de infrarrojos de la Dactilociclina A en bromuro de potasio se muestra en la figura 1. Son destacables los siguientes valores máximos: 1677, 1609, 1384, 1241, 1204 y 1136 cm−1 . El espectro de masas por bombardeo con átomos rápidos (FAB) en ion positivo en dimetilsulfóxidoditiotreitol-detioeritritol-glicerina (en lo sucesivo denominado DDDG) se muestra en la figura 2. El espectro de masas FAB en ion negativo en DDDG se muestra en la figura 3. La medida de la masa de alta resolución en el ion M+H produjo una masa de 698,2282 daltons. El espectro RMN de C13 a 67,5 MHz de la Dactilociclina A en metanol deuterado se muestra en la figura 4; el espectro RMN de H1 a 400 MHz en metanol deuterado se muestra en la figura 5. La Dactilociclina A es soluble en metanol, mezclas de acetonitrilo-agua y dimetilsulfóxido, pero no es sustancialmente soluble en acetonitrilo, cloroformo, benceno o agua. La Dactilociclina A tiene un valor de Rf de 0,33 cuando se somete a cromatografı́a en placas (200 µm) de capa fina en fase inversa Whatman KC18 con un disolvente que consiste en dimetilformamida-acetonitrilo-solución tampón, pH 4,2, 3:4:3. La composición de la solución tampón es: ácido etilendiaminotetracético 0,5 mM, sal de disodio, ácido cı́trico 15 mM, citrato de sodio 20 mM y nitrato de potasio 50 mM. La Dactilociclina A tiene un tiempo de retención de 3,28 minutos cuando se somete a cromatografı́a por HPLC en una columna (0,45 x 30 cm) de fenilo Waters µBondapak con un caudal de 1 ml por minuto. Este sistema utiliza justo el mismo disolvente descrito para el análisis cromatográfico en capa fina. La Dactilociclina B tiene unos valores máximos de absorción ultravioleta en metanol (E1% ) a 373(190), 262(200) y 238(240) nm además de la absorción final. Los valores máximos de la absorción cambian a 368(180), 261(220) y 238(240) por adición de un ácido. Los valores máximos de la absorción cambian a 385(180), 281(200) y 243(260) nm por adición de una base. El espectro de infrarrojos de la Dactilociclina B en bromuro de potasio se muestra en la figura 6. Son destacables los siguientes valores 7 2 053 697 máximos: 1725, 1606, 1546, 1382, 1240, 1102 y 993 cm−1 . El espectro de masas FAB en ion positivo de la Dactilociclina B en DDDG se muestra en la figura 7. El espectro de masas FAB en ion negativo de Dactilociclina B en DDDG se muestra en la figura 8. El espectro de masas de alta resolución en el ion M+H produjo una masa de 712,2165 daltons. El espectro RMN de H1 a 400 MHz de la Dactilociclina B en metanol deuterado se muestra en la figura 9. La Dactilociclina B tiene un valor de Rf de 0,11 cuando se somete a cromatografı́a en placas (200 µm) de capa fina en fase inversa Whatman KC18 con un disolvente que consiste en dimetilformamida-acetonitrilo-solución tampón, pH 4,2, 3:4:3. La composición de la solución tampón es: ácido etilendiaminotetracético 0,5 mM, sal de disodio, ácido cı́trico 15 mM, citrato de sodio 20 mM y nitrato de potasio 50 mM. La Dactilociclina B tiene un tiempo de retención de 4,85 minutos cuando se somete a cromatografı́a mediante HPLC en una columna (0,45 x 30 cm) de fenilo Waters µBondapak con un caudal de 1 ml por minuto. Este sistema utiliza justo el mismo disolvente descrito para el análisis cromatográfico en capa fina. La Dactilociclina C tiene unos valores máximos de absorción ultravioleta en MeOH (E1% ) a 381(120) y 275(170) nm además de la absorción final. Actividad biológica Se utilizó la metodologı́a siguiente para determinar la concentración inhibitoria mı́nima (denominada en lo sucesivo MIC) de los compuestos de esta invención. Los organismos de ensayo se hicieron crecer en 20 ml de Caldo de Ensayo Antibiótico (Difco) inoculando el caldo (en tubos) con un asa de siembra del organismo a partir de un cultivo inclinado en agar BHI (Difco). Los tubos inoculados fueron incubados a 37◦ C durante 18 a 24 horas. Estos cultivos se supone que contienen 109 unidades formadoras de colonias (CFU) por ml. Los cultivos fueron diluidos 1:100 para dar un nivel de inóculo final de 107 CFU; las diluciones fueron hechas con Caldo Vacuno de Levadura (Difco). Los compuestos de ensayo fueron disueltos en un diluyente apropiado a una concentración de 1000 µg/ml. Se hicieron diluciones al doble en Caldo Vacuno de Levadura (Difco) que resultaron en un intervalo de 1000 µg/ml a 0,5 µg/ml. Una porción de 1,5 ml de cada dilución se colocó en platos de petri individuales a los que se añadieron 13,5 ml de agar K-10. La composición de agar K -10 es: 5 10 15 20 25 8 Extracto vacuno Extracto de levadura Peptona Dextrosa Agar Agua destilada La concentración de fármaco final en el agar varió en el intervalo de 100 µg/ml a 0,05 µg/ml. Placas testigo de crecimiento del organismo que contienen solamente agar fueron preparadas e inoculadas antes y después de las placas de ensayo. El organismo fue aplicado a la superficie de agar en cada placa con un Inoculador Multipunto Denly, que suministra aproximadamente 104 CFU en la superficie de agar. Las placas fueron incubadas a 37◦C durante 18 horas y se determinaron las MICs. La MIC es la concentración más baja de compuesto que inhibe el crecimiento del organismo. Los organismos de ensayo escogidos para este estudio son parejas de cepas sensibles a la tetraciclina y resistentes a la tetraciclina. Los resultados, que se muestran a continuación, demuestran que hay una falta de resistencia cruzada entre los compuestos nuevos de esta invención y la tetraciclina. 30 Organismo∗ 35 40 45 50 1,5 g 3,0 g 6,0 g 1,0 g 15,0 g c.s. para 1 litro MIC (µg/ml) Tetra- Dactilo- Dactilociclina ciclina A ciclina B Staphylococcus aureus SC2399 0,4 Staphylococcus aureus SC10016 100 Staphylococcus aureus SGB 42 0,2 Staphylococcus aureus SGB 45 100 Staphylococcus epidermidis SC9052 0,8 Staphylococcus epidermidis SC 9087 50 Staphylococcus faecalis SC9011 1,6 Staphylococcus faecalis SC9776 >100 1,6 6,3 6,3 3,1 1,6 3,1 3,1 3,1 6,3 3,1 3,1 3,1 25 6,3 25 6,3 55 60 65 5 9 2 053 697 REIVINDICACIONES 1. Un procedimiento par preparar un compuesto, Dactilociclina A, que tiene el espectro de infrarrojos en bromuro de potasio según se muestra en la figura 1, el espectro de masas por bombardeo con átomos rápidos en el modo de ion positivo según se muestra en la figura 2, el espectro de masas por bombardeo con átomos rápidos en el modo de ion negativo según se muestra en la figura 3, el espectro RMN de C13 a 67,5 MHz según se muestra en la figura 4, y el espectro RMN de H1 a 400 MHz según se muestra en la figura 5, caracterizado por cultivar Dactylosporangium, sp. A.T.C.C. n◦ 53693. 2. Un procedimiento para preparar un compuesto, Dactilociclina B, que tiene el espectro de infrarrojos en bromuro de potasio según se muestra en la figura 6, el espectro de masas por bom- 5 10 15 10 bardeo con átomos rápidos en el modo de ion positivo según se muestra en la figura 7, el espectro de masas por bombardeo con átomos rápidos en el modo de ion negativo según se muestra en la figura 8 y el espectro RMN de H1 a 400 MHz según se muestra en la figura 9, caracterizado por cultivar Dactylosporangium, sp. A.T.C.C. n◦ 53693. 3. Un método para preparar una preparación farmacéutica, que comprende combinar una cantidad farmacéuticamente efectiva de Dactilociclina A según la reivindicación 1 con un vehı́culo farmacéuticamente aceptable. 4. Un método para preparar una preparación farmacéutica que comprende combinar una cantidad farmacéuticamente efectiva de Dactilociclina B según la reivindicación 2 con un vehı́culo farmacéuticamente aceptable. 20 25 30 35 40 45 50 55 60 NOTA INFORMATIVA: Conforme a la reserva del art. 167.2 del Convenio de Patentes Europeas (CPE) y a la Disposición Transitoria del RD 2424/1986, de 10 de octubre, relativo a la aplicación del Convenio de Patente Europea, las patentes europeas que designen a España y solicitadas antes del 7-10-1992, no producirán ningún efecto en España en la medida en que confieran protección a productos quı́micos y farmacéuticos como tales. 65 Esta información no prejuzga que la patente esté o no incluı́da en la mencionada reserva. 6 2 053 697 7 2 053 697 8 2 053 697 9 2 053 697 10 2 053 697 11 2 053 697 12 2 053 697 13 2 053 697 14 2 053 697 15