Transparencias del tema Solidos I
Anuncio

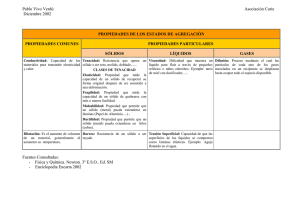
Física Cuántica Sólidos I. Introducción. José Manuel López y Luis Enrique González Universidad de Valladolid Curso 2004-2005 – p. 1/10 Introducción. • • • • En un sólido podemos encontrar 1023 átomos por cm3 . Imposible resolver el hamiltoniano. Un sólido es un conjunto de electrones e iones, los electrones se mueven en el potencial creado por los iones. (distancia entre iones ≡ 3 Å) ¿ Por qué estudiamos cuanticamente un sólido? : Algunos fenómenos que ocurren en sólidos son inexplicables desde el punto de vista clásico. Por ejemplo el magnetismo. Las técnicas de la física cuántica han permitido entender las propiedades de los sólidos y han sido la base del actual desarrollo de la tecnologia electrónica. Curso 2004-2005 – p. 2/10 ¿Qué es un sólido? -cristal -policristal -amorfo -cuasicristal. Desde el punto de vista cuantico la determinación de la estructura de un sólido no difiere fundamentalmente de una mólecula. Born-Oppenheimer: energía electronica para posiciones ionicas fijas + movimiento ionico en el potencial correspondiente. El orden tridimensional del sólido cristalino nos permite resolver el problema electrónico: IMPORTANCIA DE LAS PROPIEDADES DE SIMETRÍA. Curso 2004-2005 – p. 3/10 Tipos de sólidos según el enlace: Sólidos covalentes: Atomos ligados entre sí por enlaces direccionales localizados similares a los encontrados en el estudio de la molécula H2 . La distribución espacial de los átomos está determinda por la naturaleza y direccionalidad de los enlaces. Vease red diamante. • • • • • Son duros y dificiles de deformar. Malos conductores del calor y la electricidad. Puntos de fusión altos. Las energías de excitación electrónicas son de unos pocos eV. Son transparentes. Curso 2004-2005 – p. 4/10 Curso 2004-2005 – p. 5/10 Sólidos iónicos: Distribución regular de iones positivos y negativos unidos por fuerzas de Coulomb. Enlace no direccional ⇒ los iones tratan de apilarse de forma compacta. Vease red NaCl. • Son malos conductores del calor y la electricidad • Son duros y frágiles • Tienen alto punto de fusión Curso 2004-2005 – p. 6/10 Puentes de hidrógeno: Están formados por moléculas fuertemente polares con 1 o más atomos de H, el enlace es coulombiano entre hidrogenos parcialmente cargados positivamente y otros átomos parcialmente cargados negativamente: puentes de hidrogeno. Vease figura agua. Ejemplos: H2 O, HF , etc. Muy importantes en biología. Curso 2004-2005 – p. 7/10 van der Waals: Están constituidos por sustancias moleculares no polares que se unen entre sí por fuerzas tipo van der Waals débiles. (Interacción dipolo instantaneo-dipolo inducido). • No conducen el calor ni la electricidad • Tienen un punto de fusión muy bajo y son muy compresibles y deformables. Ejemplos: CH4 , Cl2 , I2 , CO2 , C6 H6 , gases nobles, etc. Curso 2004-2005 – p. 8/10 Metales: Este tipo de sólidos han sido los más importantes desde el punto de vista de la evolución cultural y tecnológica de la humanidad. Compuestos por átomos, u otros constituyentes, que tienen energías de ionizacion pequeñas y que en el proceso de formación del cristal son facilmente desprendidos y pasan a formar parte de una "nube" electrónica que se mueve libremente por todo el volumen del cristal. • • • Conducen muy bien el calor y la electricidad Son opacos Son malebles y dúctiles Curso 2004-2005 – p. 9/10 Esta clasificación no debe ser tomada de forma muy estricta. Por ejemplo el grafito está formado por capas planas de C en una configuración de tipo hexagonal. En cada capa existen simultáneamente enlace de tipo covalente localizado (enlaces σ entre orbitales atómicos híbridos sp2 ) y de tipo metálico (caso límite del “macroenlace" de tipo π en moléculas conjugadas). Cada capa es por tanto una especie de macromolécula neutra y la interacción entre capas es entonces de tipo van der Waals. (Vease red grafito) Curso 2004-2005 – p. 10/10