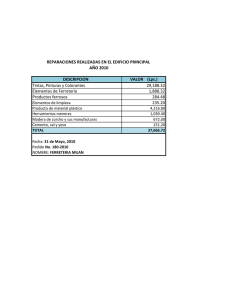
degradación de colorantes (azul de metileno) por método
Anuncio

“DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUÍMICAS INGENIERÍA QUÍMICA TESIS “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODOS ELECTROQUÍMICOS” PRESENTA LUCIANO BAUTISTA SUÁREZ DIRECTOR DEL TRABAJO RECEPCIONAL DR. JOSÉ ÁNGEL COBOS MURCIA ORIZABA, VER. NOVIEMBRE 2011 I “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” II “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” A g r a d e c i m i e n t o s El mejor camino a seguir en la vida, no es aquel que uno escoge, ni no el que uno mismo traza. Esta tesis quiero dedicársela como agradecimiento a aquellas personas que durante ese largo camino jamás han dejado de estar a mi lado, brindándome su apoyo y su amor incondicional. Aquellos mismos que día a día celebraron mis triunfos, y en mis fracasos me brindaron el brazo más fuerte para no dejarme desfallecer y el más amoroso para ayudarme a levantar. Esta tesis la dedico a mi madre, ya que sin su amor y constante esfuerzo no hubiera sido posible trazar mi propio camino. A Dios, porque ha sido fuente de constante alivio y sabiduría. Al Dr. José Ángel Cobos Murcia mi director de tesis, quien me ofreció ser partícipe de este trabajo de tesis, además me brindo conocimientos, consejos, confianza y apoyo en los momentos que necesite. A mis amigos y compañeros porque gracias a la amistad y esfuerzo de todos hoy logramos un triunfo más. A la universidad veracruzana y a sus maestros por permitirme realizarme y desarrollarme durante 9 semestres. III “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” INDICE INTRODUCCIÓN ........................................................................................................... VIII JUSTIFICACIÓN .............................................................................................................. IX OBJETIVOS ...................................................................................................................... X HIPÓTESIS ....................................................................................................................... X CAPITULO 1 ...................................................................................................................... 2 1.1 Azocompuestos ........................................................................................................ 2 1.1.1 Compuestos azoicos de arilo o Alirulos .............................................................. 3 1.1.2 Compuestos azoicos de alquilo .......................................................................... 3 1.2 Azul de metileno ....................................................................................................... 6 ............................................................................................................................... 6 1.3 Historia de los colorantes .......................................................................................... 7 1.3.1 Colorantes .......................................................................................................... 7 1.3.2 Clasificación de los colorantes ........................................................................... 7 1.4 colorantes de mayor importancia industrial ............................................................... 8 1.4.1 Colorantes nitrados y nitrosados ........................................................................ 8 1.4.2 Colorantes Azoicos ............................................................................................ 8 1.4.3 Colorantes de Difenil y del Trifenil Metano ......................................................... 9 1.4.4 Colorantes Indigoides ......................................................................................... 9 1.4.5 Colorantes de Antraquinona ............................................................................. 10 1.4.6 Colorantes Azufrados o Fosforados ................................................................. 10 1.5 Colorantes en Alimentos ......................................................................................... 10 1.6 Colorantes Naturales ............................................................................................. 11 1.7 Impacto ambiental.................................................................................................. 13 Capítulo 2 ......................................................................................................................... 15 2.1 Métodos para la degradación de Azocompuestos ................................................... 15 2.2 Mecanismos biológicos para la remoción y degradación de colorantes .................. 15 2.2.1 Tratamientos bacterianos ................................................................................. 15 2.2.2 Tratamientos fúngicos. ..................................................................................... 16 2.2.3 Bisorción .......................................................................................................... 16 2.3 Procesos electroquímicos y mecanismo fisicoquímico .......................................... 17 IV “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” 2.3.1 Fotocatálisis Heterogénea ................................................................................ 17 2.3.2 Procesos electroquímicos de oxidación avanzada .......................................... 17 2.6 Tratamientos biológicos VS Métodos electroquímicos ............................................ 18 2.6.1 Ventajas de los tratamientos biológicos ............................................................ 18 2.6.2 Ventajas de los métodos electroquímicos......................................................... 18 Capítulo 3 ......................................................................................................................... 21 3.1 Fundamentos de procesos electroquímicos ............................................................ 21 3.2 Celda electroquímica ............................................................................................. 23 3.2.1 Proceso de tratamiento electroquímico ........................................................... 24 3.3 Variables electroquímicas ...................................................................................... 26 3.4 Requisitos para que circule la corriente eléctrica .................................................... 27 3.5 Intensidad eléctrica ................................................................................................. 28 3.6 Algunos antecedentes de degradación de aguas residuales con colorantes ........... 31 3.6.1 Degradación del azul de metileno..................................................................... 31 3.6.2 Tratamiento electroquímico de efluentes sintéticos .......................................... 31 3.6.3 Oxidación Supercrítica del Agua (Instituto Mexicano de Tecnología del Agua). 32 3.6.4 Tratamiento anaerobio de Aguas contaminadas con Colorantes Azo ............... 32 3.6.5 Procesos biológicos mediante tanques de estabilización con o sin aireación y filtros percoladores .................................................................................................... 32 3.6.6 Aplicación de la energía solar ultravioleta al tratamiento de la contaminación por compuestos no biodegradables (Plataforma Solar de Almería). ................................ 32 3.6.7 Evaluación de la fotodegradación sensibilizada con TiO2 y Fe3+ para aguas coloreadas. ............................................................................................................... 33 3.6.8 Fotocatálisis de Naranja II con TiO2 inmovilizado, efecto del pH y el peróxido de hidrógeno. ................................................................................................................. 33 3.6.9 Degradación fotocatalítica del colorante azo amaranto para alimentos, mineralización del grupo azo a nitrógeno. ................................................................. 33 3.6.10 Degradación solar fotocatalítica de varios colorantes comerciales utilizando TiO2 en suspensión. .................................................................................................. 34 3.6.11 Degradación fotocatalítica de colorantes en el agua: Caso de estudio del índigo e índigo carmín (Escuela Central de Lyon, Laboratorio de fotocatálisis). ........ 34 3.6.12 Degradación fotocatalítica de varios tipos de colorantes (Alizarina Naranja G, Rojo de Metilo, Rojo Congo y Azul de Metileno) en el agua irradiados con luz UV y dióxido de titanio (Escuela Central de Lyon, Laboratorio de Fotocatálisis). ............... 35 Capitulo 4 ......................................................................................................................... 37 V “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” 4.1 Metodología ............................................................................................................ 37 4.1.1 Desarrollo de metodología ............................................................................... 38 4.3 Método analítico para determinar la degradación del azul de metileno ................... 45 Capitulo 5 ......................................................................................................................... 47 5.1 Evaluación de la curva de calibración ..................................................................... 47 5.2 Evaluación del electrodo de Fe ............................................................................... 48 5.3 Evaluación del electrodo de Cu .............................................................................. 49 5.4 Evaluación del electrodo de Aluminio ..................................................................... 50 5.5 Elección de las condiciones, electrodo y variables que se usaron para realizar las pruebas exhaustivas por medio de análisis factorial. .................................................... 51 5.6 Obtención de resultados ......................................................................................... 52 5.7 Resultado de pruebas exhaustivas con electrodos de Cu y Fe con sus respectivas condiciones................................................................................................................... 53 5.8 Cinética de degradación ......................................................................................... 55 CONCLUSIÓNES ............................................................................................................ 56 REFERENCIAS BIBLIOGRAFICAS ................................................................................. 58 CONSULTAS EN INTERNET ........................................................................................... 60 ANEXOS .......................................................................................................................... 62 INDICE DE FIGURAS Figura.1.1 Estructura rojo congo………………………………………………………………...3 Figura.3.1 Reacciones electrolíticas…………………………………………………………...21 Figura. 3.2 Celda electrolítica 1………………………………………………………………...22 Figura. 3.3 Celda electrolítica 2………………………………………………………………...22 Figura.3.4 Celda electrolítica…………………...………………………………………………23 Figura.3.5 Mecanismos de oxidación directa e indirecta para el tratamiento electroquímico…………………………………………………………………………………….25 Figura. 3.6 Circuito eléctrico…………………………………………………………………….27 Figura.3.7 Colector solar………………………………………………………………………...31 Figura. 4.1 Diagrama de trabajo………………………………………………………………..37 Figura.4.1 Multímetro digital, el cual indica el voltaje (potencial)…………………………...41 Figura.4.2 Multímetro digital, el cual indica la intensidad de corriente……………………..41 VI “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” Figura. 4.4 Reóstato, su función es regular la intensidad de voltaje……………………….42 Figura.4.6 Transformador de corriente eléctrica……………………………………………...43 Figura. 4.7. Montaje final de equipo de trabajo……………………………………………….44 Figura. 4.8 Triplicado de experimentos en celdas……………………………………………45 Figura 5.1.Evaluación de la curva de calibración del azul de metileno…………………….47 Figura. 5.6. Gráfico de la eficiencia de los electrodos Cu y Fe…………………………......54 Figura. 5.7 Evaluación de la velocidad de degradación……………………………………..55 Figura.1 Anexos. Micromoles degradados de color guinda…………………………………65 Figura.2 Anexos. Eficiencia de los electrodos………………………………………………...65 Figura.3 Anexos. Eficiencia pruebas exhaustivas…………………………………………….66 ÍNDICE DE TABLAS Tabla 1.1 Algunos colorantes usados en la industria………………………………………….5 Tabla 1.2 Propiedades del azul de metileno……………………………………………………6 Tabla 4.1Experimentos realizados……………………………………………………………..39 Tabla 4.2.Medidas de los electrodos…………………………………………………………..40 Tabla 5.1 Electrodo de Fe con sus respectivos resultados y condiciones de trabajo……48 Tabla 5.2 Electrodo de Cu con sus respectivos resultados y condiciones de trabajo…..49 Tabla 5.3 Electrodo de Al con sus respectivos resultados y condiciones de trabajo……50 Tabla 5.4. Analisis de electrodos……………………………………………………………...51 Tabla 5.5 Resultado muestras exhaustivas…………………………………………………..53 Tabla 1 Anexos. Experimentos………………………………………………………………..64 VII “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” INTRODUCCIÓN El proceso electroquímico permite destruir una gran variedad de compuestos tóxicos y peligrosos, aun en bajas concentraciones, persistentes a la degradación natural, este proceso se ha desarrollado recientemente y ha probado ser efectivo en la destrucción de muchos contaminantes orgánicos. Este método electroquímico es prometedor en el tratamiento de compuestos azo ya que es muy fácil la instalación del equipo electroquímico y sus requerimientos: este sistema electroquímico se compone de 2 multimetros digitales, un reóstato, un potenciómetro, un trasformador de corriente eléctrica, una celda electrolítica, parrilla eléctrica, cables, caimanes, y electrodos. El proceso electrolítico consiste en la utilización de un potencial impuesto a cada uno de los experimentos que se realizan, para así promover una reacción de oxidación muy energética. Esta reacción tiene lugar cuando se suministra una corriente eléctrica por medio de electrodos sujetados con caimanes a la solución de azul de metileno en presencia de oxigeno. Este trabajo consistió en el estudio de la degradación y mineralización del colorante azul de metileno, cuya fórmula molecular es C16H18ClN3S.2H2O.Este colorante es utilizado en los laboratorios de análisis ambiental para la determinación de sustancias activas al azul de metileno (SAAM), como son los detergentes, prueba rutinaria en esta clase de laboratorios. VIII “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” JUSTIFICACIÓN Uno de los contaminantes de aguas de mayor impacto en el medio ambiente, son los colorantes producidos en diversas industrias, principalmente textileras. Se estima que entre el 10-15% de los colorantes usados en estas industrias son arrojados en las aguas residuales. Las sustancias químicas que contienen los colorantes están relacionadas con la presencia de compuestos tóxicos con grupos cromoforos de alto peso molecular, los cuales al acumularse en lagos y ríos, provocan disminución en la luminosidad de las aguas y en consecuencia inducen a la disminución de la actividad fotosintética, lo cual produce a su vez una disminución en el contenido de oxigeno disponible en el agua. En la actualidad se considera que el medio ambiente cumple tres funciones trascendentales, fuente fundamental de recursos necesarios para el proceso productivo, ofrece servicios relacionados con el disfrute del medio ambiente como la belleza natural, aire limpio, agua, además actúa como depósito de desechos y residuos generados en las actividades de producción y consumo humano. Desde un punto de vista económico existe la necesidad de impulsar un desarrollo sostenible que considere la satisfacción de las necesidades de generaciones futuras. Este trabajo se centra en la degradación de los colorantes textiles por métodos electroquímicos lo cual resulta en un método factible, rápido, sencillo y económico. IX “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” OBJETIVOS OBJETIVOS GENERALES Evaluar el comportamiento de variables electroquímicas, potencial, pH, y corriente para la degradación del azul de metileno, para así establecer un sistema electroquímico que tenga la capacidad de degradar por lo menos un 80% del colorante. OBJETIVOS PARTICULARES Evaluar el potencial electroquímico durante la degradación electroquímica para la disminución del contenido del colorante azul de metileno. Valorar las condiciones ideales del pH ideal para la degradación del azul de metileno empleando un método electroquímico. Apreciar la eficiencia de diferentes electrodos empleados durante la degradación electroquímica del azul de metileno. HIPÓTESIS La degradación de colorantes será factible mediante el método electroquímico empleando para ello electrodos metálicos, imponiendo una diferencia de potencial electroquímico que suministre la energía requerida para la trasformación química de las moléculas del colorante así como su posible mineralización. X “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” CAPITULO 1 GENERALIDADES 1 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” CAPITULO 1 En este capítulo se describen las características de los azocompuestos y la clasificación de los colorantes, además del impacto ambiental que representan estos compuestos para el medio ambiente y en particular la relación que se tienen con las aguas residuales. 1.1 AZOCOMPUESTOS Un grupo azo es un grupo funcional del tipo R-N=N-R', en donde R y R' son grupos que contienen átomos de carbono. Los átomos de nitrógeno están unidos por un doble enlace, los compuestos que contienen el enlace -N=N- se denominan azoderivados, compuestos azoicos, o azocompuestos. Cuando el grupo azo está conjugado con dos anillos aromáticos, el compuesto absorbe radiación electromagnética en el espectro de la región visible, por lo que el compuesto presenta coloración y, además es intensa. Por esto, son empleados como colorantes en la industria textil, papelera, alimentaria, entre otras. Por ejemplo, el p-dimetilaminoazobenceno se emplea como colorante en la margarina. La presencia de otros grupos funcionales en el compuesto aromático puede provocar que éste absorba a distintas longitudes de onda y por tanto, se obtengan distintos compuestos con distintos colores. También pueden provocar que el compuesto absorba la luz con mayor o menor intensidad. Así mismo se pueden introducir algunos grupos (por ejemplo, grupos sulfónicos que aportan propiedades como la solubilidad). Por otro lado en 1884 se sintetizó el rojo congo figura 1.1, un colorante azóico que se empleó para teñir algodón, y que actualmente son los más empleados en la industria textil. (Weininger, 1988). 2 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” Figura.1.1 Estructura rojo congo. Otro ejemplo de estos compuestos es el naranja de metilo que se utiliza como indicador en volumetrías ácido-base y que dependiendo del pH su grupo azo se protona o desprotona, por lo que presenta diferentes colores según el pH. (Weininger, 1988). 1.1.1 COMPUESTOS AZOICOS DE ARILO O ALIRULOS Los compuestos azoicos de arilo suelen ser especies cristalinas estables, siendo el azobenceno el compuesto aromático azoico típico y que existe principalmente como isómero trans, pero a través del proceso de fotólisis, se convierte en el isómero cis. Los compuestos aromáticos azoicos se pueden sintetizar usando la reacción de acoplamiento diazoico, que involucra una reacción de sustitución electrofílica aromática, donde un catión arildiazonio ataca a otro anillo de arilo, especialmente aquellos que tienen grupos donadores de electrones. Puesto que las sales de diazonio suelen ser inestables cerca de la temperatura ambiente, las reacciones de acoplamiento diazoico suelen llevarse a cabo a temperaturas bajas (alrededor de 0°C). Así mismo la oxidación de las hidrazinas también produce compuestos azoicos. (McMurry, 2008). 1.1.2 COMPUESTOS AZOICOS DE ALQUILO Los compuestos azoicos alifáticos ((R y/o R' = alifático) son menos comunes que los compuestos azoicos de arilo. Un ejemplo es el dietildiazeno, EtN=Net a temperaturas elevadas o irradiación, los enlaces carbono-nitrógeno (C-N) en ciertos compuestos azoicos de alquilo se rompen con la pérdida de gas nitrógeno 3 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” para generar radicales libres. Debido a este proceso, algunos compuestos azoicos alifáticos se utilizan como iniciadores de radicales. Un ejemplo representativo es el azobisisobutilonitrilo (AIBN), que se usa ampliamente como un iniciador de procesos de polimerización. Debido a su inestabilidad, especialmente para los alifáticos, debe tenerse cuidado al manejar compuestos azoicos, o puede ocurrir una explosión. (Beyer, 1987). La razón por la cual estos colorantes son utilizados en las industrias, incluyen características como las diferentes tonalidades que pueden proporcionar, pueden ser utilizados en diferentes métodos de aplicación y permiten una rápida humectación a la prenda. Los colorantes usados industrial mente poseen una compleja estructura química encontrando así aquellos que contienen grupos azo, diazo , antraquinonas y complejos metálicos, los cuales generalmente se aplican como mezclas. Según sus propiedades pueden ser clasificados como se muestra en la Tabla 1.1 a continuación. 4 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” Tabla 1.1 Algunos colorantes usados en la industria, (Garzón 2009). Colorante Estructura No. De color Tipo de colorante NARANJA NARANJA S DIRECTO 26 DIAZO AZUL AZUL DISPERSO 3 DISPERSO 3 ANTRAQUINONA AZUL ACIDO AZUL ACIDO DIAZO 133 133 INDIGO AZUL 2 INDIGOIDE AZUL PR AMARILLO MD AZUL ACIDO 129 ANTRAQUINONA AMARILLO AZO 12 AZUL MB AZUL 13 AZO 5 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” 1.2 AZUL DE METILENO Este colorante tiene forma de cristales o polvo cristalino, presenta un color verde oscuro, con brillo bronceado. Es Inodoro y estable al aire, sus disoluciones en agua o en alcohol son de color azul profundo. Es fácilmente soluble en el agua y en cloroformo; también es moderadamente soluble en alcohol. Este colorante se utiliza en los laboratorios de análisis ambiental para la determinación de sustancias activas al azul de metileno (SAAM), como son los detergentes, prueba rutinaria en esta clase de laboratorios, también se utiliza como materia prima para fabricar agentes antipalúdicos y es empleado para el teñido directo, para embellecer tintes amortiguados como el azul de alizarina, el indigo y el palo Campeche. Además se emplea en el estampado y tinte de la seda algodón de diferentes tonos de color. (Restrepo 2007). En la tabla 1.2 se resumen algunas de las propiedades de este colorante Tabla 1.2 Propiedades del azul de metileno. Nombre químico 3,7-bis (dimetilamino)Cloruro d fenazationio Cloruro de tetrametiltionina Fórmula química C16H18N3ClS Masa molecular 319,85 g/mol Densidad 1.757g/cm³ Punto de fusión 100 °C Punto de ebullición Se descompone 6 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” 1.3 HISTORIA DE LOS COLORANTES Desde las primeras civilizaciones el hombre usó materias colorantes naturales. Los pigmentos o sustancias coloreadas se extraían de plantas, animales y minerales. Estas materias eran empleadas para teñir ropas, pintar las pieles y fabricar objetos religiosos y recreativos. 1.3.1 COLORANTES Se da este nombre a sustancias coloreadas, las cuales son capaces de teñir las fibras vegetales y animales. Para que un colorante sea útil, debe ser capaz de unirse fuertemente a la fibra, y por lavado no debe perder su color. Debe ser químicamente estable y soportar la acción de la luz. 1.3.2 CLASIFICACIÓN DE LOS COLORANTES Colorantes directos: Se absorbe directamente por las fibras en soluciones acuosas. Los hay ácidos y básicos, siendo los ácidos sales de los ácidos sulfúricos o carboxílicos que se precipitan sobra la fibra. Los colorantes básicos son sales amoniacales o complejos formados por cloruro de zinc o aminas. Estos dos tipos de colorantes se emplean especialmente en el teñido de lanas y en poliamidas sintéticas. Algunos colorantes básicos, de elevado peso molecular, se absorben por el algodón y el rayón (Walter, 1987). Colorantes sustantivos: Son colorantes que pueden teñir directamente las fibras de algodón. Colorantes mordientes: El mordiente es un producto que se adiciona a la fibra y se absorbe por ella, pudiendo consecutivamente atraer el colorante. Un ejemplo de este tipo de colorante es el ácido tánico, el cual se usa como mordiente para los colorantes básicos. Este término, se usa principalmente para los colorantes que se adicionan usando óxidos metálicos como mordiente. Especialmente se emplean como mordientes los óxidos de aluminio y cromo por formar precipitados insolubles. Colorantes a la tina: Son sustancias insolubles que se pueden reducir a materiales alquil-solubles. El colorante se aplica en su forma reducida y se reoxida en presencia de la fibra. 7 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” 1.4 COLORANTES DE MAYOR IMPORTANCIA INDUSTRIAL 1.4.1 COLORANTES NITRADOS Y NITROSADOS Son nitro o nitroso derivados del benceno y naftaleno con algún grupo fenólico o amino. El más antiguo de estos colorantes es el “amarillo de alfa naftol S”, que se usa especialmente como colorante de productos empleados para la alimentación. Actualmente los nitrocolorantes más importantes son las nitrofenilaminas, que dan tonos amarillos, naranjas y castaños. Ejemplo de este grupo es el “pardo de amino naftol C” y algunas de estas nitrofenilaminas más simples se emplean como tinturas dispersas para acetato de celulosa y nylon (Klages 2006). 1.4.2 COLORANTES AZOICOS Esta clase constituye el mayor grupo de tinturas. Estos colorantes se preparan mediante la reacción de una amina aromática diazotada con un fenol o una amina aromática. El más sencillo de estos colorantes es el “amarillo de anilina”, que corresponde al “para-amino azo-benceno”.C6H5 - N == N - C6H4NH2. Se usa para teñir lana y seda, su color es fugaz, estos colorantes portadores de determinados grupos forman complejos con las sales metálicas, con lo que se aumenta la resistencia al lavado y la luz. (Walter, 1987). La Crisoidina: Pertenece al mismo grupo. Se requiere para la preparación del prontosil (con un grupo SO2NH2), que es una sulfamina que se utiliza contra los estretococos. El Pardo de bismark: Se emplea para teñir el cuero. Rojo de metilo: Es un valioso indicador. El rojo congo: Tiñe el algodón de color rojo, pero el color cambia a azul por la acción de los ácidos minerales. Se emplea por ello como indicador. 8 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” 1.4.3 COLORANTES DE DIFENIL Y DEL TRIFENIL METANO Son tinturas básicas para lana, seda o algodón, mordentado con ácido tánico. Son colorantes muy estimados por su color brillante. Tienen el inconveniente de no ser resistentes a la luz o al lavado, excepto aplicados a fibras acrílicas. Un ejemplo de ellos es el “verde malaquita”. Las Fucsias o Rosalinas: Corresponde a las tinturas de color fucsia y rosa. Violeta de Metilo: Se prepara oxidando la dimetilamilina con CuCl2. Es la tintura empleada en tintas púrpuras, lápices indelebles y cintas para máquinas de escribir [Walter, 1987]. Violeta Cristal: Es importante en la fabricación de la Violeta de Genciana, que se emplea como antiséptico preparado a partir de la mezcla violeta cristal con violeta de metilo. Ftaleínas: Aunque no se emplea como tintura, la fenolftaleína es el representante más importante de este grupo. Se usa como indicador de reacciones de ácido bases. Su importancia principal es como medicamento base de laxantes. Junto con lodo (tretaiodofenolfaleína), se emplea para el examen radiológico de la vesícula, acumula en la vesícula átomos de lodo pesado que son opacos a los rayos X. (Walter 1987). 1.4.4 COLORANTES INDIGOIDES Indigos: Es un colorante vegetal, fue usado para teñir vestiduras de las momias egipcias con índigo. La fórmula molecular del índigo es C16H10N2O2. Es una sustancia insoluble en agua. Es de color azul oscuro con reflejos bronceados. Se aplica en la industria textil. Es resistente a la luz y al lavado y su bajo costo hace que sea e colorante azul más empleado. (Klages 2006). La Púrpura de Tiro: Es una materia colorante natural, muy empleada en la antigüedad. En Creta se cree que se empleaba ya en 1600 A.C y se obtenía de 9 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” moluscos de la familia murex. Para producir un gramo de púrpura se necesitaban 9.000 moluscos, aproximadamente. (Klages 2006). 1.4.5 COLORANTES DE ANTRAQUINONA Pertenecen a las tinturas mordientes. El representante más conocido es la alizarina, tintura natural, ya conocida por los antiguos egipcios y persas. Existe en la raíz de la rubia. La alizarina es poligenética, produce diferentes colores, con diferentes mordientes. Con Magnesio genera un color violeta, con mordiente a base de calcio da color rojo púrpura, con mordiente de bario un color azul, con aluminio rosado, con cromo castaño violeta y con hierro (ferroso), negro violeta. Se empleó para producir el color rojo turco en el algodón. (Walter 1987). 1.4.6 COLORANTES AZUFRADOS O FOSFORADOS Incluyen los colorantes preparados por calentamiento de materias orgánicas con azufre y sulfato de sodio (tionación). Los primeros colorantes azufrados eran amarillos, pardos solía producirse calentando aserrín, estiércol y azufre. Más tarde se produjeron tinturas negras, azules, verdes, amarillas y naranjas. Se emplean estos colorantes solamente en tintura de algodón, ya que atacan a las proteínas y fibras de éster. 1.5 COLORANTES EN ALIMENTOS En su mayoría de origen natural o artificial que se usan para aumentar el color de los alimentos, ya sea porque el alimento a perdido color en su tratamiento industrial o bien para hacerlo más agradable a la vista y apetecible al consumidor. Aquellas sustancias que se añaden o devuelven color a un alimento, y que además incluyen componentes naturales u otras fuentes naturales. Agentes Preservantes: De efecto germicida y antimicótico, como por ejemplos: Los benzoatos usados en las conservas, sorbato de potasio usado en cecinas, quesos, vinos, bebidas, y propionatos utilizados en la industria del pan. 10 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” Agentes Antioxidantes: Evitan enranciamiento y pardeamiento de alimentos principalmente de grasas; como por ejemplo los eritorbatos que se usan en la industria cecinera, frutas congelables y pescado congelado. Otro es el B.H.T. (butilhidroxitolueno), que inhibe especialmente la oxidación de mantequilla, margarina, aceites vegetales y sopas deshidratadas. Agentes Saborizantes: Tales como el acetato de amilo o esencia de plátano Agentes Emulsionantes: Impiden que las mayonesas y cremas envasadas se corten; tales como la lecitina. Agentes Edulcorantes: Por ejemplo la sacarina, los ciclamatos fueron usados durante mucho tiempo para endulzar bebidas, postres, helados sintéticos; y que sin embargo, en la actualidad, han sido prohibidos pues se les atribuye efectos cancerígenos. Agentes que mejoran textura de alimentos: Tal es el caso de polifosfatos que se añaden a las aves congeladas y ciertos tipos de jamón, para que estas carnes se mantengan tiernas y jugosas; otro es la polidextrosa que da más consistencia a mermeladas y productos dietéticos. (Astisaran, 2003). 1.6 COLORANTES NATURALES Curcumima E-100: Se aplica en helados, salsas, sopas, confitería, postres, platos precocinados, quesos, bebidas, condimentos, entre otros. Presentándose en líquidos hidrosolubles, líquidos liposolubles y polvos hidrosolubles. Tiene buena estabilidad a los ácidos, poca a la luz y media al calor. La coloración que se obtiene es amarilla y amarilla-anaranjada. Riboflavina E-101ª : Se aplica en helados, confitería, bebidas, o yogur, presentándose en líquidos hidrosolubles y polvos hidrosolubles. Tiene buena estabilidad al calor y media a la luz y a los ácidos. La coloración que se obtiene es amarilla. 11 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” Clorofila E-141: Se aplica en helados, confitería, bebidas, condimentos o vinagretas. Su presentación en líquidos hidrosolubles, líquidos liposolubles y polvos hidrosolubles. Tiene estabilidad de media a buena a los ácidos, media a la luz y al calor. La coloración que se obtiene es verde. Carmín Cochinilla E-120 La palabra carmín designa a la vez a un matiz de color y un producto colorante. Se llama en efecto comúnmente carmín a un colorante rojo natural que se extrae de la hembra de la cochinilla CoccusCacti, insecto que vive en las ramas de los cactus, particularmente en el Opuntio Coccinilifera principalmente en Perú y también en las Islas Canarias. Este colorante se usa desde la antigüedad en tejidos, vinagres, alcoholes, productos cárnicos y más recientemente se usa en los productos cosméticos. Con el carmín se obtiene un color rojo vivo en medio ácido y un color violáceo en medio básico debido a que el carmín es un indicador de pH y su color varía dependiendo del medio en el que se encuentre (Astisaran, 2003). 12 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” 1.7 IMPACTO AMBIENTAL Los colorantes sintéticos son compuestos químicos xenobióticos, los cuales no se encuentran en forma natural en la biosfera, sino que han sido sintetizados por el hombre (Moeller y Garzon, 2003). Por la complejidad estructural que presentan las plantas de tratamiento convencionales tienen un bajo porcentaje de remoción de estos, razón por la cual son vertidos sin ser tratados (Alatorre y Moeller, 2006). Los colorantes azoicos se utilizan en grandes cantidades en las industrias textil y alimentaria, y su vertido en aguas residuales de dichas industrias, incluso en bajas concentraciones, produce una intensa coloración que tiene un fuerte impacto ambiental, no sólo por su contaminación visual sino también por su toxicidad. De ahí la relevancia de su tratamiento y eliminación de las aguas previas al vertido de las industrias, buscando su decoloración y si es posible, su completa mineralización. 13 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” CAPITULO 2 DEGRADACIÓN DE COMPUESTOS AZO 14 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” CAPÍTULO 2 Este capítulo menciona los diversos métodos para la degradación de los compuestos azo y se clasifican en métodos biológicos y fisicoquímicos, e igual hace referencia en las ventajas y desventajas de cada uno de estos métodos. 2.1 MÉTODOS PARA LA DEGRADACIÓN DE AZOCOMPUESTOS Los tratamientos biológicos, tanto aeróbico, como anaeróbico o mixto, son considerados como efectivos para la remoción de sustancias toxicas y del exceso de materia orgánica presente en el medio. Para este propósito se han utilizado diferentes tipos de microorganismos, tales como, bacterias, algas, levaduras y hongos (Garzón, 2009). Los hongos de podredumbre blanca se han implementado desde hace 30 años ya que estos tienen la capacidad de degradar la lignina, la cual es un polímero que posee una alta concentración de anillos aromáticos con alto grado de polimerización. El mecanismo enzimático se da por la acción de oxidasas y peroxidasas, estas enzimas no presentan una especificidad alta, por lo tanto pueden tener actividad sobre la estructura de diferentes sustratos fenólicos y azo. 2.2 MECANISMOS BIOLÓGICOS PARA LA REMOCIÓN Y DEGRADACIÓN DE COLORANTES 2.2.1 TRATAMIENTOS BACTERIANOS El desarrollo de procesos biotecnológicos encaminados hacia la decoloración de efluentes industriales, buscan obtener como objetivo principal, la remoción de un amplio espectro de colorantes, así como, un alto porcentaje de degradación y decoloración (Garzón, 2009). Algunos factores ambientales pueden influir en la decoloración de las aguas residuales, tales como pH, temperatura y cantidad de oxígeno disponible en el medio, ya que en ciertas condiciones, las moléculas de los colorantes se pueden descomponer en compuestos de bajo peso molecular. De esta forma podemos encontrar biotransformación de tipo aerobia o anaerobia. 15 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” 2.2.2 TRATAMIENTOS FÚNGICOS . La capacidad que poseen los hongos para degradar compuestos aromáticos complejos como parte de su metabolismo natural, ha permitido que sean usados en la degradación de diversos compuestos xenobióticos, incluyendo colorantes sintéticos usados en la industria. Muchos basiodimicetes y ascomicetos han sido usados en la decoloración de colorantes. Esto puede deberse a que los filamentos fúngicos, son menos sensibles a variaciones en temperatura, pH, nutrientes y aireación. Adicionalmente gracias a su alta tasa metabólica y a su rápida colonización de superficies que permite un crecimiento rápido sobre un soporte si se desea inmovilizar. (Cabral, 2005). Solamente un pequeño número de microorganismos son responsables de la biodegradación de la lignina, de los cuales los hongos de la podredumbre blanca constituyen el grupo más importante. El sistema enzimático extracelular de estos organismos, se basa fundamentalmente en la producción de radicales libres, permitiendo que las enzimas sean catalíticamente activas sobre diversos sustratos orgánicos. Las enzimas más significativas son las lacasas, ligninoperoxidasa (LiP), manganeso peroxidasa (MnP), y veratrilperoxidasa (VP), que tienen una potente capacidad oxidante gracias a la gran cantidad de compuestos xenobióticos que pueden ser degradados por estos hongos, debido a esto se les ha dado un muy importante lugar en procesos de biorremedación. 2.2.3 BISORCIÓN La bisorción es el proceso mediante el cual se produce la acumulación de sustancias químicas por la biomasa microbiana, la cual puede estar viva o muerta. Este proceso involucra una fase solida (bisorbente) y una fase líquida (solvente, que normalmente es el agua), la cual contendrá las especies disueltas que serán bisorbidas. De acuerdo a la afinidad del sorbente por el sorbato, es atraído hacia el sólido y entrelazado por diferentes mecanismos. Este proceso continua hasta que se establece un equilibrio entre el sorbato disuelto enlazado al sólido. El uso de biomasa inerte tiene ventajas especialmente si las aguas a tratar tienen un alto contenido tóxico. (Rivas, 2000). 16 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” La bisorción por microorganismos se ha reportado como un tratamiento no convencional efectivo para el tratamiento de efluentes de agua así como para tratamiento de suelos contaminados con residuos tóxicos. 2.3 PROCESOS ELECTROQUÍMICOS Y MECANISMO FISICOQUÍMICO 2.3.1 FOTOCATÁLISIS HETEROGÉNEA Es un proceso catalítico promovido por energía aportada por determinada longitudes de onda, que se basa en la adsorción directa o indirecta de energía radiante (visible o UV) capaz de excitar un sólido al grado de hacer que se comporte como un material conductor, en la superficie del cual se desarrollaran reacciones de óxido- reducción, las cuales genera radicales libres muy reactivos, al mismo tiempo que reacciona con las especies a su alrededor, rompiendo el enlace más débil de la molécula y reduciendo u oxidándolos hasta convertirlos en especies menos complejas sin que el catalizador sufra cambios químicos. 2.3.2 PROCESOS ELECTROQUÍMICOS DE OXIDACIÓN AVANZADA Los procesos electroquímicos de oxidación avanzada por sus siglas en ingles (EAOPs) se basan en la electrólisis indirecta o asistida, en la cual el compuesto orgánico de interés es generadas como los eliminado de la disolución mediante especies activas radicales · OH, o bien oxidantes generados electroquímicamente como por ejemplo el H2O2. Los principales procesos de este tipo son: Oxidación anódica, electrogeneración de oxidantes, Electro-Fenton, FotoelectroFenton, peroxicoagulación y fotoperoxicoagulación. Estos procesos electroquímicos se basan en la utilización de energía eléctrica para romper los enlaces de las moléculas. Se clasifican como procesos avanzados de oxidación porque los electrones se transfieren al compuesto orgánico en último extremo mediante la intervención de radicales hidroxilo. La principal ventaja de este tipo de procesos es evitar la introducción de reactivos en disolución. Por ello la Ingeniería electroquímica tiene un amplio campo de aplicaciones. En los últimos años, un campo de la electroquímica que se está desarrollando con fuerza es el tratamiento de efluentes industriales, al tratarse de 17 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” un procedimiento muy atractivo para dar solución a los problemas medioambientales de nuestra industria. 2.6 TRATAMIENTOS BIOLÓGICOS VS MÉTODOS ELECTROQUÍMICOS 2.6.1 VENTAJAS DE LOS TRATAMIENTOS BIOLÓGICOS Las ventajas de los tratamientos biológicos son bien conocidas, pero también sus limitaciones para altos valores de DQO (Demanda Química de Oxígeno) o en presencia de compuestos altamente tóxicos. La posible presencia de compuestos inorgánicos, tales como metales pesados, puede provocar un descenso en el número de bacterias. Por otra parte, la incineración de compuestos orgánicos puede originar la formación de productos tóxicos que sean arrastrados al mismo tiempo por la combustión de los gases; también, la presencia de agentes corrosivos puede provocar problemas en la estabilidad de los materiales del incinerador [1]. 2.6.2 VENTAJAS DE LOS MÉTODOS ELECTROQUÍMICOS El tratamiento electroquímico se puede utilizar en el tratamiento de residuos altamente tóxicos. El proceso puede funcionar a temperatura y presión ambiental. Es una tecnología respetuosa con el medioambiente porque solamente usa electricidad. El consumo energético depende de la DQO. El tratamiento electroquímico se puede parar simplemente apagando la fuente de energía. Bajo costo. Tecnología segura y eficiente. La tecnología electroquímica se usa actualmente para: Producción in-situ de cloro. Generación de ozono. La degradación de PCBs. Destrucción de cianuros y nitritos. 18 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” Purificación de aguas residuales usando agentes oxidantes y, en general, como un método para la reducción de la DQO de cualquier efluente. Eliminación de fenol. Eliminación de tenso activos y tintes o colorantes. [1] 19 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” CAPITULO 3 FUNDAMENTO ELECTROQUÍMICO 20 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” CAPÍTULO 3 Este capítulo describe las principales variables que influyen en el tratamiento electroquímico y algunas degradaciones que se han llevado a cabo en los últimos años así como también el fundamento de una celda electrolítica, ya que es de suma importancia encontrar o elegir el mejor método para la degradación de los compuestos azo. 3.1 FUNDAMENTOS DE PROCESOS ELECTROQUÍMICOS La electroquímica estudia los cambios químicos que producen una corriente eléctrica y la generación de electricidad mediante reacciones químicas. Es por ello, que el campo de la electroquímica ha sido dividido en dos grandes secciones. La primera de ellas es la electrólisis, la cual se refiere a las reacciones químicas que se producen por acción de una corriente eléctrica. La otra sección se refiere a aquellas reacciones químicas que generan una corriente eléctrica, éste proceso se lleva a cabo en una celda o pila galvánica. Reacciones electroliticas Celdas Galvánicas Electroquímicas Producen energía Consumen energía Procesos Redox Figura.3.1 Reacciones electrolíticas 21 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” Celdas electrolíticas: son aquellas en las cuales la energía eléctrica que procede de una fuente externa provoca reacciones químicas no espontáneas generando un proceso denominado electrólisis. Las celdas electrolíticas constan de un recipiente para el material de reacción, dos electrodos sumergidos dentro de dicho material y conectados a una fuente de corriente directa como se muestra en la figura 3.2 (Castillo 2010). Figura. 3.2 Celda electrolítica 1 Celdas voltaicas o galvánicas: son celdas electroquímicas en las cuales las reacciones espontáneas de óxido-reducción producen energía eléctrica. Las dos mitades de la reacciónes de óxido reducción, se encuentran separadas, por lo que la transferencia de electrones debe efectuarse a través de un circuito externo figura 3.3 [1]. Figura. 3.3 Celda electrolítica 2 22 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” En todas las reacciones electroquímicas hay transferencia de electrones y por tanto, son reacciones de óxido reducción (redox), existen teorías que permiten explicar el comportamiento de las soluciones electrolíticas. Una de estas teorías es la de la Ionización de Arrhenius que propuso en 1887 la Teoría de la disociación electrolítica, la cual está basada en la idea de que los electrolitos se disocian en iones al ponerse en contacto con el agua. (Castillo 2010). 3.2 CELDA ELECTROQUÍMICA Todas las reacciones electroquímicas comprenden la transferencia de electrones, son reacciones de óxido-reducción. Las superficies de oxidación y reducción se llaman electrodos y están constituidos físicamente, por un ánodo y un cátodo respectivamente. El sistema de aplicación se fundamenta principalmente en una celda y una corriente de entrada y de salida por los electrodos [Castillo 2010]. Una celda electroquímica es un dispositivo para generar energía eléctrica a partir de una reacción redox espontanea, Figura 3.4 (Chang, 2002). Figura.3.4 Celda electrolítica [Castillo 2010] 23 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” 3.2.1 PROCESO DE TRATAMIENTO ELECTROQUÍMICO Es una tecnología basada en la degradación oxidativa de compuestos químicos a través de reacciones anódicas. Las reacciones anódicas se utilizan normalmente para generar de forma artificial una película protectora de óxido en el ánodo. Se caracterizan por el desprendimiento de hidrógeno en el cátodo, el cual es inatacable, y la inexistencia de desprendimiento alguno en el ánodo, lo que implica la formación de la película. La naturaleza del electrolito presente en la disolución, que confiere a ésta carácter conductor, con gran importancia sobre los fenómenos que se desarrollan en la superficie anódica. Se pueden señalar dos tipos de reacciones anódicas en función del electrolito presente en la disolución: Electrolito que no tiene acción disolvente sobre la capa de óxido: en este caso se forma una película muy adherente y no conductora. El crecimiento de la película se realiza hasta que su resistencia eléctrica es tan elevada que impide la circulación de la corriente hacia el ánodo. Se forma entonces una capa llamada «capa barrera». Electrolito que tiene una acción disolvente sobre la capa de óxido: si el metal mismo es disuelto y si los productos de reacción son solubles en el electrolito, no se forma capa de óxido En general se puede decir que la oxidación electroquímica (depuración electroquímica) se produce mediante reacciones anódicas en las que el oxígeno es transferido desde el disolvente a los productos que deben oxidarse. (3.1) Al aplicar una intensidad de corriente determinada, el agua se oxida a O 2, obteniéndose como intermedio de reacción radicales OH, radicales reactivos que 24 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” atacan al componente orgánico a destruir y que se generan directamente en la superficie del ánodo, quedando adsorbidos en él. H2O OH OH- + H+ + e- ½ O2 + H+ +e- (3.2) (3.3) La característica principal de los tratamientos electroquímicos es que utilizan la energía eléctrica como vector de descontaminación ambiental. La oxidación anódica de compuestos orgánicos puede proceder de diversos mecanismos, incluyendo la oxidación directa e indirecta, (Figura 3.5). Oxidación directa: La transferencia de electrones se da entre las especies orgánicas y la superficie del electrodo electrocatalítico. Oxidación indirecta: Los compuestos orgánicos no interactúan directamente con la superficie del electrodo, sino que el proceso tiene lugar a partir de la intermediación de algunas especies electroactivas. Figura.3.5 Mecanismos de oxidación directa e indirecta para el tratamiento electroquímico 25 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” 3.3 VARIABLES ELECTROQUÍMICAS a) Electrodos Los electrodos son superficies en la cuales tienen lugar las semi-reacciones de oxidación o de reducción, y pueden o no participar en las reacciones. Los electrodos que no reaccionan reciben el nombre de electrodos inerte y su contraparte recibe el nombre de electrodos activos. Sin importar el tipo de celda, electrolítica o voltaica, los electrodos se identifican de la manera siguiente:(Figura 3.4) Cátodo: Es el sitio donde sucede la reducción, donde la especie electroactiva gana electrones. Ánodo: Superficie donde ocurre la oxidación, donde la especie electroactiva pierde electrones. b) Potencial eléctrico El potencial eléctrico de un punto en el espacio se define como el trabajo realizado para traer la unidad de carga positiva desde el infinito, donde el potencial eléctrico es cero, hasta el punto en cuestión [Castellán, 1998]. La corriente eléctrica fluye del ánodo al cátodo por la diferencia de energía potencial que existe entre ambos. Este flujo de electricidad es similar a la caída de agua en una cascada debido a la diferencia de energía potencial de gravedad, o el fluir de un gas de una zona de elevada presión a una depresión baja. La diferencia de potencial eléctrico entre el ánodo y el cátodo se mide con un potenciómetro, donde la lectura (voltios) es el potencial electroquímico impuesto de la celda. Este también tiene el término de fuerza electromotriz o fem (E) como también potencial de celda [Chang, 2002]. c) Corriente Lo que conocemos como corriente eléctrica no es otra cosa que la circulación de cargas o electrones a través de un circuito eléctrico cerrado, que se mueven siempre del polo negativo al polo positivo de la fuente de suministro de fuerza 26 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” electromotriz (FEM). En un circuito eléctrico cerrado la. Corriente circula siempre del polo.negativo al polo positivo de la.fuente de fuerza electromotriz [1]. Figura. 3.6 Circuito eléctrico 3.4 REQUISITOS PARA QUE CIRCULE LA CORRIENTE ELÉCTRICA Para que una corriente eléctrica circule por un circuito es necesario que se disponga de tres factores fundamentales: 1. Fuente de fuerza electromotriz (FEM). 2. Conductor. 3. Carga o resistencia conectada al circuito. 4. Sentido de circulación de la corriente eléctrica. 1. Una fuente de fuerza electromotriz (FEM) como, por ejemplo, una batería, un generador o cualquier otro dispositivo capaz de bombear o poner en movimiento las cargas eléctricas negativas cuando se cierre el circuito eléctrico. 2. Un camino que permita a los electrones fluir, ininterrumpidamente, desde el polo negativo de la fuente de suministro de energía eléctrica hasta el polo positivo de la propia fuente. En la práctica ese camino lo constituye el conductor o cable metálico, generalmente de cobre. 3. Una carga o consumidor conectada al circuito que ofrezca resistencia al paso de la corriente eléctrica. Se entiende como carga cualquier dispositivo que para funcionar consuma energía eléctrica como, por ejemplo, una bombilla o lámpara para alumbrado, el motor de cualquier equipo, una 27 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” resistencia que produzca calor (calefacción, cocina, secador de pelo, etc.), un televisor o cualquier otro equipo electrodoméstico o industrial que funcione con corriente eléctrica [2]. Cuando las cargas eléctricas circulan normalmente por un circuito, sin encontrar en su camino nada que interrumpa el libre flujo de los electrones, decimos que estamos ante un “circuito eléctrico cerrado”. Si, por el contrario, la circulación de la corriente de electrones se interrumpe por cualquier motivo y la carga conectada deja de recibir corriente, estaremos ante un “circuito eléctrico abierto”. Por norma general todos los circuitos eléctricos se pueden abrir o cerrar a voluntad utilizando un interruptor que se instala en el camino de la corriente eléctrica en el propio circuito con la finalidad de impedir su paso cuando se acciona manual, eléctrica o electrónicamente 3.5 INTENSIDAD ELÉCTRICA Una de las propiedades más importantes de los electrolitos es la conductividad eléctrica ya que significa la capacidad de estos para transportar la electricidad. La resistencia al paso de la corriente de un conductor electrolítico se determina por medio de la ley de ohm, si se le aplica una diferencia de voltaje a un fluido que contenga iones, se establecerá una corriente de iones positivos que se mueven en la dirección del campo eléctrico y los iones negativos lo harán en sentido contrario. La conductividad electrolítica es una medida de la disociación de una solución que permite el transporte de la corriente eléctrica por el movimiento de los iones por la influencia de un gradiente de potencial. Los iones se mueven a una velocidad que depende de su carga y tamaño, la viscosidad del medio y la magnitud del gradiente de potencial (Rodríguez, 1996). E= I * R En la cual: E = Potencial eléctrico. I= Intensidad de corriente. R = Resistencia de la celda. 28 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” La densidad de corriente es una magnitud vectorial la cual tiene unidades de corriente eléctrica por unidad de superficie. Matemáticamente, la corriente eléctrica y la densidad de corriente se relacionan por la ecuación sig.: I=∫ J * ds Donde I es la corriente eléctrica en amperios A J es la densidad de corriente en A. m-2 S es la superficie en m² El proceso de descomposición por medio de la electricidad de una sustancia es la electrólisis. La palabra electrólisis significa "destrucción por la electricidad". La mayor parte de los compuestos inorgánicos y algunos orgánicos se ionizan cuando se funden o son disueltos en agua u otros líquidos; es decir, sus moléculas se disocian en especies químicas llamados iones cargados negativa y positivamente los cuales tienen la propiedad de conducir la energía eléctrica. Si en una disolución de un electrolito se coloca un par de electrodos y se conecta una fuente de corriente continua entre ellos, los iones negativos de la disolución se mueven hacia el electrodo positivo y los iones positivos hacia el negativo (Figura 3.2). Al alcanzar a los electrodos, los iones pueden perder o ganar electrones y transformarse en átomos neutros o moléculas; la naturaleza de las reacciones del electrodo depende del voltaje aplicado o de la diferencia de potencial. El efecto de una corriente sobre un electrolito puede entenderse mediante el mecanismo sencillo de la electrolisis del agua. Si en agua se disuelve bicarbonato de sodio, ésta se disocia en cationes (Oxígeno) y aniones (Hidrógeno). Al aplicar una carga eléctrica a los electrodos, los iones Oxígeno se mueven hacia el cátodo, se descargan, y se depositan en el electrodo como átomos de Oxígeno. Los iones Hidrógeno, al descargarse en el ánodo, se convierten en átomos de Hidrógeno (Rodríguez, 1996). 29 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” El agua está compuesta por Hidrógeno y Oxígeno. Se llama hidrolisis a la separación de éstos dos elementos químicos mediante el uso de la electricidad. Las reacciones electroquímicas producidas en el cátodo y en el ánodo se presentan a continuación [Rodríguez, 1996]. 2H2O + 2e- H2 + 2OHH2O 2H+ + ½ O2 + 2e- E0= -0.83V E0 = -1.23V Estas reacciones no se dan de forma espontánea. Para que se logren efectuar es necesario aplicar corriente eléctrica mediante un generador de corriente continuo o una pila galvánica. Es por este motivo que la reacción se lleva a cabo en una celda electrolítica, en la cual por la acción de un flujo de electrones suministrado por la fuente de voltaje externa ocurren cambios químicos [Rodríguez, 1996]. 30 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” 3.6 ALGUNOS ANTECEDENTES DE DEGRADACIÓN DE AGUAS RESIDUALES CON COLORANTES La decoloración de aguas residuales por métodos electroquímicos y biológicos se ha hecho posible por medio de la aplicación de las siguientes técnicas. 3.6.1 DEGRADACIÓN DEL AZUL DE METILENO Una manera de degradación es empleando un colector solar el cual contiene tres módulos, cada uno de los cuales estaba compuesto por 8 tubos de vidrio de 48mm de diámetro externo y 150cm de largo y lámina de aluminio. Esto permite la reflexión de la radiación ultravioleta de la luz solar. Todo el conjunto tiene una bomba de recirculación y un tanque. Mostrando mediante una serie de experimentos que lograron degradar el azul de metileno, en un promedio de degradación de 78,04% [3]. Figura.3.7 Colector solar 3.6.2 TRATAMIENTO ELECTROQUÍMICO DE EFLUENTES SINTÉTICOS Este método se especializa en la destrucción de contaminantes orgánicos en aguas residuales mediante el uso de procesos basados en la oxidación anódica que son muy eficientes en la degradación total o parcial de productos tóxicos no biodegradables en sectores como el textil donde se emplean colorantes. Han obtenido resultados satisfactorios de remoción de los contaminantes hasta en un 98%. También se ha iniciado en una línea de fabricación de electrodos de difusión de gas que tienen una gran aplicación en la destrucción de productos orgánicos, la principal desventaja es el alto costo de operación y la construcción de los electrodos [4]. 31 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” 3.6.3 OXIDACIÓN SUPERCRÍTICA DEL AGUA (INSTITUTO MEXICANO DE TECNOLOGÍA DEL AGUA). También se conoce como oxidación hidrotérmica, sus siglas en ingles (HTO), esta tecnología es aplicable a todo tipo de aguas residuales y lodos industriales por medio de la cual los compuestos orgánicos tóxicos se descomponen y pasan a CO2 y H2O.Se han obtenido excelentes resultados ya que con este tratamiento se tiene una degradación total de los contaminantes, con un alto rendimiento en la mayoría de los casos del 100% ya que la oxidación ocurre en segundos y no se producen óxidos de nitrógeno, la mayor desventaja de este proceso es la complejidad de su aplicación y que es poco asequible [5]. 3.6.4 TRATAMIENTO ANAEROBIO DE AGUAS CONTAMINADAS CON COLORANTES AZO Se obtuvieron resultados satisfactorios en la remoción del colorante azo naranja 7 en donde se utilizó un cosustrato al cual se le adicionó glucosa lo cual aumentó la velocidad de remoción del contaminante a un 95%, la mayor desventaja de este tipo de tratamiento es la concentración inicial del contaminante pues esta debe ser baja ya que los microorganismos no resisten este tipo de condiciones [5]. 3.6.5 PROCESOS BIOLÓGICOS MEDIANTE TANQUES DE ESTABILIZACIÓN CON O SIN AIREACIÓN Y FILTROS PERCOLADORES Se han utilizado microorganismos aerobios y anaerobios en tanques de sedimentación para la degradación de los contaminantes, se han obtenido resultados satisfactorios. La remoción el contaminante es casi total en la mayoría de los casos de un 99%. Nuevamente se tiene la desventaja de no poder ser utilizado en altas concentraciones de contaminantes [6]. 3.6.6 APLICACIÓN DE LA ENERGÍA SOLAR ULTRAVIOLETA AL TRATAMIENTO DE LA CONTAMINACIÓN POR COMPUESTOS NO BIODEGRADABLES (PLATAFORMA SOLAR DE ALMERÍA). Se ha empleado la fotocatálisis para la degradación de aguas contaminadas con colorantes azoicos (naranja de metilo y naranja II), usando la luz solar ultravioleta 32 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” como fuente de energía, los resultados han sido ampliamente satisfactorios con un porcentaje de remoción hasta del 98 – 99%. La desventaja que se presenta en este proceso con luz solar, es que no resulta aplicable a todos los colorantes azoicos debido a las grandes diferencias en su estructura molecular [7]. 3.6.7 EVALUACIÓN DE LA FOTODEGRADACIÓN SENSIBILIZADA CON TIO2 Y FE3+ PARA AGUAS COLOREADAS . Se han tratado aguas residuales provenientes de la industria textil, por medio del tratamiento que consiste en la integración de varios equipos para mejorarla calidad de las aguas residuales, se utilizan los siguientes procesos: un reactor biológico, una columna de filtración, un reactor fotocatalítico, un filtro de membrana, un tanque de almacenamiento y bombas. Obtuvieron una remoción total del color y un 79% de COT, el mayor inconveniente que se presenta con este proceso es el alto costo de implementación y operación ya que se utilizan una gran cantidad de equipos. [8]. 3.6.8 FOTOCATÁLISIS DE NARANJA II CON TIO2 INMOVILIZADO, EFECTO DEL P H Y EL PERÓXIDO DE HIDRÓGENO. Se obtuvo una remoción de color de más del 90%, el TiO 2 se empacó en un soporte de cuarzo y se utilizó un foto reactor con luz ultravioleta artificial, la velocidad de decoloración se mejoró al agregarse el peróxido de hidrógeno, la desventaja más evidente es que como el catalizador se encuentra empacado, en el momento en que este se agota, se debe reemplazar todo el empaque, además la limpieza del reactor es complicada y requiere más tiempo. (Fernández, 2003). 3.6.9 DEGRADACIÓN FOTOCATALÍTICA DEL COLORANTE AZO AMARANTO PARA ALIMENTOS , MINERALIZACIÓN DEL GRUPO AZO A NITRÓGENO. Trataron el colorante azo amaranto con un reactor fotocatalítico y luz ultravioleta artificial, dióxido de titanio en suspensión. El porcentaje de remoción obtenido tras 2 horas y media de tratamiento fue del 85% y el porcentaje de mineralización fue del 94%, al trabajar con este tipo de colorante se debe hacer una dilución previa al tratamiento fotocatalítico porque la solución inicial posee una alta turbidez que no 33 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” permite el paso de la luz uv, esto representa una gran desventaja para este tipo de proceso ya que aumentan los costos de operación. (Karkmaz , 2004). 3.6.10 DEGRADACIÓN SOLAR FOTOCATALÍTICA DE VARIOS COLORANTES COMERCIALES UTILIZANDO TIO2 EN SUSPENSIÓN. Se ha trabajado con varios colorantes comerciales tales como: rojo K-2G, rojo KBP, amarillo KD-3G, rosa catiónico etc. Utilizando dióxido de titanio en suspensión y luz UV, se pudo observar a través del estudio que la velocidad de decoloración era más rápida que la velocidad de mineralización, según los resultados del COT, pero aun así los resultados fueron muy satisfactorios ya que en la totalidad de los colorantes se obtuvo un porcentaje de decoloración mayor a 95% y un porcentaje de remoción de COT entre 50% – 80%, la desventaja más significativa es el acoplamiento con procesos biológicos debido a la alta concentración de contaminante y además no es aplicable a todos los tipos de colorantes azo debido a las grandes diferencias en estructura química.(Yizhong, 2000). 3.6.11 DEGRADACIÓN FOTOCATALÍTICA DE COLORANTES EN EL AGUA : CASO DE ESTUDIO DEL ÍNDIGO E ÍNDIGO CARMÍN (ESCUELA CENTRAL DE LYON , LABORATORIO DE FOTOCATÁLISIS ). Se evaluó la respuesta de los colorantes índigo e índigo carmín, a la degradación con luz UV y dióxido de titanio en suspensión y así poder establecer un mecanismo detallado de degradación por medio de la identificación de los productos intermedios. Obtuvieron excelentes resultados en porcentaje de decoloración y una mineralización casi completa del carbono, el nitrógeno y los sulfuros. El porcentaje de decoloración para ambos colorantes fue mayor al 95% y el porcentaje de mineralización alcanzó un valor mayor al 80%, la desventaja más significativa para la degradación de estos colorantes es la dificultad de tratamiento por medios biológicos. (Herrmannetal, 2001). 34 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” 3.6.12 DEGRADACIÓN FOTOCATALÍTICA DE VARIOS TIPOS DE COLORANTES (ALIZARINA NARANJA G, ROJO DE METILO, ROJO CONGO Y AZUL DE METILENO) EN EL AGUA IRRADIADOS CON LUZ UV Y DIÓXIDO DE TITANIO (ESCUELA CENTRAL DE LYON, LABORATORIO DE FOTOCATÁLISIS ). Se han estudiado cinco tipos de colorantes y su respuesta al tratamiento por degradación fotocatalítica con dióxido de titanio y luz UV, estas aguas contaminadas provienen de la industria textil, con altas concentraciones decolorantes y también alta coloración, obtuvieron los siguientes resultados en términos de porcentaje de decoloración y COT, con valores de 96% y 85%respectivamente, pero la mayor desventaja observada es la dificultad con el acople biológico debido a que los microorganismos no resisten estas condiciones. [9] 35 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” CAPITULO 4 METODOLOGÍA 36 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” CAPITULO 4 4.1 METODOLOGÍA A continuación se describe la metodología empleada en este trabajo. En la figura 4.1 se muestra el diagrama de proceso donde se describen los pasos realizados. El diagrama de proceso describe de forma general cada una de las actividades realizadas para llevar a cabo el trabajo de investigación y como resultado final este trabajo de tesis. Figura. 4.1 Diagrama de trabajo 37 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” 4.1.1 DESARROLLO DE METODOLOGÍA a) Análisis de la degradación del azul de metileno Se preparó dos litros de una solución de azul de metileno (Cloruro Metionina), 25mg/L de concentración. Los experimentos se llevaron a cabo con ayuda de un diseño experimental factorial n3 donde n es el número de variables variando factores como: pH, potencial, y de electrodos usados. Las variables que se mantuvieron constantes fueron volumen de la celda, agitación a 2 rpm y tiempo de imposición de potencial electroquímico. Se analizaron 27 muestras analizando 3 tipos de electrodos Cu, Fe y Al. Además del pH que fuera 5, 7, 9 y el potencial impuesto como se observa en la Tabla 4.1. Los experimentos se realizaron a una temperatura ambiente durante 3600 segundos cada una y finalmente los resultados que mostraron mejores resultados se realizaron con pruebas exhaustivas estudiando las mejores condiciones de cada uno de los electrodos. Por cada prueba corrida se limpió con lija y lima cada uno de los electrodos para que estos estuviesen limpios y así no afectar los resultados con efectos de experimentos anteriores. 38 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” En la siguiente Tabla se muestra una serie de experimentos a desarrollar, los experimentos consisten en 27 pruebas con condiciones diferentes y en las que se abra de trabajar así como lo indica la Tabla 4.1. Tabla 4.1Experimentos realizados Experimento Electrodo Potencial pH BC Al 1.5 9 bC Al 1 9 C Al 0.5 9 Bc Al 1.5 7 bc Al 1 7 c Al 0.5 7 B Al 1.5 5 b Al 1 5 1 Al 0.5 5 aBC Cu 1.5 9 abC Cu 1 9 AbC Cu 0.5 9 aBc Cu 1.5 7 abc Cu 1 7 ac Cu 0.5 7 aB Cu 1.5 5 ab Cu 1 5 a Cu 0.5 5 ABC Fe 1.5 9 Ac Fe 1 9 AC Fe 0.5 9 ABc Fe 1.5 7 Abc Fe 1 7 Ac Fe 0.5 7 AB Fe 1.5 5 Ab Fe 1 5 A Fe 0.5 5 39 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” Para la realización de los experimentos de la Tabla 4.1 a continuación se describe el proceso por etapas. Etapa 1 En una balanza analítica se pesa 50 mg de azul de metileno, después se diluye en 2 litros de agua destilada y así obtenemos una solución de 25mg/L de concentración. Etapa 2 A continuación se muestra en la Tabla 4.2 las dimensiones de los electrodos usados, los electrodos deben estar totalmente limpios por ello se lijan y liman hasta que obtenga brillo cada uno o estén totalmente limpios. Tabla 4.2.Medidas de los electrodos Electrodo Largo Ancho Espesor Cu 4.8cm 2.1cm 0.3mm Fe 3.5cm 2.2cm 0.2mm Al 4.8cm 1.9 0.1mm Etapa 3 Se selecciono una celda electrolítica de forma rectangular por la geometría de los electrodos, esta celda es de plástico y en ella se vertió un volumen de azul de metileno a degradar de 35mL por cada experimento realizado. La celda se coloca sobre la parrilla con agitación, dentro de la celda se coloca el electrodo a usar y una agitador magnético. El ph se modifica dependiendo del experimento a realizar con solución de NaOH y HCl uno molar. 40 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” Etapa 4 En esta etapa se describe y conocerá el sistema electroquímico así como cada una de las partes que lo conforman. Para el montaje de este sistema se requiere evaluar el potencial impuesto usando un potenciómetro conectado en serie (figura.4.1), así como un amperímetro en paralelo para registrar la corriente generada durante la electrolisis (figura.4.2). Figura.4.1 Multímetro digital, el cual indica el voltaje (potencial). Figura.4.2 Multímetro digital, el cual indica la intensidad de corriente. 41 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” Para ajustar el pH se empleó un potenciómetro (figura 4.3) y disoluciones de HCl y NaOH 1M. En esta etapa primero se calibra el potenciómetro con una solución buffer para después ser usado y medir el pH requerido. En la figura 4.4 se observa un reóstato el cual nos permite disipar potencias altas debido a que hay variación de corriente en nuestro lugar de trabajo. Figura. 4.3 Potenciómetro digital con el cual se ajustó el pH de las diferentes pruebas. Figura. 4.4 Reóstato, su función es regular la intensidad de voltaje 42 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” A continuación se observa en la figura 4.5 la celda electrolítica, la cual consiste en un recipiente de plástico en la cual se virtieron 35mL de solución de azul de metileno a degradadar. Cuando se sujetan los electrodos con los caimanes, que estos solo muerdan una mínima parte para que no sean afectados por la solución en degradación. Figura.4.5 Celda electrolítica con solución problema y sus respectivos electrodos, para este caso Fe Esta fuente en nuestro equipo permite imponer solo un potencial de 1.5V figura 4.6. Figura.4.6 Transformador de corriente eléctrica 43 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” 4.2. Sistema electrolítico En la siguiente figura se observa y describe el montaje final con cada uno de sus componentes figura 4.7. 1 3 8 2 6 4 5 7 Figura. 4.7. Montaje final de equipo de trabajo. 1. Caimanes que sujetan a los electrodos 2. Celda electrolítica con solución de azul de metileno 3. Reóstato que permite regular el potencial impuesto a la solución problema 4. Fuente que permite imponer 1.5 V. 5. Instalación de cables a una corriente directa 6. Parrilla eléctrica la cual nos proporciona agitación por medio de un agitador magnético 7. Amperímetro digital en el cual se registra la intensidad de corriente consumida por el sistema. 8. Potenciómetro digital, en este se registra el potencial impuesto. 44 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” 4.3 MÉTODO ANALÍTICO PARA DETERMINAR LA DEGRADACIÓN DEL AZUL DE METILENO Etapa 5 Para evaluar el porciento de azul de metileno degradado se elaboró una curva de calibración a diferentes concentraciones del azul de metileno. Para ello, se efectúan diluciones de unas muestras de contenido conocido y se realiza su registro La curva de calibración se realizó vertiendo 4 mL de la solución madre del azul de metileno en una celda como se observa en la figura 4.8, después se leyó por el espectrofotómetro, aquí se registró la absorbancia y cada experimentó se realizó por triplicado. Después se hizo un promedio, desviación estándar y así se determinó la curva de calibración. Figura. 4.8 Triplicado de experimentos en celdas 45 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” CAPITULO 5 DISCUCIÓN DE RESULTADOS 46 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” CAPITULO 5 5.1 EVALUACIÓN DE LA CURVA DE CALIBRACIÓN Es de suma importancia conocer la concentración inicial de la solución problema para determinar por diferencia de concentraciones cual es el resultado de degradación. Cabe mencionar que para registrar la absorbancia de los experimentos primero se determina el máximo de absorbancia de la solución madre de azul de metileno, para después en las siguientes pruebas emplear la misma longitud de onda. En la figura 5.1 se observa una correlación positiva cercana a 1el cual indica una dependencia entre las 2 variables que son tiempo y la absorbancia. Absorbancia azul de metileno Curva de calibración 2.620 y = 0.058x + 0.321 R² = 0.998 2.120 1.620 1.120 0.620 0.120 0 5 10 15 20 25 30 35 [Methylen Blue]/mgL-1 Figura 5.1.Evaluación de la curva de calibración del azul de metileno De acuerdo al diseño experimental planteado en la sección de metodología en la tabla 4.2, se evalúan cada uno de los electrodos. A continuación se presentan en tablas los resultados de cada uno de los electrodos y sus respectivos comentarios. 47 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” 5.2 EVALUACIÓN DEL ELECTRODO DE FE En la Tabla 4.2 se puede observar en la columna de mmoles de colorante degradado (resultados empíricos, pues aquí mismo se encuentra la oxidación del electrodo), se muestra que los mejores resultados son en las condiciones de pH= 5, pH= 9 imponiendo un potencial electroquímico de 1.0V. Lo cual se comprueba mediante los resultados obtenidos espectroscópicamente por la disminución de la intensidad del color azul y que se observa en la columna de absorbancia y de concentración, observando que los mejores resultados son a potenciales de 0.5 V y 1.0, en un pH= 9. [Se tiene como intervalo de degradación los porcentajes que van desde el 59% hasta el 76%. En los experimentos empleando el electrodo de Fe, se observaba pequeñas partículas asociadas a la oxidación del Fe y su posible complejación con el colorante. Por último, se filtró el precipitado del sobrenadante y observando un cambio en la intensidad del color, observando que, si no se lleva a cabo la filtración la solución permanece sucia debido al oxido de Fe y su complejo. Tabla 5.1 Electrodo de Fe con sus respectivos resultados y condiciones de trabajo. Experimento E potencial pH mmoles - [colorante]/mgL 1 [colorante degradado] /mgL % -1 Degradado A Fe 0.5 5 1.3 17.5 37.9 68.4 Ab Fe 1 5 3.0 16.0 39.4 71.2 AB Fe 1.5 5 0.5 22.6 32.8 59.2 Ac Fe 0.5 7 1.1 17.7 37.7 68.1 Abc Fe 1 7 1.4 19.9 35.5 64.1 ABc Fe 1.5 7 2.4 20.7 34.7 62.6 AC Fe 0.5 9 1.7 13.2 42.2 76.1 Ac Fe 1 9 2.7 13.9 41.5 74.9 ABC Fe 1.5 9 2.7 14.8 40.6 73.3 48 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” 5.3 EVALUACIÓN DEL ELECTRODO DE CU En la Tabla 4.3 El mejor resultado obtenido de este electrodo y el que alcanzo mayor degradación empíricamente y se comprobó es en condiciones de 1.5 V de potencial impuesto en la celda electrolítica y a pH= 5. Los electrodos de Cu son muy limpios debido a que no oxidan la solución, ya que estos desprenden menores partículas de Cu durante su tiempo de evaluación, por cada prueba que se realizó se limpió los electrodos con lija muerta. Cada vez que se realizó la limpieza de los electrodos se observó que en el ánodo había adherencia de colorante en forma de película. Tabla 5.2 Electrodo de Cu con sus respectivos resultados y condiciones de trabajo. Experimento E potencial pH mmoles [colorante]/mgL -1 [colorante % degradado] Degradado /mgL -1 a Cu 0.5 5 2.2 43.5034 11.9 21.5 ab Cu 1 5 3.4 22.09184 33.3 60.1 aB Cu 1.5 5 16.8 21.07143 34.3 62.0 ac Cu 0.5 7 4.1 22.2619 33.1 59.8 abc Cu 1 7 9.7 22.43197 33.0 59.5 aBc Cu 1.5 7 11.2 35.68027 19.7 35.6 AbC Cu 0.5 9 3.7 21.07143 34.3 62.0 abC Cu 1 9 2.6 23.45238 32.0 57.7 aBC Cu 1.5 9 10.1 21.07143 34.3 62.0 49 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” 5.4 EVALUACIÓN DEL ELECTRODO DE ALUMINIO En esta sección el mejor resultado es en condiciones de 1.5 V, pH= 9, la interpretación que se da a este resultado es que el aluminio se oxida, atrapa colorante y lo precipita, más no se asegura que degrade las aminas del colorante o rompa el enlace cromóforo. El electrodo tiene un buen funcionamiento, pero ya relacionado con las demás condiciones de trabajo no resulta factible debido que los mejores resultados son a pH básico, lo que implica amortiguar la solución. Tabla 5.3 Electrodo de Al con sus respectivos resultados y condiciones de trabajo. Experimento E Potencial pH mmoles [colorante]/mgL -1 [colorante % degradado] degradado /mgL -1 C Al 0.5 9 1.6 25.66327 29.7 53.7 1 Al 0.5 5 0.7 36.70068 18.7 33.8 c Al 0.5 7 2.6 37.04082 18.4 33.1 bC Al 1 9 1.9 11.29252 44.1 79.6 b Al 1 5 0.7 42.48299 12.9 23.3 bc Al 1 7 1.5 43.84354 11.6 20.9 BC Al 1.5 9 2.1 8.673469 46.7 84.3 B Al 1.5 5 1.5 18.0102 37.4 67.5 Bc Al 1.5 7 3.4 42.48299 12.9 23.3 50 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” 5.5 ELECCIÓN DE LAS CONDICIONES, ELECTRODO Y VARIABLES QUE SE USARON PARA REALIZAR LAS PRUEBAS EXHAUSTIVAS POR MEDIO DE ANÁLISIS FACTORIAL. A continuación se presenta el análisis estadístico por el cual se seleccionó el mejor electrodo y las mejores condiciones en las pruebas exhaustivas. Así se logró establecer el mejor sistema obteniendo un excelente resultado. En la columna número asignado en la parte inferior el primer digito indica electrodo 2 es para el Cu y 3 para el Fe, el segundo digito potencial (0.5, 1.0 y 1.5) y tercer digito indica pH (5, 7,9). Dependiendo del efecto positivo que tenga el electrodo y sus respectivas condiciones es como se seleccionó el mejor sistema. Aluminio no aparece dentro de los mejores resultados ya que este fue el que menos efecto tuvo combinado con las otras condiciones. Informe de analisis de varianza Page/Date/Time 5 09-02-2011 11:11:30 Base de datos Respuesta Número asignado ABC: C1,C2,C3 2,1,5 2,1,7 2,1,9 2,1.5,5 2,1.5,7 2,1.5,9 3,0.5,5 3,0.5,7 3,0.5,9 3,1,5 3,1, 3,1,9 3,1.5,5 3,1.5,7 3,1.5,9 C5 Tabla 5.4. Analisis de electrodos Enumerar Promedio Error 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 3.4 9.7 2.6 16.8 11.2 10.1 1.3 1.1 1.7 3 1.4 2.7 0.5 2.4 2.7 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 Efecto -1.822222 2.588889 -0.766667 2.855556 -2.2 -0.655556 0.6777778 5.56E-02 -0.733333 1.288889 -1.366667 7.78E-02 -1.966667 1.311111 0.6555555 51 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” El estudio anterior nos permitió determinar los mejores electrodos siendo estos Cu y Fe. Con estos resultados se realizó unas últimas pruebas exhaustivas y estas proporcionaron con un mayor tiempo una degradación mejor. Una vez teniendo los mejores resultados se pensó en hacer que nuestra solución a degradar tuviese mayor conductividad eléctrica esta podría disminuir la intensidad de corriente consumida. Para aumentar la conductividad eléctrica se le adiciono NaCl común a la disolución a degradar (pruebas exhaustivas) la concentración de sal se determinó mediante varias pruebas de error, al final se obtuvo la concentración de sal (1g/100mL) y se siguió la misma metodología que en las veintisiete primeras pruebas. 5.6 OBTENCIÓN DE RESULTADOS [Colorante]/mgL-1se obtiene de la absorbancia del experimento menos la intersección (0.321) entre la pendiente (0.059). [Colorante degradado] /mgL-1se obtiene de la concentración inicial (44) menos [colorante]/mgL-1final. % Degradado se obtiene de [Colorante degradado] /mgL -1multiplicado por 100 entre la concentración inicial (44). 52 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” 5.7 RESULTADO DE PRUEBAS EXHAUSTIVAS CON ELECTRODOS DE CU Y FE CON SUS RESPECTIVAS CONDICIONES En los experimentos finales la disolución de azul de metileno contenía NaCl, es por ello que ocurre una mayor conductividad eléctrica en la solución durante la residencia en la celda, a su vez los electrodos Cu y Fe consumen menos corriente que otros lo cual es muy factible debido a la disminución del gasto de corriente eléctrica. Con la sal agregada la degradación del colorante se realiza a menor tiempo y la solución cambia de color azul a verde, después a trasparente. Si a la solución se le continua suministrando potencial al igual que en los primeros experimentos los electrodos de Cu y Fe ensucian la solución con precipitados de cada uno de ellos, lo cual hay que filtrar para clarificar. En la siguiente Tabla 5.5 se muestran los respectivos resultados de las pruebas exhaustivas, observando que los mejores resultados se presentan en el electrodo de Cu con un 93% de degradación Tabla 5.5 Resultado muestras exhaustivas Prueba a b c mmoles [colorante]/mgL1 [colorante % degradado] Degradado -1 /mgL AC Cu 1.5 7 489.6 2.857143 41.1 93.5 aB Cu 1.5 5 138.4 4.880952 39.0 88.9 aBc Cu 1.5 7 118.6 8.401361 35.5 80.9 ABc Fe 1.5 7 147.4 16.19048 27.7 63.1 AB Fe 1.5 5 205.4 16.41156 27.5 62.6 53 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” A continuación se muestran los resultados de la Tabla 5.5 en forma grafica Figura 5.6 para observar de mejor forma los resultados. Además 2 de las condiciones de trabajo: el pH de color guinda(c) y potencial impuesto de azul (b). Figura. 5.6. Gráfico de la eficiencia de los electrodos Cu y Fe Pruebas exhaustivas b 93.5 c % Degradado 88.9 80.9 63.1 62.6 7 5 7 7 5 Cu Cu Cu Fe Fe AC aB aBc ABc AB 54 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” 5.8 CINÉTICA DE DEGRADACIÓN La constante cinética es directamente proporcional a la concentración inicial del azul de metileno y se modela como un decaimiento exponencial con respecto al tiempo. Este gráfico figura 5.7 es de primer orden y se evalúa con respecto al tiempo en minutos, para entenderse mejor se muestran las siguientes ecuaciones 3.50 Ln[MB] = Ln[MB]0-0.0136s-1*t R² = 0.9496 Ln[MB]/mgL-1 3.00 2.50 2.00 1.50 0 10 20 30 40 Tiempo / min 50 60 Figura. 5.7 Evaluación de la velocidad de degradación 55 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” CONCLUSIÓNES Los procesos electroquímicos representan una tecnología eficaz para el tratamiento de aguas residuales contaminadas con productos orgánicos, provenientes de las industrias químicas, agroquímicas, textiles, de pinturas entre otras. El proceso electroquímico consiste en la destrucción de la molécula mediante el empleo de energía eléctrica, con el objetivo de disminuir la intensidad en el colorante. Observando los resultados del método electroquímico y que estos contienen un alto porcentaje de degradación, se puede trabajar mezclando la electroquímica con los procesos biológicos y así si quedan trazas de residuos aplicando el método electroquímico, se puede usar como segundo un método biológico y lograr una mayor degradación en función de los dos métodos. La electrolisis del colorante azul de metileno alcanzo un alto porcentaje de degradación, el promedio de las pruebas exhaustivas fue de un 93%, en un tiempo de 3 horas. Se concluye que la degradación es factible, con un método muy limpio y rápido. El porcentaje de degradación y la velocidad de degradación del azul de metileno aumento al agregar a la solución de estudio 0.1 gr de sal por cada 100 mL a degradar, la sal contenida en la solución a degradar hizo la solución más conductora de electricidad por lo que se observó menor gasto de corriente eléctrica. El sistema que tuvo mayor porcentaje de degradación de la solución de azul de metileno fue con las siguientes condiciones: electrodo de Cu con un potencial de 1.5, pH= 7, agitación 2 rpm. Las soluciones después de haber sido degradadas necesitan de filtración para que estas no se tiñan nuevamente de color azul, esto debido a que es una solución reversible y a la posible formación de un complejo. 56 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” Esta tecnología resulta atractiva para la descontaminación de aguas con sustancias orgánicas como colorantes, la degradación electroquímica se basa en el uso de sal como conductor de corriente eléctrica y un potencial impuesto. 57 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” REFERENCIAS BIBLIOGRAFICAS Alatorre, F.A. Moeller, G. (2006). “Influencia De Las características Hidráulicas Y Geométricas De Biofiltros empacados Sobre La Eliminación De Un colorante Azo” Xv Congreso Nacional De Ingeniería Sanitaria Y Ciencias Ambientales. Astiasaran, Iciar y Martínez, J. Alfredo, (2003), Alimentos y nutrición en la práctica sanitaria. Ed. Díaz de santos. Madrid. Beyer, H. y Walter, W,( 1987), Manual de Química Orgánica, Ed. Reverté, España. Castillo Méndez, (2010) “Fundamento De Los Reactores Electroquimicos”. Cabral Goncalvez I.,S.Pentha,M.Matos,ARSantos,F. Franco and HM Pinherio.(2005). Evaluation o fan integrated anerobic/aerobic SBR system for the treatment of wool dyeing effluents. Biodegradation. 16, 81-89. Clavijo Díaz,(2002), Fundamentos de química analítica. Equilibrio iónico y análisis químico. Bogotá Colombia Fernández, J; KIWI,J, Fotocatálisis de Naranja 11 con TIO2inmovilizado, Efecto del pH y el peróxido de hidrogeno, universidad de Concepción, 2003. F. Klages, (2006), Tratado de Química Orgánica. Tomo I. Ed. Reverté. México. Gilbert W. Castellan,Fisicoquimica, Longman,Mexico D.F. 1998 Garcés Giraldo, Luis Fernando; RODRIGUEZ R, Alejandra, Evaluación de 2da edicion, Addison Wesley la fotodegradación sensibilizada con TIO2 Y Fe3+ para aguas coloreadas Corporación Universitaria Lasallista, 2004. Garzón Jiménez, (2009), Cinética De Degradación de Colorantes Textiles De Diferentes Clases Químicas Por hongos y Bacterias Inmovilizados Sobre Fibra De Agave Tequiliana Webber Var.Azul. Pontificia Universidad Javeriana (Colombia) y el Instituto Politécnico Nacional (México). 58 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” Harris, Daniel Charles (2003). Quantitative chemical analysis. San Francisco: W.H. Freeman. Inés Restrepo T., Luis Darío Sánchez T., Alberto Galvis C., Jhonny Rojas M., Janeth Sanabria, (2007). Avances en investigación y desarrollo en agua y saneamiento para el cumplimiento de las metas del milenio, Ed. Universidad del Valle, Cali Colombia. John McMurry (2008), Química Orgánica. Séptima edición. México. Karkmaz, M; MUZENAT, Degradación fotocatalítica de colorante azoamaranto para alimentos, mineralización del grupo azo nitrógeno Universidad de Lyon, 2004. Lachhebm, Hinda. PUZENAT, Eric.(2002). Photocatalyctic degradatión of varioustyps of dyes (Alizarin S, Crocein Oranje G, Methyl Red, Congo Red, Methyle Blue in WatER by UV-irradiated titania. EN: applied Catalysis. Martins M.A.M., Et. Al. (1999). Biodegradation of Azo Dyes by the Yeast Candida zeylanoidesin Batch Aerated Cultures. Chemosphere. 38(11), 2455-2460. Nuria Cubero, Albert Monferrer, Jordi Villalta, (2002), Aditivos Alimentarios. Ed. Aedos, s.a. Razo F. E. et al. (1997). Complete Biodegradation of the Azo Dye Azodisalicylate under Anaerobic Conditions. Environ. Sci. Technol. 31, 2098-2103. Raymond Chang, (2002), Química Orgánica. Ed. McGraw-Hill. México. Rodriguez Torres I., Caracterizacion del transporte de masa para un reactor de flujo canal con electrodos bidimensionales (1996); Universidad Autónoma Metropolitana- Iztapalapa, México D.F. Van der Zee FP. (2002). Anaerobic azo dyereduction. Ph. D. thesis. Wageningen Universiteit. Netherlands. 154 pp. Weininger, Stermitz, (1988). Química Orgánica. Ed. Reverté, México. YIZHONG, Wang (2000). Solar photo catalytic degradation of eight commercial dyes in TIO2.EN: catalysis Today.Vol 34.p.98-111. 59 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” CONSULTAS EN INTERNET 1 http://www.fisicanet.com.ar/quimica/electrolisis/ap07_electrolisis.php 2 www.asifunciona.com/electrotecnia/ke_corriente_electrica/ke_corriente_ele ctrica_1. htm 3 www.infoambiental.es/resultados//search/77/degradacion/de/azul/de/metilen o/por /fotocatalisis 4 Universidad de Alicante. http://cv1.cpd.ua.es. Fecha de consulta 31/05/2011. 5 MOELLER, Gabriela. Tratamiento de Aguas Residuales Industriales www.ai.org.mx Fecha de consulta 31/05/2011 6 Universidad de Santiago de Compostela. http://www.usc.es/biogrup. Fecha de consulta 31/05/2011 7 www.psa.es/webesp/areas/quimica/docs/descontaminacion_mediante_fotoc atalisis.pdf 8 GARCÉS G, Luis Fernando, Mejía F, Edwin Alejandro, SANTAMARÍA A, Jorge Ivan. 2003. La fotocatálisis como alternativa para el tratamiento de aguas residuales. Revista lasallista de investigación, articulo pdf. http://lasallista.edu.co. Fecha de consulta 08/01/2011 9 FEIGELSON, L. MUSZKAT, L. BIR, L. MUSZKAT, K.A.(2003). Dye Photo Enhancement of TIO2 – polluntants.Theorganobromine PhotocatalizedDegradatión Herbicide of Organic Bromacil.(Articulo de internet).www.konectic.org.kr/koneticreport/analreport/a1aa25_08.htm. Fecha de consulta 10/07/2011 60 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” ANEXOS 61 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” ANEXOS GLOSARIO Curva de calibración La curva de calibrado es un método de química analítica empleado para medir la concentración de una sustancia en una muestra por comparación con una serie de elementos de concentración conocida. Se basa en la existencia de una relación en principio lineal entre un carácter medible y la variable a determinar (la concentración). Contaminación del agua La contaminación del medio ambiente por las materias residuales que resultan de las actividades humanas es uno de los problemas más importantes y complejos con los que enfrenta la humanidad. La contaminación del agua puede ser producida por materias muy diversas procedentes de efluentes domésticos e industriales y produce alteraciones físicas, químicas y biológicas. La demanda química de oxígeno (DQO) Es un parámetro que mide la cantidad de sustancias susceptibles de ser oxidadas por medios químicos que hay disueltas o en suspensión en una muestra líquida. Se utiliza para medir el grado de contaminación y se expresa en miligramos de oxígeno diatómico por litro (mgO2/l). Aunque este método pretende medir principalmente la concentración de materia orgánica, sufre interferencias por la presencia de sustancias inorgánicas susceptibles de ser oxidadas (sulfuros, sulfitos, yoduros...), que también se reflejan en la medida. La demanda biológica de oxígeno (DBO). Es un parámetro que mide la cantidad de materia susceptible de ser consumida u oxidada por medios biológicos que contiene una muestra líquida, disuelta o en suspensión. Se utiliza para medir el grado de contaminación, normalmente se mide transcurridos cinco días de reacción (DBO5), y se expresa en miligramos de oxígeno diatómico por litro (mgO2/l). El método de ensayo se basa en medir el 62 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” oxígeno consumido por una población microbiana en condiciones en las que se ha inhibido los procesos fotosintéticos de producción de oxígeno en condiciones que favorecen el desarrollo de los microorganismos. La curva de consumo de oxígeno suele ser al principio débil y después se eleva rápidamente hasta un máximo sostenido, bajo la acción de la fase logarítmica de crecimiento de los microorganismos. Oxígeno Disuelto OD. Es la medida del oxígeno disuelto en el agua, expresado normalmente en ppm (partes por millón). La solubilidad del oxígeno en el agua depende de la temperatura: a mayor temperatura menos oxígeno se disuelve. Por otra parte si el agua está contaminada tiene muchos microorganismos y materia orgánica y la gran actividad respiratoria disminuye el oxígeno disuelto. Un nivel alto de OD indica que el agua es de buena calidad pH. Es un número que nos indica la concentración de hidrogeniones de una disolución. Dado un pH cualquiera, por ejemplo, 7, la concentración de iones H3O+ será de 10 elevado a - el número de pH, por ejemplo, en este caso: 10-7. Si el pH es 7 la disolución es neutra (igual número de iones H3O+ que de iones OH-. Si el pH es mayor que 7 la disolución es básica, también llamada alcalina; y si el pH es menor que 7 la disolución es ácida Reductor. Ambiente o sustancia química que induce la reducción mientras él se oxida. Efluentes. Suelen ser líquidos o gases producidos por las industrias o como consecuencia de la cloacas de los hogares urbanos, que se liberan en el medio ambiente, pueden ser tratadas o no tratadas. Demanda Biológica de Oxígeno: DBO Es el oxígeno que se consume en un determinado volumen de agua en un plazo fijo de tiempo de tiempo (5 días), a una temperatura estándar (15ºC y en 63 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” condiciones de oscuridad. Nos indica la materia orgánica presente en el agua, porque cuanta más hay, más activas estarán las bacterias aerobias, y más oxígeno se consumirá. Por tanto si la DBO es alta indica contaminación y mala calidad de esta agua y al revés. Electrólisis. Disociación del agua por electrólisis.- Ruptura de la molécula de agua en moléculas de oxígeno e hidrógeno. A continuación se presentan los primeros resultados obtenidos en las veintisiete pruebas realizadas, cada una con sus respectivas condiciones de trabajo. Tabla 1 Anexos. Experimentos Experimento a b aB aBc aBC Abc Ac AbC Ab Bc Ab ABC Ac abC C Abc A BC bC AC C B Bc Abc A Ac B 1 Cu Cu Cu Cu Cu Cu Cu Al Fe Fe Fe Cu Al Fe Cu Al Al Fe Al Al Al Fe Fe Fe Al Al 1.5 1.5 1.5 1 0.5 0.5 1 1.5 1 1.5 1 1 0.5 1.5 0.5 1.5 1 0.5 0.5 1.5 1 1 0.5 0.5 1 0.5 c Micromoles diferencia 5 7 9 7 7 9 5 7 5 9 9 9 7 7 5 9 9 9 9 5 7 7 5 7 5 5 16.8 11.2 10.1 9.7 4.1 3.7 3.4 3.4 3.0 2.7 2.7 2.6 2.6 2.4 2.2 2.1 1.9 1.7 1.6 1.5 1.5 1.4 1.3 1.1 0.7 0.7 6.6 0.0 7.7 6.1 6.3 6.6 5.1 0.0 12.6 13.8 14.6 6.5 0.0 7.8 0.2 0.0 17.3 15.3 2.9 0.0 0.0 8.7 11.1 10.9 0.0 0.0 64 “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” AB Fe 1.5 5 0.5 6.0 Este gráfico representa en color azul la cantidad de corriente consumida por cada uno de los electrodos, por lo tanto quien más consume corriente es quien es menos conductor de electricidad A continuación se muestra en orden descendente la eficiencia de cada uno de los electrodos y se observa a través de la tabla 1 anexos que el mejor electrodo es el cobre. Figura.2 Anexos. Eficiencia de los electrodos 18.0 16.0 14.0 12.0 10.0 8.0 6.0 4.0 2.0 0.0 65 AB 1 b Ac A Abc bc B C AC bC BC a A… c abC Ac A… Ab Bc ab A… ac abc aBc aB 20.0 18.0 16.0 14.0 12.0 10.0 8.0 6.0 4.0 2.0 0.0 a… Figura.1 Anexos. Micromoles degradados de color guinda “DEGRADACIÓN DE COLORANTES (AZUL DE METILENO) POR MÉTODO ELECTROQUÍMICO” Resultado de pruebas exhaustivas Este grafico representa la degradación del colorante en pruebas exhaustivas todas a un potencial impuesto de 1.5V y un tiempo de 3 horas. Figura.3 Anexos. Eficiencia pruebas exhaustivas 100 93.5 88.9 90 80.9 80 70 63.1 62.6 60 50 40 30 20 10 1.5 1.5 1.5 1.5 1.5 0 1 AC Cu 2 aB Cu aBc Cu ABc Fe AB Fe 66