DEPARTAMENTAL AREA QUIMICA Categoría: 3ro Secundaria
Anuncio

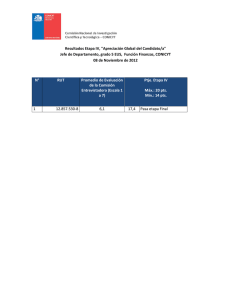
TERCERA ETAPA: DEPARTAMENTAL AREA QUIMICA Categoría: 3ro Secundaria Número de Examen 20 de agosto de 2011 Año Internacional de la Química 1. (10 pts., 1 pto/c.u)Indique si es verdadera (V) o falsa (F) cada una de las siguientes afirmaciones: a) Una estructura de resonancia es una representación adecuada de la molécula real ( F ) b) Un anión es más grande que su átomo neutro (V) c) Lantánidos y actínidos tienen incompleto el orbital d (F) d) El valor de la constante Kp depende de las presiones de reactivos y productos ( F ) e) El elemento con un Z = 8 es una sustancia paramagnética (V) f) La oxidación es ganancia de electrones (F) g) Los enlaces covalentes dobles son más cortos que los enlaces covalentes triples ( F ) h) Los sólidos se dividen en dos categorías: cristalinos y amorfos (V) i) La tabla periódica actual se basa en el peso atómico del elemento (F) j) La electronegatividad es una medida de la carga negativa de un elemento (F) 2. (20 pts.)Se tiene el sistema que se muestra en la figura. Al principio todas las llaves de paso se encuentran cerradas, entonceséstas se abren y rápidamente se produce la reacción: CO + O2→ CO2 los otros gases Ar y He son inertes y por tanto no reaccionan. Si la temperatura permanece constante a 27 oC y los pesos atómicos son: Ar = 40, O = 16, He = 2, y C = 12. a) ¿Cuál es el número de moles de Ar en el sistema? 0,17 moles Ar 1 pto. b) ¿Cuál es el número de moles de He en el sistema? 0,35 moles He 2 pts. c) ¿Cuál es la presión del He al final del proceso? 0,861 atm 2 pts. d) ¿Cuál es el número de moles de CO2 en el sistema al final del proceso? e) ¿Cuál es la presión total al final del proceso? 5,672 atm 1,25 moles CO3pts. 2 4 pts. f) ¿Cuál es la composición de la mezcla gaseosa (en fracciones molares) al final del proceso? 4 pts. XAr=0,07 XHe = 0,15 XCO2 = 0,54 XCO = 0,23 g) ¿Cuál es la presión parcial de cada gas en la mezcla al final del proceso? PAr=0,418 atm PHe = 0,861 atm PCO2 = 1,318 atm PCO = 3,075 atm 4 pts. 3. (15 pts.)La alicina, un compuesto orgánico formado por C, H, O y S, es el compuesto que proporciona el olor característico al ajo y de múltiples propiedades farmacéuticas (antibacteriano, antiviral, anticancerígeno, contra la presión arterial, etc.). Al realizar un análisis de este compuesto se encuentra que tiene la siguiente composición porcentual: C:44,41%, H:6,21%, S:39,51%, O:9,86%. También se encuentra que su masa molar es igual a 162 g/mol. (Pesos atómicos: C = 12, H = 1, S = 32, O = 16) a) ¿Cuál es la fórmula empírica de este compuesto? C6H10OS2 4 pts. b) ¿Cuál es el peso molecular empírico de este compuesto? 162 ó 162 g/ mol 4 pts. c) ¿Cuál es la fórmula molecular de la alicina? C6H10OS2 3 pts. d) Sabiendo que la constante crioscópica (Kf) del agua es1,86 °C·kg/mol. Si se disuelven 16,2 g de alicina en 100g de agua. ¿Cuál es la temperatura de fusión (de congelamiento) de esta disolución? -1,86oC 4 pts. Pag. 1/2 1ra OCEPB - Categoría: 3ro Secundaria 4. (20 pts.) El Estaño, Sn, de peso atómico 118,70 y número atómico 50 está en el grupo IV del sistema periódico, sus isótopos en orden de abundancia son: 120, 118, 116, 119. Tiene valencias de +2 y +4. De los nueve minerales, que contienen estaño, hallados en la corteza terrestre, solo uno, la casiterita SnO2, tiene importancia industrial. Los otros minerales principales son la estannita, Cu2FeSnS4, y la tealita, Pb(Zn)SnS2. La determinación del estaño en minerales puede hacerse por análisis volumétrico. El estaño se disuelve con ácido clorhídrico, se reduce por digestión con alambre de níquel o de hierro, se enfría en atmósfera protectora de dióxido de carbono y se “valora” o “titula” con solución de dicromato de potasio, según la reacción: Dicromato de potasio + cloruro estannoso + ácido clorhidrico = Cloruro crómico + cloruro estánnico + cloruro de potasio + agua a) Escribirla ecuación química de valoración del estaño con dicromato de potasio debidamente igualada. K2Cr2O7 + 3 SnCl2 + 14 HCl → 2CrCl3 + 3SnCl4 + 2 KCl + 7 H2O 5 pts. b) Escribir la semirreacción de reducción + -2 6 e- + 14 H + Cr2O7 3 pts. → 2Cr+3 + 7 H2O c) ¿Cuál es el peso equivalente del agente oxidante? 49 g K2Cr2O7 2 pts. d) Si se hacen reaccionar 5 g de dicromato de potasio, en la reacción de valoración ¿Cuántos gramos de cloruro estánnico se forman? 13,3 g SnCl4 3 pts. e) ¿Qué peso de dicromato de potasio se requiere para preparar 500 ml de una solución 0,1N? 2,45 g K2Cr2O7 3 pts. f) 1,5 g de un mineral de estaño se disuelven con HCl, luego se reduce (a cloruro estannoso) por digestión con alambre de hierro, y finalmente se “valora” o “titula” con solución de dicromato de potasio, gastandose 35,5 ml de esta solución. ¿Cuál es el porcentaje de estaño en el mineral? 4 pts. 14 % Sn K = 39 Cr = 52 Sn = 118,70 O = 16 H = 1 Cl = 35,5 Cu = 63,55 Fe = 55, 85 S = 32 5. (15 pts.) Al Considere la siguiente reacción a 127º C: A2(g) + B2(g) 2 AB(g) La mezcla de un mol de A2 con tres moles de B2 da origen a x moles de AB en equilibrio. La adición de 2 moles más de A2 produce otros x moles de AB. En el equilibrio, antes de la adición de los dos moles de A2 moles de B2 a) ¿Qué cantidad de moles de B2 están presentes? 2 pts. En el equilibrio, después de la adición de los dos moles de A2 b) ¿Qué cantidad de moles de A2 están presentes? c) ¿Cuál es el valor de x? 3/2 (3 – x) moles A2 3 pts. 5 pts. d) ¿Cuál es el valor de la constante de equilibrio Kc? 4 3 pts.y ¿Cuál es el valor de Kp? 4 2 pts. 6. (20 pts.) Se han de preparar 1,8 litros de disolución 2 Nen NaCl. Para ello, se empleará una solución de ácido 3 clorhídrico de densidad 1,165 g/cm del 33.16 % en peso, y una solución de sosa caústica(NaOH) de densidad 1,380 g/ cm3y del 35,01 % en peso de NaOH. a) ¿Cuál es el volumen de la solución de acido clorhídrico a emplear? b) ¿Cuál es el volumen de la solución de sosa caústica a emplear? 340,1 cm3 298,1 cm3 50 cm3 de esta solución resultante se mezclan con 150 cm3 de una solución de nitrato de plata 1 N. c) ¿Cuantos gramos de cloruro de plata se forman? d) ¿Cual es la concentración en iones sodio? 14,35 g AgCl 0,5 N 0,75 N e) ¿Cuál la concentración en iones nitrato? 4 pts.Pag. 2/2 4 pts. 4 pts. 4 pts. 4 pts.