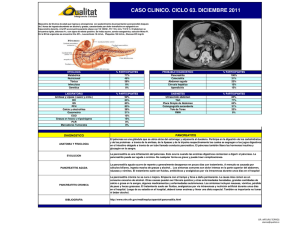
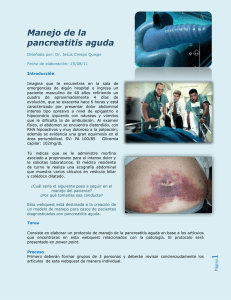
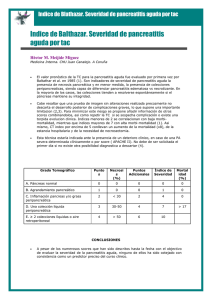
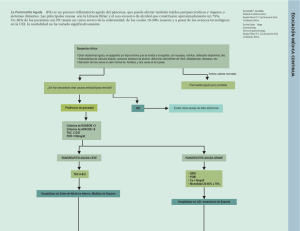
pancreatitis aguda - Enfermeria en Atención al Enfermo Crítico
Anuncio

PANCREATITIS AGUDA GRAVE El presente artículo es una actualización al mes de enero del 2006 del Capítulo del Dr. Carlos Lovesio, del Libro Medicina Intensiva, Dr. Carlos Lovesio, Editorial El Ateneo, Buenos Aires (2001) DEFINICIÓN Un Simposio realizado en Cambridge en 1984 definió a la pancreatitis aguda como cualquier episodio con características clínicas de inflamación aguda del parénquima pancreático, sea cual fuere el estado morfológico o funcional de la glándula antes o después del ataque. En cambio, se denominó pancreatitis crónica a la inflamación continuada e irreversible de la glándula, asociada a la pérdida progresiva de la función pancreática. En el año 1988 un nuevo Simposio efectuado en Marsella aceptó las mismas definiciones. La definición precedente es anatómica, y a ella no se le pueden superponer en forma precisa las manifestaciones clínicas. En efecto, la pancreatitis aguda se presenta con cuadros clínicos variables, desde las formas graves, colapsantes, hasta las formas silenciosas, que se revelan tardíamente por la aparición de un derrame pleural o de un seudoquiste del páncreas. Debido a que la terminología utilizada en la literatura en relación con la pancreatitis aguda era muy variable, confusa y en ocasiones conflictiva, en 1992 se reunieron en Atlanta, EE.UU, 40 expertos internacionales a los fines de establecer un sistema de clasificación basado en la clínica (Bradley E.: Arch Surg 128:586-1993). Si bien no constituye un sistema de clasificación perfecto, puesto que existen formas intermedias de la enfermedad, el mismo proporciona una base más exacta para los estudios experimentales y para el manejo clínico de la enfermedad. Las definiciones aceptadas son: Pancreatitis aguda. Es un proceso inflamatorio agudo del páncreas, con compromiso variable de otros tejidos regionales o de sistemas orgánicos a distancia. Pancreatitis aguda severa (PAS). La PAS se caracteriza por la presencia de necrosis parenquimatosa, necrosis de la grasa retroperitoneal, fallo sistémico, un cuadro clínico tormentoso y el desarrollo de complicaciones potencialmente letales. Afecta al 20 al 25% de los pacientes que desarrollan una pancreatitis. Se considera que un paciente es portador de PAS si presenta alguno de los siguientes criterios: 1. Fallo orgánico con uno o más de los siguientes: shock (presión arterial sistólica < 90 mm Hg), insuficiencia respiratoria (PaO2 <60 mmHg), insuficiencia renal (creatinina sérica > 2 mg/dl luego de la hidratación) y sangrado gastrointestinal (> 500 ml en 24 horas) 2. Complicaciones locales tales como necrosis, pseudoquistes o abscesos 3. Al menos 3 de los criterios de Ranson (ver más adelante) 4. Al menos 8 de los criterios del APACHE II. Se ha comprobado que la falla orgánica que se presenta en la primera semana, si se resuelve dentro de las 48 horas, no es un indicador de un ataque severo de pancreatitis aguda. Pancreatitis aguda leve (PAL). La PAL se asocia con mínima disfunción orgánica y con una recuperación sin inconvenientes, y no presenta las manifestaciones citadas para la PAS. Colecciones fluidas agudas. Las colecciones fluidas agudas se producen precozmente en el curso de la pancreatitis aguda, en general asociadas a las formas severas de la enfermedad. Se localizan en o próximas al páncreas, y generalmente carecen de pared, ya sea de tejido de granulación o fibroso. Necrosis pancreática. Es un área o áreas localizada o difusa de parénquima pancreático no viable, que habitualmente se asocia con necrosis grasa peripancreática. La tomografía axial computada dinámica con contraste es la técnica diagnóstica para establecer la presencia de necrosis pancreática (ver más adelante). La necrosis se desarrolla precozmente en el curso de la pancreatitis aguda, y habitualmente está bien establecida a las 96 horas luego del inicio de los síntomas clínicos. La distinción clínica entre necrosis pancreática estéril e infectada es muy importante, puesto que la aparición de infección en los tejidos necrosados se asocia con una elevada morbilidad y mortalidad. Debido a que los hallazgos clínicos y de laboratorio son similares en ambos casos, esta importante distinción debe ser realizada con cultivos obtenidos por punción aspiración transcutanea. Pseudoquiste agudo. Es una colección de jugo pancreático dentro de una pared de tejido fibroso o de granulación que se produce como consecuencia de una pérdida persistente de jugo pancreático desde el conducto pancreático, y que persiste por más de cuatro semanas. Absceso peripancreático. Es una colección circunscripta de pus intraabdominal, habitualmente en la proximidad del páncreas, conteniendo escasa o nula cantidad de necrosis pancreática, que se produce como consecuencia de una pancreatitis aguda o de un traumatismo pancreático. En la Fig. 1, tomada de Beger y colaboradores, se indica el curso y las probabilidades evolutivas de la pancreatitis aguda, adaptados a la clasificación precedente. Comienzo PANCREATITIS AGUDA Día 1-4 Leve Día 6-21 Resolución sin complicaciones Semana 4-7 Grave (necrotizante -10 a 20%) Necrosis estéril (60%) Necrosis infectada (40%) Pseudoquiste Absceso (3-4%) Fig. 1- Curso y posibilidades evolutivas de la pancreatitis aguda. ETIOLOGÍA La enfermedad litiásica del tracto biliar, en particular la litiasis coledociana, es el proceso patológico más frecuentemente relacionado etiológicamente con la pancreatitis aguda. En la estadística de nuestro medio, la litiasis biliar se registra en alrededor del 70% de los casos de pancreatitis aguda. Diehl y colaboradores han demostrado que el factor de riesgo más importante es el tamaño de los cálculos, ya que los pacientes portadores de al menos un cálculo de menos de 5 mm de diámetro, tienen un riesgo cuatro veces mayor de presentar un episodio de pancreatitis aguda. Los autores estadounidenses y franceses destacan la frecuente asociación del alcoholismo con la pancreatitis aguda. Olsen, en una evaluación prospectiva de 100 pacientes con pancreatitis aguda, encontró que en el 54% de ellos el alcohol era el factor causal. El mecanismo por el cual el alcohol produce pancreatitis es desconocido; se ha sugerido que actúa directamente sobre las células acinosas del páncreas. Los traumatismos cerrados del abdomen, así como la cirugía abdominal, en particular la exploración de la vía biliar, pueden determinar un tipo particular de pancreatitis aguda. La litotricia extracorpórea para la desintegración de cálculos en la vía biliar se ha asociado con una frecuencia de pancreatitis aguda del 0,003 al 3%. La pancreatitis es una complicación a tener presente luego de la colangiopancreatografía endoscópica retrógrada. El transplante de órganos se asocia con un aumento del riesgo de desarrollo de pancreatitis aguda. En una serie reciente, se demostró una incidencia de 1,8% en recipientes de transplante cardiaco, de 1,6% en recipientes de transplante renal, y en el 1,5% de transplantes hepáticos. La pancreatitis aguda asociada con el transplante de órganos tiene una alta mortalidad si se presenta precozmente luego del procedimiento. La hipertrigliceridemia marcada, con un nivel de triglicéridos habitualmente superior a los 1.000 mg/dl, puede ser una causa ocasional de pancreatitis. La patente habitual es la del tipo V de dislipidemia. La hipercolesterolemia, en contraste con la hipertrigliceridemia, no produce pancreatitis. La causa infecciosa más frecuente de pancreatitis es el virus de la parotiditis. Causas menos frecuentes incluyen la infección por el virus de la inmunodeficiencia humana, el citomegalovirus, la fiebre tifoidea, la salmonelosis y la leptospirosis. Una causa rara de pancreatitis es el hiperparatiroidismo. En estos casos la enfermedad cursa con hipercalcemia. Ciertas drogas, tales como la azatioprina, diuréticos tiacídicos, fursemida, ácido etacrínico, sulfas, metronidazol, pentamidina, tetraciclina, eritromicina, estrógenos, ddI y ácido valproico se han mencionado como factores causales de pancreatitis aguda. Una serie de causas misceláneas pueden producir pancreatitis aguda: tumores pancreáticos o ampulares, cuerpos extraños obstruyendo la papila, coledococele, hipertensión del esfínter de Oddi, enfermedad de Crohn, síndrome de Reye, hipotermia, hemólisis intravascular aguda, porfiria, lupus sistémico, poliarteritis nodosa, hipertensión maligna y otras. En el 15 al 25% de los casos de pancreatitis aguda no se logra identificar ninguna causa; esto se define como pancreatitis idiopática. Estudios recientes mediante el examen de la bilis obtenida por endoscopía duodenal y seguidos con ecografías seriadas establecen que hasta el 70% de estos casos pueden ser originados por una microlitiasis biliar oculta o por la presencia de barro biliar. ANATOMÍA PATOLÓGICA La pancreatitis aguda se caracteriza por lesiones macroscópicas de edema, de hemorragia y de necrosis. La hemorragia y la necrosis no son hallazgos constantes. Clásicamente, se distinguen dos variedades anatómicas: la pancreatitis edematosa o intersticial y la pancreatitis necrosante y hemorrágica. En la pancreatitis aguda edematosa, el páncreas está tumefacto, turgente, y al corte es friable y muestra los lóbulos separados por edema (Fig. 2). La necrosis grasa es muy limitada. Este proceso inflamatorio tiende a recidivar varias veces, no progresa hacia formas más graves y cura en general sin secuelas. En la pancreatitis aguda necrosante se observan, además de las lesiones precedentes, signos de necrosis de la glándula, originados en particular por la acción de enzimas lipolíticas y proteolíticas. La necrosis grasa, o citoesteatonecrosis, es signo de pancreatitis aguda necrosante. Esta se presenta bajo forma de pequeñas placas opacas, sobreelevadas, dispersas por la cavidad peritoneal. El páncreas es el punto de partida de lesiones necróticas y hemorrágicas que varían considerablemente en extensión y que pueden englobar la casi totalidad del órgano (formas masivas) o segmentos aislados de éste (formas parciales o de pequeños focos) (Fig. 3). En la histología, se observa en la periferia de los focos de necrosis lengüetas destructivas que se extienden a lo largo de los espacios interlobulares. Se aprecian además importantes lesiones vasculares y linfáticas, con inflamación y necrosis de la pared de los vasos. Fig. 2.- Pancreatitis edematosa. Fig. 3.- Pancreatitis necrotizante. Obsérvense las manchas de citoesteatonecrosis sobre el páncreas y el material extraído en el acto quirúrgico. En adición a la presencia de necrosis parenquimatosa pancreática, la extensión del proceso necrotizante a los tejidos retroperitoneales extrapancreáticos, incluyendo los compartimentos retroperitoneal para y retrocólico, fosas perirenales y tejidos perivasculares, es un factor importante en el curso de la enfermedad y afecta considerablemente la severidad clínica y la mortalidad. Los procesos necróticos quedan localizados en la retrocavidad de los epiplones o invaden la gran cavidad peritoneal, dando lugar a distintas formas clínicas. Por otra parte, los focos de necrosis pueden evolucionar hacia la resolución, creando una cicatriz fibrosa, o sobreinfectarse secundariamente y originar un absceso. Los restos necróticos y el jugo pancreático pueden organizarse y generar un seudoquiste, de localización extrapancreática, peripancreática o intrapancreática. Las formas necrohemorrágicas de pancreatitis aguda presentan como base fisiopatológica una agresión vascular intensa brusca, que produce rápidamente necrosis; no progresa ni recidiva, pero su magnitud puede ser tal que con frecuencia variable conduce a la muerte. Se debe tener presente que las lesiones patológicas de la pancreatitis aguda pueden tener distintos patrones evolutivos, tal como se indicará en el apartado de complicaciones locales. FISIOPATOLOGÍA A pesar de existir una gran cantidad de datos experimentales y clínicos, la patogenia de la pancreatitis aguda es aún motivo de controversia. Si bien se admite que en la pancreatitis asociada con la enfermedad litiásica la migración de un cálculo a través de la ampolla de Vater puede relacionarse con el inicio del episodio (Acosta, Kelly), la explicación de porque esto ocurre no es clara. De acuerdo a Kelly y colaboradores, si bien los cálculos pueden iniciar un ataque, no son los causantes de la progresión de la enfermedad. Aunque muchos factores etiológicos pueden desencadenar una pancreatitis aguda, sin embargo, una vez que el proceso inflamatorio se ha iniciado, la evolución final es relativamente independiente del agente causal. Por otra parte, la pancreatitis aguda tiene un amplio espectro de manifestaciones clínicas, que varían entre las formas edematosas, autolimitadas, con un pronóstico benigno, hasta la inflamación necrotizante severa con una evolución fatal. La pancreatitis aguda severa frecuentemente produce una respuesta inflamatoria sistémica, caracterizada por el deterioro de la fisiología normal y por el desarrollo de falla multiorgánica. Muchas investigaciones experimentales recientes tienden a aceptar que la lesión inicial en la pancreatitis aguda afecta a la célula acinar. La liberación no controlada y la activación intrapancreática de las enzimas digestivas desencadenan una compleja cascada de eventos en los cuales los blancos más prominentes son los vasos capilares y las células endoteliales. Las alteraciones resultantes en la hemodinámica pancreática, el aporte de oxígeno, y la liberación de mediadores inflamatorios desempeñan un rol significativo en la progresión rápida a la necrosis y a la autodigestión. Los disturbios del calcio intracelular son eventos precoces en la pancreatitis aguda. La liberación de moléculas inflamatorias también produce efectos sistémicos, tales como el síndrome de pérdida capilar, fiebre e hipotensión. Estos efectos combinados pueden producir necrosis del páncreas y estimular la apoptosis (Fig. 4). Abuso de alcohol Obstrucción del tracto biliar Otras causas Daño de las células acinares Inflamación local del páncreas Activación de células dendríticas, macrófagos, fibroblastos, células T y células endoteliales TNF IL-1β IL-6 Quemoquinas (IL-8) PAF Sustancia P Respuesta proinflamatoria local Respuesta local contenida Pro Anti Receptores solubles TNF IL-10 Agonistas receptor IL-1 Respuesta antiinflamatoria sistémica Migración de mediadores proinflamatorios a la circulación Pro Anti Resolución SRIS - FMO Fig. 4.- Posibles factores mediadores de la injuria e inflamación en la pancreatitis aguda. Recientemente se ha establecido que durante los primeros 30 minutos de un ataque agudo de pancreatitis, y dependiendo de la presencia y grado de lesión pancreática, se producen y liberan una variedad de compuestos tóxicos, biológicamente activos, al torrente circulatorio. Se han detectado niveles elevados de tripsinógeno en sangre y orina, péptidos activados por el tripsinógeno, fosfolipasa A2 y elastasa de polimorfonucleares en pacientes con pancreatitis aguda. Por otra parte, una gran cantidad de mediadores inflamatorios del tipo de las citoquinas también son producidos en la pancreatitis aguda y aislados de sangre y líquido ascítico. La segunda fase de la enfermedad está caracterizada por la repercusión sistémica. Actualmente existen numerosas evidencias de que tanto el síndrome inflamatorio como la falla pluriparenquimatosa son la consecuencia de una respuesta inmunometabólica descontrolada, similar a la que origina el síndrome de falla pluriparenquimatosa en la sepsis y el politraumatismo. Esta respuesta consiste en la activación en cascada de los sistemas del complemento, quininas, coagulación, fibrinolisis, interleuquinas y otros. Las células efectoras son los neutrófilos, macrófagos y plaquetas, que a través de múltiples mediadores inflamatorios determinan los dos fenómenos probablemente responsables de la falla multiorgánica: la inadecuada disponibilidad de oxígeno a nivel tisular y el inadecuado empleo de oxígeno por falla celular. Los detonantes de esta respuesta en la pancreatitis aguda podrían ser el brusco desequilibrio entre proteasas y antiproteasas, por agotamiento de estas últimas, la acción del foco inflamatorio representado por las lesiones locales y el efecto sistémico de la sepsis. CUADRO CLÍNICO Síntomas El síntoma fundamental de la pancreatitis aguda es el dolor abdominal, habitualmente intenso, gravativo, terebrante, que sume al paciente en un estado de creciente intranquilidad y temor. Sin embargo, en ocasiones el proceso es indoloro o casi indoloro. El dolor comienza muy frecuentemente en el epigastrio, y puede quedar localizado allí cuando el ataque es leve. Más a menudo, se propaga a todo el abdomen e incluso a las regiones torácica inferior y dorsolumbar. Si bien el comienzo del dolor en la pancreatitis aguda puede ser abrupto e intenso, con mayor frecuencia se desarrolla en forma paulatina y desaparece del mismo modo. La presentación abrupta e intensa es la que ocurre de ordinario cuando existen cálculos vesiculares o coledocianos. Desde el comienzo hasta que finaliza, el dolor de la pancreatitis aguda es la mayoría de las veces constante, pero ciertos dolores pueden aumentar y disminuir en intensidad siguiendo las alternativas de la distensión gaseosa, el peristaltismo, los movimientos diafragmáticos, la tos, los vómitos, etc. Los vómitos son frecuentes en la pancreatitis aguda. En los primeros momentos de la enfermedad pueden contener alimentos, son por lo general acuosos, biliosos y en ocasiones sanguinolentos. No son fecaloides, a diferencia de los de la obstrucción intestinal. Signos físicos Los signos físicos suelen mostrar amplias variaciones en su localización, extensión, intensidad y calidad, todo ello en relación con la zona pancreática interesada, la gravedad y naturaleza de los hallazgos patológicos, el estadío del ataque, la presencia, extensión o ausencia de peritonitis, ileo o ascitis, la participación de otros órganos abdominales, etcétera. El espasmo de los músculos abdominales, que inicialmente es epigástrico y moderado, se generaliza a medida que la irritación peritoneal se extiende a todo el abdomen. Falta la rigidez en tabla, característica de las perforaciones de vísceras huecas. Al tiempo que el proceso agudo evoluciona, el abdomen se distiende cada vez más por el ileo y, en algunos casos, por la ascitis. Junto con estos cambios, la percusión del abdomen demuestra timpanismo o matidez, según que se la realice sobre órganos distendidos por el meteorismo o sobre zonas de ascitis. Con el progreso del cuadro, cada vez hay menos ruidos intestinales normales, y llegan a desaparecer por completo cuando aquél alcanza su plenitud. La presencia de febrícula es común en la pancreatitis aguda. Si la temperatura se prolonga y excede en 2ºC la normal, es probable que existan una necrosis infectada o un absceso pancreático. Cuando la fiebre es elevada, en picos, y se presenta junto con escalofríos e ictericia, se debe sospechar una colangitis ascendente, posiblemente con litiasis coledociana y bacteriemia. En la mayoría de los pacientes se comprueba un aumento moderado de la frecuencia cardíaca, con presión arterial normal. La taquicardia persistente se asocia con una evolución desfavorable. En efecto, Olsen cita que de 19 pacientes cuya frecuencia cardíaca se mantuvo por encima de 120, 4 fallecieron dentro de las 48 horas del inicio de la enfermedad. En las formas más graves de pancreatitis aguda hay disnea y aun ortopnea, causadas por diversos grados de ileo, distensión abdominal, ascitis, derrame pleural, atelectasia pulmonar o condensación, hipovolemia y shock. En ocasiones se observa la aparición de signos cutáneos y subcutáneos, bajo la forma de lesiones de necrosis grasa o extravasación de sangre que contiene líquido ascítico (signo de GreyTurner: equimosis en los flancos; y signo de Cullen: equimosis periumbilical). LABORATORIO Determinaciones enzimáticas. La determinación de amilasemia y amilasuria es la prueba más sensible para la confirmación del diagnóstico de pancreatitis aguda. La amilasemia fisiológica es menor de 120 unidades internacionales por dL, mientras que la amilasuria no debe superar las 500 unidades por litro. Los valores sanguíneos y urinarios de la amilasa tienden a elevarse durante las dos o tres horas siguientes al comienzo de la pancreatitis aguda. En los ataques leves o relativamente graves retornan a la normalidad en tres a cinco días. Una elevación más prolongada es propia de la pancreatitis grave o de una recrudescencia del proceso agudo durante la recuperación. Las elevaciones séricas y urinarias de la amilasa no guardan correspondencia cierta con la naturaleza o la gravedad de la pancreatitis aguda. Por ejemplo, una pancreatitis necrótica extensa puede producir elevaciones relativamente pequeñas de las enzimas, mientras que una pancreatitis edematosa aguda puede acompañarse de valores elevados. Por otra parte, los valores obtenidos variarán en función del tiempo transcurrido desde el inicio de la pancreatitis. Con frecuencia, la elevación de los valores enzimáticos en el abdomen agudo refleja la existencia de una pancreatitis, pero deberán excluirse las causas extrapancreáticas: perforación de víscera hueca, parotiditis aguda, obstrucción del intestino delgado, rotura de embarazo tubario, trombosis de arteria mesentérica, etc. En estos casos en general la elevación no es significativa. Algunos autores han demostrado que la amilasa sérica puede ser normal en pacientes con pancreatitis aguda e hiperlipidemia. Se ha sugerido que el suero hiperlipémico puede afectar los procedimientos de laboratorio utilizados para la determinación de la amilasa, o que un inhibidor enzimático está presente en el suero de estos pacientes. En tal caso, la dilución del suero con solución salina reduce la interferencia con la determinación enzimática y permite detectar los valores reales de amilasemia. El clearance de amilasa está aumentado en casos de pancreatitis aguda. Se debe tener en cuenta, no obstante, para interpretar los resultados, el estado de la función renal. Se ha comprobado que existe una alta incidencia de resultados normales en pacientes con pancreatitis, motivo por el cual este test no se utiliza actualmente. En años recientes se han evaluado otras enzimas con el propósito de mejorar la inespecificidad de la amilasemia. En tal sentido, se estudiaron la lipasa, isoenzimas de la amilasa, elastasa, tripsina inmunoreactiva y fosfolipasa A2. Las ventajas de la determinación de la lipasa son que la actividad de la misma permanece aumentada por un periodo más largo que la de la amilasa en el suero, y que no existe otra fuente de lipasa en el organismo, lo que hace a este examen de elevada especificidad. Hemograma. El recuento de glóbulos blancos se encuentra elevado en alrededor del 50% de los pacientes con pancreatitis aguda. La hemoglobina y los valores del hematocrito superan habitualmente las cifras normales, a causa de la hemoconcentración. Bilirrubinemia. A pesar de informarse que del 15 al 20% de los pacientes con pancreatitis aguda presentan ictericia, es más común hallar cifras elevadas de bilirrubina sérica sin que haya ictericia. Por lo general no hay más de 4 a 10 mg/dl. Se deben verificar los niveles de bilirrubina en los pacientes con abdomen agudo al examinarlos por primera vez y reiterar las determinaciones, porque las cifras elevadas indican a menudo una lesión en el eje bilioduodenopancreático. Calcemia. Las modificaciones de los niveles de calcio en la pancreatitis aguda se han considerado importantes. La presencia de hipocalcemia refleja una pancreatitis aguda grave. Por el contrario, si se detectan valores de calcio por encima de lo normal, debe descartarse el hiperparatiroidismo u otro proceso productor de hipercalcemia. Glucemia. En forma inconstante se detectan hiperglicemia y glucosuria, como manifestación de la inhibición, en general transitoria, de la actividad de los islotes de Langerhans. En algunos casos, se ha descrito el desencadenamiento de coma diabético, cetogénico o hiperosmolar, como consecuencia de una pancreatitis aguda. Por excepción la pancreatitis aguda deja como secuela una diabetes. Uremia. La pancreatitis aguda suele alterar la función renal, de tal modo que se ha descrito un incremento de la urea y la creatinina plasmáticas en el 11 al 20% de los pacientes. Marcadores de necrosis. Recientemente se ha utilizado la determinación de la proteína C reactiva, la alfa1 antitripsina y la alfa2 macroglobulina para establecer la presencia de necrosis pancreática. Si bien estos marcadores séricos pueden ser altamente sensibles para la detección de la necrosis pancreática definida histológicamente, los mismos no son lo suficientemente específicos como para predecir adecuadamente que pacientes requerirán en definitiva un tratamiento quirúrgico. Se admite que un nivel de proteína C reactiva mayor de 150 mg/l después de 48 horas del inicio del dolor es indicativo de un ataque severo. Examen del líquido peritoneal. Si se detecta fluido peritoneal por una técnica de imagen en ausencia de otros elementos bioquímicos o radiológicos de pancreatitis, el fluido debe ser examinado. La evaluación microscópica del mismo puede revelar una contaminación bacteriana sugestiva de perforación. Un elevado contenido de amilasa en el fluido puede sugerir pancreatitis, aunque también puede aparecer en otras condiciones de abdomen agudo. El color del fluido peritoneal en la pancreatitis aguda varía entre claro, de color cereza o rojo-marrón, y aunque esto es de importancia pronóstica, la aspiración del mismo no es recomendable como procedimiento de rutina. DIAGNÓSTICO POR IMÁGENES Radiografías simples En la radiografía de abdomen se puede constatar la presencia de una opacidad prevertebral, colocada trasversalmente sobre las dos primeras vértebras lumbares y rebasándolas hacia la izquierda. Esta opacidad corresponde a la infiltración de los tejidos peripancreáticos y al exudado coleccionado en la trascavidad de los epiplones. Con frecuencia se observa un ileo segmentario, que afecta a las vísceras huecas directamente relacionadas con el proceso pancreático. Es muy raro que en la pancreatitis aguda se detecte la presencia de neumoperitoneo. El valor de la radiografía directa no está en su capacidad para confirmar el diagnóstico de pancreatitis aguda sino en excluir la presencia de otras patologías tales como perforación intestinal, isquemia intestinal u obstrucción intestinal. La radiografía de tórax permite demostrar la sobreelevacion del hemidiafragma izquierdo e, inconstantemente, derrame pleural o atelectasias basales en el mismo lado. En los casos severos se puede reconocer un infiltrado alveolar difuso que sugiere un síndrome de dificultad respiratoria aguda. Ecografía abdominal La ecografía es una técnica de diagnóstico muy recomendable para la evaluación inicial de la pancreatitis aguda, a causa de su bajo costo y la facilidad de realización y repetición a la cabecera del paciente. Sin embargo, la ecografía en la pancreatitis aguda requiere de un equipo de alta resolución y de un operador competente. Resultan imprescindibles los cambios de posición del enfermo y el relleno con líquido del estómago y del duodeno. Cuando se reúnen todas estas condiciones, tanto la vesícula como las vías biliares y el páncreas pueden ser reconocidos en la casi totalidad de las pancreatitis leves y moderadas. En la presentación de Oria, el 20% de 60 pacientes con pancreatitis aguda biliar presentaron ecografía normal, mientras que en el 80% restante existían uno o más signos de inflamación pancreática aguda (Fig. 5). Fig. 5.- Ecografía de abdomen. Pancreatitis aguda edematosa. Fig. 6.- Ecografía de abdomen. Pancreatitis aguda. Agrandamiento pancreático con líquido peripancreático. Litiasis superpuesta a la cabeza del páncreas. La ecografía es el método de elección para investigar las vías biliares durante la pancreatitis aguda (Fig. 6). Aun en presencia de abundante gas intestinal, tanto la vesícula como la vía biliar proximal pueden ser fácilmente identificadas si se utiliza la ventana adecuada. En la serie de Neoptolemos y colaboradores, la vesícula se visualizó en el 80% de los casos y se detectaron cálculos en el 92% de estos pacientes. Conviene realizar la ecografía al ingreso y en caso de no obtenerse una buena visualización repetirla a las 24-48 horas. Si bien la ecografía es el estudio de elección para el diagnóstico de la colelitiasis, en un tercio de los casos sus resultados no son concluyentes. En tales casos es conveniente utilizar los criterios de Bloney y colaboradores. Según los mismos, cinco factores permiten establecer el origen litiásico de la pancreatitis aguda, a saber: fosfatasa alcalina >300 UI/l, edad > 50 años, TGO > 100 UI/L, sexo femenino y amilasa > 4.000 UI/L. Cuando estos factores se analizan en pacientes sin colecistectomía previa, la presencia de tres o más permite predecir la presencia de cálculos con una certeza del 77%. El páncreas normal es visualizado por ecografía en más del 90% de los pacientes. La presencia de gas intestinal y la obesidad son factores que pueden limitar la evaluación. El páncreas normal es similar en ecogenicidad al hígado y al bazo. La pancreatitis leve produce un agrandamiento difuso de la glándula y en muchos casos, disminución de la ecogenicidad. Menos frecuentemente, el páncreas puede ser isoecoico o presentar un aumento de la intensidad. En la pancreatitis moderada o severa la ecografía no es tan útil como la TAC debido a su limitada capacidad para evaluar las colecciones fluidas peripancreáticas y la distribución extrapancreática de la enfermedad. La ecografía en cambio, permite reconocer los pseudoquistes, la dilatación del conducto pancreático y las calcificaciones pancreáticas. Endoultrasonografia La endoultrasonografia (EUS) es una combinación de la endoscopia con la ultrasonografia de alta frecuencia. Es menos invasiva que la duodenopancreatografia y se ha informado como útil para el diagnóstico de la pancreatitis aguda y la coledocolitiasis. La EUS se ha recomendado cuando la TAC y la ultrasonografia transabdominal no reconocen la presencia de litiasis en los conductos biliares. También se ha utilizado para seleccionar aquellos pacientes que se podrían beneficiar de una extracción endoscópica de los cálculos. Tomografía axial computada Las ventajas de la TAC con contraste en la estadificación de la pancreatitis aguda se basan en su capacidad de evaluar en forma directa la morfología de la glándula y el compromiso del tejido retroperitoneal peripancreático. Su particular capacidad para diagnosticar y cuantificar la necrosis pancreática representa un valioso aporte para evaluar la severidad de un ataque agudo. Además, las características de la lesión pueden servir para establecer una gradación pronóstica. Balthazar y colaboradores han sugerido una serie de guías para el empleo eficaz de la TAC en pacientes con sospecha de pancreatitis aguda. Se debe realizar una TAC inicial en a) pacientes en los cuales el diagnóstico clínico es dudoso; b) pacientes con hiperamilasemia y pancreatitis clínica severa, distensión abdominal, rigidez parietal, fiebre alta y leucocitosis; c) pacientes con un escore de Ranson > 3 o un APACHE II > 8; d) pacientes que no presentan una mejoría clínica rápida dentro de las 72 horas del inicio de la terapéutica médica conservadora, y e) pacientes que demuestran mejoría clínica inicial pero luego agravan su cuadro clínico o presentan complicaciones, incluyendo fiebre, dolor, incapacidad de tolerar la dieta oral, hipotensión o descenso del hematocrito. Una tomografía de control es recomendable en los pacientes con pancreatitis leve, sólo si se observa un cambio en el estado clínico que sugiere el desarrollo de una complicación. En los pacientes con pancreatitis grave de inicio, es recomendable realizar una TAC de control a los 7-10 días de evolución, independientemente de la evolución clínica, debido a que algunas complicaciones importantes pueden desarrollarse sin evidencias clínicas prematuras. La TAC dinámica se debe realizar en el momento del pico de perfusión arterial pancreática, utilizando un gran volumen de medio de contraste yodado. El páncreas normal sin contraste tiene un número de atenuación por TAC de 30 a 50 HU, y muestra un refuerzo homogéneo con la administración de contraste, alcanzando un número de atenuación de 100-150 HU. Las características tomográficas de la pancreatitis aguda leve o moderada incluyen un espectro de cambios variables entre una apariencia normal de la glándula sin anormalidades peripancreáticas, hasta el agrandamiento difuso, con bordes esfumados, y una leve alteración de la atenuación con la sustancia de contraste (Fig. 7). El proceso inflamatorio en general es difuso y compromete a toda la glándula. En estos casos la red capilar parenquimatosa está intacta, en general existe vasodilatación, y toda la glándula muestra un refuerzo difuso y homogéneo con aumento de al menos 50 a 60 HU sobre los valores basales de atenuación. En un pequeño número de pacientes, el diagnóstico de pancreatitis es exclusivamente clínico, ya que los estudios de imágenes no muestran anormalidades. Fig. 7.- Pancreatitis aguda dislipidémica. Necrosis peripancreática en la cabeza del páncreas. Se observa la característica lechosa del plasma (Colesterol 1200 mg/dl; triglicéridos: 1400 mg/dl). En los pacientes en los cuales la red capilar está dañada, existe una disminución marcada o una falta total de refuerzo con el contraste, en relación con el desarrollo de zonas pancreáticas de isquemia y necrosis (Fig. 8). Fig. 8.- TAC de abdomen. Pancreatitis aguda grave. Necrosis de gran parte del páncreas con reacción peripancreática. Una zona focal o difusa, bien marginada de parénquima sin refuerzo, mayor de 3 cm de diámetro o mayor del 30% del área del páncreas, se considera diagnóstica de necrosis pancreática. La exactitud total de la TAC dinámica en la detección de la necrosis pancreática es del 80 al 90%. Cuando el porcentaje de necrosis de la glándula es mayor del 30%, la especificidad de la TAC es del 100%, pero alcanza al 50% cuando sólo existen pequeñas áreas de necrosis. La presencia y extensión de la necrosis grasa peripancreática no se pueden determinar adecuadamente con la tomografía. En la pancreatitis aguda severa, existe una falta del refuerzo normal de una porción o de toda la glándula, que es consistente con el diagnóstico de necrosis pancreática. Las áreas necróticas muestran una alteración definida de la apariencia y la textura del parénquima pancreático, con disolución de los elementos blandos y licuefacción. La presencia de necrosis generalmente es conspicua alrededor de las 72-96 horas del inicio del proceso. En muchos pacientes, existen colecciones fluidas heterogéneas peripancreáticas (Fig. 9), y en ocasiones ascitis (Fig. 10). Fig. 9.- Pancreatitis necrohemorrágica. Colecciones fluidas peripancreáticas. Fig. 10.- Pancreatitis severa con ascitis hemorrágica. En el apartado de complicaciones locales se indican los hallazgos tomográficos de cada situación en particular. La TAC puede ser utilizada como un indicador pronóstico de la severidad de un ataque de pancreatitis aguda. Esto se consigue estimando la presencia y el grado de la inflamación peripancreática y o de las colecciones fluidas; y por la detección de la presencia y extensión de la necrosis pancreática (Ver Pronóstico). Resonancia magnética por imágenes Una serie de estudios recientes muestran que la MRI es un método alternativo aceptable de la TAC con contraste para evaluar la severidad y predecir la evolución de la pancreatitis aguda. La MRI permite evaluar la distribución de las colecciones fluidas agudas pancreáticas y extrapancreáticas, así como la extensión de la necrosis. Las ventajas de la MRI incluyen la detección de la necrosis sin la necesidad del empleo de material de contraste iodado, la capacidad de generar una colangiopancrea-tografía por RMI, y la detección de disrupciones en el conducto pancreático cuando se utiliza en forma concomitante secretina. Se debe tener en cuenta, sin embargo, que la colangiopancreatografia por RMI es una técnica reciente, y los resultados podrán mejorar con el aumento de la experiencia y equipos más desarrollados. Colangiopancreatografía retrógrada endoscópica (ERCP) La colangiopancreatografía retrógrada endoscópica (ERCP) es un método sensible y especifico para la detección de los cálculos en el conducto biliar y la obstrucción biliar. Esta ventaja debe ser balanceada contra la naturaleza invasiva de la ERCP y el riesgo conocido de complicaciones así como la frecuencia de canulación sin éxito, que varía entre el 5 y el 20%. Se admite que el rol de la ERCP precoz en la pancreatitis aguda biliar severa parece estar establecido cuando se asocia con sepsis biliar u obstrucción. El rol principal de la ERCP en la pancreatitis es la identificación o confirmación de cálculos en el colédoco si la ecografía o la TAC no son concluyentes, y proveer acceso para una serie de intervenciones terapéuticas incluyendo la esfinterotomía, la remoción de cálculos o la colocación de stents. Las pérdidas ductales y las fístulas que pueden aparecer en la pancreatitis crónica o en la pancreatitis traumática también son mejor evaluadas con ERCP. Se debe tener en cuenta que la ERCP puede producir una pancreatitis aguda. Se admite que la hipertensión del esfínter de Oddi, la edad joven, el sexo femenino, la pancreatitis previa, las dificultades en la canulación, las inyecciones múltiples y la realización de una esfinterotomía pancreática son factores que aumentan el riesgo de pancreatitis por ERCP. Murray y colaboradores comprobaron que la administración previa de diclofenac puede reducir la incidencia de pancreatitis aguda en pacientes con alto riesgo de pancreatitis por ERCP. En la Tabla 1 (Turner M.) se comparan las características de la ecografia, tomografia y colangiopancreatografia en el manejo de la pancreatitis aguda. Tabla 1.- Comparación de la US/CT/ERCP. Imágenes PD/CBP Imágenes del parénquima pancreático Imágenes de las estructuras peripancreáticas Exclusión de otras enfermedades Acceso para intervenciones terapéuticas Intervenciones guiadas Invasivo PD: conducto pancreático; CBP: colédoco US + + + + ++ - CT + ++ ++ ++ ++ - ERCP ++ ++ ++ ++ DIAGNÓSTICO El diagnóstico de la pancreatitis aguda se basa en la presencia de la tríada de cuadro clínico, hiperamilasemia y evidencia morfológica de inflamación pancreática. Esta última puede ser demostrada mediante métodos por imágenes (ecografía y/o TAC), cirugía o anatomía patológica. La obligatoriedad de la presencia de los tres criterios para definir el ataque es especialmente útil para aumentar la especificidad diagnóstica. COMPLICACIONES En la pancreatitis no complicada, el paciente responde habitualmente bien al tratamiento médico, y es descargado del hospital dentro de los 7 a 15 días de su internación. Sin embargo, diversas complicaciones pueden ensombrecer el pronóstico de la afección y conducir a una evolución prolongada o fatal. Las complicaciones que ocurren durante y después de un episodio de pancreatitis aguda son responsables del 2 al 10% de mortalidad asociada con esta enfermedad. La detección precoz de estas complicaciones por el cuadro clínico, los exámenes de laboratorio o los estudios de imágenes es esencial para el adecuado manejo de las mismas. Durante la última década se ha establecido que la mayoría de las complicaciones que ponen en riesgo la vida se desarrollan casi exclusivamente en pacientes con necrosis pancreática. Es útil recordar que las complicaciones graves, potencialmente letales, pueden coexistir y pueden ocurrir en cualquier momento de la historia natural de la pancreatitis aguda. Estas complicaciones pueden exhibir manifestaciones tóxicas sistémicas asociadas con falla multiorgánica, o pueden reflejar fenómenos patológicos locales confinados al páncreas y a los tejidos peripancreáticos. Una clasificación temporal de las complicaciones en precoces, intermedias y tardías es útil en la práctica clínica, debido a que las mismas tienden a ocurrir en diferentes periodos de tiempo luego del inicio de la pancreatitis aguda. Aunque existe cierta superposición en el tiempo de su ocurrencia, las complicaciones precoces que se desarrollan al inicio o dentro de la primera semana de un ataque agudo son fundamentalmente sistémicas. Las complicaciones locales y abdominales habitualmente ocurren en forma tardía, semanas o incluso meses luego del episodio agudo de pancreatitis. La naturaleza dinámica de los fallos orgánicos que se producen durante la primera semana de un ataque de pancreatitis aguda severa tienen un sustancial efecto pronóstico. Los pacientes con fallos orgánicos que se resuelven dentro de las primeras 48 horas tienen un riesgo mínimo de desarrollar complicaciones locales y muerte. En contraste, los pacientes que tienen fallos orgánicos que persisten por tres o más días tienen un riesgo de uno en tres de presentar una evolución fatal. Las complicaciones locales se producen en la mayoría de los pacientes con fallo orgánico persistente. En contraste, los pacientes con fallo orgánico transitorio tienen un riesgo del 25% de presentar complicaciones locales sintomáticas y estos pacientes excepcionalmente mueren. En la Tabla 2 (Jonson C. y colaboradores) se demuestra la relación existente entre la presencia o ausencia, y duración de la falla orgánica en la primera semana, y la subsiguiente mortalidad en 290 pacientes con pancreatitis aguda severa. Tabla 2. - Relación entre fallos orgánicos y pronóstico en pancreatitis aguda severa. Sin fallo orgánico Fallo orgánico al ingreso Transitorio Persistente Nuevo fallo orgánico dentro de los 7 días Transitorio Persistente Sobrevivientes 113 Muertos 3 Total 116 59 56 1 32 60 88 11 11 0 4 11 15 Complicaciones precoces Las complicaciones sistémicas precoces asociadas con la falla multiorgánica son responsables del 20 al 50% de la mortalidad asociada con la pancreatitis aguda. En un informe reciente, el 47% de las muertes se produjeron en una media de ocho días, secundarias a la falla sistémica y a la comorbilidad, mientras que el 53% se produjo tardíamente, con una media de 56 días, y fueron secundarias a la infección pancreática y retroperitoneal. Pancreatitis aguda y shock. Si bien el shock asociado a la pancreatitis aguda no tiene características particulares, conviene recordar, en favor del origen pancreático, su instalación en el curso de una crisis dolorosa epigástrica con vómitos y estado suboclusivo, la facies lila por combinación de cianosis y subictericia, y la posibilidad de demostrar hematomas o áreas de citoesteatonecrosis subcutánea. Desde el punto de vista fisiopatológico, se trata de un shock hipovolémico con reducción considerable del volumen sanguíneo circulante, a lo cual se puede agregar la vasodilatación asociada con la respuesta inflamatoria sistémica y la depresión miocárdica inducida por sustancias vasoactivas liberadas por el páncreas necrosado. La reducción del volumen depende de la acumulación de plasma y sangre en la zona peripancreática, y su extravasación a la luz intestinal por el ileo. Habitualmente existe hemoconcentración que se traduce por el aumento del hematocrito. En un período tardío de la enfermedad, ciertos colapsos irreversibles son causados por procesos sépticos que tienen su origen en el foco de necrosis pancreática. El shock en el curso de la pancreatitis aguda es un accidente grave, cualquiera que sea el momento de su aparición, y suele ser resistente al reemplazo de fluidos y a la administración de drogas vasoactivas. En tales casos, la evaluación hemodinámica con catéter de arteria pulmonar es fundamental para poder establecer la mejor conducta terapéutica destinada a optimizar la disponibilidad de oxígeno tisular. Pancreatitis aguda e insuficiencia respiratoria. Con frecuencia aparecen complicaciones respiratorias en la pancreatitis aguda. Los fenómenos más frecuentes son elevación diafragmática, derrame pleural, atelectasias laminares y, menos a menudo, neumonía bacteriana. Se admite que las complicaciones respiratorias son la principal causa de muerte dentro de los primeros siete días en la pancreatitis aguda. La determinación de gases en sangre con frecuencia demuestra una hipoxemia arterial clínicamente oculta en los pacientes con pancreatitis aguda. Esta hipoxemia precoz habitualmente se asocia con una alcalosis respiratoria moderada. En la mayoría de los pacientes, esta hipoxemia se resuelve con rapidez a medida que la pancreatitis mejora. El Síndrome de distress respiratorio agudo es una complicación frecuente de la pancreatitis aguda. El cuadro clínico se caracteriza por disnea progresiva con taquipnea y cianosis. Existe hipoxemia acentuada y refractaria al tratamiento con oxígeno, y el examen radiográfico demuestra un edema intersticial o alveolar progresivo. Pancreatitis aguda e insuficiencia renal aguda. La asociación de pancreatitis aguda e insuficiencia renal aguda (IRA) es relativamente frecuente, variando en las distintas series entre el 6 y el 30%. Recientemente, Kes y colaboradores comprobaron, en una serie de 563 pacientes con pancreatitis aguda, una prevalencia de insuficiencia renal aguda del 14%, pero sólo el 3,8% de los pacientes con insuficiencia renal aguda tenían una falla renal aislada. En el 68,4% se produjo un fallo multiorgánico precediendo al inicio de la IRA. Los pacientes con IRA eran significativamente mayores, tenían enfermedades crónicas preexistentes, habitualmente falla multiorgánica y complicaciones pancreáticas mayores. La mortalidad en los pacientes con IRA fue del 74,4%, en comparación con una mortalidad del 7,4% en los pacientes con pancreatitis aguda y función renal normal. En los pacientes que requirieron dialisis, la mortalidad ascendió al 95%. Muchos factores de riesgo se han implicado en el desarrollo de IRA durante la pancreatitis aguda, pero el mecanismo exacto involucrado se desconoce. Probablemente, la etiología sea multifactorial. Dentro de los factores de riesgo más importantes se incluyen la hipovolemia con deterioro de la perfusión renal, eventos vasculares y humorales mal conocidos, la coagulación intravascular y las infecciones sistémicas. Pancreatitis aguda y encefalopatía. En 1941, Rothermuch y von Hamm describieron una encefalopatía específicamente ligada a la pancreatitis. Desprovista de signos neurológicos específicos, solo puede ser reconocida por el contexto de aparición, que permite sospechar su etiología. El cuadro clínico es totalmente inespecífico: estado confusional, disartria, signos focales, trastornos del tono muscular, y evolución fluctuante. Los mecanismos responsables de esta encefalopatía son desconocidos, pero se debe tener presente que antes de establecer una relación causal directa es preciso eliminar la participación de trastornos metabólicos específicos, tales como deshidratación, hiperosmolaridad, cetoacidosis, etc.; y también el compromiso cerebral imputable a la alteración hemodinámica o a la sepsis. Pancreatitis aguda y coagulopatías. Los niveles de plaquetas y de fibrinógeno pueden estar alterados, y el tiempo de protrombina puede estar elevado durante las primeras horas que siguen a la pancreatitis aguda. La CID ha sido documentada en pacientes con pancreatitis grave. Se ha sugerido que la misma sería un factor en la patogénesis de las complicaciones locales y sistémicas de la enfermedad. En general se constata una trombocitopenia con niveles elevados de PDF circulantes. Tardíamente, en el curso de la enfermedad, la CID puede ser secundaria a la presencia de sepsis. Complicaciones metabólicas. Hasta en el 50% de los pacientes con pancreatitis aguda se constata una hiperglucemia transitoria, siendo de mal pronóstico. La progresión a una cetoacidosis diabética o a un coma hiperosmolar ha sido descripta, pero parece ser más frecuente en pacientes con hiperlipidemia. Los pacientes con cetoacidosis diabética pero sin pancreatitis pueden presentar hiperamilasemia, y el dolor abdominal simular un ataque agudo de pancreatitis severa. Una alteración metabólica comprobada en el 30 al 60% de los pacientes con pancreatitis aguda es la hipocalcemia, definida por un nivel de calcio sérico menor de 8 mg/dL. Esta anormalidad ocurre precozmente y constituye un indicador pronóstico de severidad de la enfermedad. La patogénesis de este trastorno metabólico está controvertida, siendo probablemente multifactorial. La saponificación de las sales de calcio que se produce luego de la necrosis grasa extensa puede secuestrar calcio y explicar la hipocalcemia. Hipertensión intraabdominal y síndrome compartimental abdominal. La falta de un diagnóstico y tratamiento adecuado de un Síndrome compartimental abdominal (SCA) es un factor contribuyente potencial para el desarrollo de un Síndrome de falla pluriparenquimatosa precoz en pacientes con pancreatitis aguda severa. De Waele y col. comprobaron en un grupo de pacientes con pancreatitis aguda grave, que el 78% presentaban hipertensión intraabdominal (HIA). En un estudio de 297 pacientes tratados por pancreatitis aguda severa en China (Tao H. y col.) se comprobó una incidencia total de HIA (definida por una presión intraabdominal mayor de 15 mm Hg) del 36%. La estimación corriente de la prevalencia de HIA en la pancreatitis aguda severa es de alrededor del 40%, con alrededor del 10% progresando a un SCA asociado con un aumento de la mortalidad hospitalaria. En la mayoría de los casos, el desarrollo de HIA es rápido y debido a los efectos combinados de una resucitación agresiva con fluidos y el proceso inflamatorio en el retroperitoneo que conduce al desarrollo de edema visceral y ascitis pancreática dentro de días o incluso horas de la admisión, aunque en algunos casos se ha descrito una forma tardía de SCA asociada con la emergencia de necrosis pancreática y peripancreática infectada. En el estudio de Tao y col., los pacientes que desarrollaron disfunción orgánica dentro de las 72 horas del comienzo de los síntomas presentaron una incidencia de HIA del 78%, comparado con el 23% en pacientes con pancreatitis grave sin disfunción orgánica precoz. Ello ha llevado a que se proponga la inclusión del monitoraje precoz y el tratamiento del SCA en los algoritmos de manejo de pacientes con pancreatitis aguda grave. Existe una evidencia clínica creciente que la mayor parte de las muertes en la etapa precoz de la enfermedad, que durante años se atribuyeron a una respuesta inflamatoria aguda excesiva que conducía a una falla pluriparenquimatosa precoz, en realidad está asociada con un SCA no diagnosticado y no tratado. En el estudio de de Waele, se comprobó que en los pacientes que presentaban HIA, la incidencia de insuficiencia respiratoria alcanzaba al 94%, de fallo cardiovascular al 94% y de fallo renal al 89%. En un estudio que comparó pacientes con y sin SCA tratados en terapia intensiva por pancreatitis aguda grave, la mortalidad hospitalaria para los pacientes con SCA fue del 50%, comparada con el 15% de los pacientes sin SCA. Existió una clara correlación entre el valor máximo de PIA dentro de las primeras dos semanas y la incidencia de mortalidad. Complicaciones intermedias Las complicaciones intermedias se producen como consecuencia de fenómenos locales a nivel de la lesión pancreática y peripancreática. Se desarrollan luego de que se resuelven las manifestaciones sistémicas. Las mismas ocurren predominantemente durante la segunda a quinta semana luego del ataque agudo. Las complicaciones locales se desarrollan en pacientes con pancreatitis severa y generalmente en presencia de necrosis pancreática. La detección precoz y el adecuado tratamiento de estas complicaciones es esencial, debido a que son responsables de más del 50% de la mortalidad reportada en la pancreatitis aguda. El término necrosis pancreática hace referencia a la presencia de tejido pancreático no viable. Característicamente, existe una decoloración grisácea o negruzca y una consistencia pastosa de los tejidos que pueden ser removidos por disección digital durante el acto quirúrgico. La necrosis puede ser superficial o extenderse a través de la profundidad del parénquima. La necrosis pancreática no tiene límites bien definidos y se puede extender difusamente a través de los recesos del retroperitoneo. La necrosis se evidencia en la pancreatografía dinámica durante la TAC como áreas que no refuerzan con el contraste por la existencia de compromiso microvascular. La necrosis peripancreática implica la presencia de tejido retroperitoneal no viable fuera de los límites de la glándula. Es difícil realizar una distinción anatómica entre la necrosis pancreática y la necrosis peripancreática. La necrosis pancreática es de gran trascendencia en la evolución de la pancreatitis aguda. La mortalidad de la pancreatitis intersticial es menor del 1%, aumentando dramáticamente al 10 al 23% cuando se produce necrosis pancreática. Por otra parte, virtualmente todas las complicaciones graves se producen en pacientes con pancreatitis necrotizante. La contaminación bacteriana secundaria afecta al 40 al 70% de los pacientes con necrosis pancreática, constituyendo un factor de riesgo mayor de muerte. La mayoría de los pacientes con pancreatitis aguda que presentan fallo multiorgánico tienen pancreatitis necrotizante, y más del 80% de las muertes que se producen en pacientes con pancreatitis afectan a aquellos con necrosis pancreática. La necrosis infectada. En el 1 al 6% de los pacientes con pancreatitis aguda se produce infección local, y la misma es responsable del 80% de las muertes debidas a la enfermedad. A pesar de la mejoría en el tratamiento, la infección pancreática continúa asociándose con una mortalidad del 10 al 70%, y una morbilidad del 60 al 90%. El riesgo de infección se correlaciona con la severidad de la pancreatitis determinada por los criterios de Ranson u otros esquemas de estratificación pronóstica. En sólo el 3% de los pacientes con menos de tres signos de Ranson se produce una infección severa, el riesgo aumenta al 32% en pacientes con tres a cinco signos y al 5080% en pacientes con más de cinco signos. La infección en la pancreatitis aguda se considera la resultante de la contaminación secundaria de la zona de inflamación retroperitoneal. Los microorganismos infectantes se originan en forma endógena, a partir de un sitio abdominal extrapancreático, tal como el colon o la vía biliar, y se diseminan por migración trasmural o por transporte linfático. Se admite que la pancreatitis aguda sería una causa promotora de traslocación bacteriana desde el intestino. Se ha comprobado que varios mecanismos promueven la translocación bacteriana y la infección secundaria, incluyendo la disrupción de la microflora indígena intestinal, el daño de la mucosa intestinal con el consiguiente aumento de la permeabilidad, y el deterioro de la inmunidad del huésped. La necrosis pancreática se considera un prerequisito para la infección bacteriana. La infección se produce en el 40% de los pacientes con necrosis demostrada quirúrgicamente, y la frecuencia de infección se correlaciona con la extensión de la necrosis. Se observa una mayor incidencia de infección en pacientes con necrosis extensa, necrosis peripancreática y ascitis pancreática. Si bien se acepta que la infección es una complicación tardía de la necrosis, en el 24% de los pacientes operados en la primera semana ya se puede detectar la infección. Los gérmenes predominantes son la E. coli, Klebsiella pneumoniae y S. faecalis. Otros gérmenes hallados son S. aureus, Pseudomonas, Streptococus sp., Enterobacter aerogenes y Bacteroides fragilis. Los anaerobios se hallan en el 20-30%. En el 50-75% de los casos la infección es polimicrobiana. La infección con Candida se ha reportado en el 10-20% de los casos. Se especula que el aumento del empleo de antibióticos profilácticos en la pancreatitis necrotizante podría promover cambios en el espectro bacteriano, conduciendo a la selección de bacterias Gram positivas y hongos. En un estudio reciente de Luiten y colaboradores, evaluando la descontaminación selectiva en pacientes con pancreatitis aguda severa, se comprobó que la presencia de gérmenes Gram negativos o de flora mixta en la necrosis era de mal pronóstico, no así si los gérmenes hallados eran exclusivamente Gram positivos: estafilococo epidermidis o enterococo. Los mismos autores han comprobado que la colonización intestinal con gérmenes Gram negativos, exceptuando la E.coli, es un parámetro pronóstico precoz en pacientes en los cuales todavía no se ha producido la infección pancreática, ya que se asocia con un aumento significativo del riesgo de infección local y mortalidad. Hoerauf y colaboradores, por su parte, constataron un aumento de la incidencia de infecciones por Candida albicans en los pacientes con pancreatitis necrótica, y una mayor mortalidad en estos casos, en particular en los pacientes con alto escore APACHE II al ingreso. Isenmann y colaboradores encontraron la misma asociación, pero destacan que la mayoría de los pacientes presentan Candida en combinación con otras bacterias, y todas las muertes fueron una secuela de la sepsis asociada, siendo difícil o imposible establecer un porcentaje de muertes directamente atribuibles a la infección por Candida. La semiología y el laboratorio de la infección pancreática abarcan un amplio espectro, que incluye desde la falla pluriparenquimatosa hasta la ausencia de signos clínicos y de laboratorio compatibles con infección. En la mayoría de las series los hallazgos más comunes en el momento del diagnóstico son la fiebre, la leucocitosis, una masa palpable y la insuficiencia renal o respiratoria (Tabla 3). El curso clínico de pacientes con necrosis infectada se caracteriza por una elevada incidencia de complicaciones cardiorespiratorias, renales y sistémicas. La tomografía axial computada es el mejor método diagnóstico en la evaluación de las complicaciones infecciosas locales. Sin embargo, aun los hallazgos tomográficos no permiten diferenciar la necrosis estéril de la necrosis infectada. La presencia de gas en la región del páncreas por lo general es indicativa de infección, pero también puede ser secundaria a una fístula entérica con el área de necrosis (Fig. 11). Tabla 3.- Incidencia de hallazgos clínicos y de laboratorio en 18 pacientes con infección localizada secundaria a pancreatitis (Ranson). Hallazgo Fiebre de > 38ºC Distensión abdominal Albúmina sérica < 3,5 g/dl Bilirrubina > 1,5 mg/dl Masa abdominal palpable Plaquetopenia < 175.000 /mm3 Hipotensión arterial < 90 mm Hg Necesidad de asistencia respiratoria Falla renal o urea > 40 mg/dl Transtornos neurológicos Aumento de amilasa Leucocitosis > 10.000 /mm3 Porcentaje 100 94 75 70 71 55 39 39 39 28 28 28 La presencia de infección puede ser establecida con certeza por la realización de una punción aspirativa con aguja bajo control tomográfico. El material obtenido debe ser evaluado por tinción directa y por cultivo. La ruta de acceso percutanea debe evitar atravesar el aparato digestivo para prevenir los resultados falsos positivos y evitar la contaminación de un páncreas estéril. La punción está indicada en pacientes seleccionados con un curso clínico sospechoso de infección evidenciado por fiebre, leucocitosis y una tomografía que demuestra una necrosis pancreática, colecciones pancreáticas o peripancreáticas o áreas sin refuerzo en la pancreatografía dinámica. En dos estudios comparando los resultados de la punción con aguja fina con el estándar de referencia de cultivos tisulares obtenidos luego de la intervención quirúrgica o percutanea en pacientes con sospecha clínica de infección pancreática, los valores predictivos positivos y negativos de la punción alcanzaron o excedieron el 90%. Es importante no desestimar el riesgo de la contaminación de una necrosis estéril por la punción si se atraviesa un asa intestinal. Fig. 11.- Necrosis infectada de páncreas con gas en su interior. A la izquierda se muestra la punción diagnóstica realizada con aguda fina, destinada a la evaluación microbiológica. Es esencial reconocer que la necrosis estéril no necesariamente permanece estéril y es imprescindible una vigilancia continuada, incluyendo repetidas punciones aspirativas, hasta que se certifique que el paciente está totalmente recuperado. Las manifestaciones específicas de infección influencian el tratamiento y la sobrevida. Los pseudoquistes infectados y los abscesos pancreáticos tratados por drenaje externo presentan una mortalidad respectiva del 5 al 10% y del 5 al 25%. La necrosis pancreática infectada requiere un debridamiento más extenso y drenaje y presenta una mortalidad del 30 al 50%. En 114 pacientes operados por Beyer y colaboradores, por pancreatitis necrotizante, la mortalidad fue del 38% en presencia de infección, comparada con el 9% cuando el tejido necrótico era estéril. La cirugía en los pacientes con falla pluriparenquimatosa se asocia con una mortalidad superior al 80%, mientras que esta cifra disminuye al 10-20% en pacientes sin falla de otros órganos o sistemas. Las colecciones fluidas agudas son colecciones de jugo pancreático que se producen precozmente en el curso de la enfermedad en alrededor del 40% de los pacientes. Se resuelven espontáneamente en alrededor del 50% de los casos. Las que no se resuelven pueden evolucionar a un pseudoquiste, o pueden asociarse con una variedad de complicaciones, las más comunes de las cuales son dolor, infección secundaria y hemorragias. Las colecciones fluidas carecen de cápsula fibrosa o inflamatoria y por tanto están confinadas solamente por los espacios anatómicos entre los que se desarrollan, más habitualmente el espacio pararenal anterior y el saco menor. Las colecciones agudas se comportan en la TAC como áreas de baja atenuación, pobremente definidas, sin cápsula reconocible ni pared, lo que las distingue de los pseudoquistes (Fig. 12 y 13). Las áreas heterogéneas, de baja atenuación en el espacio peripancreático, habitualmente presentes en el comienzo de un episodio agudo de pancreatitis, representan una combinación de necrosis grasa, fluido pancreático extravasado, inflamación inespecífica y hemorragia. El absceso pancreático se define como una colección pobremente encapsulada de pus localizada habitualmente en la proximidad pero fuera del páncreas. El mismo se produce en el 3% de los casos de pancreatitis aguda, habitualmente tres a cuatro semanas luego del inicio de la enfermedad en pacientes que han desarrollado colecciones fluidas peripancreaticas. Fig. 12. Pancreatitis aguda grave de origen biliar asociada a colecistitis. Se observa un catéter de colecistostomía, el gran cálculo enclavado en el bacinete y una colección fluida en la cola. Fig. 13. Pancreatitis aguda grave. Se observa ascitis y una colección fluida retrogástrica. La extravasación de enzimas pancreáticas activadas en el retroperitoneo crea áreas localizadas de necrosis grasa que luego se licuan e interfieren con la reabsorcion normal del fluido retroperitoneal. Estas colecciones sufren una infección secundaria, generalmente polimicrobiana, con gérmenes de origen intestinal, dando origen a los abscesos. El diagnóstico tomográfico del absceso pancreático está basado en la presencia de una colección fluida de baja atenuación con el contraste, con una pared relativamente fina que puede contener burbujas aéreas (Fig. 14 y 15). Tales burbujas no son patognomónicas de infección, y sólo la punción percutanea con aguja fina con el consiguiente reconocimiento de pus permite establecer el diagnóstico. Fig. 14.- Absceso pancreático ulterior a pancreatitis aguda en paciente VIH positivo. A la izquierda se observa el material obtenido por punción. Germen aislado: Staphylococcus aureus. Fig. 15.- Absceso tabicado de páncreas ulterior a pancreatitis aguda. A la izquierda se observa el material purulento que emerge de la zona pancreática durante el acto operatorio. Es importante distinguir entre absceso y necrosis infectada, debido a que el riesgo de mortalidad de la necrosis infectada es elevado en relación con el de los abscesos, y la terapéutica específica para cada condición es diferente. Los abscesos pueden ser tratados con drenaje percutaneo, mientras que la necrosis infectada en general requiere el debridamiento quirúrgico. Los pseudoquistes son colecciones encapsuladas de fluido pancreático, redondeadas u ovales. Evolucionan a partir de una colección fluida aguda en alrededor del 30-50% de los pacientes con pancreatitis aguda. Este proceso evolutivo requiere cuatro o más semanas para desarrollarse. La pared del quiste no es epitelizada, y está compuesta de tejido inflamatorio, granulomatoso o fibrótico dependiendo del tiempo del examen. En la tomografía, los pseudoquistes son redondos u ovales, y tienen una cápsula fina y simétrica, y un contenido fluido de <15 UH. Varían considerablemente en tamaño (Fig. 16). El fallo en la reabsorción de secreciones pancreáticas extravasadas, y el mantenimiento de un tracto de comunicación con el sistema ductal del páncreas, explica el desarrollo de los pseudoquistes. En la mayoría de los casos están asociados y se desarrollan en el lugar de una necrosis pancreática. Pueden existir bacterias dentro de un pseudoquiste, pero en general no tienen significación clínica, puesto que representan una contaminación y no una infección clínica. Cuando aparece pus, la lesión se debe considerar un absceso pancreático. Alrededor de la mitad de los pseudoquistes se resuelven espontáneamente. La otra mitad se puede estabilizar y resolver parcialmente sin producir secuelas clínicas, o pueden agrandarse o causar complicaciones: dolor, infección secundaria, hemorragia, obstrucción ductal, o compromiso del tracto digestivo, bajo la forma de obstrucción, fístula o hemorragia. En general los quistes de más de 6 cm de diámetro requieren tratamiento quirúrgico más frecuentemente que los menores de ese diámetro. Es importante distinguir entre absceso y necrosis infectada, debido a que el riesgo de mortalidad de la necrosis infectada es elevado en relación con el de los abscesos, y la terapéutica específica para cada condición es diferente. Los abscesos pueden ser tratados con drenaje percutaneo, mientras que la necrosis infectada en general requiere el debridamiento quirúrgico. Fig. 16.- Pseudoquiste de páncreas. Las fístulas gastrointestinales y la disrupción del conducto pancreático son comunes en la pancreatitis severa (Fig. 17). La mortalidad y la estadía en el hospital están influencias por las severidad de la enfermedad, por la presencia de necrosis, y por la infección, pero no por la presencia de estas complicaciones. Aunque la patogénesis exacta de las fístulas gastrointestinales en la pancreatitis severa puede ser multifactorial y no se ha definido totalmente, se pueden reconocer algunos factores predisponentes. Las fístulas gastrointestinales pueden ser consecuencia de la necrosis pancreática o de los tejidos peripancreáticos, o de una injuria iatrogénica. La necrosis y la resultante respuesta inflamatoria puede crear una disección retroperitoneal extensa que involucra la vasculatura de la transcavidad y del mesocolon transverso, con trombosis potencial. Esta cascada de eventos compromete el flujo sanguíneo del segmento gastrointestinal involucrado, produciendo inicialmente isquemia, luego necrosis focal y eventualmente una fístula. Tardíamente, la necrosis infectada puede requerir necrosectomía, predisponiendo al tracto digestivo a injurias iatrogénicas no solamente durante la operación sino también en la etapa postoperatoria. Las fístulas pancreáticas, por su parte, pueden resultar de la necrosis del parénquima pancreático que compromete los conductos pancreáticos principales o tributarios. En la serie reciente de Ch. Frey, en 136 pacientes portadores de pancreatitis severa, se reconocieron 25 fístulas gastrointestinales (18,5%) en 23 pacientes: 3 gástricas, 5 duodenales, 5 yeyunales y 12 colónicas. La presencia de necrosis e infección fue el factor predisponente más importante en el desarrollo de estas fístulas. Además, 21 pacientes desarrollaron fístulas pancreáticas durante la evolución, todos menos uno tenían necrosis y todos fueron sometidos a necrosectomía. Se han descripto en el curso de la pancreatitis aguda obstrucciones intestinales, involucrando el duodeno, colédoco e intestino. Fig. 17.- Fístula pancreático-duodenal en paciente portador de pancreatitis necrótica. La misma se hizo evidente dos meses después del episodio agudo de pancreatitis. Complicaciones tardías Algunas complicaciones graves tienen tendencia a ocurrir en forma tardía, meses o incluso años luego de uno o varios episodios de pancreatitis aguda, o cuando se ha desarrollado una pancreatitis crónica. Su presentación insidiosa o incluso la ausencia del antecedente de una pancreatitis bien documentada hacen dificultoso el diagnóstico o la sospecha clínica. En este caso desempeñan un rol principal los métodos de diagnóstico por imágenes. La hemorragia local, complicación de alta morbimortalidad, es causada por la erosión de un vaso mayor por las enzimas pancreáticas o por la infección. Las arterias más afectadas son la esplénica (45%) (Fig. 18), la gastroduodenal (18%), las arterias de las arcadas gastroduodenales (18%) y ocasionalmente la arteria hepática. En general es una complicación tardía de la enfermedad. La mayoría de las complicaciones hemorrágicas son secundarias al sangrado de un pseudoaneurisma, que es aparentemente común en la pancreatitis. Aunque la mayoría de los pacientes con hemorragia masiva luego de la pancreatitis tienen un pseudoaneurisma roto; la hemorragia también puede ser producida por el sangrado venoso o capilar extenso en un área de necrosis pancreática. Fig. 18.- Hemorragia masiva en pacientes con pancreatitis necrohemorrágica. En la operación se comprobó la ruptura de la arteria esplénica, que aparece seccionada y ligada en la imagen. La pronta detección y evaluación de las complicaciones hemorrágicas es de particular importancia. En pacientes con un descenso súbito del hematocrito, la detección precoz es imprescindible para evitar la muerte. Ante la sospecha clínica, la realización de una TAC helicoidal con un bolo intravenoso de contraste, la evaluación angiográfica con embolización, y en caso necesario, el tratamiento quirúrgico agresivo, pueden disminuir la elevada mortalidad asociada con esta complicación. La embolización arterial es el tratamiento de elección cuando es posible realizarlo, estando reservada la cirugía para la hemorragia venosa severa o la hemorragia en los pseudoquistes. La trombosis del sistema venoso afecta principalmente a la vena esplénica debido a su proximidad con el cuerpo y cola del páncreas, pero se puede extender hacia el sistema portal y la vena mesentérica superior. La trombosis de la vena esplénica se produce en el 1 al 3% de las pancreatitis, siendo su expresión clínica silenciosa, habitualmente hasta el desarrollo de esplenomegalia o hematemesis. A nivel del hilio se desarrolla una circulación colateral con agrandamiento de las venas cortas y de las venas gastroepiploicas, pudiendo formarse varices gástricas en la pared posterior del fundus gástrico. La ascitis pancreática, definida como una disrupción permanente del conducto pancreático principal con el establecimiento de una comunicación entre el páncreas y la cavidad peritoneal, induciendo una ascitis masiva crónica, es rara. Probablemente sea la consecuencia de una necrosis pancreática con la extravasación continua de fluido o a la ruptura de un pseudoquiste, que mantiene su conexión con el sistema ductal del páncreas. La presentación clínica de la ascitis pancreática incluye aumento del diámetro abdominal, dolor abdominal, pérdida de peso, y ocasionalmente nauseas y vómitos. El examen tomográfico muestra líquido intraperitoneal abundante y en ocasiones los estigmas de una pancreatitis previa, tales como dilatación de los conductos pancreáticos, colecciones fluidas en el páncreas o en su adyacencia y o calcificaciones. El aspirado de líquido peritoneal permite establecer el diagnóstico cuando el contenido proteico es mayor de 3 g/dL y la amilasa se encuentra por encima de 1.000 UI. El tratamiento es quirúrgico, debiendo recordarse que esta complicación tiene una mortalidad operatoria de un 20% y un índice de recurrencia del 15%. PRONÓSTICO La pancreatitis aguda no es una enfermedad estática, caracterizándose por una evolución en el tiempo variable, asociada a manifestaciones clínicas, morfológicas e imagenológicas específicas. En aproximadamente las dos terceras partes de los pacientes la enfermedad sigue un curso leve o moderado, asociándose con mínima disfunción orgánica. La mejoría clínica se puede lograr fácilmente con un adecuado reemplazo de volemia, tratamiento del dolor y nutrición parenteral, no observándose complicaciones mayores. Las primeras 24-48 horas ulteriores al inicio de los síntomas definen habitualmente el pronóstico, ya que en este período un 20 a 30% de todos los pacientes progresan hacia una forma grave de la enfermedad. Por lo dicho, resulta obvia la importancia práctica que tiene realizar un pronóstico en las primeras 48 horas de la enfermedad. El sistema pronóstico ideal aún no ha sido descripto porque en la pancreatitis aguda existen dos formas de gravedad: una inicial y otra tardía. La gravedad inicial es el resultado de la repercusión sistémica de la enfermedad, cuya expresión más grave es la falla pluriparenquimatosa de causa no séptica. La gravedad tardía es la consecuencia de las complicaciones locales y está en relación con la magnitud de la necrosis local. Si bien existe relación entre ambas formas de gravedad, ya que las pancreatitis inicialmente graves son las que con mayor frecuencia desarrollan complicaciones alejadas, las excepciones prueban que un solo sistema pronóstico puede no ser efectivo para ambas formas de gravedad. Dado que la gravedad de la pancreatitis aguda es muy variable, la selección y evaluación de un tratamiento apropiado requiere la identificación rápida de los pacientes críticamente enfermos y con alto riesgo de complicaciones o muerte. La World Association ha establecido una serie de hallazgos que pueden predecir un ataque severo, presentes dentro de las 48 horas de la admisión al hospital (Tabla 4). El trabajo de varios investigadores ha hecho posible identificar indicadores precoces de riesgo de desarrollo de enfermedad grave y estratificar a los pacientes con pancreatitis aguda de acuerdo con la morbilidad y mortalidad probables. Tabla 4.- Hallazgos que pueden predecir un ataque severo, dentro de las 48 horas de la admisión. Evaluación inicial 24 horas luego de la admisión 48 horas luego de la admisión Impresión clínica de severidad Indice de masa corporal >30 Derrame pleural en la radiografía de tórax Escore APACHE II >8 Impresión clínica de severidad Escore APACHE II >8 Escore de Glasgow 3 o más Persistencia de falla orgánica, en especial múltiple Proteína C reactiva >150 mg/l Impresión clínica de severidad Escore de Glasgow 3 o más Proteína C reactiva >150 mg/l Persistencia de la falla orgánica por 48 horas Falla orgánica múltiple o progresiva Ranson estableció un patrón pronóstico para la evaluación de la pancreatitis aguda (Tabla 5). El mismo se basa en 11 signos objetivos; cinco determinados al ingreso, y seis durante las primeras 48 horas. Tabla 5.- Signos pronósticos tempranos de riesgo de complicaciones mayores en pacientes con pancreatitis aguda (Ranson). A la internación Edad mayor de Leucocitosis mayor de Glucosa mayor de LDH mayor de TGO mayor de A las 48 horas Disminución del hematocrito Aumento de la urea Calcemia menor de PaO2 menor de Ex. Base menor de Secuestro fluido mayor de Pancreatitis no litiásica Pancreatitis litiásica 55 años 16.000/mm3 200 mg/dl 350 UI/l 240 UI/l 70 años 18.000/mm3 220 mg/dl 400 UI/l 250 UI/l > 10 % > 5 mg 8 mg 60 mm Hg 4 mEq/l 6.000 ml > 2 mg 8 mg 5 mEq/l 4.000 ml A medida que aumenta el número de factores de riesgo, existe un aumento correspondiente en la morbilidad y la mortalidad. En un estudio de 450 pacientes, los que tenían menos de tres signos presentaban un riesgo escaso de muerte o de desarrollar complicaciones mayores; mientras que en pacientes con seis o más signos positivos, el riesgo de muerte o de complicaciones pasibles de un cuidado intensivo prolongado aumentaba considerablemente. Los individuos con más de seis signos de gravedad habitualmente tenían pancreatitis necrotizante. La correlación de la severidad de la enfermedad o el desarrollo de necrosis en pacientes con tres a cinco signos, que es un escore habitual, es deficiente. El patrón pronóstico, si bien no es definitivo para casos particulares, permite identificar a los pacientes que deben ser sometidos a monitoreo o a tratamiento intensivo. Un inconveniente importante del escore de Ranson es que el mismo sólo es aplicable durante las primeras 48 horas de la enfermedad, y no ha sido validado para ser utilizado días o semanas más tarde, cuando el paciente puede ser transferido desde otra institución. Utilizando un sistema similar, Imrie y colaboradores, describieron nueve variables para estadificar la gravedad de la pancreatitis aguda (Tabla 6). La pancreatitis fue grave y la mortalidad elevada si durante las primeras 48 horas se presentaban tres o más factores. Tabla 6.- Sistema de escore de Glasgow para la prediccion inicial de la severidad de la pancreatitis aguda (Imrie y colaboradores). Edad Recuento de glóbulos blancos Glucosa Urea PaO2 Calcio Albúmina Lactatodeshidrogenasa (LDH) Aspartato alanino aminotransferasa > 55 años > 15.000 > 10 mmol/litro > 50 mg/dL < 60 mm Hg < 2 mmol/l < 3,2 g/dl > 600 unidades/litro > 100 unidades/litro Mc Mahon y colaboradores utilizaron el lavado peritoneal diagnóstico en la admisión como un indicador temprano de la gravedad de la pancreatitis aguda. Los criterios originales de positividad incluían la presencia de más de 10 ml de líquido en la punción, cualquiera que fuese su color; líquido de color oscuro, tipo jarabe de grosellas, cualquiera fuera su cantidad; y líquido rojizo en el retorno de lavado peritoneal. En un estudio más reciente, el umbral de 10 ml fue elevado a 20 ml para evitar los falsos positivos. El lavado demostró ser eficaz en el pronóstico de la gravedad temprana, sobre todo de las pancreatitis biliares. El valor de estos indicadores para la predicción temprana de la gravedad ha sido comparado prospectivamente. A las 48 horas los criterios de Ranson prevén correctamente la enfermedad grave con un 82% de exactitud, comparado con 72% utilizando los criterios de Imrie. Mc Mahon y colaboradores evaluaron la utilidad del sistema APACHE II para establecer la gravedad y el pronóstico de la pancreatitis aguda. El APACHE II puede ser utilizado para evaluar la severidad inicial de la enfermedad y las posibilidades de desarrollo de una complicación ulterior. Un escore de 9 o más indica un ataque severo, pero ello no significa que muchos pacientes con un escore menor no desarrollen complicaciones. Un escore APACHE II de 8 o más prácticamente incluye todos los pacientes que desarrollarán complicaciones (sensibilidad 95%), pero sólo la mitad de ellos desarrollará complicaciones (valor predictivo 50%). El APACHE II fue especialmente útil para monitorizar el progreso de los pacientes con necrosis pancreática, aunque se considera esencial la información provista por otros métodos diagnósticos, en particular la tomografía computada. En la Reunión de Consenso sobre Pancreatitis Aguda del Club del Páncreas de la Argentina (1998), se propuso, en función de su simplicidad, al Score de evaluación de la falla orgánica secuencial (SOFA), para definir y cuantificar las disfunciones orgánicas en los pacientes con pancreatitis aguda (Tabla 7). Tabla 7. Escore de evaluación de la falla orgánica secuencial (SOFA) (Vincent J., y col.: Intensive Care Med 22:707-1996) Sistema orgánico Respiración (PaO2/FiO2 mm Hg) Coagulación (Plaquetas x103/mm3) 1 2 3 4 <400 <300 <200 con ARM <100 con ARM <150 <100 <50 <20 Hígado (Bilirrubina, mg/dl) Cardiovascular (Hipotensión) (dosis en µ g/Kg.min) SNC (Glasgow) Renal (Creatinina, mg/dl o diuresis) 1,2-1,9 PAM < 70 mm Hg 2,0-5,9 Dopamina < 5 o dobutamina cualquier dosis 6,0-11,9 Dopamina > 5 o epinefrina <0,1 o norepinefrina <0,1 >12 Dopamina >15 o epinefrina > 0,1 o norepinefrina >0,1 13-14 1,2-1,9 10-12 2,0-3,4 6-9 3,5-4,9 o < 500 ml/día <6 > 5,0 o < 200 ml/día La tomografía computada ha demostrado tener valor pronóstico tanto en la etapa temprana como tardía de la pancreatitis aguda. En la etapa temprana se considera que la inyección en bolo de sustancia de contraste durante el estudio permite separar a las pancreatitis edematosas de las necróticas. En las primeras se observa una intensificación homogénea de la densidad radiológica del páncreas, y en las segundas aparece un defecto localizado o difuso. El hallazgo de un área glandular que no se intensifica en la tomografía dinámica, asociada a lesiones peripancreáticas, es un signo de gran valor para anticipar las complicaciones locales tardías. El valor de la tomografía con contraste para establecer el pronóstico de la gravedad tardía es bien conocido, y se han descripto diversas clasificaciones basadas en el grado de compromiso pancreático y peripancreático. Considerando la magnitud de la necrosis pancreática y la presencia de necrosis peripancreática en la tomografía axial computada, Balthazar, Ranson y colaboradores han desarrollado un índice de gravedad, tal se expone en la Tabla 8. Tabla 8.- Indice de severidad tomográfica en la pancreatitis aguda. NECROSIS PANCREÁTICA Ausente 0 Necrosis de un tercio de la glándula 2 Necrosis de la mitad de la glándula 4 Necrosis de más de la mitad del páncreas 6 GRADO DE SEVERIDAD DE PANCREATITIS AGUDA A: tejido pancreático y peripancreático radiológicamente normal 0 B: agrandamiento pancreático exclusivo sin cambios inflamatorios en el 1 tejido peripancreático C: cambios inflamatorios confinados al páncreas y grasa peripancreática 2 D: una colección fluida peripancreática 3 E: dos o más colecciones fluidas peripancreáticas 4 En función de los hallazgos precedentes, los autores comprobaron que existía una relación estrecha entre el puntaje obtenido y el grado de morbimortalidad de la enfermedad, tal como se establece en la Tabla 9. El índice de severidad tomográfica es un intento de mejorar el valor pronóstico de la TAC en la pancreatitis aguda. A los pacientes con grados A-E de pancreatitis se le asignan cero a cuatro puntos más dos puntos para necrosis de hasta 30%, cuatro puntos para necrosis de 30 a 50%, y seis puntos para necrosis de más del 50%. En este caso, un paciente con un grado D tiene un valor de tres puntos; si, en adición, el paciente tiene más del 50% de necrosis, se le asignan seis puntos adicionales, presentando un índice total de nueve. Balthazar y colaboradores hallaron una correlación estadísticamente significativa, con un aumento continuo de la incidencia de morbilidad y mortalidad en pacientes estratificados de acuerdo al índice de severidad tomográfica (Tabla 8). Esta correlación, sin embargo, no fue confirmada por otros autores. Tabla 9.- Relación entre los hallazgos tomográficos y la morbimortalidad en la pancreatitis aguda. Indice de Puntaje Morbilidad (%) Mortalidad (%) severidad 1 0a3 8 3 2 4a6 35 6 3 7 a 10 92 17 Meyer y colaboradores, utilizando una clasificación similar constataron que cuando no existía necrosis extrapancreática en el examen tomográfico, el 90% de los pacientes presentaban un curso clínico benigno, y sólo el 10% presentaban complicaciones, consistentes en pseudoquistes no infectados que se resolvieron espontáneamente. Por el contrario, cuando existieron tres o más colecciones extrapancreáticas, el 78% de los casos fue severo, con un 19% de mortalidad, y sólo el 22% siguió un curso benigno. Finalmente, en el grupo intermedio, aproximadamente la mitad de los pacientes presentaron una pancreatitis severa con un 1,5% de mortalidad. Kemppenen y colaboradores han comprobado que la determinación del sitio de la necrosis es útil para establecer la predicción evolutiva. En un estudio de 161 TAC de pacientes con pancreatitis aguda, comprobaron que el sitio anatómico de la necrosis era un mejor indicador que la extensión de la misma para predecir el riesgo de complicaciones, siendo particularmente riesgosa la necrosis de la cabeza del páncreas, probablemente por producir una obstrucción del conducto pancreático y un aumento de la presión a nivel acinar. MORTALIDAD Basado en la experiencia clínica y experimental, se ha comprobado que tanto la presencia como la extensión de la necrosis pancreática son responsables del curso clínico de los pacientes con pancreatitis severa. Las complicaciones sépticas locales de las pancreatitis agudas severas son responsables en la actualidad de la mayoría de las muertes asociadas con la enfermedad. En efecto, se ha comprobado que en los pacientes con necrosis, la presencia de infección bacteriana dentro de la necrosis es un hecho ominoso, siendo causal de más del 80% de las muertes en la enfermedad. La mortalidad reportada para las pancreatitis agudas severas en la literatura oscila entre 14 y 25%. En la serie de Howard y colaboradores, de 15 años (1977-1992), la mortalidad total fue del 21%, pero disminuyó al 12% en los últimos cinco años, lo cual es coincidente con otras series recientes. Es de destacar que la mayor mortalidad se evidenció en el grupo de pacientes con necrosis infectada, pudiendo alcanzar en estos casos al 50%. En un estudio multicéntrico español (Fernandez Cruz y colaboradores), los factores con mayor valor predictivo con respecto a la mortalidad fueron la edad avanzada, la presencia de insuficiencia renal o respiratoria, y el desarrollo de shock. Gotzinger y colaboradores evaluaron 340 pacientes con pancreatitis aguda severa que requirieron tratamiento quirúrgico. Comprobaron que la extensión de la necrosis pancreática fue menor del 50% en 202 pacientes y mayor del 50% en 138 pacientes. La infección, la falla orgánica y la mortalidad fueron significativamente mayores en pacientes con >50% de necrosis en comparación con los pacientes con menos necrosis. La extensión de la necrosis también influenció la sobrevida. Seis factores se correlacionaron con la evolución fatal en este estudio. Los pacientes que murieron tenían un escore APACHE II significativamente mayor a la admisión que los sobrevivientes, eran mayores, tenían una incidencia mayor de fallo orgánico simple o múltiple, tenían una extensión mayor de la necrosis, y sufrieron más frecuentemente de infección bacteriana local. TRATAMIENTO La pancreatitis aguda constituye un espectro de enfermedad que varía entre una forma leve, de curso autolimitado que sólo requiere una breve internación, hasta una enfermedad rápidamente progresiva y fulminante que produce un síndrome de falla orgánica múltiple con o sin sepsis acompañante. Sólo una minoría de pacientes con pancreatitis tienen una enfermedad suficientemente severa como para requerir la admisión en terapia intensiva. Estos pacientes tienen una incidencia de mortalidad que oscila entre el 30 y el 50%, y una estadía media en el hospital mayor de un mes, lo que evidencia la severidad de la pancreatitis en este extremo del espectro. Tratamiento médico Los pacientes con pancreatitis aguda grave se benefician de un entorno de control más estricto, dado el potencial a la progresión a la disfunción orgánica progresiva y/o al desarrollo de complicaciones locales que comprometen la vida. En una Reunión de Consenso realizada en Nueva York en abril del 2004, se fijaron una serie de recomendaciones para el tratamiento de la forma grave de pancreatitis aguda (Nathens A. y col.). En las mismas, se recomienda la admisión a terapia intensiva para los pacientes que reúnen los criterios convencionales de admisión (deterioro hemodinámico, falla respiratoria, deterioro renal, progresión a la falla multiorgánica). Además, la internación en UTI se debe considerar en pacientes que se encuentran en alto riesgo de deterioro rápido, tales como los ancianos, los obesos, los pacientes que requieren un alto volumen de resucitación, y los pacientes con necrosis pancreática sustancial. Una vez ingresado el paciente a terapia intensiva, deberá ser asistido por un grupo multidisciplinario liderado por un intensivista, con acceso rápido a expertos en endoscopia, colangiopancreatografia endoscópica retrógrada (ERCP), cirugía, y radiología intervencionista. Este grupo de asistencia deberá implementar una serie de medidas diagnósticas y terapéuticas. Se analizan a continuación algunos aspectos específicos de las medidas propuestas. Alivio del dolor.- Es una necesidad inmediata en el tratamiento de pacientes con pancreatitis aguda. Está contraindicado el empleo de morfina, ya que produce un aumento en la presión intracanalicular de las vías biliares y eleva las cifras de amilasa y lipasa séricas. Es útil recurrir a los analgésicos antiespasmódicos, que a la vez que alivian el dolor, producen distensión de los conductos biliares extrahepáticos. Aspiración nasogástrica. Si bien no existen estudios comparativos que demuestren la eficacia de la aspiración nasogástrica en la evolución de la pancreatitis aguda, su realización permite aliviar la dilatación gástrica y evitar los estímulos secretorios pancreáticos del ácido clorhídrico. Optimización hemodinámica. Recientemente, Rivers y colaboradores han demostrado que una terapéutica precoz destinada a lograr una alta disponibilidad de oxígeno en los pacientes con sepsis y shock séptico se asocia con una mejoría significativa en la sobrevida. El trabajo se realizó en unidades de emergencia, en las cuales se tomó como punto de resucitación adecuada el lograr en las primeras seis horas de asistencia del paciente una presión venosa central entre 8 y 12 mm Hg, una presión arterial media mayor de 65 mm Hg, un volumen minuto urinario mayor de 0,5 ml/kg/h, y como carácter diferencial con el grupo control, una saturación venosa en la vena cava superior (SvcO2) obtenido a través de un catéter de presión venosa central mayor de 70%. Para ello, se administraban cristaloides, y en caso de no lograr los resultados propuestos, se transfunde sangre hasta obtener un hematocrito ≥30% y/o una infusión de dobutamina hasta un máximo de 20 µ g/kg/min. Comparativamente con el grupo control, en el cual se buscaban los mismos objetivos anteriores pero no la obtención de una saturación venosa de oxígeno predeterminada, los enfermos en el grupo tratado tuvieron una mortalidad del 30,5% comparada con una del 46,5% en el grupo asignado a tratamiento convencional. Durante el periodo de resucitación ulterior en terapia intensiva, los escores APACHE II y los requerimientos de reemplazo de volemia fueron significativamente menores en el grupo tratado, indicando menos disfunción orgánica severa en los pacientes asignados a la terapéutica de recuperación rápida. Este estudio provee un fuerte soporte a la noción que la terapéutica de la sepsis debe ser iniciada tan pronto como sea posible y debe estar dirigida a end points claramente definidos. En la Reunión de Consenso antes citada, se recomienda el empleo de la técnica de Rivers y col., de resucitación volumétrica precoz, en el tratamiento de la pancreatitis aguda grave. Cuidado respiratorio. Una insuficiencia respiratoria insidiosa, no reconocible clínicamente, ocurre en alrededor del 40% de los pacientes. El método diagnóstico en estos casos es la determinación seriada de gases en sangre, constatándose una hipoxemia progresiva. En la mayoría de los pacientes, esta hipoxemia precoz mejora en la medida en que lo hace la pancreatitis, y la única recomendación terapéutica es el aporte suplementario de oxígeno. En pacientes con pancreatitis grave o que requieren una laparotomía precoz, el riesgo de insuficiencia respiratoria aumenta y estos pacientes deben ser intubados y asistidos mecánicamente. En caso de utilizarse asistencia rspiratoria mecánica, se recomienda el empleo de las estrategias de protección pulmonar destinadas a evitar la injuria pulmonar asociada a ventilador. Empleo de antibióticos. Los ensayos iniciales con antibioticoterapia profiláctica en la pancreatitis aguda no demostraron beneficios. Dos estudios recientes, sin embargo, utilizando cefuroxima e imipenem, respectivamente, demostraron una reducción de la incidencia de infección y una tendencia a disminuir la mortalidad. Ambos estudios presentan algunos problemas metodológicos, a pesar de lo cual, la tendencia de los últimos años ha sido el empleo de antibióticos profilácticos en los casos de pancreatitis aguda grave, utilizando un carbapenem (imipenem o meropenem) o la combinación ciprofloxacina-metronidazol. La terapéutica debe iniciarse tan pronto como se realiza el diagnóstico de pancreatitis aguda necrotizante, y se debe continuar al menos por dos a cuatro semanas. La propuesta precedente, sin embargo, no esta exenta de problemas. En efecto, los antibióticos pueden producir efectos colaterales significativos tales como colitis pseudomembranosa, emergencia de infecciones por gérmenes multiresistentes o infecciones micóticas. Sería de gran interés, por tanto, contar con marcadores precoces para identificar a los pacientes que presentan más riesgo de desarrollar infección de la necrosis. En este sentido, Riche y colaboradores han comprobado que la determinación precoz de los niveles séricos de procalcitonina y de IL-6 podría ser útil para diferenciar los pacientes que van a desarrollar infección, a fin de acotar la terapéutica antimicrobiana para este grupo en particular. En el estudio de los autores, la combinación de un nivel de IL-6 <400 pg/l y de procalcitonina <2 ng/l parecen identificar adecuadamente a los pacientes que no se encuentran en riesgo de infección de la necrosis. De Waele y colaboradores, en una serie reciente, reconocieron una elevada incidencia de infección micótica en pacientes tratados por pancreatitis aguda severa. El empleo prolongado de antibióticos profilácticos y el retardo en la cirugía son explicaciones posibles para estos hallazgos. La mortalidad no estuvo aumentada en presencia de infección micótica, por lo que no es claro al momento actual si existe alguna ventaja en utilizar profilaxis antifúngica en pacientes con esta patología. Si bien dos meta-análisis recientes (Sharma y col., y Golub y col.) indican que los antibióticos profilácticos probablemente tengan un efecto positivo en el curso de pacientes con pancreatitis necrotizante, un estudio controlado (Isenmann R. and the German antibiotics in severe acute pancreatitis study group) de ciproflaxina-metronidazol contra placebo no reconoció ningún beneficio con el empleo de antibióticos profilácticos con respecto al riesgo de desarrollar infección en la necrosis pancreática. Es de destacar la política del grupo de iniciar tratamiento antibiótico precozmente en pacientes con un curso severo de pancreatitis aguda, cuando se cumplen los siguientes criterios: desarrollo de sepsis de novo o síndrome de respuesta inflamatoria sistémica, fallo de novo de dos o más sistemas orgánicos, infección comprobada pancreática o extrapancreática, y un aumento en la proteína C reactiva en combinación con evidencia de infección pancreática o extrapancreática. Esta estrategia de tratamiento antibiótico “a la demanda“ evita los inconvenientes citados de la profilaxis universal, y además se ha demostrado efectiva en términos de costos de tratamiento. Un concepto reciente se relaciona con el empleo de la descontaminación selectiva intestinal. Aceptando que el aparato digestivo es la fuente de la infección en la pancreatitis, la reducción de la flora intestinal podría ser beneficiosa para prevenir la infección pancreática. En tal sentido, si bien existen algunos estudios experimentales y clínicos que avalan su empleo en la pancreatitis aguda (Luiten y col.), el empleo de la descontaminación selectiva en estas circunstancias no ha logrado aceptación. En función de los resultados anteriores, la Reunión de Consenso de Nueva York no recomienda el empleo rutinario de antibacterianos o antifúngicos sistémicos profilácticos en pacientes con pancreatitis necrotizante a la luz de las evidencias no concluyentes y de la dividida opinión de los expertos. Grupos especiales de pacientes que se podrían beneficiar del tratamiento profiláctico deben ser identificados por investigaciones subsecuentes. En la Reunión tampoco se recomienda el empleo rutinario de la decontaminación selectiva del tracto digestivo para el manejo de la pancreatitis necrotizante. A partir del quinto día del comienzo de una pancreatitis aguda, si existen elementos en favor de un proceso infeccioso (fiebre, escalofríos, leucocitosis) es necesario establecer si la necrosis pancreática está o no infectada. El estado bacteriológico del páncreas debe ser determinado por una punción guiada bajo tomografía de los tejidos pancreáticos o peripancreáticos. En presencia de necrosis infectada, el tratamiento antibiótico solo difícilmente podrá controlar el proceso, siendo recomendable recurrir al tratamiento quirúrgico. La justificación de esta metodología se basa en varios factores. Los compuestos tóxicos bacterianos liberados desde el área de necrosis en la circulación son la causa de sepsis y contribuyen a la falla pluriparenquimatosa, por lo que la remoción del foco séptico es necesaria para prevenir y terminar este círculo vicioso. En adición, la remoción de los restos infectados puede prevenir complicaciones tardías tales como los abscesos pancreáticos. La infección pancreática establecida constituye una de las infecciones más difíciles de controlar, en parte debido a que el huésped ya ha experimentado un insulto, el de la pancreatitis severa, y en parte debido a que la flora microbiana presente será más resistente. Para estas infecciones, que se producen en pacientes con tratamiento antibiótico previo, existe una gran probabilidad de que se presenten organismos resistentes. El agente exacto a utilizar dependerá de la experiencia individual con la infección nosocomial. En este sentido es particularmente importante contar con cultivos adecuados y estudios de sensibilidad. La recomendación habitual de tratamiento de la necrosis infectada es la cirugía inmediata, debido a que se asume que el manejo no operatorio en general no es efectivo. Runzi y col., sin embargo, han presentado recientemente un informe sobre el empleo efectivo de medidas de sostén con la adaptación antibiótica específica en función de los gérmenes aislados de la punción de la zona de necrosis, con resultados favorables, reservando la cirugía para los casos que no responden a esta actitud terapéutica. Empleo de antiácidos. La hemorragia digestiva alta por úlceras agudas es una complicación frecuente en pacientes con pancreatitis aguda grave. La incidencia de tales hemorragias puede ser reducida manteniendo el pH gástrico por encima de 4 con antiácidos y bloqueantes H2. Soporte nutricional. La inflamación pancreática genera una respuesta primaria de estrés que se asocia con un aumento del gasto energético, catabolismo proteico, mala asimilación de los nutrientes, disrupción del metabolismo de los substratos, y reducción de la ingesta de nutrientes exógenos. Todo ello deteriora el estado nutricional y la respuesta inmune. Estos procesos pueden ser agravados por la pérdida de la integridad de la mucosa intestinal, que genera una respuesta secundaria, pudiendo facilitar la translocación bacteriana y convirtiéndose en el motor de la respuesta inflamatoria sistémica y de la falla pluriparenquimatosa. La gravedad de la enfermedad es el aspecto fundamental que determina la necesidad y el tipo de soporte nutricional en la pancreatitis. Los pacientes con pancreatitis severa (Ranson ≥ 3, APACHE ≥ 10, evidencia de falla orgánica múltiple, y presencia de necrosis en la TAC dinámica), requieren un soporte nutricional agresivo y tienen pocas posibilidades de restablecer su ingreso oral antes de los 7-10 días de enfermedad. El obtener un acceso digestivo y comenzar la nutrición enteral dentro de las 48-72 horas del inicio de la enfermedad a los fines de mantener la integridad del intestino es muy importante, habiéndose demostrado que la ruta de soporte nutricional afecta la evolución clínica en este grupo de pacientes. La falta de nutrición enteral produce la atrofia de la mucosa gastrointestinal, sobrecrecimiento bacteriano, aumento de la permeabilidad intestinal, y traslocación de bacterias o sus productos a la circulación. La nutrición parenteral total puede promover la traslocación bacteriana en pacientes con pancreatitis. En modelos experimentales de pancreatitis, la nutrición enteral, en comparación con la nutrición parenteral total, reduce la endotoxemia sistémica, la traslocación bacteriana, y el recuento de colonias bacterianas en los ganglios linfáticos mesentéricos, el páncreas y el pulmón. La nutrición enteral, por otra parte, podría proveer una mejor respuesta genética al desafío infeccioso. Existen cada vez más informes sobre el empleo de la nutrición enteral en la pancreatitis aguda, en contra del dogma impuesto sobre la necesidad de nutrición parenteral en esta patología. Cuando se utiliza nutrición enteral, se sugiere que la misma se administre en forma distal al ligamento de Treitz, para evitar los efectos estimulantes de la secreción pancreática de las enzimas que se liberan por arriba del mismo. Existen estudios comparativos de nutrición enteral versus nutrición parenteral en la pancreatitis aguda grave, que demuestran que la nutrición enteral es bien tolerada, no presentando efectos adversos en el curso de la enfermedad. Estudios recientes, incluso, han sugerido que la nutrición enteral en el yeyuno en pacientes con pancreatitis aguda es útil para moderar la respuesta inflamatoria y posiblemente séptica, en especial en los casos severos. Un estudio experimental en animales de Kotani y colaboradores comprobó que la nutrición enteral atenúa el sobrecrecimiento bacteriano cecal, mantiene la integridad de la mucosa intestinal y la permeabilidad, y mantiene la respuesta inmune del huésped; pero comparada con la nutrición parenteral, no mejora el pronóstico final. El acceso enteral se logra más fácilmente por radioscopía o mediante técnica endoscópica, debiendo hacerse avanzar la sonda de alimentación más allá del ligamento de Treitz. Si el paciente es intervenido quirúrgicamente, se deberá dejar una yeyunostomía. Eatock y col. recientemente han comprobado que la alimentación nasogástrica es tolerable y aparentemente no exacerba la pancreatitis, informando niveles similares de proteína C reactiva y escores de dolor luego de la introducción de nutrición nasogástrica en comparación con la nasoyeyunal. En la Fig. 19 se indican las recomendaciones actuales sobre el manejo nutricional en la pancreatitis aguda grave. Se debe tener presente que el gasto energético en reposo de estos enfermos está aumentado. Según Grant, al GMB calculado por la fórmula de Harris-Benedict se le debe añadir hasta un 3040% como suplemento calórico. Los hidratos de carbono, aunque son la fuente calórica ideal, en esta enfermedad deben ser utilizados con control estricto. Su metabolización está alterada, tal como ocurre en la sepsis. Se recomienda no utilizar un aporte de glucosa mayor de 5 mg/kg/min, ya que por encima de este nivel se puede producir hiperglucemia no controlable o desviación del metabolismo de la glucosa hacia la lipogénesis. En los pacientes críticos con pancreatitis aguda grave, y en particular en aquellos que reciben nutrición parenteral, se deben utilizar protocolos que involucren un estricto control de la glucemia. EVALUAR SEVERIDAD PANCREATITIS LEVE O MODERADA PANCREATITIS GRAVE Ranson < 2 APACHE II < 9 Sin falla orgánica Sin necrosis pancreática CUIDADO DE SOPORTE Ranson > 3 APACHE II > 10 Falla orgánica múltiple Necrosis pancreática Complicaciones Resucitación con fluidos Analgesia SOPORTE NUTRICIONAL AGRESIVO Intolerancia NPT NET Aumento de la inflamación RESOLUCIÓN DE LA PANCREATITIS NPT: nutrición parenteral total NET: nutrición enteral Dieta oral Fig. 19.- Manejo nutricional de la pancreatitis aguda. Mucho se ha discutido el empleo de lípidos en la nutrición de pacientes con pancreatitis aguda. Actualmente, su uso es cada vez más aceptado, sobre la base de que disminuyen la secreción gástrica y pancreática, permiten disminuir la cantidad de glucosa, y en dosis que no superan los 2 g/kg/día, no producen efectos secundarios clínicos ni bioquímicos. Su empleo, sin embargo, es desaconsejable en la pancreatitis dislepidémica. La administración de lípidos debe suspenderse si se constatan valores de triglicéridos en la sangre superiores a los 1.000 mg/dl. Para conseguir un correcto balance nitrogenado, es necesario un aporte de aminoácidos elevado, dado el hipercatabolismo presente. Se debe recurrir a una relación calorías no proteicas:gramos de nitrógeno muy baja (100:1). En caso de utilizarse nutrición parenteral, la misma deberá ser enriquecida con glutamina para evitar el deterioro metabólico intestinal. A partir de la resolución del ileo, se deberá instalar una nutrición enteral elemental, la cual se mantendrá hasta resolver totalmente la inflamación pancreática. En este momento puede iniciarse una dieta oral exenta de grasas, hasta la normalización total, con control ante el posible rebrote de manifestaciones clínicas. Lavado peritoneal. Ha sido recomendado para el tratamiento de las formas graves de pancreatitis aguda sobre la base de estudios experimentales y clínicos. El empleo del lavado peritoneal encuentra su justificación en las características del exudado peritoneal que complica frecuente y precozmente las formas necrohemorrágicas de pancreatitis aguda. El beneficio del lavado peritoneal está asociado a la eliminación de una serie de sustancias tóxicas, como histamina, bradiquinina, prostaglandinas, enzimas proteolíticas y sustancias capaces de aumentar la permeabilidad vascular, y que al ser reabsorbidas en la circulación pueden generar manifestaciones sistémicas graves. El lavado peritoneal es útil cuando existe evidencia temprana de pérdida significativa de volumen plasmático, hipotensión, pulso mayor de 140 por minuto o deterioro clínico evidente. El lavado debe ser instituido dentro de las 24 horas del inicio de la enfermedad. El lavado se realiza a través de un catéter de diálisis insertado por vía percutanea. En cada pasaje se utilizan uno o dos litros de dializado. El fluido no necesita equilibrarse como en la diálisis peritoneal, y debe ser evacuado inmediatamente. Los dos problemas secundarios descritos con el lavado peritoneal son la insuficiencia respiratoria secundaria a la distensión abdominal con elevación diafragmática y las alteraciones del metabolismo de la glucosa. La experiencia inicial de Ranson utilizando el lavado peritoneal durante dos a cuatro días en pacientes con pancreatitis aguda grave demostró una mejoría dramática en las funciones cardiovascular y respiratoria. Ello se asoció con una reducción en la mortalidad temprana de la enfermedad. Sin embargo, la mortalidad hospitalaria total se redujo muy escasamente. Esto se debe a que el lavaje no modifica la frecuencia ni la mortalidad de la infección tardía de los tejidos pancreático y peripancreático desvitalizados. En una experiencia ulterior, sin embargo, el mismo autor logró disminuir en forma significa la incidencia de sepsis tardía mediante el empleo del lavado peritoneal durante un tiempo prolongado, mayor de siete días. Se desconoce el mecanismo de este efecto beneficioso. Tratamiento quirúrgico El tratamiento quirúrgico es una eventualidad necesaria en muchos pacientes con pancreatitis aguda grave (Tabla 10). Las medidas operativas que han sido propuestas pueden ser clasificadas en varias categorías, como se indica en la Tabla 11. Tabla 10.- Indicaciones de cirugía en la pancreatitis aguda grave. Aceptadas Diagnóstico diferencial Obstrucción biliar persistente Necrosis pancreática infectada Controvertidas >50% de necrosis pancreática estéril Imposibilidad de restablecer la alimentación Deterioro del estado clínico Absceso pancreático Síndrome compartimental abdominal Falla pluriparenquimatosa Tabla 11.- Medidas quirúrgicas en la pancreatitis aguda. 1.- Para limitar la gravedad de la inflamación pancreática: a. Cirugía sobre la vía biliar b. Endoscopía retrógrada con o sin esfinterotomía 2.- Para interrumpir la patogénesis de las complicaciones: a. Resección y drenaje pancreático (necrosis infectada) b. Lavado peritoneal 3.- Para el tratamiento de las complicaciones: a. Drenaje de abscesos Operaciones sobre la vía biliar. En nuestro medio, Acosta ha propuesto la cirugía precoz, dentro de las 48 horas del inicio de la enfermedad, para el tratamiento de la obstrucción biliar persistente en enfermos con pancreatitis aguda. Ranson y Welch, por su parte, son partidarios de la cirugía diferida en estas condiciones, ya que, según ellos, el riesgo de la cirugía precoz es muy elevado en pacientes con pancreatitis aguda grave. El estudio de Kelly y Wagner, confirma la idea de que la cirugía inmediata o temprana agrava el compromiso cardiovascular, respiratorio y renal de la pancreatitis grave, y que por lo tanto, no debería ser indicada. Por el contrario, en los enfermos estables la cirugía no agrava la pancreatitis a menos que se realicen procedimientos sobre el páncreas o maniobras excesivas a nivel de la papila. Esfinterotomía endoscópica. La colangiopancreatografía endoscópica retrógrada (ERCP) con o sin esfinterotomía ha sido propuesta como una terapéutica adecuada y posible de ser realizada en las primeras horas que siguen a una pancreatitis aguda. La misma puede ser realizada en forma segura por endoscopistas entrenados en el 90% de los casos de pancreatitis biliar. Cuanto más pronto se realice, más frecuentemente se hallarán cálculos impactados. Cuando se encuentra un cálculo impactado y se puede efectuar una esfinterotomía con extracción del mismo, se constata una rápida mejoría clínica. En los pacientes con un cálculo impactado, ictericia creciente y sepsis, la descompresión de urgencia es de gran beneficio. En estos casos se debe admitir que existe una colangitis concomitante, y el tratamiento de ésta es lo que explica los beneficios de la técnica. Neoptolemos ha publicado un estudio randomizado de 121 pacientes con pancreatitis biliar, en los cuales se evalúo la esfinterotomía endoscópica dentro de las 72 horas del inicio de los síntomas, en relación con el tratamiento convencional. En pacientes con pancreatitis leve a moderada, no se encontraron diferencias entre los dos grupos de tratamiento en relación a las complicaciones y al tiempo de internación. En contraste, en los pacientes con pancreatitis severa que fueron sometidos a una esfinterotomía de urgencia se constató una menor incidencia de complicaciones (24% vs 61%), una menor estadía en el hospital (9,5 vs 17 días) y un menor número de muertes (1 vs 5). En un estudio similar al precedente, Fan S. y colaboradores estudiaron 195 pacientes con pancreatitis aguda que fueron asignados al azar a uno de dos grupos. Noventa y siete pacientes fueron sometidos a ERCP con papilotomía endoscópica dentro de las 24 horas de la admisión, y 98 pacientes recibieron tratamiento conservador y ERCP con o sin papilotomía selectiva sólo si se producía un deterioro clínico. Comprobaron que la ERCP con o sin papilotomía resultó en una reducción de la sepsis biliar en comparación con el tratamiento conservador. Se produjeron complicaciones en el 18% de los pacientes sometidos a ERCP de emergencia y en el 29% de los asignados a tratamiento conservador, con una mortalidad total del 5 y 9%, respectivamente. Estudios recientes de Folsch y Nowak han reproducido los resultados anteriores. En adición, se ha realizado una revisión sistemática que incluye los cuatro estudios anteriores (Sharma y col.). Acosta y col., recientemente, compararon la eficacia de la ERCP con o sin esfinterotomía endoscópica versus el tratamiento conservador en un grupo de pacientes con pancreatitis biliar con obstrucción ampular persistente. Los pacientes del primer grupo eran sometidos a ERCP con o sin esfinterotomía dentro de las 48 horas del inicio de los síntomas si la obstrucción persistía por 24 horas o más, mientras que en el grupo control la ERCP era realizada si se consideraba necesaria después de las 48 horas. El estudio demostró que en pacientes con pancreatitis biliar y obstrucción ampular, la limitación de la duración de la obstrucción a no más de 48 horas disminuía la morbilidad. Los estudios precedentes han demostrado la ventaja de la realización de la esfinterotomía endoscópica con liberación de los cálculos, realizada entre las 24 y 72 horas de la admisión, en relación con el tratamiento médico exclusivo, en particular en aquellos pacientes cuyos síntomas se consideran severos desde el inicio, de acuerdo con los sistemas pronósticos descriptos. La ERCP siempre se debe realizar bajo cobertura antibiótica. Las recomendaciones de la Reunión de Consenso relativas al empleo del tratamiento endoscópico de la pancreatitis biliar incluyen: a.- En el contexto de una ictericia obstructiva, u otra evidencia de obstrucción aguda de la vía biliar y/o del tracto pancreático y pancreatitis aguda debida a litiasis sospechada o confirmada, se recomienda la realización de una ERCP urgente dentro de las 72 horas del comienzo de los síntomas. Si la ERCP no puede ser realizada, se deben considerar métodos alternativos de drenaje biliar. b.- En ausencia de ictericia obstructiva, pero con una pancreatitis aguda grave debida a litiasis sospechada o confirmada, se recomienda la ERCP dentro de las 72 horas del comienzo de los síntomas. Tratamiento definitivo de la patología biliar. La incidencia de pancreatitis aguda recurrente en pacientes que superan un episodio de oclusión biliar por cálculo es de 32 a 63%, y es muy recomendable la realización de una cirugía biliar definitiva una vez que el episodio de pancreatitis aguda se ha estabilizado. En la mayoría de los pacientes esto debe realizarse durante la misma hospitalización. La colecistectomía laparoscópica es la técnica recomendable en esta circunstancia. En la Fig. 20 se indica un algoritmo aceptable para el tratamiento de la pancreatitis de origen biliar. Obviamente, la ERCP y la esfinterotomía endoscópica deben ser realizadas por un profesional con experiencia en la técnica. Pancreatitis aguda biliar Moderada (Ranson < 3) Grave (Ranson > 3) ERCP + esfinterotomía endoscópica urgente (72 hs) Cuidado de soporte continuo Mejoría Deterioro clínico o signos de sepsis Colecistectomía laparoscópica electiva TAC dinámica No Necrosis pancreática Si Punción aspiración Sin infección Infección Cirugía a requerimiento Debridamiento y colecistectomía Fig. 20.- Propuesta de tratamiento de la pancreatitis de origen biliar. El momento de realización de la colecistectomía depende de la situación clínica. En los casos leves la colecistectomía se debe realizar tan pronto como el paciente se recupere, y preferiblemente durante la misma hospitalización que llevó a la admisión, a fin de prevenir una pancreatitis recurrente. En la pancreatitis aguda severa la colecistectomía se debe realizar tardíamente, cuando el proceso inflamatorio se ha resuelto y el procedimiento se puede realizar fácilmente. Si se desarrollan complicaciones locales, tales como necrosis infectada o pseudoquistes, la colecistectomía se debe realizar cuando se trata quirúrgicamente la complicación. Nealon y colaboradores han abordado el tema particular del momento de realización de la colecistectomía en pacientes que sobreviven a un episodio de pancreatitis aguda moderada a severa y que presentan colecciones fluidas peripancreáticas o pseudoquistes. En estos casos, los autores recomiendan demorar la operación hasta la resolución de los pseudoquistes o si estos persisten por más de seis semanas, proceder a su drenaje conjuntamente con la colecistectomía a partir de este momento. Tratamiento del síndrome compartimental abdominal. El tratamiento del SCA en pacientes con pancreatitis aguda severa se basa en el reconocimiento de las causas de aumento de la PIA. Si en un examen ecográfico se confirma la presencia de grandes cantidades de ascitis, el primer tratamiento será el drenaje percutaneo del exudado intraperitoneal, lo que se puede asociar con una significativa disminución de la PIA. En muchos casos, sin embargo, el edema visceral es el principal factor que contribuye al desarrollo de SCA, y la laparotomía descompresiva con cierre abdominal temporaria con una bolsa de Bogotá o similar constituye la manera más efectiva del disminuir la PIA. En estos casos se recomienda realizar una incisión vertical supra e infraumbilical, sin acceder al retroperitoneo. Si la decomprensión es realizada después de la segunda o tercera semana desde el inicio de la enfermedad y existe evidencia de necrosis extensa en la TAC o una infección establecida, se deberá realizar una necrosectomía en conjunto con la laparotomía decompresiva. Aunque la sobrevida informada de pacientes sometidos a decomprensión abdominal por un SCA en la pancreatitis aguda severa es baja, la decomprensión precoz se asocia con una mejor evolución que la decomprensión tardía o la falta de ella. Debridamiento quirúrgico del páncreas o necrosectomía. Se admite que aproximadamente el 40% de los pacientes con necrosis pancreática o peripancreática presentan una infección secundaria del área de necrosis. En tal circunstancia, es necesario recurrir a la necrosectomía. Existe un grupo de pacientes que necesitan una laparotomía en ausencia de infección para descomprimir un síndrome compartimental abdominal (SCA) significativo. El SCA se manifiesta clínicamente por aumento de la presión en la vía aérea, disminución del volumen minuto cardiaco, y oliguria o anuria a pesar de un reemplazo de volemia adecuado. El momento de la intervención quirúrgica en la pancreatitis aguda severa aún es tema de discusión. La tendencia es demorar lo más posible las intervenciones sobre el páncreas, con el objeto de permitir la delimitación de los procesos patológicos. Las intervenciones precoces, en la primera semana de la enfermedad, sólo están indicadas en el pequeño grupo de pacientes con formas fulminantes de pancreatitis o con contaminación bacteriana comprobada de la necrosis. Cada vez son más los pacientes con necrosis estéril que pueden ser tratados adecuadamente con tratamiento médico intensivo, sin la necesidad de intervención quirúrgica. El riesgo de las operaciones precoces en pacientes con necrosis estéril es convertir la necrosis remanente luego de la necrosectomía inicial en una necrosis infectada por contaminación bacteriana secundaria. La mortalidad operatoria es baja en pacientes con necrosis estéril operados después de la primera semana. Las colecciones pequeñas probablemente se resuelvan de manera espontanea, y las colecciones grandes se operarán en función de la signología y de la evolución tomográfica. La mayoría de los cirujanos recomiendan una laparotomía amplia. Se considera que un drenaje adecuado consiste no sólo en la evacuación de las colecciones purulentas, sino sobre todo en la extirpación de los tejidos necróticos peripancreáticos. Es habitual dejar gruesos tubos de drenaje en la zona operatoria para proceder al lavaje continuo durante el posoperatorio. Una observación importante es que el proceso necrótico es dinámico y continuo, pudiendo persistir hasta dos semanas luego del debridamiento inicial. Una segunda exploración es la forma de tratamiento más empleada en la necrosis persistente, aunque si existe localización precisa del foco y las condiciones son favorables, se puede utilizar el abordaje posterior o la vía percutanea. En casos seleccionados se recomienda dejar el abdomen abierto. Las ventajas del método derivan de no cerrar la pared abdominal y poder realizar curaciones repetidas. Esto puede beneficiar al paciente crítico al disminuir la presión intraabdominal, lo cual favorece las funciones respiratoria y renal y mejora la circulación esplácnica. La principal ventaja del método es la evacuación repetida de los tejidos necróticos neoformados que no se eliminan por los tubos de drenaje. Su mayor inconveniente es el riesgo de fistulización intestinal y de hemorragias. La elevada mortalidad en la necrosis pancreática infectada a pesar de la cirugía ha conducido al desarrollo de varias técnicas mínimamente invasivas, incluyendo procedimientos radiológicos, endoscópicos y laparoscópicos. La razón es minimizar el estrés peri y posoperatorio en pacientes críticamente enfermos con falla multiorgánica. Adicionalmente, estas técnicas pueden ser utilizadas para controlar inicialmente la sepsis y demorar la cirugía hasta que se logre una mejor demarcación del tejido necrótico. En los últimos años se ha reportado una experiencia creciente con el empleo de procedimientos laparoscópicos para el tratamiento de la necrosis pancreática. El abordaje laparoscópico se puede realizar por distintas vías, incluyendo la transmesocólica, transgástrica, transgastrocólica y retroperitoneal. Antes de completar la operación, se deben colocar gruesos tubos para realizar lavaje posoperatorio, aunque la necesidad exacta de esta medida aún es controvertida. Recientemente se ha informado sobre la posibilidad del drenaje percutaneo de los abscesos pancreáticos (Freeny y col). La mayor dificultad del drenaje percutaneo es la imposibilidad de debridar los tejidos necróticos y exponer toda la extensión y las loculaciones de una cavidad laberíntica. En tal sentido, el concepto aceptado es que si bien los abscesos son susceptibles del drenaje percutáneo, rara vez es posible obtener resultados satisfactorios en presencia de una necrosis infectada. Gambiez y colaboradores han propuesto una vía de acceso retroperitoneal de las colecciones necróticas retroperitoneales, lo cual evitaría la apertura de la cavidad abdominal. La técnica no es excluyente, y puede combinarse secundariamente con una laparotomía si es necesario. La indicación preferencial de este método es la presencia de colecciones heterogéneas de necrosis con contaminación bacteriana. Castellanos y colaboradores, por su parte, han utilizado la técnica combinada con la retroperitoneoscopía para el tratamiento y el control evolutivo de la necrosis pancreática infectada. En la Reunión de Consenso precitada (Nathens y col.) se establecieron recomendaciones con respecto al tratamiento de la necrosis pancreática estéril. Varias series de casos describen el curso de pacientes con pancreatitis aguda severa y necrosis estéril tratados sin debridamiento. A partir de estos datos, es claro que los pacientes sin evidencias de infección pancreática pueden ser manejados sin cirugía con baja incidencia de morbilidad y mortalidad, aun en la etapa de disfunción orgánica. El deterioro clínico no es necesariamente una indicación para el debridamiento quirúrgico. El riesgo significativo de injuria intestinal iatrogénica, hemorragia, y abdomen abierto, y de infección de la necrosis pancreática estéril debe ser cuidadosamente considerado cuando se plantea esta posibilidad. Una excepción sería el paciente con imposibilidad de retomar la alimentación enteral, por agravamiento y dolor persistente, en cuyo caso puede ser imprescindible el debridamiento del área de necrosis. BIBLIOGRAFIA Acosta J., Ledesma C.: Gallstone migration as a cause of acute pancreatitis. N Engl J Med 290:4941974 Acosta J., Katkhouda N., Debian K.: Early ductal decompression versus conservative management for gallstone pancreatitis with ampullary obstruction. A prospective randomized clinical trial. Ann Surg 243:33-2006 Advanitakis M., Delhaye M., Maertelaere V.: Computed tomography and magnetic resonance imaging in the assessment of acute pancreatitis. Gastroenterology 126:715-2004 Almofarreh M., Laajan M., Tikoo N.: The role of ERCP in the management of gallstone-associated acute pancreatitis. Ann of Saudi Medic 12:334-1992 Ammori B.: Role of the gut in the course of severe acute pancreatitis. Pancreas 26:122-2003 Arnell T., Virgilio C., Chang L.: Admission factors can predict the need for ICU monitoring in gallstone pancreatitis. American Surgeon 62:815-1996 Baker C., Toan Huynh : Acute pancreatitis: surgical management. Crit Care Clin 11:311-1995 Balthazar E., Robinson D.: Acute pancreatitis: value of CT in establishing prognosis. Radiology 174:331-1990 Balthazar E., Freeny P.: Imaging and intervention in acute pancreatitis. Radiology 193:297-1994 Balthazar E.: Staging of acute pancreatitis. Radiol Clin N Am 40:1199-2002 Balthazar E.: Complications of acute pancreatitis. Clinical and CT evaluation. Radiol Clin N Am 40:1211-2002 Balthazar E.: Acute pancreatitis: assessment of severity with clinical and CT evaluation. Radiology 223:603-2002 Barie P.: A critical review of antibiotic prophylaxis in severe acute pancreatitis. Amer J Surg 170:38S-1996 Baril N., Ralls P., Wren S.: Does an infected peripancreatic fluid collection or abscess mandate operation? Ann Surg 231:361-2000 Baron T., Morgan D.: Acute necrotizing pancreatitis. N Engl J Med 340:1412-1999 Baxter J., Imrie C., McKay C.: Acute pancreatitis and octreotide. Lancet 338-1991 Beger H.: Results of surgical treatment of necrotizing pancreatitis. World J Surg 9:972-1985 Beger H., Rau B., Mayer J.: Natural course of acute pancreatitis. World J Surg 21:130-1997 Blomey S., Osborne H.: The early identification of patients with gallstone associated pancreatitis using clinical and biochemical factors only. Ann Surg 198:574-1983 Bourke J., Nead G.: Drug associated primary acute pancreatitis. Lancet 1:706-1978 Bradley E. (III): A clinically based classification system for acute pancreatitis. Summary of the International Symposium on Acute Pancreatitis. Atlanta. Arch Surg 128:586-1993 British Society of Gastroenterology: United Kingdom guidelines for the management of acute pancreatitis. Gut 42 (Suppl 2):S1-1998 Buchler M., Gloor B., Muller Ch.: Acute necrotizing pancreatitis: treatment strategy according to the status of infection. Ann Surg 232:619-2000 Burns G., Bank S.: Disorders of the pancreas: current issues in diagnosis and management. Mc Graw-Hill Inc New York 1992 Carballo Alvarez F.: Somatostatina en el tratamiento de la pancreatitis aguda humana: meta análisis. Acta Chir Cataloniae 12: 119-1991 Carr Locke D.: Role of endoscopy in gallstone pancreatitis. Amer J Surg 165:519-1993 Castellanos G., Piñero A., Serrano A.: Infected pancreatic necrosis: translumbar approach and management with retroperitoneoscopy. Arch Surg 137:1060-2002 Chi-Leung Liu, Chung Mau Lo: Acute biliary pancreatitis: diagnosis and management. World J Surg 21:149-1997 Club del Páncreas Argentina: Reunión de Consenso sobre Pancreatitis Aguda. Buenos Aires, 1998 Dassopoulos T., Ehrenpreis E.: Acute pancreatitis in HIV-infected patients: a review. Amer J Med 107:78-1999 Deziel D., Doolas A.: Pancreatic abscess and pancreatic necrosis: Current concepts and controversies. Problems in General Surg 7:415-1990 De Waele J., Vogelaers D., Blot S.: Fungal infections in patients with severe acute pancreatitis and the use of prophylactic therapy. Clin Infect Dis 37:208-2003 De Waele J., Blot S., Colardyn F.: Bloodstream infections after surgery for severe acute pancreatitis. Pancreas 28:391-2004 De Waele J., Hoste E., Blot S.: Intra-abdominal hypertension in patients with severe acute pancreatitis. Critical Care 9:R452 (DOI 10.1186/cc3754)-2005 Diehl A., Holleman D., Chapman J.: Gallstone size and risk of pancreatitis. Arch Intern Med 157:1674-1997 Doglietto G., Gui D., Pacelli F.: Open vs closed treatment of secondary pancreatic infection. Arch Surg 129:689-1994 Eatock F., Chong P., Menezes N.: Nasogastric feeding is a safe and practical alternative feeding in severe acute pancreatitis: a randomized controlled trial. Pancreatology 1:A149-2001 Escot J., Fournier D.: Diagnostic clinic et biologique des pancreatitis aigues. Rev Prat 31:243-1981 Fan S.T., Lai E., Mok F.: Early treatment of acute biliary pancreatitis by endoscopic papillotomy. N Engl J Med 328:228-1993 Ferguson C., Bradley E.: Can markers for pancreatic necrosis be used as indicators for surgery? Amer J of Surg 160:459-1990 Fernandez Cruz L., Navarro S., Valderrama R.: Acute necrotizing pancreatitis: a multicenter study. Hepatogastroenterology 41:185-1994 Fernandez Cruz L., Navarro S.: Late outcome after acute pancreatitis. World J Surg 21:169-1997 Fiedler F., Jauernig G., Keim V.: Octreotide treatment in patients with necrotizing pancreatitis and pulmonary failure. Intensive Care Med 22:909-1996 Foitzik T., Fernandez C., Ferraro M.: Pathogenesis and prevention of early pancreatic infection in experimental acute necrotizing pancreatitis. Ann Surg 222:179-1995 Folsch U., Nitsche R., Ludtke R.: Early ERCP and papillotomy compared with conservative treatment for acute biliary pancreatitis. N Engl J Med 336:237-1997 Forsmark C., Toskes P.: Acute pancreatitis: medical management. Crit Care Clin 11:311-1995 Freeny P., Hauptmann E., Althous S.: Percutaneous CT-guided catheter drainage of infected acute necrotizing pancreatitis. Am J Roentgenol 170:969-1998 Frey Ch.: Management of necrotizing pancreatitis. West J Med 159:675-1993 Gambiez L., Denimal F., Porte H.: Retroperitoneal approach and endoscopic management of peripancreatic necrosis collections. Arch Surg 133:66-1998 Golub R., Siddiqi F., Pohl D.: Role of antiotics in acute pancreatitis: a meta-analysis. J Gastrointest Surg 2:496-1998 Gotzinger P., Sutner T., Kriwanek S.: Surgical treatment for severe acute pancreatitis: extent and surgical control of necrosis determine outcome. World J Surg 26:474-2002 Granger J., Remick D.: Acute pancreatitis: models, markers, and mediators. Shock 24:(Suppl 1) 452005 Grendell J.: Acute pancreatitis. Curr Opinion in Gastroent 14:376-1998 Hauser H.: Acute pancreatitis: radiological evaluation. Helvetica Chir Acta 59:35-1992 Heinerman M., Mayer F.: Combined endoscopic surgical management of acute biliary pancreatitis. Wiener Klin Wochensch 104:448-1992 Hill M., Huntington D.: Computed tomography and acute pancreatitis. Gastroent Clin of North Amer 19:811-1990 Ho H., Frey C.: Gastrointestinal and pancreatic complications associated with severe pancreatitis. Arch Surg 130:817-1995 Hoerauf A., Hammer S., Muller B.: Intra-abdominal Candida infection during acute necrotizing pancreatitis has a high prevalence and is associated with increased mortality. Crit Care Med 26:2010-1998 Howard T., Wiebke E., Mogavero G.: Classification and treatment of local septic complications in acute pancreatitis. Amer J Surg 170:44-1995 Isenmann R., Schwarz M., Rau B.: Characteristics of infection with Candida species in patients with necrotizing pancreatitis. World J Surg 25:372-2002 Isenmann R., and the German Antibiotics in Severe Acute Pancreatitis (ASAP) Study Group: Prophylactic antibiotic treatment in patients with predicted severe acute pancreatitis: a placebo-controlled, double-blind trial. Gastroenterology 126:997-2004 Johnson C., Abu-Hilal M.: Persistent organ failure during the first week as a marker of fatal outcome in acute pancreatitis. Gut 53:1340-2004 Kalfarentzos F., Kahagias J., Mead N.: Enteral nutrition is superior to parenteral nutrition in severe acute pancreatitis: results of a randomized prospective trial. Br J Surg 85:1665-1997 Karne S., Gorelick F.: Etiopathogenesis of acute pancreatitis. Surg Clin North Amer 79:699-1999 Kelly T., Wagner D.: Gallstone pancreatitis: a prospective randomized trial of the timing of surgery. Surgery 104:600-1988 Kelly T., Elliot D.: Proper timing of surgery for gallstone pancreatitis. Amer J Surg 159:361-1990 Kelly T., Elliot D.: The management of gallstone pancreatitis in the era of laparoscopic cholecystectomy. Amer J Surg 172:225-1996 Kemppenen E., Sainio H., Haapianen L.: Early localization of necrosis by contrast-enhanced CT can predict outcome in severe acute pancreatitis. Br J Surg 83:924-1996 Kes P., Vucicevic Z.: Acute renal failure complicating severe acute pancreatitis. Renal Failure 18:621-1996 Kirchner R., Lausen M.: Acute gallstone pancreatitis. Dig Surg 7:1-1990 Klar E.: Etiology and pathogenesis of acute pancreatitis. Helvetica Chir Acta 59:7-1992 Kotani J., Usami M., Nomura H.: Enteral nutrition prevents bacterial translocation but does not improve survival during acute pancreatitis. Arch Surg 134:287-1999 Larvin M., McMahon M.: APACHE II escore for assessment and monitoring of acute pancreatitis. Lancet 201-July 22-1989 Latifi R., McIntosh J., Dudrick S.: Nutritional management of acute and chronic pancreatitis. Surg Clin North Amer 71:579-1991 Leach S., Gorelick F.: New perspectives on acute pancreatitis. Scand J of Gastroent 27:S1992-291992 Lee S., Nichols J.: Biliary sludge as a cause of acute pancreatitis. N Engl J Med 326:589-1992 Leppaniemi A., Kemppainen E.: Recent advances in the surgical management of necrotizing pancreatitis Curr Opin Crit Care 11:349-2005 Leppaniemi A., Kirkpatrick A., Salazar A.: Miscellaneous conditions and ACS: severe acute pancreatitis. En Abdominal Compartment Syndrome, edited by Rao Ivatury, Michael Cheatham, Manu Malbrain and Michael Sugrue. Eurekah.com. 2005 Luiten E., Hop W., Lange J.: Differential prognosis of Gram negative versus Gram positive infected and sterile pancreati necrosis: results of a randomized trial in patients with severe acute pancreatitis treated with adjuvant selective decontamination. Clin Infect Dis 25:811-1997 Luiten E., Hop W., Endtz H.: Prognostic importance of gram-negative intestinal colonization preceding pancreatic infection in severe acute pancreatitis. Intensive Care Med 24:438-1998 Malcynski J., Iwanow I.: Severe pancreatitis: determinants of mortality in a tertiary referral center. Arch Surg 131:242-1996 Manes G., Rabitti P., Menchise A.: Prophylaxis with meropenem of septic complications in acute pancreatitis. Pancreas 27:e79-2003 Maravi Poma E., Gener J., Alvarez Lerma F.: Early antibiotic treatment of septic complications in severe acute necrotizing pancreatitis. Intensive Care Med 29:1974-2003 Marik P., Zaloga G.: Meta-analysis of parenteral nutrition versus enteral nutrition in patients with acute pancreatitis. BMJ, doi:10.1136/bmj.38118.593900.55 (published 2 june 2004) Marshall J.: Acute pancreatitis: a review with an emphasis on new developments. Arch Intern Med 153:1185-1993 McClave S., Spain D., Snider H.: Nutritional support in acute and chronic pancreatitis. Gastroenterol Clin North Amer 27:421-1998 McClave S., Snider H.: The gut in nutritional management of acute pancreatitis. Clin Perspectives in Gastroenterol 86: March/April 1999 Medich D., Lee T., Melhem M.: Pathogenesis of pancreatic sepsis. Amer J of Surg 165:46-1993 Meyer P., Clavieu P., Robert J.: Role of imaging technics in the classification of acute pancreatitis. Dig Dis 10:330-1992 Millat B., Fingerhut A.: Predictability of clinicobiochemical scoring systems for early identification of severe gallstone associated pancreatitis. Amer J Surg 164:32-1992 Mizuguchi T., Mukaiya M., Imaizumi H.: Successful management of severe acute pancreatitis with multiple organ failure. Pancreas 28:211-2004 Mosimann F.: Diagnosis of acute pancreatitis. Helvetica Chir Acta 59:17-1992 Murray B., Carter R., Imrie C.: Diclofenac reduces the incidence of acute pancreatitis after endoscopic retrograde cholangiopancreatography. Gastroenterology 124:1786-2003 Nagar A., Gorelick S.: Acute pancreatitis. Curr Opin Gastroenterol 20:439-2004 Nathens A., Curtis J., Beale R.: Management of the critically ill patient with severe acute pancreatitis. Crit Care Med 32:2524-2004 Nealon W., Bawduniak J., Walser E.: Appropriate timing of cholecystectomy in patients who present with moderate to severe gallstone-associated acute pancreatitis with peripancreatic fluid collections. Ann Surg 239:741-2004 Neoptolemos J., Carr Locke D., y colaboradores: Controlled trial of urgent endoscopic retrograde cholangiopancreatography and endoscopic sphincterotomy versus conservative treatment for acute pancreatitis due to gallstones. Lancet 2:979-1988 Niederau C., Hippenstiel J.: Conservative management of acute pancreatitis: complications and outcome in a community-based hospital. Pancreas 32:67-2006 Nowak A., Nowakowska E., Marek T.: Final results of the prospective, randomised, controlled study on endoscopic sphincterotomy versus conventional management in acute biliary pancreatitis. Gastroenterology 108:A380-1995 Olsen H.: Pancreatitis: a prospective clinical evaluation of 100 cases and review of the literature. Amer J Digest Dis 19:1077-1974 Oria A.: Adelantos en el diagnóstico y tratamiento de la patología pancreática benigna. Rev Arg de Cirugía N° Extraordinario 1989 Patti M., Pellegrini C.: Gallstone pancreatitis. Surg Clin of North Amer 70:1277-1990 Pederzoli P., Bassi C., Vesentini S.: A randomized multicenter trial of antibiotic prophylaxis of septic complications in acute necrotizing pancreatitis with imipenem. Surg Gynecol Obstet 176:480-1993 Pellegrini C.: Surgery for gallstone pancreatitis. Amer J Surg 165:515-1993 Perez Mateo M., Boix V.: Analisis critico de los ensayos clínicos de pancreatitis aguda publicados entre 1983 y 1989. Med Clin (Barc) 96:371-1991 Pisters P., Ranson J.: Nutritional support for acute pancreatitis. Surg Gyn Obst 175:275-1992 Ranson J.: Acute pancreatitis: where are we? Surg Clin North Amer 61:55-1981 Ranson J.: The role of surgery in the management of acute pancreatitis Ann Surg 211:382-1990 Ranson J., Berman R.: Long peritoneal lavage decreases pancreatic sepsis in acute pancreatitis. Ann of Surg 211:708-1990 Ranson J.: Complications of pancreatitis. En Taylor M.: Gastrointestinal emergencies. Williams and Wilkins. Baltimore 1992 Rau B., Uhl W., Buchler M.: Surgical treatment of infected necrosis. World J Surg 21:155-1997 Reynaert M., Dugernier T.: Clinical evaluation, evolution, and intensive care treatment of severe acute pancreatitis. Helvetica Chir Acta 59:27-1992 Riche F., Cholley B., Laisne M.: Inflammatory cytokines, C reactive protein, and procalcitonin as early predictors of necrosis infection in acute necrotizing pancreatitis. Surgery 133:257-2003 Rivers E., Nguyen B., Havstad S.: Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med 345:1368-2001 Robin A., Campbell R., Palani C.: Total parenteral nutrition during acute pancreatitis: Clinical experience with 156 patients. World J Surg 14:572-1990 Rottner D., Warshaw A.: Surgical intervention in acute pancreatitis. Crit Care Med 16:89-1988 Runzi M., Niebel W., Goebell H.: Severe acute pancreatitis: nonsurgical treatment of infected necroses. Pancreas 30:195-2005 Sainio V., Kemppainen E., Puolakkainen P.: Early antibiotic treatment in acute necrotising pancreatitis. Lancet 346:663-1995 Santhi Swarrop V., Chari S., Clain J. : Severe acute pancreatitis. JAMA 291:2865-2004 Shanmugam N., Isenmann R., Barkin J.: Pancreatic fungal infection. Pancreas 27:133-2003 Sharma V., Howden C.: Metaanalysis of randomized controlled trials of endoscopic retrograde cholangiography and endoscopic sphincterotomy for the treatment of acute biliary pancreatitis. Am J Gastroenterol 94:3211-1999 Sharma V., Howden C.: Prophylactic antibiotic administration reduces sepsis and mortality in acute necrotizing pancreatitis: a meta-analysis. Pancreas: 22:28-2001 Simchuk E., Traverso W., Nukui Y.: Computed tomography severity index is a predictor of outcomes for severe pancreatitis. Am J Surg 179:352-2000 Slakey D., Johnson C.: Management of severe pancreatitis in renal transplant recipients. Ann Surg 225:217-1997 Solomkin J., Umansky K.: Intraabdominal sepsis: newer interventional and antimicrobial therapies for infected necrotizing pancreatitis. Curr Opin Crit Care 9:424-2003 Steer M.: Acute pancreatitis. En Taylor M.: Gastrointestinal emergencies. Williams and Wilkins. Baltimore 1992 Steinberg W.: Predictors of severity of acute pancreatitis. Gastroent Clin of North Amer 19:8491990 Sternby B., Brien J.: What is the best biochemical test to diagnose acute pancreatitis? Mayo Clin Proc 71:1138-1996 Tao H., Zhang J., Zou S.: Clinical characteristics and management of patients with early acute severe pancreatitis. Experience from a medical center in China. World J Gastroenterol 10:919-2004 Tenner S., Banks P.: Acute pancreatitis: nonsurgical management. World J Surg 21:143-1997 Traverso L., Kozarek R.: Interventional management of peripancreatic fluid collections. Surg Clin North Amer 79:745-1999 Turner M.: The role of US and CT in pancreatitis. Gastrointestinal Endosc 56(Suppl)S241-2002 UK Working Party on Acute Pancreatitis: UK guidelines for the management of acute pancreatitis. Gut 54:(Suppl III):iii1, doi:10.1136-2005 Vincent J.: Organ dysfunction as an outcome measure: The SOFA Score. Sepsis 1:53-1997 Warshaw A.: Pancreatic necrosis: to debride or not to debride: that is the question. Ann Surg 232:627-2000 Weber C., Adler G.: Acute pancreatitis. Curr Opin Gstroenterol 19:447-2003 Werner J., Feuerbach S., Uhl W.: Management of acute pancreatitis: from surgery to interventional intensive care. Gut 54:426-2005 Wilson C., Imrie C.: Current concepts in the management of pancreatitis. Drugs 41:358-1991 Wyncoll D.: The management of severe acute necrotizing pancreatitis: an evidence-based review of the literature. Intensive Care Med 25:146-1999 Yadav D., Pitchumoni C.: Issues in hyperlipidemic pancreatitis. J Clin Gastroenterol 36:54-2003 Yousaf M., McCallion K., Diamond T.: Management of severe acute pancreatitis. Brit J Surg 90:407-2003 Z’graggen K., Aronsky D.: Acute postoperative pancreatitis after laparoscopic cholecystectomy. Arch Surg 132:1026-1997