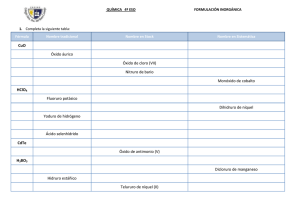
FORMULACIÓN QUÍMICA INORGÁNICA INTRODUCCIÓN
Anuncio

FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR INTRODUCCIÓN • En el desarrollo de la nomenclatura química han surgido varios sistemas para la construcción de los nombres de los elementos y compuestos químicos. Cada uno de los sistemas tiene su propio conjunto de reglas. • Algunos sistemas son de aplicación general; en cambio, otros han surgido de la necesidad de usar sistemas más especializados en áreas determinadas de la química. • Las últimas recomendaciones de la IUPAC para la formulación y nomenclatura de las sustancias inorgánicas, introducen novedades muy llamativas: Los compuestos de los halógenos con el oxígeno no se nombran como óxidos, sino como haluros de oxígeno. Se modifica la nomenclatura sistemática de los oxoácidos y las oxosales. Se suprimen los nombres de fosfina, arsina y estibina y se sustituyen por azano, fosfano, arsano estibano. (sin embargo se acepta el nombre de amoniaco para el NH3 reservando azano para los derivados sustituidos, en la nomenclatura de sustitución, como nombre de hidruro progenitor) Se modifica la nomenclatura de iones. • En concreto, en lo referente a la química inorgánica, se considera que las sustancias inorgánicas pueden ser nombradas basándose en los tres sistemas de nomenclatura siguientes: La nomenclatura de composición. La nomenclatura de sustitución solo puede usarse en determinadas áreas. La nomenclatura de adición: es quizás la que puede usarse de forma más generalizada en química inorgánica. • La nomenclatura de sustitución y de adición requiere el conocimiento de la estructura de las especies químicas que van a ser nombradas. • En cambio, la nomenclatura de composición puede usarse cuando no es necesario aportar información sobre la estructura de las sustancias, o no se conoce, y sólo se indica la estequiometría o composición. 1 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR NOMENCLATURA DE COMPOSICIÓN. (IR-5.1) La nomenclatura de composición está basada formalmente en la composición, y no en la estructura, y es la que se debe utilizar si no se dispone de información estructural o si ésta es mínima. El tipo de nombre de composición más sencillo (1ª categoría de nombres de composición) es el nombre estequiométrico, que es solamente el reflejo de la fórmula empírica o de la molecular. (IR-5.2). Un nombre estequiométrico puro no transmite información ninguna sobre la estructura del compuesto. Las proporciones de los elementos constituyentes en los nombres estequiométricos pueden indicarse de varias maneras: utilizando prefijos multiplicadores (mono, di, tri…) utilizando números de oxidación del elemento (en romanos, en paréntesis mediante el sistema de Stock) utilizando números de carga de los iones, (mediante los números de Ewens-Basset: números arábigos seguido del signo correspondiente). En el caso más sencillo, en el que la especie a denominar consta de un solo elemento, el nombre se forma añadiendo el prefijo multiplicador pertinente al nombre del elemento. Por ejemplo octaazufre, S8 . Al construir el nombre estequiométrico de un compuesto binario, uno de los elementos se clasifica como el constituyente electropositivo y el otro como el constituyente electronegativo. El constituyente electropositivo, es por convenio el elemento que aparece en último lugar en la secuencia de la Tabla VI y su nombre es el del propio elemento sin modificar (Tabla I). El nombre del constituyente electronegativo se construye modificando el nombre del elemento con la terminación –uro (-ide en terminología inglesa). El nombre estequiométrico del compuesto se forma combinando el nombre del constituyente electronegativo, que se cita primero, con el del constituyente electropositivo, ambos debidamente calificados con los prefijos multiplicadores adecuados (mono,di,tri, tetra, penta…), (Tabla IV). Los prefijos multiplicadores preceden a los nombres a los que afectan y se les unen sin espacios ni guiones. Las vocales finales de los prefijos numéricos no deben elidirse, aunque una 2 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR excepción permitida por el uso general es “monóxido” en lugar de monooxido. Las dos partes del nombre se separan por la preposición “de” con un espacio a ambos lados. Los nombres estequiométricos pueden corresponder a la fórmula empírica o a una fórmula molecular diferente de la empírica. Los prefijos multiplicadores no son necesarios en los nombres binarios cuando no hay ambigüedad en la estequiometria del compuesto, (fosfuro de calcio). El prefijo “mono” es hablando estrictamente, superfluo y se necesita solamente para enfatizar la estequiometria cuando se comentan sustancias relacionadas por la composición. Ejemplo: NO, NO2, N2O4 Alternativamente, las proporciones de los constituyentes pueden indicarse usando números de oxidación o números de carga) Por último, añadir que para formar el nombre de composición de los compuestos que contienen más de dos elementos se necesitan convenios adicionales. Ejemplos de lo expuesto: Cloruro de hidrógeno HCl Monóxido de nitrógeno NO Dióxido de nitrógeno NO2 Tetraóxido de dinitrógeno N2O4 Dicloruro de oxígeno OCl2 Cloruro de dioxígeno Cl2O Tetraóxido de trihierro Fe3O4 Carburo de silicio SiC Tetracloruro de silicio SiCl4 Difosfuro de tricalcio Fosfuro de calcio Ca3P2 Estannuro de níquel NiSn Octacincuro de pentacobre Cu5Zn8 Hexacarburo de tricosacromo Cr23C6 3 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR En un nombre estequiométrico no es necesario especificar las cargas de los átomos. Sin embargo, en muchos casos se sabe que los átomos o grupos de átomos tienen una carga determinada; por ello, en la nomenclatura de composición el nombre de un compuesto puede incluir los nombres de los iones individuales construidos como nombres estequiométricos, si bien admiten otros principios… (IR-5.3) Un catión es una especie monoatómica o poliatómica que tiene una o más cargas positivas. La carga de un catión puede indicarse en los nombres y en las fórmulas usando el número de carga, o bien, en el caso de los cationes que se nombren de forma aditiva, con el(los) nº(s) de oxidación del átomo(s) central(es) (IR-5.4.4.2) El nombre de un catión monoatómico es el del elemento con el número de carga pertinente añadido entre paréntesis. Los electrones desapareados en cationes monoatómicos pueden indicarse con un punto radical, es decir, un punto centrado en la línea, delante de la carga y precedido por un número si fuese necesario. Sodio(1+) Cromo(3+) Na+ Cr3+ Cobre(1+) Cobre(2+) Cu+ Cu2+ I+ Yodo(1+) . .+ Oxígeno( 1+) O Helio(.+) He Hidrógeno(1+), Protio (1+), Deuterio(1+), Tritio(1+), hidrón protón deuterón tritón .+ H+ (mezcla de los tres isótopos) 1 + H 2 + H 3 + H Los cationes homopoliatómicos se nombran añadiendo el número de carga al nombre estequiométrico de la especie neutra correspondiente, es decir, al nombre del elemento con el 4 FORMULACIÓN QUÍMICA INORGÁNICA IES SIERRA SUR FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 prefijo multiplicador adecuado. Puede añadírsele un punto o puntos de radical para indicar la presencia de electrones desapareados O2+ Dioxígeno(1+) . .+ Dioxígeno( 1+) O2 Tetraazufufre(2+) S42+ Dimercurio(2+) Hg22+ Pentabismuto(4+) Bi54+ Trihidrógeno(1+) H3+ . Dinitrógeno (2 2+) N (2.)2+ Los cationes heteropoliatómicos se nombran generalmente mediante las nomenclaturas de sustitución (IR6.4) o de adición (IR-7). Los nombres de sustitución no requieren el número de carga, porque el nombre en sí mismo implica la carga. Para indicar la presencia de electrones desapareados, se puede añadir puntos de radical a los nombres de adición. Amonio, no sistemático, aceptado por la IUPAC NH4+ Fosfanio (de sustitución) PH4+ Tetrafluoroestibanio (de sustitución) Tetrafluoroantimonio(1+) (de adición) Tetrafluoroantimonio(V) (de adición) SbF4+ . Boranioilo (de sustitución) BH3 + Oxidanodiio (de sustitución) H4O2+ Oxonio, no sistemático, aceptado por la IUPAC, H3O+ Azanio (de sustitución) . Trihidruroboro( 1+) (de adición) Oxidanio (de sustitución) no es hidronio 5 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Un anión es una especie monoatómica o poliatómica que tiene una o más cargas negativas. La carga de un anión se indica en el nombre usando el número de carga, o con el número de oxidación del átomo central o de los átomos centrales si se trata de un anión nombrado mediante la nomenclatura de adición (5.4.2.2). Las terminaciones de los nombres de los aniones son. –uro (para las especies monoatómicas, homopoliatómicas o heteropoliatómicas cuyo nombre procede de un hidruro progenitor), -ato (para las especies heteropoliatómicas nombradas por adición), e –ito que se usa en unos pocos casos que se aceptan todavía, pero que no derivan de la nomenclatura sistemática actual. Cuando no exista ambigüedad puede omitirse el número de carga. Los nombres basados en hidruros progenitores no llevan números de carga porque el nombre en sí implica la carga. Cloruro(1-) Cl- Disulfuro(2-) S22- Fosfanuro PH2- Cloruro (no presenta ambigüedad) Basado en hidruro progenitor, no necesita explictar la carga Fosfanodiuro PH2- Basado en hidruro progenitor, no necesita explictar la carga Tetraclorurocobalto(2-) o [CoCl4]2- De adición Tetraclorurocobalto(II) Dioxonitrato(1-) o nitrito NO2- Silanuro SiH3- Germanuro GeH3- Sulfanuro SH- Diazano-1,2-diuro - Tricloruroestannuro SnCl3- Boranuuro BH4- HNNHLa adición de un hidruro H- a un hidruro progenitor se indica con la terminación -uuro 6 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR El nombre de un anión monoatómico es el nombre del elemento modificado para que lleve el indicador de anión –uro, que se forma o bien reemplazando la terminación del nombre del elemento (-eso,-ico, -io, -o, -ógeno, -ono, -oro) por –uro, o añadiendo directamente la terminación –uro al nombre del elemento. Cloro: cloruro, carbono: carburo, xenón: xenonuro, wolframo: wolframuro; Bismuto: bismuturo, germanio: germuro; se reserva germanuro para el ión GeH3- (es excepción. Oxígeno. Óxido). Algunos de los nombres de los aniones monoatómicos se basan en la raíz del nombre del elemento en latín; en estos casos se reemplaza la terminación “um” o “ium” por –uro. Ejemplos: plata, argentum, argenturo; oro, aurum, aururo; cobre, cuprum, cupruro; hierro, ferrum, ferruro; plomo, plumnbum, plumburo,; estaño, estannum, estannuro (ver todos los nombres modificados en Tabla IX). Cuando sea necesario se puede añadir los números de carga y los puntos de radical para identificar completamente a los aniones. Los aniones homopoliatómicos se nombran añadiendo el número de carga al nombre estequiométrico de las especies correspondientes, es decir al nombre modificado del elemento con el prefijo multiplicador pertinente. Puede añadirse el punto radical si fuese conveniente. En algunos casos los nombres no sistematicos son, todavía, alternativas aceptables. Dióxido(1-) . o O2- Superóxido .- Nombre alternativo aceptado por la IUPAC Dióxido( 1-) O2 Dióxido(2-) O22- Peróxido Nombre alternativo aceptado por la IUPAC Trióxido(1-) O3 - Ozónido Nombre alternativo aceptado por la IUPAC Triyoduro(1-) . I 3.- Dicloruro( 1-) Cl2 Dicarburo(2-) C22- Acetiluro Nombre alternativo aceptado por la IUPAC 7 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Trinitruro(1-) N3- Azida Nombre alternativo aceptado por la IUPAC Disulfuro(2-) S22- Pentaestannuro(2-) Sn52- Nonaplumburo(4-) Pb94- En algunos casos puede considerarse que los aniones homopoliatómicos derivan de un hidruro progenitor por eliminación de hidrones (IR-6.4) Dioxidanodiuro O22- Disulfanodiuro S22- Los aniones heteropoliatómicos se nombran generalmente mediante la nomenclatura de sustitución (IR6.4.4) o la de adición. A los nombres de adición se les puede añadir un punto de radical para indicar la presencia de electrones desapareados. Algunos aniones heteropoliatómicos tienen todavía nombres vulgares no sistemáticos y aceptados por la IUPAC Azanuro (de sustitución) NH2- Dihidruronitrato(1-) (de adición) Amida (no sistemático aceptado) Germanuro (de sustitución) GeH3- Trihidrurogermnato(1-) (de adición) Sulfanuro (de sustitución) HS- Hidruosulfato(1-) (de adición) Sulfanuuro (de sustitución) H3S- Trihidrurosulfato(1-) (de adición) Sulfito (aceptado no sistemático) SO32- Troxidosulfato(2-) (de adición) Hipoclorito (aceptado no sistemático) OCl- Clorurooxigenato(1-) (de adición) Clorato ClO3- Trioxidoclorato(1-) (de adición) (aceptado no sistemático) 8 FORMULACIÓN QUÍMICA INORGÁNICA IES SIERRA SUR FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 [PF6]- Hexafluorurofosfato(1-) (de adición) [CuCl4]2- Tetraclorurocuprato(2-) (de adición) [Fe(CO)4]2- Tetracarbonilferrato(-II) (de adición) .- H2S . Dihidrurosulfato( 1-) (de adición) En algunos casos no es posible o no es deseable el uso de la nomenclatura de adición o de sustitución para nombrar un ion en ausencia de información estructural. En dichos casos, es preferible dar un nombre estequiométrico y añadir el número de carga. Los paréntesis se necesitan para restablecer con claridad que el número de carga indica la carga neta del ion: O2Cl2+ (Dicloruro de dioxígeno)(1+) Un electrón desapareado debe indicarse en una fórmula con un punto como superíndice que se coloca a la derecha del símbolo químico de manera que no interfiera con los indicadores del número másico, del número atómico o de la composición; en el caso de diradicales el superíndice está precedido del correspondiente superíndice multiplicador; y el punto del radical con su multiplicador si lo tuviera, precede a la cargay por último, para evitar confusiones el multiplicador y el punto radical pueden colocarse enetre paréntesis • Una segunda categoría de nombres de composición es la de los nombres estequiométricos generalizados en la que las diferentes partes pueden ser nombres de iones mono o poliatómicos. (IR- 5.4) 9 FORMULACIÓN QUÍMICA INORGÁNICA IES SIERRA SUR FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 Nombres estequiométricos generalizados (IR-5.4) • Los constituyentes del compuesto a nombrar se dividen formalmente en electropositivos y electronegativos. Al menos tiene que haber un constituyente electronegativo y uno electropositivo. • Por definición los cationes son electropositivos y los aniones electronegativos; y por convenio, los elementos electropositivos se encuentran después de los elementos electronegativos, siguiendo el orden de la flecha en la Tabla VI. • En principio, la división en constituyentes electropositivos y electronegativos es arbitraria si el compuesto tiene más de dos elementos. • Los nombres de los constituyentes electronegativos preceden siempre al nombre de los electropositivos en el nombre completo. • Dentro de cada clase de constituyentes el orden de citación es el alfabético, ignorando, para ello, los prefijos multiplicadores, con la excepción del hidrógeno, que se cita siempre el último de los componentes electropositivos si se encuentra realmente clasificado como un constituyente electropositivo. • Este principio para la construcción de nombres estequiométricos generalizados es análogo al de la construcción de fórmulas de sales generalizadas. (IR-4.4.3.4) KMgF3 Si la fórmula de un compuesto que contiene tres o más elementos no se asigna MgCl(OH) fácilmente utilizando nombres……pág 62.... en ese caso el compuesto puede FeO(OH) tratarse como una sal generalizada. Este término se utiliza para designar cualquier NaTl(NO3)2 compuesto en el que se puede identificar al menos un constituyente que es un ion Li[H2PO4] positivo, o que puede clasificarse como electropositivo, o que es más Na[HPHO3] electropositivo que los demás constituyentes y, al menos, un constituyente que es NaNH4[HPO4] un ión negativo o que puede clasificarse como electronegativo o que es más K5[CuSb2] electronegativo que el resto de los constituyentes. El principio de ordenación es K5CuSb2 este caso: • Todos los constituyentes electropositivos preceden a todos los constituyentes electronegativos 10 FORMULACIÓN QUÍMICA INORGÁNICA IES SIERRA SUR FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 • Se usa el orden alfabético dentro de cada uno de los dos grupos que constituyen la fórmula K5[CuSb2] Cu y Sb se consideran los constituyentes electronegativos K5CuSb2 K y Cu se consideran los componentes electropositivos Algunas sales generalizadas pueden ser tratadas como compuestos de adición La desviación respecto del orden alfabético en los constituyentes de la misma clase está permitida para resaltar las semejanzas entre compuestos. Sin embargo, el orden de citación en un nombre estequiométrico generalizado no es necesariamente el mismo que el orden de los símbolos en la correspondiente fórmula de la sal generalizada. Los siguientes nombres estequiométricos generalizados, que se basan en consituyentes de un solo elemento, no conllevan ninguna información sobre su estructura IBr Bromuro de yodo Estos nombres estequiométricos ArHF Fluoruro de argón e hidrógeno generalizados ArFH Fluoruro hidruro de argón constituyentes de un solo elemento, no ClOF Fluoruro de cloro y oxígeno conllevan información ninguna sobre OClF Cloruro fluoruro de oxígeno su estructura. PBrClI Bromuro cloruro yoduro de fósforo El nombre de adición de ClOF, se basan en [ClFO], Fluorurooxidocloro, FArH, [ArFH]; Fluorurohidruroargón En estos ejemplos el orden de dos elementos cualesquiera en el nombre depende de la división arbitraria de los elementos en constituyentes electropositivos y electronegativos. La misma regla se aplica al orden de los símbolos de los elementos en las fórmulas. • Cuando aparecen nombres de iones poliatómicos como constituyentes en un nombre estequiométrico generalizado, NaNH4[HPO4] : Hdrogenofosfato de amonio y sodio; en él hay implicada, a menudo, cierta cantidad de información estructural • Las proporciones de los constituyentes, ya sean monoatómicos o poliatómicos, se indican en los nombres estequiométricos generalizados por medio de prefijos multiplicadores, como en el caso de los constituyentes de compuestos binarios. 11 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR • Na2CO3 Trioxidocarbonato de disodio o carbonato de sodio K4[Fe(CN)6] Hexacianuroferrato de tetrapotasio PCl3O Tricloruro óxido de fósforo KMgCl3 Tricloruro de magnesio y potasio Cuando el propio nombre del constituyente comienza por un prefijo multiplicador, como por ejemplo disulfato, dicromato, trifosfato, tetraborato, etc. o cuando puede surgir alguna otra ambigüedad, se usan los prefijos multiplicadores alternativos bis, tris, tetrakis, pentakis… (Tabla IV). • Ca(NO3)2 Bis(trioxidonitrato) de calcio o nitrato de calcio (UO2)2SO4 Tetraoxidosulfato de bis(dioxidouranio) Ba(BrF4)2 Bis(tetrafluorurobromato) de bario U(S2O7)2 Bis(disulfato) de uranio Ca3(PO4)2 Bis(fosfato) de tricalcio Ca2P2O7 Difosfato de calcio Ca(HCO3)2 Bis(hidrogenocarbonato) de calcio Se puede aportar información sobre las proporciones de los constituyentes en los nombres utilizando uno de los siguientes recursos: el número de carga, que define la carga iónica; y el número de oxidación, que define el estado de oxidación. • Al nombrar el compuesto se prefiere el número de carga, porque la determinación del número de oxidación puede ser ambigua y subjetiva en ciertas ocasiones. Por tanto es aconsejable usar sólo los números de oxidación cuando no haya incertidumbre en su asignación. • El número de carga es un número cuya magnitud es la carga iónica. Se escribe entre paréntesis inmediatamente después del nombre del ion y sin espacio entre ellos. La carga se escribe con números arábigos seguido de su signo. La carga unidad se indica siempre, a diferencia de las 12 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR descripciones de las cargas con superíndices que se usan en las fórmulas. El número de carga no se usa después del nombre de una especie neutra. • FeSO4 Sulfato de hierro(2+) Fe2(SO4)3 Sulfato de hierro(3+) (UO2)2SO4 Sulfato de dioxidouranio(2+) K4[Fe(CN)6] Hexacianuroferrato(4-) de potasio [Co(NH3)6]Cl(SO4) Cloruro sulfato de haxaamminocobalto(3+) UO2SO4 Sulfato de dioxidouranio(2+) UO2SO4 Sulfato de dioxidouranio(2+) El número de oxidación de un elemento se indica con un número romano encerrado entre paréntesis que sigue inmediatamente al nombre del elemento al que se refiere, (modificado con la terminación “-ato” si fuese necesario). El número de oxidación puede ser positivo, negativo o cero (representado por 0). Se sobreentiende que un número de oxidación es siempre positivo, a menos que se use explícitamente el signo (-), (el signo positivo no se usa nunca). Los números de oxidación fraccionarios no se utilizan en nomenclatura química. • Para deducir los números de oxidación, cuyo uso es muy común en los nombres de los elementos de transición, se observan varios convenios: El hidrógeno se considera positivo(número de oxidación I) cuando está combinado con elementos no metálicos y negativo (número de oxidación (-I) cuando está combinado con elementos metálicos Los enlaces entre átomos de la misma especie no contribuyen al número de oxidación Los grupos orgánicos unidos a átomos metálicos se tratan unas veces como aniones, por ejemplo CH3-, ligando metilo es metanuro y Co como neutros. N2O Óxido de nitrógeno(I) NO2 Óxido de nitrógeno(IV) 13 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Fe3O4 Óxido de hierro(II) y dihierro(III) MnO2 Óxido de manganeso(IV) CO Óxido de carbono FeSO4 Sulfato de hierro(II) Fe(SO4)3 Sulfato de hierro(III) SF6 Fluoruro de azufre(VI) (UO2)2SO4 Sulfato de dioxidouranio(V) UO2SO4 Sulfato de dioxidouranio(VI) K4[Fe(CN)6] Hexacianuroferrato(II) de potasio Hexacianuroferrato(4-) de potasio K4[Ni(CN)4] Tetracianuroniquelato(0) de potasio Tetracianuroniquelato(4-) de potasio Na2[Fe(CO)4] Tetracarbonilferrato(-II) de sodio Tetracarbonilferrato(2-) de sodio [Co(NH3)6]Cl(SO4) Cloruro sulfato de hexamminocobalto(III) Cloruro sulfato de hexaamminocobalto(3+) Fe4[Fe(CN)6]3 Hexacianuroferrato(II) de hierro(III) Hexacianuroferrato(4-) de hierro(3+) • No se recomienda el uso de los números de oxidación al nombrar iones homopoliatómicos para evitar ambigüedades. Los números de oxidación se refieren a los átomos individuales del elemento en cuestión, incluso si están unidos a un nombre que contiene un prefijo multiplicador 14 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR • Cuando el propio nombre del constituyente empieza por prefijo multiplicador, (como en el caso de disulfato, dicromato, trifosfato, tetraborato), o cuando puede surgir alguna otra ambigüedad, se usan los prefijos multiplicadores alternativos: “bis-, tris-, tetrakis-, pentakis-…) (Tabla IV) y el nombre del grupo afectado se coloca entre paréntesis. • Debe ponerse especial atención en distinguir los constituyentes monoatómicos múltiples de los constituyentes poliatómicos. TlI3 Tris(yoduro) de talio o yoduro de talio (III) o yoduro de talio(3+) Consta de yoduro y talio en la proporción 3:1. Por lo tanto, en el primer nombre el prefijo numérico tris se usa para dejar completamente claro que están implicados tres iones yoduro. Los nombres alternativos usan el número de oxidación III o el número de carga 3+ para el talio Tl(I3) Triyoduro(1-) de talio, o (triyoduro) de talio(I) o triyoduro de talio(1+) Consta de triyoduro I3- y talio en la proporción 1.1. En el primer nombre es evidente que el constituyente electronegativo es una entidad homopoliatómica de carga -1. Los dos nombres siguientes indican esta característica de forma indirecta al añadir el número de oxidación o el número de carga al nombre del talio. La inclusión del nombre de la parte electronegativa entre paréntesis reafirma que es una entidad homopoliatómica. También se aceptan para ambos compuestos los nombres completamente explícitos que incluyen el número de carga del ion talio, aunque sean parcialmente redundantes. TlI3 Trisyoduro de talio(3+), Tl(I3) Triyoduro(1-) de talio(1+) Ambos compuestos tienen la misma fómula global, TlI3, y ambos se pueden nombrar con el nombre estequiométrico sencillo triyoduro de talio HgCl2 Dicloruro de mercurio, Cloruro de mercurio(II), Cloruro de mercurio(2+) Hg2Cl2 Dicloruro de dimercurio, (nombre puramente estequiométrico); Dicloruro de (dimercurio), (indica que contiene un ion homodiatómico); Cloruro de dimercurio(2+), (aquí se especifica la carga del dicatión por lo que no es necesario el prefijo di para el cloruro 15 FORMULACIÓN QUÍMICA INORGÁNICA IES SIERRA SUR FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 Na2S3 (trisulfuro) de disodio, indica la presencia del anión poliatómico Trisulfuro(2-) de sodio, no es necesario el prefijo multiplicador del nombre del catión por estar indicada la carga del anión Fe2S3 tris(sulfuro) de dihierro, sulfuro de hierro(III) Óxido de dipotasio K2O (Dióxido) de dipotasio K2O2 (Dióxido) de KO2 Dióxido(2-) de potasio, Dióxido(2-) de dipotasio Dióxido(1-) de potasio monopotasio Trióxido(1-) de potasio (Trióxido) de potasio KO3 Dióxido BaO2 Dióxido(2-) de bario, (especifica el anión diatómico) de bario; nombre estequiométrico Peróxido de bario (nombre alternativo del anión sencillo, aceptado por la IUPAC; (dióxido) de bario Bis(óxido) de manganeso MnO2 Dióxido de manganeso (especifica que hay dos sencillo) iones óxido y no un anión Óxido de manganeso(IV) (nombre estequiométrico diatómico) • Otro tipo de nombres de composición, (3ª categoría de nombres de composición), lo constituyen los diseñados para los compuestos formales de adición, que tienen un formato propio. (IR-5.5) (ver IR-4:4.3.5) NOMBRES DE LOS COMPUESTOS DE ADICIÓN FORMALES: El término compuestos de adición comprende a los compuestos dador-aceptor (aductos) y a una variedad de compuestos reticulares; sin embargo el método descrito es válido también para las sales múltiples, así como para algunos compuestos de estructura incierta o para los que no es necesario comunicar estructura completa. Los nombres de cada uno de los componentes individuales de un compuesto de adición generalizado se construyen mediante el sistema de nomenclatura apropiado, ya sea de composición, de sustitución o 16 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR de adición. El nombre completo del compuesto se forma conectando los nombres de los componentes con guiones extralargos, las proporciones de los componentes se indican después del nombre por medio de un descriptor estequiométrico que está formado por números arábigos separados por una barra o barras. El descriptor, que se coloca entre paréntesis, está separado del nombre del compuesto por un espacio. El orden de los nombres de los componentes individuales es, primero, según el número creciente de los componentes, y segundo, el alfabético. Como única excepción el nombre del componente agua se cita el último. El nombre genérico hidratos es aceptado por la IUPAC para los compuestos de adición que contienen agua como componente debido a su uso generalizado, (la desinencia ato no tiene significado). Los nombres hidrato de tipo clásico son aceptados por la IUPAC para los hidratos de estequiometria sencilla, pero no se han formulado reglas para estequiometrias no enteras, por ejemplo: 3CdSO4.8H2O Trifluoruro de boro—agua(1/2) BF3.2H2O Kripton—agua(8/46) 8Kr.46H2O Kripton—(3H2)agua(8/46) 8Kr.463H2O Cloruro de calcio--amoniaco(1/8) CaCl2.8NH3 Cloruro de aluminio—etanol(1/4) AlCl3.4EtOH Cloruro de bismuto(III)—cloruro de BiCl3.3PCl5 fósforo(V) (1/3) Carbonato de sodio—peróxido de 2Na2CO3.3H2O2 hidrógeno(2/3) Óxido de cobalto(III)—agua(1/n) Co2O3.nH2O Sulfato de sodio—agua(1/10) Na2SO4.10H2O Sulfato de aluminio—sulfato Sulfato de sodio decahidrato de Al2(SO4)3.K2SO4.24H2O potasio—agua(1/1/24) Bis(sulfato) de aluminio y potasio— AlK(SO4)2.12H2O Bis(sulfato) de aluminio y agua(1/12) potasio dodecahidrato Sulfato de cadmio-agua(3/8) 3CdSO4.8H2O 17 FORMULACIÓN QUÍMICA INORGÁNICA IES SIERRA SUR FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 En resumen, los nombres de composición son: o de tipo estequiométrico (los cuales a su vez, son de tipo binario, excepto el caso de especies homoatómicas), o de tipo compuesto de adición. La nomenclatura de composición se utiliza cuando el nombre vaya a expresar una información estructural escasa o nula. Ejemplos Bromuro de yodo IBr Bromuro cloruro yoduro de fósforo PBrClI Fluoruro de argón e hidrógeno ArHF Fluoruro hidruro de argón ArFH Fluoruro de cloro y oxígeno ClOF Cloruro fluoruro de oxígeno OClF Diantimoniuro de cobre y CuK5Sb2 pentapotasio (Dicloruro de dioxígeno)(1+) O2Cl2+ Hidrogenofosfato de amonio y sodio NaNH4[HPO4] Trioxido carbonato de disodio Na2CO3 (carbonato de sodio, no sistemático aceptado) Hexacianuroferrato de tetrapotasio K4[(FeCN)6] Tricloruro óxido de fósforo PCl3O Tricloruro de magnesio y potasio KMgCl3 Bis(trioxidonitrato) de calcio o Ca(NO3)2 (nitrato de calcio, no sistemático aceptado) Tetraoxidosulfato de (UO2)2SO4 bis(dioxidouranio) Bis(tetrafluorurobromato) de bario Ba(BrF4)2 Bis(sulfato) de uranio U(SO4)2 Bis(fosfato) de tricalcio Ca3(PO4)2 Difosfato de calcio CaP2O7 Bis(hidrogenocarbonato) de calcio Ca(HCO3)2 18 FORMULACIÓN QUÍMICA INORGÁNICA IES SIERRA SUR FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 Cloruro de fósforo(V) PCl5 Óxido de nitrógeno(I) N2O Óxido de nitrógeno(IV) NO2 Dióxido de nitrógeno Tetraóxido de dinitrógeno N2O4 Óxido de hierro(II) y de dihierro(III) Fe3O4 Óxido de manganeso(IV) MnO2 Óxido de carbono(II) CO Sulfato de hierro(II) FeSO4 Sulfato de hierro(III) Fe2(SO4)3 Fluoruro de azufre(VI) SF6 Sulfato de dioxidouranio(V) (UO2)2(SO4) Sulfato de dioxidouranio(VI) UO2SO4 Cloruro sulfato de Co(NH3)6Cl(SO4) hexaamminocobalto(III) Hexacianuroferrato(4-) de potasio K[Fe(CN)6] Hexacianuroferrato(4-) de hierro(3+) Fe4[Fe(CN)6]3 Tris(yoduro) de talio Tl(I3) Yoduro de talio(III) Yoduro de talio(3+) Triyoduro(1-) de talio TlI3 (Triyoduro) de talio(I) Triyoduro de talio(1+) Dicloruro de mercurio HgCl2 Cloruro de mercurio(II) Cloruro de mercurio(2+) Dicloruro de dimercurio Hg2Cl2 Dicloruro de (dimercurio) Cloruro de dimercurio(2+) (al especificar la carga del dicatión no es necesario anteponer di- a cloruro) (trisulfuro) de disodio Na2S3 Trisulfuro(2-) de sodio 19 FORMULACIÓN QUÍMICA INORGÁNICA IES SIERRA SUR FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 (indica la presencia de un aníon (no es necesario el prefijo multiplicador del nombre del homopoliatómico) catión por indicarse la carga del anión) Tris(sulfuro) de dihierro Fe2S3 Sulfuro de hierro(III) Óxido de dipotasio K2O Dióxido(2-) de dipotasio (Dióxido) de dipotasio K2O2 Dióxido(2-) de potasio (Dióxido) de monopotasio KO2 Dióxido(1-) de potasio (Trióxido) de potasio KO3 Trióxido(1-) de potasio (Dióxido) de bario BaO2 Dióxido(2-) de bario (especifica el nombre del anión) Dióxido de bario (nombre estequiométrico sencillo) Peróxido de bario 8nombre alternativo aceptado por la IUPAC Bis(óxido) de manganeso (especifica MnO2 Dióxido que hay dos iones óxido y no un anión (nombre diatómico) sencillo) de manganeso estequiométrico Óxido de manganeso(IV) Trifluoruro de boro—agua(1/2) BF3.2H2O Kripton—agua(8/46) 8Kr.46H2O Kripton—(3H2)agua(8/46) 8Kr.463H2O Cloruro de calcio--amoniaco(1/8) CaCl2.8NH3 Cloruro de aluminio—etanol(1/4) AlCl3.4EtOH Cloruro de bismuto(III)—cloruro de BiCl3.3PCl5 fósforo(V) (1/3) Carbonato de sodio—peróxido de 2Na2CO3.3H2O2 20 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR hidrógeno(2/3) Óxido de cobalto(III)—agua(1/n) Co2O3.nH2O Sulfato de sodio—agua(1/10) Na2SO4.10H2O Sulfato de aluminio—sulfato de Al2(SO4)3.K2SO4.24H2O Sulfato de sodio decahidrato potasio—agua(1/1/24) Bis(sulfato) de aluminio y potasio— AlK(SO4)2.12H2O Bis(sulfato) de aluminio y agua(1/12) potasio dodecahidrato Sulfato de cadmio-agua(3/8) 3CdSO4.8H2O Cloruro de hidrógeno HCl Compuesto binario Monóxido de nitrógeno Dicloruro de oxígeno Cloruro de dioxígeno NO OCl2 Cl2O Compuesto binario Compuesto binario Compuesto binario Tetraóxido de trihierro Carburo de silicio Tetracloruro de silicio Difosfuro de tricalcio Fosfuro de calcio Estannuro de níquel Octacincuro de pentacobre Hexacarburo de tricosacromo Sodio(1+) Cromo(3+) Cobre(1+) Cobre(2+) Yodo(1+) Hidrógeno(1+), hidrón Protio (1+), protón Deuterio(1+), deuterón Tritio(1+), tritón Dioxígeno(1+) Tetraazufufre(2+) Dimercurio(2+) Pentabismuto(4+) Trihidrógeno(1+) Amonio, no sistemático, aceptado por la IUPAC Fe3O4 SiC SiCl Ca3P2 Compuesto binario Compuesto binario Compuesto binario Compuesto binario NiSn Cu5Zn8 Cr23C6 Na+ Cr3+ Cu+ Cu2+ I+ H+ 1 + H 2 + H 3 + H O2+ S42+ Hg22+ Bi54+ H3+ NH4+ Compuesto binario Compuesto binario Compuesto binario Cationes monoatómicos Fosfanio (de sustitución) PH4+ Cationes homopoliatómicos Azanio (de sustitución) Cationes heteropoliatómicos Se nombran generalmente mediante las nomenclaturas de sustitución o de adición De sustitución 21 FORMULACIÓN QUÍMICA INORGÁNICA IES SIERRA SUR FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 Tetrafluoroestibanio (de sustitución) Tetrafluoroantimonio(1+) (de adición) Tetrafluoroantimonio(V) (de adición) Boranioilo (de sustitución) SbF4+ . BH3 + . Trihidruroboro( 1+) (de adición) Oxidanodiio (de sustitución) H4O2+ Oxonio, no sistemático, aceptado por la IUPAC, no es hidronio Óxido(2-) u óxido Nitruro(3-) o nitruro Dióxido(1-) Dióxido(2-) Trióxido(1-) Triyoduro(1-) Dicarburo(2-) Trinitruro(1-) Disulfuro(2-) sulfito hipoclorito clorato hidrogenocarbonato dihidrogenofosfato H3O+ Oxidanio de sustitución O2N3O21O22O31I31C22N33S22SO32ClOClO3HCO3H2PO43- Aniones monoatomicos Aniones monoatomicos Aniones homopoliatómicos Aniones homopoliatómicos Aniones homopoliatómicos Aniones homopoliatómicos Aniones homopoliatómicos Aniones homopoliatómicos Aniones homopoliatómicos Aniones heteropoliatómicos Aniones heteropoliatómicos Aniones heteropoliatómicos Aniones heteropoliatómicos Aniones heteropoliatómicos NOMENCLATURA DE SUSTITUCIÓN. • La nomenclatura de sustitución es un sistema en el que los nombres se basan en los de los hidruros progenitores. • Los nombres de los derivados de los hidruros progenitores se forman citando los prefijos o sufijos pertinentes de los grupos sustituyentes que reemplazan a átomos de hidrógeno, precedidos por localizadores, cuando sea necesario, y unidos, sin separación, al nombre del hidruro padre sin sustituir. • La nomenclatura de sustitución se recomienda solamente para los derivados de los hidruros progenitores cuyos nombres se encuentran en la Tabla IR.6.1 y para los derivados de los hidruros polinucleares que contienen solo estos elementos. 22 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR • Se sobreentiende que los números de enlaces de los átomos del esqueleto son los que se encuentran en la Tabla IR.6.1 (4 enlaces para el Si, 2 para el Se…). Cuando aparecen otros números de enlaces diferentes, tienen que indicarse con un designador adecuado, (mediante el convenio λ ) • La construcción de un nombre de sustitución implica, en general, al reemplazo de átomos de hidrógeno en una estructura progenitora por otros átomos o grupos de átomos. • Otras operaciones relacionadas, que se consideran a menudo como parte de la nomenclatura de sustitución, son “el reemplazo en el esqueleto” y el “reemplazo funcional en los oxoácidos progenitores” • Esta nomenclatura es la usada generalmente para nombrar los compuestos orgánicos. • Los hidruros mononucleares de los elementos de los grupos 13-17 de la Tabla Periódica juegan un papel central en la nomenclatura de sustitución. Estos se usan como hidruros progenitores: El nombre sistemático para el metano es carbano; sin embargo no se recomienda carbano dado que el nombre metano es de uso universal Los nombres azano y oxidano se proponen con la intención de usarlos solamente par nombrar derivados del amoniaco y del agua, respectivamente, mediante la nomenclatura de sustitución y son la base para nombrar entidades polinucleares (triazano, dioxidano) Los nombres fluorano, clorano, bromano, yodano se incluyen aquí porque son las bases para la formación de los nombres de sustitución de iones, radicales…. Estos hidruros, sin sustituir pueden denominarse Fluoruro de hidrógeno, Cloruro de hidrógeno, Bromuro de hidrógeno, Yoduro de hidrógeno (Son nombres de composición y no sirven como nombres de hidruros progenitores) Los nombres fosfina, arsina, estibina ya no se pueden usar, en su lugar deben denominarse fosfano, arsano, estibano Sulfano cuando está sin sustituir puede denominarse sulfuro de hidrógeno o, mejor, sulfuro de dihidrógeno, (nomenclatura de composición). Análogamente, sucede para Selano, Telano y Polano, que si no están sustituidos pueden denominarse Seleniuro de dihidrógeno, Telururo de dihidrógeno y Polonuro de dihidrógeno Los hidruros de boro, neutros se denominan boranos En el caso de hidruros progenitores homopolinucleares, acíclicos, en los que todos sus átomos presentan sus números de enlaces normales, exceptuando los del boro y los del carbono, los nombres se construyen añadiendo el prefijo multiplicador apropiado (di-, tri-, tetra-…) (Tabla IV), 23 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR que corresponde al número de átomos de la cadena unidos en serie, delante del nombre del hidruro mononuclear correspondiente, que finaliza en –ano (dioxidano o peróxido de hidrógeno, H2O2 ; diazano o hidracina, NH2NH2; difosfano, PH2PH2 El nombre de composición “peróxido de hidrógeno” es una alternativa a dioxidano, pero no es válido como nombre de hidruro progenitor en la nomenclatura de sustitución La hidracina NH2NH2 sí se utiliza como nombre de hidruro progenitor (homopolinuclear) Los hidruros de poliboro neutros se llaman boranos y la estructura progenitora más sencilla, BH3, recibe el nombre de borano. El número de átomos de boro en una molécula de hidruro de boro se indica con un prefijo multiplicador. La diferencia principal entre este sistema de nomenclatura y el de los hidrocarburos es que aquí tiene que definirse el número de átomos de hidrógeno, puesto que no puede deducirse de consideraciones de enlace sencillas. El número de átomos de hidrógeno se indica con el número arábigo apropiado, encerrado entre paréntesis y que sigue inmediatamente al nombre. Este tipo de nombres expresa solamente información sobre la composición: B2H6, diborano(6); B20H16 Icosaborano(16) Nomenclatura de sustitución de los derivados de hidruros progenitores • Los grupos sustituyentes o sustituyentes que se considere que reemplazan a átomos de hidrógeno en hidruros progenitores, se nombran usando los sufijos –ol, -tiol, -peroxol, ácido carboxílico y prefijos hidroxi-, fosfanil-, bromo-, nitro-… adecuados. • Algunos sustituyentes se citan siempre como prefijos, especialmente los átomos de los halógenos-. De otro modo, el sustituyente de mayor rango (el grupo característico principal) se cita como sufijo y el resto como prefijos. • Los prefijos se citan en orden alfabetico, excepto “hidro” delante del nombre del hidruro progenitor y se usan paréntesis para evitar ambigüedades. • Los prefijos multiplicadores indican la presencia de dos o más sustituyentes idénticos; si los sustituyentes están, a su vez, sustituidos, se usan los prefijos bis-, tris- tetrakis-… • En el caso de que un prefijo multiplicador finalice en –a y un sufijo que empiece por una vocal, la “a” se elide y la “o” del final del nombre del hidruro progenitor se omite delante de un sufijo que comienza por una vocal. 24 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR • Cuando hay una alternativa de elección del hidruro progenitor, el nombre se basa en el del hidruro progenitor del elemento que aparece en primer lugar en la secuencia: N, P,As, Sb Bi; Si,Ge, Sn, Pb; B,Al, Ga, In, Tl; O, S, Se, Te; C, F, Cl, Br.I NOMBRES DE IONES Y RADICALES DERIVADOS DE LOS HIDRUROS PROGENITORES • Aquí aparecen los nombres de los iones y radicales que pueden derivarse formalmente de hidruros mediante operaciones de eliminación o adición de átomos de hidrógeno, iones hidruro o hidrones • Una gran mayoría de iones y radicales pueden nombrarse también por métodos de adición ¿Tabla IX????? Cationes derivados de hidruros progenitores por adición de uno o más hidrones. • El nombre de un ion, derivado formalmente de la adición de un hidrón a un hidruro progenitor, se obtiene añadiendo el sufijo –io al nombre del hidruro progenitor con la elisión de la “a” u “o” finales, para nombrar los policationes formados de esta manera se usan los sufijos “diio”, “triio”…sin elisión de la –a u –o final del hidruro progenitor. • Los localizadores necesarios se colocan inmediatamente antes del sufijo, de forma que los debidos a hidrones añadidos tienen prioridad sobre los localizadores de insaturación. • Los nombres alternativos: amonio, hidrazinio, hidrazinadiio y oxonio se usan para nombrar derivados orgánicos NH4+ Azanio, amonio NH3NH2+ NH3NH3 + Diazanio, hidrazinio Diazanodiio, hidrazinadiio H3O+ Oxidanio, oxonio (no es hidronio) H4O2+ Oxidanodiio H3O2+ Dioxidanio 25 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Cationes derivados de hidruros progenitores por pérdida de uno o más iones hidruro • Un catión que se forma por la pérdida formal de un ión hidruro, se nombra añadiéndole el sufijo “-ilio” al nombre progenitor con elisión de la “-o” o vocal final. • Los policationes que se forman de esta manera se nombran añadiendo los sufijos “-diilio”; “- triilio”… al nombre del hidruro progenitor sin elisión de la “-o” o vocal final. Los localizadores necesarios se colocan precediendo inmediatamente al sufijo, de modo que los que se refieren a los iones hidruro eliminados tienen precedencia sobre los localizadores de insaturación. • El sufijo “-ilio” sustituye a la desinencia “-ano del hidruro progenitor en los nombres silano, germano, estannano y plumbano, así como en algunos hidrocarburos (IR6.4.3) PH2+ Fosfanilio Si2H5+ Disilanilio SiH3+ Sililio Si2H5+ Disilanilio BH2+ Boranilio Cationes sustituidos • Los nombres de los derivados sustituidos de los cationes se forman a partir del hidruro progenitor modificado, añadiéndole los prefijos propios de los sustituyentes. • Al numerar los derivados de los progenitores polinucleares, los localizadores de los hidrones añadidos o de los iones hidruro eliminados tienen prioridad sobre los localizadores de los sustituyentes [NF4]+ Tetrafluoroazanio, tetrafluoroamonio [PCl4]+ Tetraclorofosfanio [NMe4]+ Tetrametilazanio, tetrametilamonio 26 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR [MeOH2]+ Metiloxidanio, metiloxonio [ClPHPH3]+ 2-cloro-difosfan-1-io Aniones derivados de los hidruros progenitores por pérdida de uno o más hidrones • Un anión obtenido formalmente por eliminación de uno a más hidrones a partir de un hidruro progenitor se nombra añadiéndole “-uro”, “-diuro”… al nombre del progenitor, elidiendo la “-o” o la vocal terminal solamente cuando ésta va delante de “-uro” • Cualquier localizador necesario se coloca precediendo inmediatamente al sufijo • Los localizadores de los hidrones eliminados tienen precedencia sobre los localizadores de insaturación • Los nombres de los aniones derivados por la pérdida formal de uno o más hidrones de los grupos hidroxilo y de sus análogos los calcógenos, -caracterizados por sufijos como “-ol” y “tiol”, se forman añadiendo la desinencia “-ato” al nombre correspondiente NH2- Azanuro o amida NH2- Azanodiuro o imida H2NNH- Diazano o hidrazinuro H2NN2- Diazano-1,1-diuro o Hidrazina-1,1-diuro - HNNH- Diazano-1,2-diuro o Hidrazina-1,2-diuro SiH3- Silanuro GeH3- Germanuro SnH3- Estannanuro SH- Sulfanuro SiH3O- Silanolato 27 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR PH2S- Fosfanotiolato Aniones derivados de los hidruros progenitores por adición de uno o más iones hidruro • La adición de un ion hidruro a un hidruro progenitor se indica por la desinencia “-uuro” • Las reglas referidas a los localizadores son análogas a las dadas para el sufijo “-uro”. • Los nombres de adición son alternativas aceptables para este tipo de compuestos BH4- Boranuuro Tetrahidruroborato(1-) (nombre de adición) Aniones sustituidos • Los nombres de los derivados sustituidos de los aniones se forman a partir de los nombres de los hidruros progenitores , modificados añadiéndoles los prefijos adecuados de los sustituyentes. Al numerar las estructura, la posición de la que se eliminó un hidrón o se añadió un hidruro tiene precedencia sobre las posiciones con sustituyentes • En muchos casos, los nombres de adición son alternativas aceptables y habituales SnCl3- Tricloestannanuro (nombre de sustitución, de estannano) Tricloruroestannato(1-) (nombre de adición) MePH- Metilfosfanuro ( nombre de sustitución, por pérdida de hidrón) MeNH- Metilazanuro (nombre de sustitución, por pérdida de hidrón) Metilamida 28 FORMULACIÓN QUÍMICA INORGÁNICA IES SIERRA SUR FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 [BH3CN]- Cianoboranuuro (nombre de sustitución, anión sustituido, ganancia de hidruro) Cianurotrihidruroborato(1-) nombre de adición [PF6]- Hexafluoro- λ 5‐fosfanuuro (nombre de sustitución, anión sustituido, ganancia de hidruro) NOMENCLATURA DE ADICIÓN. • La nomenclatura de adición de desarrollada originariamente para los compuestos de coordinación tipo Wegner, que se consideraban constituidos por uno (o varios) átomo(s) central(es), rodeado por grupos añadidos conocidos como ligandos; sin embargo se puede utilizar para asignar, con propiedad, nombres de adición a muchos otros tipos de compuestos. • Solo se puede utilizar si se conoce la estructura del compuesto. • Los nombres de adición se construyen colocando los nombres de los ligandos, modificados en ocasiones, como prefijos del nombre del átomo(s) central(es) • La elección del átomo(s) central(es) es un paso clave para crear un nombre de adición. • Si hay un átomo(s) metálico(s), este se debe elegir como átomo central(es), deben ser relativamente centrales en la estructura de la molécula y debe guardar relación con la simetría de la molécula para simplificar el nombre. • Cuando hay varias opciones para elegir el átomo central debe elegirse como tal aquel que se encuentra el último al seguir las flechas de la tabla VI • Los nombres de adición se construyen colocando los nombres de los ligandos (modificados en algunas ocasiones) como prefijos del nombre del átomo central. • Las desinencias “-ato, -ito, -ido, -uro” de los ligandos aniónicos no cambian al generar estos prefijos • Los nombres de los ligandos neutros y catiónicos también se usan sin modificaciones, excepto en unos pocos casos especiales; en particular el agua, cuyo prefijo es acua-, el amoniaco, cuyo prefijo es ammino-, monóxido de carbono, cuyo prefijo es carbonil y monóxido de nitrógeno unido por el nitrógeno cuyo prefijo es nitrosil 29 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR • En principio es una cuestión de convenio considerar que un ligando sea catiónico, neutro o aniónico. • Es un error suponer que los ligandos son siempre aniónicos de forma que OH es siempre hidróxido; Cl cloruro, SO4 sulfato. • Algunos ligandos se consideran convencionalmente neutros, por ejemplo: las aminas, fosfanos y los ligandos derivados de los hidrocarburos por eliminación de un átomo de hidrógeno como metil, bencil… • Al nombrar mediante la nomenclatura de adición una especie aniónica, ésta toma la terminación –ato, mientras que no se usa ninguna terminación en particular para las especies catiónicas o neutras. Y además, los nombres de adición de los iones finalizan con el número de carga. Entidades polinucleares: dinucleares simétricas • Los nombres de los compuestos e iones mononucleares, es decir, de las especies que poseen un único átomo central se forman citando los prefijos pertinentes para los ligandos, en orden alfabético, delante del nombre del átomo central. Cuando hay varios ligandos iguales se emplean prefijos multiplicadores di-,tri,…; en el caso de que sean ligandos sencillos: cloruro, bencilo, acua, ammino, hidróxido; y bis- tris- tetrakis… cuando se trata de ligandos más complicados. Éstos últimos también se utilizan para evitar cualquier ambigüedad. Los prefijos multiplicadores que no son parte inherente del nombre del ligando no afectan al orden alfabético. • En las entidades dinucleares simétricas, los dos átomos centrales son del mismo elemento y están ligados de forma idéntica.El procedimiento general para nombrar una entidad dinuclear simétrica es el siguiente: los ligandos se representan de la manera habitual y el afijo multiplicador di- se añade inmediatamente antes del nombre del átomo central. Si el compuesto es un anión, el nombre del elemento central se modifica con la desinencia – ato. 30 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR La existencia de un enlace entre los dos átomos centrales se indica añadiéndole al nombre los símbolos de los dos átomos en letra cursiva unidos por un guión extralargo y encerrados entre paréntesis. Los ligandos puentes en especies dinucleares se indican con la letra griega µ colocada antes del nombre del ligando y unida a él con un guión. El término completo se separa del resto del nombre mediante guiones. Si hay más de un ligando puente idéntico se emplean prefijos multiplicadores. Ej: di- µ -cloruro-tetraclorurodialuminio Si(OH)4 Tetrahidroxidosilicio (adición) Silanotetrol (sustitución) B(OMe)3 Trimetoxidoboro (adición) Trimetoxiborano (sustitución) [ClFO] Fluorurooxidocloro (adición) FClO [OCl2] Diclorurooxigeno (adición) ClOCl Diclorooxidano (sustitución) [ArFH] Fluorurohidruroargón (adición) FArH [HgMePh] Metilfenilmercurio (adición) [Al(POCl3)6]3+ Hexakis(triclorurooxidofosforo)aluminio)(3+) (adición) [Al(OH2)6]3+ Hexaacuaaluminio(3+) (adición) [H(OH2)2]+ Diacuahidrógeno(1+) [PFO3]2- Fluorurotrioxidofosfato(2-) (adición) [Sb(OH)6]- Hexahidroxidoantimoniato(1-) (adición) [HF2]- Difluorurohidrogenato(1-) (adición) (adición) 31 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR [BH2Cl2]- Diclorurodihidruroborato(1-) (adición) Dicloroboranuuro (sustitución) [ICl2]+ Dicloruroyodo(1+) Dicloroyadanio [BH4]- (adición) (sustitución) Tetrahidruroborato(1-) (adición) Boranuuro [CH5]- (sustitución) Pentahidrurocarbonato(1-) (adición) Metanuuro (sustitución) Carbanuuro (sustitución) [PH6]- Hexahidrurofosfato(1-) [PF6]- Hexafluorurofosfato(1-) (adición) (adición) Hexafluoro- λ 5‐fosfanuuro (sustitución) µ -cloruro-dioxígeno OClO dioxidocloro NCCN HSSH Bis(nitrurocarbono)(C—C) (adición) Dinitrurodicarbono (adición) .- Bis(hidrurosulfato)(S-S)(.1-) .- Bis(nitrurocarbonato)(C-C)(.1-) NCCN Entidades polinucleares: dinucleares asimétricas Sobrepasa el objetivo de este curso 32 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR NOMBRE DE LOS COMPUESTOS DE ADICIÓN (FORMALES) • Los nombres de cada uno de los componentes individuales de un compuesto de adición formal se construyen mediante el sistema de nomenclatura apropiado, ya sea de composición, de sustitución o de adición. • El nombre completo del compuesto se forma conectando los nombres de los componentes con guiones extralargos (“em”), las proporciones de los componentes se indican después del nombre por medio de un descriptor estequiométrico que está formado por números arábigos separados por barras. • El descriptor, que se coloca entre paréntesis, está separado del nombre del compuesto por un espacio. • El orden de los nombres de los componentes individuales es, primero, según el número creciente de los componentes y, segundo, el alfabético. • Como única excepción, el nombre del componente agua se cita el último. • Los números en el descriptor siguen el mismo orden que los nombres de los componentes correspondientes. • El nombre genérico “hidratos” es aceptado por la IUPAC para los compuestos de adición que contienen agua como componente debido a su uso generalizado (si bien la desinencia –ato podría confundir con un componente aniónico). • Los nombres hidrato, de tipo clásico, por ejemplo: sulfato de cobre pentahidrato, CuSO4.5H2O son aceptados por la IUPAC para los hidratos de estequiometria sencilla, pero no se han formulado reglas cuando la estequiometría es fraccionaria. • Los nombres deuterato y tritiato para los compuestos de adición de 2H2O y de 3H3O, respectivamente, no son aceptados por la IUPAC. 33 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Nomenclatura para los ácidos inorgánicos y sus derivados • El método llamado “nomenclatura ácida” se usa poco y no es necesaria, por tanto su uso ya no se recomienda. • Los compuestos e iones moleculares considerados habitualmente ácidos inorgánicos se tratan de igual manera que las demás especies moleculares a la hora de construir sus nombres sistemáticos. • El principio de aplicación general más sencillo para la nomenclatura sistemática es la nomenclatura de adición. • Algunos compuestos sencillos inorgánicos y otros que contienen carbono tienen nombres no sistemáticos o semisistemáticos que contienen la palabra ácido. Ej: H3BO3 ácido bórico -(HBO2)n- acido metabórico, H3PO4 ácido fosfórico H4P2O7 ácido difosfórico H2S2O4 ácido ditionoso H2S2O8 ácido peroxodisulfúrico o peroxidisulfúrico al dar estos nombres se describe una propiedad química particular de los compuestos en cuestión; por el contrario, los nombres sistemáticos se basan únicamente en la composición y en la estructura • A todos los ácidos anteriores se les puede dar nombres sistemáticos usando los principios de las nomenclaturas de adición y de sustitución, a este respecto los nombres que contienen la palara ácido son redundantes. Incluso muchas especies que muestran propiedades químicas de ácidos no se llaman de esta manera. Por ejemplo: los iones hidratados como hexaacuaaluminio(3+) , Al(H2O)63+ y algunos hidruros y sus derivados como amonio NH4+, sulfuro de hidrógeno H2S , (sulfano), … • Fundándose en las consideraciones anteriores, el uso de la palabra “ácido” se desaconseja en cualquier nombre nuevo en la nomenclatura inorgánica. Sin embargo, se usan habitualmente tal 34 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR cantidad de nombres de “ácidos” ya existentes “ácido sulfúrico, H2SO4 ácido perclórico HClO4…”) que la sugerencia de reemplazarlos por nombres sistemáticos sería poco práctico. • Otra razón para incluir los ácidos ya existentes en las recomendaciones actuales es que los ácidos se usan como estructuras progenitoras en la nomenclatura de de algunos derivados orgánicos (compuestos que contienen carbono) de forma que los nombres derivados se basan directa o indirectamente en los nombres que contienen la palabra “ácido” • Por tanto, los compuestos y los iones moleculares considerados habitualmente ácidos inorgánicos se tratan de igual manera que las demás especies moleculares a la hora de construir sus nombres sistemáticos. • Existe un tipo adicional de nombres que se denomina “nomenclatura de hidrógeno”. Estos nombres pueden considerarse una generalización de los nombres vulgares de aniones tales como “hidrogenocarbonato”. • Finalmente, los nombres que no denotan compuestos de una composición definida, tales como ácido estánnico, ácido wolfrámico, ácido clorhídrico se encuentran fuera del ámbito de la nomenclatura sistemática. Sin embargo los sistemas químicos involucrados pueden tratarse siempre usando nombres sistemáticos tales como cloruro de hidrógeno, óxido de estaño(IV); óxido de wolframio(VI) • Al nombrar ácido fosfórico H3PO4 ; [PO(OH)3] no se transmite estructura sino que el nombre responde a un patrón general en el que la desinencia “–ico” denota un alto o el más alto estado de oxidación, Ácido arsónico [AsHO(OH)2] • Los compuestos y los iones moleculares considerados habitualmente ácidos inorgánicos se tratan de igual manera que las demás especies moleculares a la hora de construir sus nombres sistemáticos, siendo el principio general de aplicación más sencillo la nomenclatura de adición • Las moléculas o iones que formalmente se pueden considerar como entidades de coordinación mononucleares pueden nombrarse por adición. por ejemplo: H3SO4+ [SO(OH)3]+ Trihidroxidooxidoazufre(1+) H2SO4 [SO2(OH)2] Dihidroxidodioxidoazufre HSO4- [SO3(OH)]- Hidroxidotrioxidosulfato(1-) 35 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Nomenclatura de hidrógeno • Es una nomenclatura alternativa para los compuestos e iones que contienen hidrógeno. • La palabra hidrogeno debe ser escrita sin tilde, pero debe leerse con énfasis en la sílaba –dro-, con un prefijo multiplicador, si es relevante, se une (sin espacio) al nombre de un anión obtenido por la nomenclatura de adición y colocada dentro de los signos de inclusión pertinentes. A esta construcción le sigue (de nuevo sin espacio) un número de carga, que indica la carga neta de la especie o unidad estructural que se va a nombrar (excepto si la especie/unidad es neutra). • La nomenclatura de hidrógeno es útil cuando la conectividad (las posiciones de unión de los hidrones) en un compuesto o ion que contiene hidrones es desconocida o no se especifica (es decir, cuando no se indica de cual de los dos o más tautómeros se trata, o cuando no se desea especificar una conectividad complicada, como en los compuestos reticulares). • La nomenclatura de hidrogeno puede usarse también para iones y compuestos moleculares sin problemas de tautomería, si se desea enfatizar que la estructura tiene hidrones unidos al anión en cuestión. Ejemplos: HMnO4 Hidrogeno(tetraoxidomanganato) H2MnO4 Dihidrogeno(tetraoxidomanganato) H2CrO4 Dihidrogeno(tetraoxidocromato) HCrO4 Hidrogeno(tetraoxidocromato)(1-) H2Cr2O7 Dihidrogeno(heptaoxidodicromato) H2O2 Dihidrogenoperóxido (Peróxido de hidrógeno sería nombre de composición) HO2- Hidrogeno(peróxido)(1-) H2S Dihidrogeno(sulfuro) Sulfuro de hidrógeno (sería nombre de composición) H2NO3+ Dihidrogeno(trioxidonitrato)(1+) 36 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR • La definición estricta de la nomenclatura de hidrógeno impone los siguientes requerimientos, al objeto de que los nombres de hidrógeno no se confundan con otros nombres: Que”hidrogeno” esté unido al resto del nombre Que se tiene que especificar el número de hidrógenos por medio de un prefijo multiplicador Que se coloque la parte aniónica entre signos de inclusión Que se especifique la carga neta de la estructura que se va a nombrar • Las únicas excepciones aceptables al formato anterior de los nombres de hidrógeno son los pocos y particulares nombres de aniones abreviados de la lista siguiente: Anión Nombre de hidrógeno simplificado Nombre de hidrógeno aceptado H2BO3‐ Dihidrogenoborato Dihidrogeno(trioxidoborato)(1‐) HBO3‐ Hidrogenoborato Hidrogeno(trioxidoborato)(1‐) HCO3‐ Hidrogenocarbonato Hidrogeno(trioxidocarbonato)(1‐) H2PO4‐ Dihidrogenofosfato Dihidrogeno(tetraoxidofosfato)(1‐) HPO42‐ Hidrogenofosfato Hidrogeno(tetraoxidofosfato)(2‐) HPHO3‐ Hidrogenofosfonato Hidrogeno(hidrurotrioxidofosfato)(1‐) H2PO3‐ Dihidrogenofosfito Dihidrogeno(trioxidofosfato)(1‐) HPO32‐ Hidrogenofosfito Hidrogeno(trioxidofosfato)(1‐) HSO4‐ Hidrogenosulfato Hidrogeno(tetraoxidosulfato)(1‐) HSO3‐ Hidrogenosulfito Hidrogeno(trioxidosulfato)(1‐) • En algunos casos no puede haber confusiones, y la distinción entre nombres de composición y nombres de hidrógeno no tiene mayor importancia, particularmente para los halogenuros de hidrógeno. Así HCl, puede llamarse igualmente, sin ambigüedad cloruro de hidrógeno (nombre de composición) o hidrogeno(cloruro) (nombre de hidrogeno) • Los ejemplos siguientes demuestran que a los homo y heteropoliácidos y a sus formas parcialmente deshidronadas pueden asignárseles nombres de hidrógeno una vez que se hayan nombrado sus correspondientes aniones 37 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR : Dihidrogeno[ µ -oxidobis(trioxidofosfato(2-)] (nomenclatura de adición) H2P2O72- Dihidrogeno(heptaoxidodifosfato(2-) (nomenclatura de hidrogeno)?????’ Dihidrogeno(difosfato) semisistemática????? Los dos hidrones pueden localizarse en dos átomos de oxígeno del mismo átomo de fósforo o uno en cada átomo de fósforo; la nomenclatura de hidrógeno no especifica necesariamente la estructura H2Mo6O19 [Dihidrogenononadecaoxidohexamolibdato] (nomenclatura de hidrogeno) H2Cr2O7 Dihidrogeno(heptaoxidodicromato) (nomenclatura de hidrógeno) µ -oxido-bis(hidroxidodioxidocromo) (nomenclatura de adición) H2B2(O2)2(OH)4 Dihidrogeno(tetrahidroxidodi- µ ‐peroxido)diborato (nomenclatura de hidrógeno) H4[Fe(CN)6] Tetrahidrogeno(hexacianuroferrato) (nomenclatura de adición) HCN Hidrogeno(nitrurocarbonato) Hidruronitrocarbono (sería su correspondiente nombre de adición). (el nombre de hidrógeno hace referencia indistinta a dos tautómeros, por tanto la nomenclastura de hidrógeno se puede emplear para iones y compuestos moleculares sin problemas de tautomería, si se desea enfatizar que la estructura tiene hidrones unidos al anión en cuestión)) • Los siguientes ejemplos muestran cómo es posible nombrar fácilmente mediante la nomenclatura de hidrógeno compuestos de metales de transición a los que tradicionalmente se les dio el nombre de ácidos. HMnO4 Hidrogeno(tetraoxidomanganato) H2MnO4 Dihidrogenotetraoxidomanganato 38 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR H2CrO4 HCrO4 • – Dihidrogeno(tetraoxidocromato) Hidrogeno(tetraoxidocromato)(1-) Los nombres del tipo ácido permangánico, HMnO4, ácido dicrómico H2Cr2O7, etc no se encuentran en las recomendaciones actuales porque representan un área donde es difícil sistematizar y decidir lo que se incluye y donde no son necesarios para la nomenclatura orgánica, en contraposición con los nombres “acidos” correspondientes de los ácidos de los elementos principales. • Finalmente debe observarse que el uso en los nombres de las sales y de ésteres parciales de ácidos orgánicos polivalentes es diferente del anterior, donde “hidrogeno” se cita siempre como una palabra separada justamente después del nombre del anión. Ej: ftalato de hidrógeno y potasio; Ftalato de etilo e hidrógeno Los tres sistemas de nomenclatura pueden proporcionar nombres diferentes, pero sin ambigüedades, para un compuesto dado. La elección entre los tres sistemas depende de la clase de compuesto inorgánico que se trate y del grado de detalle que se desea comunicar. 39 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR A continuación se tratarán los diversos tipos de compuestos inorgánicos y se estudiarán las reglas correspondientes a los tipos de nomenclatura que pueden emplearse. Previamente se deben recordar los siguientes conceptos: • Una muestra de un elemento que tiene fórmula indefinida o es una mezcla de alótropos tiene el mismo nombre que el átomo • Todos los isótopos de un elemento llevan el mismo nombre y se designan por sus números de masa (oxígeno-18) y se representa 18º, a excepción de los isótopos del hidrógeno • La mezcla indiferenciada de isótopos de hidrógeno debe denominarse “hidrón” y reservar los nombres protio, deuterio, tritio para los elementos isotópicamente puros y protón deuterón y tritón para los iones isotópicamente puros. • Las modificaciones alotrópicas de un elemento tienen el mismo nombre que el átomo del que derivan, junto con un descriptor, generalmente α , β , γ , que especifica la modificación., colcres y, en los casos adecuados los nombres de minerales (v.g diamante, grafito para las dos formas más conocidas del carbono) • Los gases nobles existen en forma monoatómica. Su fórmula es el símbolo del gas noble: He , Ne , Ar , Kr , Xe , Rn • O2 Las sustancias simples, elementos moleculares, (no metálicos), tienen composición definida: , O3 H 2 N 2 P4 S8 F2 Cl2 Br2 I 2 , , , , , , , , (Se representan mediante el símbolo del elemento químico acompañado de un subíndice a la derecha que indica el número de constituyentes individuales( en este caso átomos) que forman la molécula. • Las sustancias simples (covalentes o metálicas) que forman macromoléculas se representan sólo con el símbolo del elemento: C (grafito, diamante, fullereno), Fe, Na, Ag… • Las sustancias compuestas heteropolares que forman macromoléculas se representan mediante la fórmula empírica, fórmula que señala la proporción entre los átomos, ejemplo: SiO2 40 FORMULACIÓN QUÍMICA INORGÁNICA IES SIERRA SUR FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 Nombre vulgar aceptado Nombre (sistemático) de hidrogeno FÓRMULA Nombre sistemático de adición Nombre de composición Nombre de sustitución Ácido bórico (a) H3BO3 [B(OH)3] Dihidrogenoborato Trihidrogeno(trioxidoborato) Trihidroxidoborato H2BO3‐ [BO(OH)2]‐ Dihidrogeno(trioxidoborato)(1‐) Dihidroxidooxidoborato(1‐) Hidrogenoborato HBO32‐ [BO2(OH)]2‐ Hidrogeno(trioxidoborato)(2‐) Hidroxidodioxidoborato(2‐) Borato BO33‐ Trioxidoborato(3‐) Trioxidoborato(3‐) ‐(HBO2)‐n ‐[B(OH)n]‐ Metaborato (BO2)n‐ Ácido carbónico H2CO3 [CO(OH)2] Ácido metabórico Hidrogeno(dioxidoborato) Dioxoborato(1‐) Dihidrogeno(trioxidocarbonato) Dihidroxidooxidocarbonato Hidrogenocarbonato HCO3‐ [CO2(OH)]‐ Hidrogeno(trioxidocarbonato)(1‐) Hidroxidodioxidocarbonato(1‐) Carbonato CO32‐ Trioxidocarbonato(2‐) Trioxidocarbonato(2‐) Carbono C Monocarbono C4‐ Carburo(4‐) Carburo 41 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Monóxido de carbono CO Dióxido de carbono CO2 Dióxidocarbono Monosulfuro de carbono CS Disulfurocarbono Dicarbono C2 Acetiluro C22‐ Dicarburo(2‐) Dióxido de tricarbono C3O2 O=C=C=C=O Metano CH4 Carbano Cianuro de hidrógeno HCN Ácido ciánico HOCN [C(N)OH] Hidroxidonitrurocarbonato Ácido isociánico HNCO [C(NH)O] (Hidruronitrato)oxidocarbono Cianato OCN‐ [C(N)O]‐ Nitrurooxidocarbonato(1‐) Cianuro CN‐ Ácido silícico (a) H4SiO4 [Si(OH)4] Silicato Nitrurocarbonato(1‐) Tetrahidrogeno(tetraoxidosilicato) Tetrahidroxidosilicio SiO44‐ Tetraoxidosilicato(4‐) Tetraoxidosilicato(4‐) HSiO43‐ Ácido metasilícico (H2SiO3)n ‐(Si(OH)O2)n‐ Metasilicato ‐(SiO3)‐2n‐ Ácido disilícico (b) H6Si2O7 [HO)3SiOSi(OH)3] Disilicato [Si2O7]2‐ [OSiOSiO]3‐ µ ‐óxido‐bis(trihidroxidosilicio)(6‐) Ácido nítrico HNO3 [NO2(OH)] Hidrogeno(trioxidonitrato) µ ‐óxido‐bis(trihidroxidosilicio) Hidroxidodioxidonitrato 42 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR H2NO3+ [NO(OH)2]+ Dihidrogeno(trioxidonitrato)(1+) Dihidroxidooxidonitrógeno(1+) Nitrato NO3‐ Trioxidonitrato(1‐) Trioxidonitrato(1‐) Hidroxilamina (e) NH2OH [H2NHO] hidroxidodihidruronitrógeno Ácido nitroso HNO2 [NO(OH)] Hidrogeno(dioxidonitrato) hidroxidooxidonitrato Nitrito NO2‐ Dioxidonitrato(1‐) Dioxidonitrato(1‐) Hidroxilamina H3NO Hidroxidodihidruronitrógeno Ácido hiponitroso HNO Hidroxidonitrogeno Hidrogenooxidonitrato Ácido peroxinitroso HNO(O2) Dioxidanurooxidonitrógeno Ácido fosfórico (a) H3PO4 [PO(OH)3] Trihidrogeno(tetraoxidofosfato) Dihidrogenofosfato Trihidroxidooxidofosfato H2PO4‐ [PO2(OH)2]‐ Dihidrogeno(tetraoxidofosfato(1‐) Dihidroxidodioxidofosfato(1‐) Hidrogenofosfato HPO42‐ [PO3(OH)]2‐ Hidrogeno(tetraoxidofosfato)(2‐) Hidroxidotrioxidofosfato(2‐) Fosfato PO43‐ Tetraoxidofosfato(3‐) Tetraoxidofosfato(3‐) Ácido fosfónico (g) H2PHO3 [PHO(OH)2] Fosfonato [PHO3]2‐ Hidrogenofosfonato [PHO2(OH)]‐ Ácido fosforoso (g) H3PO3 [P(OH)3] dihidroxidohidrurooxidofósforo Hidrurotrioxidofosfato(2‐) Hidroxidohidrurodioxidofosfato(1‐) Trihidrogeno(trioxidofosfato) Trihidroxidofósforo 43 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Dihidrogenofosfito H2PO3‐ [PO(OH)2]‐ Dihidrogeno(trioxidofosfato)(1‐) Dihidroxidooxidofósfato(1‐) Hidrogenofosfito HPO32‐ [PO2(OH)]2‐ Hidrogeno(trioxidofosfato)(2‐) Hidroxidodioxidofosfato(2‐) HPO2 hidroxidooxidofósforo HO3P Hidroxidodioxidofósforo Fosfito PO33‐ Trioxidofosfato(3‐) Trioxidofosfato(3‐) Ácido fosfonoso H2PHO2 [PH(OH)2] Ácido difosfórico (c) H4P2O7 [(HO)2P(O)OP(O)(OH dihidroxidohidrurofosforo µ ‐óxido‐bis(dihidroxidooxidofósforo) )2] Ácido metafosfórico ‐(HPO3)‐n Ácido difosfónico H2P2H2O5 [(HO)P(H)(O)OP(H) µ ‐óxido‐ (O)(OH)] bis(hidroxidohidrurooxidofosforo) µ ‐óxido‐bis(hidrurodioxidofosfato)(2‐)) Difisfonato [PH(O)2PH(O)2]2‐ Ácido peroxifosfórico PO(OH)2(OOH) Dioxidanurodihidroxidooxidofósforo Ácido arsénico(arsórico) (i) H3AsO4 [AsO(OH)3] Trihidrogeno(tetraoxidoarseniato) Ácido arsenoso Trihidroxidooxidoarsénico (i) H3AsO3 [As(OH)3] Trihidrogeno(trioxidoarseniato) Trihidroxidoarsénico (AsHO3)2‐ Hidrurotrioxidoarsenato(2‐) (AsH2O2)‐ Dihidrurodioxidoarsenato(1‐) (AsH2O)‐ Dihidrurooxidoarsenato(1‐) AsO(OH)2‐ Arsenito AsO33‐ AsO33‐ Dihidroxidooxidoarsenato(1‐) Trioxidoarsenato(3‐) 44 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Arsenuro As3‐ Arsenato AsO43‐ AsO43‐ As2H4 Diarsano As4 Tetraarsénico Ácido antimónico (i) H3SbO4 [SbO(OH)3] (estibórico) Tetraoxidoarsenato(3‐) Trihidrogeno(tetraoxidoantimoniato) Trihidroxidooxidoantimonio Ácido antimonioso (i) H3SbO3 [Sb(OH)3] (estiboroso) Trihidrogeno(trioxidoantimoniato) Trihidroxidoantimonio Ácido sulfúrico H2SO4 [SO2(OH)2] Hidrogenosulfato Dihidrogeno(tetraoxidosulfato) Dihidroxidodioxidoazufre HSO4‐ [SO3(OH)]‐ Hidrogeno(tetraoxidosulfato)(1‐) Hidroxidotrioxidosulfato(1‐) Sulfato SO42‐ Tetraoxidosulfato(2‐) Tetraoxidosulfato(2‐) Ácido sulfónico (j) HSHO3 [SHO2(OH)] Ácido sulfuroso H2SO3 [SO(OH)2] Hidrogenosulfito Hidroxidohidrurodioxidoazufre Dihidrogeno(trioxidosulfato) Dihidroxidooxidosulfato HSO3‐ [SO2(OH)]‐ HO3S‐ Hidrogeno(trioxidosulfato)(1‐) Hidroxidodioxidosulfato(1‐) Sulfito SO32‐ Trioxidosulfato(2‐) Trioxidosulfato(2‐) Ácido sulfínico (j) HSHO2 Ácido disulfúrico (c) H2S2O7 [SHO(OH)] hidroxidohidrurooxidoazufre [(HO)S(O)2OS(O) µ ‐óxido‐bis(hidroxidodioxidoazufre) 2(OH)] 45 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Sulfuro de hidrógeno H2S Sulfuro de dihidrógeno Sulfano Dihidruroazufre [SH2] H‐S‐S‐H Bis(hidruroazufre)(S‐S) Trisulfuro de dihidrógeno H2S3 Trisulfano H3S+ Sulfanio Trihidruroazufre(1+) H3S‐ Sulfanuuro Trihidrurosulfato(1‐) Tetrasulfuro de H2S4 dihidrógeno Pentasulfuro de dihidrógeno Tetrasulfano H2S5 Pentasulfano Pentasulfuro de dihidrógeno Disulfato [S2O7]2‐ Ácido ditiónico (c) H2S2O6 (l) [(O)3SOS(O)3]2‐ µ ‐óxido‐bis(trioxidosulfato)(2‐) [(HO)(O)2SS(O)2(O Bis(hidroxidooxidoazufre)(S—S) H)] Ditionato [S2O6]2‐ Ácido disulfuroso (n) H2S2O5 [O3SSO3]2‐ Bis(trioxidosulfato)(S—S)(2‐) [(HO)(O)2SS(O)(OH NO SIMÉTRICO )] Disulfito S2O52‐ HS‐ [O(O)2SS(O)O]2‐ NO SIMÉTRICO Sulfanuro Hidrogenosulfuro(1‐) Ácido ditionoso (c) H2S2O4 (l) Ácido selénico [(HO)(O)SS(O)(OH) ] H2SeO4 [SeO2(OH)2] Selenato Bis(hidroxidooxidoazufre)(S—S) Dihidrogeno(tetraoxidoselenato) Dihidroxidodioxidoselenio SeO42‐ Tetraoxidoselenato(2‐) Tetraoxidoselenato(2‐) 46 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Ácido selenónico (j) (o) Ácido selenoso (o) H2SeO3 [SeHO2(OH)] H2SeO3 [SeO(OH)2] Selenito Hidrurohidroxidodioxidoselenio Dihidrogeno(trioxidoselenato) Dihidroxidooxidoselenio SeO32‐ Trioxidoselenato(2‐) Trioxidoselenato(2‐) Hidrogenoselenato HSeO4‐ Hidroxidotrioxidoselenato(1‐) H3Se‐ Selanuuro Trihidruroselenato(1‐) HSe‐ Selanuro Hidogenoselenuro(1‐) Selenuro de dihidrógeno H2Se [SeH2] Selano Dihidruroselenio Diseleniuro de H2Se2 dihidrógeno Diselano Bis(hidruroselenio)(Se‐Se) HTe‐ Telanuro Hidrogeno(telanuro)(1‐) Telanuro de hidrógeno H2Te [TeH2] Telano Dihidruroteluro H2 Dihidrógeno H3O+ Oxonio Oxidanio Trihidrurooxigeno(1+) H4O2+ Oxidanodiio Tetyrahidrurooxígeno(2+) D2 Dideuterio 47 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR T2 Ditritio H2Br+ Bromanio(1+) Dihidrurobromo(1+) H2Cl+ Cloranio Dihidrurocloro(1+) Ácido selenínico HSeO3‐ HSeHO2 H3Se+ [SeHO(OH)] Hidroxidodioxidoselenato(1‐) hidrurohidroxidooxidoselenio Selanio Trihidruroselenio(1+) H3Se‐ Selanuuro Trihidruroelenato(1‐) H3Te‐ Telanuuro Trihidrurotelurato(1‐) H3Te+ Telanio Trihidruroteluro(1+) Ácido ortotelúrico (a) H6TeO6 [Te(OH)6] Hexahidroxidoteluro Ortotelurato (a) [TeO6]6‐ Ácido telúrico (a) H2TeO4 [TeO2)OH)2] Telurato (a) [TeO4]2‐ Tetraoxidotelurato(2‐) Ácido teluroso H2TeO3 [TeO(OH)2] Dihidroxidooxidoteluro HCl Hexaoxidotelurato(6‐) Dihidroxidodioxidoteluro Cloruro de hidrógeno Clorurohidrógeno Clorano Ácido perclórico HClO4 [ClO3(OH)] ClHO4 Hidrogeno(tetraoxidoclorato) Hidroxidotrioxidocloro 48 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Perclorato ClO4‐ Tetraoxidoclorato(1‐) Tetraoxidoclorato(1‐) Ácido clórico HClO3 Clorato [ClO3(OH)] ClHO3 ClO3‐ Hidrogeno(trioxidoclorato) Hidroxidodioxidocloro Trioxidoclorato(1‐) Trioxidoclorato(1‐) Ácido cloroso HClO2 Clorito [ClO(OH)] ClHO2 ClO2‐ Hidrogeno(dioxidoclorato) Hidroxidooxidocloro Dioxidoclorato(1‐) Dioxidoclorato(1‐) Ácido hipocloroso HClO [ClOH] ClHO Hidrogeno(oxidoclorato) Hidroxidocloro Hipoclorito [OCl]‐ Clorurooxigenato(1‐) Dicloro Cl2 Tetracloro(1+) Cl4+ Tetracloro(1+) ClF2‐ Difluoruroclorato(1‐) ClF41‐ Tetrafluoruroclorato(1‐) Fluoruro de hidrógeno HF Fluorano Ácido fluorhídrico Diflúor Fluorurohidrógeno HF(aq) F2 Fluoranio Dihidruroflúor(1+) Agua H2O Óxido de dihidrógeno Oxidano (n.h.p.) Dihidrurooxígeno (n. adición) 1 H2O 2 H2O Óxido de diprotio Óxido de dideuterio 49 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR 3 Óxido de ditritio H2O Peróxido de hidrógeno H2O2 Dioxidano (n.h.p.) Bis8hidrurooxígeno)(O‐O) H2F+ Monofluoruro de cloro ClF Fluorurocloro Cloruro Cl‐ Cloruro(1‐) Dibromo Br2 Tribromuro(1‐) Br3‐ HI Yodano Tribromuro Yoduro de hidrógeno Ácido yodhídrico Yodurohidrógeno HI(aq) Monobromo Br Bromo(1+) Br1+ Bromuro Br‐ HBrO4 [BrO3(OH)] Bromuro(1‐) Ácido perbrómico Perbromato Hidroxidotrioxidobromo BrHO4 BrO4‐ Hidrogeno(tetraoxidobromato) Tetraoxidobromato(1‐) Tetraoxidobromato(1‐) Ácido brómico HBrO3 [BrO2(OH)] BrHO3 Hidrogeno(trioxidobromato) Hidroxidodioxidobromo Bromato BrO3‐ Trioxidobromato(1‐) Trioxidobromato(1‐) Ácido bromoso HBrO2 [BrO(OH)] Hidrogeno(dioxidobromato) Hidroxidooxidobromo 50 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Bromito BrO4‐ Tetraoxidobromato(1‐) Tetraoxidobromato(1‐) Ácido hipobromoso HBrO [BrOH] BrHO Hidrogeno(oxidobromato) Hidroxidobromo Hipobromito OBr‐ Bromurooxigenato(1‐) (a) H5IO6 [IO(OH)5] Ortoperyodato (a) [IO6]5‐ Ácido peryódico (a) HIO4 [IO3(OH)] Ácido ortoperyódico Pentahidroxidooxidoyodo Hexaoxidoyodato(5‐) Hidrogeno(tetraoxidoyodato) Hidroxidotrioxidoyodo Peryodato (a) IO4‐ Tetraoxidoyodato(1‐) Tetraoxidoyodato(1‐) Ácido yódico HIO3 [IO2(OH)] Hidrogeno(trioxidoyodato) Hidroxidodioxidoyodato Yodato IO3‐ Trioxidoyodato(1‐) Trioxidoyodato(1‐) Ácido yodoso HIO2 [IO(OH)] Hidrogeno(dioxidoyodato) Hidroxidooxidoyodo Yodito IO2‐ Dioxidoyodato(1‐) Dioxidoyodato(1‐) Ácido Hipoyodoso Hipoyodito HIO OI ‐ [IOH] Hidrogeno(oxidoyodato) Hidroxidoyodo Yodurooxigenato(1‐) 51 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR H2Cr2O7 Dicromato Cr2O72‐ Heptaoxidodicromato(2‐) μ‐óxido‐bis(trioxidocromato)(2‐) H3BO3 HBO2 Boruro B3‐ BH2‐ Boranodiuro BH2+ Hidrfuroboro(2+) BH2‐ Boranuro Borano BH3 Trihidruroboro BH4+ Tetrahidruroboro(1+) Boruro(3‐) Boranio BH4‐ Tetrahidruroborato(1‐) Boranuuro Monóxido de boro BO Oxidoboro BO+ Oxidoboro(1+) BO‐ Oxidoborato(1‐) BO3‐ Trioxidoborato(3‐) H4SiO4 H2SiO3 52 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR H2CrO4 HMnO4 NaHSO4 CuHSO4 Cu(HSO4)2 LiHSO3 NH4SO3 CaHPO4 Mg(HPO4)2 Al(H2PO3)3 Fe(H2PO3)3 FeHBO3 KH2BO3 Cd(HS2O7)2 Na2H2P2O7 Ca3(PO4)2 RbMnO4 HMnO4 HMnO41‐ Rb2MnO4 NaNO2 Hidroxidotrioxidomanganeso Hidroxidotrioxidomanganato(1‐) 53 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR KNO3 AlPO4 (NH4)2CO3 K2Cr2O7 Cr2+ Dióxido de cromo CrO2 CrO CrO3 Diperóxidocromo CrO4 CrO42‐ Tetraoxidocromato(2‐) CrO43‐ Tetraoxidocromato(3‐) CrO44‐ Tetraoxidocromato(4‐) Trióxido de dicromo Cr2O3 Cr2O72‐ Cromo(2+) Óxido de cromo(IV) Monóxido de cromo Óxido de cromo(II) Trióxido de cromo Óxido de cromo(VI) Cr(O2)2 Óxido de cromo(III) Dicromato Heptaoxidodicromato(2‐) μ‐óxido‐bis(trioxidocromato)(2‐) NaClO4 Fe(ClO3)2 Fe(ClO3)3 54 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Au2(SO4)3 Ca2+ Calcio(2+) Co3+ Cobalto(3+) Monocloruro de aluminio AlCl Cloruroaluminio Al+ Aluminio(1+) Al3+ Aluminio(3+) Tricloruro de aluminio AlCl3 Tricloruroaluminio Tricloroalumano Monohidruro de aluminio AlH Trihidruro de aluminio AlH3 Alumano (n.h.p.) Trihidruroaluminio Dialuminio Al2 Oro(3+) Au3+ Astaturo At‐ Diastato At2 Óxido de bario BaO Peróxido de bario BaO2 Monohidruro de berilio BeH Trihidruro de bismuto BiH3 Fe2+ Hierro(2+) Fe3+ Hierro(3+) Dióxido(2‐) de bario 55 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Ge4‐ Germuro Ge2+ Germanio(2+) Ge4+ Germanio(4+) Germano GeH4 Tetrahidrurogermanio H+ Hidrón (protón, deuterón, tritón) H‐ Hidruro( proturo, deuteruro, trituro) HO hidroxil Hidroxi,oxidanil(o) ‐OH OH‐ Oxidanuro Hidrurooxigeneto(1‐) Hidróxido HO2‐ Hidrogeno(peroxido)(1‐) Dioxidanuro Cu+ Cobre(1+) Cu2+ Cobre(2+) HMnO4 Hidrogeno(tetraoxidomanganato) Hidroxidotrioxidomanganeso H2MnO4 Dihidrogeno(tetraoxidomanganato) Dihidroxidodioxidomanganeso H2Po H2 He2 Dihelio 56 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Hg2+ Mercurio(2+) Hg22+ Dimercurio(2+) I Monoyodo Yoduro I‐ Yoduro(1‐) ICl2+ Fluoruro de yodo IF IF4‐ I2 Diyodo I3 Triyodo Triyoduro I3‐ Triyoduro(1‐) IF6‐ Trihidruro de indio InH3 Dicloruroyodo(1+) Fluoruroyodo Tetrafluoruroyodato(1‐) Hexafluoruroyodato(1‐) Trihidruroindio Indigano(n.h.p) Superóxido de potasio KO2 Dióxido(1‐)de potasio KO3 Trióxido(1‐) de potasio Ozónido de potasio Óxido de dipotasio K2O K2O2 Dióxido(2‐) de potasio Peróxido de potasio 57 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Litio(1+) Li+ Cloruro de litio LiCl [LiCl] Hidruro de litio LiH [LiH] Li2 Mg+ Magnesio(1+) Mg2+ Magnesio(2+) Monóxido de manganeso MnO MnO2 MnO3+ Trioxidomanganeso(1+) Permanganato MnO4‐ Tetraoxidomanganato(1‐) Clorurolitio Hidrurolitio Dilitio Óxido de manganeso(II) Dióxido de manganeso Óxido de manganeso(IV) Manganato(VII) MnO42‐ Manganato(VI) Tetraoxidomanganato(2‐) MnO43‐ Tetraoxidomanganato(3‐) 58 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Manganato(V) Trióxido de dimanganeso Mn2O3 Mn2O7 μ‐óxido‐bis(trioxidomanganeso) Tetraóxido de trimanganeso Mn3O4 Tetraóxido de manganeso(II,III) Nitrógeno N Óxido de manganeso(III) Heptaóxido de dimanganeso Óxido de manganeso(VII) Mononitrógeno Nitruro N3‐ Nitruro(3‐) Azanonitruro NCl2‐ Dicloruronitrato(1‐) NF2‐ Difluoruronitrato(2‐) Trifluoruro de nitrógeno NF3 NF4+ Tetrafluoruroamonio Tetrafluoruronitrógeno(1+) =NH Imino NH+ Hidruronitrógeno(1+) 59 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR NH2+ NH‐ Hidruronitrato(1‐) NH2‐ Azanodiuro Hidruronitrógeno(2+) Hidruronitrato(2‐) NH2‐ Azanuro Dihidruronitrato(1‐) Amida Azano NH3 Amina (n.h.p) Amina???? (n.h.p) Como igando ammino Amonio NH4+ Azanio No es óxido nítrico Oxidonitrógeno(.) Monóxido de nitrógeno NO NO+ NO2+ NO‐ Dióxido de nitrógeno NO2 NO2+ NO2‐ Dioxidonitrato(1‐) Trióxido de nitrógeno NO3 Trioxidonitrogeno(.) No es nitrosil Oxidonitrógeno(1+) Oxidonitrógeno(2+) No es radical Oxidonitrato(1‐) No es nitrilo Dioxidonitrógeno(1+) 60 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Nitrato NO3‐ NO4‐ Trioxidonitrato(1‐) [NO(OO)]‐ Oxidoperoxidonitrato(1‐) Peroxinirito Monosulfuro de nitrógeno NS Dinitrógeno N2 N2.+ Dinitrógeno(.1+) N22+ Dinitrógeno(2+) N22‐ Dinitruro(2‐) N2H2 H2N‐NH2 Diazano H2N‐NH3+ Hidrazinio HN=NH Diazeno No es óxido nitroso Óxido de dinitrógeno N2O Dióxido de dinitrógeno N2O2 N2O22‐ Trióxido de dinitrógeno N2O3 NO+ Oxidonitrógeno(1+) NO2‐ Dioxidonitrato(1‐) ONONO Bis(oxidonitrato)(N‐N)(2‐) μ‐óxido‐bis(oxidonitrógeno) 61 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Tetraóxido de dinitrógeno N2O4 O2NNO2 N3(.) Trinitrógeno(.) N3H Trinitruro(1‐) de hidrógeno Bis(dioxidonirogeno)(N‐N) Azida de hidrógeno N3‐ Trinitruro81‐) Azida N5+ Pentanitrógeno(1+) Na+ Sodio81+) NaCl [NaCl] Cloruro de sodio Clorurosodio NaCl+ Na2 Disodio Na2+ Disodio(1+) Ni2+ Níquel(2+) Ni3+ Níquel(3+) O =O Oxo Óxido O2‐ Óxido(2‐) Clorurosodio(1+) Monooxígeno 62 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR ‐O‐ Epoxi en ciclos OBr Bomuro de oxígeno ‐OBr Bromooxi OBr+ OBr‐ Bromurooxigenato(1‐) OCl Clorurooxígeno(.) No es bromosilo Bromooxígeno(1+) (Mono)cloruro de oxígeno Clorosil(o) Clorooxi ‐OCl OF (mono)fluoruro de oxígeno OF. Fluorurooxígeno(.) OF+ Fluorurooxígeno(1+) OF‐ Fluorurooxigenato(1‐) OF2 [OF2] Cloruro de dioxígeno O2Cl+ No es cloril(o) Clorito ClO2‐ Difluoruro de oxígeno Dióxidocloro(1+) Dioxidoclorato(1‐) O2Cl2+ Difluoruro de dioxigeno O2F2 Dicoruro de dioxigeno(1+) 63 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Difluordioxidano FOOF Bis(fluorurooxígeno)(O‐O) Yoduro de dioxígeno O2I IO2. IO2+ Yodito IO2‐ Ozono O3 Ozónido O3.‐ OI (mono)yoduro de oxígeno ‐IO Yodooxi OI+ OI Yodurooxigenato(1‐) O2 Dioxígeno O22. ‐O‐O‐ Dioxidoyodo(.) No es yodil(o) Dioxidoyodo(+) Dioxidoyodato(1‐) Trioxígeno ‐O‐O‐O‐ Trioxidanodiil(o) Trióxido(.1‐) No es yodosil Yodurooxígeno(1+) Dioxígeno(2.) Peroxi Dioxidanobis(ilio) O22+ Dioxígeno(2+) 64 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Dioxidanobis(ilio) O2.‐ O22‐ No es hiperóxido Superóxido Oxidanodiuro Dióxido(2‐) Peróxido O2Br BrO2+ Bromuro de dioxígeno No es bromil(o) Dioxidobromo(1+) Bromito BrO2‐ Dioxidobromato(1‐) O3Br Bromuro de trioxígeno BrO3. Trióxidobromo(.) BrO3+ Bromato BrO3‐ Cloruro de trioxígeno O3Cl ClO3. ClO3+ ClO3‐ Yoduro de trioxígeno O3I IO3. IO3+ No es perbromil(o) Trioxidobromo(1+) Trioxidobromato(1‐) Trioxidocloro(.) No es percloril(o) Trioxidocloro(1+) Trioxidoclorato(1‐) Trioxidoyodo(.) No es peryodil(o) Trioxidoyodo(1+) 65 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Yodato IO3‐ Trioxidoyodato(1‐) O4Br Bromuro de tetraoxígeno Perbromato BrO4‐ Tetraoxidobromato(1‐) Cloruro de tetraoxigeno O4Cl ClO4. Tetraoxidocloro(.) Perclorato ClO4‐ Tetraoxidoclorato(1‐) Yoduro de tetraoxígeno O4I Peryodato IO4‐ Tetraoxidoyodato(1‐) IO4. Tetraoxidoyodato(.) IO53‐ Pentaoxidoyodato(3‐) Ortoperyodato IO65‐ Hexaoxidoyodato(5‐) (I2O9)4‐ Monofósforo P P+ Fósforo(1+) Fosfuro P3‐ Fosfuro(3‐) [03I(μ‐O)3IO3]4‐ Tris‐μ‐óxido‐bis(trioxidoyoddato)(4‐) Fosfanotriuro PF2‐ Difluorfosfanuro PF2‐ Fluorurofosfato(2‐) Fluorfosfanodiuro 66 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Trifluoruro de fósforo PF3 Trifluorfosfano [PF3] Trifluorurofósforo PF4+ Tetrafluorurofósforo(1+) Tetrafluorfosfanio PF4‐ Tetrafluorurofosfato(1‐) Tetrafluorfosfanuro Pentafluoruro de fósforo PF5 Pentafluorurofósforo PF6‐ Hexafluorurofosfato(1‐) PH2‐ Fosfanodiuro Hidrurofosfato(2‐) PH2‐ Fosfanuro Dihidrurofosfato(1‐) Trihidruro de fósforo Fosfano(n.h.p.) PH3 Trihidrurofósforo [PH3] Fosfano(n.h.p.) Trihidrurofósforo PH4+ Fosfanio Tetrahidrurofósforo(1+) PH4‐ Tetrahidrurofosfato(1‐) Fosfanuuro Pentahidruro de fósforo PH5 Pentahidrurofósforo 67 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Monóxido de fósforo PO PO. Fosforil(o) Óxidofósforo(.) PO+ No es fosforilo Óxidofósforo(1+) PO‐ Óxidofosfato(1‐) PO2‐ Dióxidofosfato(1‐) PO3‐ Trioxidofosfato(1‐) Fosfito PO33‐ Trioxidofosfato(3‐) ‐P(O)(O)2 Fosfonato (PO3)n Fosfato PO43‐ Tetraoxidofosfato(3‐) Peroxifosfato PO53‐ Trioxidoperoxidofosfato(3‐) ‐PS PS+ PS43‐ P2 Difósforo P2‐ Difosfuro(1‐) P22‐ Difosfuro(2‐) (HPPH)2‐ HP=PH Fosforoperoxoato Tiofosforil(o) No es tiofosforil Sulfurofósforo(1+) Tetrasulfurofosfato(3‐) Difosfano‐1,2‐diuro Difosfano 68 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR H2PPH‐ P2H4 Hipodifosfato (P2O6)4‐ Difosfato Tetrafósforo P4 Plomo (4+) Pb4+ Tetrahidruro de plomo PbH4 Pb94‐ Nonaplumburio(4‐) Pd4+ Paladio(4+) Pt2+ Platino(2+) PuO2+ ReO4‐ Monoazufre S S+ Azufre(1+) S2‐ Sulfuro(2‐) Difosfanuro (H2PPH2) Difosfano(n.h.p) Bis(trioxidofosfato)(P_P)(4‐) (O3POPO3)4‐ Μ‐óxido‐bis(trioxidofosfato)(4‐) Plumbano Tetrahidruroplomo (no es plutonil) Dioxidoplutonio(1+) Tetraoxidorenato(1‐) Azufre en general Sulfanodiuro Sulfuro Monó(o)xido SO 69 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Dióxido de azufre SO2 [SO2] Dioxidoazufre Sulfuril Sulfonil SO2‐ Dioxidosulfato(2‐) Sulfanodiolato Trioxido de azufre SO3 Sulfito SO32‐ Trioxidosulfato(2‐) SO42‐ Tetraoxidosulfato(2‐) HSO4‐ Hidrogenotetraoxidosulfato(1‐) Hidroxidotrioxidosulfato(1‐) SO52‐ SO3(OO)2‐ Trioxidoperoxidosulfato(2‐) Peroxisulfato Diazufre S2 S22‐ Disulfuro(2‐) Disulfanodiuro S2O22‐ SOOS2‐ (S‐O‐O‐S)2‐ Bis(oxidosulfato)(S‐)(2‐) (O‐S‐S‐O)2‐ Bis(sulfurooxigenato)(O‐O)(2‐) Tiosulfito S2O22‐ Tiosulfato S2O32‐ Disulfanodiolato Dioxidosulfurosulfato(2‐) SO3S2‐ Trioxidosulfurosulfato(2‐) 70 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Ditionito S2O42‐ O2SSO22‐ S2O52‐ O2SOSO22‐ Ditionato S2O62‐ O3SSO32‐ Disulfato S2O72‐ O3SOSO32‐ Peroxidisulfato S2O82‐ Ditiosulfonil S3 S32+ Triazufre(2+) S32‐ Trisulfuro(2‐) S4 S42+ Tetraazufre(2+) S42‐ Tetrasulfuro(2‐) S4O62‐ S5 S52‐ S8 S82+ Octaazufre(2+) S82‐ Octasulfuro(2‐) Antimonuro Sb3‐ Antimonuro(3‐) Bis(dioxidosulfato)(S‐S)(2‐) μ‐óxido‐bis(dioxidosulfato)(2‐) Bis(trioxidosulfato)(S‐S) μ‐óxido‐bis(trioxidosulfato)(2‐) O3SOOSO32‐ Triazufre Tetraazufre Bis[(trioxidosulfato)sulfato)](S‐S)(2‐) Pentaazufre Pentasulfuro(2‐) Octaazufre Estibanotriuro 71 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR SbH2‐ Estibanuro Dihidruroantimonato(1‐) SbH2+ Trihidruro de antimonio SbH3 [SbH3] Dihidruroantimonio(1+) Estibano (n.h.p) Trihdruroantimonio SbH4+ Estibanio Tetrahidruroantimonio(1+) Pentahidruro de antimonio SbH5 λ5‐Estibano (n.h.p) Pentahidruroantimonio Se Monoselenio Se2‐ Selanodiuro Selenuro(2‐) Selenuro Mon(o)óxido de selenio SeO SeO2‐ Trióxido de selenio SeO3 Selenito SeO32‐ [Seo] Dioxidoselenio Dioxidoselenato(2‐) Trioxidoselenato(2‐) 72 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Selenato SeO42‐ Si4+ Silicio(4+) Siliciuro Si4‐ Siliciurio(4‐) Carburo de silicio SiC SiC+ Carburosilicio(1+) SiH+ Hidrurosilicio(1+) SiH‐ Hidrurosilicato(1‐) SiH22. Dihidrurosilicio(2.) SiH3+ Hidrurosilicio(1+) SiH3‐ Silanuro Tetraoxidoselenato(2‐) [SiC] Carburosilicio Trihiodrurosilicato(1‐) Tetrahidruro de silicio SiH4 [SiH4] Silano (nhp) Tetrahidruroosilicio SiO Oxidosilicio Monoxidosilicio SiO+ Dióxido de silicio SiO2 Metasilicato ‐(SiO3)n‐ Oxidosilicio(1+) 73 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Silicato SiO42‐ Si2 Disilicio Si2+ Disilicio(1+) Si2‐ Disiliciuro(1‐) Si2H6 Disilano (nhp) Disilicato Si2O72‐ Si44‐ SnCl3‐ Tricloruroestannato(1‐) Tetrahidruro de estaño SnH4 Tetrahidruroestaño Sn52‐ Pentaestannuro(2‐) TcO4‐ Tetraóxidotecnecato(1‐) Telururo Te2‐ Tetraoxidosilicato(4‐) μ‐óxido‐bis(trioxidosilicato)(2‐) Tetrasiliciuro(4‐) [SnH4] Estannato (nhp) Telanodiuro Telururo(2‐) Te032‐ Trioxidotelurato(2‐) TeO42‐ Tetraoxotelurato(2‐) Ortotelurato TeO66‐ Hexaoxidotelurato(6‐) Óxido de titanio(II) TiO TiO2+ Oxidotitanio(2+) 74 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Trihidruro de talio Talano (nhp) TlH3 Trihidrurotalio Dióxido de uranio UO2 UO2+ No es uranilo Dioxidouranio(1+) UO22+ No es uranilo Dioxidouranio(2+) Óxido de vanadio(II) Monóxido de vanadio VO VO2+ Óxido de vanadio(IV) VO2 Dióxido de vanadio VO2+ Dioxidovanadio(1+) Óxido de circonio(II) ZrO ZrO2+ No es vanadilo Oxidovanadio(2+) Oxidocirconio(2+) 75 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR (a) El prefijo orto no se ha usado coherentemente en el pasado. Para los ácidos bórico, silícico y fosfórico se ha eliminado porque no hay ambigüedad en el nombre sin orto. (d) los nombres de los ácidos hidronados ácido nítrico, ácido sulfúrico… representan un híbrido de varias nomenclaturas. No se recomienda su uso en lo sucesivo (f) Estos son nombres sistemáticos de sustitución. Los nombres tradicionelaes ácido hiponitroso, e hiponitrito no están aceptados; en cualquier caso la sistemática a la que habría que adherirse para usar el prefijo hipo daría los nombres ácido hipodinitroso e hipodinitrito (g) El nombre ácido fosforoso se ha utilizado en la bibliografía para [P(OH)3] y [PHO(OH)2] (h) Éstos son nombres de sustitución. No se usan habitualmente nombres ácidos para los dos isómeros de HPO2 (i) Los nombres arsórico, arsoroso, estibónico y estiboroso se usan como progenitores (l) El uso sistemático del prefijo hipo generaría los nombres ácido hipodisulfúrico para el ácido ditiónico y ácido hipodisulfuroso para el ácido ditiónico (n) Este nombre vulgar crea un problema por su estructura no siméetrica (o) La fórmula H2SO3 se ha usado hasta ahora para los ácidos selenoso y selenónico 76 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Nombre sistemático n.alternativo aceptado por la IUPAC O2- Óxido(2-) Óxido O22- Dióxido(2-) Peróxido 1- O2 ; Dióxido(1-) o dióxido(.1-) O2 O3O Superóxido .- .- Trióxido(1-) . Óxido( 1-) Ozónido N3- Nitruro(3-) I3 - Triyoduro(1-) Cl2.- Dicloruro(.1-) C2- Dicarburo(2-) Acetiluro N3- Trinitruro(1-) Azida S2 2- Nitruro Disulfuro(2-) Sn52- Pentaestannuro(2-) Pb94- Nonaplumburo(4-) Cloruro de hidrógeno HCl Monóxido de nitrógeno NO Dióxido de nitrógeno NO2 Tetraóxido de dinitrógeno N 2O4 Dicloruro de oxígeno OCl2 Cloruro de dioxígeno Cl2O Tetraóxido de trihierro Fe3O4 Carburo de silicio SiC Tetracloruro de silicio SiCl4 Difosfuro de tricalcio Fosfuro de calcio Ca3P2 Estannuro de níquel NiSn 77 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Octacincuro de pentacobre Cu5Zn8 Hexacarburo de tricosacromo Cr23C6 Sodio(1+) Na+ Cr3+ Cobre(1+) Cobre(2+) Cu+ Cu2+ I+ Yodo(1+) . .+ Oxígeno( 1+) O Helio(.+) .+ He Hidrógeno(1+), Protio (1+), Deuterio(1+), Tritio(1+), Dioxígeno(1+) H+ (mezcla de los tres isótopos) H+ 2 + H 3 + H hidrón protón deuterón tritón 1 O2+ . .+ Dioxígeno( 1+) O2 Tetraazufufre(2+) S42+ Dimercurio(2+) Hg22+ Pentabismuto(4+) Bi54+ Trihidrógeno(1+) H3+ . Dinitrógeno (2 2+) N (2.)2+ Amonio, no sistemático, aceptado por la IUPAC NH4+ Fosfanio (de sustitución) PH4+ Tetrafluoroestibanio (de sustitución) Tetrafluoroantimonio(1+) (de adición) Tetrafluoroantimonio(V) (de adición) SbF4+ Azanio (de sustitución) 78 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR . Boranioilo (de sustitución) BH3 + Oxidanodiio (de sustitución) H4O2+ Oxonio, no sistemático, aceptado por la IUPAC, Cloruro(1-) Cl- Disulfuro(2-) S22- Fosfanuro PH2- H3O + . Trihidruroboro( 1+) (de adición) Oxidanio (de sustitución) no es hidronio Cloruro (no presenta ambigüedad) Basado en hidruro progenitor, no necesita explictar la carga PH2- Fosfanodiuro Basado en hidruro progenitor, no necesita explictar la carga Tetraclorurocobalto(2-) o [CoCl4]2- De adición Tetraclorurocobalto(II) Dioxonitrato(1-) o nitrito NO2- Silanuro SiH3- Germanuro GeH3- Sulfanuro SH- Diazano-1,2-diuro - Tricloruroestannuro SnCl3- Boranuuro BH4- HNNHLa adición de un hidruro H- a un hidruro progenitor se indica con la terminación -uuro Dióxido(1-) . o O2- Superóxido .- Nombre alternativo aceptado por la IUPAC Dióxido( 1-) O2 Dióxido(2-) O22- Peróxido 79 FORMULACIÓN QUÍMICA INORGÁNICA IES SIERRA SUR FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 Nombre alternativo aceptado por la IUPAC Trióxido(1-) O3 - Ozónido Nombre alternativo aceptado por la IUPAC Triyoduro(1-) . I 3.- Dicloruro( 1-) Cl2 Dicarburo(2-) C22- Acetiluro Nombre alternativo aceptado por la IUPAC Trinitruro(1-) N3- Azida Nombre alternativo aceptado por la IUPAC Disulfuro(2-) S22- Pentaestannuro(2-) Sn52- Nonaplumburo(4-) Pb94- Dioxidanodiuro O22- Disulfanodiuro S22- Azanuro (de sustitución) NH2- Dihidruronitrato(1-) (de adición) Amida (no sistemático aceptado) - Germanuro(de sustitución) GeH3 Sulfanuro (de sustitución) HS- Hidruosulfato(1-) (de adición) Sulfanuuro (de sustitución) H3S- Trihidrurosulfato(1-) (de adición) Sulfito(aceptado no sistemático) SO32- Troxidosulfato(2-) (de adición) Hipoclorito (aceptado no sistemático) OCl- Clorurooxigenato(1-) (de adición) Clorato (aceptado no sistemático) ClO3 - Trihidrurogermnato(1-) (de adición) Trioxidoclorato(1-) (de adición) [PF6]- Hexafluorurofosfato(1-) (de adición) [CuCl4]2- Tetraclorurocuprato(2-) (de adición) [Fe(CO)4]2- Tetracarbonilferrato(-II) (de adición) .- H2S . Dihidrurosulfato( 1-) (de adición) O2Cl2+ (dicloruro de dioxígeno)(1+) 80 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR IBr Bromuro de yodo ArHF Fluoruro de argón e hidrógeno ArFH Fluoruro hidruro de argón ClOF Fluoruro de cloro y oxígeno ClFO Cloruro fluoruro de oxígeno PBrClI Bromuro cloruro yoduro de fósforo ClFO],fluorurooxidocloro, FArH, , [ArFH]; fluorurohidruroargón NaNH4[HPO4] : Hdrogenofosfato de amonio y sodio; Na2CO3 Trioxidocarbonato de disodio o carbonato de sodio K4[Fe(CN)6] Hexacianuroferrato de tetrapotasio PCl3O Tricloruro óxido de fósforo KMgCl3 Tricloruro de magnesio y potasio FeSO4 Sulfato de hierro(2+) Fe2(SO4)3 Sulfato de hierro(3+) (UO2)2SO4 Sulfato de dioxidouranio(2+) K4[Fe(CN)6] Hexacianuroferrato(4-) de potasio [Co(NH3)6]Cl(SO4) Cloruro sulfato de haxaamminocobalto(3+) UO2SO4 Sulfato de dioxidouranio(2+) Ca(NO3)2 Bis(trioxidonitrato) de calcio o nitrato de calcio (UO2)2SO4 Tetraoxidosulfato de bis(dioxidouranio) 81 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Ba(BrF4)2 Bis(tetrafluorurobromato) de bario U(S2O7)2 Bis(disulfato) de uranio Ca3(PO4)2 Bis(fosfato) de tricalcio Ca2P2O7 Difosfato de calcio N2O Óxido de nitrógeno(I) NO2 Óxido de nitrógeno(IV) Fe3O4 Óxido de hierro(II) y dihierro(III) MnO2 Óxido de manganeso(IV) CO Óxido de carbono FeSO4 Sulfato de hierro(II) Fe(SO4)3 Sulfato de hierro(III) SF6 Fluoruro de azufre(VI) (UO2)2SO4 Sulfato de dioxidouranio(V) UO2SO4 Sulfato de dioxidouranio(VI) K4[Fe(CN)6] Hexacianuroferrato(II) de potasio Hexacianuroferrato(4-) de potasio K4[Ni(CN)4] Tetracianuroniquelato(0) de potasio Tetracianuroniquelato(4-) de potasio Na2[Fe(CO)4] Tetracarbonilferrato(-II) de sodio Tetracarbonilferrato(2-) de sodio [Co(NH3)6]Cl(SO4)Cloruro sulfato de hexamminocobalto(III) 82 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Cloruro sulfato de hexaamminocobalto(3+) Fe4[Fe(CN)6]3 Hexacianuroferrato(II) de hierro(III) Hexacianuroferrato(4-) de hierro(3+) TlI3 Tris(yoduro) de talio o yoduro de talio (III) o yoduro de talio(3+) Tl(I3) Triyoduro(1-) de talio, o (triyoduro) de talio(I) o triyoduro de talio(1+) HgCl2 Dicloruro de mercurio, Cloruro de mercurio(II), Cloruro de mercurio(2+) Hg2Cl2 Dicloruro de dimercurio, (nombre puramente estequiométrico); Dicloruro de (dimercurio), (indica que contiene un ion homodiatómico); Cloruro de dimercurio(2+), (aquí se especifica la carga del dicatión por lo que no es necesario el prefijo di para el cloruro Na2S3 (trisulfuro) de disodio, indica la presencia del anión poliatómico Trisulfuro(2-) de sodio, no es necesario el prefijo multiplicador del nombre del catión por estar indicada la carga del anión Fe2S3 tris(sulfuro) de dihierro, sulfuro de hierro(III) Óxido de dipotasio K 2O Dióxido(2-) de dipotasio (Dióxido) de dipotasio K2O2 Dióxido(2-) de potasio (Dióxido) de KO2 Dióxido(1-) de potasio monopotasio (Trióxido) de potasio KO3 Trióxido(1-) de potasio 83 FORMULACIÓN QUÍMICA INORGÁNICA IES SIERRA SUR FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 Dióxido de bario; BaO2 Dióxido(2-) de bario, (especifica el anión diatómico) nombre estequiométrico Peróxido de bario (nombre alternativo del anión sencillo, aceptado por la IUPAC; (dióxido) de bario Bis(óxido) de manganeso MnO2 Dióxido de manganeso (especifica que hay dos sencillo) iones óxido y no un anión Óxido de manganeso(IV) (nombre estequiométrico diatómico) Trifluoruro de boro—agua(1/2) BF3.2H2O Kripton—agua(8/46) 8Kr.46H2O Kripton—(3H2)agua(8/46) 8Kr.463H2O Cloruro de calcio--amoniaco(1/8) CaCl2.8NH3 Cloruro de aluminio—etanol(1/4) AlCl3.4EtOH Cloruro de bismuto(III)—cloruro de BiCl3.3PCl5 fósforo(V) (1/3) Carbonato de sodio—peróxido de 2Na2CO3.3H2O2 hidrógeno(2/3) Óxido de cobalto(III)—agua(1/n) Co2O3.nH2O Sulfato de sodio—agua(1/10) Na2SO4.10H2O Sulfato de aluminio—sulfato Sulfato de sodio decahid de Al2(SO4)3.K2SO4.24H2O potasio—agua(1/1/24) Bis(sulfato) de aluminio y potasio— AlK(SO4)2.12H2O Bis(sulfato) de aluminio agua(1/12) potasio dodecahidrato Sulfato de cadmio-agua(3/8) 3CdSO4.8H2O Ejemplos 84 FORMULACIÓN QUÍMICA INORGÁNICA IES SIERRA SUR FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 Bromuro de yodo IBr Bromuro cloruro yoduro de fósforo PBrClI Fluoruro de argón e hidrógeno ArHF Fluoruro hidruro de argón ArFH Fluoruro de cloro y oxígeno ClOF Cloruro fluoruro de oxígeno OClF Diantimoniuro de cobre y CuK5Sb2 pentapotasio (Dicloruro de dioxígeno)(1+) O2Cl2+ Hidrogenofosfato de amonio y sodio NaNH4[HPO4] Trioxido carbonato de disodio Na2CO3 (carbonato de sodio, sistemático aceptado) Hexacianuroferrato de tetrapotasio K4[(FeCN)6] Tricloruro óxido de fósforo PCl3O Tricloruro de magnesio y potasio KMgCl3 Bis(trioxidonitrato) de calcio o Ca(NO3)2 (nitrato de calcio, no sistemático aceptado) Tetraoxidosulfato de (UO2)2SO4 bis(dioxidouranio) Bis(tetrafluorurobromato) de bario Ba(BrF4)2 Bis(sulfato) de uranio U(SO4)2 Bis(fosfato) de tricalcio Ca3(PO4)2 Difosfato de calcio CaP2O7 Bis(hidrogenocarbonato) de calcio Ca(HCO3)2 Cloruro de fósforo(V) PCl5 Óxido de nitrógeno(I) N2O Óxido de nitrógeno(IV) NO2 Dióxido de nitrógeno Tetraóxido de dinitrógeno N2O4 Óxido de hierro(II) y de dihierro(III) Fe3O4 85 no FORMULACIÓN QUÍMICA INORGÁNICA IES SIERRA SUR FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 Óxido de manganeso(IV) MnO2 Óxido de carbono(II) CO Sulfato de hierro(II) FeSO4 Sulfato de hierro(III) Fe2(SO4)3 Fluoruro de azufre(VI) SF6 Sulfato de dioxidouranio(V) (UO2)2(SO4) Sulfato de dioxidouranio(VI) UO2SO4 Cloruro sulfato de Co(NH3)6Cl(SO4) hexaamminocobalto(III) Hexacianuroferrato(4-) de potasio K[Fe(CN)6] Hexacianuroferrato(4-) de hierro(3+) Fe4[Fe(CN)6]3 Tris(yoduro) de talio Tl(I3) Yoduro de talio(III) Yoduro de talio(3+) Triyoduro(1-) de talio TlI3 (Triyoduro) de talio(I) Triyoduro de talio(1+) Dicloruro de mercurio HgCl2 Cloruro de mercurio(II) Cloruro de mercurio(2+) Dicloruro de dimercurio Hg2Cl2 Dicloruro de (dimercurio) Cloruro de dimercurio(2+) (al especificar la carga del dicatión no es necesario anteponer di- a cloruro) (trisulfuro) de disodio (indica la presencia de un Na2S3 aníon Trisulfuro(2-) de sodio (no es necesario el prefijo multiplicador del nombre del homopoliatómico) catión por indicarse la carga del anión) Tris(sulfuro) de dihierro Fe2S3 Sulfuro de hierro(III) Óxido de dipotasio K2O Dióxido(2-) de dipotasio 86 FORMULACIÓN QUÍMICA INORGÁNICA IES SIERRA SUR FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 (Dióxido) de dipotasio K2O2 Dióxido(2-) de potasio (Dióxido) de monopotasio KO2 Dióxido(1-) de potasio (Trióxido) de potasio KO3 Trióxido(1-) de potasio (Dióxido) de bario BaO2 Dióxido(2-) de bario (especifica el nombre del anión) Dióxido de bario (nombre estequiométrico sencillo) Peróxido de bario 8nombre alternativo aceptado por la IUPAC Bis(óxido) de manganeso (especifica MnO2 Dióxido que hay dos iones óxido y no un anión (nombre diatómico) sencillo) de manganeso estequiométrico Óxido de manganeso(IV) Trifluoruro de boro—agua(1/2) BF3.2H2O Kripton—agua(8/46) 8Kr.46H2O Kripton—(3H2)agua(8/46) 8Kr.463H2O Cloruro de calcio--amoniaco(1/8) CaCl2.8NH3 Cloruro de aluminio—etanol(1/4) AlCl3.4EtOH Cloruro de bismuto(III)—cloruro de BiCl3.3PCl5 fósforo(V) (1/3) Carbonato de sodio—peróxido de 2Na2CO3.3H2O2 hidrógeno(2/3) Óxido de cobalto(III)—agua(1/n) Co2O3.nH2O Sulfato de sodio—agua(1/10) Na2SO4.10H2O Sulfato de aluminio—sulfato de Al2(SO4)3.K2SO4.24H2O Sulfato de sodio decahidrato potasio—agua(1/1/24) Bis(sulfato) de aluminio y potasio— AlK(SO4)2.12H2O Bis(sulfato) de aluminio y 87 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR agua(1/12) potasio dodecahidrato Sulfato de cadmio-agua(3/8) 3CdSO4.8H2O Cloruro de hidrógeno HCl Compuesto binario Monóxido de nitrógeno Dicloruro de oxígeno Cloruro de dioxígeno NO OCl2 Cl2O Compuesto binario Compuesto binario Compuesto binario Tetraóxido de trihierro Carburo de silicio Tetracloruro de silicio Difosfuro de tricalcio Fosfuro de calcio Estannuro de níquel Octacincuro de pentacobre Hexacarburo de tricosacromo Sodio(1+) Cromo(3+) Cobre(1+) Cobre(2+) Yodo(1+) Hidrógeno(1+), hidrón Protio (1+), protón Deuterio(1+), deuterón Tritio(1+), tritón Dioxígeno(1+) Tetraazufufre(2+) Dimercurio(2+) Pentabismuto(4+) Trihidrógeno(1+) Amonio, no sistemático, aceptado por la IUPAC Fe3O4 SiC SiCl Ca3P2 Compuesto binario Compuesto binario Compuesto binario Compuesto binario NiSn Cu5Zn8 Cr23C6 Na+ Cr3+ Cu+ Cu2+ I+ H+ 1 + H 2 + H 3 + H O2+ S42+ Hg22+ Bi54+ H3+ NH4+ Compuesto binario Compuesto binario Compuesto binario Cationes monoatómicos Fosfanio (de sustitución) Tetrafluoroestibanio (de sustitución) PH4+ SbF4+ Tetrafluoroantimonio(1+) (de adición) Tetrafluoroantimonio(V) (de adición) Boranioilo (de sustitución) Oxidanodiio (de sustitución) . BH3 + Cationes homopoliatómicos Azanio (de sustitución) Cationes heteropoliatómicos Se nombran generalmente mediante las nomenclaturas de sustitución o de adición De sustitución . Trihidruroboro( 1+) (de adición) H4O2+ 88 FORMULACIÓN QUÍMICA INORGÁNICA FORMULACIÓN INORGÁNICA SEGÚN LAS REGLAS DE LA IUPAC 2005 IES SIERRA SUR Oxonio, no sistemático, aceptado por la IUPAC, no es hidronio Óxido(2-) u óxido Nitruro(3-) o nitruro Dióxido(1-) Dióxido(2-) Trióxido(1-) Triyoduro(1-) Dicarburo(2-) Trinitruro(1-) Disulfuro(2-) sulfito hipoclorito clorato hidrogenocarbonato dihidrogenofosfato H3O+ Oxidanio de sustitución O2N3O21O22O31I31C22N33S22SO32ClOClO3HCO3H2PO43- Aniones monoatomicos Aniones monoatomicos Aniones homopoliatómicos Aniones homopoliatómicos Aniones homopoliatómicos Aniones homopoliatómicos Aniones homopoliatómicos Aniones homopoliatómicos Aniones homopoliatómicos Aniones heteropoliatómicos Aniones heteropoliatómicos Aniones heteropoliatómicos Aniones heteropoliatómicos Aniones heteropoliatómicos 89