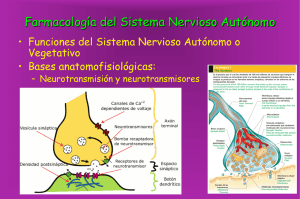
FARMACOLOGIA DEL SISTEMA NERVIOSO CENTRAL
Anuncio

Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar FARMACOLOGIA DEL SISTEMA NERVIOSO CENTRAL I. Introducción A continuación se citan los fármacos principales que se emplean en veterinaria para alterar la función del SNC. Al final, se incluyen tablas y apéndices sobre protocolos de anestesia en perros y combinaciones de anestésicos posibles. II. III. IV. V. VI. Anticonvulsionantes……………………………………………..1-7 Estimulantes del SNC……………………………………………..8 Tranquilizantes…………………………………………………8-16 Opiáceos (analgésicos)………………………………………...17-22 Anestesia a. Principios………………………………………………..23-27 b. Agentes inhalatorios………………………...……………..30 c. Anestésicos inyectables…………………………………….34 Apéndices 1-4. Tablas de dosificaciones en perros…………….38 Apéndice 5. Protocolo de anestesia larga en perros…………....41 Apéndice 6. Protocolos de anestesia corta en perros…………...42 Apendices 7. Otros protocolos de anestesia en perros…………43 Taller de farmacología tipo examen…………………….………47 Recordatorio de mecanismos en células excitables………….…51 Barrera hematoencefálica (BBB del inglés Blood-Brain-Barrier). Los fármacos deben penetrar la barrera para tener efecto en el SNC. Para poder entrar deben ser liposolubles, de pequeño tamaño, no ir unidos a proteínas plasmáticas, no estar ionizados al pH del liquido cerebroespinal. En estados de inflamación la permeabilidad siempre aumenta. En los neonatos aún no está del todo desarrollada la BBB y los fármacos penetran más fácilmente. II. Anticonvulsionates. 1. Barbitúricos a. Fenobarbital b. Pentobarbital c. Primidona 2. Fenitoína 3. Benzodiacepinas 4. Bromuro potásico A. Generalidades Es bien importante caracterizar el tipo de sintomatología nerviosa que presenta el animal para poder sospechar si se trata del cerebro lo que está afectado, que parte del mismo (p ej., nivel cerebelar, cortical), y también descartar distintas etiologías posibles: Convulsiones: las convulsiones se caracterizan por haber perdida de conciencia Tónico: tensión acompañada de movimientos involuntarios violentos tónico-clónicos, con contínua y rigidez. opistótonos, pedaleo en decúbito, masticatorios que suelen ir unidos a signos (la contracción es 1 “sostenida”) Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar Clónica: alternan la contracción y relajación en sucesión rápida (contracciones “repetidas”) autonómicos – salivación, vómitos, micción, diarrea, midriasis. Su origen radica en una sobreestimulación de alguna zona del cerebro donde se producen descargas neuronales excesivas. Si la temperatura rectal aumenta por encima de 41ºC, debe enfriarse al animal con agua fría. En la fase post-ictal se produce depresión por exhaustación. Las causas pueden ser numerosas. La denominación “epilepsia” se reserva para aquellas convulsiones en que no existe causa externa al cerebro, es decir que el problema radica en un mal funcionamiento de una zona del cerebro que se sobreestimula de vez en cuando. Las epilepsias no se curan (por lo general) y el tratamiento suele ser de por vida. Depresión/coma: existe un efecto narcótico directo sobre el SNC con pérdida de conciencia total o parcial. Temblores y tetanias: deben diferenciarse bien de las convulsiones para hacer un buen diagnóstico ya que pueden tener origen en el SNC, SNP o muscular. Normalmente los dueños de los animales las confunden con convulsiones. En las tetanias se producen contracciones sostenidas (tónicas) de los músculos. La mioclonias son contracciones rítmicas repetidas que afectan grupos concretos de músculos (incluso en el sueño) y no suelen ser de origen tóxico (en el perro hace pensar en moquillo o encefalitis). El animal está consciente en todo rato. Trastornos que afectan al sistema nervioso autónomo: Cuando falla el SNA, los síntomas que se presentan son principalmente por disfunción de los sistemas urinarios, digestivos y oculares (ver apuntes sobre la disautonomia). Paresias o parálisis (por daño a motoneuronas o axones largos). o Cuando se evalúe el grado de parálisis también se debe precisar en lo posible usando alguna escala: 0 – ausencia total de movimiento – “paraplejía” 1 – Incapacidad de levantarse y mantenerse - ataxia y paraparesis severa 2- Incapacidad de levantarse pero se sostiene – paraparesis moderada y ataxia 3- Se puede levantar pero cae fácilmente – ataxia y paraparesis leve 4 – Se levanta y anda incoordinado – ataxia y paraparesis mínima 5 – Coordinación y fuerza normales Ataxia (mala coordinación de los movimientos por perdida del control central (cerebral, cerebelar o vestibular). o Los signos de ataxia cerebelar son: torneo, nistagmo, cabeza ladeada e incoordinación, hipermetrías, perdida del equilibrio). Cambios de conducta (alteración de una fibra sensible, motora o cognitiva). Es difícil de estudiar y describir cambios del comportamiento. Términos generales que se usan son: letargo, apatía, ansiedad, desorientación, hiperactividad, histeria, agresión. Mecanismo de acción de los anticonvulsionantes: Por lo general actúan estabilizando las membranas bien: a) directamente sobre los canales iónicos voltaje-dependientes, b) indirectamente aumentando la concentración de neurotransmisores inhibidores (GABA y 2 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar glicina), o c) interfiriendo con la acción del neurotransmisor glutamato (excitatorio). En el siguiente esquema se muestra el receptor GABA sobre el que actúan los barbitúricos (pentobarbital) y las benzodiacepinas (diacepam). Aplicaciones terapéuticas: reducen la incidencia, severidad y duración de las convulsiones. Administración. El efecto va en función de las concentraciones plasmáticas; como por lo general tienen una T1/2 larga, se tardan varios días en alcanzarse las concentraciones estables en sangre (ver esquema dibujado para el fenobarbital). Lo bueno de tener una vida media muy larga es que solo hay que administrar la dosis una o dos veces al día y eso es una ventaja para el dueño. Cuando se calcula el intervalo y la dosis, las concentraciones pico no deben superar los niveles con efectos adversos (>45 µg/mL de fenobarbital hay ataxia y sedación) y las concentraciones mínimas deben estar dentro del rango terapéutico que prevenga las convulsiones. Efectos secundarios. Síntomas de rebote al retirar la medicación (convulsiones, epilepsias). Inducen las enzimas del sistema microsomal hepático, con lo que su eliminación se acelera con los días. El principal efecto secundario de muchos anticonvulsivos (excepto las sales de bromuro) en los perros es la hepatotoxicidad (6-15% perros tratados con primidona sola, o junto con la fenitoína). Es normal que las enzimas hepáticas aumenten (por inducción) pero ello no necesariamente indica que deba retirarse el tratamiento a menos que se presenten signos propios de insuficiencia hepática crónica (ascitis, vómitos, ictericia). Por lo general se aconseja que habría que disminuir o discontinuar el tratamiento si se produce: 1) elevación de la ALT o ALP (phosphatase alkaline) 4-5 veces por encima del rango superior, 2) hay elevación 3 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar postpandrial de los ácidos biliares y/o bilirrubina, 3) hipoalbuminemia. Con respecto a la elevación de la AST y GGT hay controversia. Posología en animales epilépticos. Se recomienda siempre empezar con un solo antiepiléptico. A los 15 días se aumenta la dosis en un 30% si ésta resulta insuficiente o se disminuye en un 30% si hay signos de sobredosis. Si esto no resuelve los problemas, entonces combinar fármacos. 1. Barbitúricos 1.1. Fenobarbital. Potente inductor de algunos citocromos P450 que hace que se aumente su metabolismo con el tiempo (1-2 semanas) y se requieran mayores dosis para mantener concentraciones terapeúticas de 15-45 g/ml. Éste es uno de los mecanismos por los que el organismo desarrolla tolerancia a fármacos. Tiene una vida media muy larga por lo que se necesitan varios días hasta alcanzar niveles estables en sangre (ver esquema siguiente). El principal efecto adverso a largo plazo es el desarrollo de problemas hepáticos, otros efectos a corto plazo que son corrientes que se produzcan incluyen sedación, ataxia, PU/PD y polifagia. Estos efectos a corto plazo se pueden controlar limitando la cantidad de comida. La sedación y ataxia se alcanzan cerca del rango máximo de la dosis terapéutica por lo que se puede disminuir la dosis y aún estar dentro del rango terapéutico. Aplicaciones terapéuticas: las dosis que se requieren para producir efecto antiepiléptico son mucho menores que las necesarias para causar sedación, por eso se emplea para tratar epilepsias. No obstante si el animal se encuentra en estado epiléptico y requiere un efecto inmediato, debería emplearse otro barbitúrico (p ej., pentobarbital), ya que su período de inducción es lento (pocos minutos hasta que se observa el efecto). Esto se debe a que el fenobarbital tarda más tiempo en entrar en el SNC que los otros barbitúricos. La dosis para epilepsia en perros y gatos de mantenimiento es de 2-4 mg/kg bid PO y como tiene una T1/2 muy larga se recomienda esperar al menos 2 semanas para medir concentraciones plasmáticas estables. Las dosis de choque (iniciales) recomendadas son de 20 mg/kg IV. 4 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar 1.2. Pentobarbital. Actúa mucho más rápido que el fenobarbital pero su efecto perdura por menos tiempo por lo que no sirve para tratamientos crónicos. Termina convulsiones a dosis que inducen anestesia y que producen gran depresión cardiorrespiratoria. No obstante si el animal se encuentra en estado epiléptico su acción es inmediata por vía IV y el efecto perdura por 45-90 minutos (con fenobarbital la duración es de 8-12 horas). Es quizás el agente de eutanasia más empleado, y la “forma más humana de sacrificar un animal” ya que el animal queda inconsciente inmediatamente y antes de pararse la respiración y el corazón, con lo que no sufre. 5 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar Por vía oral la LD50 es algo mayor que por vía IV (si un carnívoro se come un hígado de un herbívoro sacrificado con pentobarbital la dosis que ingiere oralmente es fácil que llegue a superar la LD50 oral, lo que mataría el animal). 1.3. Primidona. Es un análogo estructural del fenobarbital pero con una T1/2 mucho más corta. Al biotransformarse se convierte en fenobarbital y feniletilmalonamida (PEMA). Es una alternativa al fenobarbital para tratar epilepsias. 2. Fenitoína. Se une a los canales de Na+ voltaje-dependiente en su estado inactivo impidiendo su recuperación. Aquellas neuronas que están constantemente disparándose son las más sensibles al bloqueo. Reduce la propagación de impulsos anómalos en el cerebro, sin tener una acción depresora general como los barbitúricos. Además tiene un efecto anti-arrítmico similar al de la lidocaína. A concentraciones mayores también bloquea los canales de Ca+ y la liberación de catecolaminas. Aplicaciones terapeuticas: o Se usa como antiarrítmico para tratar arritmias inducidas por digitálicos o Terapia alternativa para epilepsias (si la primidona/fenobarbital no funcionan) aunque a diferencia de humanos en los perros tiene una corta vida media por lo que habría que darlo muy repetido y no resulta práctico. 3. Benzodiacepinas: diacepam, midazolam, clonacepam, lorazepam. 3.1.Diacepam. Potencia el efecto inhibitorio del GABA. Por ser poco soluble en agua se disuelve con propileneglicol (40%), benzoato sodico (5%), y etanol (10%) para administrarse parenteralmente. Al ser muy liposoluble penetra bien la barrera hematoencefálica. Aplicaciones terapéuticas: o Anticonvulsionante (perros desarrollan tolerancia rápido y por eso no sirve para prevenir epilepsias, en gatos sí es la 2nda opción para prevenir epilepsias). o relajante muscular o tranquilizante/ansiolítico o estimulador del apetito en gatos Precauciones: por lo general no se recomienda mezclar con otros fármacos (p ej., barbitúricos) ni con los fluidos IV, ya que precipitaría. No obstante si se puede mezclar con la ketamina en la misma jeringa. Debe darse lentamente porque puede causar tromboflebitis y cardiotoxicidad por el propileneglicol. Como anticonvulsionante puede administrarse en casa por el dueño por vía rectal (2 mg/kg). 3.2. Midazolam. A diferencia del diacepam si es soluble en agua a un pH<4. Al pH de la sangre es liposoluble y penetra bien la barrera hematoencefálica. Tiene un efecto inmediato al darse por vía IV o IM por penetrar rápidamente en el SNC. A diferencia del diacepam si se puede mezclar con otros fármacos y con soluciones salinas. 3.3. Clonacepam. Se emplea combinado con el fenobarbital para tratar anxiedad y fobia. 4. Bromuro potásico (BrK). El bromo hiperpolariza la membrana con lo que se previenen descargas epilépticas, penetra por los canales de cloro pero después no puede salir tan fácilmente. Se absorbe rápidamente por el tracto GI. No se metaboliza ni une a proteínas. En el perro tiene una T1/2 muy larga (=25 días) por lo que requiere de hasta 4 meses para alcanzar concentraciones estables en plasma. Se elimina solo por los riñones y compite en los túbulos 6 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar renales con el Cl- por “reabsorberse”. Por esta razón una dieta alta en sal (ClNa) u otra sal que lleve cloro (p.ej., cloruro amónico), aumentaría la excreción del Br- por el riñón y haría descender las concentraciones terapéuticas. La dosis recomendada es de 20-40 mg/kg PO sid, y las concentraciones terapéuticas en suero son de 0.5-1.6 g/ml. Dicha dosis se puede combinar con el fenobarbital, es decir se añade el BrK a la terapia con fenobarbital. Como se necesitarían meses para alcanzar concentraciones terapéuticas estables, se puede administrar una dosis de carga de hasta 400-600 mg/kg PO dividida 5 veces en 24-48 horas. Signos de sobredosificación (toxicidad) por BrK incluyen trastornos del SNC (hiporeflexia, debilidad muscular generalizada con incapacidad de andar, temblores musculares, desorientación, vómitos, anorexia y constipación). Aplicaciones terapéuticas: o Epilepsias refractarias al fenobarbital. Tratamiento de las epilepsias y crisis convulsivas: Objetivo disminuir ataques a uno solo ó ninguno cada 6-8 semanas. Si el animal está recibiendo terapia y no ha tenido ninguna convulsión por 6-12 meses se puede retirar lentamente (meses) el tratamiento. Si recurriesen entonces habría que resumir la terapia, probablemente de por vida. Se recomienda comenzar con un solo fármaco y reevaluar a las dos semanas en que se puede aumentar o disminuir la dosis en un 30% dependiendo de que resulte insuficiente o los efectos secundarios sean excesivos. Si esto fallase, entonces se considera adicionar un segundo fármaco. El fármaco de primera elección es el fenobarbital a la dosis de 2-4 mg/kg bid. El segundo fármaco de elección es el KBr (20-40 mg/kg sid) para perros y el diacepam (0.5-1.0 mg/kg q 12 h) para gatos. En caso de crisis epilépticas y convulsiones (independientemente de la causa), el tratamiento de emergencia en la clínica consistiría en dar rápidamente diacepam 1.0-2 mg/kg IV que se puede repetir a los 4-5 minutos si la actividad motora no cesa. Si los signos no desaparecen se adiciona primero fenobarbital (6 mg/kg IV) que se puede repetir a los 20 minutos y si esto no es suficiente se procede con el pentobarbital (barbitúrico mucho más potente que produce anestesia). Para perros intoxicaciones con fluoroacetato sodico, directamente se emplea el pentobarbital ya que ni el diacepam ni el fenobarbital son capaces de cesar las convulsiones. No obstante, cuando el animal llega intoxicado con dicho matarratas el pronóstico es muy grave. Se les puede mantener vivos varios días con pentobarbital pero en cuanto cesa el efecto del pentobarbital (30-90 minutos) comienzan a convulsionar de nuevo. A continuación se muestra un Tabla con el tratamiento para el Guayaquil (etanol se desaconseja). Table 2. Treatment protocol for 1080 toxicosis suggested by Australian and North American toxicologists*. ● Decontaminate if early in the syndrome ● Control of seizures with pentobarbital or gas anesthesia (to effect) and muscle relaxants such as methocarbamol or glycerol-guaiacolate (to effect). Fenobarbital (40-50 mg/kg SC) will prolong the effect of pentobarbital. Oxygen should always be available. ● Control body temperature ● Intravenous fluid therapy (ie., lactated Ringer´s solution) ● Infuse sodium bicarbonate (3.6 mEq/Kg) over 15-30 min (monitor and supplement as required) ● Administer calcium gluconate (10%) at 0.1-0.2 mL/kg/h (monitor and supplement as required) ●If available: acetamide (15 g in 1 L 5% dextrose) at 10 mL/kg over 15 min and then reduce to 8 mL/kg/h until finished. ● Ethanol is not recommended. 7 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar *References: Goh et al., (2005), Parton KH (2004), and Beasley (1999). III. Estimulantes del SNC (analépticos) Doxapram (ver prospecto adjunto del Viviram-v®). Estimula el centro de la respiración y vasomotor en la medula oblongada. Se emplea para revertir sobredosis de anestésicos (mecanismo no selectivo) y para estimular la respiración en los recién nacidos con partos asistidos, laboriosos ó por cesáreas. En neonatos se emplea tópicamente en la mucosa oral o por vía intramuscular. No es un sustituto para la ventilación asistida en las anestesias. Dosis altas pueden inducir convulsiones. IV. Tranquilizantes, sedativos, neurolépticos, atarácticos. Todos estos son términos usados para indicar fármacos que calman al animal y favorecen el sueño. Los animales tranquilizados están más calmados y facilitan su manejo, pero pueden ser excitados y responder a estímulos de manera normal (mordiendo, arañando, pataleando). Cuando se emplean como pre-anestésicos, normalmente se requiere menos dosis del anestésico general. 1. Fenotiacinicos 2. Butirofenonas 3. Benzodiacepinas 4. Agonistas α2-adrenérgicos 8 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar Efectos producidos según el receptor bloqueado: Dopaminergicos antipsicotico (conducta). Serotonina anxiolitico, antidepresor, antiagresión, sedación, hipotension Histamina sedación, antiemesis, hipotensión Adrenérgicos alfa hipotensión, taquicardia refleja, sedación, hipersalivación, incontinencia, disfunción sexual Colinergicos muscarinicos sequedad mucosas, visión borrosa, constipación, dificultad en la micción, taquicardia sinusal, 1. Fenotiacínicos (acepromacina, promacina, prometazina, clorpromacina). Según el tipo de fenotiacinico actúan bloqueando en mayor o menor medida los receptores dopaminérgicos, colinergicos, histaminicos, adrenérgicos y también la acción de la serotonina (5hidroxitriptamina, 5-HT). Por lo general su efecto perdura por 3-6 horas, se biotransforman en el hígado y excretan como metabolitos por la orina. Efectos farmacológicos: o No tienen efecto analgésico o Cardiovasculares hipotensión (por bloqueo de receptores α1). Si el animal tiene hipovolemia o está en estado de shock, están contraindicados porque podrían agravar el estado hipotensor. Puede producirse una taquicardia sinusal refleja, aunque el efecto directo de los fenotiacinicos sobre el corazón es de producir bradicardia sinusal. En caballos con dolor cólico no está recomendado ya que suelen presentar deshidrataciones graves, y al crear hipotensión empeoramos aún más la perfusión sanguínea. 9 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar Cuando hay una hipovolemia o caída de la presión sanguínea se activa mucho el SNsimpático (situación de stress sistémica) con lo que se libera epinefrina de la médula adrenal y estimulan los receptores 2 de la circulación sistémica. Como las fenotiacinas tienen bloqueados los 1 que producen vasoconstricción, va a predominar el efecto vasodilatatorio con lo que se agravaría una hipotensión y estado de shock (NO USAR en ANIMALES con SHOCK o cirujías en que no se van a emplear liquidos intravenosos). o Respiratorios dosis altas deprimen la respiración. Cuando se combinan con opiáceos para producir neuroleptoanalgesia este efecto se potencia. El organismo no responde a un aumento de la PCO2. o Digestivos deprimen la motilidad y el reflejo del vómito a nivel central (zona quimioreceptora de la medula). Se emplean para prevenir mareos durante el transporte. o Sangre descenso del hematocrito por secuestro esplénico o Metabólicos Descenso de la temperatura corporal por vasodilatación periférica, menor producción de calor y depresión del centro termorregulador en el hipotalamo. o Reproductores → contraindicado en caballos y toros enteros porque produce protusión de pene por paralizar los músculos retractores del mismo, el pene se llena de sangre y si la sangre no circula por protusión permanente se puede llegar a necrosar todo el órgano. Aplicaciones terapéuticas: o Tranquilización (NO hay analgesia ni tampoco anestesia) (SC perros),(IM equinos) o Antieméticos o Reducción de arritmias antes del uso de anestésicos inhalatorios (estos últimos sensibilizan al miocardio a la acción de las catecolaminas). Efectos adversos: no deben administrarse a animales con historia de epilepsia, porque pueden precipitar una crisis convulsiva. En los caballos si se administran accidentalmente en la carotída se producen convulsiones inmediatas y la muerte del animal. En algunos gatos se produce excitación (rigidez, temblores, intranquilidad) que es el efecto opuesto del deseado. Inhiben en cierta medida la AChE con lo que no deben emplearse en intoxicaciones por insecticidas OPs/carbamatos. 10 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar 2. Butirofenonas (droperidol, azaperona, haloperidol). Actúan bloqueando los receptores dopaminérgicos y los α1 periféricos. A diferencia de los fenotiacinicos no deprimen la respiración, pero también bajan a la presión arterial. Aplicaciones terapéuticas: la azaperona se emplea bastante en cerdos para: o Tratar la agresividad en cerdos (cuando se introducen en un grupo por primera vez). o Como agente pre-anestésico o Prevención de hipertermia malignas (“síndrome de stress porcino”) sobre todo si se anestesian con halotano. o Se combinan con el fentanilo para producir neuroleptoanalgesia (Innovar-vet). 11 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar 3. Benzodiacepinas (diacepam, midazolam, lorazepam). El mecanismo de acción básico consiste en que facilita la acción del GABA sobre su receptor. Tienen sinergismo con los barbitúricos que también actúan sobre el receptor GABA. Los efectos farmacológicos sobre corazón, respiración y musculoesquelético son mínimos. El principal efecto adverso es que producen excitación en algunos animales en vez de tranquilización (en caballos y gatos puede producir ataxia, debilidad y fasciculaciones musculares). Los efectos de las benzodiacepinas se pueden revertir dando flumezanil (antagonista competitivo del receptor GABA). El diacepam no es soluble en agua y el propilenglicol (vehiculo excipiente) irrita por vias IM y SC (dar vía IV preferiblemente), el midazolam si es soluble en agua (IM y SC). Aplicaciones terapéuticas: o Se emplean con anestésicos para favorecer la relajación muscular y reducir la dosis del anestésico general. o Benzodiacepinas + opiáceos = neuroleptoanalgesia o Benzodiacepinas + barbitúricos o ketamina = anestesia general. o El diacepam se usa como anticonvulsionante PO o IV. o El zolacepam se usa exclusivamente con tiletamina para anestesia en perros/gatos. 12 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar 4.-Agonistas α2 adrenérgicos (xilacina, detomidina, medetomidina, dexmetomidina) Xilacina (nombres comerciales: Rompun, Anased) Medetomidina (Domitor) Actúan estimulando los receptores α2-adrenérgicos centrales y situados a nivel pre- o postsinápticos. Los presinápticos inhiben la liberación de NE al estimularse (efecto de retroalimentación negativa) por lo que descienden el tono simpático. Los post-sinápticos 2 se encuentran periféricamente en los vasos sanguíneos y tienen un efecto similar a los 1. Efectos farmacológicos: o Cardiovasculares simples dosis sedantes de xilacina produce una bradicardia del 50%, por eso la xilacina hace una combinación ideal con la ketamina que produce taquicardia y así sus efectos se compensan. Cuando se administra xilacina IV se produce una vasoconstricción periférica inicialmente y aumento de la presión sanguínea (por acción sobre los α2-postsinápticos que tienen un efecto similar a los 1), sin embargo la PA vuelve a la normalidad (o desciende) en 30 segundos por el descenso de actividad simpática (efecto de los α2 presinápticos centrales). No obstante, debido a que se produce una taquicardia y aumento de presión sanguínea inicial, se aconseja no administrar “conjuntamente” con atropina en la premedicación. Tanto la atropina como la xilacina producen parálisis intestinal y las arritmias sinusales post-operatorias son corrientes. En las 13 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar vacas solo cuando la bradicardia descienda 25 latidos/minuto sí estaría indicado revertirla con atropina ó glicopirrolato. o SNC efecto sedante y analgésico (cerebro) + analgesia y relajación muscular (espina dorsal). Potencian el efecto de los opiáceos, barbitúricos y anestésicos inhalatorios. Descenso del tono simpático. Efecto hipnótico (actúa sobre el núcleo coeruleo). o Digestivo en gatos produce el vómito (principal emético en gatos). A continuación se produce un descenso de la motilidad intestinal que en rumiantes produce salivación excesiva (al bloquearse la actividad deglutiva), y atonia ruminal. Si se produjese un íleo post-operativo, puede revertirse por acción de un antagonista α2 como la yohimbina. En vacuno es bastante corriente que el animal muestra heces fluidas 24 horas después de la administración. o Urinario y reproductivo Aumento de la diuresis y prolapso de pene. Aplicaciones terapéuticas: o Por sus efectos se catalogarían dentro de los sedantes y relajantes musculares. o Analgesia. Producen buena analgesia visceral. Además producen cierta relajación muscular y efecto tranquilizador. No obstante para procedimientos muy dolorosos se debe combinar con otros analgésicos. o Agente preanestésico – buena sedación o Analgesia epidural – para cirugías con el animal (vaca, caballo, cerdo en pie) en que solo se precisa de analgesia regional. Existe una gran variabilidad en las dosis necesarias para cada especie. Los efectos adversos pueden revertirse usando un antagonista α2 como la yohimbina o el atipamezole. La dexmetomidina es el enantiomero-S de la metomidina (mezcla racémica de S y L), por tanto se usa la mitad de la dosis que lleva la metomidina; no obstante, como muestra el siguiente estudio los efectos adversos parecen similares en perros. La levometomidina no tiene efecto! Canine sedation/analgesia field study: In the field study safety analysis, 106 dogs received dexmedetomidine and 107 received medetomidine. Dogs ranged from 16 weeks to 16 years of age, representing 49 breeds. The following table shows the number of dogs displaying each clinical observation (some dogs experienced more than one adverse reaction). Table 4: Adverse reactions during the canine sedation/analgesia field study Ausculted unidentified arrhythmias Severe bradycardia requiring treatment Apnea requiring treatment Slow onset of sedation (exceeding 30 minutes) Ineffectiveness (dog standing throughout the study) Severe hypothermia requiring treatment Prolonged recovery Dexmedetomidine Total N=106 19 1 1 1 Medetomidine Total N=107 20 1 0 1 3 2 2 1 0 4 The occurrence of ausculted unidentified arrhythmias (some at multiple time points) decreased following the administration of atipamezole. 14 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar 15 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar 16 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar V. OPIACEOS A. Introducción El tratamiento del dolor se puede bloquear a distintos niveles como indica el siguiente esquema. Los narcóticos (opiáceos) lo hacen en el SNC (medula espinal y cerebro) Terminología: El término “opiáceos” se refiere a fármacos que se unen a receptores opioides. El término narcótico se usa para hacer referencia a los analgésicos opiáceos y en farmacología son sustancias que producen sueño (“Narkotikos” en griego = adormecimiento). No obstante, el concepto popular de narcótico es el de drogas que causan dependencia. La principal aplicación es abolir dolores intensos producidos por cirugías, traumas, y enfermedades tipo cánceres. Los principales agonistas (puros y parciales) y antagonistas opiáceos, así como su mecanismo de acción se resumen en las siguientes figuras 14.1 y 14.2: 17 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar Existen tres tipos de receptors opioides: mu, kappa y delta. Todos ellos son acoplados a proteinas G de membrana y actúan inhibiendo la adenilil-ciclasa. Eso hace que se favorezca la salida de K+ postsináptico (hiperpolarización) o reducen la entrada de Ca+ pre-sináptico (ver figura 14.2) y que están presentes en las fibras sensitivas que captan el dolor. Históricamente los opiáceos han sido considerados como el grupo de analgésicos más efectivos y forman parte en la mayoría de protocolos de analgesia. Del punto de visto clínico se pueden clasificar en agonistas puros y parciales según actúen sobre uno o más de los diferentes receptores opioides, cuya estimulación puede dar lugar a respuestas distintas. El efecto de todos los agonistas puede fácilmente revertirse con antagonistas como la naloxona y naltrexona, y para los agonistas puros se puede disminuir administrando agonistas parciales como el butorfanol y buprenorfina. Los opiáceos tienen distinta afinidad por los tres receptores y como cada receptor es responsable de distintos efectos, ello explica que los distintos derivados opiáceos tengan distinta potencia, eficacia y respuestas fisiológicas. Respuestas fisiológicas de cada receptor: Mu analgesia supraespinal, depresión respiratoria, euforia (excitación violenta en algunas especies como los gatos y caballos), dependencia Kappa analgesia espinal, miosis, sedación Delta disforia, alucinaciones, estimulación del centro vasomotor. Los agonistas puros estimulan todos los receptores (morfina, fentanilo y oximorfina) Los agonistas/antagonistas mixtos bloquean un tipo de receptor y estimulan otro (butorfanol, buprenorfina) Los antagonistas puros revierten los efectos de los puros y mixtos sin tener efecto propio (naloxona). En las siguientes tablas se muestran la potencia de los opiáceos en comparación con la morfina a la que se le asigna arbitrariamente un valor de 1 (Tabla 4-3). La tabla 1.1 muestras los principales opiáceos que se emplean en el perro y gato. Principales opiáceos en el perro y gato. Dosis recomendables (IV o IM) para cuidados intensivos. 18 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar Recordatorio: la eficacia y potencia de un compuesto no necesariamente son paralelas. Potencia se refiere a la dosis necesaria para alcanzar la ED50. Eficacia se refiere al efecto terapéutico máximo que se puede conseguir con la droga (independientemente de la dosis). La potencia y eficacia de los opiáceos está en función de la afinidad por los tres tipos de receptores opiáceos. Las figura 2.10 se muestra la curvas dosis-respuesta para un determinado efecto (p.ej., analgesia) que produce un agonista total, un agonista parcial y un agonista parcial. Si la dosis del agonista parcial es alta se consigue una disminución del efecto del agonista puro. La morfina es el más “efectivo” de los opiáceos como analgésico, pero es menos “potente” que la buprenorfina o el fentanilo (ver figura siguiente). En consecuencia se necesita más dosis de morfina pero el efecto máximo conseguido es superior a otros opiáceos. “El Whisky es más potente que la cerveza pero los dos pueden llegar a producir la misma borrachera.” . 19 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar Uno de los mecanismos de acción de los receptores opiáceos es el de inhibir la liberación de la sustancia P: Las neuronas sensitivas primarias receptoras del dolor utilizan la sustancia P (constituida por 11 aminoácidos) como transmisor en su sinapsis con las neuronas del asta dorsal de la médula espinal. En realidad al dar fármacos opiáceos estamos actuando sobre los mismos receptores que las endorfinas o morfinas endógenas, cuya presencia inhibe la liberación de la sustancia P por la neurona sensitiva, con lo que las neuronas sensitivas secundarias captan menos dolor. La acupuntura causa liberación de endorfinas y su efecto puede bloquearse por acción de la naloxona. Figura 6. Modulación de la señal dolorosa transmitida por la sustancia P. Las endorfinas inhiben la liberación de la sustancia P. Efectos farmacológicos: o Analgesia. Actúan como agonistas de las endorfinas endógenas que se liberan en el SNC. No se produce perdida de la consciencia. o Sedación (reducción de la actividad mental) y tranquilización. Algunos animales y especies muestran el efecto opuesto de euforia. o Depresión del centro respiratorio que es menos sensible a la PCO2. Es la causa principal de muerte en sobredosis. La depresión del reflejo de la tos 20 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar o o o o por opioides anti-tusígenos (codeína) no se correlaciona con la actividad analgésica o respiratoria ya que se produce por otros receptores distintos. Cardiovascular. Efecto mínimo. Nauseas y vómitos inicialmente, y después inhiben el centro emético (principalmente por la morfina en perros). Constipación (anti-diarreicos) y anti-diuresis. Miosis (permite distinguir de otras posibles etiologías por sobredosis en gente con estado de coma, ya que pocas sustancias causan miosis). Aplicaciones terapéuticas: o Analgesia – además son sedantes. Por regla general, es mejor pre-medicar antes de una cirugía y prevenir el dolor, en vez de tratarlo una vez instaurado después de la cirugía. o Neuroleptoanalgesia o Medicación preanestesica o Anti-diarreicos (comercializados y que no tienen efecto sedante o analgesico son la loperamida y el difenoxilato) o Supresión de los tos (codeína y dextrometorfano) Acciones específicas Oximorfona se combina que un tranquilizante (acepromazina) para causar neuroleptoanalgesia (sedación+analgesia sin perdida de la conciencia) Fentanilo se combina con un tranquilizante (droperidol) para causar neuroleptoanalgesia (Innovar-vet®) Carfentanilo se emplea para inmovilizar animales exóticos grandes. Antagonistas: Naloxona. Los efectos de los opiáceos se pueden revertir con antagonistas como la naloxona. Lo más relevante es tener en cuenta que el efecto de la naloxona es más corto (~1 hora) que el de muchos opiáceos por lo que se pueden requerir de dosis repetidas para que el animal no recaiga. Se emplea en los postoperatorios para recuperar el ritmo respiratorio con el inconveniente que también desaparece el efecto analgésico, al reaparecer el dolor pueden aparecer respuestas fisiológicas como la taquicardia, excitación, hipertensión. La naltrexona tiene una vida media más larga que la naloxona y por tanto no es necesario repetirla. Analgésicos opiáceos en el perro Farmaco: Dosis/Ruta: Duración del efecto Notas: Narcóticos Butorphanol (Stadol®) (Torbugesic®) (Torbutrol®) Buprenorphine (Buprenex®) Morphine Oxymorphone Pentazocine (Talwin®) 0.1-0.5 mg/kg IV, IM,SQ 2-6 horas Analgesia moderada, No usar junto con parches de fentanilo 0.01-0.02 mg/kg IM, SQ 6-8 horas Buena analgesia 0.25-0.5 mg/kg IM, SQ 0.1-0.2 mg/kg IV, IM, SQ 5-10 mg/kg IM, SQ 4 horas 4 horas 4 horas Buena analgesia Buena analgesia Meperidine (Demerol) 2-4 mg/kg IM, SQ 30-60 minutos No recommendable por 21 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar Analgésicos opiáceos en el perro Fentanyl patch su corta vida media Requiere de 24 horas para hacer ejercer su efecto 1-3 dias (Duragesic) 50 microgram/hora transdermally Naloxone (Narcan®) 0.005-0.02 mg/kg IV or 0.04 mg/kg IM 40-70 minutos Revierte el efecto narcotico, puede requerirse mas de una dosis Buffered aspirin or Ascriptin® 10-20 mg/kg PO 12 hours GI side effects Carprofen (Rimadyl) 2.2 mg/kg PO (1.0 mg/lbs) 4.4 mg/kg PO or SQ 10-15 mg/kg PO 12 hours 24 hours 24 hours Possible liver effects NSAIDs Etodolac (EtoGesicTM) Possible liver effects Efectos secundarios de los opiáceos (Figura 14-6): Hiperexcitabilidad con la morfina. Se puede obviar dando menores dosis y combinando con un tranquilizante Hipotensión. Puede ocurrir con la morfina por liberación de histamina. Deprime la respiración – principal causa de muerte. Hemorragia y edema cerebral. Debe darse con precaución si el animal ha sufrido un traumatismo craneal o tiene depresión respiratoria que haga aumentar la cantidad de sangre que llega al cerebro. Retención urinaria Constipación 22 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar ANESTESIA 1. Términos La anestesia general balanceada consiste en un el estado de 1) perdida de conciencia (narcosis), 2) perdida de sensibilidad dolorosa (analgesia), 3) perdida del tono muscular (miorelajación), y 4) perdida de reflejos y reacciones neuroendocrinas (protección neuroendocrina). Ningún anestésico reúne todas estas características y por eso es necesario hacer combinaciones. Existen muchas combinaciones posibles. En general, una buena anestesia aparte de cumplir todo lo anterior debe reunir las siguientes características: ● Buena ventilación ● Buena circulación ● Riego al riñón (producción de orina) ● No causar toxicidad Viendo cuales son las características ideales de una anestesia, podemos decir que los principales efectos no deseados de la mayoría de anestésicos y que pueden provocar la muerte serían: la depresión cardiorespiratoria e hipotensión (por eso es bueno tener oxigeno suplementario para evitar una hipoxia y administrar fluidos intravenosos para que la presión sanguínea no baje). En el perro anestesiado el ritmo cardiaco es de 60-80 (sin anestesia 80-120 minuto) y el ritmo respiratorio de 10-12 (sin anestesia y descansando es de 20-40/minuto). Signos de una excesiva profundidad en la anestesia serían: R.R< 8/minuto (con respiración superficial), membranas pálidas (indicativo de hipotensión y mala perfusión en que la sangre no llega a la mucosa) o cianóticas (indicativo de una mala oxigenación de la sangre), CRT (capillary refill time) > 2 segundos (indicativo de hipotensión); HR (Heart Rate) < 60/minutos en perros y < 100/minutos en gatos, hipotermia, músculos flácidos (sin tono). La anestesia disociativa es la que produce la ketamina o tiletamina que actúa independizando las funciones del SNC, es decir, no duerme el cerebro sino que disocia las distintas áreas del mismo. Los anestésicos disociativos son excitatorios, por eso si solo se usa la ketamina el animal mantiene los reflejos y ojos abiertos, tiene hipertonía muscular y puede convulsionar. La neuroleptoanalgesia consiste en la asociación de un neuroléptico (tranquilizante) y un analgésico opiáceo. En este estado el animal está indiferente al entorno pero puede reaccionar a estímulos externos, menearse y tener reflejos indeseables (vómitos, defecaciones, hiperventilaciones, jadeos, bradicardias). Al no suprimirse la conciencia no podemos decir que se trate de anestesia pero puede ser suficiente para procedimientos menores y animales que vienen en estado de shock por traumas en que hay que quitarles el dolor y sedarlos levemente. La neuroleptoanalgesia se podría considerar como la premedicación idónea anterior a la anestesia general. La anestesia local y regional suprime la sensibilidad dolorosa en las terminaciones nerviosas (local) o en las raíces de los nervios raquídeos que inervan una zona (regional). Se realiza por infiltración de un anestésico como la bupivacaína o la lidocaína. La anestesia epidural tiene muchas ventajas. Básicamente consiste en administrar el analgésico opiáceos y/o anestésico locales (lidocaína o bupivacaína) en el espacio epidural (ver imagen siguiente). Según la sustancia, dosis y localización se puede conseguir quitar el dolor sin que se afecte la función motora, con lo que el animal puede mantenerse en pie sin perder las funciones vegetativas posteriores (defecación, micción, etc.), del tacto, ni motoras (se mantiene en pie). Actualmente, los protocolos más avanzados de anestesia están haciendo uso de la anestesia epidural porque es mucho más efectiva que la general, se requieren dosis muchos menores de fármacos anestésicos y analgésicos, y el efecto dura mucho más que si usamos otras vías de administración. La asepsia debe ser absoluta al introducir jeringas en el espacio epidural. La 23 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar médula nunca debe de puncionarse ya que se puede lesionar. Si no se tiene experiencia no debería realizarse por el riesgo de dañar la médula. De hecho y para evitar puncionar la medula, se recomienda hacer anestesia en la zona lumbosacra, sacrocoxal o intercoxigea según la especie. Por ejemplo, en el perro se puede hacer lumbosacra ya que a este nivel la médula ya no llega (acaba en la 6-7 lumbar), mientras que en gatos y rumiantes la médula llega hasta la 3era y 1ª vertebra sacra, respectivamente. Espacio epidural (espacio entre vertebras y dura madre) Dura madre (rosa) Aracnoides con trabeculas (rojo) Liquido cefaloraquídeo (azul claro) Pia madre (azul) Medula (amarillo) En bovinos, se administra entre la coxígea C1-C2 que se localiza elevando la cola como muestra la figura siguiente. Un volumen de lidocaína pequeño de 5-10 mL al 2% produce analgesia caudal sin parálisis o ataxia posterior. El efecto dura 1-2 horas y si no ha comenzado en 10 minutos, la inyección probablemente no se hizo en el espacio epidural. Si se inyectan volúmenes grandes de hasta 100-150 mL entonces se conseguirá parálisis de miembros posteriores e insensibilidad de flancos (pared abdominal) y tejido mamario. Si el anestésico viaja muy dorsalmente (cabeza más baja de miembros posteriores) hasta la zona cervical puede ocurrir que se lleguen a paralizar músculos respiratorios del tórax. Se debe proteger frente la abducción de patas traseras cuando el animal se comienza a recuperar. 24 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar Las aplicaciones de la anestesia epidural en bovinos con dosis bajas de lidocaína se muestra en la Tabla adjunta de la izquierda. Si se combina la xilacina (0.5 mL de xilacina al 2% diluida en solución salina) con la lidocaína se obtiene un efecto más duradero (3-4 horas) y además aporta ligera sedación del animal. Para cesarías en pie, esto se debe de combinar con anestesia regional del flanco. Existen dos grupos de anestésicos locales como muestra la figura 6-1 siguiente: esteres (procaína, cocaína, chloroprocaína y tetracaína) y amidas (lidocaína y bupivacaína). Ambos grupos actúan de igual manera bloqueando los canales de Na+ voltaje dependiente tanto en fibras sensoras como motoras, no obstante las sensoras se afectan antes que las motoras por ser menos gruesas. Los esteres unen por un enlace ester el grupo aromático (hidrofóbico) con la amina terciaria (hidrofílico), mientras que los que tienen grupo amida lo hacen por un enlace amida. La diferencia importante estriba en que los del grupo ester se metabolizan rápidamente por esterasas del plasma y las amidas se metabolizan en el hígado por conjugación con el ácido glucurónico, y lo hacen más lentamente en varias horas. Por eso los dos que más se emplean son la lidocaína y la bupivacaína (ambos son tipo amida y duran entre 1-2 horas para la lidocaína y hasta 6-8 horas para la bupivacaína). Cuando se combinan con epinefrina la duración del efecto se prolonga. El principal efecto adverso es que, si por error se introdujesen en sangre, el animal podría morir por sobredosis, ya que las dosis administradas muchas veces son suficientes para causar signos nerviosos (contracción musculares y convulsiones) y cardíacos (arritmias). El otro efecto secundario importante es que como también se afectan las fibras simpáticas responsables por el tono vasomotor de la circulación visceral, la anestesia epidural siempre causa hipotensión de vísceras abdominales por lo que se debería acompañar de fluidos intravenosos. 25 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar En el documento en inglés del Dr. Lyon Lee (http://instruction.cvhs.okstate.edu/vmed5412/Lect013.htm) se incluyen modelos de anestesia y analgesia local para todas las especies: caballos, vacas, pequeños rumiantes, perros y gatos. Por ejemplo, para perros se puede hacer una laparotomía, o un procedimiento ortopédico de miembros posteriores, con dosis de 0.1 mg/kg de morfina con 1 mL bupivacaina (al 0.5%) por cada 10 Kg de peso vivo….inyección lumbosacra (L7). En gatos se aplicaría a nivel de la S1. Para cesáreas, ruminotomías, desplazamientos de abomaso, etc. en bovinos (ver Figura 8), es muy importante saber realizar bloqueos paravertebrales ya que la vaca debe mantenerse en pie durante todo el procedimiento y la anestesia epidural no es suficiente para cubrir la analgesia a nivel de la fosa paravertebral ni flancos. Se bloquean las raíces dorsales y ventrales de los nervios espinales T13, L1 y L2. Se emplean 10-20 mL de lidocaína al 2% por cada sitio de inyección. El efecto comienza en 10 minutos y se prolonga por unos 90 minutos. Figure 8. The proximal and distal paravertebral block at the T-13, L1 and L2 in cattle. This technique is one of the most commonly used regional analgesia in cattle for standing surgery (C-section, and laparotomy). (From Thurmon et al. 1996) La pre-anestesia consiste en administrar un fármaco antes del anestésico general y tiene muchas ventajas como son la de hacer una inducción suave, disminuir la cantidad de anestésico necesario (sobretodo en casos de cesáreas en que los barbitúricos, agentes inhalatorios y agentes disociativos van a deprimir a los fetos), favorecer la analgesia perioperatoria (es decir, en el pre-, durante y el postoperatorio), reducir secreciones y respuestas autonómicas (complicaciones como la bradicardia, hipotensión por estimulación vagal). Los principales preanestésicos que se usan antes de inducir la anestesia son: fenotiacinicos, benzodiacepinas, 26 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar atropina, analgésicos opiáceos. La selección de uno u otro va a depender de la especie animal, estado del paciente y tipo de cirugía. o Paciente deprimido de antemano: estaría contraindicado usar un tranquilizante (fenotiacina o benzodiacepina) y sin embargo si estaría indicada la atropina para protegerlo de la bradicardia e hipotensión. o Paciente hipovolémico/hipotérmico: contraindicadas las fenotiacinas. o Paciente que esta sano y excitado: las fenotiacinas serían un buen pre-anéstesico. o Paciente sano geriatrico ó pediatrico y excitado: las benzodiacepinas son las ideales porque no deprimen tanto el corazón y respiración. o Paciente cardiaco: no se le debería administrar atropina. o Todos los pacientes: Opiáceos en todos ellos a menos que exista un traumatismo encefálico, ya que podrían aumentar la presión intracraneal. En prácticamente todos los protocolos de una buena analgésia balanceada, los preoperatorios incluyen algún opiáceo (en nuestro entorno el más accesible es el tramadol). 27 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar Clásicamente se han distinguido 4 fases en la anestesia basadas en el grado de profundidad que produce el eter (no obstante los anestésicos actuales actúan mucho más rápido y pasan rápido a la fase III). La Figura 11.2 muestra los pasos desde el estado de muerte (death) en que el cerebro está totalmente “apagado” hasta el estado de excitación máxima en que está convulsionando (seizures). Fase I – Excitación voluntaria ataxia, conducta violenta. El paciente está consciente y lucha contra la narcosis. De la excitación la pupila se dilata, puede haber incontinencia urinaria y fecal, y aumenta el ritmo cardiaco y respiratorio. Fase II – Excitación involuntaria el paciente pierde Catalepsia = estado la conciencia, experimenta delirio y acaba en estado nervioso de rigidez cataléptico. Al principio de esta fase los “reflejos muscular y postura están aumentados” (incluido reflejo del vomito), hay corporal inmobil. contracciones musculares involuntarias y en general se producen respuestas exageradas ante cualquier estímulo. Estás dos primeras fases deben evitarse en duración y severidad ya que el paciente no está relajado. La ketamina, oxido nitroso y fenciclidina no pasan al animal de fase II a III. (ver tabla 11.1). Administrados solos pueden producir convulsiones Fase III - Anestesia quirúrgica se puede proceder a la cirugía. Los músculos se han relajado, hay pérdida de respuesta a estímulos y la respiración es regular. En general se produce pérdida de las funciones motoras, sensitiva y refleja por lo que el animal no reacciona a estímulos dolorosos (se divide en 4 planos según aparecen en la Tabla 11.2). Fave IV – Parálisis medular se produce con sobredosis por parálisis del centro de la respiración y vasomotor. Normalmente estos centros son los últimos que se afectan en el cerebro y por eso la anestesia no debe llegar a deprimirlos. Del punto de visto práctico distinguimos tres fases: Inducción – incluye la fase I y II típica del éter. En esta fase el paciente es cuando pierde la conciencia y puede presentar estados de delirio y reacciones violentas. Normalmente se usan agentes como el tiopental que producen inconsciencia (paso directo de fase I a fase III) en tan solo 25 segundos desde su inyección intravenosa. Mantenimiento – se debe medir el grado de anestesia constantemente y adecuar la administración a un mantenimiento estable de las constantes vitales. Puesto que los anestésicos inhalatorios permiten un control del grado de anestesia de “minuto a minuto”, son ideales para el mantenimiento. Los inhalatorios (excepto el oxido nitroso) no producen analgesia. Recuperación – Es la fase opuesta a la inducción en que el individuo recupera la conciencia y la respiración. El anestésico ideal además de producir una inducción rápida, produce una recuperación también rápida ya que el animal en el proceso de recuperación de la conciencia puede también mostrar estados de excitación, pedaleo, aullidos, temblores musculares etc. 28 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar 29 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar ANESTESICOS INHALATORIOS El mecanismo de acción exacto se desconoce pero el grado de depresión está relacionado con la liposolubilidad, la cual a su vez aumenta con el grado de halogenación del hidrocarburo y disminuye con la presencia de grupos alcohol. Se acumulan en las membranas alterando la función de las mismas y en general estabilizándolas, al igual que lo hacen otros solventes orgánicos (ver esquema siguiente - figura 5). Los anestésicos inhalatorios no van específicamente al cerebro (no tienen receptores como tal): se disuelven en todos los tejidos de acuerdo al cociente de partición tejido/sangre que varía para cada tejido según su afinidad por el compuesto. El “flujo de sangre” y la “capacidad” (volumen) del tejido determinan la velocidad con que se alcanza el equilibrio, el cual viene dado por el coeficiente de partición entre los dos tejidos. Tejidos con muchos lípidos como el “cerebro” tienen gran afinidad por agentes liposolubles y al tener un gran flujo de sangre y ser pequeño (volumen pequeño en comparación al del tejido adiposo o musculatura esquelética) se llenan pronto. Debido a que el tejido adiposo tiene mucha capacidad (sobretodo en animales obesos) pero poco flujo sanguíneo, tarda más en equilibrarse con la concentración en sangre. 30 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar Tabla 1: Agentes volátiles y sus propiedades físicas. AGENTE SVP in MAC/OGPC (Coeficiente mmHg aceite/gas) Methoxyflurane (olor dulce, no irritante, si es buen analgésico preferible a dosis subanestesicas. Su volatilidad y lenta inducción limitan su uso a agente de mantenimiento, evitar en traumas SNC) 24 0.2% / 950 Blood/Gas coefficient “solubilidad en sangre” Potencia (escala de 17), Inducción 13 Volatilidad 3% 1 -Muy potente, Muy Lento Ether (no se usa por ser irritante y +++ secreciones, es muy seguro – bebes lo toleran) 425 1.92% 12 (explosivo), 4 - Poco potente, Muy lento Trichloroethylene (seguro, buena analgesia y no irritante, no se alcanzan [ ] suficientes ni con vaporizadores) 60 0.17% 9 Volatilidad 7% 1 - Muy potente, Muy lento Halothane (Buena inducción y olor agradable, potente pero con baja analgesia y animales experimentan dolor al despertarse, debe combinarse con opioides, oxido nitroso, anestesia local, evitar en traumatismos del SNC) 243 0.75% / 220 2.3 Volátilidad 32% 2- Potencia alta, rápido Sevoflurane (inducción y recuperación super rápida, no irritante y dulce – muy costoso) 160 2.4% / 53.4 0.6 Volatilidad 21% 5 - Poca potencia, Muy rápido Desflurane (irritante con lo que puede causar laringoespasmo, tos y +++secreciones) 673 6.0% / 18.7 0.42 6 – poca potencia Muy rápido Isoflurane (olor desagradable, no induce arritmias como el halotano pero también produce hipotensión, no se metaboliza por lo que es bueno para animales con problemas hepáticos/renales, es el agente de elección para traumatismos craneales) 250 1.15% / 97 1.4 3- Buena Potencia Rapido 0.47 100% Volatil 7- Debil anestesico Muy rápido Oxido nitroso (N2O - mal anestésico pero buena analgesia, ni siquiera al 80% produce anestesia, por usarse al 60-70% puede desplazar al O2 y por eso, aunque es el más seguro debe mantenerse el 20% O2 más de 5 minutos durante la recuperación 760 188% / 1.4 31 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar SVP = Saturated Vapor Pressure (indica la concentración máxima que se puede alcanzar en la fase gaseosa a temperatura “20C” y presión “760 mmHg” ambientales). Cuanto mayor sea la SVP, mayor concentración del agente habrá en la fase gaseosa; p.ej., el “eter” tiene una SVP de 425 mmHg, por lo tanto a 20C se consigue una saturación máxima del 56% (425/760x100=56%) (760 mmHg es la presión atmosferica a nivel del mar). El halotano (244 mmHg) tiene una SVP a 20C = 32%. Una concentración del 32% sería mortal rápidamente por lo que se necesitan vaporizadores que controlen exactamente la concentración de agente que entra en el animal (1.2 – 1.4 MAC para anestesiar el 95% de los animales). MAC = Minimum Alveolar Concentración (concentración de equilibrio necesario para prevenir la respuesta refleja a una incisión de piel en el 50% de pacientes humanos). Se correspondería con la dosis efectiva 50 (DE50). Indicaría la potencia; cuanto menor sea la concentración necesaria en el alveolo para producir anestesia mayor potencia. Existe una correlación indirecta entre MAC y OGPC, tal que cuanto mas “liposoluble” sea el agente más potente es. Para el oxido nitroso, como más de 100% saturación no se puede conseguir en el alveolo, el que 1 MAC = 188% nos indicaría que es muy poco potente como anestésico. OGPC = oil-gas partition coefficient (OGPC). La potencia anestésica es proporcional a la solubilidad del gas en aceite de oliva. BGPC = Blood/gas partition coefficient (cuanto menor sea mas rápido actúa porque pasa más rápido al cerebro (no le gusta estar en sangre). Si es pequeño se alcanzan concentraciones altas en el alveolo rápidamente; para el eter sin embargo el coeficiente es alto y en cuanto llega al alveolo se disuelve y pasa a sangre, la sangre actúa como un gran “esponja” que se tiene que llenar antes de que pasen concentraciones altas al cerebro – “por tanto el paciente tarda mucho en dormirse”). De la misma manera cuanto menos es la solubilidad en sangre antes se despertará el paciente, no obstante aquí también influye el cociente de partición entre tejidos y sangre ya que estos actúan como reservorio del gas anestésico. “Por tanto las variables de los anestésicos inhalatorios son: a) rapidez de acción, b) potencia, c) propiedad de irritar el tracto respiratorio (con lo que no se pueden usar para inducir, a menos que usemos el sevoflurano), y d) no debe ser tóxico, y para ello es mejor si no debe metabolizarse para eliminarse. Ejemplos: imagínense al “Desflurane” como un porche que pasa de 0 a 100 km/hr en 5 segundos (muy rápido), pero consume 6 litros en hacerlo (poco potente). Compárenlo con un carro normal “metoxyflurane” que tarda mucho en pasar de 0 a 100 km/hr (lento) pero solo consume 1 litro en conseguirlo (es muy potente pero poco rápido). 32 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar Para el calculo de la concentración máxima que puede alcanzarse en el aire por un gas se puede calcular dividiendo la presión de vapor por la atmosférica (760 mmHg a nivel del mar) y multiplicando por 100 (la tabla anterior da los datos de mmHg y concentración máxima alcanzable (%) para los distintos gases inhalatorios. Como la concentración inspirada se puede controlar con el circuito de anestesia usado, la presión de vapor no tiene tanta importancia clínica siempre que el agente sea suficientemente volátil (>MAC%) a temperatura ambiente. Como se puede observar en la tabla 5-2 y 5-5 casi todos los agentes inhalatorios tienen una MAC << % saturación (la excepción es el oxido nitroso). Aproximadamente el 95% de los animales se pueden anestesiar con una concentración de 1.2 – 1.4 x MAC. Si se administra junto con otro anestésico entonces las MAC deben sumarse. Como usar los agentes inhalatorios? Puede usarse uno de acción rápida para inducir, y después combinarlo con otro más potente para mantener la anestesia. A un animal que se deje poner la mascara y respire el anestésico, es un método aceptable cuando la inducción es corta (para evitar la fase I y II de excitación). Otro método es usar un inductor rápido IV como el tiopental vía IV seguido del agente volátil para el mantenimiento. Casi todos los procedimientos de anestesia general en humanos se realizan así, con un agente pre-anestésico hipnótico, ya que en general los anéstesicos halogenados son irritantes (excepto el sevoflurano) y pueden producir toses, laringoespasmos y por tanto inducciones difíciles. Ejemplo: en el hospital de la Facultad se emplea el isoflurano (AErrane®, Baxter) que tiene una MAC en el perro de 1.28%. Como durante la inducción puede producir broncoespasmo y aumento de las secreciones bronquiales por irritación, lo ideal es usar un hipnótico de corta duración (propofol, etomidato o tiopental para inducir primero y evitar posibles irritaciones respiratorias y laringoespasmo durante la fase de inducción). Después se usa el isoflurano para mantener la anestesia a la concentración de 1.0–1.5 % junto con oxigeno, o bien 0.5% junto con oxido nitroso (60-70%). 33 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar ANESTESICOS INJECTABLES Barbitúricos Ciclohexilaminas (Ketamina, fenciclidina, tiletamina) Propofol Etomidato Ventajas e inconvenientes de los agentes anestésicos inyectables Ventajas Inconvenientes Fáciles de administrar Una vez administrados es imposible impedir que actúen. Difícil de revertir El animal debería ser intubado para protegerlo Se pueden acumular y la respuesta es por lo general mas duradera que los inhalatorios Producen anestesia de forma rápida y suave Requieren poco equipamiento No irritan las vías aéreas 1. Barbitúricos Son ácidos débiles (acido barbitúrico=urea+acid malonico) que según tengan un oxigeno o azufre en el C2 se clasifican en oxibarbituricos o tiobarbituricos. En general los tiobarbituricos son más liposolubles por lo que penetran antes en el SNC, pero la duración del efecto también es mas corta (ver tabla siguiente): Su mecanismo de acción consiste en facilitar la acción del neurotransmisor GABA y disminuir los efectos excitatorios del neurotransmisor glutamato. 34 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar En la grafica adjunta se ve que ocurre al inyectar tiopental IV. Inicialmente todo pasa a la sangre pero se distribuye rápidamente (<1 minuto) a las vísceras más irrigadas (cerebro) y con alto contenido en lípidos (cerebro). A la misma vez, penetra en otros tejidos que tardan más en llenarse porque reciben menos sangre pero que son más grandes que el cerebro (tejido muscular y adiposo). No obstante la gráfica no puede estar bien porque si desarapece totalmente de sangre no pueden seguir llenándose el músculo y tejido adiposo. Puesto que el metabolismo del tiopental es más lento que la redistribución, ocurre que al bajar los niveles en sangre las concentraciones en cerebro caen (porque se había acumulado mucho más que en otros tejidos) mientras que en otros tejidos (músculo y adiposo) siguen aumentando hasta que se alcance el equilibrio con la sangre. Si miramos el tiempo, observamos que al cabo de 10-15 minutos post-inyección la mayoría del fármaco ha salido del SNC y está en el tejido muscular. Los barbitúricos no son buenos analgésicos. Tiopental y tiamilal Aplicaciones terapéuticas o Fármacos de elección para inducir la anestesia (incluido casos de traumatismos del SNC). o Pueden usarse para mantener la anestesia pero eso implica que la recuperación va a ser lenta porque se saturan el tejido muscular y adiposo. o Seguro para inducir anestesia en cesáreas Pentobarbital Aplicaciones terapéuticas o Eutanasia (tiene un margen de seguridad muy bajo para anestesia). o Crisis convulsivas refractarias al diacepam y fenobarbital (la duración del efecto es de 45-90 minutos). Fenobarbital Aplicaciones terapéuticas o Anticonvulsivo para prevenir ataques epilépticos (su período de acción es el más largo 8-12 horas). 2. Ketamina Otras ciclohexilaminas son la tiletamina y fenciclidina. Todas producen una anestesia disociativa, es decir solo ciertas partes del cerebro están “dormidas”. No produce depresión cardiorrespiratoria, por el contrario estimula el corazón, la respiración y presión sanguínea (no usar en traumatismos craneales). No produce relajación muscular, el tono se mantiene o incluso aumenta con lo que los miembros se mantienen rígidos y extendidos (estado cataléptico), además se mantienen los reflejos y los ojos abiertos (con lo que se reseca mucho la cornea y puede llegar a dañarse). La analgesia somática es buena pero la visceral es mala. En el 20% de gatos que solo reciben ketamina se cita que se producen 35 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar convulsiones. La ketamina a dosis subanestésicas de 0.5-1 mg/kg (10x por debajo de lo normal) se puede usar como analgésico y de hecho actualmente se emplea en infusiones intravenosas continuas (0.6 mg/kg/hr) para tal efecto (ver el documento de protocolos de analgesia perioperatorio en perros y gatos). La ketamina y tiletamina solo logran un estado cataléptico: animal con miembros rígidos y extendidos. Actuan inhibiendo la acción de dos neurotransmisores excitatorios en la medula espinal: la acetilcolina y el glutamato. Aparte son antagonistas no competitivos del receptor N-metil-d-aspartato (NMDA). Aplicaciones terapéuticas o Anestesia disociativa. Se debe asociar a un tranquilizante (acepromacina, xilacina, diacepam) para proveer relajación muscular y prevenir convulsiones y otras reacciones adversas. Se puede mezclar en la misma jeringa con los tranquilizantes citados pero nunca se debe mezclar con barbitúricos porque precipitarían (los barbitúricos se deben administrar solos). o Amplio margen de seguridad (5x más que los barbitúricos). o Analgésico a dosis subanestésicas y en infusión intravenosa contínua. 3. Propofol Se trata de un fármaco que viene formulado como emulsión acuosa al 1%. Se emplea para inducir rápidamente por vía intravenosa y mantenimiento por infusión continua. Tiene la ventaja sobre los barbitúricos de que no produce tanto “guayabo” después de la anestesia y la recuperación es suave y más rápida. Como produce pobre analgesia se asocia con opiáceos. Produce menor depresión cardiorrespiratoria que los barbitúricos o los agentes inhalatorios. Dosis repetidas no se acumulan como ocurre con los barbitúricos y aunque la duración de la anestesia es corta (2-10 minutos) la recuperación muy rápida. Esto se debe a que se metaboliza rápidamente en el hígado. Actúa activando el receptor GABA. Aplicaciones terapéuticas o Inducción de la anestesia y mantenimiento para procedimientos cortos. o Anestesias en que el paciente debe salir andando. o Pacientes con traumas cerebrales por descenderles la presión sanguínea cerebral. 4. Etomidato Se emplea para inducir anestesia pero carece de actividad analgésica. Se emplea en pacientes como problemas cardiacos por tener poca acción sobre el corazón y circulación, y tener un amplio margen de seguridad. (p ej., el índice terapéutico es de 16 mientras que el del tiopental es de 4). Es de acción ultracorto y no se acumula y es el ideal para perros con problemas cardiacos. Aplicaciones terapéuticas o Inducción de la anestesia y mantenimiento para procedimientos cortos. o Anestesias en que el paciente debe salir andando. ANESTESICOS LOCALES Bloquean la propagación de los potenciales de acción por inhibición de la entrada de Na+ a través de los canales voltaje-dependientes. Como se puede mostrar en la figura siguiente (Figure 6-1) en la estructura química tienen un grupo aromático, un enlace intermedio, y una amina terciaria. 36 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar El enlace intermedio es bien de tipo ester o amida, la adición de átomos de carbono en la región aromática o amina terciaria aumenta la liposolubilidad del compuesto y con ello su potencia. A continuación se muestran tablas con las dosis de analgésicos, tranquilizantes, y anestésicos, así como de posibles combinaciones anestésicas para el perro. Como se puede observar se emplean combinaciones y ello hace que haya que administrar dosis menores de cada fármaco al producirse un efecto sinérgico entre ellos. En los apéndices 5 y 6 se detallan muy bien protocolos para una ovariohisterectomia (en inglés spay) y una profilaxis dental. En el documento de “Protocolos de analgesia perioperatoria en perros y gatos” otros iguales de eficaces (pregunta: que objetivo tiene cada uno de los fármacos administrados y por cuanto tiempo se administra cada uno de ellos?) . Una buena página web para anestesias se encuentra en la dirección: http://www.iacuc.ucsf.edu/Proc/awDogFrm.asp 37 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar 38 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar 39 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar 40 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar 41 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar 42 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar 43 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar 44 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar Taller de Farmacología del Sistema Nervioso Central 1. Leer el siguiente caso clínico y contestar las preguntas que siguen al final: 45 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar 46 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar Preguntas: Cual fue el motivo de visita a la clínica? Cuanto tiempo llevaba en perro en tratamiento? Que efectos secundario (aparentemente sin problemas clínicos) estaba causando el tratamiento y que el veterinario (en un principio) sospecho que estaba causando el problema? Que cambios hizo inmediatos en la terapia de acuerdo con su diagnostico presuntivo? Que cambios hizo y porque al cabo de dos semanas de iniciar la nueva terapia? Que explicación dan para que las concentraciones terapeúticas de bromuro descendiesen y se produjeran de nuevo convulsiones? Que cambios realizó de nuevo para restaurar las concentraciones terapeuticas de bromuro? Que efectos beneficiosos tuvo el retirar el fenobarbital de la terapia? 2. Te traen un pastor alemán de 4 años de edad con un historial de convulsiones ocasionales. Prescribimos fenobarbital (2 mg/kg, PO, c12 h). Al cabo de 6 meses llega a la clínica y el análisis de plasma muestra concentraciones de 37 g/ml de fenobarbital (rango terapéutico 20-40 g/ml). Qué te indicaría que es necesario sustituir o combinar el tratamiento con otro fármaco? a) El número de episodios convulsivos ha aumentado de frecuencia últimamente. b) El perro tiene mayor apetito y PU/PD c) El perro muestra signos de sedación y ataxia ligera. d) El análisis de sangre revela una elevación de las enzimas hepáticas. e) Las concentraciones de fenobarbital en plasma están cerca del máximo del rango terapéutico. 3. Has administrado xylazina (ver prospecto del Rompun®) a una vaca por vía IM “a la dosis recomendada en caballos” . Que efectos esperarías observar a dicha dosis en una vaca? a) Depresión profunda del SNC b) Bradicardia y arritmias sinusal c) Retención urinaria d) Taquicardias y taquipnea. e) Excitación 47 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar f) a y b g) b y c 4. a) Cuales de los agentes inhalatorios de la figura de la derecha alcanzaría el equilibrio entre la concentración alveolar y de la sangre más rápidamente? B) Por qué la fase de recuperación es más lenta con el halotano que el oxido nitroso? 5. Viendo el coeficiente de partición entre los distintos tejidos para los siguientes agentes inhalatorios, que agente tardará más tiempo en eliminarse del organismo? TISSUE BLOOD PARTITION COEFFICIENTS Desflurane Sevoflurane Isoflurane Halothane Fat 27.2 47.5 44.9 51.1 Muscle 2.0 3.1 2.9 3.4 6. Une con una flecha el compuesto/fármaco con el efecto fisiológico que produce: Esteres de la colina Insecticida organofosforado Agonista gangliónico Agonista beta-2 adrenérgico Agonista alpha-2 adrenergico estimulación nicotínica activación directa de receptores muscarínicos inhibición de la acetilcolinesterasa broncodilatación sedación 7. Une con una fecha el efecto que produce la estimulación de cada uno de los receptores: β1 β2 Vasodilatación Taquicardia 48 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar α1 α2 Muscarinico Inhibición de la liberación de NA Vasoconstricción Bradicardia 8. Unir con una flecha como reverterías el efecto producido por los fármacos de la primera columna. Morfina Acepromacina Xilazina Isoflurano Diacepam Yohimbina Oxigeno No se puede revertir naloxona flumezanil 9. Que fármaco sería el que emplearías “primero” para tratar un animal epiléptico que tiene una crisis convulsiva? a. acepromacina b. Ketamina c. diacepam d. Bromuro potasico (KBr) e. Morfina 10. Que agente anestésico emplearías para hacer más corta la fase de inducción? a. anestésico disociativo b. agente inhalatorio con alto coeficiente de partición sangre/gas c. agente inhalatorio con alto coeficiente de partición aceite/gas d. oxido nitroso e. Ninguna de las opciones 11. La premedicación con atropina antes de la anestesia bloquea las reacciones de la hipervagotonía que incluiría todas las siguientes EXCEPTO: (la hipervagotonia equivale a una estimulación del sistema parasimpático) a. salivación b. depresión cardíaca c. hipersecreción bronquial d. midriasis e. vómitos 49 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar 12. Léanse el siguiente articulo (disponible en la pagina web de la Universidad) para comentar en clase. 50 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar Respuestas del Taller 2. a) El número de episodios convulsiones ha aumentado. Los otros efectos como el mayor apetito y PU/PD son de esperar y se pueden controlar disminuyendo la dieta y dándole agua 3-4 veces al día. Igualmente la sedación y ataxia ligera es de esperar cerca del rango máximo terapéutico. La elevación de enzimas hepáticas es indicación de una hepatopatia y aunque no bueno para el hígado, no necesariamente indica insuficiencia hepática, solo sí la función hepática se ve alterada (elevación de bilirrubina o de acidos biliares, signos clínicos y/o enzimas ALT y AST muy altas, >5x lo normal). Como el fenobarbital no está controlando las convulsiones cerca del rango máximo terapéutico aconsejable, lo que se debería hacer es combinarlo al principio y poco a poco incluso sustituirlo con otro el BrK. 3. f) a y b. Existe una gran diferencia de susceptibilidad a la xilazina entre especies. El vacuno requiere aproximadamente 10 veces menos dosis que el equino para obtener en mismo efecto. Una dosis terapéutica en caballos de alrededor de 0.5 mg/kg IM puede matar una vaca. Por tanto, los signos que se producirán son propios de una sobredosificación de xilacina, los principales son depresión cardiorrespiratoria (bradicardia sinusal y del ritmo respiratorio) y profunda depresión del SNC. 4. a) el oxido nitroso alcanza el equilibrio más rápidamente que los otros. Como no se disuelve bien en la sangre se acumula mucho en el alveolo y pasa de golpe a la sangre. La sangre entonces se satura rápidamente y como en general todos son liposolubles, el cerebro que recibe más sangre que el tejido adiposo acumula (al principio) más cantidad que los otros tejidos. No obstante, como el tejido adiposo y músculo esquelético tienen mas capacidad (más masa) pueden con el tiempo acumular más cantidad que el cerebro (reservorios). b) Al retirarse el anestésico, si es poco soluble en sangre pasa rápidamente al alveolo, por eso del oxido nitroso la recuperación es rápida, mientras que del halotano es más lenta porque se queda más tiempo en la sangre. Básicamente en las dos gráficas A y B se observa que la velocidad de inducción es igual de rápida a la de recuperación: cuanto más rápida sea la inducción más rápida la recuperación. 5. La combinación de coeficiente de partición tejido/sangre y sangre/gas determinan en último lugar la rapidez de la recuperación. Si no tenemos en cuenta el coeficiente sangre/gas, podríamos decir que los pacientes se recuperan más rápido con el Desflurane y más lentamente con el halotano. Cuanto más soluble en la grasa, mas se acabará acumulando en el tejido graso y por tanto más tarda en eliminarse del cuerpo, consecuencia: los individuos obesos se levantan más tarde de una anestesia! 6. Une con una flecha el compuesto/fármaco con el efecto fisiológico que produce: Esteres de la colina Insecticida organofosforado Agonista gangliónico Agonista beta-2 adrenérgico Agonista alpha-2 adrenergico estimulación nicotínica activación directa de receptores muscarínicos inhibición de la acetilcolinesterasa broncodilatación sedación 51 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar 7. Une con una fecha el efecto que produce la estimulación de cada uno de los receptores: β1 β2 α1 α2 Muscarinico Vasodilatación Taquicardia Inhibición de la liberación de NA Vasoconstricción Bradicardia 8. Unir con una flecha como reverterías el efecto producido por los fármacos de la primera columna. Morfina Acepromacina Xilazina Isoflurano Diacepam Yohimbina Oxigeno No se puede revertir naloxona flumezanil 9. Que fármaco sería el que emplearías “primero” para tratar un animal epiléptico que tiene una crisis convulsiva? a. acepromacina b. Ketamina c. diacepam d. Bromuro potasico (KBr) e. Morfina 10. Que agente anestésico emplearías para hacer más corta la fase de inducción? a. anestésico disociativo b. agente inhalatorio con alto coeficiente de partición sangre/gas c. agente inhalatorio con alto coeficiente de partición aceite/gas d. oxido nitroso e. Ninguna de las opciones 11. La premedicación con atropina antes de la anestesia bloquea las reacciones de la hipervagotonía que incluiría todas las siguientes EXCEPTO: (la hipervagotonia equivale a una estimulación del sistema parasimpático) a. salivación b. depresión cardíaca c. hipersecreción bronquial d. midriasis e. vómitos 12. Que otros protocolos de inducción se podrían emplear? Creen que sirven para diminuir el dolor postoperatorios? Cual de los dos protocolos les parece más adecuado y por que? 52 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar Recordatorio de los mecanismos que operan en las células excitables: La siguiente figura muestra esquemáticamente los mecanismos que controlan la excitabilidad en las neuronas, fibras musculares (esqueléticas, cardiacas y de fibra lisa) o células exocrinas (salivares, lacrimales, bronquiales). Recuerden que la célula se activa cuando se despolariza (números 1,2 7 y 8 de la figura), se recupera cuando se repolariza (es decir, vuelve al estado de reposo) y también se pueden hiperpolarizar para evitar que se produzcan sobrestimulaciones o excesos de impulsos nerviosos (la hiperpolarización es un estado más negativo dentro y que impide la despolarización, números 3,4,5 y 6 de la figura). Los mecanismos básicos sobre los que interactúan muchos fármacos para alterar la actividad eléctrica son 4: 1) alteración en la concentración del neurotransmisor: ejemplos son el bloqueo de liberación de ACh de las motoneuronas por acción de la toxina botulinica, ó a la inversa, es decir la inhibición de la acetilcolinesterasa con lo que no se hidroliza la ACh y acumula en la sinapsis produciéndose una sobreestimulación de los receptores colinergicos. 2) Alteración en la función del receptor: ocurre cuando el compuesto se une a un receptor y lo activan (agonista) como por ejemplo ocurre con los barbitúricos sobre el receptor GABA, o bien el compuesto inactiva el receptor como ocurre con la atropina sobre los receptores muscarinicos. 3) Alteración de la señal de transducción intracelular: se refiere a la acción sobre los canales de Na+ o Ca2+ voltaje-dependientes (números 7 y 8 de la Figura). Por ejemplo la lidocaina y procaína son anestésicos locales que actúan inhibiendo dichos canales de Na+. 4) Alteración en la terminación de la señal (números 9 y 10 de la figura): Si no se quitan los cationes del interior de la célula esta permanece excitada. Esto ocurre con los glucósidos cardiacos como la digoxina que inhibe la bomba de Na+/K+ (número 10 de la figura) lo que a su vez disminuye el intercambio entre el Na+/Ca y el calcio se acumula dentro de la célula aumentando la contracción y excitabilidad de la fibra muscular cardiaca. El litio (usado para tratar las epilepsias) actúa entrando en la célula por los canales de Na+ pero al no ser sustrato de la bomba de Na+/K+ la célula no se repolariza y por tanto disminuye su capacidad de despolarizarse. 53 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar 54 Sistemas Orgánicos I: Farmacología del Sistema Nervioso Central Profesor: David Villar 55