7. Enlaces Químicos - IES San Juan Bautista
Anuncio
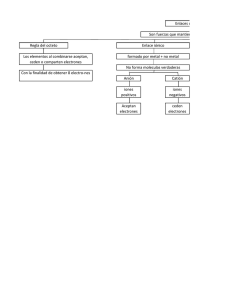
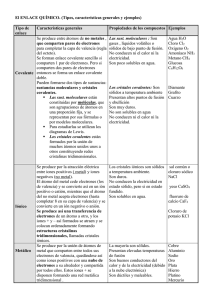
¿Qué tengo que conocer de Química en 4º E.S.O.? Diego E. Pérez-Olea / Dpto. Física y Química. I.E.S. San Juan Bautista Séptima entrega de actividades para el refuerzo y recuperación de Física y Química de 4º ESO. Para tener constancia del conocimiento de las familias de esta actividad adicional, agradeceríamos devolvieran firmada esta hoja con los problemas resueltos que, una vez supervisados por el departamento, será devuelto al alumno para su uso posterior. Firma del padre/madre Nombre del alumno/a Fecha Grupo Tema 7 Enlaces atómicos: Los átomos se suelen combinar con otros para formar los compuestos, y lo hacen por conseguir situaciones más estables. Lo pueden hacer de tres formas, según se unan elementos no metálicos con metálicos, elementos no metálicos entre sí o elementos metálicos entre sí. Según hagan su tipo de enlace, tendrán propiedades diferentes. Tipos de enlace La combinación de elementos de hace para tener los electrones de la última capa completa, o llenos o vacíos. Covalente: se basa en que comparten electrones. Enlace entre elementos no metálicos. Diagramas de Lewis. Sirve para representar como comparten los electrones. Como estos elementos tienden a captar electrones, lo que hacen es compartirlos. Se dibuja el elemento con un punto por cada electrón que haya en la última Además de los compuestos, existen: capa, y debe completar 8 (salvo el H y He que solo tienen 1s). Al Cristales atómicos covalentes: enlaces covalentes entre átomos que forman redes combinarlos, cada elemento tiene que tener 8 puntos alrededor (aunque estén tridimensionales. P.e. el Carbono forma diamante o grafito según la estructura cristalina. al lado del otro elemento). Cada par de electrones compartido forma un Cristales moleculares covalentes: son las moléculas las que forman redes enlace. tridimensionales. Compuestos covalentes moleculares: formados por átomos no metálicos diferentes El agua es la sustancia covalente más importante. H4Si: Iónico: se basa en la cesión de electrones. Se produce entre elementos metálicos (que ceden electrones) y no metálicos (que aceptan electrones), por lo que la atracción entre los elementos se hace por fuerza electroestática. H2O: NH3: Se puede usar el diagrama de Lewis para representar los electrones, pero teniendo en cuenta que se ceden, no se comparten (los puntos negros son los electrones del Sodio, los blancos del Cloro): Metálico: intercambian los electrones de las últimas capas con lo que quedan repartidos sin pertenecer a ningún átomo en particular. Principales ropiedades de los compuestos según sus enlaces (propiedades más características) Propiedad Estado natural Puntos fusión/ebullición Conductividad eléctrica Solubilidad Covalente Gaseosos, rara vez líquidos Bajos (excepto los cristales covalentes que son muy altos) No conducen Insolubles o poco solubles en agua Iónico Cristalino (gran dureza) Elevados Metálico Estado sólido (el mercurio en líquido) Medio-altos o muy altos Malos en estado sólido, buenos en estado líquido (fundido o disolución) Muy solubles en agua Muy buenos incluso en estado sólido No solubles Ejercicios propuestos Compuesto 7.1 tabla: Deduce que tipo de enlace tienen los compuestos de la 7.2 Identifica los enlaces de los siguientes compuestos:. CO; NH3, HCl; NaCl;Na2S;Hg A B C D E Conductividad electrica Mala Mala Buena En disolución En disolución Estado natural líquido gaseoso Sólido Sólido sólido 7.3 Escribe el diagrama de Lewis de los compuestos del ejercicio 7.2 7.4 En los oxoácidos, la parte del anión tiene un metal y oxígeno, y el catión tiene hidrógeno. ¿Qué tipo de enlace existe entre estos dos? 7.5 Escribe el diagrama de Lewis del anión sulfato y del anión yodato. Puntos de fusión Bajo bajo Alto Alto alto Solubilidad No Poco No No No