(Exposición 3er año)
Anuncio

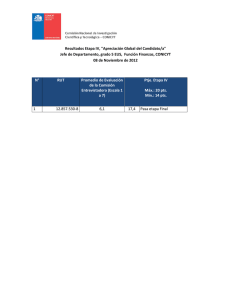
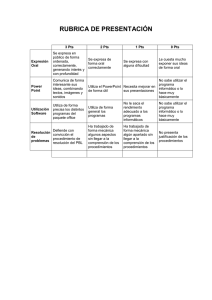
UNIDAD EDUCATIVA COLEGIO SAN ANTONIO DEL TUY OCUMARE DEL TUY, ESTADO MIRANDA CURSO: 3 er AÑO A y B PROFESOR: CARLOS M. LANDAETA H. INSTRUCCIONES PARA LA EXPOSICIÓN La exposición consiste en la presentación de un trabajo escrito y su defensa con material de apoyo. El tema se trata de la Tabla Periódica de los Elementos Químicos y los grupos principales, contenido del tema 2 del cronograma del primer lapso. TEMAS DE EXPOSICIÓN 1) Grupo 1: Familia de Metales Alcalinos (Li, Na, K, Rb y Cs). 2) Grupo 2: Familia de Metales Alcalino-Térreos (Be, Mg, Ca, Sr, Ba y Ra). 3) Grupo 13: Familia del Boro (B, Al, Ga, In y Tl). 4) Grupo 14: Familia del Carbono (C, Si, Ge, Sn y Pb). 5) Grupo 15: Familia del Nitrógeno (N, P, As, Sb y Bi). 6) Grupo 16: Familia del Oxígeno (O, S, Se, Te y Po). 7) Grupo 17: Familia de Halógenos (F, Cl, Br, I y At). 8) Grupo 18: Familia de Gases Nobles (He, Ne, Ar, Kr, Xe y Rn) PUNTOS A DESARROLLAR Y DISCUTIR EN CADA TEMA: a) Nombre, Símbolo y Valencia química de cada elemento del grupo. b) Propiedades características de cada elemento: Densidad (g/mL), punto de fusión y ebullición, número atómico, masa atómica. Estado físico de cada elemento en la naturaleza. c) Abundancia de cada elemento en la naturaleza. Abundancia y localización de cada elemento en Venezuela. d) Origen de cada elemento químico y año de descubrimiento. ¿Quiénes fueron sus descubridores ganadores del premio Nobel de Química?. e) Usos de cada elemento en la actualidad (año 2011). Aplicaciones Tecnológicas, Médicas, industriales y otras. PAUTAS PARA LA DEFENSA: Trabajaran grupos de cuatro (4) estudiantes por tema. En la exposición, cada grupo colocara una pieza cuadrada de 15 cm de lado para cada elemento químico perteneciente a la familia con las especificaciones dadas a continuación: 11 Ggeee Número atómico 0,97 g /mL 97,8 °C Na Símbolo Masa atómica 22,989 g/mol Valencia 892 °C Densidad Punto Fusión Punto Ebullición 15 cm Imagen del elemento +1 15 cm Uno de los grupos será sorteado para que realice una tabla periódica grande, en cartulina blanca, con las medidas de cada celda para cada elemento a fin de utilizarla como base para la colocación de cada pieza. La tabla será colocada en la pared del aula de clases para ambientar y como recurso didáctico de estudio. 11 Na a INDICACIONES GENERALES DE LAS PIEZAS: a) Color de las piezas (celdas): Grupo 1: Familia de Metales Alcalinos (Li, Na, K, Rb y Cs). Grupo 2: Familia de Metales Alcalino-Térreos (Be, Mg, Ca, Sr, Ba y Ra). Grupo 13: Familia del Boro (B, Al, Ga, In y Tl). Grupo 14: Familia del Carbono (C, Si, Ge, Sn y Pb). Grupo 15: Familia del Nitrógeno (N, P, As, Sb y Bi). Grupo 16: Familia del Oxígeno (O, S, Se, Te y Po). Grupo 17: Familia de Halógenos (F, Cl, Br, I y At). Grupo 18: Familia de Gases Nobles (He, Ne, Ar, Kr, Xe y Rn) b) Materiales: Puede utilizar cartulinas de colores, cartulina de construcción, Foamy u otros. c) Color de las letras del símbolo químico: sólido (color negro), líquido (azul) y Gas (rojo). d) Puede emplear cinta adhesiva o cierre mágico para pegar las piezas en las celdas de la tabla en blanco. TRABAJO ESCRITO: Debe ser entregado el día de la exposición, en hojas blancas tamaño carta transcrito en computadora letra Times New Roman tamaño 12 para el texto y tamaño 14 (negrita) para títulos. Interlineado 1,5 y un espaciado entre párrafos. Márgenes de 4 cm (Superior e izquierdo) y 3 cm (Inferior y derecho), encuadernado con tapas de color azul. A continuación se muestra la estructura del trabajo y su escala de estimación: 1) Portada (1 pto) 2) Índice (1 pto) 3) Introducción (3 pts) 4) Desarrollo del tema (5 pts) 5) Conclusiones (4 pts) 6) Bibliografía (1 pto) 7) Anexos. (1 pto) Cumplimiento de las normas de transcripción y encuadernado (2 pts) Redacción (2 pts) TOTAL : 20 pts. EVALUACIÓN: La exposición tiene una ponderación máxima de 20 pts (nota individual) y el trabajo escrito 20 pts (nota grupal), la nota definitiva es el promedio de las dos calificaciones. Para la defensa, cada estudiante será evaluado bajo el siguiente formato: Evaluación de la Defensa (individual) Estudiante Material de apoyo (pieza, trípticos, folletos) Contenido Oratoria Dominio del tema 1 2 3 4 NOTA: Cada casilla tiene una ponderación máxima de 5 pts, para un total de 20 pts. Definitiva Calificación definitiva (individual) Estudiante Defensa Trabajo escrito Definitiva (individual) (grupal) (Promedio) 1 2 3 4 FECHA DE PRESENTACIÓN DE LA DEFENSA Y ENTREGA DE TRABAJO: 28 de noviembre de 2011 (3ero A) y 29 de noviembre de 2011 (3ero B) REFERENCIAS BIBLIOGRÁFICAS [1] Rodríguez, M del P.; Química 9º grado. Editorial SALESIANA, 1ª edición (1993). [2] Flores, J., Química 9º grado.Editorial SANTILLANA. (También existe el problemario). [3] Suárez, F., Química 9º grado E. B., Editorial ROMOR. (También existe el problemario). [4] Fernández C., M. M., López B., D. M., Química 9º E. B., Editorial Triángulo. [5] Requeijo De, A., Requeijo, D., Química 9º grado. Consulte también: www.webelements.com; www.quimicasat.jimdo.com CMLH/cmlh/quimicaSAT2011