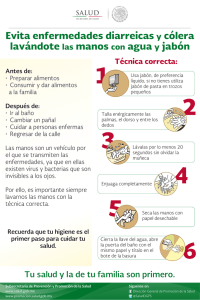
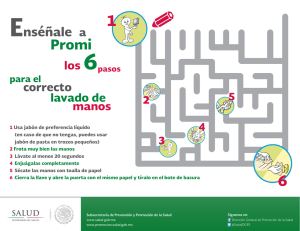
De enseñanza-aprendizaje módulo compilado por el consorcio
Anuncio

Módulo de enseñanza-aprendizaje compilado por el consorcio PARSEL como parte de un proyecto financiado por la EC FP6 (SAS6-CT- 2006 - 042922-PARSEL) en Popularidad y relevancia de Ciencias de la Educación para la alfabetización científica ¿Qué jabón es el mejor? Ciencia de grado l0-ll (química) módulo sobre la acción limpiadora del jabón Resumen: Este conjunto de actividades permite a los estudiantes a considerar los factores que pueden estar involucrados en la determinación de las mejores jabón para su uso. Las actividades también permiten a los estudiantes a diseñar las pruebas para determinar la eficacia de la jabones como agentes de limpieza. Por último, la actividad refuerza el sentido de un jabón y una comprensión de su acción de limpieza. Las secciones incluidas Actividades de los estudiantes Describe la situación con más detalle y las tareas a los (para los estudiantes) estudiantes que tengon que realizar 2 Guía didáctica sugerir un método de enseñanza 3 Evaluación da sugiere estrategias de evaluación formativa 4 Nota para el profesor 1 da pruebas sugirieron que se llevarán a cabo por los estudiantes Objetivos generales / Competencias: Los estudiantes deberán: • Decidir cómo determinar el "mejor" jabón. • Reconocer los factores que influyen en la elección de jabón para comprar. • Proponer y llevar a cabo un procedimiento para probar la capacidad de limpieza de jabones. •Cooperar de manera significativa a la comunicación oral como miembro de un grupo en la planificación, ejecución a cabo e interpretar las pruebas de jabones para llevar a cabo las pruebas de una manera eficaz. • Comprensión de la emulsión y la acción del jabón como agente limpiador. El contenido curricular: saponificación (la consolidación del concepto); jabones (consolidación de su preparación) y su acción de limpieza. Tipo de actividad: La elaboración de los factores que afectan a la "mejor", la planificación y realización de pruebas sobre la limpieza y capacidad de jabón. La comparación de jabones por el costo. Prever el tiempo: 4 clases Este material único de enseñanza-aprendizaje se destina a la guía del profesor a la promoción de alfabetización de los estudiantes mediante el reconocimiento científico de aprendizaje en cuatro ámbitos - el desarrollo intelectual, el proceso y la naturaleza de la ciencia, el desarrollo personal y desarrollo social. Su singularidad se extiende a un acercamiento a las clases de ciencias que está diseñado para ser popular y pertinentes. Para ello, el enfoque es deliberadamente de la sociedad a la ciencia y los intentos de específicamente las necesidades de aprendizaje de los estudiantes. Esta singularidad está especialmente expuesto por; 1. un título relacionado con la sociedad y basadas en cuestiones (apoyado en la guía del estudiante por un escenario); 2. énfasis centrado en el estudiante de solución de problemas científicos, que abarca el aprendizaje de una serie de objetivos educativos y científicos; 3. incluida la decisión socio-científica para relacionar lo que la ciencia adquirió a la sociedad necesidades de la ciudadanía responsable. ¿Qué jabón es el mejor? Actividades Estudiantiles Escenario Hay muchas marcas de jabón en los estantes del supermercado. Pero, ¿cómo decidir qué pastilla de jabón para comprar? ¿Alguna vez has pensado que el jabón es el mejor para comprar? ¿Cómo se decide? ¿Es el que limpia el mejor? ¿Es el que mejor está en las manos? ¿Es el precio un factor? Es el tamaño de un factor? Vamos a llevar a cabo un proyecto para averiguar qué jabón es "mejor", donde tenemos que definir el significado apropiado del término "mejor" en nuestro contexto. Tu tareas Para determinar que el jabón es "mejor" que tendrá que considerar una serie de factores. Las actividades en parte 1 y 2 le ayudará a considerar qué factores son importantes. Parte 3 es un proyecto para comparar la eficacia de diferentes jabones. Usted tendrá que diseñar el procedimiento para ello. Cuando haya completado las partes l, 2 y 3, debe ser capaz de utilizar los resultados para ayudar a hacer su opción de "mejor " el jabón. Esta es la parte 4. Parte l: En cuanto a las etiquetas - la comparación de los costos Marca (nombre) El nombre del país (jabón hecho) Costo ($) Masa (En g) Costo (Por g) 1 2 Preguntas 1. ¿Hay alguna información falta en el cuadro? 2 ¿Es importante para los fines de este proyecto? en caso afirmativo, ¿cómo podemos obtener la información? Parte 2: Hacer más comparaciones - prueba de los jabones l. Oler el jabón. Describir el olor. 2. Remoje la barra de jabón de l hora. No te muevas que durante este tiempo. Luego se retira y seca la barra de un día. Pesar de nuevo la barra. Calcular la pérdida de masa. 3. Diseño otro experimento para comparar los diferentes bares. Declarar el propósito del experimento. Preguntas l. ¿Qué información comparativa útil se puede obtener de la prueba 1? 2. ¿Por qué perfume añadido al jabón? Es probable que esto sea un factor en la determinación de "la" mejor "de jabón? 3. Imagine que usted es un consejero de trabajo para la sociedad de consumo. ¿Qué factores le indican son importantes al elegir qué jabón para comprar? 4. ¿Encontraste algún jabón que fue de color negro? (muy improbable) ¿Puede sugerir una razón para ello? Parte 3: El Proyecto Diseño de un conjunto de procedimientos para comparar la efectividad de los jabones para la limpieza. En esto usted tendrá que decidir lo que va a ser limpiada, el factor que tiene que ser comparados y las variables que se necesitan para mantener constante. En el proyecto, voy a limpiar ........ Factor 1 que voy a comparar es ....... (Para esta comparación, voy a control lo siguiente ...) Factor 2, que voy a comparar es ........ (Para esta comparación, voy a control lo siguiente ...) Mis resultados indican ...... Parte 4: La elección del "mejor" de jabón Sugiero que la mejor jabón es ....... He basado mi decisión en los siguientes ...... ¿Qué jabón es el mejor? Guía del Profesor Este proyecto permite a los estudiantes para aprender acerca de a) las funciones de jabón b) presentar sugerencias de cómo van a proceder, c) variables de control para llegar a una conclusión válida Resultados del aprendizaje de la lección Al final de l lecciones, los estudiantes deben ser capaces de: • comparar jabón varias costo por g-1; • cooperar en equipo y con toda la clase para asegurar la comparación de costos g-1 se puede hacer a través de una gama de jabones. Al final de la lección 2, los estudiantes deben ser capaces de: • llevar a cabo un experimento para comparar la solubilidad de los jabones; • presentar un procedimiento significativo para que los jabones que se compara; • Respuesta por escrito relacionado con la interpretación y el control de la integridad de una tabla; Al final de la lección 3, los estudiantes deben ser capaces de: • interpretar los resultados del experimento en la comparación de la solubilidad de los jabones; • llevar a cabo una serie de pruebas para determinar la capacidad de limpieza de jabones; • Respuesta por escrito relacionado con factores que influyen en la elección de jabón; Al final de las clases 4, los estudiantes deben ser capaces de: • explicar la manera en que los jabones un acto de limpieza; • determinar la "mejor" de jabón con las justificaciones relacionadas con factores generales y la capacidad de limpieza; Estrategia de enseñanza sugeridos l. Este proyecto puede preceder a la enseñanza acerca de la capacidad de limpieza de jabón. Se basa en los estudiantes antes conocimiento en esta área y puede conducir a las preguntas de por qué algunos jabones eran más eficaces que otros, o por qué ahora el uso de detergentes en lugar de jabones para lavar la ropa. También precede a una consideración de lo que el jabón es o cómo se hace. 2. La parte 1 es un ejercicio sencillo y para iniciar esto, el maestro como los alumnos se pueden llevar en muestras de jabón. Si este es el caso, los maestros deben instruir a los estudiantes para asegurar que el precio de la barra de jabón está claramente marcada en el exterior de la telenovela y que el jabón se envuelve de modo que elnombre de marca es claramente visible. 3. Los experimentos en la parte 2 se necesita un poco de planificación por parte del profesor. Como no es importante que el experimento 2 se lleva a cabo de l hora exactamente, probablemente el mejor procedimiento en este caso es iniciar este experimento en el comienzo de la siguiente lección l parte y para quitar el jabón en el final de la lección. El jabón se seca hasta que los estudiantes de nuevo se reúnen en la clase que puede ser l día o más. 4. Durante el resto de la lección, los estudiantes pueden diseñar un experimento aún más cuidadosa y explicar lo que esperan que esta experiencia contribuirá a una comparación de diferentes jabones. Los estudiantes también pueden ser guiados para discutir las preguntas dadas para esta parte del proyecto. Pero lo más importante de todos, los estudiantes pueden desarrollar sus ideas sobre cómo se podría estudiar el poder de limpieza de las telenovelas en la parte principal del proyecto, que seguirá en la próxima lección. El profesor puede recoger estos al final de la lección. 5. El maestro será capaz de estudiar las sugerencias de los alumnos para su proyecto y preparar la aparatos necesarios para ello. En gran parte esto significará poner a disposición de "sucio" muestras de tela que puede compararse fácilmente con las instalaciones disponibles en el laboratorio. 6. A raíz de los experimentos, es importante que los estudiantes escriban sus proyectos y exponer sus razones para decidir la "mejor" jabón. El logro de los Objetivos 1. Reconocer los factores que influyen en la elección de jabón para comprar. Este aspecto se logra mediante la realización de l partes y 2 del proyecto. Hay que consolidó aún más por las razones dadas por los alumnos para determinar su "mejor" comprar en la parte 4. 2. Proponer y llevar a cabo un procedimiento para probar la capacidad de limpieza de jabones. Esta es la parte 3 del proyecto y el profesor determinará la capacidad de los estudiantes para lograr este objetivo marcado por la constancia escrita de sus procedimientos sugeridos a continuación, la observación y guía sus acciones durante la sesión práctica siguiente. 3. Expuesto los motivos para decidir sobre la "mejor" comprar. Este es un componente integral de la parte 4 del proyecto y el maestro será capaz de determinar cómo ahora esto se logra ver los registros escritos de los estudiantes. 4. Capacidad de los estudiantes para trabajar como miembro de un grupo. Esto se consigue durante el proyecto real de 1-4 partes en las que los alumnos deben llevar a cabo el proyecto como un grupo. Atención especial a la cooperación puede ser colocado en l parte en los resultados entre los grupos es muy probable que sea necesario. ¿Qué jabón es el mejor? Desarrolladores: Jack Holbrook lnstituto: ICASE País: Reino Unido Criterios de evaluación Evaluación sugerida de aprendizaje de los estudiantes. El profesor puede decidir si desea evaluar a los estudiantes sobre la base de los resultados de aprendizaje propuestos para cada lección, y si todos los estudiantes son evaluados cada vez, o si uno o dos grupos se evalúan solamente. El método propuesto de evaluación en cada uno de los casos es decir formativa se colocó durante el aprendizaje. Esto significa que las necesidades de marcado para ser sencillo y un esquema de 3 puntos se presenta. Se deja a la maestra para dividir si las marcas son dados a estudiantes individuales, o si, por alguna o todas las marcas ocasiones se dan por el trabajo del grupo en su conjunto, este trabajo en equipo y fomentar la asistencia alumno-alumno, donde se requiere la comprensión adicional. Lección 1 (dos marcas separadas se sugieren) Dimensión 1 2 Criterios para la evaluación de los Marcar / alumnos determinado grado Comparación de los Comparación de los jabones y responder a jabones y responder a las preguntas por escrito. las preguntas por Capaz de responder a las preguntas sobre el escrito jabón proporcionada por el profesor. Cooperar en grupo Coopera con otros en un grupo y totalmente participa en los trabajos del grupo. Muestra habilidades de liderazgo - guía al grupo pensar con creatividad y ayudar a las personas que necesitan asistencia; resumir los resultados. Lección 2 (tres marcas separadas se sugieren) Dimensión 1 2 3 Criterios para la evaluación de los Marcar / alumnos determinado grado Escribe un plan para Desarrolla un procedimiento adecuado para un procedimiento comparar jabones Recoger los datos Llevar a cabo experimentos sobre la experimentales solubilidad de los jabones y anotar recogidos observaciones Interpretar o calcular Lleva a cabo correctamente los cálculos de a partir de datos la solubilidad de habon. recogidos y llegar a Señala a conclusiones apropiadas conclusiones 4 Responde a las Proporciona correcta una respuesta por preguntas escrito a las preguntas dadas por vía oral o en forma escrita Lección 3 (tres marcas separadas se sugieren) Dimensión 1 Criterios para la evaluación de los Marcar / alumnos determinado grado Registro de los datos Lleva a cabo las pruebas sobre la acción experimentales limpiadora de jabones recogidos y observaciones de los registros y los datos recogidos adecuadamente (en términos de número de observaciones considera aceptable / exactitud registrado / da errores) 2 Interpretar o calcular Interpreta los datos recogidos en la a partir de datos solubilidad de los jabones de una manera recogidos y llegar a justificable. Señala a conclusiones conclusiones apropiadas 3 Responde a las Proporciona correcta una respuesta por preguntas escrito a las preguntas por vía oral o en forma escrita. Proporciona respuestas con suficiente detalle en especial cuando han de dar una opinión o decisión. Lección 4 (dos marcas separadas se sugieren) Dimensión 1 Criterios para la evaluación de los Marcar / alumnos determinado grado Responde a las Capaz de explicar la manera en que los preguntas jabones actúan como agentes de limpieza Proporciona respuestas con el suficiente detalle. 2 Científico o el Da una decisión justificada en la "mejor" razonamiento elección de jabón. científico-social Parte C Evaluación de la Estrategia del profesor Herramienta de evaluación basados en el marcado del Material escrito por parte del profesor Dimensión 1 Criterios para la evaluación de los Marcar / alumnos determinado grado Escribe un plan o un Presenta un estudio adecuado de preguntas informe de una de carácter científico y / o conoce a investigación propósito de la investigación / experimento. Crea una investigación adecuada o plan experimental para el nivel de detalle requerido por el profesor. Presenta una predicción adecuada. Desarrolla un procedimiento adecuado (incluyendo aparatos y productos químicos necesarios y los procedimientos de seguridad es necesario) 2 Registro de los datos Hace observaciones y registros / datos experimentales recogidos adecuadamente (m términos de recogidos número de observaciones considerado aceptable / exactitud registrado / da errores) 3 Interpretar o calcular interpreta los datos recogidos de una manera a partir de datos justificable recogidos y llegar a Señala a conclusiones apropiadas conclusiones 4 Responde a las Proporciona correcta una respuesta por preguntas escrito a las preguntas por vía oral o en forma escrita. Proporciona respuestas con suficiente detalle en especial cuando han de dar una opinión o decisión 5 razonamiento Da una decisión justificada en la "mejor" científico o elección de jabón. científico-social Evaluación de los Estudiantes de herramientas basadas en las observaciones del Profesor Dimensión 1 Criterios para la evaluación de los Marcar / alumnos determinado grado Realizar el Realiza el experimento de acuerdo con la experimento (en el las instrucciones o en el plan de crear. pre-investigación y Mantiene una mesa de trabajo ordenada y las fases de limpia. investigación) Entiende los objetivos del trabajo experimental y sabe que las pruebas y mediciones a realizar. Utiliza las herramientas de laboratorio y el equipo de medición en un manera segura y apropiada. Se comporta de una manera segura con respecto a él o a sí misma y a los demás. 2 Funcionamiento en el Contribuye a la discusión de grupo durante grupo durante la el fases de la investigación teórica experimentación o la (preguntas y plantea hipótesis, diseño del discusión experimento, se basa conclusiones, toma decisiones justificadas). Muestra tolerancia con y sirve de estímulo a, los miembros del grupo. Coopera con otros en un grupo de colinas, participa en los trabajos del grupo. Muestra habilidades de liderazgo - guía al grupo pensar con creatividad y ayudar a las personas que necesitan asistencia (cognitivo o psicomotor); resumiendo resultados. 3 La presentación de la Presenta la actividad de una manera clara y experiencia por vía práctica oral con las decisiones justificadas. Presenta por el conocimiento y la comprensión que ilustra De la materia. Utiliza términos científicos precisos y adecuados y el idioma Notas para el profesor ¿Qué jabón es el mejor? Notas para el profesor Para estas lecciones, se supone que los estudiantes ya están familiarizados con la reacción de saponificación y el tipo de sustancias que forman la materia prima para la fabricación de jabones. Estas lecciones reforzar este aprendizaje y se relacionan las reacciones a las propiedades del jabón real en el mercado. Se pone de manifiesto que es difícil tomar una decisión en la que el jabón es el mejor y factores como el precio y la publicidad también puede jugar un papel más importante en la sociedad que permite elegir que se las propiedades de limpieza jabón deLa sí mismo. Las lecciones por lo tanto cubrir el costo del jabón, la solubilidad del jabón, si se deja reposar en agua por algún tiempo y permitir a los estudiantes para introducir otros factores que pueden influir como el envasado, el tamaño de la pastilla de jabón y el color. La prueba real de las propiedades de limpieza refuerza la necesidad de un control si las comparaciones tengan sentido. Los estudiantes están obligados a proponer experimentos adecuados, dar instrumento idóneo para ello (sobre la base de sus experiencias, si antes de trabajar en el laboratorio de la escuela) y, sobre todo, cómo el experimento de control se creó en cada caso. experimentos previstos son los siguientes: l. pH de la pastilla de jabón (una medición y control es la cantidad fija de jabón, la cantidad fija de agua utilizada y que el agua debe provenir de la misma fuente, es decir, toda el agua del grifo, destilada o todos los (Desionizada - si el agua es realmente el pH = 7) de agua. Este experimento no es probablemente significativa sin el uso de un medidor de pH, las diferencias tienden a ser pequeñas. 2. Capacidad para eliminar las manchas de un pedazo de tela (controles - misma tela, del mismo tamaño de tela, mismo tipo de intensidad de la mancha, de temperatura, las manchas, lo mismo, el agua misma, la misma cantidad de agua, el mismo tipo de envase para llevar a cabo el experimento, lo mismo ayudas adicionales, por ejemplo agitación, mismo período de tiempo para el experimento, mismo cheque post-experimento). Las variaciones en estos factores pueden afectar la capacidad de limpieza del jabón y por lo tanto, los experimentos podría variar una variable a la vez el uso de jabones diferentes y controles relacionados con el efectividad de los jabones diferentes en cada condición. 4. Capacidad de espuma (controles aquí son la misma cantidad de jabón, el agua misma, la misma cantidad de agua, el tiempo mismo, lo mismo ayudas adicionales, tales como temblores, mismo tipo de contenedor, el mismo instrumento para medir la profundidad de la espuma. ¿Qué es el jabón? El jabón es un producto de limpieza a partir de grasas y aceites con álcali. Ingredientes Aceites y grasas para el jabón son ésteres de ácidos grasos que reaccionan con los álcalis como el sodio hidróxido para formar glicerol y la sal sódica del ácido graso. Los ácidos grasos necesarios para la fabricación de jabón puede provenir de las grasas animales, grasas, aceites de pescado y aceites vegetales. La dureza, cualidades espuma, y la transparencia del jabón varían de acuerdo con la combinaciones de grasas y álcalis utilizados como ingredientes. Un jabón artesano experimentado utiliza muchas combinaciones de aceites. ¿Cómo limpia el jabón? La mayoría de los jabones quitar la grasa y la suciedad, porque ellos (o algunos de sus componentes si considerar el color y el perfume original) son surfactantes (agentes de superficie). Los surfactantes tienen una estructura molecular que actúa como un vínculo entre el agua y la suciedad partículas. Esto afloja las partículas de las fibras subyacentes o las superficies a limpiar. Un extremo de la molécula de jabón es hidrofílica (atraen el agua), y el otro es hidrofóbica (atraídos por sustancias que no son solubles en agua). Esta peculiar estructura jabón permite adherirse a las sustancias que de otro modo insolubles en agua. La suciedad es a continuación, lavado con el jabón. Una explicación científica Las moléculas de agua consisten en dos átomos de hidrógeno y un átomo de oxígeno. El átomo de oxígeno es vinculados a los dos átomos de hidrógeno en un ángulo de enlace de alrededor de 104 grados. El oxígeno es mucho más electronegativo que el hidrógeno y por lo que tiende a tener una mayor densidad de electrones. En consecuencia, la molécula de agua es polar - tiene: una carga positiva en un extremo de la molécula (el fin de hidrógeno) y una carga negativa en el otro (al final de oxígeno). El extremo positivo de una molécula de agua se verá fuertemente atraído por el extremo negativo de la otra molécula de agua. Cuando un compuesto iónico, como el cloruro de sodio, se disuelve en agua, el oxígeno (negativo) el fin de que el agua se siente atraído por los cationes (iones positivos) mientras que el hidrógeno (positivo) el fin de que el agua se siente atraído por los aniones (iones negativos). La solubilidad de una sustancia en el agua es en gran medida determinado por la fuerza relativa de la atracción de agua a la sustancia en comparación con la fuerza de la atracción entre las moléculas de agua. En contraste con el oxígeno, el carbono tiene casi la misma electronegatividad como el hidrógeno y el enlace carbono-hidrógeno es no polar. Por ejemplo, la molécula de octano (un componente de gasolina) se compone de 8 átomos de carbono en una cadena, con dos átomos de hidrógeno unidos a los carbones del interior y 3 átomos de hidrógeno de los carbonos finales. Puesto que la densidad de electrones es distribuida uniformemente, la molécula es eléctricamente neutro en toda su longitud. La forma más sencilla de entender la solubilidad es recordar la regla de "lo semejante disuelve como," que es polar y sustancias iónicas son solubles en sustancias polares e iónicos mientras que los no-sustancias polares son solubles en sustancias no polares. Así, la sal se disuelve en agua, pero no en la gasolina. Aceite se disuelve en la gasolina, pero no agua. Las células vivas y sustancias polares / no polares Las células vivas necesitan ambas sustancias polares y no polares. La célula utiliza no polares sustancias, las grasas y aceites, que constituyen la membrana celular que separa el interior del la célula desde el exterior. Si la membrana celular se soluble en agua, se disuelven de distancia y pronto no habría nada para dividir la celda de la no-celular. Sin embargo, con el fin de para llegar a la celda, en primer lugar, todas las partes de la célula debe ser soluble en agua, ya que los materiales l1ow se transportan de un lugar a otro. Lo que la naturaleza necesita es un no-material polar que se puede disolver, mueve alrededor, y luego hizo no polar de nuevo. Este material es conocido como un lípido (grasa), o triglicéridos. Un lípido es un éster y básicamente consta de dos partes - un ácido graso y un trihydric (3 OH grupos) alcohol llamado glicerol. Tanto los ácidos grasos por sí mismo y el glicerol por sí mismo son solubles en agua, debido a los átomos de oxígeno polares en los extremos de estas moléculas. En un lípido, tres ácidos grasos se unen a los tres átomos de oxígeno (3 grupos de OH) en el glicerol. Aunque los átomos de oxígeno todavía están allí, ahora están enterrados en el interior del molécula y lípidos es esencialmente no-polar. El lípido es por lo tanto insolubles en agua. Un ácido graso (saturadas) tiene la formula CnH2n+1COOH. La química está dominada por las propiedades del grupo COOH. Debido a que este grupo es polar, los ácidos grasos tienden a ser soluble en agua. ácido octanoico, C8H17COOH, es sólo uno de un número muy elevado de ácidos grasos ácidos. De hecho, la mayoría de los ácidos grasos son más largos que el ácido octanoico. Dos muy común componentes de los lípidos son el ácido palmítico (C15H31COOH) y el ácido esteárico (C17H35COOH). Lípidos sólidos son generalmente llamados grasas. Otra clase de ácidos grasos insaturados son los ácidos grasos, con menos de hidrógenos 2n + l para todos los carburos n. Ácido oleico, por ejemplo, ha fórmula C17H33COOH y el ácido linoleico tiene fórmula C17H31COOH. Las grasas saturadas contienen ácidos grasos saturados y son sólidos a temperatura ambiente. Manteca de cerdo, y mantequilla son ejemplos de grasas saturadas. Jabón de estas grasas tiende también a ser sólidas a a temperatura ambiente. Las grasas insaturadas contienen ácidos grasos insaturados y son líquidos a a temperatura ambiente. En general, estos aceites son llamados y ejemplos incluyen el aceite de maíz y aceite de cártamo. Estos aceites producir jabón líquido. Mientras que las grasas no saturadas son generalmente más. Así margarina, que se hace a partir de aceites vegetales no saturados (por ejemplo, aceite de maíz) se hidrogena a cambio de una aceite no saturado para producir un saturadas (sólidas) de grasa. Para hacer el jabón, el éster trihydric (grasa) se hidroliza (desglosado) en sus ácidos grasos y componentes de glicerol. El ácido graso tiene una cola larga de hidrocarburos que es soluble en grasas, y un extremo polar de oxígeno que es soluble en agua. Así, un ácido graso en la solución de los actos como un jabón de disolver las grasas en un extremo de la molécula de agua y en la otra. Cuando un base fuerte, como la lejía, se utiliza para hidrolizar (saponificar), la grasa, el ácido graso es entonces presentarse como un catión grande, que es polar en un extremo y no polar en el otro. Así como cloruro de sodio y carbonato de sodio que son solubles en agua, octanoato de sodio, la sal sódica del ácido octanoico también es soluble en agua. Saponificación Saponificación es el término aplicado a la hidrólisis de las grasas con un álcali fuerte como lejía. Si tomamos una grasa derivada del aceite de palma (que contiene ácido palmítico) y se hidroliza con hidróxido de sodio, la reacción es: [C15H3lCO]3[C3H5O3] (s) + 3 NaOH (HQ) -----> 3 Cl5H3lCOONa (aq) + C3H5(OH)3 (aq) grasa (s) + 3 lejía (aq) -----> 3 palmitato de sodio (aq) + glicerol (aq) Si bien esta reacción puede parecer intimidante debido a la fonnulas largo, es, de hecho, muy simple. lt se podría escribir en general, como: [RCO]3[C3H5O3] (s) + 3 NaOH (aq) -----> 3 RCOONa (aq) + CH2OH.CHOH.CH2OH (aq) donde "R " es alguna cadena de carbono del hidrógeno a largo. Si usted busca en una lista de ingredientes en un jabón, encontrará cosas como "estearato de sodio," o "palmitato de sodio", Esto es simplemente especificando los ácidos grasos en particular en la jabón. Cuando la grasa se introduce en una solución de jabón, la cola no polar de los ácidos grasos se disuelve en la grasa no polar, dejando al final de oxígeno soluble en agua en la superficie de la grasa glóbulo. Con suficiente jabón, estos glóbulos de grasa se cubren con un agua solub1e revestimiento y se dispersan a lo largo de la solución, al igual que en la última cifra. Ellos no son realmente disuelto desde individuales moléculas de grasa no se dispersan en la solución. Más bien, el la grasa se emulsiona. REFLEXIÓN SOBRE EL CONTENIDO DEL MÓDULO PARSEL Creo que la teoría inherente en el proceso de saponificación, que es inherente a un contexto más amplio de la química orgánica, es difícil de entender para los estudiantes que no tienen una base adecuada para abordar este tema, así que creo que es más apropiado para los estudiantes de bacchillerato que para los estudiantes de ocho. Desde la perspectiva de la química orgánica en el proceso de saponificación es bastante complejo, porque la saponificación es una reacción química entre un ácido graso (o un lípido saponificable, portador de residuos de ácidos grasos) y una base o alcalino, en la que se obtiene como principal producto la sal de dicho ácido y de dicha base. Estos compuestos tienen la particularidad de ser anfipáticos, es decir tienen una parte polar y otra apolar (o no polar), con lo cual pueden interactuar con sustancias de propiedades dispares. Por ejemplo, los jabones son sales de ácidos grasos y metales alcalinos que se obtienen mediante este proceso. El método de saponificación en el aspecto industrial consiste en hervir la grasa en grandes calderas, añadiendo lentamente sosa cáustica (NaOH), agitándose continuamente la mezcla hasta que comienza esta a ponerse pastosa. La reacción que tiene lugar es la saponificación y los productos son el jabón y la glicerina: Grasa + sosa cáustica → jabón + glicerina Antes que nada habria que dirimir entre un lipido saponificable y uno insaponificable a pesar que los enlaces son muy similares existe una diferencia entre los enlaces covalentes de sus elementos. Un lípido saponificable sería todo aquel que esté compuesto por un alcohol unido a uno o varios ácidos grasos (iguales o distintos). Esta unión se realiza mediante un enlace éster, muy difícil de hidrolizar. Pero puede romperse fácilmente si el lípido se encuentra en un medio básico. En este caso se produce la saponificación alcalina. En los casos en los que para la obtención del jabón se utiliza un glicérido o grasa neutra, se obtiene como subproducto el alcohol llamado glicerina, que puede dar mayor beneficio económico que el producto principal.En el ejemplo de arriba una molécula de un lípido es tratada con dos de hidróxido de potasio; se obtienen dos moléculas de palmitato de potasio (un jabón) y una de glicerina.La acción limpiadora del jabón se debe a su poder emulsionante, esto es, su habilidad para suspender en agua sustancias que normalmente no se disuelven en agua pura. La cadena hidrocarbonada (parte hidrofóbica) de la sal (el jabón), tiene afinidad por sustancias no polares, tales como las grasas de los alimentos. El grupo carboxilato (parte hidrofílica) de la molécula tiene afinidad por el agua.En la solución de jabón, los iones carboxilato rodean a las gotas de grasa: sus partes no polares se ubican (disuelven) hacia adentro, mientras que los grupos carboxilatos se ordenan sobre la superficie externa. Así, reducidas a volúmenes muy pequeños, las gotas pueden asociarse con las moléculas de agua y se facilita la dispersión de la grasa. Estas pequeñas gotas que contienen las partículas no polares rodeadas de aniones carboxilato se denominan micelas. Es la presencia de estos aniones carboxilato la que hace que las superficies de las micelas estén cargadas negativamente y se repelan entre sí, impidiendo la coalescencia y manteniendo la emulsión, es decir la dispersión en gotas muy finas.Un exceso de ácidos grasos en el jabón hace que éste sea opaco y de consistencia lechosa.Cuando se hace un jabón mediante un procedimiento en frío, el jabón saldrá opaco, aunque hayamos sido muy precisos en la medida de álcalis y aceites, ya que este proceso rara vez produce el calor suficiente para neutralizar por completo los ácidos grasosEl proceso en caliente incorpora el calor de la cocina al calor químico producido por la saponificación. Este calor añadido une todos los ácidos grasos con el álcali y como resultado tenemos un jabón transparente y neutro.La saponificación es una reacción química que produce calor, y cuanto más calor produzca más completa será la saponificación.