comités de ética en investigación - Diplomados y Cursos
Anuncio

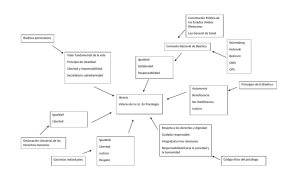
COMITÉS DE ÉTICA EN INVESTIGACIÓN Columba Suinaga Romero de Terreros. Es licenciada en Derecho por el Instituto Tecnológico Autónomo de México (ITAM), Experta Universitaria en Bioética por la Universidad Ramón Llull de Barcelona, cursó un postgrado en dirección y gestión de proyectos para organizaciones no lucrativas en la Universidad Ramón Llull de Barcelona y la Fundación Perè Tarrès. Fue miembro del Comité Ético de Investigación Clínica de las Islas Baleares en España. Ha realizado cursos en Buenas Prácticas Clínicas para estudios de investigación en el Instituto Borja de Bioética acreditados por la Comisión de formación continuada del Sistema Nacional de Salud Español. Ha impulsado diversos proyectos para la defensa de los derechos de los pacientes en España, fue directora de la asociación de pacientes STILL, para la defensa de los derechos de los afectados por el trastorno por déficit de atención e hiperactividad (TDAH). Ha participado en diversos foros de pacientes como el European Patient Forum y el Foro Español de los pacientes. Ha impartido cursos y conferencias relacionados con los derechos de los pacientes. Ha organizado y participado en congresos y jornadas sobre TDAH y derechos de los pacientes y bioética. Lic. Sandra L. Carrizosa Guzmán Licenciada en Derecho por la Universidad Nacional Autónoma de México. Especialista en Derecho Constitucional por el Posgrado de la Facultad de Derecho de la UNAM. Ambos grados obtenidos con mención honorífica. Tiene experiencia como abogada postulante tanto en el ámbito público como en el privado. De 2008 a 2011 formó parte del grupo de abogados del Hospital General “Dr. Manuel Gea González”, donde participó como miembro del Comité de Ética en Investigación y el Comité Hospitalario de Bioética. Actualmente forma parte de la Dirección de Planeación y Desarrollo Académico de la Comisión Nacional de Bioética donde se desempeña como Subdirectora de Ética en Políticas Públicas en Salud realizando estudios, asesorías e intervenciones en la configuración de políticas públicas con el objetivo de promover la inclusión de aspectos éticos y bioéticos. Actualmente, se encuentra desarrollando el Modelo de análisis bioético de políticas públicas en salud. Mtra. Dalia Méndez Ortega Médico Cirujano por la Universidad Autónoma de Tamaulipas; Máster en Bioética y Derecho: Problemas de Salud y Biotecnología por la Universidad de Barcelona. Especialista en Derechos Humanos por la Universidad de Castilla la Mancha, organizado por la Universidad de Castilla la Mancha y la Comisión Nacional de Derechos Humanos y Máster Universitario en Derecho Constitucional por la Universidad de Castilla la Mancha. Participó como Tutora del Máster en Bioética y Derecho de la Universidad de Barcelona y actualmente es miembro del Comité Hospitalario de Bioética del Hospital General de México. Dra. Garbiñe Saruwatari Zavala Licenciada en Derecho por la Universidad Iberoamericana. Maestra en Bioética por la Universidad Nacional de Cuyo (Mendoza, Argentina) y la Organización Panamericana de la Salud. Doctoranda en Derechos Humanos por la Universidad Nacional de Educación a Distancia de España (Madrid, España). Actualmente se desempeña como Jefe del Departamento de Estudios Jurídicos, Éticos y Sociales del Instituto Nacional de Medicina Genómica (INMEGEN). Es Presidente del Comité de Ética en Investigación del INMEGEN. Ha sido integrante de los Comités de Bioética del Instituto Nacional de Enfermedades Respiratorias y de la Clínica San Rafael. Se desempeñó como Jefe de Departamento de Vinculación en la Comisión Nacional de Arbitraje Médico [20082010]. Asimismo, como Investigadora en la Comisión Nacional de los Derechos Humanos [2002-2008]. Fue Profesora de asignatura en el Departamento de Derecho de la Universidad Iberoamericana [2004-2006]. DESCRIPCIÓN GENERAL En México la Comisión Nacional de Bioética ha iniciado el camino para vincular los avances científicos y tecnológicos al campo de los derechos humanos. En este contexto, el campo de la salud adquiere especial relevancia, por ello se ha promovido la necesidad de constituir comités de ética en investigación y comités hospitalarios de bioética en los centros de investigación y de atención sanitaria. Los comités de ética en investigación son órganos colegiados autónomos, institucionales, interdisciplinarios, plurales y de carácter consultivo, creados para evaluar y dictaminar protocolos de investigación en seres humanos. Así mismo los comités hospitalarios de bioética impulsarán el desarrollo de una cultura bioética en sus centros guiando su actuación de tal forma que derive en una “manera de hacer” y un compromiso de sus profesionales con los pacientes y sus familias. Ayudarán sin duda a mejorar la calidad de la atención sanitaria, con una mejora significativa de los procesos asistenciales, incidiendo también en la calidad de la gestión de las organizaciones sanitarias, haciéndolos más eficaces y eficientes. Conforme a lo dispuesto en los artículos 41 Bis y 98 de la Ley General de Salud, los establecimientos para la atención médica del sector público, social o privado del Sistema Nacional de Salud, en donde se realice investigación en seres humanos y se brinde atención sanitaria, están obligados a contar con comités. La obligación legal de implementar estos comités en todos los centros de salud públicos, sociales y privados, se publicó en el Diario Oficial de la Federación de 14 de diciembre 2011. 1. Fundamentación bioética y los principios bioéticos en la investigación Antecedentes: Código de Nuremberg, Informe Belmont, Declaración de Helsinki. 2. Documentos, normas y códigos éticos más relevantes para la investigación clínica a nivel internacional La norma de Buenas Prácticas Clínicas de la ICH Convenio de Oviedo del Consejo de Europa. Recomendaciones de la CIOMS (investigación trasnacional en países con pocos recursos) 3. Marco Jurídico Mexicano de la Investigación Clínica Marco jurídico. Competencias de COFEPRIS Competencias de CONBIOETICA 4. La importancia del consentimiento informado en la Investigación clínica. Concepto de consentimiento Informado. Responsabilidad jurídica. 5. Los Comités de Ética en Investigación Concepto y funciones de los Comités de Ética en Investigación 6. Los Protocolos de Investigación Ejemplos de aplicación práctica de los principios éticos básicos en la investigación clínica. Aspectos metodológicos Principios éticos básicos y su relación con los aspectos metodológicos del ensayo clínico. La Investigación en menores y otros grupos vulnerables 7. Aspectos legales y aspectos científicos de los ensayos clínicos. Funcionamiento interno: procedimientos y notificaciones Seguro e indemnización Registro Evaluación científica del protocolo de un ensayo clínico: seguridad y eficacia en los ensayos. 8. Buenas prácticas clínicas. Principios de la buena práctica clínica Las BPC, garantía de calidad: CEI, Competencia del investigador, comunicaciones, reportes de seguridad, de suspensión del estudio, efectos adversos, problemas imprevistos, etc. 9. Conflictos de interés en la investigación clínica Actores de los ensayos clínicos: Autoridad regulatoria, patrocinador, investigador, CEI, participantes. 10. La protección de datos personales en los ensayos clínicos. Datos de salud: sensibles y con especial protección. Muestras biológicas ( análisis genéticos) 20 horas