Montelukast a niños menores de 5 años
Anuncio

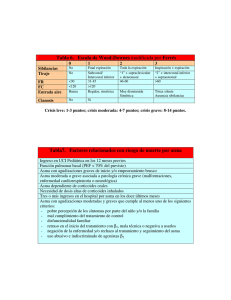
Montelukast a niños menores de 5 años Dra. Nora Ernestina Martínez Aguilar Pediatra, inmuno-Alergóloga. Investigadora Clínica. Maestra en Ciencias en Investigación Clínica. Doctor en Ciencias en Investigación en Medicina. Asesor externo de la maestría de Investigación Clínica. ESM, IPN. Investigador-colaborador en el Instituto Nacional de Medicina Genómica e Instituto Nacional de Salud Pública. Ponente en cursos nacionales e internacionales. Montelukast a niños menores de 5 años Índice Montelukast a niños menores de 5 años © 2014 Laboratorios Liomont, SA de CV Carretera México Toluca 5420, piso 12, El Yaqui, 05320, México, DF Editado y producido por Nieto Editores José Martí 55, Escandón, 11800, México, DF www.nietoeditores.com.mx Introducción Leucotrienos Receptores de los leucotrienos Antagonistas de los receptores de leucotrienos Montelukast Metabolismo del montelukast Eficacia y seguridad Indicaciones de montelukast Montelukast en asma, en menores de 5 años Montelukast en bronquiolitis y otros procesos respiratorios virales en menores de 5 años Montelukast en asma inducida por ejercicio Montelukast en asma inducida por antiinflamatorios no esteroides Montelukast en apnea obstructiva del sueño Montelukast como inmunomodulador Eficacia y seguridad de montelukast en niños menores de 5 años Montelukast en menores de 6 meses de edad Referencias 1 2 4 5 6 6 7 8 8 10 13 14 14 15 16 16 18 Introducción Muchos lactantes y niños en edad preescolar experimentan episodios recurrentes de síntomas bronquiales, sobre todo sibilancias y tos, que se traducen en asma y comienzan a los pocos meses de vida, principalmente durante una infección de las vías respiratorias inferiores. Así, el asma es la enfermedad crónica más frecuente en este grupo de edad. Los síntomas y las exacerbaciones pueden ser desencadenados por infecciones virales, alergenos, ejercicio, humo del tabaco y aire de mala calidad.1 Figura 1. Papel central de los leucotrineos en el asma De acuerdo con la fisiopatología, el asma es un por virus, es decir, del asma en particular y de la proceso inflamatorio crónico en el que participan alergia en general.2,3 La terapéutica actual indica diferentes células y componentes celulares. Los que al bloquear los receptores de los cisteinil-leucisteinil-leucotrienos son importantes mecotrienos se bloquea su acción y los efectos diadores inflamatorios en los procesos que de ellos derivan. Es decir, los antaEl asma es alérgicos que juegan un papel relevanla enfermedad gonistas de los receptores de leucotriete en la patogénesis y progresión de la nos previenen la inflamación en la vía crónica más enfermedad, de la broncoconstricción aérea, disminuyen los síntomas nocturinducida por el ejercicio, por aspirina o frecuente en este nos del asma, mejoran los valores de la grupo de edad. 1 función pulmonar, reducen el requerimiento de agonistas -β2 adrenérgicos y de corticoesteroides inhalados, así como la frecuencia y gravedad de las exacerbaciones en el asma. También mitigan la respuesta temprana y tardía desencadenada por alergenos o virus y la broncoconstricción secundaria al ejercicio, reducen el número de eosinófilos en el esputo y suero y bloquean la reacción inducida por la aspirina o por cambios de temperatura. Montelukast es un tratamiento alternativo para pacientes con asma y puede agregarse a los corticoesteroides inhalados. Por su mecanismo de acción se ha comprobado su efecto en otras enfermedades alérgicas en las que participan los cisteinil-leucotrienos.1-4 Leucotrienos Los leucotrienos, derivados del metabolismo del ácido araquidónico, son mediadores potentes de la inflamación. Inicialmente se conocieron como sustancia de reacción lenta de la anafilaxia (SRSA) y, posteriormente, se denominaron “leucotrie- 2 Figura 2. Los leucotrineos pueden liberarse directamente en el medio extracelular y no ser metabolizados por otras células. nos” porque la fuente original fueron los leucocitos. El leucotrieno B4 (LTB4) fue el primero en aislarse, posteriormente LTC4, LTD4, LTE4 y por último las lipoxinas.3,5-8 Los LTC4 y LTD4 son, aproximadamente, 2000 a 5000 veces más potentes que la histamina. Incluso, se refiere que los leucotrienos pueden ser incluso 9500 veces más potentes, mientras LTE4 es Figura 3. Los leucotrineos participan en diferentes etapas de la fisiopatología del asma. 30 a 100 veces más potente que la histamina en su efecto broncoconstrictor. LTD4 también tiene un efecto mayor que la metacolina.5-8 también, para la producción de LTB4 por las células epiteliales bronquiales, aún a pesar de que la enzima 5-lipoxigenasa esté ausente.9,10 Los LTA4 pueden liberarse directamente en el medio extracelular y no ser metabolizados por otras células (biosíntesis transcelular). Esta vía resulta, Los leucotrienos participan en diferentes etapas de la fisiopatología del asma, en relación con la mayor secreción de moco o la disminución del 3 transporte de éste, en la producción de broncoespasmo, en la inducción de la proliferación de células proinflamatorias, en la quimiotaxis de eosinófilos, en la liberación de la proteína catiónica eosinofílica, en el daño celular, el edema y en la activación de los nervios sensoriales. Gracias a la investigación farmacéutica se han desarrollado moléculas capaces de inhibir la acción de los cisteinil-leucotrienos, que bloquean a los receptores o impiden la síntesis de éstos por inhibición de la 5-lipooxigenasa. La eficacia clínica de estos fármacos en el asma, específicamente del montelukast, ha sido ampliamente estudiada y demostrada en diferentes estudios.1,9,10 Receptores de los leucotrienos Los cisteinil-leucotrienos son una familia de mediadores inflamatorios potentes de lípidos sintetizados a partir del ácido araquidónico por una variedad de células, incluidas las cebadas, neutrófilos, eosinófilos, basófilos plaquetas, células 4 vasculares y macrófagos. La familia incluye: leucotrieno C4, D4 y E4, que son mediadores biológicos potentes en la fisiopatología de las enfermedades inflamatorias y desencadenantes de la broncoconstricción a través de la interacción específica con receptores de superficie celular, pertenecientes a la superfamilia de los receptores acoplados a la proteína G. Actúan mediante el reconocimiento por sus receptores (CysLTRs), son de dos tipos: CysLTR1 y CysLTR2. Los receptores de CysLTR1 se expresan, principalmente, en células de músculo liso, células cebadas, macrófagos pulmonares intersticiales de los pulmones y el bazo.3,9,11 Los receptores de CysLTR2 se encuentran en el corazón, cerebro, hipotálamo, tálamo, putamen, pituitaria, médula y en las glándulas suprarrenales. En los procesos inflamatorios secundarios a una lesión vascular cerebral (por isquemia cerebral o hipoxemia), como la isquemia inducida por la oclusión de la arteria cerebral media, lesión neuronal y proliferación tardía del astrocito, pue- den encontrarse involucrados ambos receptores (CysLTR1 y CysLTR2).12-16 Los eosinófilos desempeñan un papel fundamental en el proceso de la inflamación crónica asociada con el asma y los cisteinil-leucotrienos aumentan la supervivencia de los eosinófilos en respuesta a las señales paracrinas de los mastocitos y linfocitos. Los cisteinil-leucotrienos se han encontrado sobreexpresados en diferentes enfermedades: rinitis alérgica, rinosinusitis, rinoconjuntivitis, poliposis nasal y asma inducida por aspirina.3,9,12-15 Los leucotrienos activan a los CysLTR al producir la contracción del músculo liso, hipersecreción de moco, reclutamiento de células inflamatorias, permeabilidad vascular, producción de moco, disfunción neuronal y remodelación de las vías respiratorias. Por ello, uno de los tratamientos significativos es el bloqueo de los receptores de cisteinil-leucotrienos para evitar que se produzcan esos efectos. Antagonistas de los receptores de leucotrienos Figura 4. Los cisteinil-leucotrineos aumentan la supervivencia de los eosinófilos en respuesta a las señales paracrinas de los mastocitos y linfocitos. 5 Los tratamientos actuales con antileucotrienos incluyen: bloqueadores de los CysLTR como montelukast, zafirlukast y pranlukast e inhibidores de la 5 lipo-oxigenasa, como zileutón. En el caso del asma y otros procesos alérgicos, como la rinitis, la eficacia de montelukast ya se ha demostrado y en otros padecimientos aún se encuentra en experimentación.16 Montelukast trienos. El tratamiento con montelukast se incluye en las diferentes guías internacionales.1,4,14 Montelukast (Figura 5) es un potente y selectivo antagonista para CysLTR1 activado por LTD4. El metabolismo oxidativo de montelukast incluye sulfoxidaciones y metilhidroxilaciones, y solo es catalizado por el citocromo P450. Los resultados experimentales indican que CYP3A4 cataliza la sulfoxidación y la 21-hidroxilación, mientras que CYP2C9 media selectivamente la metil- hidroxilación,17 lo que permite el antagonismo eficaz de las actividades proasmáticas y pro-inflamatorias de los cisteinil-leucoO CI O S N O Figura 5. Estructura química del montelukast. 6 La evidencia reciente sugiere que montelukast posee una serie de actividades antiinflamatorias secundarias, aparentemente no relacionados con el antagonismo de los CysLTR1. Estos incluyen la inhibición de las enzimas 5-lipoxigenasa, histona-acetiltransferasa, y adenosina 3´-5´monofosfato-cíclico (cAMP) fosfodiesterasa, así como la interferencia con los receptores P2Y purinérgicos y la inhibición de la adherencia de los eosinófilos al endotelio vascular y su migración.17 Metabolismo del montelukast Montelukast se metaboliza en el ser humano, con una pequeña fracción de la dosis excretada como fármaco original en la bilis. Los principales metabolitos identificados en las muestras de plasma y bilis de los animales de experimentación y en humanos son: 1) acil-glucurónido (M1); 2) sulfóxidos diastereoisómeros (M2a y M2b, cada configuración aún por identificar); 3) metabolitos diastereoméricos hidroxilados (M5a y M5b de isómeros S y R, respectivamente); y 4) los metabolitos diastereoméricos metil-hidroxilados (M6a y M6b; configuración aún por identificar) .18 El citocromo P450 juega un papel exclusivo en la catálisis del metabolismo oxidativo de montelukast, mediante la hidroxilación regioselectiva por CYP3A4 y CYP2C9: CYP3A4 se cataliza, selectivamente, la sulfoxidación y la 21-hidroxilación, mientras que CYP2C9 interviene en la metil-hidroxilación. No inhibe las isoenzimas CYP2C9 y CYP3A4 del citocromo P450, por lo que tiene menos interacciones que otros antagonistas de los receptores de leucotrienos.18 Eficacia y seguridad En un metanálisis realizado por Hon KL y su grupo a propósito de la eficacia clínica y seguridad 7 de montelukast, se llegó a las siguientes conclusiones:19 • La mayor parte de los estudios confirman la utilidad de montelukast en monoterapia o como tratamiento adicional a ICS en el asma leve a moderada en la infancia y en todos los grupos de edad. Puede ser una alternativa eficaz y segura en el control del asma, incluso con su uso a largo plazo. • Las ventajas de montelukast incluyen: mínimos efectos secundarios y adversos, rápido inicio de acción y efecto pico. • El hecho de que la medicación se administra por vía oral una vez al día permite la satisfacción del paciente y el cumplimiento, especialmente en la de edad pediátrica. Montelukast tiene un lugar importante en el tratamiento de niños con sibilancias desencadenadas por virus, asma inducida por el ejercicio y en los niños cuyos padres son esteroide-fóbicos y en- cuentran que el tratamiento con corticoesteroides es inaceptable. El montelukast puede conducir a una reducción en las visitas de atención médica, ahorro económico en la atención a la salud, mejor control del asma y reducción de la cantidad de tiempo fuera de la escuela y del trabajo.19 Indicaciones de montelukast Está indicado en diferentes padecimientos: rinitis alérgica, rinosinusitis, rinoconjuntivitis, poliposis nasal, asma inducida por aspirina, por ejercicio y por procesos virales. También se ha empleado en otros procesos, como: urticaria, dermatitis, bronquiolitis obliterante, displasia broncopulmonar y enfermedad pulmonar intersticial.1,4,17,20 1. La eficacia de montelukast se ha probado en diversos estudios en los que mejora significativamente el FEV1 y el FEV1-FVC en pacientes con asma leve a moderada: niños de 6-13 años después de 6 semanas de tratamiento.21 La realización de espirometrías antes de esta edad resulta complicada; sin embargo, los estudios clínicos, doble ciego y con placebo han permitido probar la efectividad de montelukast en niños menores de 5 años. 2. Montelukast oral (4 mg), administrado una vez al día, es un tratamiento eficaz para el asma persistente en niños de 2 a 5 años y es generalmente bien tolerado y sin efectos adversos clínicamente significativos, mejora diferentes parámetros de control del asma.22 3. Montelukast brinda protección contra la broncoconstricción inducida por la hiperventilación con aire frío y seco, en niños asmá- Montelukast en asma, en menores de 5 años 8 ticos de 3-5 años, disminuye la hiperreactividad de la vía aérea. El efecto broncoprotector fue independiente del tratamiento concomitante con corticoesteroides.23,24 y mínimas o nulas interacciones con alimentos o medicamentos, hace de montelukast una solución al problema del tratamiento del asma en niños de 2-5 años.27 4. En niños de 2-5 años, con asma persistente, montelukast disminuye los síntomas y en 30% las exacerbaciones.22 8. El tratamiento para el asma en niños menores de 5 años con antagonistas de los receptores de leucotrienos, como montelukast, está indicado y ha sido aprobado en diferentes guías y consensos nacionales e internacionales. Entre estas guías terapéuticas están: el consenso PRACTALL (Practicing Allergology), las guías GINA (Global Initiative for Asthma), las guías GEMA (Guía Española para el Manejo del Asma), guías NAEPP (National Asthma Education and Prevention Program), Guías Mexicanas de Asma y Alergias en niños: recomendaciones prácticas del Programa Alergia Finlandés 2008-2018 para la prevención, diagnóstico y tratamiento, por mencionar algunas.1,4,28-31 5. Dado el gran solapamiento en los fenotipos de los niños con sibilancias y el hecho de que los pacientes pueden pasar de un fenotipo a otro, los corticoesteroides inhalados y el montelukast pueden considerarse una prueba terapéutica en casi cualquier niño en edad preescolar con sibilancias recurrentes.25 6. La evidencia sugiere que montelukast es eficaz como monoterapia en niños con asma leve.26 7. El apego al tratamiento, por ser oral y una sola dosis al día, así como su eficacia y seguridad 9 9. De esta forma, también ha sido aprobada la indicación de montelukast para rinitis alérgica, por las guías ARIA (Allergic Rhinitis and its Impact on Asthma) y en otras Guías terapéuticas para el tratamiento de procesos alérgicos.1,4,28,30-32 Montelukast en bronquiolitis y otros procesos respiratorios virales en menores de 5 años La bronquiolitis aguda es una importante causa de morbilidad en lactantes y preescolares. Es la causa más común de hospitalizaciones debidas a infecciones de las vías respiratorias bajas en este grupo de edad. De acuerdo con la Academia Americana de Pediatría, la bronquiolitis es la: “inflamación aguda, edema y necrosis de las células epiteliales que recubren la vía aérea pequeña, con aumento en la producción de moco y broncoespasmo”. Otra definición complementaria es “… el primer episodio de sibilancias en un niño menor de 12 a 24 meses que tiene las características clínicas de una infección respiratoria viral, sin otra explicación para la respiración sibilante como la neumonía o la atopia” .33 Figura 6. Papel central de los leucotrineos en el asma La bronquiolitis es provocada típicamente por una infección viral. En las secreciones respiratorias (aspirados nasofaríngeos) se han identificado múltiples agentes virales causantes de la bronquiolitis aguda: el virus sincitial respiratorio (VSR), rinovirus, virus parainfluenza, virus de la influenza, adenovirus y coronavirus. El VSR es la causa más común, representa 50-80% de los casos de bronquiolitis.33,34 10 La mayoría de los niños con bronquiolitis tiene taquicardia y taquipnea. La oximetría de pulso nos ayuda a la hora de decidir acerca de la necesidad de oxígeno suplementario. El tórax puede parecer hiperextendido e hiperresonante a la percusión. A través de los pulmones pueden escucharse sibilancias y crepitaciones finas. Los pacientes gravemente afectados tienen retracción marcada. Pueden tener cianosis y problemas de perfusión. La apnea puede ocurrir en los prematuros y en menores de dos meses de edad. Otros problemas asociados que pueden ocurrir en niños con bronquiolitis incluyen: conjuntivitis, otitis media y faringitis.33 La causa de las sibilancias en lactantes y preescolares casi siempre es por virus (bronquiolitis) y suelen desaparecer hacia la edad escolar. Sin embargo, durante este tiempo el problema puede empeorar y causa gran angustia en los padres. El Índice Predictivo del Asma (IPA) [Cuadro 1] ayuda a predecir la evolución y tomar decisiones terapéuticas. Si las sibilancias aparecen después de los 18-24 meses, sin causa que las justifique y el 11 Cuadro 1. Índice Predictivo de Asma (IPA) Criterios mayores - Diagnóstico médico de asma en alguno de los padres. - Diagnóstico médico de eccema atópico. - Sensibilización a algún aeroalergeno. Criterios menores - - - - Rinitis alérgica diagnosticada por un médico (a los 2-3 años). Sibilancias no relacionadas con resfriados. Eosinofilia en sangre periférica igual o superior al 4%. Sensibilización a leche, huevo o cacahuate. Características del Índice Predictivo de Asma (IPA) - - - Lactantes con más de tres episodios de sibilancias al año durante los primeros tres años de vida que cumplen un criterio mayor o dos criterios menores. Sensibilidad 16% y especificidad 97%. Valor predictivo positivo del 77% y valor predictivo negativo del 68%, respecto a lactantes con sibilancias recurrentes para el inicio de asma en edad escolar (6-13 años) Tomado de las Guías Españolas para el Manejo del Asma. GEMA, 2009 IPA es positivo, es bastante probable el diagnóstico de asma atópica, pero relacionada con un proceso viral. En cambio, si se inician en el primer año de vida, son desencadenadas por virus y el IPA es negativo, quizá desaparecerán en unos años. Ello dependerá, también, de la exposición a otros detonantes (contaminantes, humo de cigarro, biomasa) o complicaciones relacionadas y la evaluación pulmonar (Cuadros 2 y 3).28, 34 Cuadro 3. Evaluación de la gravedad de la exacerbación de asma en niños, integrando la evaluación pulmonar y la saturación de oxígeno Pulmonary Score SaO2 Leve 0-3 >94% Moderada 4-6 91 - 94% Grave 7-9 <91% SaO2 : saturación de oxihemoglobina. En caso de discordancia entre la puntuación clínica y la saturación de oxígeno se utilizará el de mayor gravedad, Guías Españolas para el Manejo de Asma. GEMA, 2009 Cuadro 2. Evaluación pulmonar en asma (Pulmonary score) Puntuación 0 Frecuencia respiratoria < 6 años > 6 años < 30 < 20 Sibilancia No Uso del músculo esternocleidomastoideo No 1 31-45 21-35 Final de la espiración Incremento leve 2 46-60 36-50 Toda la espiración (estetoscopio) Aumentado 3 > 60 > 50 Inspiración y espiración sin estetoscopio** Actividad máxima * Se puntúa de 0 a 3 en cada uno de los apartados (mínimo 0, máximo 9). ** Se no hay sibilancias y la actividad del músculo esternocleidomastoideo está aumentada, puntuar el apartado “sibilancias” con un 3. Guías Españolas para el manejo de Asma. GEMA, 2009. 12 Montelukast puede indicarse a lactantes y preescolares con sibilancias recurrentes desencadenadas por infecciones virales, suspendiendo su uso si no se obtiene respuesta.34-36 Montelukast sólo o asociado al tratamiento antiasmático habitual puede ser útil en algunos preescolares cuando se administra en los meses de alta incidencia de infecciones virales, ya que éstas son un desencadenante importante de exacerbaciones en la infancia.34-36 En preescolares con sibilancias producidas por múltiples desencadenantes y síntomas leves persistentes, puede considerarse una prueba terapéutica con montelukast como alternativa a los corticoesteroides inhalados o combinada con ellos.4-35 Montelukast en asma inducida por ejercicio Además de su indicación como medicamento controlador del asma alérgica y la inducida por virus, disminuye también la hiperreactividad bronquial y evita la obstrucción bronquial inducida por la actividad física en la escuela antes y en edad escolar. El ejercicio induce un síndrome de broncoconstricción que se produce en un grupo susceptible de sujetos con desprendimiento epitelial, con sobreproducción de eicosanoides inflamatorios e infiltración de eosinófilos y células cebadas en las vías respiratorias. El ejercicio favorece la pérdida de agua de las vías respiratorias, que conduce a la circulación de agua desde el epitelio para corregir el cambio transitorio en la osmolaridad. Aunque el mecanismo preciso por el que la pérdida de agua conduce a la activación de los leucocitos no se conoce, es evidente que el ejercicio inicia la liberación de mediadores inflamatorios, cisteinilleucotrienos por los leucocitos, células cebadas y eosinófilos. Esto justifica el adecuado efecto terapéutico que ejercen los antagonistas de los receptores de leucotrienos (montelukast) en el asma inducida por ejercicio.36 13 Montelukast en asma inducida por antiinflamatorios no esteroides El asma inducida por antiinflamatorios no esteroides, principalmente la que se refiere a la exacerbada por aspirina, suele diagnosticarse en la edad adulta y se compone de: asma, rinosinusitis crónica con poliposis nasal y reacciones respiratorias agudas luego de la ingestión de AINES. Se asocia con marcada eosinofilia en la sangre y esputo, y con aumento en la producción de cisteinil-leucotrienos, principalmente LTC4, por lo que la terapia con antagonistas de los receptores de leucotrienos (montelukast) es benéfica en los pacientes con asma por AINES y otros fenotipos comentados, como el asma por ejercicio, en pacientes obesos y asma en fumadores.37,38 Montelukast en apnea obstructiva del sueño El síndrome de apnea obstructiva del sueño en los niños es un trastorno con una prevalencia a la alta, causado por un conjunto de procesos fisiopatológicos complejos, lo que lleva a la disfunción de la vía aérea superior durante el sueño recurrente. La relevancia clínica del síndrome de apnea obstructiva del sueño reside en su asociación con comorbilidades importantes que afectan a los sistemas cardiovascular, neurocognitivo y metabólico. Las decisiones terapéuticas deben integrar la magnitud de los síntomas, la existencia o no de factores de riesgo y signos de morbilidad así como los resultados de la polisomnografía.39 El tratamiento de primera línea en niños con hipertrofia amigdalina es la adenoamigdalectomía, 14 aunque cada vez hay más evidencia de que la terapia médica, con esteroides intranasales o montelukast, puede considerarse en el síndrome de apnea obstructiva del sueño.39 Montelukast como inmunomodulador Los cisteinil-leucotrienos se producen, predominantemente, por las células del sistema inmune innato, especialmente los basófilos, eosinófilos, mastocitos y monocitos-macrófagos. Se ha comentado ampliamente su actividad como un potente broncoconstrictor. Sin embargo, los cisteinil-leucotrienos tienen una actividad consecuentemente pro-inflamatoria debida a sus interacciones autocrinas y paracrinas sobre los receptores acoplados a la proteína G, expresados no sólo en los tipos de células mencionados, sino también en los linfocitos Th2, y en células estructurales y, en menor medida, a los neutrófilos y células CD8.40 El reconocimiento de la importancia del papel de los cisteinil-leucotrienos en la inmunopatogénesis de varios tipos de trastornos inflamatorios agudos o crónicos, especialmente el asma, impulsó el desarrollo de antagonistas selectivos contra los receptores de cisteinil-leucotrienos (CysLTR1), específicamente montelukast, pranlukast, y zafirlukast.40 Hace poco se documentó que estos agentes poseen actividades antiinflamatorias secundarias, distintas del antagonismo de los CysLTR1, eficaces particularmente en la orientación de los neutrófilos y monocitos-macrófagos. Los mecanismos subyacentes del montelukast incluyen: interferencia con la fosfodiesterasa del nucleótido cíclico, disminución de la actividad de la 5-lipooxigenasa de la actividad del factor de transcripción proinflamatorio nuclear kappa B y de la adhesión y migración de los eosinófilos.40 También reduce la desgranulación de los eosinófilos en las sibilancias postvirales y la cuenta total de eosinófilos.41 15 Eficacia y seguridad de montelukast en niños menores de 5 años En un trabajo realizado por Zou y su grupo (2014) se incluyeron 595 lactantes de 3 a 36 meses, que fueron hospitalizados debido a bronquiolitis por virus sincitial respiratorio y se dividieron al azar a dos grupos. Un grupo, al que se les administró montelukast sódico y otro grupo tratado con placebo, administrados sucesivamente para 28 días. Los resultados mostraron que el número de días sin síntomas en el grupo montelukast fue significativamente mayor que en el grupo de control, lo que indica que montelukast puede prevenir con eficacia los ataques de sibilancias recurrentes después de la infección aguda por virus sincitial respiratorio.42 En comparación con los glucocorticoides y otros medicamentos para el control de sibilancias clínicas comunes, montelukast es más seguro. En el estudio de Zou, 32 casos reportaron reacciones adversas. Estos efectos adversos estaban relacionados con: ansiedad y excitación (25%), 7 aumento de aminotransferasas (22%), cefalea (13%), diarrea (7%), rubor (6%), dolor abdominal (6%), eritema (6%), empeoramiento de la tos (6%), mareo (6%) y costalgia (3%). Todas estas reacciones adversas fueron leves y sus síntomas desaparecieron inmediatamente después de retirar el fármaco; en diferentes estudios se han demostrado resultados similares.19,42-44 Otros eventos reportados en niños de 2 a 5 años son excepcionales de heptotoxicidad (hepatitis colestática, daño hepatocelular y hepático mixto), fiebre, otitis, sinusitis, faringitis, dermatitis, varicela, urticaria, conjuntivitis, con una frecuencia ≥2% comparada con placebo.19,35, 42-45 Montelukast en menores de 6 meses de edad Kearns y sus colaboradores (2008) realizaron un estudio de farmacocinética en 12 niños de 1 a 3 meses de edad con bronquiolitis o antecedentes 16 de bronquiolitis y síntomas similares al asma con una dosis única de gránulos orales de montelukast 4 mg y la tolerabilidad de la administración diaria de 2 dosis diferentes de montelukast (4 mg y 8 mg administrados una vez al día durante 7 días) versus placebo. Tres pacientes tuvieron aumentos transitorios en la aspartato aminotransferasa relacionados con el fármaco (montelukast 8 mg [n = 2]; placebo [n = 1]). La administración de montelukast en 4 y 8 mg una vez al día durante 7 días a neonatos de 1 a 3 meses de edad fue generalmente bien toleradá.46 También se han realizado otros estudios piloto en niños con bronquiolitis en menores de seis meses, bronquiolitis obliterante, en niños con problemas respiratorios sin un diagnóstico definitivo de asma y en pacientes postrasplantados de pulmón.33,35,46-48 Puede indicarse con un agonista beta 2 de rescate.19,35 Los corticoesteroides inhalados pueden irse ajustando y reduciendo paulatinamente con el uso de montelukast.19,35 Los pacientes con asma inducida por AINES deben evitar los AINES.19,35,42-44 Los eventos neuropsiquiátricos, como: insomnio, agitación, agresividad, hostilidad, ansiedad, depresión, irritabilidad, sonambulismo, alucinaciones, pensamientos y conducta suicida, temblores, deben reportarse, a pesar de ser escepcionales.19,35, 42-45 Precauciones y advertencias El montelukast no está indicado para revertir los ataques agudos de asma, incluido el estado asmático. Pero puede continuarse su uso durante las exacerbaciones. 17 Referencias 1. Bacharier LB, Boner A, Carlsen KH, Eigenmann PA, Frischer T, Götz M, Helms PJ, Hunt J, Liu A, Papadopoulos N, Platts-Mills T, Pohunek P, Simons FER, Valovirta E, Wahn U, Wildhaber J, The European Pediatric Asthma Group* Artículo de revisión. Diagnóstico y tratamiento del asma en los niños y adolescentes: informe de consenso del PRACTALL. Allergy 2008;63:5-34. 2. Tse SM, Tantisira K, Weiss ST. The pharmacogenetics and pharmacogenomics of asthma therapy. Pharmacogenomics J 2011;11:383-92. 3. Brink C, Dahle ́n SE, Drazen J, Evans JF, Hay DW, Nicosia S, Serhan CN, Shimizu T, Yokomizo T. International Union of Pharmacology. XXXVII: Nomenclature for leukotriene and lipoxin receptors. Pharmacol Rev 2003;55:195-227. 10. Mastalerz L, Kumik J. Antileukotriene drugs in the treatment of asthma. Pol Arch Med Wewn 2010;120:103-8. 11. Bäck M, Dahlén SE, Drazen JM, Evans JF, Serhan CN, Shimizu T, Yokomizo T, Rovati GE. International Union of Basic and Clinical Pharmacology. LXXXIV: leukotriene receptor nomenclature, distribution, and pathophysiological functions. Pharmacol Rev 2011;63: 539-84. 12. Matsuse H , Hirose H, Fukahori S, Tsuchida T, Tomari S, Kawano T, Fukushima C, Kohno S. Regulation of dendritic cell functions against harmful respiratory pathogens by a cysteinyl leukotrienes receptor antagonist. Allergy Rhinol (Providence) 2012;3:e30-4. 13. Sardana N, Craig TJ. Congestion and sleep impairment in allergic rhinitis. Asian Pac J Allergy Immunol 2011;29:297-306. 14. Wentzel JL, Soler ZM, DeYoung K, Nguyen SA, Lohia S, Schlosser RJ. Leukotriene antagonists in nasal polyposis: a meta-analysis and systematic review. Am J Rhinol Allergy 2013;27:482-9. 4. Global Initiative for Asthma Management and Prevention GINA 2009. www.ginasthma.org. 15. 5. Weiss JW, Drazen JM, Coles N, McFadden ER Jr, Weller PF, Corey EJ, Lewis RA, Austen KF. Bronchoconstrictor effects of leukotriene C in humans. Science 1982;216:196-198. Singh R.K. Gupta S. Dastidar S. Ray A. Cysteinyl Leukotrienes and Their Receptors: Molecular and Functional Characteristics. Pharmacology 2010;85:336-349. 16. 6. Barnes NC, Piper PJ, Costello JF. Comparative effects of inhaled leukotriene C4, leukotriene D4 and histamine in normal human subjects. Thorax 1984;39:500-504. Currie GP, Srivastava P, Dempsey OJ, Lee DK.Therapeutic modulation of allergic airways disease with leukotriene receptor antagonists. QJM 2005;98:171-82. 17. 7. Adelroth E, Morris MM, Hargreave FE, O’Byrne PM. Airway responsiveness to leukotrienes C4 and D4 and to methacholine in patients with asthma and normal controls. N Engl J Med 1986; 315:480-484. Tintinger GR, Feldman C, Theron AJ, Anderson R. Montelukast: more than a cysteinyl leukotriene receptor antagonist? Scientific World Journal 2010;10:2403-13. 18. 8. Davidson AB, Lee TH, Scanlon PD, Solway J, McFadden ER Jr, Ingram RH Jr, Corey EJ, Austen KF, and Drazen JM. Bronchoconstrictor effects of leukotriene E4 in normal and asthmatic subjects. Am Rev Respir Dis 1987;135:333-337. Chiba M, Xu X, Nishime JA, Balani SK, Lin JH. Hepatic microsomal metabolism of montelukast, a potent leukotriene D4 receptor antagonist, in humans. Drug Metab Dispos 1997;25:1022-31. 19. Neves JS, Radke AL, Weller PF. Cysteinyl leukotrienes acting via granule membrane-expressed receptors elicit secretion from within cell-free human eosinophil granules. J Allergy Clin Immunol 2010;125:477-82. Hon KL, Leung TF, Leung AK. Clinical effectiveness and safety of montelukast in asthma. What are the conclusions from clinical trials and meta-analyses? Drug Des Devel Ther 2014;8:839-50. 20. Lenney W, Boner AL, Bont L, Bush A, Carlsen KH, et al. Medicines used in respiratory diseases only seen in children. Eur Respir J 2009;34:531-51. 9. 18 21. Visitsunthorn N, Chirdjirapong V, Santadilog S, Pajarn P, et al. The effect of montelukast on bronchial hyperreactivity and lung function in asthmatic children aged 6-13 years. Asian Pac J Allergy Immunol 2011;29:127-33. 31. Pelkonen AS, Kuitunen M, Dunder T, Reijonen T, Valovirta E, Mäkelä MJ; Finnish Allergy Programme. Allergy in children: practical recommendations of the Finnish Allergy Programme 2008-2018 for prevention, diagnosis, and treatment. Pediatr Allergy Immunol 2012;23:103-16. 22. Knorr B, Franchi LM, Bisgaard H, Vermeulen JH, et al. Montelukast, a Leukotriene Receptor Antagonist, for the Treatment of Persistent Asthma in Children Aged 2 to 5 Years. Pediatrics 2001;108:3 e48. 32. Larenas LD y col. Tratamiento del asma. Guía Mexicana de Asma 2009. Rev Alerg Mex 2013;60:184-92. 23. Bisgaard H, Nielsen KG. Bronchoprotection with a leukotriene receptor antagonist in asthmatic preschool children. Am J Respir Crit Care Med 2000;162:187-90. 33. Verma N, Lodha R, Kabra SK. Recent advances in management of bronchiolitis. Indian Pediatr 2013;50:939-49. 34. Úbeda-Sansano MI, Murcia-García J, Castillo-Laita JA. Sibilancias recurrentes en los primeros años de vida. Manejo en atención primaria. Documentos técnicos del GVR (publicación DT- GVR-4). Disponible en: www.aepap.org/gvr/protocolos.htm 35. Montella S, Maglione M, De Stefano S, Manna A, Di Giorgio A, Santamaria F. Update on leukotriene receptor antagonists in preschool children wheezing disorders. Ital J Pediatr 2012;26:29-38. 36. Hallstrand TS, Altemeier WA, Aitken ML, Henderson WR Jr. Role of cells and mediators in exercise-induced bronchoconstriction. Immunol Allergy Clin North Am 2013;33:313-28. 37. Cowburn AS, Sladek K, Soja J, Adamek L, et al. Overexpression of leukotriene C4 synthase in bronchial biopsies from patients with aspirin-intolerant asthma. J Clin Invest 1998;101:834-46. 38. Paggiaro P, Bacci E. Montelukast in asthma: a review of its efficacy and place in therapy. Ther Adv Chronic Dis 2011;2:47-58. 39. Tan HL, Gozal D, Kheirandish-Gozal L. Obstructive sleep apnea in children: a critical update. Nat Sci Sleep 2013;5:109-23. 40. Theron AJ, Steel HC, Tintinger GR, Gravett CM, Anderson R, Feldman C. Cysteinyl leukotriene receptor-1 antagonists as modulators of innate immune cell function. J Immunol Res 2014; 2014:608-930. 41. Kim CK. Eosinophil-derived neurotoxin: a novel biomarker for diagnosis and monitoring of asthma. Korean J Pediatr 2013;56:8-12. 42. Zou YX, Zhang J, Ma C, Li J, Zai J, Guo YS. Clinical efficacy of montelukast sodium in treating infantile wheezing. Eur Rev Med Pharmacol Sci 2014;18:775-80. 24. Hakim F, Vilozni D, Adler A, Livnat G, Tal A, Bentur L. The effect of montelukast on bronchial hyperreactivity in preschool children. Chest 2007;131:180-86. 25. Brand PL, Baraldi E, Bisgaard H, Boner AL, et al. Definition, assessment and treatment of wheezing disorders in preschool children: an evidence-based approach. Eur Respir J 2008;32:1096-110. 26. Wahn U, Dass SB. Review of recent results of montelukast use as a monotherapy in children with mild asthma. Clin Ther 2008;30 Spec No:1026-35. 27. Green RJ, Weinberg EG. Problems in the management of asthma in young children--a potential role for montelukast. S Afr Med J 2004;94:746-8. 28. Caballero-Martínez F, Plaza V, Quirce-Gancedo S, Fernández-Benítez M, et al. External assessment of the GEMA2009 recommendations by a multidisciplinary expert panel on asthma. Arch Bronconeumol 2010;46:411-9. 29. Kaya A, Erkocoglu M, Akan A, Vezir E, et al. TRACK as a complementary tool to GINA and NAEPP guidelines for assessing asthma control in preschool children. J Asthma 2014;51:530-5. 30. O´Laughlen MC, Rance K, Rovnyak V, Hollen PJ, Cabana MD. National A´sthma Education Prevention Program: survey of nurse practitioners’ knowledge, attitudes, and behaviors. J Pediatr Health Care 2013;27:e1724. 19 43. Ghosh G, Manglik Ak, Roy S. Efficacy and safety of montelukast as monotherapy in children with mild persistent asthma. Indian Pediatr 2006;43:780-785. 46. Kearns GL, Lu S, Maganti L, Li XS, Migoya E, Ahmed T, Knorr B, Reiss TF. Pharmacokinetics and safety of montelukast oral granules in children 1 to 3 months of age with bronchiolitis. J Clin Pharmacol 2008;48:502-11. 44. Jonas DE, Wines RCM, DelMonte M, Amick HR, et al. D rug Class Review: Controller Medications for Asthma: Final Update 1 Report. Portland (OR): Oregon Health & Science University; 2011 Apr. 47. Verleden GM, Verleden SE, Vos R, De Vleeschauwer SI, et al. Montelukast for bronchiolitis obliterans syndrome after lung transplantation: a pilot study. Transpl Int 2011;24:651-6. 45. Kocyigit A, Gulcan Oksuz B, Yarar F, Uzun F, Igde M, Islek I. Hallucination development with montelukast in a child with asthma: case presentation. Iran J Allergy Asthma Immunol 2013;12:397-9. 48. Smit HA, van der Wouden JC, Brunekreef B, Leufkens HG, Bracke M. Prescription of respiratory medication without an asthma diagnosis in children: a population based study. BMC Health Serv Res 2008;8:16. doi: 10.1186/1472-6963-8-16. 20