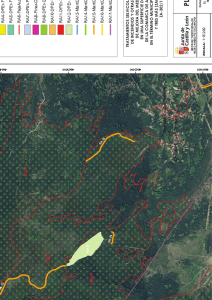
Informe - Osakidetza
Anuncio

COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS DE EUSKADI INFORME DE EVALUACIÓN DUTASTERIDA (DCI) NO APORTA NADA NUEVO Principio activo: DUTASTERIDA Nombre Comercial y presentaciones: AVIDART® (GLAXO SMITHKLINE, SA) 0,5 MG 30 CAPSULAS Condiciones de dispensación: Fecha de evaluación: Fecha de comercialización: Procedimiento de autorización: 34,56€ Con receta médica. Cupón precinto diferenciado. Julio 2005 Febrero 2004 Reconocimiento mutuo Grupo Terapéutico: G04C B: Fármacos usados en la hipertrofia prostática benigna. Inhibidores de la testosterona 5-αreductasa. Coste tratamiento/DDD (€): Dutasterida 1,15 Finasterida 0,96 0 0,2 0,4 0,6 0,8 1 1,2 1,4 Resumen: Dutasterida es un inhibidor de la enzima 5-α-reductasa, autorizada para el tratamiento de los síntomas de moderados a graves de la hiperplasia benigna de próstata (HBP), y para reducir en estos casos el riesgo de retención urinaria aguda, y la necesidad de cirugía. - Los ensayos clínicos realizados frente a placebo han mostrado su eficacia en cuanto a la reducción de los síntomas urinarios medidos mediante el índice AUA-SI (American Urological Association-Symptom Index), en la disminución de riesgo de retención aguda urinaria, y de cirugía relacionada con HBP, así como en la mejoría de la calidad de vida. Se puede tardar 6 meses en alcanzar una respuesta al tratamiento. - Los efectos adversos generalmente fueron leves o moderados. La incidencia fue del 19 % en los pacientes tratados con DT frente al 14 % en el grupo placebo. - Aunque no hay datos publicados de comparaciones directas frente a finasterida, la eficacia clínica de DT y finasterida parece comparable. No se dispone de estudios comparativos de DT frente a alfa bloqueantes adrenérgicos (doxazosina, alfuzosina, tamsulosina o terazosina). Por lo tanto, no parece que DT aporte ventajas sustanciales en el tratamiento de HBP. 1 Qué es: Dutasterida (DT) es un inhibidor de la enzima 5-α-reductasa, autorizado para el tratamiento de los síntomas de moderados a graves de la hiperplasia benigna de próstata (HBP), y reducir en estos casos el riesgo de retención aguda de orina, y la necesidad de cirugía (1). Está contraindicada en mujeres, niños, adolescentes, y en pacientes con hipersensibilidad a inhibidores de la 5-αreductasa, así como en caso de insuficiencia hepática grave. Cómo actúa: DT actúa por inhibición competitiva e irreversible de la enzima 5-α-reductasa en sus dos isoformas, (tipo 1 presente principalmente en hígado y piel; y, tipo 2, principalmente en la próstata), por lo que impide la trasformación de testosterona en dihidrotestosterona (DHT), disminuyendo los niveles plasmáticos de ésta, y como consecuencia disminuye el tamaño de la próstata y mejora el flujo urinario, siendo su efecto dosis dependiente. La dosis recomendada es de 0,5 mg/día (1,2). El tiempo hasta alcanzar las concentraciones séricas máximas de DT es de 1 a 3 horas. La biodisponibilidad absoluta es aproximadamente del 60%. Tiene un gran volumen de distribución (300 a 500 l) y se une con gran afinidad a las proteínas plasmáticas (>99,5%). La vida media es de aproximadamente 3-5 semanas. Aún no se ha podido explicar la metabolización del 55% de la dosis del fármaco y las vías metabólicas no se han determinado adecuadamente (3). Posología y forma de administración (1): La dosis recomendada es una cápsula (0,5 mg) administrada por vía oral una vez al día. Las cápsulas deben tragarse enteras y se pueden tomar con o sin alimentos. Aunque se puede observar una mejoría al principio, se puede tardar 6 meses en alcanzar la respuesta. No es necesario ajuste de dosis en ancianos. Eficacia: Se realizó un estudio preliminar de cálculo de dosis controlado con placebo y finasterida, con diseño de grupos paralelos, a doble ciego, en el que se comparó la reducción de los niveles plasmáticos de DHT producida por 0,01, 0,05, 0,5, 2,5 y 5 mg/día de DT y, por 5 mg/día de finasterida. La duración del seguimiento fue tan sólo de 24 semanas. La disminución de DHT plasmática fue significativamente mayor con dosis de DT superiores a 0,5 mg/día, que la observada en el grupo placebo, y la reducción fue del 95 % con DT a dosis de 0,5 mg/día, y del 71 % en el grupo tratado con finasterida; no obstante, los autores, en sus conclusiones, señalan que debería investigarse las posibles implicaciones en la práctica clínica de esta marcada supresión de la DHT plasmática (4). Se dispone del análisis combinado de los resultados de tres ensayos clínicos aleatorizados (ECA) en fase III, multicéntricos, realizados a doble ciego, de dos años de duración, en los que se comparó DT frente a placebo, y en los que se incluyeron un total de 4.325 pacientes con HBP y con síntomas de moderados a graves. La variable principal de eficacia fue el cambio en los síntomas urinarios, mediante el índice AUA-SI (American Urological Association-Symptom Index), el cual presentó una reducción significativamente mayor en los pacientes tratados con DT 0,5 mg/día que en el grupo placebo. También se observaron diferencias significativas en los resultados en otras variables como la disminución en el riesgo relativo de retención aguda urinaria (1,8 % vs 4,2 %), y en la incidencia de cirugía relacionada con HBP (2,2 % vs 4,1 %) (5). Este ensayo analizó únicamente los resultados de los pacientes que completaron el estudio. Hubo un 32 % de abandonos. En un resultado intermedio a los 12 meses presentado a la FDA, el índice AUA-SI mostró diferencias estadísticamente significativas en los pacientes con volumen de prostático >40 ml pero no significativo en pacientes con volumen <40 ml (3). En otro análisis conjunto de los resultados de estos estudios se evaluó la mejoría en la calidad de vida de los pacientes, utilizando el HBP Impact Index, en el que DT también produjo una reducción significativamente superior a la producida por placebo (2,41 puntos vs 1,64 puntos) (6). Dos de estos estudios se prolongaron durante dos años más en una fase de estudio abierto que incluyó 1.570 pacientes (792 pacientes con DT durante 48 meses). Se observó una eficacia mantenida de DT, sin incremento de los efectos adversos con respecto a los descritos a los 24 meses (7). Las evidencias comparativas con otros inhibidores de la 5-alfa-reductasa se limitan a un único estudio no publicado, realizado en 1.630 pacientes durante un año, en el que se evaluó la eficacia de DT 0,5 mg/día frente a 5 mg/día de finasterida en la indicación autorizada. Las variables de medida fueron: reducción en el índice AUA-SI (-5,5 DT vs -5,8 FT), reducción relativa del volumen prostático (26,7 % DT vs 27,1 FT), y el aumento en el flujo urinario máximo; las diferencias observadas entre ambos tratamientos no fueron significativas para ninguna de las variables, ni en lo referente a la incidencia de efectos adversos (8). 2 No se dispone de estudios comparativos de DT frente a otros fármacos utilizados en el tratamiento de la HBP, como son los alfabloqueantes adrenérgicos: doxazosina, alfuzosina, tamsulosina o terazosina. Seguridad: En los ECA controlados la incidencia de RAM relacionadas con el fármaco generalmente fueron leves o moderados (19% de incidencia con DT frente al 14% con placebo). Las RAM más frecuentemente observadas fueron trastornos de la función sexual: trastornos en la erección o impotencia (7,3% vs 4,0%), disminución de la libido (4,2% vs 2,1%), trastornos en la eyaculación (2,2% vs 0,8%) y ginecomastia (2,3% vs 0,7%)(5). La incidencia de RAM tiende a disminuir a lo largo del tiempo, con excepción de la ginecomastia que permaneció constante durante los 48 meses de tratamiento (7). Se desconoce la incidencia de RAM poco frecuentes o de las que pueden ocurrir después del tratamiento prolongado (1). La importante disminución en los niveles plasmáticos de DHT que se produce en los pacientes tratados con DT o finasterida (90 % vs 70 %) (4), podría traducirse a largo plazo en alteraciones óseas o lipídicas. Sin embargo, en un pequeño estudio de seguridad no publicado, realizado frente a finasterida, de un año de duración, y en el se incluyeron 99 pacientes, no se observaron alteraciones en la densidad mineral ósea, en los marcadores del metabolismo óseo, ni en el perfil lipídico, en ninguno de los grupos de pacientes. Tampoco se observaron alteraciones de la cantidad ni de la movilidad de los espermatozoides (3,9). DT está contraindicada en mujeres, niños, adolescentes, y en pacientes con hipersensibilidad a DT o a otros inhibidores de la 5-α-reductasa, así como en caso de insuficiencia hepática grave. Como ocurre con todos los inhibidores de la 5-α-reductasa, DT podría inhibir el desarrollo de los órganos genitales externos del feto masculino, por tanto la mujeres embarazadas deben evitar la manipulación y el contacto con este fármaco. Así mismo, se recomienda la utilización de preservativos durante el embarazo, al haberse encontrado pequeñas cantidades de DT en el semen de sujetos tratados (1,3). Advertencias y precauciones (1): DT disminuye los niveles de PSA aproximadamente en un 50%. Para interpretar un valor aislado de PSA en un hombre tratado con DT durante 6 meses o más, se deben doblar los valores de PSA para poder compararlos con los valores normales en hombres no tratados. Utilización en situaciones especiales (1): En los pacientes con HBP debe descartarse el cáncer de próstata antes de iniciar tratamiento con DT y posteriormente de forma periódica. La exposición de la mujer embarazada a DT puede provocar el desarrollo inadecuado de los genitales masculinos. DT se absorbe a través de la piel, por lo tanto, las mujeres, los niños y los adolescentes deben evitar el contacto con cápsulas rotas. Si tiene contacto con cápsulas rotas, se debe lavar inmediatamente la zona afectada con agua y jabón. Así mismo, se recomienda la utilización de preservativos durante el embarazo. Se debe tener cuidado en la administración de DT en pacientes con insuficiencia hepática de leve a moderada. Interacciones (1,3) La combinación de DT con inhibidores de la enzima CYP3A4 (ritonavir, indinavir, nefazodona, itraconazol, ketoconazol, verapamilo, diltiazem…) puede aumentar las concentraciones de DT. Se puede considerar la posibilidad de reducir la frecuencia de dosificación de DT si se observan efectos adversos. Lugar en terapéutica: Según las recomendaciones de distintas guías terapéuticas, los inhibidores de la 5-α-reductasa constituyen un tratamiento apropiado en pacientes con HBP que presentan síntomas de moderados a graves y con volumen prostático superior a 30-50 ml (10,11,12). Los bloqueantes alfa adrenérgicos son también una opción adecuada de tratamiento. Los α-bloqueantes no disminuyen el volumen prostático ni modifican la evolución natural, su respuesta se hace evidente al cabo de 4-6 semanas y sus efectos adversos principales son hipotensión ortostática y eyaculación retrógrada. Por otro lado, los inhibidores de 5α-reductasa reducen el volumen prostático, su efecto se hace evidente en 6 meses o más y sus efectos adversos principales son trastornos de la función sexual. Las evidencias disponibles han mostrado la mayor eficacia de DT frente a placebo (5,6,7), y no han demostrado ninguna superioridad de DT frente a finasterida (otro inhibidor selectivo de 5-α-reductasa con acción específica sobre el tipo 2, autorizada con las mismas indicaciones), en cuanto a las variables clínicas relevantes como puedan ser la mejoría de los síntomas, la calidad de vida y la reducción de la necesidad de intervención quirúrgica (8,9). Aunque no hay datos 3 publicados de comparaciones directas frente a finasterida (13,14), la eficacia clínica de DT y finasterida parece comparable. No se dispone de estudios comparativos de DT frente a alfabloqueantes adrenérgicos (doxazosina, alfuzosina, tamsulosina o terazosina). Por lo tanto, no parece que DT aporte ventajas sustanciales en el tratamiento de HBP. BIBLIOGRAFÍA 1. Ficha técnica de Avidart®. Laboratorios GlaxoSmithKline, SA., enero 2003. 2. Dutasterida. In: Klasko RK, editor. Drugdex® System. Micromedex, Greenwood Village, Colorado (Vol. 125. Edition expires [09/2005]). 3. Food and Drugs Administration. Center for Drugs Evaluation and Research. Aplication Number 21-319. Medical review, 2001. 4. Clark RV, Hermann DJ, Cunningham GR, Wilson TH, Morrill BB, Hobbs S. Marked suppression of dihydrotestosterone in men with benign prostatic hyperplasia by dutasterida, a dual 5alpha-reductase inhibitor. J Clin Endocrinol Metab. 2004; 89(5): 2179-84. 5. Roehrborn CG, Boyle P, Nickel JC, Hoefner K, and Andriole G, on behalf of the aria3001, aria3002, and aria3003 study investigators. Efficacy and safety of a dual inhibitor of 5-alpha-reductase types 1 and 2 (dutasterida) in men with benign prostatic hyperplasia. Urology. 2002; 60(3): 434-41. 6. O’leary MP, Roehrborn C, Andriole G, Nickel C, Boyle P, Höfner K Improvements in benign prostatic hyperplasia-specific quality of life with dutasterida, the novel dual 5alpha-reductase inhibitor. BJU Internacional. 2003; 92(3): 262-6. 7. Roehrborn CG, Marks LS., Fenter T, Freedman S, Tuttle J, Gittleman M, et al. Efficacy and safety of dutasterida in the four years treatment of men with benign prostatic hyperplasia. Urology. 2004; 63(4): 70915. 8. Commission de la transparence. “Avis de la commissión –Avidart®.” 2 juilet 2003. Disponible en URL: http://agmed.sante.gouv.fr/htm [consultado el 25-6-2005]. 9. Andriole G, Kirby R. Safety and tolerability of the dual5α-reductase inhibitor futasteride in the treatment of benign prostatic hyperplasia. Eur Urol. 2003; 44(1): 82-8. 10. AUA Practice Guidelines Committee. AUA guideline on management of benign prostatic hyperplasia (2003). Chapter 1: diagnosis and treatment recommendations. J Urol. 2003; 170(21): 530-47. 11. Madersbacher S, Alivizatos G, Nordling J, Rioja Sanz C, Emberton M, de la Rosette J J.M.C.H. EAU 2004 Guidelines on assessment,therapy and follow-up of men with lower urinarytract symptoms suggestive of benign prostatic obstruction (BPHGuidelines). Eur Urol. 2004; 46(5): 547-54. 12. Vilaseca Canals J et al, coordinador. Guía Terapéutica en Atención Primaria Basada en la Evidencia. 2ª ed. Barcelona: SEMFYC, 2004. p. 72. 13. BOT - Base de Datos del Medicamento. Consejo General de Colegios Oficiales de Farmacéuticos®, 2005 mayo. 14. Ficha Técnica de Proscar®. Merck Sharp & Dohme de España, S.A., diciembre 2004. La evaluación de novedades terapéuticas en el momento de su comercialización se apoya en información cuya validez puede verse limitada con el paso del tiempo, por lo que debe ser empleada con precaución. Esta evaluación ha sido realizada de acuerdo con el Procedimiento Normalizado de Trabajo de los Comités de Evaluación de Nuevos Medicamentos de Andalucía, Cataluña y Euskadi. 4 Referencia (Autor, publicación) INFORME DE DUTASTERIDA: TABLA RESUMEN DE ENSAYOS CLÍNICOS CONTROLADOS (ECR) Tipo de estudio y Población Pauta de Variables de Resultados Comentarios objetivo estudiada tratamiento medida (tamaño / valores (criterios de (endpoint) p / intervalos de inclusión y confianza) exclusión) Roehrborn C G et Análisis de al. Urology. 2002; resultados de 3 60(3): 434-41. ECA frente a PL, doble ciego, Patrocinado por multicéntricos, GSK 2 años. Objetivo: evaluar eficacia/seguridad de DT en el tratamiento de los síntomas de moderados a graves de HBP, la reducción del riesgo de retención aguda de orina y de cirugía. 4.325 pacientes .≥ 50 años .volumen prostático ≥ 30 cm3 .AUA-SI ≥ 12 .Qmax ≤ 15 ml/s . PSA entre 1,5 y 10ng/ml DT 0,5 mg 1vez/d Variables principales (n= 2.167) vs DT: 4,5 puntos placebo 1 vez/d Reducción en la vs (n= 2.158) puntuación del PL: 2,3 puntos índice AUA-SI p< 0,001 Riesgo de DT: 1,8 % retención aguda vs urinaria Pl: 4,2 % p< 0,001 Variables secundarias Cambio en DHT sérica DT: -389+ 228 vs PL: 16+ 150 p< 0,001 Incidencia de cirugía debido HBP DT: 2,2 % vs PL: 4,1 % p< 0,001 Incremento en Qmax DT: 2,2 vs PL: 0,6 p< 0,001 Calidad del estudio (escala Jadad) (*) No analisis ITT. Abandonos 32% 3 puntos Se incluyen en la tabla los resultados obtenidos a los 24 meses aleatorizado: sí doble ciego: si pérdidas: sí randomización adecuada: doble ciego adecuado: - Escasa aplicabilidad clínica: el comparador debería de ser finasterida (eficacia demostrada) Efectos adversos(todos p<0,001): Impotencia: DT: 7,3% placebo: 4,0% Disminución líbido: 4,2% vs 2,1% Ginecomastia: 2,3% vs 0,7% Trastorno eyaculación; 2,2% vs 0,8% 5 O´Leary et al. B JU I n t e r n a t i o n a l. 2003; 92(3):262-6. IGUAL AL ENSAYO ANTERIOR Disminución en el BII inicial <5 índice BII con DT: -0,12 respecto al inicio vs PL: 0,51 IGUAL AL ENSAYO ANTERIOR BII inicial >5 DT: -2,41 vs PL: -1,64 p< 0,001 Roehrborn C G et Estudio abierto, de al. Urology. 2004; 2 años de duración, 63(4): 709-15. análisis de resultados por ITT Financiado por realizado después GSK completar fase de 2 años de ECA. DT 0,5 mg 1vez/d 1570 pacientes (de entre los incluidos en la fase previa de ECA) Se distribuyen en dos grupos: PL (durante 2 años de ECA)/DT Objetivo: evaluar eficacia/seguridad, (2 años de a largo plazo, de DT estudio abierto) en el tratamiento de (n= 778) los síntomas de vs HBP, y la DT/DT Grupo que disminución en el recibe DT riesgo de retención durante el total aguda de orina y de de los 4 años (n= cirugía. 792) Reducción en la puntuación del índice AUA-SI a los 48 meses Incremento en Qmax (Se consideró clínicamente relevante una disminución de BII de 0,5) PL/DT: -5,3 vs DT/DT: -6,1 NE PL/DT: 1,8 vs DT/DT: 2,8 Estudio retrospectivo que analiza los resultados por ITT y en los que completan el estudio. No existe grupo control. No se trata de un ECA En el grupo DT/DT ( 4años) Impotencia: 0,4% Disminución de la líbido: 0 Trastornos de eyaculación: 0,1% Ginecomastia: 1% 6 ECA= ensayo clínico aleatorizado; DT= dutasterida; PL= placebo; HBP= hiperplasia benigna de próstata; AUA-SI= American Urological Association-Symptom Index, Qmax= flujo urinario máximo; DHT= dihidrotestosterona, TE= testosterona; BII= Bening Prostatic Hiperplasia Impac Index (escala de medida de los trastornos ocasionados por HBP); ITT= Intención de tratar NE: no se especifica el valor de p en el estudio (*) Rango de puntuación: 0-5. Estudio de baja calidad: puntuación < 3 7 COMITÉ DE REDACCIÓN - Iñigo Aizpurua Imaz. Farmacéutico de CEVIME. Departamento de Sanidad. - Susana Fernández Gallastegui. Farmacéutica de Atención Primaria; Comarca Uribe. Osakidetza-Servicio vasco de salud. - Julia Fernández Uria. Farmacéutica de Atención Primaria; Comarca Bilbao. Osakidetza-Servicio vasco de salud. - Juan José García Albás. Farmacéutico de BIOEF. Fundación Vasca de Innovación e Investigación Sanitarias. - Anabel Giménez Robredo. Farmacéutica de Atención Primaria; Comarca Uribe. Osakidetza-Servicio vasco de salud. - Josu Ibarra Amarica. Médico de Atención Primaria; Comarca Araba. Osakidetza-Servicio vasco de salud. - Nekane Jaio Atela. Farmacéutica de Atención Primaria; Comarca Interior. Osakidetza-Servicio vasco de salud. - Itxasne Lekue Alcorta. Farmacéutica de Atención Primaria; Comarca Ezkerraldea- Enkarterri. Osakidetza-Servicio vasco de salud. - Eulali Mariñelarena Mañeru. Médica de Atención Primaria; Comarca Gipuzkoa Este. Osakidetza-Servicio vasco de salud. - Carlos Martínez Martínez. Farmacéutico de Farmacia Hospitalaria; Hospital de Txagorritxu. Osakidetza-Servicio vasco de salud. - Carmela Mozo Avellaned. Farmacéutica de Atención Primaria; Comarca Gipuzkoa Este. Osakidetza-Servicio vasco de salud. - Justo Mugica Campos. Médico de Atención Primaria; Comarca Gipuzkoa Oeste. Osakidetza-Servicio vasco de salud. - Elena Olloquiegui Biurrarena. Farmacéutica de Atención Primaria; Comarca Gipuzkoa Oeste. Osakidetza-Servicio vasco de salud. - Isabel Porras Arregui. Farmacéutica de CEVIME. Departamento de Sanidad. - Juan Salgado Sáez. Médico de Atención Primaria; Comarca Interior. Osakidetza-Servicio vasco de salud. - Luisa Ugedo Urruela. Farmacóloga; Facultad de Medicina y Odontología. Universidad del País Vasco. 8