0 45 360 675 ∞ % trans 0 10.8 49.3 62.7 70.0 carbonbezoxiglicil-Lt
Anuncio

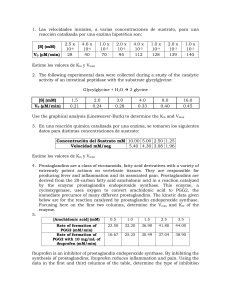
Termodinámica y Cinética Química 2006/2007. Hoja 6 Área de Química-Física. Universidad Pablo de Olavide 48. *Para la reacción de descomposición del N2O5(g) ( N2O5(g) NO2(g)+NO3(g) ) se han obtenido los siguientes datos cinéticos: 25ºC Experimento 1 Experimento 2 Tiempo/horas 0 6.1 0 6.1 PN2O5/mmHg 350 175 500 250 55ºC Tiempo/minutos PN2O5/mmHg 0 350 8.2 175 0 500 8.2 250 (a) Determinar el orden de reacción. (b) Calcular las constantes de velocidad a 25ºC, 55ºC y 85ºC. (c) Calcular la energía de activación y el factor de frecuencia. (d) A 85ºC ¿qué tiempo sería necesario para obtener una conversión del 40%? 49. En la obtención del ácido nítrico, una de las etapas principales es la oxidación del óxido nítrico a dióxido de nitrógeno: 2 NO(g) + O2(g) -> 2 NO2(g). Para esta reacción, se ha determinado experimentalmente que su ecuación de velocidad es: v = k [NO]2 ·[O2] y que la constante de velocidad, a 250 ºC, vale: k = 6,5 × 10 -3 mol-2L2s-1. Calcular la velocidad de oxidación del NO, a dicha temperatura, cuando las concentraciones iniciales (mol L-1) de los reactivos son: a) [NO] = 0,100 M ; [O2] = 0,210 M b) [NO] = 0,200 M; [O2] = 0,420 M 50. *Hasta 1967 se aceptaba para la reacción H2(g) + I2(g) 2HI(g), el mecanismo de una etapa (i): H2 + I2 2HI. En dicho año Sullivan propuso el siguiente mecanismo en tres etapas(ii): I2 2I 2I I2 2I + H2 2HI k1 k2 k3 a) Obtener la ecuación de velocidad correspondiente a ambos mecanismos. b) Sillavan obtuvo los siguientes resultados para la constante k3: k3(417.9K)=1.12 105 l2mol-2s-1 y k3(520.1K)=4.0 105 l2mol-2s-1. Calcular la energía de activación correspondiente a esta reacción. 51. La isomerización cis-trans del 1,2 dimetilciclopropano a 453ºC es una reacción reversible de orden 1. Calcular la constante de equilibrio si la composición en porcentaje de la mezcla a diferentes tiempos es la siguiente: Tiempo (s) % trans 0 0 45 10.8 360 49.3 675 62.7 ∞ 70.0 52. *La hidrólisis del carbonbezoxiglicil-L-triptófano catalizada por la carboxipeptidasa pancreática tiene lugar a través de la reacción: carbonbezoxiglicil-L-triptófano + H2O carbobenzoxyglicina + L-triptófano La tabla siguiente muestra las velocidades de formación del L-triptófano a 25ªC y pH7 obtenidas por R. Lumry, E.L. Smith y R.R. Glandtz J. Am. Chem. Soc. 73, 4330 Concentración de sustrato (mM) Velocidad (mM s-1) 2.5 0.024 5.0 0.036 10.0 0.053 15.0 0.060 20.0 0.064 (a) Representa esa tabla siguiendo el método de Lineweaver-Burk y determina los valores de KM y Vmax. (b) Repite el análisis utilizando el método de Eadie-Hofstee (c) ¿Cual será la media de los 10 valores posibles de KM y Vmax?