Anuncio

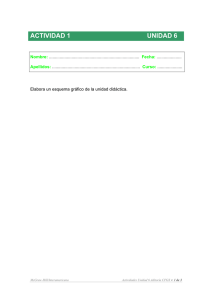
Documento descargado de http://www.revclinesp.es el 01/12/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. REVISIÓN Terapia individualizada con azatioprina o 6-mercaptopurina mediante monitorización de la actividad de la tiopurina metiltransferasa (TPMT) J. P. Gisberta, F. Gomollónb, J. Matéa y J. M. Pajaresa a Servicio de Aparato Digestivo. Hospital Universitario de La Princesa. Madrid. b Servicio de Aparato Digestivo. Hospital Miguel Servet. Zaragoza. Introducción La azatioprina (AZA) y su metabolito la 6-mercaptopurina (6-MP) son análogos de las purinas con actividad inmunodepresora que se utilizan para el tratamiento de diversos procesos autoinmunitarios, entre los que se encuentran la artritis reumatoide, el lupus eritematoso sistémico, la hepatitis autoinmune, la enfermedad inflamatoria intestinal o algunas enfermedades dermatológicas. Además, ambos fármacos representan una pieza clave dentro la terapia inmunodepresora encaminada a prevenir el rechazo tras el trasplante de órganos. La AZA se convierte en 6-MP, que puede ser metabolizada mediante metilación a través de la tiopurina metiltransferasa (TPMT), oxidada gracias a la xantina oxidasa a ácido tioúrico, o catabolizada hacia nucleótidos de la 6-tioguanina (6-TGN) a través de la hipoxantina-guaninafosforribosil transferasa (fig. 1). En suma, el efecto de la AZA y de la 6-MP es consecuencia de su conversión intracelular en 6-TGN, los cuales son los responsables fundamentales de la actividad de estos fármacos, a través de su incorporación al ADN y ARN 1. La dosis de AZA y 6-MP se ajustan habitualmente en función del peso del paciente, con lo que se pretende alcanzar la mayor eficacia terapéutica y al mismo tiempo reducir la incidencia de efectos adversos, aunque esto no siempre se consigue. Se han sugerido diversas estrategias para monitorizar de forma individualizada y de modo más fiable la dosis de AZA/6-MP con la intención, por una parte, de identificar a los pacientes con riesgo de toxicidad por estos fármacos y, por otro, a aquellos con dosis subterapéuticas e inmunodepresión inadecuada. En el presente manuscrito se revisarán dichas estrategias, haciendo especial hincapié en la determinación de la TPMT con la intención de obtener un perfil individualizado de actividad enzimática. Estrategias propuestas para individualizar la dosis de AZA/6-MP Determinación de los valores de volumen corpuscular medio El tratamiento con AZA provoca variaciones en el volumen corpuscular medio (VCM) de los hematíes y se ha observado que existe una estrecha correlación entre el incremento de éste y la concentración intraentrocitaria de 6-TGN 2, 3. El incremento del VCM es observable a partir del tercer mes de tratamiento con AZA y se estabiliza después del sexto mes 3. De este modo, se ha sugerido que la dosis de este fármaco sería correcta cuando a los tres meses se evidencia un incremento en el VCM entre 3 y 8 fl, mientras que a los 6 meses dicho ascenso debería oscilar entre 6 y 8 fl. Con incrementos inferiores sería preciso aumentar la dosis de AZA en 0,5 mg/kg/día, mientras que con elevaciones superiores la dosis debería reducirse en esa misma cuantía 2,3. No obstante, es improbable que la determinación del VCM sea realmente útil para monitorizar la dosis de AZA/6-MP, ya que existe una notable variabilidad interindividual en la evolución de este marcador tras la instauración del tratamiento y porque las enfermedades inflamatorias intestinales se asocian frecuentemente con un déficit de hierro y de ácido fólico (en el caso de la enfermedad de Crohn) que provocan, respectivamente, microcitosis o macrocitosis, con el consiguiente artefacto del valor del VCM. Además, otros fármacos (como la sulfasalazina) capaces de inducir macrocitosis pueden artefactar el VCM. Por último, no es infrecuente que la coexistencia de sobrecrecimiento bacteriano y la consiguiente malabsorción de vitamina B12 complique la interpretación de este parámetro. En resumen, los datos mencionados limitan considerablemente la utilidad de la determinación del VCM como marcador fiable del efecto de la AZA. Leucopenia como estimación del efecto inmunosupresor de la AZA/6-MP Correspondencia: J. P. Gisbert. Playa de Mojácar, 29. Urbanización Bonanza. 28669 Boadilla del Monte (Madrid). Correo electrónico: [email protected] Aceptado para su publicación el 13 de mayo de 2002. Hace ya unos anos se postuló la existencia de una correlación entre la respuesta clínica de los pacientes con enfermedad de Crohn tratados con 6-MP y el desarrollo de una cierta leucopenia (por debajo de 5.000 leucocitos/ml 4). Sin embargo, estudios recienRev Clin Esp 2002;202(10):555-62 555 Documento descargado de http://www.revclinesp.es el 01/12/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. GISBERT JP, ET AL. TERAPIA INDIVIDUALIZADA CON AZATIOPRINA O 6-MERCAPTOPURINA MEDIANTE MONITORIZACIÓN DE LA ACTIVIDAD DE LA TIOPURINA METILTRANSFERASA (TPMT) 6-metil mercaptopurina TPMT Glutatión Azatioprina HGPRT 6-mercaptopurina 6-tioguanina Xantina oxidasa ADN Ácido tioúrico tes han demostrado que la leucopenia no constituye un marcador fiable de la respuesta terapéutica a la AZA/6-MP (aunque sí pueda correlacionarse con la acumulación de 6-TGN 3,5) y que, por tanto, su utilidad para monitorizar el tratamiento (por ejemplo de la enfermedad inflamatoria intestinal) es más que dudoso 5-8. Monitorización de los 6-TGN Los 6-TGN pueden determinarse en el interior de los eritrocitos mediante técnicas de cromatografía de alta resolución y se ha demostrado que la concentración intraeritrocitaria refleja la existente en los tejidos 1. De este modo se ha evidenciado que las concentraciones intracelulares de 6-TGN están relacionadas con la toxicidad y con el efecto terapéutico de la AZA y que los efectos mielosupresores en concreto parecen depender de la cuantía de estos metabolitos. Por tanto, su determinación se ha propuesto como un marcador útil para la monitorización del tratamiento con AZA 3,6,9-18. Además se ha sugerido que aquellos pacientes que son refractarios a estos fármacos, a pesar de tener niveles eritrocitarios adecuados de 6-TGN, deberían ser candidatos a tratamiento coadyuvante o alternativo con otros inmunosupresores o cirugía (en el caso, por ejemplo, de los pacientes con enfermedad inflamatoria intestinal) 13. Algunos autores han demostrado que los pacientes con enfermedad inflamatoria intestinal tratados con AZA o 6-MP que responden favorablemente tienen unos niveles medios de 6-TGN superiores a los de aquellos en los que fracasa el tratamiento 6,12,13, y que dichos niveles se asocian con un menor riesgo de recurrencia de enfermedad de Crohn 6,19,20 o de leucemia linfoblástica aguda 11,14,21. Otros autores han confirmado que los pacientes tratados con dosis bajas de AZA tienen concentraciones subterapéuticas de 6-TGN, y al incrementar progresivamente la dosis del inmunosupresor se alcanzan niveles más elevados de estos metabolitos y se consigue una mejor respuesta clínica 13. Sin embargo, en otros estudios no se ha podido comprobar relación alguna entre la actividad de la enfermedad inflamatoria intestinal o 556 Fig. 1. Vía metabólica de la azatioprina y 6-mercaptopurina. TPMT: tiopurina metiltransferasa; HGPRT: hipoxantina-guanina fosforibosil transferasa. el recuento leucocitario de los pacientes tratados con AZA o 6-MP y las concentraciones séricas de 6-TGN 5,8,22-24. Incluso la administración directa de tioguanina se siguió, en un reciente estudio, de unas concentraciones de 6-TGN que no se correlacionaron claramente con la eficacia terapéutica ni con los efectos adversos, lo que sugiere que la relación entre éstos y los niveles de 6-TGN es indirecta 25. Por otra parte, incluso en los estudios en los que se evidencia una diferencia en los niveles de 6-TGN entre los pacientes con y sin respuesta clínica, no se ha podido identificar un punto de corte nítido que pueda discriminar de forma certera ambos grupos. Por tanto, actualmente no está establecida la utilidad de la determinación en la práctica clínica de las concentraciones de 6-TGN en los pacientes tratados con AZA/6-MP. Se ha sugerido que probablemente su cuantificación sólo estaría indicada en las siguientes situaciones: cuando se sospecha que el paciente no está cumpliendo correctamente la terapia, cuando se está recibiendo tratamiento concomitante con alopurinol 26, 28, cuando la actividad de la TPMT es intermedia o baja (véase más adelante) o sobre todo cuando no existe respuesta a pesar de administrar una dosis estándar de AZA o 6-MP (en este último caso, unas concentraciones de 6-TGN elevadas confirmarían la ineficacia de estos fármacos y nos obligarían a optar sin más demora por otras alternativas terapéuticas) 29. Monitorización de la actividad de la TPMT La actividad de la enzima TPMT parece ser el factor más importante en la regulación de las concentraciones de los 6-TGN. Así, en los pacientes con baja actividad de la TPMT se observan elevadas concentraciones de estos metabolitos, mientras que en aquellos con alta actividad enzimática las concentraciones de los 6-TGN son bajas 6,24,30, aunque no todos los estudios han podido demostrar esta correlación inversa 31. A continuación se revisará, por tanto, el papel que pudiera tener la determinación de la actividad de la TPMT en la terapia individualizada con AZA o 6-MP. Rev Clin Esp 2002;202(10):555-62 Documento descargado de http://www.revclinesp.es el 01/12/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. GISBERT JP, ET AL. TERAPIA INDIVIDUALIZADA CON AZATIOPRINA O 6-MERCAPTOPURINA MEDIANTE MONITORIZACIÓN DE LA ACTIVIDAD DE LA TIOPURINA METILTRANSFERASA (TPMT) Distribución de la actividad de la TPMT en la población general La farmacocinética de la AZA está sujeta a una importante variabilidad interindividual que se debe en gran parte a un significativo polimorfismo genético de la TPMT 32. De este modo, desde el punto de vista genotípico, hace ya más de dos décadas que Weinshilboum y Sladek estudiaron una muestra aleatoria de población de aproximadamente 300 individuos y encontraron la siguiente distribución trimodal 33: el 88,6% eran homocigotos para el alelo de alta actividad (TPMTHH), el 11,1% eran heterocigotos (TPMTHL), y tan sólo el 0,3% eran homocigotos para el alelo de baja actividad (TPMTLL). Fenotipo y actividad de la TPMT Weinshilboum et al fueron los primeros en describir, a finales de la década de los setenta, un método para determinar la actividad de la TPMT en hematíes humanos 33. Posteriormente otros autores han cuantificado la actividad de esta enzima en función del genotipo del paciente 34,35 y han encontrado los siguientes valores: sujetos homocigotos para el alelo de alta actividad (niveles altos, más de 13,8 U/ml hematíes); sujetos heterocigotos (niveles intermedios, entre 5 y 13,7 U/ml) y sujetos homocigotos para el alelo de baja actividad (niveles bajos, menos de 5 U/ml). Genotipo y actividad de la TPMT Diversos autores han detectado la presencia de mutaciones de la TPMT mediante la técnica de reacción en cadena de la polirnerasa (PCR) y digestión con enzimas de restricción, y han demostrado una correlación evidente entre dichas mutaciones y el riesgo de sufrir mielotoxicidad 6,36-40. Esto se explica debido a que el genotipo de la TPMT parece ser el factor más importante en la regulación de las concentraciones de los 6-TGN, habiéndose demostrado una estrecha correlación (inversa) entre la actividad de la enzima y las concentraciones de estos metabolitos 6,17,40, de modo que aquellos pacientes con una baja actividad de la TPMT que reciban dosis estándar de AZA pueden presentar efectos secundarios como la aplasia medular. El gen de la TPMT se localiza en el cromosoma 6p22.3, se extiende a lo largo de unas 34 kb de ADN genómico y contiene 10 exones. Las variables alélicas del gen TPMT más frecuentes en la población caucásica resultan de la combinación de dos mutaciones puntuales en las posiciones 460 (G → A) del exón 7 y 719 (A → G) del exón 10, aunque hasta el momento se han descrito al menos 10 variantes alélicas que están asociadas con un defecto en su actividad enzimática 41-43. Este polimorfismo genético de la TPMT ha sido descrito en todas las poblaciones estudiadas hasta el momento, incluyendo la raza blanca, asiática y africana 37,39,42,44-46. En un interesante estudio llevado a cabo recientemente en España (y Holanda) se evaluaron las fre- cuencias de las diversas variables alélicas del gen TPMT, evidenciándose que el 10% de los individuos eran portadores heterocigotos de un alelo mutante de este gen, y no se encontraron diferencias entre los pacientes con colitis ulcerosa y los del grupo control 47. El alelo mutante más frecuentemente encontrado en ambos grupos fue el TPMT3A (A460 → G719), el cual se identificó en el 60% de los portadores. Otras mutantes alélicas, como la TPMT3B y la TPMT3C, se detectaron más frecuentemente en este estudio que en otros previamente publicados, hecho que probablemente refleja las diferencias étnicas entre las diversas poblaciones 47, 48. Concordancia entre genotipo y fenotipo de la TPMT Como se ha mencionado anteriormente, existen dos estrategias para identificar a los pacientes con deficiencia de TPMT: la medición de la actividad de esta enzima en los eritrocitos (es decir, el fenotipo) 49,50 y la determinación de las diversas mutaciones presentes en el ADN celular (esto es, el genotipo) 37,42. Múltiples estudios han demostrado que existe una elevada concordancia entre la clasificación genotípica y fenotípica de la actividad de la TPMT, que ha sido tan alta como del 97%-98% 37,51 o incluso del 100% 40 en algunos casos, aunque otros autores han comprobado que estos favorables resultados sólo se observan en los pacientes homocigotos para el alelo de baja actividad de la TPMT, pero no en los heterocigotos 35. Se ha sugerido que la falta de concordancia entre el diagnóstico fenotípico y genotípico puede ser debido, al menos en parte, a la existencia de alguna rara mutación de los alelos del locus de la TPMP que aún no ha sido identificada. Ventajas e inconvenientes de la determinación del fenotipo y del genotipo de la TPMT Una ventaja teórica de la determinación del fenotipo (mediante el estudio de la actividad eritrocitaria de la TPMT) es que éste podría traducir con más fidelidad la actividad real de la enzima, pues la manifestación fenotípica de un determinado genotipo no es siempre la misma, sino que puede depender de diferentes variables como la edad, el sexo, la dieta, la presencia de insuficiencia renal o el tratamiento con otros fármacos 21,26,52-58. Así, por ejemplo, el propio tratamiento con AZA puede incrementar la actividad de la TPMT 59, y diversos estudios farmacológicos realizados tanto in vitro como in vivo han evidenciado una inhibición de esta enzima y un incremento en los 6-TGN debidos al tratamiento con sulfasalazina o 5-aminosalicilatos, medicamentos de uso frecuente en la enfermedad inflamatoria intestinal 24,60-62. En este sentido recientemente se ha descrito el caso de un paciente con mielosupresión mientras recibía tratamiento simultáneo con AZA y olsalazina (un derivado de la mesalazina); aunque dicho paciente tenía un genotipo homocigoto para el alelo de alta actividad de la TPMT, su fenotipo (es decir, su actividad enzimáti- Rev Clin Esp 2002;202(10):555-62 557 Documento descargado de http://www.revclinesp.es el 01/12/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. GISBERT JP, ET AL. TERAPIA INDIVIDUALIZADA CON AZATIOPRINA O 6-MERCAPTOPURINA MEDIANTE MONITORIZACIÓN DE LA ACTIVIDAD DE LA TIOPURINA METILTRANSFERASA (TPMT) ca) se encontraba en el rango bajo de la normalidad, lo que sugiere que podía haberse producido una interacción farmacológica con la consiguiente acumulación tóxica de 6-TGN 61. La terapia con furosemida podría influir también en la S-metilación de las tiopurinas 63. En cualquier caso esta teórica interacción, con inducción de toxicidad medular clínicamente relevante, no ha sido corroborada en otros estudios llevados a cabo en humanos, por lo que se precisan experiencias in vivo que confirmen los efectos descritos in vitro. Por último, la determinación del genotipo permite únicamente clasificar a los pacientes, como hemos visto, en tres grandes grupos (homocigotos TPMTHH, heterocigotos TPMTHL y homocigotos TPMTLL), mientras que la cuantificación de la actividad enzimática podría permitir, en teoría, la individualización de la dosis de AZA/6-MP en cada paciente, incluso en aquellos con genotipo «normal» (homocigotos de alta actividad) 64; en este último grupo existe una notable variabilidad interindividual en la actividad de la TPMT y es posible que ello implique la necesidad de administrar dosis distintas de fármacos inmunodepresores. Por su parte, la determinación del genotipo de la TPMT tiene una serie de ventajas, como su sencillez (la automatización progresiva del diagnóstico molecular es ya una realidad), su rapidez (los resultados se obtienen en unas pocas horas) y el precio relativamente bajo de la técnica (aunque este aspecto varía considerablemente según el medio en que se aplique) 36,47,55. Además, puesto que el genotipo no varía en un determinado paciente, sólo necesita ser determinado una única vez. Finalmente, la medición de la actividad eritrocitaria de la TPMP (el fenotipo) puede artefactarse si se ha recibido una transfusión de hematíes en las últimas semanas 66, lo que no es excepcional que ocurra en algunos pacientes tratados con AZA/6-MP, como aquellos con una leucemia linfoblástica o una colitis ulcerosa, o en cualquier enfermo cuya depresión medular haya sido suficientemente grave como para precisar tratamiento con hemoderivados. En este sentido, recientemente se ha publicado el caso de un paciente que requirió una transfusión de hematíes y que posteriormente sufrió una pancitopenia mientras estaba siendo tratado con AZA, a pesar de que su fenotipo demostraba en aquel momento una actividad normal de la TPMT; no obstante, el genotipo del paciente fue, como cabía esperar, homocigoto para el alelo de baja actividad, y la repetición de la actividad fenotípica de la TPMT dos meses después mostró, finalmente, una deficiencia acusada de esta enzima 66. Actividad de la TPMT y riesgo de mielotoxicidad debida a AZA/6-MP La leucopenia «crónica» es el efecto adverso más frecuentemente producido por la AZA y la 6-MP, alteración analítica que aparece entre el 5% y el 25% de los pacientes que reciben este tratamiento 30,67-69. Más raramente, la mielotoxicidad aparece como una forma más aguda y grave, generalmente de pancitope558 nia 30. Por ejemplo, en un estudio retrospectivo de 396 pacientes con enfermedad inflamatoria intestinal que estaban recibiendo tratamiento con 6-MP, un 2% desarrolló una supresión medular grave, clínicamente relevante, que requirió hospitalización 70. En otra serie de 739 pacientes tratados con AZA se descríbió la aparición de leucopenia en el 3,8% de los casos, y ésta fue clasificada como grave en el 1,2% 71. Diversos estudios han evidenciado una correlación entre el fenotipo o el genotipo de la TPMT y el riesgo de mielotoxicidad 6,17,18,30,34,35,38-40,52,53,65,72-78. De este modo, los pacientes homocigotos para el alelo de baja actividad de la TPMT tienen un riesgo aumentado de sufrir mielotoxicidad grave debido al exceso de acumulación de 6-TGN, consecuencia de que una cantidad mayor de 6-MP es metabolizada por la ruta enzimática de la hipoxantina-guanina fosforibosil transferasa (fig. 1) 26,34 Por ejemplo, Colombel et al 52 estudiaron a un grupo de pacientes con enfermedad de Crohn que habían sufrido una mielosupresión mientras recibían tratamiento con AZA o 6-MP y encontraron que el 27% de ellos tenía un genotipo de TPMT asociado con una deficiencia enzimática. En otro estudio, de los 23 pacientes que habían sufrido toxicidad medular mientras recibían tratamiento con AZA o 6-MP, 6 tenían una deficiencia completa de TPMT y 9 una deficiencia parcial 35. Dicho de otro modo, la probabilidad de padecer una deficiencia completa de TPMP o de ser heterocigoto para esta enzima es más de 6 veces mayor entre los pacientes que han sufrido un episodio de mielosupresión en comparación con aquellos que han tolerado el tratamiento con AZA/6-MP sin problemas 35. Otros autores han descrito incidencias de mielotoxicidad de hasta el 100% en los sujetos homocigotos para el alelo de baja actividad, pero de tan sólo el 7% en aquellos con actividad enzimática normal 40. El grado de déficit de actividad de la TPMT parece guardar relación con el período de tiempo transcurrido entre la administración del tratamiento con AZA y la aparición de los efectos adversos hematológicos. Así, se ha descrito que este período de latencia es corto (de aproximadamente 1,5 meses) en los pacientes homocigotos para el alelo de baja actividad, mientras que sería algo más prolongado en los heterocigotos y más aún en los homocigotos para el alelo de alta actividad 30,52. De estos datos se deduce que la neutropenia que aparece precozmente tras haber comenzado el tratamiento, y que previamente era considerada como un efecto adverso de tipo idiosincrásico, es debida en la mayoría de los casos al déficit (fundamentalmente al déficit absoluto) de actividad de la TPMP. Por otra parte, la toxicidad medular tardía que aparece en los pacientes tratados con AZA está relacionada posiblemente con otros factores distintos de la deficiencia de TPMT. En este último caso se debería investigar de forma exhaustiva la presencia de factores ambientales u otros tratamientos potencialmente mielotóxicos asociados antes de suspender (quizá injustificadamente) la administración de AZA de forma definitiva. Rev Clin Esp 2002;202(10):555-62 Documento descargado de http://www.revclinesp.es el 01/12/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. GISBERT JP, ET AL. TERAPIA INDIVIDUALIZADA CON AZATIOPRINA O 6-MERCAPTOPURINA MEDIANTE MONITORIZACIÓN DE LA ACTIVIDAD DE LA TIOPURINA METILTRANSFERASA (TPMT) Actividad de la TPMT y riesgo de efectos secundarios distintos de la mielotoxicidad Aunque la hepatotoxicidad asociada al tratamiento con AZA o 6-MP está bien documentada, sus mecanismos patogénicos son aún desconocidos. En un reciente estudio se evidenció una correlación entre hepatotoxicidad y niveles elevados de 6-metilmercaptopurina 6, mientras que otros autores han descrito una tendencia a una mayor toxicidad hepática en los pacientes con elevada actividad de la TPMT 40. Esta observación sugiere que una actividad enzimática elevada y la consiguiente acumulación de 6-metilmercaptopurina también podrían desempeñar un importante papel en la toxicidad hepática debida a la AZA o 6-MP, habiéndose sugerido que la monitorización de los niveles de este metabolito podría ayudar a identificar a los pacientes con riesgo elevado de sufrir esta complicación. Finalmente, algún estudio ha demostrado la aparición de hepatotoxicidad en aproximadamente una cuarta parte de los pacientes con una deficiencia absoluta de TPMT 35, aunque otros autores no han podido demostrar relación alguna entre toxicidad hepática y deficiencia de este enzima 35,39,40, por lo que el verdadero papel que la actividad de la TPMT puede desempeñar en la predicción de los efectos adversos hepáticos es aún controvertido. Por último, algunos autores han sugerido que la incidencia de efectos adversos gastrointestinales podría estar también relacionada con un déficit de actividad de la TPMT 79, aunque estos resultados deberán ser confirmados en futuros estudios. Actividad de la TPMT y eficacia inmunodepresora de la AZA Mediante la determinación de la actividad enzimática de la TPMT no sólo podría estimarse el riesgo de sufrir efectos adversos, sino también la probabilidad de que la dosis administrada de AZA esté produciendo la inmunodepresión adecuada y el consiguiente efecto terapéutico. Así, se ha sugerido que los pacientes homocigotos para el alelo de alta actividad de la TPMT, y especialmente aquellos con una actividad de esta enzima en el rango alto de la normalidad, estarían indebidamente inmunosuprimidos con la posología convencional de AZA 34 y podrían beneficiarse de dosis más elevadas de este fármaco 53. No obstante, otros estudios han concluido que la determinación de la actividad de la TPMT no predice el riesgo de sufrir un rechazo tras un trasplante renal en los pacientes que están siendo tratados con AZA/6-MP 31. Por último, algunos autores han evaluado si la inducción de la actividad de la TPMT debida al propio tratamiento con AZA es útil para predecir la evolución del trasplante renal y han observado que a mayor inducción enzimática, menor probabilidad de rechazo 59. ¿Cómo se puede ajustar la dosis de AZA/6-MT en función de la actividad de la TPMT? Se ha sugerido que, de acuerdo con la actividad de la TPMT, se podría actuar básicamente de tres formas. Los pacientes con un genotipo homocigoto de alta actividad (o con actividad normal de la TPMT) deberían recibir dosis de inmunosupresores que hayan demostrado ser claramente eficaces; por ejemplo, en el caso de la enfermedad inflamatoria intestinal, entre 2 y 3 mg/kg/día de AZA, y aproximadamente 1,5 mg/ kg/día de 6-MP 80. En estos pacientes, además, podrían administrarse dosis «de carga» de estos fármacos en determinadas circunstancias clínicas que precisen de una actividad terapéutica inmediata, como es el caso de las formas fistulizantes, corticodependientes o corticoresistentes de la enfermedad de Crohn 2. En aquellos pacientes con genotipo heterocigoto o con actividad intermedia de la TPMT se debería reducir empíricamente la dosis inicial hasta aproximadamente el 50%. No obstante, algunos autores han comprobado que una reducción media de la dosis de tan sólo el 15% (con respecto a la utilizada en los pacientes con actividad normal de la TPMT) es habitualmente bien tolerada por el grupo de pacientes heterocigotos, a pesar de que en ellos se acumula en los hematíes una concentración doble de 6-TGN 40. Finalmente, ante un paciente con un genotipo o fenotipo homocigoto de baja actividad de la TPMT se debería contraindicar el empleo de AZA y 6-MP 52, 65 o, en todo caso, sería obligado administrar dosis muy reducidas de estos fármacos (por ejemplo, un 10%-15% de la dosis estándar) 26,35,40,80-82. En este sentido, algunos autores han demostrado que a pesar de existir una deficiencia completa de TPMT es posible administrar finalmente tratamiento con AZA/6-MP a dosis mínimas y bajo un estricto control clínico y analítico 35. ¿Está indicado monitorizar la actividad de la TPMT en todos los pacientes que vayan a recibir tratamiento con AZA o 6-MP? Por una parte, los datos anteriormente mencionados que demuestran que el conocimiento de la actividad de la TPMP permite predecir con notable fiabilidad la aparición de efectos adversos hematológicos graves argumentan a favor de la determinación rutinaria del genotipo o fenotipo de esta enzima en los pacientes que van a recibir tratamiento con AZA o 6-MT 34,40,47,80. Además, debemos tener presente que en los pacientes en los que aparezca la mielotoxicidad nos veremos obligados a suspender el tratamiento con AZA/6-MP hasta que la aplasia medular se recupere, lo que puede comprometer de forma importante la evolución de la enfermedad de base (por ejemplo, la leucemia linfoblástica aguda) que está siendo tratada con estos inmunodepresores 40. Aunque los sujetos homocigotos para el alelo de baja actividad representan tan sólo el 0,3% de la población, esto es, uno entre 300 pacientes, los heterocigotos constituyen aproximadamente el 10%, una cifra mucho más relevante 33. No obstante, es evidente que se precisan más estudios, no sólo clínicos, sino también de costebeneficio, para aclarar definitivamente esta cuestión. Así, es posible que el estudio de la actividad de la TPMT en todos los pacientes sea coste-efectiva si tenemos en cuenta lo costoso del tratamiento de los Rev Clin Esp 2002;202(10):555-62 559 Documento descargado de http://www.revclinesp.es el 01/12/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. GISBERT JP, ET AL. TERAPIA INDIVIDUALIZADA CON AZATIOPRINA O 6-MERCAPTOPURINA MEDIANTE MONITORIZACIÓN DE LA ACTIVIDAD DE LA TIOPURINA METILTRANSFERASA (TPMT) pacientes con mielotoxicidad grave inducida por AZA 39, 65. En este sentido, Tavadia et al han calculado el coste de la determinación rutinaria de la actividad de la TPMT basándose en los resultados de un caso real de toxicidad medular ocurrido en su propio centro 65. Los autores llegan a la conclusión de que esta actitud sería «neutra» desde el punto de vista económico si se asume que la mielotoxicidad aparece únicamente en los pacientes homocigotos para el alelo de baja actividad de la TPMT, pero que sería coste-efectiva si como ocurre realmente los efectos adversos aparecen también en los pacientes heterocigotos. Por otra parte, es necesario confirmar si la determinación de la actividad de la TPMT permite ajustar con más precisión la dosis eficaz de AZA no sólo en los pacientes con déficit enzimático, sino en todos los casos, y evaluar el consiguiente ahorro económico de esta estrategia. Por último, como en cualquier decisión médica, es preciso tener presente no sólo los condicionantes económicos sino también, y fundamentalmente, los éticos. De este modo, si es posible llevar a cabo una determinación analítica que permita evaluar los riesgos de la AZA, o incluso utilizar una dosis completa más precozmente, parece apropiado ofrecérsela al paciente siempre que sus costes sean asumibles. La monitorización de la actividad de la TPMT ¿evita la necesidad de realizar controles analíticos rutinarios? Para responder a esta pregunta habría que plantearse en primer lugar si el déficit de TPMT es responsable de todos los casos de mielotoxicidad o, por el contrarío, existen otros factores que pueden desencadenar esta complicación. Diversos estudios han demostrado que el fenotipo o el genotipo asociado con el déficit de TPMP explica un porcentaje variable de casos de mielotoxicidad, pero que en ningún caso llega siquiera a aproximarse al 100% 35,40,52,78,83. Por tanto, se podría concluir que diversos factores (algunos conocidos, ambientales o farmacológicos, y otros aún no identificados) no relacionados con la actividad de la TPMP pueden ser responsables de la mielotoxicidad producida por la AZA, por lo que los controles analíticos periódicos deben seguir realizándose en estos pacientes a pesar de que la función de esta enzima sea rigurosamente normal 26. Conclusiones Se han sugerido diversas estrategias para monitorizar de forma individualizada y de modo más fiable la dosis de AZA/6-MP con la intención, por una parte, de identificar a los pacientes con riesgo de toxicidad por estos fármacos y, por otro, a aquellos con dosis subterapéuticas e inmunodepresión inadecuada. Entre estas estrategias se encuentra la determinación de los cambios en el VCM, la confirmación de la inducción de una determinada leucopenia, la cuantificación de los 6-TGN y la monitorización de la actividad de la TPMT, destacando esta última opción como la más 560 prometedora. La actividad de la enzima TPMT parece ser el factor más importante en la regulación de las concentraciones de los 6-TGN. La actividad de la TPMT en la población general sigue una distribución trimodal, en la que aproximadamente el 11% de los individuos son heterocigotos y el 0,3% homocigotos para el alelo de baja actividad. Existen dos estrategias para identificar a los pacientes con deficiencia de TPMT: la medición de la actividad de esta enzima en los eritrocitos (es decir, el fenotipo) y la determinación de las diversas mutaciones presentes en el ADN celular (esto es, el genotipo), existiendo una elevada concordancia entre ambas técnicas. Se ha demostrado una notable correlación entre el fenotipo o el genotipo de baja actividad de la TPMT y el riesgo de mielotoxicidad. Además, el grado de déficit de actividad de la TPMT parece guardar relación con el período de tiempo transcurrido entre la administración del tratamiento con AZA y la aparición de los efectos adversos hematológicos. El papel que la actividad de la TPMT pueda desempeñar en la predicción de los efectos adversos distintos de los hematológicos (por ejemplo, hepáticos) es aún controvertido. Aunque se ha sugerido que mediante la determinación de la actividad enzimática de la TPMT podría estimarse la probabilidad de que la dosis administrada de AZA esté produciendo la inmunodepresión adecuada y el consiguiente efecto terapéutico, este punto precisa aún ser confirmado. Los pacientes con un genotipo homocigoto de alta actividad (o con actividad normal de la TPMT) deberían recibir dosis de inmunosupresores que hayan demostrado ser claramente eficaces. En aquellos enfermos con genotipo heterocigoto o con actividad intermedia de la TPMT se debería reducir empíricamente la dosis inicial hasta aproximadamente el 50%. Finalmente, ante un paciente con genotipo o fenotipo homocigoto de baja actividad de la TPMT se debería contraindicar el empleo de AZA y 6-MP o, en todo caso, sería obligado administrar dosis muy reducidas de estos fármacos (por ejemplo, un 10%-15% de la dosis estándar). En resumen, la determinación de la actividad de la TPMT constituye una atractiva opción para individualizar la dosis de AZA o 6-MP y prevenir el riesgo de efectos adversos, aunque está por demostrar si esta estrategia debe, definitivamente, aplicarse rutinariamente en todos los pacientes. Por último, es importante recalcar que el fenotipo o el genotipo asociado con el déficit de TPMP explica un porcentaje variable de casos de mielotoxicidad, pero que en ningún caso llega siquiera a aproximarse al 100%, por lo que los controles analíticos periódicos deben seguir realizándose en estos pacientes a pesar de que la función de esta enzima sea normal. BIBLIOGRAFÍA 1. Tidd DM, Paterson AR. A biochemical mechanism for the delayed cytotoxic reaction of 6-mercaptopurine. Cancer Res 1974;34:738-46. 2. García Sánchez A, Escudero Roldán M, Pérez Calle JL, González Lara V. Utilización en el año 2000 de la azatioprina y 6-mercaptopurina en el manejo de la enfermedad inflamatoria intestinal. En: González Lara V, editor. Tratamiento médico en el año 2000. Enfermedad inflamatoria intestinal; p. 113-40. Rev Clin Esp 2002;202(10):555-62 Documento descargado de http://www.revclinesp.es el 01/12/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. GISBERT JP, ET AL. TERAPIA INDIVIDUALIZADA CON AZATIOPRINA O 6-MERCAPTOPURINA MEDIANTE MONITORIZACIÓN DE LA ACTIVIDAD DE LA TIOPURINA METILTRANSFERASA (TPMT) 3. Decaux G, Prospert F, Horsmans Y, Desager JP. Relationship between red cell mean corpuscular volume and 6-thioguanine nucleotides in patients treated with azathioprine. J Lab Clin Med 2000;135:25662. 4. Colonna T, Korelitz BI. The role of leukopenia in the 6-mercaptopurineinduced remission of refractory Crohn’s disease. Am J Gastroenterol 1994;89:362-6. 5. Belaiche J, Desager JP, Horsmans Y, Louis E. Therapeutic drug monitoring of azathioprine and 6-mercaptopurine metabolites in Crohn disease. Scand J Gastroenterol 2001;36:71-6. 6. Dubinsky MC, Lamothe 5, Yang HY, et al. Pharrnacogenomics and metabolite measurement for 6-mercaptopurine therapy in inflammatory bowel disease. Gastroenterology 2000;118:705-13. 7. Markowitz J, Grancher K, Mandel F, Daum F. Relationship of leukopenia to 6-MP induced remission of Crohn´s disease. J Pediatr Gastroenterol Nutr 1998;27:A8. 8. Sandborn WJ, Tremaine WJ, Wolf DC, et al. Lack of effect of intravenous administration on time to respond to azathioprine for steroid-treated Crohn´s disease. North American Azathioprine Study Group. Gastroenterology 1999;117:527-35. 9. Lennard L, Brown CB, Fox M, Maddocks JL. Azathioprine metabolism in kidney transplant recipients. Br J Clin Pharmacol 1984;18:693-700. 10. Lennard L. Assay of 6-thioinosinic acid and 6-thioguanine nucleotides, active metabolites of 6-mercaptopurine, in human red blood cells. J Chromatogr 1987;423169-78. 11. Lennard L, Lilleyman JS. Variable mercaptopurine metabolism and treatment outcome in childhood lymphoblastic leukemia. J Clin Oncol 1989;7:1816-23. 12. Cuffari C, Theoret Y, Latour S, Seidman G. 6-mercaptopurine metabolism in Crohn’s disease: correlation with efficacy and toxicity. Gut 1996; 39:401-6. 13. Cuffari C, Hunt S, Bayless T. Utilisation of erythrocyte 6-thioguanine metabolite levels to optimise azathioprine therapy in patients with inflammatory bowel disease. Gut 2001;48:642-6. 14. Lilleyman JS, Lennard L. Mercaptopurine metabolism and risk of relapse in childhood lymphoblastic leukaemia. Lancet 1994;343:1188-90. 15. Bergan S, Rugstad HE, Bentdal O, et al. Monitored high-dose azathioprine treatment reduces acute rejection episodes afier renal transplantation. Transplantation 1998;66:334-9. 16. Schutz E, Gummert J, Armstrong VW, Mohr FW, Oellerich M. Azathioprine pharmacogenetics: the relationship between 6-thioguanine nucleotides and thiopurine methyltransferase in patients afier heart and kidney transplantation. Eur J Clin Chem Clin Biochem 1996;34:199-205. 17. Lennard L, Van Loon JA, Weinshilboum RM. Pharmacogenetics of acute azathioprine toxicity: relationship to thiopurine methyltransferase genetic polymorphism. Clin Pharmacol Ther 1989;46:149-54. 18. Sandbom WJ, Faubion WA. Clinical pharmacology of inflammatory bowel disease therapies. Curr Gastroenterol Rep 2000;2:440-5. 19. Cuffari C, Picco M, Hunt S, Bayless T. Azathioprine metabolite levels predict clinical responsiveness to therapy in IBD. Gastroenterology 1999; 116:A694. 20. Dubinsky MC, Lamothe S, Yang HY, et al. Optimizing and individualizing 6-MP therapy in IBD: the role of 6-MP metabolite levels and TPMT genotyping. Gastroenterology 1999;116:A702. 21. Lennard L, Lilleyman JS, Van Loon J, Weinshilboum RM. Genetic variation in response to 6-mercaptopurine for childhood acute lymphoblastic leukaemia. Lancet 1990;336:225-9. 22. Lowry PW, Franklin CL, Weaver AL. Cross-sectional study of IBD patients taking azathioprine (AZA) or 6-mercaptopurine (6-MP): lack of correlation between disease activity and 6-thioguanine nucleotide (6-TGN) concentration. Gastroenterology 2000;118:A788. 23. Gupta P, Gokhale R, Kirsher B. 6-mercaptopurine (6MP) metabolite levels in children with IBD: lack of correlation of 6-thioguanine (6TG) levels with clinical response. Gastroenterology 2000;118:4202. 24. Lowry PW, Franklin CL, Weaver AL, et al. Measurement of thiopurine methyltransferase activity and azathioprine metabolites in patients with inflammatory bowel disease. Gut 2001;49:665-70. 25. Dubinsky MC, Hassard PV, Abreu MT. Thioguanine (6-TG): a therapeutic altemative in a subgroup of IBD patients failing 6-mercaptopurine (6-MP). Gastroenterology 2000:A891. 26. Vesell ES. Therapeutic lessons from pharmacogenetics. Ann Intern Med 1997;126:653-5. 27. Jeurissen ME, Boerbooms AM, van de Putte LB. Pancytopenia related to azathioprine in rheumatoid arthritis. Ann Rheum Dis 1988;47:503-5. 28. Bacon BR, Treuhaft WH, Goodman AM. Azathioprine-induced pancytopenia. Occurrence in two patients with connective-tissue diseases. Arch Intern Mcd 1981;141:223-6. 29. Lennard L, Lilleyman JS. Individualizing therapy with 6-mercaptopurine and 6-thioguanine related to the thiopurine methyltransferase genetic polymorphism. Ther Drug Monit 1996;18:328-34. 30. Anstey A, Lennard L, Mayou SC, Kirby JD. Pancytopenia related to azathioprine-an enzyme deficiency caused by a common genetic poymorphism: a review. J R Soc Med 1992;85:752-6. 31. Bergan S, Rugstad HE, Klemetsdal B, et al. Possibilities for therapeutic drug monitoring of azathioprine: 6-thioguanine nucleotide concentrations and thiopurine methyltransferase activity in red blood cells. Ther Drug Monit 1997;19:318-26. 32. Lennard L. Therapeutic drug monitoring of antimetabolic cytotoxic drugs. Br J Clin Pharmacol 1999; 47:131-43. 33. Weinshilboum RM, Sladek SL. Mercaptopurine pharmacogenetics: monogenic inheritance of erythrocyte thiopurine methyltransferase activity. Am J Hum Genet 1980;32:651-62. 34. Snow JL, Gibson LE. The role of genetic variation in thiopurine methyltransferase activity and the efficacy and/or side effects of azathioprine therapy in dermatologic patients. Arch Dermatol 1995;131:193-7. 35. Evans WE, Hon YY, Bomgaars L, et al. Preponderance of thiopurine S-methyltransferase deficiency and heterozygosity among patients intolerant to mercaptopurine or azathioprine. J Clin Oncol 2001;19:2293-301. 36. Krvnetski EY, Evans WE. Pharmacogenetics as a molecular basis for individualized drug therapy: the thiopurine S-methyltransferase paradigm. Pharm Res 1999;16:342-9. 37. Yates CR, Krynetski EY, Loennechen T, et al. Molecular diagnosis of thiopurine S-methyltransferase deficiency: genetic basis for azathioprine and mercaptopurine intolerance. Ann Intern Med 1997;126:608-14. 38. Corominas H, Domenech M, González-Juan D, et al. Aplasia medular tras administración de azatioprina: papel del polimorfismo genético de la tiopurina metiltransferasa. Med Clin (Barc) 2000;115:299-301. 39. Black AJ, McLeod HL, Capell HA, et al. Thiopurine methyltransferase genotype predicts therapy-limiting severe toxicity from azathioprine. Ann Intern Med 1998;129:716-8. 40. Relling MV, Hancock ML, Rivera GK, et al. Mercaptopurine therapy intolerance and heterozygosity at the thiopurine S-methyltransferase gene locus. J Natl Cancer Inst 1999;91:2001-8. 41. Tai HL, Krynetski EY, Yates CR, et al. Thiopurine S-methyltransferase deficiency: two nucleotide transitions define the most prevalent mutant allele associated with loss of catalytic activity in Caucasians. Am J Hum Genet 1996;58:694-702. 42. Ottemess D, Szumlanski C, Lennard L, et al. Human thiopurine methyltransferase pharmacogenetics: gene sequence polymorphisms. Clin Pharmacol Ther 1997;62:60-73. 43. Spire-Vayron de la Moureyre C, Debuysere H, Sabbagh N, et al. Detection of lmown and new mutations in the thiopurine 5-methyltransferase gene by single-strand conformation polymorphism analysis. Hum Mutat 1998;12:177-85. 44. Hon YY, Fessing MY, Pui CH, Relling MV, Krynetski EY, Evans WE. Polymorphism of the thiopurine S-methyltransferase gene in African-Americans. Hum Mol Genet 1999;8:371-6. 45. Ameyaw MM, Collie-Duguid ES, Powrie RH, Ofori-Adjei D, McLeod HL. Thiopurine methyltransferase alleles in British and Ghanaian populations. Hum Mol Genet 1999;8:367-70. 46. Spire-Vayron de la Moureyre C, Debuysere H, Mastain B, et al. Genotypic and phenotypic analysis of the polymorphic thiopurine 5-methyltransferase gene (TPMT) in a European population. Br J Pharmacol 1998; 125:879-87. 47. Corominas H, Domenech M, González D, et al. Allelic variants of the thiopurine S-methyltransferase deficiency in patients with ulcerative colitis and in healthy controls. Am J Gastroenterol 2000;95:2313-7. 48. Collie-Duguid ES, Pritchard SC, Powrie RH, et al. The frequency and distribution of thiopurine methyltransferase alleles in Caucasian and Asian populations. Pharmacogenetics 1999;9:37-42. 49. Weinshilboum RM, Raymond FA, Pazmino PA. Human erythrocyte thiopurine methyltransferase: radiochemical microassay and biochemical properties. Clin Chim Acta 1978;85:323-33. 50. Jacqz-Aigrain E, Bessa E, Medard Y, Mircheva Y, Vilmer E. Thiopurine methyltransferase activity in a French population: h.p.l.c. assay conditions and effects of drugs and inhibitors. Br J Clin Pharmacol 1994;38:1-8 51. Rossi AM, Bianchi M, Guarnien C, Barale R, Pacifici GM. Genotypephenotype correlation for thiopurine S-methyltransferase in healthy Italian subjects. Eur J Clin Pharmacol 2001;57:51-4. 52. Colombel JF, Ferrari N, Debuysere H, et al. Genotypic analysis of thiopurine S-methyltransferase in patients with Crohn’s disease and severe myelosuppression during azathioprine therapy. Gastroenterology 2000; 118:1025-30. 53. Chocair PR, Duley JA, Simmonds HA, Cameron JS. The importance of thiopurine methyltransferase activity for the use of azathioprine in transplant recipients. Transpíantation 1992;53:1051-6. 54. Pazmino PA, Sladek SL, Weinshilboum RM. Thiol S-methylation in uremia: erythrocyte enzyme activities and plasma inhibitors. Clin Pharmacol Ther 1980;28:356-67. 55. Lennard L, Van Loon JA, Lilleyman JS, Weinshilboum RM. Thiopurine pharrnacogenetics in leukemia: correlation of erythrocyte thiopurine methyltransferase activity and 6-thioguanine nucleotide concentrations. Clin Pharmacol Ther 1987;41:18-25. 56. McLeod HL, Relling MV, Liu Q, Pui CH, Evans WE. Polymorphic thiopurine methyltransferase in erythrocytes is indicative of activity in leukemic blasts from children with acute lymphoblastic leukemia. Blood 1995; 85:1897-902. 57. Klemetsdal B, Straume B, Wist E, Aarbakke J. Identification of factors regulating thiopurine methyltransferase activíty in a Norwegian population. Eur J Clin Pharmacol 1993;44:147-52. 58. Pacifici GM, Romiti P, Giuliani L, Rane A. Thiopurine methyltransferase in humans: development and tissue distribution. Dev Pharmacol Ther 1991;17:16-23. 59. Mircheva J, Legendre C, Soria-Royer C, Thervet E, Beaune P, Kreis H. Monitoring of azathioprine-induced immunosuppression with thiopurine methyltransferase activity in kidney transplant recipients. Transpíantation 1995;60:639-42. Rev Clin Esp 2002;202(10):555-62 561 Documento descargado de http://www.revclinesp.es el 01/12/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. GISBERT JP, ET AL. TERAPIA INDIVIDUALIZADA CON AZATIOPRINA O 6-MERCAPTOPURINA MEDIANTE MONITORIZACIÓN DE LA ACTIVIDAD DE LA TIOPURINA METILTRANSFERASA (TPMT) 60. Szumlanski CL, Weinshilboum RM. Sulphasalazine inhibition of thiopurine methyltransferase: possible mechanism for interaction with 6-mercaptopurine and azathioprine. Br J Clin Pharmacol 1995;39:456-9. 61. Lewis LD, Benin A, Szumlanski CL, et al. Olsalazine and 6-mercaptopurine-related bone marrow suppression: a possible drug-drug interaction. Clin Pharmacol Ther 1997;62:464-75. 62. Lowry PW, Franklin CL, Weaver AL, et al. Leucopenia resulting from a drug interaction between azathioprine or 6-mercaptopurine and mesalamine, sulphasalazine, or balsalazide. Gut 2001;49:656-64. 63. Lennard L. Clinical implications of thiopurine methyltransferase optimization of drug dosage and potential drug interactions. Ther Drug Monit 1998;20:527-31. 64. Balis FM, Adamson PC. Application of pharmacogenetics to optimization of mercaptopurine dosing. J Natl Cancer Jnst 1999;91:1983-5. 65. Tavadia SM, Mydlarski PR, Reis MD, et al. Screening for azathioprine toxicity: a pharmacoeconomic analysis based on a target case. J Am Acad Dermatol 2000;42:628-32. 66. Schwab M, Schaeffeler W, Marx C, Zanger U, Aulitzky W, Eichelbaum M. Shortcoming in the diagnosis of TPMT deficiency in a patient with Crohn´s disease using phenotyping only. Gastroenterology 2001;121:500-1. 67. Lorenzen I, Brun C, Videbaek A. Treatment of immunologic diseases with cytostatics. Acta Med Scand 1969;185: 501-6. 68. Ginzler E, Sharon E, Diamond H, Kaplan D. Long-term maintenance therapy with azathioprine in systemic lupus erythematosus. Arthritis Rheum 1975;18:27-34. 69. Mertens HG, Hertel G, Reuther P, Ricker K. Effect of immunosuppressive drugs (azathioprine). Ann N Y Acad Sci 1981; 377:691-9. 70. Present DH, Meltzer SJ, Krumholz MP, Wolke A, Korelitz BI. 6-mercaptopurine in the management of inflammatory bowel disease: short and long-term toxicity. Ann Intem Med 1989;111:641-9. 71. Connell WR, Kamm MA, Ritchie JK, Lennard-Jones JE. Bone marrow toxicity caused by azathioprine in inflammatory bowel disease: 27 years of experience. Gut 1993;34:1081-5. 72. Ishioka S, Hiyama K, Sato H, et al. Thiopurine methyltransferase genotype and the toxicity of azathioprine in Japanese. Intern Med 1999;38:944-7. 73. Andersen JB, Szumlanski C, Weinshilboum RM, Schmiegelow K. Pharmacokinetics, dose adj ustments, and 6-mercaptopurine/methotrexate drug 562 interactions in two patients with thiopurine methyltransferase deficiency. Acta Paediatr 1998;87:108-11. 74. Leipold G, Schutz E, Haas JP, Oellerich M. Azathioprine-induced severe pancytopenia due to a homozygous two-point mutation of the thiopurine methyltransferase gene in a patient with juvenile HLA-B27-associated spondylarthritis. Arthritis Rheum 1997;40:1896-8. 75. Gummert JF, Schutz E, Oellerich M, Mohr FW, Dalichau H. Monitoring of TPMT in heart transplant recipients under immunosuppressive therapy with azathioprine. Artif Organs 1995;19:918-20. 76. Ben Ari Z, Mehta A, Lennard L, Burroughs AK. Azathioprine-induced myelosuppression due to thiopurine methyltransferase deficiency in a patient with autoimmune hepatitis. J Hepatol 1995;23:351-4. 77. Kerstens PJ, Stolk JN, De Abreu RA, Lambooy LH, van de Putte LB, Boerbooms AA. Azathioprine-related bone marrow toxicity and low activities of purine enzymes in patients with rheumatoid artlrritis. Arthritis Rheum 1995;38:142-5. 78. Naughton MA, Battaglia E, O’Brien S, Walport MJ, Botto M. Identification of thiopurine methyltransferase (TPMT) polymorphisms cannot predict myelosuppression in systemic lupus erythemato sus patients taking azathioprine. Rheumatology (Oxford) 1999;38:640-4. 79. Stolk JN, Boerbooms AM, de Abreu RA, et al. Reduced thiopurine methyltransferase activity and development of side effects of azathioprine treatrnent in patients with rheumatoid arthritis. Arthritis Rheum 1998;41: 1858-66. 80. Sandbom WJ. Rational dosing of azathioprine and 6-mercaptopurine. Gut 2001;48:591-2. 81. Evans WE, Homer M, Chu YQ, Kalwinsky D, Roberts WM. Altered mercaptopurine metabolism, toxic effects, and dosage requirement in a thiopurine methyltransferase-deficient child with acute lymphocytic leukemia. J Pediatr 1991;119:985-9. 82. Lennard L, Lewis IJ, Michelagnoli M, Lilleyman JS. Thiopurine methyltransferase deficiency in childhood lvmphoblastic leukaemia: 6-mercaptopurine dosage strategies. Med Pediatr Oncol 1997;29:252-5. 83. Kader HA, Wenner WJ Jr., Telega GW, Maller ES, Baldassano RN. Normal thiopurine methyltransferase levels do not eliminate 6 mercaptopurine or azathioprine toxicity in children with inflammatory bowel disease. J Clin Gastroenterol 2000;30:409-13. Rev Clin Esp 2002;202(10):555-62