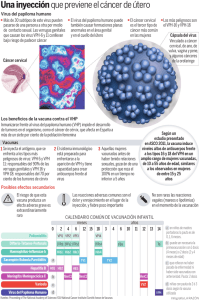
TRABAJO PROFESIONAL
Anuncio

UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE ESTUDIOS SUPERIORES CUAUTITLÁN “DETECCIÓN DE VIRUS DE PAPILOMA HUMANO DE ALTO RIESGO MEDIANTE CAPTURA DE HÍBRIDOS EN MUJERES DE LA REPÚBLICA MEXICANA” TRABAJO PROFESIONAL QUE PARA OBTENER EL TÍTULO DE: QUÍMICO FARMACÉUTICO BIÓLOGO P R E S E N T A : OSCAR GABRIEL SÁNCHEZ MANRÍQUEZ ASESORES: M en C ANA LAURA VÁZQUEZ MARTÍNEZ Dr. ALEJANDRO GARCÍA CARRANCÁ CUAUTITLÁN IZCALLI, EDO. DE MÉX. 2009 AGRADECIMIENTOS AL DR. ALEJANDRO GARCÍA CARRANCÁ DIRECTOR GENERAL DEL LABORATORIO DE INVESTIGACIÓN Y ANÁLISIS MOLECULAR S.A. DE C.V. POR LA GRAN OPORTUNIDAD QUE ME BRINDO PARA REALIZAR ESTE TRABAJO, ASÍ COMO LA ASESORÍA, APOYO, POR LA MAGNIFICA PERSONA Y SOBRETODO ESTUPENDO SER HUMANO QUE ADMIRO Y APRECIO TANTO. A LA M EN C ANA LAURA VÁZQUEZ MARTÍNEZ POR SU ASESORÍA, PACIENCIA Y CONOCIMIENTOS QUE COMPARTIÓ CONMIGO. A LOS SINODALES DE ESTE TRABAJO, QUIENES CON SUS ACERTADOS COMENTARIOS Y SUGERENCIAS, ENRIQUECIERON EL CONTENIDO Y MEJORARON LA PRESENTACIÓN FINAL, PARA QUE ESTA FACETA EN MI FORMACIÓN ESTE FINALIZANDO. A FABIOLA LÓPEZ SÁNCHEZ POR SU INVALUABLE APOYO Y AMISTAD. Dedicatorias A MI MADRE POR SU INFINITO APOYO, AMOR, COMPLICIDAD, CONSEJO Y POR INSPIRARME A SER LA PERSONA QUE AHORA SIGUE EN CONSTRUCCIÓN. A MI PADRE† QUE PENSÓ QUE NO LLEGARÍA EL MOMENTO Y ME AYUDO DE DIFERENTES Y PECULIARES FORMAS. A MIS HERMANOS: RAMÓN, MONY, ANGELICA Y VICTOR POR SU APOYO EN LA CERCANÍA Y A DISTANCIA, SU AMOR, Y TODAS ESAS COSAS QUE LOS HACEN ESPECIALES EN MI VIDA. A FELI† JOSÉ LUIS, JUANA† Y LUIS SÁNCHEZ QUE ME INSPIRAN DE GRAN MANERA Y QUIERO TANTO. A TODOS AQUELLOS QUE DE UNA U OTRA FORMA ESTÁN EN MI CORAZÓN Y FORMAN PARTE DE MI VIDA. Y ESPECIALMENTE A TI QUE FUISTE, ERES Y SERÁS SIEMPRE PARTE IMPORTANTE DE MI VIDA, GRACIAS INFINITAS. Índice Página I Introducción……………………………………………..….…….. 1 1 Historia del virus de papiloma humano…………………………… 2 2 Virus de papiloma humano………………………………………... 3 3 Las proteínas virales del papiloma humano……………………….. 5 a) Las proteínas E1 y E2……………………………………………... 5 b) Las proteínas E5, E6 y E7…………………………………………. 6 c) Las proteínas L1 y L2……………………………………………… 9 d) La región larga de control…...…………………………................... 9 4 Ciclo de vida del VPH……………………………………………... 10 5 La fase proliferativa………………………………………………... 11 6 Amplificación del genoma…………………………….…………… 13 7 La síntesis del VPH……….………………………………………... 14 8 La integración de ADN…………………………….………………. 15 9 La regresión de las lesiones y latencia del virus…….……………… 16 10 Respuesta inmune contra el VPH…………………………………... 16 a) Respuesta inmune innata…………………………………………… 17 11 Cofactores en la oncogénesis………………………………………. 18 12 Manifestaciones clínicas……………………………………………. 19 13 Alteraciones celulares del epitelio………………………………….. 21 14 Diagnostico…………………………………………………………. 23 a) La citología convencional (Papanicolaou)………………………..… 23 b Citología líquida lectura en monocapa celular………………….…... 23 c) Colposcopía………………………………………………….…….... 24 d) Diagnostico molecular de VPH……………………………………... 24 e) Captura de híbridos 2 (CH2) …………………………..…………… 25 f) Reacción en cadena de la polimerasa (PCR)……………… ………... 27 15 Tratamiento………………………………………………………….. 29 II Objetivos…………………………………………………………….. 31 III Justificación…………………….……………………......................... 32 IV Desarrollo…………………………………………………................. 33 a) Procedimiento de la técnica……………..…………….……………... 34 b) Desnaturalización de las muestras……………………………............ 34 c) Hibridación…………………………………………….…………….. 34 d) Captura de Híbridos…………………………………………………. 35 e) Detección de Híbridos………………………....…………….............. 35 f) Lavado………………………………………………………………. 36 g) Amplificación de la señal…………………………………………… 36 h) Análisis de datos….……………………………………………......... 37 V Resultados…………………………………………………………… 38 VI Discusión………………………………………….............................. 43 VII Conclusiones………………………………………………………… 45 VIII Anexo………………………………………………………………... 47 IX Citas bibliográficas…………………………………………………... 54 Lista de Abreviaturas VPH Virus de Papiloma Humano ADN Acido desoxirribonucleico CH2 Captura de Híbridos2 PCR Reacción en Cadena de la Polimerasa nm Nanómetros pb Pares de bases LCR Región Larga de Control IFN's Interferones ETS Enfermedades de Transmisión Sexual NIC-CIN Neoplasia Intraepitelial Cervical CIS Carcinoma in situ LSIL Lesión Intraepitelial Escamosa de Bajo grado HSIL Lesión Intraepitelial Escamosa de Alto grado ASC-US Atipia Escamosa Cervical de Indeterminada Significancia Pap Papanicolaou TDL Tratamientos Destructivos Locales µl Micro litros URL Unidades Relativas de Luz CV Coeficiente de Varianza IVPH Infección por Virus de Papiloma Humano LIAG Lesión Intraepitelial de Alto grado LPBG X VHP Lesión Probable de Bajo Grado por Virus de Papiloma Humano Índice de Figuras No. Figura Titulo Página 1 Esquema del modelo tridimensional del virus del papiloma humano…… 4 2 Ejemplo de la organización del genoma viral……………………………... 5 3 Interacción de E6 y E7 en el ciclo celular…………………………………. 8 4 Organización de ciclo de Vida en infección productiva por tipos de HPH 11 5 Oncogénesis por VPH y su interacción con las proteínas E6 y E7……..... 12 6 Ciclo viral en el epitelio estratificado……………………………….. 14 7 Células superficiales “Coilocitos”…………………………………… 15 8 Esquema que muestra la progresión de un epitelio normal hacia displasia y carcinoma “in situ” y las clasificaciones según Richart y el sistema Bethesda………………………………………………………. 21 9 Estuche de diagnóstico de CH2……………………………………………. 33 10 Ejemplo de procesador automático para captura de híbridos……………. 37 11 Muestras analizadas de Mayo 2005 a Mayo 2007………………….. 38 12 Porcentaje de muestras positivas de mayo 2005 a mayo de 2007…… 39 13 Frecuencia de edad en 600 pacientes que se realizaron la detección de ADN de VPH……………………………………………………… 39 14 Porcentaje de muestras positivas por edad en 600 pacientes…………. 40 15 Porcentaje de muestras positivas en algunos estados de la República... 40 16 Coeficientes de Varianza de controles negativos en las pruebas 17 18 de Mayo 2005 a Mayo 2007…………………………………………. 41 Coeficientes de Varianza de controles positivos en las pruebas de Mayo 2005 a Mayo 2007…………………………………………. 42 Tasa Nacional mortalidad 2005 Cáncer cervicouterino y por Entidad Federativa por cada 100,000 mujeres, Secretaria de Salud… 53 Índice de Tablas No. de Tabla Titulo Página 1 Equivalencias entre las diversas nomenclaturas usadas en citología…. 22 2 Comparación entre Captura de Híbridos 2 y PCR……………………………. 28 3 Resultado de las pruebas de Mayo 2005 a Mayo 2007……………….. 47 4 Coeficientes de Varianza controles negativos y positivos 2005……... 48 5 Coeficientes de Varianza controles negativos y positivos 2006……... 49 6 Coeficientes de Varianza controles negativos y positivos 2007……... 50 7 Frecuencia de edad en 600 pacientes que se realizaron detección de ADN de VPH…………………………………………… 51 8 Porcentaje de muestras positivas por edad en 600 pacientes………… 52 9 Porcentaje de muestras positivas en algunos estados de la República Mexicana de Enero de 2006 Mayo de2007………………. 53 I. Introducción Hablar de Virus de Papiloma Humano (VPH) es “La historia que no termina” 1 debido a su relación con el cáncer cervicouterino y con otros tumores del tracto anogenital femenino. Cientos de investigadores, médicos, citólogos, alrededor del mundo buscan la forma de combatir esta enfermedad desde diferentes campos, previniendo, diagnosticando y encontrando nuevas metodologías además de herramientas moleculares para la detección temprana y oportuna, así de esta manera poder salvar a más mujeres diariamente. Una fracción considerable de las infecciones por VPH es sub-clínica; el varón puede ser portador y vehículo de la infección.4 Las infecciones por los VPH representan una de las enfermedades de transmisión sexual más común en la mayor parte de los países del mundo.4 La infección cervical ocurre probablemente cuando el pene del varón infectado con virus entra en la capa basal del epitelio escamoso. Aunque el contacto genital durante cópula sexual sea probablemente la forma dominante de transmisión de VPH, existe evidencia de que la infección genital se puede adquirir por medio de fómites u otros medios no sexuales, los órganos más susceptibles de infección con potencial de iniciar una transformación neoplásica son el cuello uterino (zona de transformación) y la línea pectínea del canal rectal. El cáncer cervicouterino es un grave problema de salud pública, es la segunda causa de muerte a nivel mundial por neoplasias malignas en la mujer, con unas 500.000 muertes al año. 1 En México para el periodo de 1990 a 2000 se reportaron oficialmente un total de 48,761 defunciones por cáncer cervicouterino iniciando en 1990 con 4280 muertes en el año y terminando con 4,082 en el 2006, lo que representa en promedio 12 mujeres fallecidas cada 24 horas, las mujeres que viven en el área rural tienen 3.07 veces mayor riesgo de mortalidad por este cáncer, en comparación con las mujeres residentes en el área urbana, está situación se encuentra íntimamente relacionada con factores como la falta de escolaridad, el desempleo, el bajo nivel socioeconómico y la falta de acceso efectivo a los servicios de salud.2 Las infecciones por VPH se encuentran frecuentemente en capas del epitelio, en cuyos casos el ADN viral puede recuperarse del cuello, vulva, vagina y del canal anal. Estimaciones recientes sugieren que, en las edades de mayor actividad sexual, la 1 prevalencia de infecciones sub-clínicas por VPH pueden afectar hasta un 40% la población femenina con tasas de infección de 10-15% anual. En los grupos de mujeres mayores de 30 años, la prevalencia se reduce a un 5-10%. La duración media de las infecciones por VPH ha sido estimada en 8-10 meses, la resolución de la infección parece ofrecer un cierto grado de protección frente a reinfecciones por VPH. Nunca imagino George Nicolas Papanicolaou el alcance que tendría cuando introdujo la citología diagnóstica de frotis vaginal en 1940, ya que es una prueba de tamizaje de bajo costo y de aplicación masiva que ha permitido la detección del cáncer cervicouterino y las lesiones precursoras reduciendo significativamente la mortalidad. A finales de la década de los años 70´s, tendría algunas implicaciones técnicas, por lo cual, se ha tenido que modificar en lo que hoy se llama Citología en base liquida que permite resolver problemas como: 1) captura de la totalidad de la muestra, 2) fijación deficiente, 3) distribución aleatoria de células anómalas, 4) existencia de elementos perturbadores, 5) calidad del frotis.5 aunque esta metodología solo nos sirve eficazmente siempre y cuando están presentes anormalidades en las células, esto presenta una limitante muy importante, gracias a los avances en biología molecular y de nuevas técnicas de tamizaje podemos contar con métodos mas simples para detectar la presencia del VPH como son: La Captura de Híbridos2® y la Reacción en Cadena de la Polimerasa (PCR por sus siglas en ingles). Estas metodologías son muy sensibles y específicas detectando desde muy pequeñas cantidades de copias del virus, aunque los costos no son del todo accesibles a toda la población ya que recordemos que casi el 85% de las muertes por cáncer cervicouterino se presenta en países en vías de desarrollo. 1. Historia del virus de papiloma humano. El VPH tiene un papel muy importante en el cáncer cervicouterino, que ha sido bien establecido biológica y epidemiológicamente.3 aunque se sabe que es necesario pero no suficiente para que se pueda formar una lesión.6 esto que quiere decir que; el adquirir una infección por virus de papiloma humano no significa que tendremos cáncer y que va a morir el paciente, simplemente que hay factores determinantes conocidos de la progresión como son: el tipo viral, la persistencia de la infección en exámenes repetidos y 2 probablemente la carga viral por unidad celular, otro co-factor es el uso prolongado de anticonceptivos hormonales, inicio de relaciones sexuales a temprana edad, múltiples parejas sexuales, tabaquismo, estado hormonal, deficiencias en el sistema inmune y posiblemente la coinfección por Chlamydia trachomatis entre otros. Los casos en los que la detección de ADN viral es persistente constituyen el grupo de alto riesgo para la progresión neoplásica.4 Con la ayuda de la microscopia electrónica la revolución en la documentación de los virus dio un vuelco en la investigación en la década de los 50. Las verrugas genitales son conocidas desde la más remota antigüedad, aunque se sospechaba desde finales del siglo XIX que eran producidas por virus, hasta 1969 se logró aislar partículas virales. La primera asociación entre VPH y el cáncer cervical corresponde a la década de los 70 y a partir de ese momento se inicia una serie de estudios donde se consigue la clonación del genoma de papiloma virus en bacterias. El concepto de que algunas verrugas pueden progresar a la malignidad fue establecido por estudios de Shope, Rous en 1933, donde estudiaron la transmisión de verrugas que aparecen de manera natural en los conejos comúnmente llamados cola de algodón. Ellos descubrieron que las lesiones formadas en conejos domésticos, después de inocularlos con extractos de verrugas de los conejos de cola de algodón eran sensibles a la progresión maligna.1 El hallazgo más importante lo hizo en 1974 el Dr. Zur Hausen al ser el primero en investigar la relación del cáncer cervicouterino con la presencia de DNA de VPH por medio de experimentos de hibridación con verrugas genitales.7 Los primeros tipos de papiloma humano aislados directamente de biopsias de cáncer cervicouterino VPH16, VPH18 fueron clonados in 1983 y 1984 y después de esto empezó la expansión en los estudios rápidamente.8,9 2. Virus de papiloma humano. Anteriormente se agrupó a los Papilomavirus en la familia Papovaviridae por la similitud en su material genético que es circular de doble cadena y su cápside no envuelta. Finalmente se reconoció que las dos familias de virus cuentan con diferente organización y tamaño geonómico y no comparten ninguna similitud en la secuencia de sus nucleótidos. 3 Esto fue establecido en 2004 por el Comité Internacional en la Taxonomía de los Virus (ICTV) separándolos en dos familias diferentes, Papillomaviridae y Polyomaviridae.10 Ciento ochenta tipos de papilomavirus han sido completamente descritos, (Figura1). Se han clasificado por grupos que incluye su importancia en la patogénesis.10 Están ampliamente distribuidos en la naturaleza, en su mayoría se encuentran en mamíferos, aves y reptiles, muchos detectados en humanos, por la importancia medica en las patologías que estos provocan han sido estudiados mas ampliamente.11 Los papilomavirus aislados son descritos como tipos, esto fue basado en el aislamiento de su genoma completo, alrededor de 40 tipos afectan el tracto anogenital, por su importancia y con base en su asociación con el cáncer cervicouterino y sus lesiones precursoras y su riesgo oncogénico se clasifican en: Tipos de Alto Riesgo VPH 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59. Probable Alto Riesgo VPH 26, 53, 66, 68, 73, 82. Bajo Riesgo HPV 6, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81, CP6108. Los cuales están perfectamente adaptados al tejido de su hospedero natural, en el humano por lo general es más común encontrarlo como tumores benignos llamados verrugas cutáneas, ya que son específicos de epitelios queratinizados y mucosas, distribuidos en el cuerpo.10 Figura 1. Esquema del modelo tridimensional del virus del papiloma humano. 4 Las partículas virales del papiloma humano constan de 8000 pares de bases (pb), con un ADN de doble cadena circular y una cápside de 72 capsómeros (60 hexámeros y 12 pentámeros), con diámetro aproximado de 55nm y que alberga al genoma viral dividido en tres regiones: la región que se compone de proteínas que se expresan tempranamente (Early), E1, E2, E4, E5, E6, E7, y la región que corresponde a las proteínas tardías (Late), L1, L2, cuya expresión genera las proteínas involucradas en la producción de la cubierta viral la cápside y una región larga de control (LCR), de aproximadamente 1000pb que no codifica para ninguna proteína, pero contiene cis-elementos requeridos para la regulación de la expresión de los genes y replicación del genoma.3 Figura 2. Ejemplo de la organización del genoma viral. Muñoz et al. Vaccine 24S3 (2006) S3/1–S3/10 3. Las proteínas virales del papiloma humano a) Las proteínas E1 y E2 Los VPH replican su genoma como ADN episomal usando dos proteínas virales, E1 y 12 E2. Las proteínas E1 y E2 actúan recíprocamente formando un complejo en el origen viral de replicación (Ori) y cooperativamente activan la maquinaria de la replicación celular del genoma viral.13 5 E1 tiene una longitud casi de 2000pb aproximadamente, es de gran importancia en la investigación por ser una de las proteínas mas conservadas en los papilomavirus esto hace que muchos de los métodos de detección se basen en esta región especifica, E1 se divide en tres regiones: un dominio amino terminal, que se sospecha regula las actividades de E1, la segunda es una región espaciadora de longitud variable y una región carboxilo terminal, relacionada con una función de ATPasa y helicasa.1 Por otra parte el producto del gen viral E2 es una proteína multifuncional que controla la trascripción y replicación del genoma viral a través de su interacción con complejos celulares.14 Algo muy importante en el mecanismo de E2 en las infecciones por VPH es que modula de manera negativa la expresión de los oncogenes E6 y E7,15 por su capacidad de regular de la trascripción viral, en un mecanismo de represión del promotor temprano, el cual dirige la síntesis de los oncogenes antes mencionados. Y así detener el crecimiento de las células tumorales. En estudios donde se investigó la presencia de E2 en células HeLa provoca la detención del ciclo celular e induce apoptosis.16 b) Las proteínas E5, E6 y E7 Dentro de la función de la proteínas tempranas mencionamos por su interés tres genes que poseen actividad en la estimulación de la proliferación: E5, E6 y E7. E5 parece ser importante en el curso temprano de infección, estimula el crecimiento de la célula formando un complejo con el factor de crecimiento de la epidermis. E5 también ha mostrado características para prevenir la apoptosis posterior al daño al ADN.17,18 La proteína E5 es expresada en infecciones productivas, el rol en estas infecciones es mantener el fenotipo de la malignidad en células cancerosas representada por una proteína hidrofóbica que se encuentra en el aparato de Golgi y en la membrana plasmática o haciendo complejos con una variedad de proteínas transmenbranales como el receptor del factor de crecimiento epidermal y el receptor de estimulación colonial factor-1. E5 en VPH16 posee una actividad transformante e induce a la proteín-cinasa K (PKC) que es trascendente en la inducción de las células 3T3 en ratones o en la inmortalización de queratinocitos humanos, resultando en la supresión del inhibidor ciclin-dependiente de 6 cinasas p21CIP1, aunque la contribución de E5 en las infecciones es aun pobremente entendida.23 La propiedad oncogénica ha sido atribuida a las oncoproteínas E6 y E7 ya que muchos estudios se han realizado en este tema, contribuyen a la inmortalización celular por medio de su efecto en proteínas que regulan el ciclo celular. Las proteínas de E6 de los tipos de alto y de bajo riesgo son aproximadamente de 150 aminoácidos con 450-500pb. Las proteínas de E6 de alto riesgo se distribuyen en el núcleo y el citoplasma, se ha reportado que se han encontrado más de 12 uniones a diferentes proteínas, ha mostrado tener función en la regulación de la trascripción, incremento en la vida celular por la sobre activación de la telomerasa, de igual forma incluye la inmortalización de células primarias con queratinocitos junto con E7,19 transformación en la estabilidad en líneas celulares y tumorgénesis, altera la trascripción de genes celulares por su interacción con p300 y CBP, bloqueando la apoptosis ya que esta ligada en daño a la proteína supresora de tumores p53, por la vía de la ubiquitinación, dando lugar a la proteólisis.19 De las primeras observaciones en la acción de E6 que se han estudiado es su interacción con p53 que es un supresor de tumores bien caracterizado que regula la expresión de proteínas involucradas en el control del ciclo celular, incluso también con el inhibidor de ciclin-cinasas p21, en la exposición al daño del ADN, p53 se activa e induce altos niveles de expresión de p21, mientras que se produce el arresto del ciclo celular y apoptosis. Una vez que las células son infectadas actúa para prevenir contra los virus en las células vecinas por la activación de vías apoptoticas. Muchos virus han desarrollado mecanismos para bloquear la inducción de la apoptosis y de esta manera permitir el desarrollo de malignidades.25 Para superar la actividad proapoptótica de p53 y permitir la progresión del ciclo celular, E6 se liga al p53 en un complejo ternario con una unión ubiquitin-ligasa llamada E6-AP. (esta proteína reemplaza a Mdm2, que en células normales no infectadas es quien degrada a p53). La formación de este complejo produce la ubiquitinación de p53 y la degradación subsecuente por los proteosomas 26S, mientras que se lleva a una reducción en la vida media de p53 de varias horas a menos de 20 min en los queratinocitos, E6 también puede disminuir la regulación indirectamente en la actividad de p53 de a través de su asociación con p300/CBP que es un co-activador de p53. 7 p53 regula los puntos de control G1/S y de G2/M del ciclo celular, su producción rápida produce abrogación de estos mandos, mientras que se llevan a cabo duplicaciones cromosómicas y anormalidades en el centrosoma.25 (Figura3). La mayoría de las proteínas de VPH de bajo riesgo no se unen a p53 o lo hacen débilmente y no lo degradan.1 La proteína E7 de aproximadamente 300-320pb codifica para una proteína de 100 aminoácidos, tiene la mayor capacidad transformante,20 está ligada a la inactivación de la proteína supresora de tumores que forma parte de la familia retinoblastoma pRB que controla la replicación celular y proteínas relacionadas como p107 y p130.20 E7 está localizada en el núcleo de las células infectadas.20 Lo que hace interesante en la unión entre E7 y pRB es que conduce a la liberación de los factores de trascripción de la familia E2F dependientemente de la presencia de factores de crecimiento externos, promoviendo el progreso de la fase S del ciclo celular y por lo tanto la replicación celular.1 E7 está compuesta por tres dominios: el primero es un dominio N-Terminal (CR1), seguida por 21 aminoácidos (conocidos como CR2) y un C-Terminal. El dominio que contiene la CR2 tiene una secuencia LxCxE, esencial para la integración con pRB y las proteínas relacionadas p107 y p130.20 Una serie de experimentos sugieren que E7 puede directamente inducir alteraciones fundamentales en el metabolismo celular incluidos procesos glicolíticos y la regulación del pH intracelular, así como su habilidad para inducir anormalidades en el centrómero y como modulador mitótico ya que puede directamente contribuir en la generación de cambios cromosómicos en el hospedero que son necesarios para la progresión a la carcinogénesis.21 Figura 3. Interacción de E6 y E7 en el ciclo celular. López -Saavedra Cancerología 1 (2006): 31-55 8 c) Las proteínas L1 y L2 Las proteínas L1 y L2 han sido de gran utilidad en el estudio para la identificación de los VPH y estudios filogenéticos, esto por su alto grado de conservación en sus secuencias,21 además de ser importantes en el desarrollo de vacunas. L2 es la proteína en menor proporción de la cápside viral, L1 ocupa casi el 80% de la cápside y se expresa después de L2, esta se acumula en estructuras nucleares llamados dominios oncogénicos de la proteína de leucemia pro-monocítica (PLM) que durante el ensamblaje del virus atrae a L1 hacia estos dominios, se ha sugerido que estos cuerpos PLM son el sitio de la replicación del ADN viral y que las proteínas de la cápside se acumulan en este sitio para facilitar el empaquetamiento,1 son sintetizadas en el retículo endoplasmático de las células del hospedero, para ser posteriormente transportadas al núcleo donde se lleva a cabo su ensamblaje.16 d) La región larga de control La región larga de control (LCR), dependiendo del tipo viral mide aproximadamente 1000pb ocupando entre el 7 al 11% del genoma del virus, no codifica para ninguna proteína, pero contiene cis-elementos requeridos para la regulación de la expresión de los genes y replicación del genoma, se divide en tres partes: el promotor temprano, el amplificador o “enhancer”, de alrededor de 230pb y la región mas alejada del 5’, en donde diferentes factores celulares y virales interaccionan en esta región, entre los cuales se encuentran E1 y E2 donde modulan la actividad transcripcional y la replicación del virus, así como receptores de glucocorticoides que modulan positivamente la trascripción. El complejo proteico que se ensambla en el “enhancer”, conocido como el enhanceosoma, interacciona con las proteínas del aparato basal de trascripción, que se une en la región promotora hacia el extremo 3’ del LCR, aumentando así la actividad transcripcional del promotor y por ende la expresión de los genes tempranos.1 9 4. Ciclo de vida del VPH Los VPH inducen la formación de verrugas en una amplia serie de vertebrados incluyendo el ser humano, en la mayor parte de casos se trata de infecciones asintomáticas aunque en los últimos años se ha demostrado su capacidad oncogénica. El ciclo vital del virus del papiloma se produce de forma coordinada con la diferenciación y división celular del epitelio escamoso, al iniciar la infección se requiere el acceso de partículas virales en las células básales del epitelio escamoso a través de microlesiones que exponen dicha capa al virus.11 Para algunos tipos de VPH se piensa que requiere un rompimiento en el epitelio estratificado, tales rompimientos no están claros y puede ocurrir bajo condiciones dónde la piel esta expuesta o desgastada o se sujeta a otros ambientes dónde las microlesiones se puedan desarrollar. Se ha sugerido que para una lesión pueda ser mantenida, el virus debe infectar una célula madre “stem cell” del epitelio en las células superficiales cutáneas o dentro del folículo piloso que pueden representar un sitio importante de entrada, varios estudios han mostrado ADN de virus que han sido aislados en estos lugares. La producción de viriones maduros no ocurre hasta la capa exterior del epitelio, sin embargo, está ligada a la replicación viral y al patrón normal de queratinización y diferenciación celular.11 Para los virus de alto riesgo como VPH16 la formación de lesiones cervicales en la mucosa, puede facilitarse por la infección de células del epitelio columnar que subsecuentemente llegan a la capa basal del epitelio estratificado y al epitelio de la zona de transformación. La controversia existe acerca de la naturaleza del receptor de la superficie celular que permite la unión inicial del virus a la célula. Un trabajo reciente sugirió que la entrada de los viriones es limitado ya que es un proceso lento con una vida media de horas en lugar de minutos y eso ocurre a través de la endocitosis. Si la transformación viral en la expresión de las proteínas E6 y E7 en las células de la capa basal no es cierta según algunos autores, aunque parece que la infección inicial continua por una fase proliferativa que produce un incremento en el número de las células básales con el ADN viral en forma episomal, se ha sugerido que el genoma viral se mantiene en la capa basal en alrededor de 10–200 copias por célula y las proteínas virales tempranas (E6, E7, E1 y E2) se expresan en un nivel bajo. La contribución de E6 y E7 en la proliferación celular basal durante la infección in vivo es actualmente incierto y ha sido sugerido que la 10 expresión de E1 (y posiblemente también E2) sea suficiente para el mantenimiento basal de los episomas virales así como facilitar la segregación correcta de genomas durante la división celular.11 (Figura4). Figura 4. Organización de ciclo de Vida durante la infección productiva por tipos de HPV. J. Doorbar / Journal of Clinical Virology 32S (2005) S7–S15 (A) Representación de la piel para revelar el modelo del VPH16 y la expresión de los genes cuando la célula infectada emigra hacia la superficie del epitelio, virus como HPV2 y HPV11 sigue un patrón similar. Después de la infección (en este caso a través de un corte), el genoma viral se mantiene de forma episomal con un numero bajo de copias, durante la diferenciación del epitelio, el promotor de p97 dirige expresión de los genes E6 y E7, que son necesarios para la entrada de la fase-S (rojo). El promotor del p670 es sobre regulado en las capas más altas del epitelio, y las proteínas de la replicación viral (E1, E2, E4, E5) aumentan en abundancia (verde), facilitando la amplificación de genomas virales (azul). Los cambios en el “splicing” del ARNm permiten a E4 persistir en las capas superiores del epitelio dónde se encuentran las proteínas de la cápside viral (amarillo). (B) La amplificación del genoma viral empieza una vez en las células básales pero estas pierden su habilidad de expresar las proteínas de la fase-S. Aunque la amplificación del genoma viral puede ser detectada a lo largo de las capas superiores del epitelio, células que son activas en el apoyo de la amplificación del genoma parecen confinadas a una región dónde la expresión de E7 coincide con el incremento de la expresión de E4, y probablemente también, un aumento en la abundancia de E1 y E2. 5. La fase proliferativa Las células básales que no han sido infectadas del epitelio, terminan el ciclo celular y emigran poco después a la capa suprabasal y sufren un proceso de diferenciación terminal. Los cambios incluyen el entrecruzamiento de filamentos de queratina, la 11 secreción de lípidos que permiten la aparición del epitelio para formar una barrera física contra el ambiente durante la infección del VPH, la proteína E7 (y presumiblemente también E6) se expresa en estas células, la progresión del ciclo celular y la diferenciación terminal normal está bloqueada, se piensa que E6 y E7 trabajan para lograr estos efectos juntos y en lesiones causadas por los tipos de VPH de alto riesgo (como VPH16), las proteínas E6 y E7 se expresan con funciones que estimulan la progresión del ciclo celular y se pueden asociar con reguladores del ciclo celular y con los miembros del la familia de la proteína pRB. (Figura 5). Figura 5. Oncogénesis por VPH y su interacción con las proteínas E6 y E7. Documentos del consenso Sociedad Española de Ginecología y Obstetricia (SEGO) La infección por papilomavirus SEGO 2002 p.9-40. La proteína pRB es un regulador negativo del ciclo celular que normalmente previene la entrada de la fase-S asociada con la familia de la proteína E2F que esta involucrada en factores de la trascripción, E7 ligada al pRB desplaza a la proteína E2F, independiente de la presencia del factor de crecimiento externo y lleva a la expresión de proteínas necesarias para la replicación del ADN, E7 también se puede asociar con otras proteínas involucradas en la proliferación celular, incluso con las histonas. La capacidad de E7 para estimular la progresión de la fase-S se limita al subconjunto de células diferenciadas con niveles bajos de p21/p27 o que expresan altos niveles de E7, para superar el bloqueo de entrada a la fase-S, la proteína E6 complementa el papel de E7, se piensa que previene la inducción de apoptosis en respuesta a la entrada de la fase-S no 12 programada mediada por E7. E6 también se puede asociar con otras proteínas preapoptóticas como Bak y Bax, como consecuencia, la presencia de E6 es considerada un factor para la predisposición en el desarrollo de cáncer VPH-asociado, permitiendo de esta manera la acumulación de errores en el ADN de las células del hospedero. La proteína de E6 de tipos de VPH de alto riesgo también puede estimular independientemente la proliferación celular de E7 a través de su C-terminal. El dominio en la unión E6-PDZ es suficiente para mediar la proliferación celular en la capa suprabasal contribuyendo al desarrollo de tumores metastáticos, rompiendo la adherencia celular normal.11 6. Amplificación del genoma Para la producción de viriones infecciosos, los VPH deben amplificar su genoma viral y debe empaquetarlos en las partículas infecciosas, esto ocurre en las capas intermedias o superiores del epitelio, seguido por un aumento en la actividad del promotor tardío. El promotor tardío reside dentro del el marco abierto de lectura (ORF) de E7 y se piensa que su regulación lleva a la expresión de proteínas involucradas en la replicación del ADN viral (es decir, E1, E2, E4 y E5) sin afectar directamente la expresión de las proteínas E6 y E7 que son necesarias para la entrada a la fase-S. La amplificación de los genomas virales inicia en un subconjunto de células proliferativas y requiere la expresión de productos de genes tempranos incluso E4 y E5, a lo largo del ciclo de vida del virus, los niveles relativos de proteínas E1 y E2 de diferentes virus, permiten un aumento en el número de las copias virales en las capas superiores del epitelio, aún no se entienden bien los mecanismos moleculares que llevan a la activación del promotor tardío y a la regulación de expresión de E1/E2 y es posible que este promotor sea constitutivamente activo en todas las fases durante el ciclo productivo, los modelos actuales sugieren que un aumento en la activación del promotor durante la diferenciación pueda llevar a un aumento en el nivel de E1 y E2 (y también de E4 y E5), además un incremento subsecuente en el número de copias del genoma. Los genomas recientemente replicados servirían como templados para la expresión de E1 y E2, que facilitarían la amplificación adicional de genomas virales y a su vez, expresión en la replicación de las proteínas E1 y E2.1 (Figura 6). 13 Figura 6. Ciclo viral en el epitelio estratificado. López -Saavedra Cancerología 1 (2006): 31-55 7. La síntesis del VPH Los VPH codifican dos proteínas estructurales que se expresan en las capas superiores del epitelio infectado, cuando su genoma viral ha sido amplificado de forma completa, la proteína mayor de la cápside L1 se expresa, después L2 permite el ensamble de partículas infecciosas en las capas superiores del epitelio, la proteína L2 aumenta las estructuras nucleares conocidas como cuerpos de PML durante el ensamblaje del virus posiblemente a través de la asociación con el factor de la trascripción Daxx. Se ha sugerido que los cuerpos de PML puedan ser los sitios de replicación del ADN de los PV, y que las proteínas de la cápside se acumulan en este sitio para facilitar el empaquetamiento. La retención intracelular de antígenos de los PV hasta alcanzar las capas celulares mas altas del epitelio pueden comprometer la detección del sistema inmune al descubrir las partículas virales, particularmente como el virus tiene mecanismos moleculares que limitan la presentación de epítopos virales con el sistema inmune en las capas mas bajas del epitelio, se ha sugerido que la proteína viral E4 puede contribuir directamente a la salida del virus en la capa superior del epitelio, perturbando la integridad de la queratina afectando el ensamble de la cápside.11 (Figura 7). En las lesiones cutáneas benignas, el virus está presente en forma de plásmido extracromosomal en el núcleo de las células y se replica por separado por vía extra cromosómica. A medida que las células emigran hacia los estratos superficiales y se diferencian, cesa la replicación, pero el genoma viral en algunos tipos de infección por VPH se amplifica en las células escamosas superficiales, hasta llegar a varios 14 miles de copias por célula, en ese momento se pueden activar los genes tardíos (L1, L2) y se produce la proteína de la cápside, con lo que aparecen viriones completos. Las células superficiales en las que se acumulan numerosos viriones completos muestran características peculiares recibiendo el nombre de “coilocitos”. (Figura7) Figura 7. Células superficiales “Coilocitos” Cortesía Dr. J.E. Carmona. 8. La integración de ADN El ADN del VPH normalmente se encuentra en forma extracromosomal o episomal en lesiones benignas o en lesiones precursoras. Sin embargo, en muchas células de cáncer cervical así como en líneas celulares y en queratinocitos humanos VPH-transformados in vitro, el ADN del VPH se integra en el genoma del hospedero. Los tejidos de cáncer pueden contener ambos tipos de ADN viral episomal o integrado al mismo tiempo, aunque la integración parece ocurrir más frecuentemente en VPH18 que en HPV16. Durante la integración de ADN del VPH, el genoma viral normalmente rompe la región de E1/E2. El rompimiento lleva a la pérdida de las regiones E1 y E2. La pérdida de E2 codifica para proteínas que incluyen la inhibición de la trascripción de las regiones de E6 y E7, resultando en un incremento en la expresión de las estas proteínas, llevando a la transformación maligna de las células del hospedero y la formación del tumor. La integración viral en ADN genómico del hospedero juegan un papel fundamental en la progresión en las lesiones de bajo y alto grado.26 15 9. La regresión de las lesiones y latencia del virus Aunque la amplificación del genoma y empaquetamiento son necesarios para la formación de nuevos viriones, la infección puede tener otros resultados, la inoculación experimental con papilomavirus de conejo cola de algodón ROPV, o la inoculación de perros con papilomavirus oral canino COPV generalmente llevan al desarrollo de lesiones que pueden persistir durante semanas en lugar de años. Lesiones producidas por ROPV y COPV se parecen en muchos aspectos a las producidas por los VPH y estos virus se han propuesto como modelos para estudiar la mucosa en la infección de VPH en los humanos entre 8 y 12 semanas, la infiltración de linfocitos y la regresión de la lesión tiene lugar en aproximadamente 16 semanas, el área infectada tiene la apariencia de un epitelio sin infección. La importancia del sistema inmune para controlar la enfermedad está bien establecida contra el VPH pero los pacientes con problemas en el sistema inmune son susceptibles a la infección y pueden desarrollar lesiones que reinciden para su tratamiento. Las infecciones de VPH, son un problema particular en personas que han recibido un trasplante renal asi como en otros pacientes inmunosuprimidos. La detección frecuente de ADN de virus tipo VPH16 en lesiones cervicales en ausencia de cualquier lesión obvia, puede explicarse por la presencia en estado latente por parte del virus en muy pocas células. Se piensa que el ADN del VPH permanece en las células basales del epitelio y se reactiva posteriormente. El modelo de expresión de los genes virales en las capas celulares basales durante la infección latente puede ser similar al modelo de la expresión durante la infección productiva. Se ha sugerido que la expresión de los genes latentes se restrinja a E1 y E2 y que durante esta fase del ciclo de vida del virus no se requieren los genes E6 y E7.11 10. Respuesta inmune contra el VPH Hasta el momento se desconocen muchos aspectos de la respuesta inmune contra los VPH, no obstante, se sabe que la respuesta inmune celular es crucial en la patogénesis de la infección por VPH, una de las ventajas que posee este virus, es que no produce lisis celular, por lo cual los antígenos virales no parecen estar disponibles para ser presentados por las células presentadoras de los antígenos y por lo tanto se limita la inducción de células T 16 citotóxicas específicas. La expresión de las proteínas del VPH está cercanamente ligada al estado de diferenciación de la célula epitelial infectada, las proteínas E1 y E2 tienen un bajo nivel de expresión, además de que se localizan en el núcleo donde son difícilmente reconocidas por el sistema inmune.11 Las proteínas E4, L1 y L2 se localizan tanto en el citoplasma como en el núcleo y se expresan a niveles importantes, pero sólo en los queratinocitos bien diferenciados, los cuales son rápidamente descamados del epitelio, impidiendo su adecuado reconocimiento por el sistema inmune, en las pacientes con infección cervical persistente por VPH16 se ha encontrado ausencia de respuesta a la proteína E6, lo cual sugiere un papel importante de la respuesta de las células T a E6 para la regresión de las lesiones. En general, la gran mayoría de péptidos o antígenos del cáncer son pobremente inmunogénicos. Las células tumorales frecuentemente sub-regulan la expresión de moléculas del complejo mayor de histocompatibilidad MHC-I o inducen mutaciones en el gen de la β2-microglobulina como estrategia para evadir su reconocimiento por parte del sistema inmune.24 a) Respuesta inmune innata El principal mecanismo de defensa ante una infección viral requiere la integridad de las superficies epiteliales o endoteliales, una vez que se altera el mecanismo de barrera, se dispara una serie de mecanismos inespecíficos o innatos tales como la producción de interferones (IFN's), células asesinas (NK) y los macrófagos. La infección viral celular induce la producción de IFN-alfa (IFN-α) e IFN-beta (IFN-β), los cuales activan mecanismos antivirales en las células vecinas capaces de resistir la infección. El interferón gamma (IFN-γ), por otra parte, activa la función de las NK y macrófagos e incrementa la eficiencia de la respuesta inmune adaptativa mediante la estimulación de la expresión de las moléculas del complejo mayor de histocompatibilidad tipo I y II (MHC-I, MHC-II).24 17 11. Cofactores en la oncogénesis La capacidad de los diferentes tipos de VPH de alto riesgo para transformar e inmortalizar las células infectadas se ha establecido ampliamente. Sin embargo, también se pueden encontrar casos donde las infecciones tienen una regresión espontánea, incluso en casos dónde la infección persiste y las lesiones no aparecen hasta muchos años o más de una década después. La infección puede comenzar pero no necesariamente progresa a carcinoma cervical o sus lesiones precursoras. La influencia por otros factores, o cofactores, es necesaria para establecer una malignidad VPH-inducida.26 Los factores más investigados han sido otras enfermedades de transmisión sexual (ETS). En estudios caso control, al estudiar la relación entre ETS y cáncer cervical, se encontró una débil asociación entre anticuerpos frente a Chlamydia trachomatis y el NIC3-carcinoma in situ y carcinoma cervical, pero solamente en aquellos casos en que la detección de VPH era negativa. Aunque este hecho podría ayudar a explicar los casos de cáncer en los que no se detectaron secuencias de VPH, se duda que exista este tipo de cáncer cervical. Mucho tiempo se pensó que herpes virus podría desarrollar un importante papel en la oncogénesis cervical, sin embargo, no se ha podido demostrar en estudios caso-control.27 Aunque en 1994 se describió una asociación entre herpes virus 6 y cáncer cervical.28 La inmunosupresión es un cofactor importante en el inicio y rápida progresión de la enfermedad, puede presentarse en pacientes sometidos a quimioterapia por neoplasias o a tratamiento inmunosupresor en casos de trasplante. El tabaquismo ha sido identificado en algunos estudios como un factor de riesgo independiente para el cáncer cervical, los anticonceptivos orales pueden tener un papel importante ya que se encontró asociación entre su uso prolongado y riesgo de carcinoma, pero solamente en las mujeres VPH positivas. Las mujeres que han utilizado 6 años o más anticonceptivos orales y están infectadas por un VPH de alto riesgo tienen un riesgo 4 veces superior de desarrollar un cáncer cervical, con respecto a las mujeres que no los utilizan y que también están infectadas.4 18 12. Manifestaciones clínicas Uno de los retos de la medicina a lo largo del tiempo ha sido sin lugar a duda ganar la batalla al cáncer que hasta el día de hoy sigue siendo un problema de salud pública y social de primer orden, las formas de lucha más eficaces serían la prevención del mismo o bien su diagnóstico en fases tempranas, aquellas en que pueda ser curado después de un tratamiento adecuado. El análisis temprano de las lesiones preinvasoras no es nuevo, ya desde el siglo pasado algunos autores comentaron la existencia de anomalías morfológicas no invasoras del epitelio adyacente al tumor. En 1910, Rubin (Nueva York) habla de cáncer incipiente para nominar el concepto de transformación neoplásica confinada al espesor del epitelio. En 1912, Schottländer y Kermauner (Berlín) utilizan el término de carcinoma temprano para designar los cambios que observaban en el epitelio adyacente al carcinoma cervical invasor. Veinte años más tarde, Broders (Nueva York), basandose en su experiencia en dermatopatología, emplea el término de carcinoma in situ e invasor (CIS) al describir éste cuadro histológico. Otros términos utilizados fueron el de enfermedad de Bowen cervical por Lecéne (París), también en 1932, y el de carcinoma intraepitelial no invasor por Galvin y Te Linde (Nueva York), en 1933. Pese a la proliferación de estos y otros muchos sinónimos, el término acuñado por Broders es el que ha permanecido para designar estas lesiones caracterizadas por la completa sustitución del epitelio por células anómalas semejantes a las células del carcinoma invasivo.29 De cualquier forma, también es sabido que antes de llegar al denominado carcinoma in situ, existen otras alteraciones morfológicas previas, con identidad propia, capaces de ser diagnosticadas tempranamente, con esta idea surgió en 1956 con Reagan el término de displasia cervical,29 entendiéndose como tal a todo un espectro de anomalías morfológicas comprendidas entre el epitelio cervical normal y el del carcinoma in situ. La displasia del cérvix uterino es por tanto, el conjunto de cambios morfológicos del epitelio cervical que llevan a una desestructuración en la forma de las células escamosas, asociado a una atipia citológica, reflejada como una hipertrofia e hipercromásia nuclear.4 Durante mucho tiempo se intentó separar el concepto de displasia, como lesiones capaces de regresar del carcinoma in situ o preinvasor. Aunque en un principio parecía entendible, pronto surgieron problemas de reproducibilidad y limitaciones a la interpretación 19 histológica que dieron lugar a subclasificaciones, no fácilmente entendibles. En la segunda mitad del siglo XX se comprobó que las características celulares tanto de la displasia como las del carcinoma (in situ o invasor) serían las mismas (población monoclonal; contenido aneuploide del ADN, etc.), dando por hecho que se trataría del mismo proceso sólo que en diferentes momentos del estadio de evolución. Con base en estos estudios biológicos, fue Richart quien propuso que todas estas alteraciones podían evolucionar a una invasión e introdujo el concepto de Neoplasia Intraepitelial Cervical, más conocido con la terminología de CIN o NIC, también se cuantificó el grado de lesión lo que permitió la subdivisión en diferentes grados de severidad. Así tendríamos NIC 1 o displasia leve, cuando las alteraciones morfológicas descritas hagan referencia al tercio inferior del epitelio; NIC 2 y NIC 3 cuando la lesión alcance respectivamente dos tercios o la totalidad del espesor del epitelio.29 Las diferencias entre displasia severa y carcinoma in situ quedarían reflejadas por la existencia de una capa de elementos celulares aplanados en la superficie del epitelio. Esta clasificación, aunque todavía vigente, no está exenta de ciertas limitaciones y problemas de reproducibilidad en el momento de diagnosticar, se ha visto que no todas las lesiones de NIC evolucionan de la misma manera, más aún desde que se comprobó su asociación con los diferentes genotipos del VPH, capaces de conferir mayor o menor grado de agresividad. Esto hace que se replanten nuevos intentos de clasificación. En este sentido fue el mismo Richart quien sugirió clasificar como NIC-bajo grado y NICalto grado; el primero englobaría a lesiones de VPH y NIC 1 y el alto grado NIC 2 y 3. Otra modificación sería introducida por el sistema de Bethesda y propondría los términos de Lesión intraepitelial escamosa de Bajo grado (LSIL) y el de Lesión intraepitelial escamosa de Alto grado (HSIL). En el primero de los casos se incluirían los términos de alteraciones por papilomavirus humano (condilomas) y NIC 1, mientras que en el segundo grupo se incluiría el resto. Estos dos nuevos sistemas de reclasificación serían los mismos salvo que en el del sistema de Bethesda se prefiere el término de lesión al de neoplasia (Figura 8). 20 Figura 8. Esquema que muestra la progresión de un epitelio normal hacia displasia y carcinoma “in situ” y las clasificaciones según Richart y el sistema Bethesda. La clasificación del Sistema Bethesda del año 2001 ayuda a reconocer mejor las lesiones iniciales y facilita la reproducibilidad. En esta clasificación diferencia las alteraciones celulares según provengan del epitelio superficial o del glandular.29 Esta nueva clasificación quedaría de la siguiente manera: 13. Alteraciones celulares del epitelio a. Del epitelio escamoso de superficie: Atipia de células escamosas: ASC • De significado incierto. ASC-US Que no puede ser excluido • Lesión intraepitelial de bajo grado (VPH-NIC 1). • Lesión intraepitelial de alto grado (CIS, NIC2, NIC 3; sospechosos invasor. • Carcinoma de células escamosas. b. Del epitelio glandular: Atipia: • De células endocervicales. • De células endometriales. • De células glandulares. 21 Atipia: • De células endocervicales en favor de neoplasia. • De células glandulares en favor de neoplasia. • Adenocarcinoma endocervical “in situ” • Endocervical • Endometrial • Extrauterino • No especificado de otra manera. Por otra parte la clasificación de Papanicolaou fue de gran utilidad por muchos años, está basada en números que denominaba clases, que describían los cambios celulares. Se dividen en cinco clases y enuncian en números romanos: I. Hallazgos celulares esencialmente normales II. Cambios celulares diversos, compatibles con alteraciones de tipo inflamatorio. III. Incluía cambios celulares inciertos, algunos correspondientes a alteraciones inflamatorias y cambios regenerativos, sin incluir células con cáncer, que se describen en la siguiente clase. IV. Células con cambios iniciales de cáncer, como el carcinoma “in situ” V. Células con cambios indudables de cáncer CLASIFICACION PAPANICOLAOU NOMENCLATURAS NORMAL (CLASE II ) (CLASE III) (CLASE IV) (CLASE V) LEVE MODERADA GRAVE CARCINOMA (CLASE I) DISPLASIA NORMAL (OMS) NIC “in situ” NORMAL NIC I NORMAL LIE DE BAJO NIC 2 NIC 3 (RICHARD) SISTEMA BETHESDA LIE DE ALTO GRADO GRADO Tabla 1. Equivalencias entre las diversas nomenclaturas usadas en citología. LIE: Lesión Intraepitelial Escamosa 22 14. Diagnóstico a) La citología convencional (Papanicolaou) La citología permite la detección de lesiones precursoras del cáncer de cuello uterino mediante una intervención inocua y de bajo costo.31 El fundamento de la técnica radica en la localización de la mayoría de las lesiones en una zona fácilmente accesible, y en el reconocimiento del grado de maduración de las células atípicas que descaman de la superficie del epitelio. El procedimiento se ha aplicado durante los últimos cincuenta años con pocas variaciones.4 La citología cervical está considerada como uno de los procedimientos más eficaces en medicina preventiva y probablemente como el más eficaz en prevención de cáncer, aunque se ha calificado como una prueba de rentabilidad subóptima,30 ya que frecuencia de falsos negativos en la citología sigue siendo una de las limitaciones de los programas de detección y una de las mayores causas de litigio médico.32 Puesto que la frecuencia de falsos negativos puede ascender hasta el 50% para las lesiones de HSIL y entre el 6 y el 45% para las de LSIL. Un tercio de dichos falsos es atribuible a una mala interpretación citológica, pero los otros dos tercios son una consecuencia directa de la obtención, proceso y calidad de la muestra. Para obtener buenos resultados con la citología es requisito fundamental que la toma sea correcta, obteniendo el material directamente del endocérvix y exocérvix, para mejorar la toma endocervical se usa un cepillo, que introducido en el interior del endocérvix se adapta bien a sus paredes y al rotarlo raspa la superficie, para la toma de ectocérvix se usa una espátula de madera.30 b) Citología en base líquida lectura en monocapa celular En los últimos años se han desarrollado técnicas de proceso citológico en medio líquido, lo que permite una homogenización de la muestra para posterior extensión en monocapa celular, parece ofrecer una serie de ventajas sobre la citología convencional, especialmente al mejorar la lectura de los frotis al eliminar los grumos, sangre y otros artefactos, mejorando así la lectura microscópica, a su vez, esta técnica permite opcionalmente, la detección molecular de VPH sin necesidad nuevo muestreo.30 23 c) Colposcopía El estudio colposcópico permite la identificación de características sutiles de los epitelios, inapreciables a simple vista, que son la expresión de cambios patológicos. Es un excelente método, en combinación con el diagnóstico citológico, para la identificación y localización de las lesiones.4 La colposcopía se ha consolidado como parte fundamental del protocolo para el diagnóstico de las lesiones intraepiteliales y el cáncer inicialmente invasivo del tracto genital inferior (TGI).30 El objetivo del estudio colposcópico es aumentar la sensibilidad de la citología. En el diagnóstico de la citología anormal el estudio colposcópico tiene por finalidad: 1) confirmar la lesión; 2) descartar invasión; 3) establecer el grado de la lesión; 4) determinar las características de la lesión: topografía, extensión, afectación glandular; 5) diagnosticar neoplasias multicéntricas y 6) seleccionar la conducta terapéutica y el tipo de tratamiento, si precisa. La clasificación tiene en cuenta una serie de características de las imágenes, que permiten diferenciarlas en cambios menores, mayores o sugestivas de invasión que se corresponden, en general, con LSIL, HSIL o cáncer invasivo respectivamente.30 d) Diagnóstico molecular de VPH Ya se comento acerca de la citología y la colposcopía como método de detección aunque estas son limitadas a la presencia de malformaciones celulares y presencia de una lesión, siendo de esta forma la importancia de pruebas complementarias para la detección temprana de presencia de infección con VPH, ya que la detección de ADN viral ha sido propuesta como prueba de tamizaje primario ya que es más sensible que la citología convencional o en base liquida.33 La detección viral (y en particular la persistencia de la infección) es un factor necesario para la progresión y el mantenimiento de la lesión neoplásica de alto grado.33 24 La tecnología de detección de ADN viral está estandarizada, altamente automatizada y disponible en versión adecuada para la utilización clínica. Las principales ventajas del sistema podrían resumirse en: 1) Menor dependencia de la calidad de la muestra recogida. 2) Lectura objetiva y cualitativa de resultados. 3) Facilidad de transferencia al laboratorio clínico de automatización del proceso. 4) Elevado rendimiento persona/tiempo. 5) Alta reproducibilidad interlaboratorios.30 Las técnicas deben tener la sensibilidad y especificidad necesarias, además de una buena reproducibilidad, para considerarlas óptimas y aplicarlas en la detección del VPH en la práctica clínica y de esta forma reducir la posibilidad en el porcentaje de falsos negativos de citología. En los últimos 5 años se encuentran pautas que reconocen el valor de la prueba de ADN de VPH como detección primaria y manejo de citología cervical anormal, por lo que se ha establecido en EU y considerado en Europa,33 como sabemos los programas para la prevención han reducido la incidencia de cáncer cervical en muchos países industrializados, la sensibilidad limitada de citología cervical hace estos programas difíciles y caros de mantener. Por consiguiente, durante los próximos años es probable que se empiece a cambiar en todo el mundo los programas de detección basados en citología cervical a programas basados en la detección de ADN para los tipos de alto riesgo de VPH.35 e) Captura de híbridos 2 para la detección de ADN de VPH Qiagene® Hoy en día existen muchos protocolos descritos en publicaciones que utilizan en los laboratorios para identificar ADN de VPH, pero se dispone de escasa información acerca de su sensibilidad, especificidad y reproducibilidad. La única excepción es la técnica captura de híbridos 2 para VPH (CH2, Qiagen antes Digene Co.), que está disponible como método estandarizado y que ha sido aprobada por la Food and Drug Administration de Estados Unidos (FDA).34 La técnica de captura de híbridos 2 (CH2), detecta sitios específicos de ADN del VPH, basada en la amplificación de señal y su detección por quimioluminiscencia con anticuerpos específicos para los híbridos ADN-ARN en una microplaca de captura. la captura de híbridos de primera generación se realizaba en tubo (CHT) detectando tipos de VPH de alto riesgo 16, 18, 31, 33, 35, 45, 51, 52, y 56 (como inicialmente definió Digene y 25 apoyado por estudios epidemiológicos). La aprobación de la FDA se concedió en mayo de 1995, en marzo de 1999, la FDA aprobó la prueba de segunda generación (CH2), a la que se agregaron cuatro tipos virales adicionales a la categoría de alto riesgo en la prueba: 39, 58, 59, y 68. El nivel de detección de la prueba de segunda generación CH2 es de 5,000 copias virales por la muestra, o un picogramo de ADN de VPH por muestra (en contraste con CHT que detectaba a partir de 10 picogramos).36 En la literatura hay una gran cantidad de publicaciones que suman mas de 300 con respecto a la prueba de captura de híbridos, lo que sigue es justo una muestra de la abundancia de la información clínica que se ha derivado de estos estudios, implicando a más de 40,000 mujeres, dentro de las cuales se menciona que, utilizar en conjunto la citología (Papanicolaou) con la captura de híbridos es una manera más eficaz de determinar el riesgo para desarrollar cáncer o sus lesiones precursoras, que solamente utilizar la citología.35 Por ejemplo en un estudio de 10 años el valor predictivo-negativo de la prueba combinada de CH2/Pap es 99.21% para lesiones de NIC3.40 Un estudio mostró que la prueba de CH2 es una herramienta significativamente más sensible para el cribado del cáncer cervicouterino, que la citología convencional y que la citología en base liquida. Este estudio aleatorio y controlado, compara la prueba de ADN de VPH con la citología convencional y en base liquida, demuestra una ventaja considerable de la prueba independientemente del tipo de citología utilizada. La prueba del ADN de VPH fue 40% más sensible que la citología convencional y alrededor de un 30% más sensible que la citología en base liquida. La prueba de CH2 por sí sola ha sido más sensible que la citología convencional en mujeres entre 35 y 60 años. En otro estudio una población con resultado de ASC-US en citología, la sensibilidad de la prueba de CH2 para detectar lesiones precursoras de alto grado y cáncer cervical es de 96%, comparado con un 85% para una prueba de citología liquida.41 Por otra parte un análisis de una cohorte de 5671 mujeres mayores de 30 años demostró que la sensibilidad en detección de HSIL en la citología convencional era 57%, y que la citología líquida tenia un 84% de sensibilidad mientras que la prueba de CH2 era 100% sensible.42 Un estudio de 8466 mujeres en donde hacían detección de cáncer cervical de rutina mostró que la sensibilidad de la prueba CH2 usada conjuntamente con citología era del 100%, para la detección de NIC2+, mientras que si se hacia de forma individual la citología tenia 26 43.5%.43 En otro estudio de más de 11000 mujeres, la prueba de CH2 mostró ser 97% sensible para NIC2+, comparado con el 77% para la citología convencional, el estudio también documentó que las mujeres infectadas con VPH de alto riesgo y que tienen citología normal se puede manejar eficazmente, repitiendo la prueba después de 12 meses seguido de colposcopía .44En un estudio en 3091 mujeres, observaron que las mujeres con infección persistente de VPH (3 años o más), aumenta el riesgo relativo 300 veces de desarrollar una enfermedad cervical de alto grado HSIL que mujeres VPH-negativas.39 Puesto que la prueba CH2 es más sensible que la citología cervical en la detección de NIC2 y NIC3, las mujeres con resultados consecutivos de la prueba en donde son negativos, pueden estar tranquilas ya que el riesgo de no identificar una lesión de alto riesgo NIC2 y NIC3 o cáncer cervical es aproximadamente 1 en 1000.45 Las recomendaciones del Colegio Americano de Ginecología y Obstetricia (ACOG), la sociedad de Cáncer Americana (CAS), y la Asociación de Profesionales en Salud Reproductiva (ARHP), es que mujeres que tienen resultados negativos en las pruebas con citología y CH2 tienen virtualmente ningún riesgo de desarrollar cáncer o sus lesiones precursoras, en los próximos 3 años. El desarrollo de técnicas de biología molecular que detectan VPH de alto riesgo, con gran sensibilidad ha generado grandes expectativas para su aplicación en los programas de diagnóstico temprano del cáncer de cuello y sus lesiones precursoras. La asociación de estas técnicas a la citología cervical tiene como objetivo seleccionar aquellas mujeres que tienen mayor riesgo de presentar lesiones histológicas de alto grado o carcinoma, con el fin de evitar la práctica de colposcopias innecesarias, prolongar la duración de los intervalos de control y disminuir el número de visitas al ginecólogo.46 f) Reacción en cadena de la polimerasa (PCR) Otras de las pruebas que se efectúan para la identificación de DNA de VPH con frecuencia es la Reacción en Cadena de la Polimerasa (PCR), los protocolos mas usados en donde se emplea la PCR utilizan los “primers” consenso que se dirigen hacia una región favorablemente conservada del gen L1. Entre éstos se encuentran los “primers” GP5+/6+ y MY09/11, que amplifica un fragmento pequeño (65bp a 150bp para los “primers” GP5+/6+ 27 y 450bp para MY09/11) del gen L1. Estos métodos se han diseñado para realizar diferente estudios y tener una alta sensibilidad analítica en general, estos sistemas de PCR que usan los “primers” múltiples como PGMY09/11 y SPF son más robustos para detectar infecciones múltiples que sistemas que usan los “primers” simples como GP5+/6+. En las infecciones múltiples dónde un tipo está presente en cantidades más grandes que otros, la sensibilidad analítica y especificidad de la PCR varía enormemente, estas dependen de las características de la prueba, el tipo, calidad de la muestra biológica, tipo y calidad de los reactivos que se emplean, incluso el uso de diferentes polimerasas de ADN afectan la función óptima de la prueba. De esta manera debe de tenerse cuidado al trabajar con esta técnica y vigilar los controles de calidad ya que hasta el día de hoy no está estandarizado su uso entre los laboratorios, limitando su reproducibilidad. Haciendo de esto una gran diferencia en comparación con la detección de ADN de VPH por la técnica de CH2 ya que tiene muchas desventajas como: Comparación entre CH2 y PCR CH2 PCR Aprobación de la FDA SI NO Método estandarizado SI NO Preparación de la muestra No es requerida Necesaria para remover inhibidores Requerimientos del laboratorio Requiere un área simple Requiere múltiples áreas y equipos para procesar datos Cantidad de muestras Proceso superior a 176 muestras en 5.5 horas Depende del método Detección de tipos de VPH de alto riesgo La prueba detecta los 13 tipos AR 16,18,31,33,35,39,45,51,52,56,58,59,68 Depende del método Detección de tipos de VPH de bajo riesgo 6,11,42,43,44 Depende del método Tabla 2. Comparación entre Captura de Híbridos 2 y PCR. 28 15. Tratamiento Ya que el virus no puede erradicarse, los tratamientos se concentran en curar las lesiones intraepiteliales y escamosas, así como las verrugas que causa, de esta manera, los métodos utilizados destruyen la zona afectada, con manejos conservadores y relativamente sencillos. Toda lesión de alto grado diagnosticada por biopsia debe ser tratada para evitar su progresión, sin embargo, no hay un acuerdo sobre cual es la mejor conducta, observación o tratamiento, en las mujeres jóvenes con diagnóstico histológico de LSIL. Los tratamientos pueden ser destructivos locales (TDL) es decir, aquellos que producen una destrucción física de la lesión como: la electrocoagulación, la termocoagulación, la criocoagulación y el láser. Cada uno de ellos con sus ventajas e inconvenientes.4 Los criterios de selección necesarios para aplicar un TDL, son los siguientes: 1. Completa visualización de la lesión y de la unión escamocolumnar al examen colposcópico. 2. Descartar la extensión al canal endocervical. 3. Descartar la presencia de microinvasión o cáncer invasivo. 4. Correlación entre métodos diagnósticos. 5. Garantía de control posterior de la paciente. 6. Lesiones de alto grado sólo deben tratarse en casos muy selectivos. Cuando no se cumplen estos requisitos es obligatoria la práctica de un tratamiento escisional (TE). Los tratamientos escisionales que pueden emplearse sobre las lesiones preinvasoras del cuello uterino son los siguientes: 1. Conización. a. Fría o convencional (bisturí). b. Láser. c. Asa diatérmica. 2. Histerectomía. La histerectomía como tratamiento de lesión preinvasora, estará solo justificada en aquellos casos en que se asocie otra patología que por si misma requiera la intervención. En los últimos años se ha observado una notable evolución en el tratamiento de las lesiones preinvasoras. Al principio hubo un auge de los tratamientos destructivos sin embargo, 29 recientemente se duda de la conveniencia de éstos, prefiriéndose los tratamientos escisionales.4 En las mujeres diagnosticadas de NIC por biopsia que reúnen estrictos criterios de selección como colposcopía satisfactoria y legrado endocervical negativo, los resultados del tratamiento son semejantes con cualquiera de las técnicas: crioterapia, láser o escisión con asa.30 En general, en mujeres con HSIL se aconseja tratamiento escisional, preferentemente mediante asa, para descartar así una eventual microinvasión inesperada, presente en el 1% de los casos. No está justificado el tratamiento inmediato sistemático, a todas las mujeres con cualquier citología anormal, dado el elevado número de tratamientos innecesarios que resulta de aplicar este proceder. Previamente se debe realizar un estudio con colposcopía-biopsia sólo en mujeres con citología de HSIL y colposcopía con cambios mayores, asimismo, la histerectomía no está, en absoluto, justificada como tratamiento primario de las lesiones intraepiteliales, sólo se indicaría cuando hay patologías asociadas.30 30 II. Objetivos a) Objetivo General: Conocer y demostrar la utilidad de la prueba de Captura de Híbridos2 como método de detección de ADN del virus de papiloma humano, en muestras de mujeres de algunos estados de la República Mexicana para su análisis y buenas prácticas de laboratorio. b) Objetivos Particulares: Demostrar las buenas prácticas en el laboratorio de la técnica CH2 al procesar muestras de mujeres provenientes de diferentes estados de la república mediante métodos estadísticos que reflejen un buen desempeño en el área de trabajo, así como de control de calidad. Identificar los grupos de edad en donde se presenta frecuentemente mayor índice de infección por VPH de alto riesgo. Realizar la comparación de mujeres infectadas por VPH en diferentes estados de la República Mexicana mediante la prueba de captura de híbridos. 31 III. Justificación La importancia en la detección y diagnóstico oportuno para el cáncer cervicouterino y sus lesiones precursoras, es de primer orden, por ser un serio problema de salud publica, recordando que es la principal causa de muerte por cáncer el la mujer, con un índice preocupante en México ya que para el periodo de 1990 a 2000 se reportaron oficialmente un total de 48,761 defunciones por cáncer cervicouterino, iniciando en 1990 con 4280 muertes en el año y terminando con 4,620 en el 2000, lo que representa en promedio que fallece una mujer cada dos horas en nuestro país por esta causa, está claro que más de 50% de las mujeres que desarrollan cáncer, nunca se han realizado una prueba de detección, otro 10% a 20% de estas mujeres no se realizaron algún método de detección por lo menos en 5 años. Sin embargo, 30% de las mujeres que desarrollan cáncer, han tenido un resultado falso-negativo en su citología y aproximadamente la mitad de esos resultados falsonegativos son debidos errores en la toma de muestra y el otro 50% es debido a errores en la interpretación. Los ensayos múltiples bien controlados de tamizaje, han demostrado claramente que la detección de ADN de VPH es considerablemente más sensible que la citología (convencional o en base liquida). Por consiguiente, las pautas en prevención se dirigen principalmente al uso de pruebas moleculares de ADN de VPH para identificar infecciones y reserva la citología cervical como una manera de determinar qué mujeres VPH-positivas requieren continuación adicional o colposcopía. Es de gran importancia determinar la presencia de una infección con VPH ya que son comunes en hombres y mujeres, algunas estimaciones indican que más del 50% de adultos sexualmente activos han experimentado una infección con uno o más tipos virales de VPH. 32 IV. Desarrollo La prueba de detección de Captura de Híbridos 2 es una técnica de ácidos nucleícos basada en la amplificación de señal y su detección por quimioluminiscencia, para la detección cualitativa de trece tipos diferentes de alto riesgo de VPH. Las muestras que contienen el ADN blanco hibridan con una sonda específica de ARN para crear híbridos ARN-ADN que posteriormente se capturan sobre una fase sólida por un anticuerpo específico para el híbrido en una microplaca, ya capturados los híbridos ARN-ADN e inmovilizados sobre la superficie de la microplaca son puestos a reaccionar con anticuerpos específicos conjugados con moléculas de fosfatasa alcalina, posteriormente un substrato quimioluminiscente produce luz que es medida en un luminómetro en unidades relativas de luz (URL), por tanto la cantidad de luz generada es proporcional a la cantidad de ADN blanco en la muestra. Figura 9. Estuche de diagnóstico de CH2. 33 Procedimiento de la técnica Con el estuche de CH2 (Figura9), a temperatura ambiente y el baño maría a 65°C previamente calentado. Se prosigue a la preparación de las muestras. a) Desnaturalización de las muestras Las muestras son desnaturalizadas por la adición de un reactivo básico de hidróxido de sodio diluido y por calentamiento durante 45 minutos a 65°C. se adiciona a cada muestra y a cada control positivo y negativo, posteriormente son agitados por medio de un vortex, la desnaturalización tiene diferentes propósitos: • Elimina la fosfatasa alcalina endógena y de igual forma destruye el ARN pre- existente que puede interferir en la formación de los híbridos ARN-ADN que pueden producir falsos negativos como resultado en la prueba. • Lisar las bacterias virus y células. • Hacer accesible el ADN presente en la muestra. • Desnaturalizar la doble cadena de ADN y poder facilitar la hibridación. b) Hibridación Se coloca 75µL y de la muestra desnaturalizada, así como de los controles positivo y negativo, en micro tubos o micro placa de hibridación, se combinan con la sonda de ARN que contiene 13 tipos diferentes de VPH de alto riesgo y se hibridan en una base líquida en baño maría o en el calentador de micro placa 60 minutos a 65°C. Las condiciones controladas en la hibridación de ARN contribuyen a una alta especificidad en la reacción, para entender esto tomamos en cuenta que el ADN está compuesto de dos cadenas complementarias de nucleótidos que se une y se separa bastante fácil, generalmente, calentando o agregando reactivos químicos específicos. El término desnaturalización se refiere al proceso de separar las dos cadenas complementarias, la hibridación ocurre cuando 34 una cadena de ADN se une a una cadena complementaria, la nueva cadena puede ser una sonda genética diseñada para unirse con una hebra de ADN específico. c) Captura de Híbridos Las muestras que han sido hibridadas son transferidas con una pipeta multicanal a la microplaca de captura, la captura de los híbridos es mediada por anticuerpos específicos para el híbrido ADN-ARN sin ninguna preferencia en la secuencia de los nucleótidos de los trece tipos que contiene la sonda, los anticuerpos se encuentran en la superficie interna de la microplaca, se requiere de agitación mecánica a 1100 rpm durante una hora para una acoplamiento eficiente. d) Detección de Híbridos Después de la Captura de Híbridos, el contenido de la microplaca de captura se decanta para posteriormente añadir el reactivo de detección 1 y se incuba a temperatura ambiente durante 35 minutos, este reactivo contiene anticuerpos conjugados con fosfatasa alcalina que: • Reconocen y se ligan a los híbridos ADN-ARN. • Son conjugados con múltiples moléculas de fosfatasa alcalina. • Unir varios anticuerpos a cada híbrido. • Esto resulta en múltiples anticuerpos conjugados a la enzima, que ligado a cada híbrido. 35 e) Lavado Las placas son lavadas manualmente ó con el lavador automático de microplaca, para remover cualquier residuo de anticuerpos conjugados. El lavado es un paso crítico en la prueba ya que un lavado inadecuado puede causar un incremento en la lectura y resultados falsos positivos debidos a residuos de fosfatasa alcalina presentes en la muestra. f) Amplificación de la señal Se agrega el reactivo de detección 2 este contiene dioxetano, que funciona como substrato para la enzima fosfatasa alcalina. Una señal quimioluminiscente se genera cuando la fosfatasa alcalina reacciona con el híbrido ADN-ARN cuando es desfosforilado en la reacción enzima-sustrato. La señal generada es proporcional a la cantidad de ADN presente en la muestra original, la señal se detecta usando una luminómetro y es registrada como Unidades relativas de luz (URL). 36 g) Análisis de datos Para la lectura y análisis de los resultados de la señal generada en la prueba de captura de híbridos requiere de un programa instalado a un equipo de computo con el software DML 2000- HLS v.2, que sirve para llevar a cabo cuatro pasos primarios. 1. Registro e identificación de las muestras. 2. Para crear la lista de muestras y las listas de trabajo de las placas. 3. Medición de las microplacas. 4. Validación de la prueba y generación de los datos para su reporte. Figura 10. Ejemplo de procesador automático para captura de híbridos. 37 V Resultados Con el objetivo de evaluar el desempeño profesional, así como demostrar la utilidad de la prueba de captura de híbridos como una prueba de elección específica y útil en la detección de ADN de virus de papiloma humano de alto riesgo, en mujeres de algunos estados de la República Mexicana, se analizaron las pruebas realizadas en el laboratorio, en 700 600 500 400 300 200 100 0 MAY JUN JUL AGO SEP OCT NOV DIC ENE FEB MAR ABR MAY JUN JUL AGO SEP OCT NOV DIC ENE FEB MAR ABR MAY TOTAL MUESTRAS un periodo que comprende de Mayo de 2005 a Mayo de 2007. Figura 11. Muestras analizadas de Mayo 2005 a Mayo 2007. Se muestra en la figura anterior los resultados del total de pruebas por mes de Mayo 2005 a Mayo 2007. 38 MAY JUN JUL AGO SEP OCT NOV DIC ENE FEB MAR ABR MAY JUN JUL AGO SEP OCT NOV DIC ENE FEB MAR ABR MAY Porcentaje 40 35 30 25 20 15 10 5 0 2005 2006 2007 Figura 12. Porcentaje de muestras positivas de mayo 2005 a mayo de 2007. Como se aprecia en la figura 12 y los resultados de la tabla 3, que representa el porcentaje de muestras positivas de mayo 2005 a mayo de 2007 se tiene un promedio de muestras positivas por prueba realizada de 25.8%, que va desde un 20% a un 33.9%. Frecuencia 60 50 40 30 20 10 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 0 Edad Figura 13. Frecuencia de edad en 600 pacientes paciente que se realizaron la detección de ADN de VPH. Como se muestra en la figura 13, hay un rango de edad de los 24 a los 46 años donde las mujeres se realizan la prueba, encontramos mas frecuencia entre los 33 y 37 años y una disminución a partir de los 43 años. 39 60 Porcentaje 50 40 30 20 10 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 0 Edad Figura 14. Porcentaje de muestras positivas por edad en 600 pacientes. En la tabla 9 figura 14, se observa que en promedio 36.5% de las muestras son positivas y aumenta en considerablemente a los 25 años con 40%, 28 42.8%, 33 48% y a los 35 años con 45.7% principalmente. principalmente 35 30 25 15 10 EDO. MEX CHIAPAS CHIUAHUA HIDALGO Q. ROO GUERRERO TLAXCALA MICHOACAN TAMAULIPAS TABASCO MORELOS PUEBLA VERACRUZ D. F. CAMPECHE YUCATAN BAJA CAL 0 GUANAJUA… 5 OAXACA Porcentaje 20 Figura 15. Porcentaje de muestras positivas en algunos estados estados de la República Mexicana. En la tabla 10 figura 15, encontramos los porcentajes de muestras mue en algunos estados de la República M Mexicana ana en donde el valor medio de porcentaje de muestras positivas es de 24.6%. 40 LIMITE MAXIMO 25% 30 25 20 15 10 5 1 7 13 19 25 31 37 43 49 55 61 67 73 79 85 91 97 103 109 115 121 127 133 139 145 151 157 163 169 175 181 0 Periodo 1 Periodo 2 Periodo 3 Figura 16. Coeficientes de Varianza de controles negativos en las pruebas de Mayo 2005 a Mayo 2007. De acuerdo a los resultados obtenidos en las tablas 4, 5 y 6, con respecto a los coeficientes de varianza de los controles negativos de la prueba que muestra la figura 16. El coeficiente de varianza se obtiene a partir de los resultados, al hacer la prueba se coloca el control negativo por triplicado y se invalida la prueba si rebasa el 25%, es correlacionado con la buena manipulación en el ejercicio de la técnica. La gráfica se divide en tres periodos, en el primero dos analistas realizaban la prueba llegando casi al límite de coeficiente de varianza de 25%, a partir del segundo periodo realizo la técnica y se reduce la varianza donde se puede apreciar que no rebasa el 20% ya para el tercer periodo se reduce considerablemente la varianza y esta no rebasa el 15% con un promedio de 7.5%. 41 LIMITE MAXIMO 15% 15 10 5 1 7 13 19 25 31 37 43 49 55 61 67 73 79 85 91 97 103 109 115 121 127 133 139 145 151 157 163 169 175 181 0 Figura 17. Coeficientes de Varianza de controles positivos en las pruebas de Mayo 2005 a Mayo 2007. De igual forma para los coeficientes de varianza de los controles positivos que se obtuvieron en las tablas 4,5 y 6 representadas en la figura 17, se observa mejoras en la manipulación de la técnica donde se reduce considerablemente los valores de varianza de los controles positivos ivos que tiene como limite 15% donde no rebasa en promedio el 5.4%. 42 VI Discusión En la primera gráfica se puede apreciar la producción en el laboratorio donde se muestra los resultados del total de los procesos de Mayo 2005 a Mayo 2007, con el total de pruebas por mes, se analizaron 8491 muestras, presenta dos aumentos considerables en el mes de julio y octubre de 2005, en los que se realizo un protocolo de investigación, por lo que resta hay un incremento paulatino reflejo del actual impacto en la población en el uso de técnicas moleculares para detección y diagnóstico de infecciones con VPH y en el cambio en los protocolos de tratamiento y seguimiento de mujeres con lesiones cervicales utilizado por los médicos. La figura 12 representa el porcentaje de muestras positivas por mes que va de un 20% a un 33.9%, con un promedio de 25.8% total, donde una parte de las pacientes son de seguimiento en las que se les encontró lesiones por colposcopía y otra parte son de detección primaria a las cuales se busca la presencia de VPH. Esto nos obliga a reforzar la detección de VPH ya que como sabemos este nos puede llevar a formar cáncer o lesiones precursoras. En la revisión de la frecuencia por edad con respecto a la toma de muestra de CH2 en una muestra aleatoria de 600 pacientes nos revela información importante y a la vez preocupante, ya que como se muestra en la figura 13, hay un rango de edad de los 24 a los 46 años donde las mujeres se preocupan por visitar a su ginecólogo, principalmente se encuentra mas frecuencia entre los 33 y 37 años y una disminución a partir de los 43 años. Es preocupante ver que mujeres mayores de 45 años no acuden a realizarse esta prueba, que es donde generalmente se presenta la etapa de la posmenopausia y los factores hormonales pueden hacer más vulnerable a padecer lesiones cervicales. La secretaria de salud así como la Administración de drogas y Alimentos (FDA) recomiendan que la prueba de detección de ADN de VPH debe aplicarse a mujeres mayores a los 30 años, ya que en mujeres mas jóvenes no deberían realizarse la prueba por lo que es muy probable que tenga regresión espontanea a la infección y se evita el sobre-diagnóstico y tratamiento innecesario. Por otra parte en la tabla 9 figura 14, se observa el porcentaje de las 600 pacientes que son positivas a la prueba, se indica que el 36.5% son positivas y aumenta la frecuencia a los 25 años con 40%, a los 28 con 42.8% a los 33 con 48% y a los 35 años con 45.7%, principalmente, en este rango de edad aumenta la vida sexual activa, un factor 43 social que influye es la tasa de divorcios en este rango de edad y frecuentemente se reporta múltiples parejas sexuales, llevando a factores de riesgo de infección con VPH. En la tabla 10 figura 15, encontramos los porcentajes de muestras en algunos estados de la República Mexicana en donde el valor medio de porcentaje de muestras positivas es de 24.6%, con estados en donde aumenta, como: Oaxaca con 32.9%, Baja California 32.3%, Yucatán 28.9% y el D.F. 28.1%, coincidiendo con la tasa nacional de mortandad por cáncer cervicouterino que reporta la Secretaria de Salud, a excepción de Chiapas que tiene 16% y es uno de los estados donde son mas frecuentes la muertes por este cáncer otro factor es que los médicos de donde se refieren las pruebas son de clínicas particulares, si fuera de población abierta las cifras cambiarían dramáticamente. Para validar la prueba es fundamental tener en cuenta los controles positivos y negativos, que se realizan por triplicado, el control negativo contiene medio de transporte y 0.05% (w/v) y acida de sodio. El control positivo contiene 1 pg/ml de DNA clonado de VPH16 en un medio de transporte y 0.05% (w/v) y acida de sodio. Son importantes para llevar el margen de calidad y basarse en la medición de la prueba ya que los controles positivos se validan por medio de un valor de corte, que es la media estadística, el cual permite estimar la relevancia clínica de una infección del VPH de alto riesgo, usando un punto de inicio validado, valor que especifica el número de copias de ADN por encima del cual una prueba se considera como positiva, la intensidad de la señal es proporcional a la carga del VPH en la muestra, la validación clínica del punto de corte de la prueba es de 1 pg/ml o aproximadamente 5000 copias del virus/muestra. Las muestras con menor número de copias del virus se clasifican como negativos y la prueba se invalida si rebasan el 15% de su Coeficiente de Varianza (CV) en el valor de corte, lo mismo ocurre con los controles negativos, la prueba se invalida si su CV es mayor a un 25%. Esta relación nos da como resultado el buen manejo de la prueba, control de calidad y es reflejo fiel de la forma de trabajar de cada técnico, ya que, mientras menor sea el CV mejor es el desempeño y las buenas prácticas de laboratorio. Por tanto se hace el estudio de los CV de Mayo 2005 a mayo 2007 en donde se encuentra el resultado de los CV de los controles negativos con un valor promedio de 9.2% y para los controles positivos de 5.4%. Esto refleja un buen avance en cuanto a las buenas practicas de laboratorio disminuyendo los CV progresivamente con forme a la experiencia que se tiene en el procesamiento de las muestras. 44 VII Conclusiones La prueba de detección de ADN de VPH Captura de Híbridos 2®, es una técnica molecular cualitativa para evidenciar trece tipos diferentes de VPH de alto riesgo por medio de quimioluminiscencia con anticuerpos específicos para los híbridos ADN-ARN. En el análisis de las muestras de mayo de 2005 a mayo de 2007 se encontró que entre el 20% y 33.9% con un promedio de 25.8% del total de las muestras fueron positivas a VPH de alto riesgo, esto denota la importancia de realizar un diagnóstico temprano, ya que en muchos casos las pacientes son de primera vez a las cuales se les dará un seguimiento y tratamiento oportuno de ser necesario. Los grupos de edad más frecuente donde las mujeres se toman la muestra de CH2 es de los 23 a los 43 años, coincidiendo con los porcentajes de muestras positivas entre los 33 y 37 años, edad en la cual, hombres y mujeres tienen una vida sexual más activa y mayor número de parejas sexuales, lo alarmante de los resultados se presenta al no haber cobertura en detección en mujeres mayores de 45 años de edad que no van a su consulta y chequeo médico haciendo de los cambios hormonales por la menopausia un factor de riesgo. En los veintiún estados de la República Mexicana que tiene cobertura el laboratorio, se encontró que, en promedio las muestras positivas fueron de 24.6%, siendo los estados más altos, Oaxaca con 32.9%, Baja California 32.3%, Yucatán 28.9%, D.F. 28.1% y Veracruz con 20%. La tasa nacional de mortalidad por cáncer cervicouterino en 2005 coincide con estos estados, los más afectados son: Veracruz, Chiapas, Yucatán, Oaxaca y Morelos. Las buenas prácticas y el control de calidad en el laboratorio se obtiene de los coeficientes de varianza, para los controles positivos y negativos fue disminuyendo progresivamente, esto refleja un buen avance en cuanto a las buenas prácticas de laboratorio con forme más experiencia se tiene en el procesamiento de las muestras. Debido al cambio en los protocolos de detección, tratamiento, seguimiento de las pacientes con pruebas moleculares se considera potencialmente útil la captura de híbridos en tres usos clínicos: 1) Como prueba de cribado primario, solo o conjuntamente con citología (Papanicolaou) para detectar lesiones precursoras de cáncer de cuello del útero; 2) Como prueba de clasificación para seleccionar a las mujeres que muestran lesiones citológicas de menor importancia que necesitan ser referidas para el diagnostico y tratamiento; 3) Como prueba de seguimiento 45 para las mujeres tratadas para lesión intraepitelial de alto grado con terapia local ablativa o excisional con la finalidad de predecir la curación o la falta del tratamiento. Lo que hace de la prueba CH2 una prueba de elección especifica y útil en la detección de ADN de virus de papiloma humano de alto riesgo. Recientemente en 2009 un grupo de investigadores internacionales elaboraron una serie de directrices para nuevas pruebas de detección de ADN de VPH para el cribado primario que se basan en los extensos estudios utilizando la CH2 y PCR-EIA GP5 +/6+, indicando como requisito para cualquier prueba candidata nueva, debe contar con sensibilidad para la detección de CIN2+: no inferior al 90% de la HC2 y especificidad para la detección de CIN2+: no inferior al 98% de la HC2. Apenas hace algunas décadas que inicio el estudio de la relación del virus del papiloma humano y el cáncer cervicouterino, podemos saber un poco de cómo funciona, como actúa, como afecta, pero el VPH tiene miles de años estudiándonos y observándonos tan detalladamente que nos hace pensar, quien sabe más de quien y por lo visto hasta ahora nos lleva ventaja, hasta que algún día podamos encontrar mecanismos específicos para poder combatir y disminuir las muertes de cáncer cervicouterino provocadas por el virus de papiloma humano. 46 VIII Anexo Tabla 3. Resultado de las pruebas de Mayo 2005 a Mayo 2007. Porcentaje Positivas 33.9 22.8 21.0 31.4 21.7 28.9 20.7 22.5 2006 Mes Total pruebas Negativas Positivas Mayo 221 146 75 Junio 315 244 72 Julio 432 341 91 Agosto 207 142 65 Septiembre 258 202 56 Octubre 580 423 168 Noviembre 275 218 57 Diciembre 208 161 47 Enero Febrero Marzo Abril Mayo Junio Julio Agosto Septiembre Octubre Noviembre Diciembre 250 363 350 361 329 347 361 371 333 361 318 343 200 278 263 275 248 258 278 290 241 275 221 250 50 85 87 86 81 89 83 81 92 86 97 93 20.0 23.4 24.8 23.8 24.6 25.6 22.9 21.8 27.6 23.8 30.5 27.1 2007 2005 Año Enero Febrero Marzo Abril Mayo 400 361 380 378 389 298 242 262 260 286 102 119 118 118 103 25.5 32.9 31.0 31.2 26.5 47 Tabla 4. Coeficientes de Varianza (CV) controles negativos y positivos 2005. Mes Septiembre CV Pos 6.25 7.68 7.68 4.15 4.84 13.77 4.69 3.19 7.81 4.21 5.49 3.9 0.91 7.84 3.53 3.44 6.58 3.72 10.86 11.36 5.88 9.18 6.01 0.03 10.26 3.63 4.1 11.07 Octubre CV Neg 3.21 12.46 13.69 12.12 12.85 7.14 22.87 16.22 16.34 14.29 16.14 12.04 16.68 5.06 15.9 4.88 22.15 19.81 5.21 12.76 10.15 7.96 3.33 2.17 24.25 10.58 12.5 17.07 Noviembre Prueba 01 02 03 04 05 06 07 08 09 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 Diciembre Agosto Julio Junio Mayo Mes prueba 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 CV Neg 5.06 12.83 5.95 11.46 7.44 11.62 3.37 20.33 18.73 9.07 18.73 5.88 23.68 17.92 12.95 10.45 11.15 4.0 8.81 0.0 5.09 18.9 3.23 4.03 7.86 1.84 4.03 2.77 4.29 CV Pos 3.96 4.69 2.37 7.38 4.06 4.23 9.51 2.69 2.9 2.51 2.62 8.3 2.84 11.79 6.73 11.12 6.38 5.3 5.36 2.87 3.87 8.54 1.58 9.18 8.02 9.83 0.42 3.63 7.59 48 Tabla 5. Coeficientes de Varianza controles negativos y positivos 2006. Agosto Julio Mes Septiembre CV Pos 11.41 1.4 1.01 0.82 5.79 4.54 4.34 12.6 3.31 6.6 0.31 9.09 7.06 6.94 0.75 0.69 6.9 4.61 3.34 0.91 9.1 0.41 2.5 6.13 6.5 5.37 2.09 10.24 10.31 5.47 4.65 2.13 8.59 6.8 1.92 3.46 4.72 5.88 3.64 5.55 10.01 6.4 4.77 1.63 3.14 Octubre CV Neg 5.88 8.65 19.75 7.95 17.75 3.69 15.38 5.21 12.76 4.96 6.07 4.0 8.9 15.29 4.04 4.68 10.07 2.25 17.84 7.33 6.28 9.49 8.02 16.55 6.73 6.07 7.05 8.67 13.26 16.82 12.86 6.74 9.76 6.74 4.88 3.09 4.8 16.4 17.47 7.86 9.56 15.79 10.78 4.0 6.66 Noviembre Prueba 01 02 03 04 05 06 07 08 09 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 Diciembre Junio Mayo Abril Marzo Febrero Enero Mes Prueba 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 CV Neg 12.6 14.7 8.56 6.35 15.55 0.0 15.75 4.44 6.3 19.67 5.15 11.11 0.0 0.0 3.24 14.24 14.65 9.61 10.12 4.71 0.0 6.96 14.03 7.14 6.0 8.88 8.66 13.04 2.91 4.75 15.71 12.31 2.44 13.15 2.37 7.28 8.65 2.37 0.0 8.23 13.87 8.48 12.16 12.38 3.46 8.57 2.55 CV Pos 6.55 1.84 1.78 4.07 7.07 3.23 11.45 7.23 5.55 2.17 3.89 3.47 3.06 7.35 3.38 1.31 4.58 6.71 2.72 8.29 3.69 10.3 4.72 7.21 5.77 13.78 7.55 2.08 5.24 2.34 2.16 8.08 7.14 12.78 2.98 3.4 3.7 7.22 4.07 10.8 2.37 9.21 5.07 2.69 8.7 3.98 7.37 49 Tabla 6. Coeficientes de Varianza controles negativos y positivos 2007. Mayo Abril Marzo Febrero Enero Mes Prueba 01 02 03 04 05 06 07 08 09 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 CV Neg 4.72 8.87 4.92 9.7 8.28 5.25 7.38 11.2 9.93 10.8 8.9 4.99 7.81 6.07 4.34 12.75 11.64 2.41 0.0 6.78 9.08 14.08 8.85 8.08 12.51 9.9 1.52 13.41 6.51 5.25 7.53 8.12 7.88 8.24 7.99 4.58 CV Pos 13.81 4.74 1.73 6.26 1.23 5.69 6.18 3.28 3.51 13.83 3.58 8.59 8.19 3.6 2.1 5.19 4.24 2.89 5.46 3.82 4.02 5.74 11.48 2.5 1.9 6.86 6.51 12.92 2.87 4.73 6.41 7.29 1.46 4.61 2.49 2.12 50 Tabla 7. Frecuencia de edad en 600 pacientes que se realizaron detección de ADN de VPH. Edades Total 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 3 1 2 3 7 9 9 20 26 27 23 31 15 27 25 21 35 22 49 40 26 Edades 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 Total 19 20 27 20 12 17 14 7 8 2 3 7 4 2 3 3 2 1 1 1 1 1 4 51 Tabla 8. Porcentaje de muestras positivas por edad en 600 pacientes. Edad 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 Porcentaje positivas 5.0 19.0 13.6 13.0 37.5 40.0 30.7 33.3 42.8 24.1 40.0 38.7 18.7 48.4 14.7 54.2 36.1 24.3 7.8 17.9 17.5 Edad 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 Porcentaje positivas 14.6 11.9 13.9 15.9 4.4 2.0 6.0 1.9 3.7 1.7 1.7 4.9 52 Tabla 9. Porcentaje de muestras positivas en algunos estados de la R República Mexicana de Enero de 2006 Mayo de2007. Estados Oaxaca Baja California Yucatán Campeche D. F. Veracruz Puebla Morelos Tabasco Tamaulipas Michoacán Tlaxcala Guanajuato Guerrero Q. Roo Hidalgo Chihuahua Chiapas Edo. de Mex Porcentaje positivas 32.9 32.3 28.9 28.5 28.1 28.0 27.9 27.7 25.7 25.6 25.0 25.0 24.6 24.4 24.3 17.5 16.8 16.0 10.1 Figura 18. Tasa Nacional mortalidad 2005 Cáncer cervicouterino y por Entidad Federativa por cada 100,000 mujeres, Secretaria de Salud. 53 . IX Citas Bibliográficas 1.- López-Saavedra A. Cáncer cervicouterino y Virus de papiloma humano: La historia que no termina. Rev. del Inst. Nal. de Cancerología de México Vol. 1 No.1 Mar 2006. 2.- Palacio-Mejía LS,. Hernandez M, Lazcano-Ponce E. Cervical cancer, a disease of poverty: Mortality differences between urban and rural areas in Mexico. Salud Pública México 2003;45 Supl 3:S315-S325. 3.- Muñoz N , Castellsagué X, Berrington A, Gissmann L. Chapter 1: HPV in the etiology of human cancer. Vaccine 24S3 (2006) S3/1–S3/10. 4.- Cabero-Roura Ll., Iglesias X. IX curso intensivo de formación continua Ginecología Oncológica. Ediciones Ergon, 2002 Laboratorios Menarini, S.A. Madrid España.1-177. 5.- Ricci P. Perucca E. Citología de base líquida: revisión de la historia y los estudios al respecto. Rev. Chil. Obstet. Ginecol. 2004; 69(3): 256-262. 6.- Walboomers, J.M.M. et al.,. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J. Pathol. 1999, 189, 12-19. 7.- Zur Hausen H. Attempts to detect virus-specific DNA sequences in human tumors: I. Nucleic acid hybridizations with complementary RNA of human wart virus. Int. J. Cancer.1974. 13, 650–656. 8.- Dürst, M, Gissmann, L. Zur Hausen, H. A papillomavirus DNA from a cervical carcinoma and its prevalence in cancer biopsy samples from different geographic regions. Proc. Natl Acad. Sci. (1983). 80, 3812–3815. 9.- Boshart, M. et al. A new type of papillomavirus DNA, its presence in genital cancer and in cell lines derived from genital cancer. EMBO J. (1984). 3, 1151–1157. 10.- de Villiers E. M., Zur Hausen H. Classification of papillomaviruses. Virology (2004) 324 17– 27. 11.- Doorbar J. The papillomavirus life cycle. Journal of Clin. Virology 2005 32S, S7–S15. 12.- LaPorta, R.F., Taichman, L.B., Human papilloma viral DNA replicates as a stable episome in cultured epidermal keratinocytes. 1982. Proc. Natl. Acad. Sci. 79, 3393–3397. 13.- Chiang, C.M., Ustav, M. Viral E1 and E2 proteins support replication of homologous and heterologous papillomaviral origins. Proc. 1992 Natl. Acad. Sci. 89, 5799–5803. 54 14.- Ewan R. Taylor L. A novel technique with enhanced detection and quantitation of HPV-16 E1- and E2-mediated DNA replication Virology (2003) 315103–109. 15.- Thierry F. Yaniv M. The Bpv1-E2 trans-acting protein can be either an activator or repressor of the HPV18 regulatory region. EMBO J. (1987) 6: 3391-3397. 16.-La Frontera: Genética molecular de la enfermedad 1a Ed. IPN 2004, México pp238. 17.- Zhang, B. E5 protein of human papillomavirus type 16 protects human foreskin keratinocytes from UV B-irradiation-induced apoptosis. J. Virol. (2002).76, 220–231. 18.- Zur Hausen H. Papillomaviruses and cancer: from basic studies to clinical application 2002 Nature 342 may 2002 volume 2, 342-350. 19.- Rapp L. Chen J. The papillomavirus E6 proteins. Biochimica et Biophys. Acta (1998) 1378 F1-F19. 20.- Angeline M. The E7 oncoprotein of high-risk human papillomavirus type 16 enters the nucleus via a nonclassical Ran-dependent pathway Virology 317 (2003) 13–23. 21.- Munger K. Biological activities and molecular targets of the human papillomavirus E7 oncoprotein. Oncogene (2001) 20, 7888 –7898. 22.- Yamada T. Human papillomavirus type 16 variant lineages in united states populations characterized by nucleotide sequence analysis of the E6, L2, and L1 coding segments Journal of virology, 1995, Vol. 69, no. 12.p. 7743–7753 23.- Zur Hausen H. Papillomaviruses Causing Cancer: Evasion From Host-Cell Control in Early Events in Carcinogenesis. Journal of the National Cancer Institute, Vol. 92, No. 9, May 3, 2000, 690-697. 24.- Sanclemente G. Lo que los clínicos deben saber acerca de las vacunas contra el virus del papiloma humano Gac Méd Méx 2003Vol. 139 No. 2, 173-183. 25.- Longworth M., Laimins L. Pathogenesis of Human Papillomaviruses in Differentiating Epithelia Microbiology and molecular biology reviews, June 2004, Vol. 68, No. 2362–372. 26.- MotoyamaS. Maruo1 T. The Role of Human Papillomavirus in the Molecular Biology of Cervical Carcinogenesis Kobe J. Med. Sci., 2004, Vol. 50, No. 1, pp. 9-19. 27.- Muñoz N, Bosch FX, Risk factors for cervical intraepithelial neoplasia grade III/ carcinoma in situ in Spain and Colombia. Cancer Epidemiol Biom n Prev 1993; 2: 423-31. 28.- Chen M, Wang H, Detection of human herpesvirus 6 and human papillomavirus 16 in cervical carcinoma. Am J Pathol 1994;145:1509-16. 55 29.- Lacruz-Pelea C. Nomenclatura de las lesiones cervicales (de Papanicolau a Bethesda 2001) Rev. Esp. Patol. 2003; Vol.36, n.º 1: 5-10. 30.- Documentos del consenso Sociedad Española de Ginecología y Obstetricia (SEGO) La infección por papilomavirus SEGO 2002 p.9-40. 31.- García-López JA. ASCUS en citología cervicovaginal de rastreo y captura híbrida II Rev. Esp. patol 2003; Vol 36, n.º 1: 59-64. 32.- Bosch F.X. Castellsagué X. Human Papilloma Virus: oncogenic risk and new opportunities for prevention. Servei d'Epidemiologia i Registre del Cancer (SERC) 2006 p.1-6. 33.- Cox T. Cuzick J. HPV DNA testing in cervical cancer screening: From evidence to policies Gynecologic Oncology 103 (2006) 8–11. 34.- Cañadas M.P, Bosch FX, De Sanjosé S. Assessment of HPV detection assays for use in cervical cancer screening programs. Salud Publica Mex. 2006;48:373-378. 35.- Wright T.C. JR. Cervical Cancer Screening in the 21st Century: Is it Time to Retire the PAP Smear? Clinical Obstetrics and Gynecology 2007 Volume 50, Number 2, 313–323. 36.- Malloy C. HPV DNA Testing: Technical and Programmatic Issues for Cervical Cancer Prevention in Low-Resource Settings. Alliance for Cervical Cancer Prevention 2000 p.1-27 37.- Molijn A, Kleter B, Quint W, van Doorn LJ. Molecular diagnosis of human papillomavirus (HPV) infections. J Clin. Virol. 2005;32 (Suppl 1):S43–51. 38.- Snijders PJ, van den Brule AJ, The clinical relevance of human papillomavirus testing: relationship between analytical and clinical sensitivity. J Pathol 2003;201(1):1–6. 39.- Bory J., et al. Recurrent Human Papillomavirus Infection Detected with the Hybrid Capture 2 Assay Selects Women with Normal Cervical Smears at Risk for Developing High Grade Cervical Lesions: A Longitudinal Study of 3,091 Women. Int. J. Cancer, 2002;102:519–525. 40.- Sherman M.E. Human Papillomavirus Testing, and Risk for Cervical Neoplasia: A 10–Year Cohort Analysis. Journal of the National Cancer Institute, 2003;95:46–52. 41.- Solomon D. Comparison of Three Management Strategies for Patients with Atypical Squamous Cells of Undetermined Significance: Baseline Results from a Randomized Trial, J. Nat Cancer Inst, 2001; 93:293–299. 56 42.- Clavel C., et al. Human Papillomavirus Testing in Primary Screening for the Detection of High–Grade Cervical Lesions: A Study of 7932 Women. Brit J Cancer, 2001; 89 (12):1616–1623. 43.- Petry K. Inclusion of HPV testing in routine cervical cancer screening for women above 29 years in Germany: results for 8466 patients, British Journal of Cancer,2003;88:1570–1577. 44.- Cuzick, J. et al. Management of women who test positive for high–risk types of human papillomavirus: the hart study. The Lancet 2003;362:1871–76. 45.- ACOG Practice Bulletin No. 61, "Human Papillomavirus. Clinical Management Guidelines for Obstetrician–Gynecologists." April 2005. 57