Enlace Químico - Ciencia Matemática
Anuncio

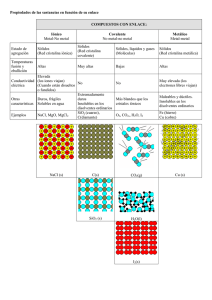
Este documento es de distribución gratuita y llega gracias a “Ciencia Matemática” www.cienciamatematica.com El mayor portal de recursos educativos a tu servicio! www.cienciamatematica.com EL ENLACE QUÍMICO CONTENIDOS. 1.- El enlace químico. 1.1. 1.2. 2.3.4.5.6.- Justificación de la fórmula de los principales compuestos binarios. Enlace covalente coordinado. Parámetros que caracterizan a los compuestos covalentes. Carácter iónico del enlace covalente. Fuerzas intermoleculares. 6.1. 6.2. 7.8.- Enlace iónico. Reacciones de ionización. Enlace covalente. Modelo de Lewis. Enlace de Hidrógeno. Fuerzas de Van der Waals Introducción al enlace metálico. Propiedades de los compuestos iónicos, covalentes y metálicos. ENLACE QUÍMICO Son las fuerzas que mantienen unidos a los átomos entre sí para formar moléculas o iones. • • • • Son de tipo eléctrico. Al formarse un enlace se desprende energía. La distancia a la que se colocan los átomos es a la que se desprende mayor energía produciéndose la máxima estabilidad. Los átomos se unen pues, porque así tienen una menor energía y mayor estabilidad que estando separado. Estabilidad en un átomo. Generalmente, los átomos buscan su máxima estabilidad adoptando un a configuración electrónica similar a la que tienen los gases nobles (1 s2 o n s2p6). El comportamiento químico de los átomos viene determinado por la estructura electrónica de su última capa (capa de valencia). Diagrama de energía en la formación Para conseguir la configuración de una molécula de H2 electrónica de gas noble, los átomos perderán, capturarán o compartirán electrones (regla del octeto). TIPOS DE ENLACES. • Iónico: unen iones entre sí. www.cienciamatematica.com • • • • Atómicos: unen átomos neutros entre sí. Covalente Metálico Intermolecular: unen unas moléculas a otras. ENLACE IÓNICO. Se da entre metales y no-metales. Los metales tienen, en general, pocos electrones en su capa de valencia y tienden a perderlos para quedar con la capa anterior completa (estructura de gas noble) convirtiéndose en cationes. Los no-metales tienen casi completa su capa de valencia y tienden a capturar los electrones que les faltan convirtiéndose en aniones y conseguir asimismo la estructura de gas noble. Reacciones de ionización Los metales se ionizan perdiendo electrones: M – n e– → Mn+ Los no-metales se ionizan ganando electrones: N + n e– → Nn– Ejemplos: Metales: Na – 1 e– → Na+ Ca – 2 e– → Ca2+ Fe – 3 e– → Fe3+ No-metales: Cl + 1 e– → Cl– O + 2 e– → O2– En enlace iónico se da por la atracción electrostática entre cargas de distinto signo, formando una estructura cristalina. Ejemplo de enlace iónico: Na ––––––→ Na+ 1 e– Cl ––––––→ Cl– El catión Na* se rodea de 6 aniones Cl– uniéndose a todos ellos con la misma fuerza, es decir, no existe una fuerza especial entre el Cl– y el Na+ que le dio el e–. La fórmula de estos compuestos es empírica. www.cienciamatematica.com Ejemplo: Escribir las reacciones de ionización y deducir la fórmula del compuesto iónico formado por oxígeno y aluminio. Las reacciones de ionización serán: Al – 3 e– → Al3+ O + 2 e– → O2– (1) (2) Como el número de electrones no coincide, para hacerlos coincidir se multiplica la reacción (1) ·2 y la (2) · 3. 2 x (1) 3 x (2) 2 Al – 6 e– → 2 Al3+ 3 O + 6 e– → 3 O2– Sumando: 2 Al + 3 O → 2 Al3++ 3 O2– La fórmula empírica será Al2O3 Estructura de compuestos iónicos. Se forma una estructura cristalina tridimensional en donde todos los enlaces son igualmente fuertes. Propiedades de los compuestos iónicos. • • • • • Duros. Punto de fusión y ebullición altos. Sólo solubles en disolventes polares. Conductores en estado disuelto o fundido. Frágiles. Fragilidad en un cristal iónico Estructura cristalina del cloruro de sodio Solubiidad en un disolvente polar ENLACE COVALENTE. Se da entre dos átomos no-metálicos por compartición de e– de valencia. www.cienciamatematica.com La pareja de e– (generalmente un e– de cada átomo) pasan a girar alrededor de ambos átomos en un orbital molecular. Si uno de los átomos pone los 2 e– y el otro ninguno se denomina ”enlace covalente coordinado” o “dativo”. Estructura de Lewis. Consiste en representar con puntos “·” o “x” los e– de la capa de valencia. Ejemplos: Grupo: Átomo: Nº e– val ·· : Cl · ·· 17 Cl 7 16 O 6 15 N 5 · :O· ·· 14 C 4 · :N· · · ·C· · El enlace covalente puede ser: • • • Simple: Se comparten una pareja de electrones. Doble: Se comparten dos parejas de electrones. Triple: Se comparten tres parejas de electrones. No es posible un enlace covalente cuádruple entre dos átomos por razones geométricas. Tipos de enlace covalente. • Enlace covalente puro. - Se da entre dos átomos iguales. • Enlace covalente polar. - Se da entre dos átomos distintos. - Es un híbrido entre el enlace covalente puro y el enlace iónico. Ejemplos de enlace covalente puro. Se da entre dos átomos iguales. Enlace covalente simple: 2H· ; (H · + · H) → H · · H ; Fórmula H–H ·· ·· ·· ·· ·· ·· ·· 2 : Cl · ; : Cl · + · Cl : → : Cl ·· Cl : ; : Cl – Cl : ·· ·· ·· ·· ·· ·· ·· ⇒ H2 ⇒ Cl2 www.cienciamatematica.com Enlace covalente doble: 2 : O : ; : O : + : O : → : O :: O : ; ·· ·· ·· ·· ·· :O=O: ·· ·· ⇒ O2 :N≡N: ⇒ N2 Enlace covalente triple: 2 : N # ; : N # + # N : → : N ## N : ; Enlace covalente polar (entre dos no-metales distintos). Todos los átomos deben 8 e– en su última capa (regla del octeto) a excepción del hidrógeno que completa su única capa con tan sólo 2 e– . La pareja de e– compartidos se encuentra desplazada hacia el elemento más electronegativo, por lo que aparece una fracción de carga negativa “δ–” sobre éste y una fracción de carga positiva sobre el elemento menos electronegativo “δ+”. Ejemplos de enlace covalente polar. ·· ·· ·· : Cl · + x H → : Cl · x H ; : Cl – H ·· ·· ·· ⇒ HCl ·O ·· · + 2 x H → H x· O ·· ·x H ; H – O ·· – H ⇒ H2O ·· · + 3 x H → H x· N ·· ·x H ; H – N·· – H ·N | ··· ··H Hx··· ⇒ NH3 ·O ·· · + 2 x Cl ·· : → : Cl ·· x· O ·· ·x Cl·· : ; : Cl ·· – O ·· – Cl ·· : ⇒ Cl2O ·· ·· ·· ·· ·· ·· ·· ·· Ejercicio A: Escribe la representación de Lewis y decide cuál será la fórmula de un compuesto formado por Si y S. ⌦ Ejercicio B: Cuatro elementos diferentes A, B, C, D tienen número atómico 6,9,13 y 19 respectivamente. Se desea saber: a) El número de electrones de valencia de cada uno de ellos. b) Su clasificación en metales y no metales. c) La fórmula de los compuestos que B puede formar con los demás ordenándolos del más iónico al más covalente. ⌦ Enlace covalente coordinado. Se forma cuando uno de los átomos pone los 2 e– y el otro ninguno. Se representa con una flecha “→” que parte del átomo que pone la pareja de e– . www.cienciamatematica.com Ejemplo: ·· Hx·O·x H + H+ → ·· ·· H–O–H ↓ H ⇒ H3O+ + + + Compuestos covalentes atómicos. Forman enlaces covalentes simples en dos o tres dimensiones del espacio con átomos distintos. Estructura del diamante Estructura del cuarzo Estructura del grafito Ejemplos: SiO2, C (diamante), C (grafito) PROPIEDADES DE LOS COMPUESTOS COVALENTES Moleculares • • • Puntos de fusión y ebullición bajos. Solubles en disolventes apolares. Conductividad parcial sólo en compuestos polares. Atómicos • • • Puntos de fusión y ebullición muy elevados. Insolubles en todos los disolventes. No conductores (el grafito sí presenta conductividad por la deslocalización de un e– de cada átomo). ENLACE METÁLICO. Se da entre átomos metálicos. Todos tienden a ceder e–. www.cienciamatematica.com Los cationes forman una estructura cristalina, y los e– ocupan los intersticios que quedan libres en ella sin estar fijados a ningún catión concreto (mar de e– ). Los e– están, pues bastante libres, pero estabilizan la estructura al tener carga contraria a los cationes. Propiedades de los compuestos metálicos. • • • • Punto de fusión y ebullición muy variado (aunque suelen ser más bien alto) Son muy solubles en estado fundido en otros metales formando aleaciones. Muy buenos conductores en estado sólido. Son dúctiles y maleables (no frágiles). Empaquetamiento de cationes metálicos. presión www.cienciamatematica.com FUERZAS INTERMOLECULARES Enlace (puente) de hidrógeno Se da entre moléculas muy polarizadas por ser uno de los elementos muy electronegativo y el otro un átomo de H, que al tener “δ+” y ser muy pequeño permite acercarse mucho a otra molécula. Enlace de hidrógeno Estructura del hielo (puentes de hidrógeno) Fuerzas de Van der Waals: • • Fuerzas de dispersión (London) Atracción dipolo-dipolo Fuerzas de dispersión (London): Aparecen entre moléculas apolares. En un momento dado la nube electrónica se desplaza al azar hacia uno de los átomos y la molécula queda polarizada instantáneamente. Este dipolo instantáneo induce la formación de dipolos en moléculas adyacentes. Atracción dipolo-dipolo: Se da entre moléculas polares. Al ser los dipolos permanentes la unión es más fuerte. Fuerzas de dispersión Atracción dipolo-dipolo www.cienciamatematica.com Ejercicios Resueltos Enlace Químico 1.- Decidir y justificar cuál es la opción correcta: dos elementos A y B cuyos números atómicos son 7 y 17 respectivamente se unen formando un compuesto de fórmula: a) AB2; b) A2B; c) AB3; d) A3B. ⌦ 2.- El enlace que se forma entre un átomo de cloro y otro de fósforo de una misma molécula es: a) covalente; b) iónico; c) puente de hidrógeno; d) fuerza de Van der Waals. ⌦ 3.- Razona cuál de las siguientes sustancias están formadas por enlaces covalentes polares: amoniaco, cloruro de sodio, cloro gaseoso, C (diamante). ⌦ 4.- Utiliza la representación de Lewis para deducir cuál será la fórmula final del compuesto formado por N y O. ⌦ 5.- Escribe las representaciones de Lewis de las siguientes moléculas: a) CO2; b) CH2=CH2; c) HNO2. ⌦ 6.- ¿Qué tipo de enlace y cual será la fórmula final del compuesto, especificando de si se trata de fórmula empírica o molecular, y utilizando las reacciones de ionización en caso de enlaces iónicos y la representación de Lewis en caso de enlaces covalentes, de los compuestos formados por las siguientes parejas de átomos: S y K, N y Cl, Br y O? ⌦ 7.- ¿Qué tipo de enlace y cual será la fórmula final del compuesto, especificando de si se trata de fórmula empírica o molecular, y utilizando las reacciones de ionización en caso de enlaces iónicos y la representación de Lewis en caso de enlaces covalentes, de los compuestos formados por las siguientes parejas de átomos: a) Ca y Br? b) As y Li? c) C y Cl? ⌦ 8.- ¿Qué tipo de enlace y cual será la fórmula final del compuesto, especificando de si se trata de fórmula empírica o molecular, y utilizando las reacciones de ionización en caso de enlaces iónicos y la representación de Lewis en caso de enlaces covalentes, de los compuestos formados por las siguientes parejas de átomos a) F y P? b) O y K? c) O y Mg? d) S y F? ⌦ 9.- Utiliza la representación de Lewis para explicar las estructuras de las especies químicas NH4+ y SO2. ⌦ 10.- a) ¿Por qué son gases a temperatura ordinaria los gases nobles? b) Escribe la representación de Lewis del Ar ¿Cuántos átomos formarán sus moléculas? ⌦ 11.- Razona cuál de la siguientes sustancias: mercurio, sulfuro de potasio, cloro, cloruro de hidrógeno a) tendrá mayor punto de fusión; b) será más soluble en agua; c) será más conductora. ⌦ 12.- Dos elementos A y B tienen respectivamente las siguientes configuraciones electrónicas: 1s22s2p63s1 y 1s22s2p4; a) ¿qué enlace formarán entre ambos?; b) ¿Cuál será la fórmula del compuesto que formen entre ambos?; c) ¿en qué tipo de disolvente será soluble?; d) ¿en qué condiciones conducirá la corriente eléctrica? ⌦ www.cienciamatematica.com 13.- ¿Qué tipo de enlace se necesitará romper si queremos: a) fundir Na2O; b) conseguir que hierva el agua; c) disolver KCl en agua; d) disociar las moléculas de H2 en átomos de hidrógeno. ⌦ Soluciones a los ejercicios 1. ⌫ A: 1s2 2s2p3; B: 1s2 2s2p6 3s2p5. Ambos son no metales, pero mientras A tiene covalencia 3, puesto que le faltan 3 e– para completar su última capa y por tanto tenderá a formar tres enlaces covalentes, B tiene covalencia 1, ya que sólo le falta 1 e– para completar su última capa y , por tanto formará sólo un enlace covalente. Por tanto, la fórmula del compuesto que formarán ambos elementos será la c) AB3. 2. ⌫ Covalente, puesto que se trata de dos elementos no metálicos de una misma molécula. 3. ⌫ Sólo el amoniaco, y que ambos elementos son elementos no metálicos distintos entre sí, con lo que el enlace covalente entre ambos será polar. 4. 5. 6. 7. El NaCl está formado por iones unidos por enlace iónico, mientras que tanto el Cl2 como el C (diamante) están formado por enlaces covalentes puros al ser los elementos que lo forman iguales. ⌫ ·· xx ·· xx ·· :O = N− O − N = O: ⇒ N2O3 ·· ·· ·· ·· xx ·· ⌫ a) CO2: :O=C=O: b) CH2=CH2: H−C=C−H c) HNO2: :O=N−O−H | | ·· H H ⌫ a) S y K: iónico; S + 2 e– → S2–; K – 1 e– → K+ ⇒ K2S; ·· xx ·· b) N y Cl: covalente; :Cl−N−Cl: ⇒ NCl3; ·· | ·· :Cl: ·· ·· xx ·· c) Br y O: covalente; :Br−O−Br: ⇒ Br2O; ·· xx ·· Fórmula empírica Fórmula molecular Fórmula molecular ⌫ a) Ca y Br: iónico; Br + 1 e– → Br–; Ca – 2 e– → Ca2+ ⇒ CaBr2; Fórmula empírica b) As y Li: iónico; As + 3 e– → As3–; Li – 1 e– → Li+ ⇒ Li3As; Fórmula empírica ·· :Cl: ·· | ·· c) C y Cl: covalente; :Cl−C−Cl: ⇒ CCl4 ; Fórmula molecular ·· | ·· :Cl: ·· 8. ⌫ a) F y P: covalente; ·· xx ·· :F−P−F: ·· | ·· :F : .. ⇒ PF3; Fórmula molecular www.cienciamatematica.com b) O y K: iónico; O + 2 e– → O2–; K – 1 e– → K+ ⇒ ·· xx ·· :F−S−F: ·· xx ·· c) S y F: covalente; 9. ⌫ ⇒ SF2; Fórmula molecular H a) NH4+: |+ H−N−H b) SO2: | 10. K2O; Fórmula empírica ·· xx ·· :O=S±O: ·· H ⌫ a) Porque forman moléculas de un solo átomo sin ninguna carga que haga que unas moléculas y otras tiendan a unirse. ·· b) : Ar : ; Moléculas de un solo átomo, puesto que ya tienen completo el octeto. ·· 11. ⌫ a) El sulfuro de potasio, ya que se trata de un compuesto iónico, mientras que las otras dos se trata de sustancias covalentes moleculares. b) El cloruro de hidrógeno ya que está formado por moléculas covalentes polares. El sulfuro de potasio también será soluble, pero menos al ser necesario tener que romper la estructura cristalina. c) El cloruro de hidrógeno ya que está formado por moléculas covalentes polares, que se moverán ante la presencia de una fuerza electromotriz. Sin embargo, la conductividad será pequeña ya que no se trata de iones completos sino de dipolos. El sulfuro de potasio también sería conductor sólo en estado disuelto o fundido, pero nunca en estado sólido. 12. ⌫ a) Como A es metal (1 e– de valencia) y B un no-metal (6 e– de valencia), entre sí formarán un enlace iónico. b) A: A – 1 e– → A+; A: B + 2 e– → B2– ⇒ A2B; c) A2B será soluble en in disolvente polar por tratarse de un compuesto iónico. d) A2B conducirá la corriente eléctrica solo en estado disuelto o fundido, ya que en es estado sólido , a pesar de existir cargas, éstas están atrapadas dentro de una estructura cristalinas que la impide moverse. 13. ⌫ a) Na2O es un compuesto iónico, por lo que se necesitará romper enlaces iónicos, es decir atracciones electrostáticas de carga. b) Se necesitarán romper los enlaces de hidrógeno que unen unas molécula de agua de otras. c) Por la misma razón que en A, al disolver Na2O se necesitará romper enlaces iónicos. d) Para disociar moléculas de H2 en átomos de H se necesitan romper el enlace covalente que mantiene unidos a ambos átomos. www.cienciamatematica.com Soluciones a los ejercicios de los apuntes: A.- B.- ⌫ La representación de Lewis de cada átomo es: · · Si · (grupo 14) · La representación de Lewis de molecular será: ·· ·· : S = Si = S : La fórmula molecular será pues: SiS2 ⌫ A B C D Z a) Nº e– valencia b) Metal/No-metal 6 4 No-metal 9 7 No-metal 13 3 Metal 19 1 Metal c) DB < CB3 < AB4 < B2 · : S · (grupo 16) ··