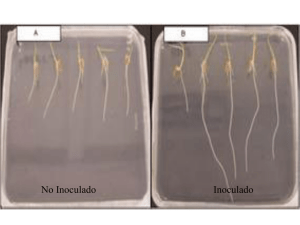
Análisis de las señales bioquímicas y moleculares involucradas en
Anuncio

Universidad Nacional de Tucumán Análisis de las señales bioquímicas y moleculares involucradas en la colonización de frutilla (Fragaria ananassa) por Azospirillum brasilense Lic. María Fernanda Guerrero Molina 2013 Facultad de Agronomía y Zootecnia A Mis Padres Universidad Nacional de Tucumán Autoridades RECTOR C.P.N. Juan Alberto Cerisola VICERRECTORA Dra. Alicia Bardón SECRETARIO ACADÉMICO Dr. Edgardo Cutín Facultad de Agronomía y Zootecnia Autoridades DECANO Prof. Ing. Agr. José Ramón Garcia VICEDECANO Ing. Agr. M. Sc. Héctor Rolando Navarro SECRETARIO ACADÉMICO Ing. Agr. Carlos Arnaldo Latina Doctorado en Ciencias Biológicas Autoridades DIRECTORA Dra. Mercedes Lizarralde de Grosso VICE-DIRECTORA Dra. Marta Inés Bühler COMITÉ ACADÉMICO Dr. Raúl Ricardo Raya Dr. Atilio Pedra Castagnaro Dr. Alfredo Grau Trabajo de postgrado para la obtención del grado académico superior de DOCTOR/A EN CIENCIAS BIOLÓGICAS CARRERA DE DOCTORADO EN CIENCIAS BIOLÓGICAS Acreditado y Categorizado A ante la Comisión Nacional de Acreditación Universitaria (CONEAU) Resolución n°: 615/07 Trabajo de postgrado titulado: “Análisis de las señales bioquímicas y moleculares involucradas en la colonización de frutilla (Fragaria ananassa) por Azospirillum brasilense” Tesista Lic. María Fernanda Guerrero Molina Director Dr. Raúl Osvaldo Pedraza Director asociado Dr. Juan Carlos Díaz Ricci Comisión de supervisión Especialista del tema Dr. Gustavo Martín Martínez Zamora Miembro de otra unidad académica Dra. Viviana Andrea Rapisarda El presente trabajo de Tesis Doctoral se realizó en la Cátedra de Microbiología Agrícola, Departamento de Ecología, Facultad de Agronomía y Zootecnia de la Universidad Nacional de Tucumán y en el Departamento de Bioquímica de la Nutrición del Instituto Superior de Investigaciones Biológicas (INSBIO; CONICET-UNT) e Instituto de Química Biológica de la Facultad de Bioquímica, Química y Farmacia de la Universidad Nacional de Tucumán. Con el apoyo financiero del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Agencia Nacional de Promoción Científica y Tecnológica (ANPCyT) y Consejo de Investigaciones de la UNT (CIUNT). AGRADECIMIETOS Al Doctorado de Ciencias Biológicas de la UNT, a la Cátedra de Microbiología de la Facultad de Agronomía y Zootecnia de la UNT y al Instituto Superior de Investigaciones Biológicas (INSIBIO) por permitir el desarrollo de este trabajo de tesis doctoral. A mis directores, Dres. Raúl Pedraza y Juan Díaz Ricci, por guiarme, por su dedicación y paciencia, por la revisión crítica de mi trabajo, y sobretodo por darme libertad y confianza para desarrollar mis ideas. Sus palabras, consejos y exigencias son los pilares de mi formación profesional y los que me empujaron a buscar la excelencia dando lo mejor de mi en cada paso. A la Dra. Beatríz Baca, por su generosidad para compartir sus conocimientos, por las largas charlas de nuestro querido Azos y por contagiarme su pasión por la ciencia y la investigación. A los miembros de mi comisión de supervisión, Dres. Viviana Rapisarda y Gustavo Martínez Zamora, por sus consejos, sus enseñanzas, su constante apoyo y por los valiosos aportes realizados durante el desarrollo de la tesis. A mis amigos y compañeros de laboratorio de la FAZ y de INSIBIO, con quienes hemos logrado construir un ambiente laboral agradable y estimulante. Son insuficientes las palabras para agradecerles su amistad, sus consejos, toda su colaboración con el desarrollo experimental de la tesis, por todos los mates y cafés, y por estos cinco años compartidos que quedarán colmados de buenos recuerdos. A mis Padres, Edgardo y Otilde, por todo… Quien fui, soy y seré se los debo a Uds. A mi Fer, mis Sisters y los peques, por su paciencia y apoyo, por su amor incondicional y por las risas y sonrisas de todos los días. A mis Amiguitas, mis hermanas del alma y mis testigos en la vida, por alentarme en los momentos difíciles y festejar conmigo mis logros. ¡Gracias! Análisis de las señales bioquímicas y moleculares involucradas en la colonización de frutilla por Azospirillum brasilense RESUMEN La producción agrícola de frutilla posee gran importancia económico-social, y por ser un cultivo intensivo, requiere grandes cantidades de fertilizantes y pesticidas para aumentar los rendimientos, siendo estos peligrosos para el ambiente y la salud humana. Una alternativa biotecnológica y ecológica para mejorar los rindes y disminuir los costos de producción, es el uso de bacterias promotoras del crecimiento vegetal o PGPB (Plant GrowthPromoting Bacteria) como las pertenecientes al género Azospirillum. Estudios previos han demostrado que Azospirillum brasilense, aislado a partir de plantas de frutilla en la provincia de Tucumán y caracterizado en nuestro laboratorio, es capaz de fijar N2, producir índoles y sideróforos, ejercer biocontrol frente a la antracnosis, presentar quimiotaxis positiva hacia los exudados radiculares de frutilla e inducir el crecimiento de éste cultivo, tanto en condiciones ambientales controladas como en el campo. Sin embargo, poco se conoce respecto a los mecanismos que se desencadenan en las plantas durante el proceso de colonización. Por ello en la presente tesis doctoral se estudiaron las señales bioquímicas, estructurales y moleculares activadas en plantas de frutilla durante la colonización por Azospirillum brasilense, las cuales permitirían el reconocimiento y el establecimiento de esta asociación benéfica, no patogénica. Se determinó que las cepas REC3 y PEC5 de Azospirillum brasilense fueron capaces de asociarse benéficamente con las plantas de frutilla, promoviendo su crecimiento sin causar síntomas de enfermedad. A. brasilense colonizó rizosférica y endofíticamente las raíces de distintas variedades de frutilla (`Camarosa´, `Milsei´ y `Selva´), y también colonizó endofíticamente los estolones de plantas madre inoculadas e hijas no-inoculadas. La obtención de la cepa transgénica A. brasilense REC3::gfp, con altos niveles de expresión del gen gfp y gran estabilidad, permitió realizar el seguimiento de la colonización radicular. La contribución de A. brasilense a la nutrición mineral de la frutilla se evaluó por microscopía electrónica de barrido acoplada a la espectroscopia de dispersión de rayos-X, determinando los siguientes elementos en los tejidos foliares: C, O, N, Na, K, P, Ca y Cu; mientras que en raíces se determinó también Si y Cl, observándose un aumento del contenido de P y una diminución de Cu en las raíces inoculadas. Además, A. brasilense promovió el crecimiento de plantas de frutilla en condiciones hidropónicas, aumentando la biomasa total, el índice de crecimiento y la proliferación de pelos radiculares, siendo este efecto más notorio cuando las plantas crecieron en un medio limitado en nutrientes. La señales estructurales, bioquímicas y moleculares activadas en las plantas de frutilla por Azospirillum brasilense, como las deposiciones de calosa, el engrosamiento de las paredes celulares, el aumento de compuestos fenólicos solubles totales, la diminución de la peroxidación lipídica, la inducción de la síntesis de fitohormonas (ácido salicílico y ácido indol-3-acético) y la expresión temprana de genes relacionados a la defensa vegetal, indicaron que esta bacteria PGPB activa un “estado de alerta” o “priming” en las plantas de frutilla, siendo éste un proceso importante de la resistencia sistémica inducida (ISR). Las señales activadas durante el “priming” son altamente reguladas y pueden ser complementarias, proporcionando una resistencia de larga duración y amplio espectro contra diferentes fitopatógenos. Sin embargo, el análisis cuantitativo de la expresión génica indicó que A. brasilense puede inducir también la resistencia sistémica adquirida (SAR), concluyendo que el mismo es capaz de inducir mecanismos de defensa en plantas de frutilla por ambas vías, SAR e ISR, que en última instancia mejoraría el rendimiento de las plantas. En conjunto, los resultados obtenidos constituyen un importante aporte al conocimiento de la interacción benéfica que se establece entre plantas de frutillas y la especie PGPB Azospirillum brasilense. Índice ÍNDICE GENERAL CAPÍTULO 1: INTRODUCIÓN GENERAL 1 1. Generalidades 2 2. Bacterias PGPB 3 3. El género Azospirillum 4 3. 1. Mecanismos de Azospirillum para la promoción del crecimiento vegetal 5 A. Síntesis de fitohormonas 5 B. Fijación biológica de Nitrógeno 7 C. Incremento en la absorción y/o biodisponibilidad de nutrientes 8 D. Síntesis de vitaminas y enzimas 9 E. Biocontrol 10 4. Hipótesis aditiva de los mecanismos de Azospirillum 11 5 Mecanismos de defensa vegetal 11 6. La frutilla 13 6. 1. Descripción de la planta 13 6. 2. Importancia del cultivo de frutilla 13 7. Interacción Azospirillum-frutilla 7. 1. Perspectivas del estudio de la interacción Azospirillum-frutilla 15 17 CAPÍTULO 2: HIPÓTESIS Y OBJETIVOS 18 Hipótesis de trabajo 19 Objetivo General 20 Objetivos específicos 20 CAPÍTULO 3: ANÁLISIS DE LA COLONIZACIÓN RIZOSFÉRICA Y/O ENDOFÍTICA DE AZOSPIRILLUM BRASILENSE EN RAÍCES Y ESTOLONES DE PLANTAS DE FRUTILLA 21 Introducción 22 1. Los sitios de colonización de Azospirillum 22 2. Proceso de colonización de Azospirillum 22 i Índice 3. Factores que intervienen en la colonización 24 3. 1. Componentes bacterianos que participan en la colonización 24 3. 2. Componentes vegetales que participan en la colonización 26 4. Objetivo del capítulo Materiales y métodos 1. Microorganismos 26 27 27 1. 1. Medios de Cultivo 28 1. 2. Observaciones macroscópicas 29 1. 3. Observaciones microscópicas 29 1. 4. Estudios de la ultraestructura celular de A. brasilense 30 1.4.1. Microscopía electrónica de transmisión 30 1.4.2. Microscopía electrónica de barrido 30 1. 5. Obtención de una cepa transgénica A. brasilense REC3::gfp (green fluorescent protein) por conjugación triparental 31 1.5.1. Microscopía de Fluorescencia 32 1.5.2. Control de estabilidad de la construcción A. brasilense REC3::gfp 33 1.5.3. Análisis estadístico 33 2. Material vegetal 34 3. Inoculación de plantas de frutilla con A. brasilense en soporte líquido 34 3. 1. Modelo Experimental 34 3. 2. Acondicionamiento de las plantas en soporte líquido 34 3. 3. Preparación del inóculo 35 3. 4. Inoculación 35 3.5. Estudios ultraestructurales. Microscopía Electrónica de Transmisión y Barrido 35 4. Inoculación de plantas de frutilla con A. brasilense en soporte sólido 36 4. 1. Modelo Experimental 36 4. 2. Inoculación 36 4. 3. Ensayos microbiológicos. Determinación del Número Más Probable (NMP) de A. brasilense en distintos tejidos de plantas de frutilla 38 ii Índice 4.3.1. Toma de muestras 38 4.3.2. Determinación del NMP 38 4. 4. Estudios ultraestructurales. Microscopía Electrónica de Transmisión y de Barrido 4. 5. Estudios Moleculares. 39 39 4.5.1. Extracción de ADN de tejidos vegetales 40 4.5.2. Amplificación por PCR del gen nifD 41 4.5.3. Extracción de ADN bacteriano, amplificación por PCR del gen 16S ADNr y restricción enzimática 42 4.5.4. Secuenciación automática del 16S ADNr 42 5. Inoculación de plantas de frutilla en condiciones hidropónicas con la cepa transgénica A. brasilense REC3::gfp 43 5. 1. Optimización de las condiciones hidropónicas para plantas de frutilla 43 5. 2. Modelo Experimental 44 5. 3. Inoculación 44 5. 4. Observación por microscopía óptica de fluorescencia 44 Resultados 1. Estudios de la ultraestructura celular de Azospirillum brasilense 45 45 1. 1. Observaciones macroscópicas 45 1. 2. Observaciones microscópicas 45 1. 3. Microscopía electrónica 46 1. 4. Microscopía de fluorescencia 48 2. Estudios ultraestructurales de las raíces de plantas desarrolladas en soporte líquido inoculadas con A. brasilense 50 3. Inoculación de plantas de frutilla con Azospirillum brasilense en soporte sólido 59 3. 1. Ensayos microbiológicos. Determinación del NMP de Azospirillum brasilense en tejidos de plantas de frutilla 60 3. 2. Estudios ultraestructurales de raíces y estolones de plantas en soporte 64 iii Índice sólido inoculadas con A. brasilense 3. 3. Estudios moleculares. Determinación del gen nifD 66 3. 4. Amplificación del gen 16S ADNr, ARDRA y secuenciación automática 67 4. Estudios de colonización por microscopía de fluorescencia 68 Discusión 70 Conclusiones 78 CAPÍTULO 4: ANÁLISIS LA COMPOSICIÓN ELEMENTAL DE PLANTAS DE FRUTILLA INOCULADAS CON A. BRASILENSE REC3 MEDIANTE MICROSCOPÍA ELECTRÓNIAC DE BARRIDO ACOPLADA AL ANÁLISIS DE DISPERSIÓN DE RAYOS-X Y SUEFECTO EN LA PROMOCIÓN DEL CRECIMIENTO 80 Introducción 81 1. Microscopía electrónica de barrido acoplada a la espectroscopia de energía dispersiva de rayos-X 81 2. Objetivo del capítulo 82 Materiales y métodos 83 1. Material vegetal y condiciones de cultivo 83 2. Microorganismos e inoculación 83 3. Diseño experimental 84 4. Determinación de peso seco 84 5. Microscopía electrónica de barrido acoplada a energía dispersiva de rayos-X 85 6. Análisis estadístico 85 Resultados 86 1. Promoción del crecimiento 86 2. Observaciones microscópicas 87 3. Microanálisis por MEB-EDS 88 Discusión 92 Conclusiones 96 iv Índice CAPÍTULO 5: ANÁLISIS DE LOS CAMBIOS ESTRUCTURALES PRODUCIDOS EN PLANTAS DE FRUTILLA POR LA INOCULACIÓN CON AZOSPIRILLUM BRASILENSE REC3 97 Introducción 98 1. Mecanismos de defensa vegetal: barreras estructurales 2. Objetivos del capítulo Materiales y métodos 98 100 100 1. Material vegetal y condiciones de cultivo 100 2. Inóculo 100 3. Inoculación y diseño experimental 101 4. Tinción de calosa 101 5. Fortificación de la pared celular 102 Resultados 102 Discusión 104 Conclusiones 106 CAPÍTULO 6: ANÁLISIS DE LAS SEÑALES BIOQUÍMICAS DISPARADAS EN PLANTAS DE FRUTILLA INOCULADAS CON AZOSPIRILLUM BRASILENSE REC3 107 Introducción 108 1. Resistencia sistémica inducida 108 2. Mecanismos de defensa: señales bioquímicas 109 3. Objetivo del capítulo 110 Materiales y métodos 111 1. Material vegetal y condiciones de cultivo 111 2. Inóculo 111 3. Inoculación y toma de muestras 112 4. Determinación histoquímica del radical superóxido y peróxido de hidrógeno 112 5. Extracción y cuantificación de compuestos fenólicos 114 6. Peroxidación lipídica 115 7. Diseño experimental y análisis estadístico 116 v Índice Resultados 1. Detección del estallido oxidativo 116 116 2. Cuantificación de compuestos fenólicos solubles totales y unidos a la pared celular 119 3. Análisis de la peroxidación lipídica 122 Discusión 123 Conclusiones 129 CAPÍTULO 7: EVOLUCIÓN TEMPORAL DE LA PRODUCCIÓN DEL ÁCIDO SALICÍLICO Y ÁCIDO INDOL 3-ACÉTICO EN PLANTAS DE FRUTILLA INOCULADAS CON AZOSPIRILLUM BRASILENSE 130 Introducción 131 1. El sistema inmune vegetal: señalización hormonal 131 2. El ácido salicílico 132 3. El ácido indol-3-acético 135 3.1. Reciprocidad de señalización de AIA entre plantas y bacterias 4. Objetivo del capítulo Materiales y métodos 138 138 139 1. Material vegetal y condiciones de cultivo 139 2. Inoculación y diseño experimental 140 3. Obtención de los fluidos peciolares 140 4. Cuantificación simultánea de AS y AIA por RP-HPLC 141 Resultados 142 1. Patrones puros de AS y AIA 142 2. Contenido de AS e plantas de frutilla inoculadas con A. brasilense y controles 145 3. Contenido de AIA en plantas de frutilla inoculadas con A. brasilense y controles 146 Discusión 148 Conclusiones 152 vi Índice CAPÍTULO 8: ANÁLISIS CUANTITATIVO DE LA EXPRESIÓN DE GENES INVOLUCRADOS EN LA INTERACCIÓN AZOSPIRILLUM-FRUTILLA 153 Introducción 154 1. Genes involucrados en la respuestas de defensa de las plantas de frutilla 154 3. Genes involucrados en la síntesis, percepción y transducción de señal del etileno 155 2. Genes involucrados en la depuración de especies reactivas del oxígeno 157 4. Objetivo del capítulo 158 Materiales y métodos 158 1. Material vegetal y condiciones de cultivo 158 2. Inoculación y diseño experimental 140 3. Extracción de ARN total y retrotranscripción del ARNm 159 4. Diseño de cebadores para RT-qPCR 160 5. PCR cuantitativa en tiempo real (RT-qPCR) 160 6. Análisis estadístico 161 Resultados 162 Discusión 166 Conclusiones 170 CAPÍTULO 9: CONCLUSIONES GENERALES 171 Conclusiones generales 172 CAPÍTULO 10: REFERENCIAS BIBLIOGRÁFICAS 175 Referencias bibliográficas 176 vii Capítulo 1 Capítulo 1 1 Capítulo 1 Introducción General 1. Generalidades En las últimas décadas el interés por producir alimentos en menor tiempo y mayor cantidad para suplir los requerimientos nutricionales de la creciente población mundial, dio lugar a una tendencia universal que busca maximizar los rindes de las explotaciones agrícolas. Sin embargo, la implementación de nuevas tecnologías y el uso de agroquímicos pueden no sólo ser nocivos para el ambiente, sino también muy costosos y difíciles de aplicar en países en vías de desarrollo, con economías débiles y poco estables. Los fertilizantes nitrogenados se obtienen industrialmente mediante la reacción de Haber-Bosch en la cual el nitrógeno atmosférico (N2) es reducido a amonio (NH4+) por el gas hidrógeno (H2) a temperatura y presiones muy elevadas (aproximadamente 300ºC y 350 atm); motivo por el cual la fijación industrial lleva aparejado un alto costo energético y económico, como así también un riesgo potencial de contaminación y eutrofización de las aguas dulces por lixiviación de los nitratos en los suelos (Paul y Clark, 1996). De acuerdo a lo anterior, en los últimos años se ha planteado la necesidad de incorporar un sistema productivo que sea económicamente rentable y sostenible en el tiempo. Una alternativa posible para la disminución o sustitución de los fertilizantes nitrogenados de síntesis química es la explotación de bacterias promotoras del crecimiento vegetal (PGPB: Plant Growth-Promoting Bacteria) capaces de mejorar el desarrollo y el rendimiento de numerosas especies vegetales. La utilización de bacterias del género Azospirillum, pertenecientes al grupo de las PGPB, como biofertilizante en la producción de distintos cultivos de importancia agrícola, entre ellos la frutilla, se presenta como una alternativa biotecnológica factible, 2 Capítulo 1 económica y ecológicamente limpia, que permite aumentar los rendimientos y reducir los costos de producción. 2. Bacterias PGPB Las bacterias asociadas a plantas que son capaces de colonizar raíces son llamadas rizobacterias y pueden ser clasificadas en grupos beneficiosos, deletéreos y neutros sobre la base de su efecto sobre el crecimiento de la planta (Timmusk, 2003). Las PGPB pertenecen a la categoría de bacterias benéficas que estimulan el crecimiento vegetal (Kloepper et al., 1989; Lugtenberg y Kamilova, 2009) a través de diferentes mecanismos como la fijación de nitrógeno, la solubilización de fosfatos, la producción de fitohormonas, enzimas como la acc-desaminasa, vitaminas, y sideróforos, entre otros (Dobbelaere et al., 2003; Bashan y de-Bashan, 2010). Este grupo incluye bacterias pertenecientes a géneros muy diversos como Azospirillum, Azotobacter, Azoarcus, Klebsiella, Beijerinckia, Burkholderia, Enterobacter, Herbaspirillum, Pseudomona y Paenibacillus (Dobbelaere et al., 2003). Dentro de este grupo se destacan los diazótrofos (diazo=nitrógeno; trofos=nutrición), bacterias que tienen la habilidad de reducir el nitrógeno atmosférico a amonio e incorporarlo a su metabolismo para producir aminoácidos y sintetizar proteínas (Paul y Clark, 1996). Consecuentemente, los diazótrofos presentan ventajas competitivas que les permiten prosperar en ambientes ricos en carbono y pobres en nitrógeno (Döbereiner y Pedrosa, 1987). De la misma manera que los diazótrofos simbióticos, como los pertenecientes al género Rhizobium se asocian con plantas fabaceas (ex leguminosas), en la naturaleza se establecen también importantes interacciones entre plantas no fabaceas y microorganismos fijadores de N2 de vida libre o asociativa, como Azospirillum. Estos últimos no forman nódulos como los diazótrofos simbióticos, por 3 Capítulo 1 ello desarrollaron diferentes mecanismos para la protección de la enzima nitrogenasa que es sensible al oxígeno. Estos mecanismos incluyen la formación de polímeros extracelulares, exclusión metabólica, microaerofilia, anaerobiosis total, protección respiratoria y conformacional, separación espacial de la nitrogenasa y barreras de difusión, entre otras, que les permite el crecimiento en ambientes aeróbicos (Tchan, 1988). En este tipo de asociaciones la planta proporciona la fuente de energía orgánica que necesitan las bacterias y un ambiente favorable para fijar nitrógeno, mientras que las bacterias facilitan el nitrógeno fijado para el crecimiento vegetal (Madigan et al., 2000). 3. El género Azospirillum Las bacterias del género Azospirillum pertenecen a las alfaproteobacterias, son Gram (-) y capaces de fijar nitrógeno (Okon y Vanderleyden, 1997; Steenhoudt y Vanderleyden, 2000; Baca, 2004). Se encuentran en el suelo rizosférico y/o asociadas con distintas plantas; han sido aisladas de la rizósfera de cereales y diversas plantas en diferentes regiones del mundo con clima tropical o templado, incluyendo cultivos de importancia agrícola como maíz, trigo, mijo, sorgo y legumbres (Baldani et al., 1983; Pacovsky, 1990; Burdman et al., 1997; Dobbelaere et al., 2001; Saubidet et al., 2002; Bashan et al., 2004). Las bacterias de este género fijan nitrógeno bajo condiciones microaeróbicas, son móviles debido a la presencia de una flagelación mixta (un flagelo polar y varios flagelos laterales), y presentan quimiotaxis hacia los exudados radiculares (ricos en hidratos de carbono, entre otros compuestos; Bashan y Holguin, 1997; Steenhoudt y Vanderleyden, 2000). Se han descripto 18 especies: A. lipoferum, A. brasilense, A. amazonense, A. halopraeferans, A. irakense, A. largomobile, A. doebereinerae, A. oryzae, A. melinis, A. zeae, A. canadense, A. rugosum, A. palatum, A. picis, A. thiophilum, A. humicireducens, 4 Capítulo 1 A. formosense, A. fermentarium (Tarrand et al., 1978; Magalhaes et al., 1983; Reinhold et al., 1987; Khammas et al.,1989; Sly y Stackebrandt, 1999; Eckert et al., 2001; Xie et al., 2005; Peng et al., 2006; Mehnaz et al., 2007a, b; Young et al., 2008; Zhou et al., 2009; Lin et al., 2009; Lavrinenko et al., 2010; Zhou et al., 2012; Lin et al., 2012, Lin et al., 2013). Azospirillum ejerce sus efectos positivos sobre el crecimiento de la planta, ya sea directa o indirectamente a través de una combinación de mecanismos diferentes que participan en forma simultánea, coordinada y cooperativamente en la asociación planta-bacteria, causando un aumento del crecimiento vegetal cuando las condiciones ambientales son apropiadas (Bashan y Levanony, 1990). 3.1. Mecanismos de Azospirillum para la promoción del crecimiento vegetal Entre los mecanismos directos e indirectos que utiliza Azospirillum para promover el desarrollo vegetal se encuentran: A. Síntesis de fitohormonas B. Fijación biológica de Nitrógeno C. Incremento en la biodisponibilidad de nutrientes D. Síntesis de vitaminas y enzimas E. Biocontrol A. Síntesis de Fitohormonas La principal hipótesis para explicar la capacidad promotora del crecimiento es su capacidad de producir varias fitohormonas que aumentan el crecimiento radicular y la proliferación de pelos radicales, mejorando así la absorción de agua y minerales, lo que eventualmente rendirá en plantas más grandes y, en muchos casos, más productivas (Lambrecht et al., 2000; Martínez-Morales et al., 2003). 5 Capítulo 1 Las fitohormonas, tales como auxinas, giberelinas y citocininas (Horemans et al., 1986; Janzen et al., 1992), son conocidas por su papel regulatorio en el desarrollo de las plantas. Son sustancias orgánicas que en concentraciones muy bajas, afectan procesos fisiológicos de la planta. El ácido indol-3-acético (AIA) es la auxina sintetizada por Azospirillum más conocida, mejor caracterizada y fisiológicamente más activa en plantas. Se ha comprobado que esta fitohormona es la principal responsable del aumento producido en el número de raíces laterales y pelos radiculares observado cuando las plantas de trigo son inoculadas con Azospirillum brasilense (Harari et al., 1988; Costacurta y Vanderleyden, 1995; Martínez-Morales et al., 2003). Al igual que otras PGPB, Azospirillum spp. es capaz de sintetizar y metabolizar giberelinas que promueven la elongación y división celular, por lo que se ha sugerido que su efecto positivo en la promoción de crecimiento vegetal sería parcialmente causado por la producción de éstas fitohormonas por parte de las bacterias (Bottini et al., 2004). En la agricultura se busca controlar los niveles de etileno en planta ya que esta hormona es sintetizada como repuesta a estreses biológicos y ambientales, causando marchitez y senescencia, y con ello significativas pérdidas económicas. Algunas PGPB son capaces de degradar el 1-aminociclopropano-1-carboxilato (ACC), precursor de la síntesis de etileno, mediante la enzima ACC-desaminasa. Por lo tanto, la modulación de los niveles de etileno de la planta, mediada por PGPB que posean la ACC-desaminasa, puede ser considerada como un mecanismo potencial adicional de promoción del crecimiento vegetal (Glick et al., 1999; 2007). 6 Capítulo 1 B. Fijación de Nitrógeno La fijación biológica de nitrógeno es el mecanismo principal de aporte de este elemento en los ecosistemas naturales y es muy importante en la agricultura del trópico (Marschner, 1995). Los diazótrofos, como Azospirillum, catalizan la reducción de nitrógeno por medio del complejo enzimático nitrogenasa, compuesto por las subunidades nitrogenasa y nitrogenasa reductasa. Ambas son metaloenzimas que contienen hierro; la nitrogenasa, además, contiene molibdeno (Madigan et al., 2000). El complejo nitrogenasa fija nitrógeno a temperatura ambiente y presión atmosférica utilizando energía proveniente de los procesos fotosintéticos (autótrofos) o de la utilización de carbohidratos por respiración y/o fermentación (heterótrofos). La reacción es altamente endergónica (940 kJ/mol de nitrógeno fijado) y se expresa en la siguiente ecuación: N2 + 24 ATP + 10 H+ + 8 e‾ 2 NH4+ + H2 + 24 ADP + 24 Pi Además, la enzima está sometida a controles regulatorios muy estrictos; se inactiva rápida e irreversiblemente en presencia de oxígeno y nitrógeno fijado, incluyendo amoníaco (NH3), nitratos (NO3‾) y algunos aminoácidos (Hartmann et al., 1986; Hartmann y Burris, 1987). El complejo nitrogenasa está codificado por los genes nif. Galimand et al. (1989) identificaron los genes de fijación de nitrógeno en A. brasilense y demostraron la existencia de una región de ADN de 30 Kb que contiene los genes nifHDKY, nifENX, nifUSV, nifW y fixABCX. Inicialmente se asumió que la capacidad de Azospirillum para fijar nitrógeno era el principal mecanismo por el cual promovía el crecimiento vegetal, pero al presente esta característica es controversial debido a que el efecto de estimulación del desarrollo de la planta es atribuido principalmente a la secreción de fitohormonas (Bashan y Levanony, 1990; Bashan y Holguin, 1997; Bashan et al., 2004). Sin embargo, 7 Capítulo 1 numerosos experimentos realizados en invernadero y en campo han demostrado reiteradamente que existe una contribución por parte de la fijación biológica de N2, determinado en laboratorio por la transferencia de 15 N2 y mediante observaciones en campo donde la inoculación con Azospirillum redujo significativamente las dosis de fertilización nitrogenada en el cultivo de distintas especies vegetales (Bashan y deBashan, 2010). C. Incremento en la absorción y/o biodisponibilidad de nutrientes Las bacterias PGPB facilitan a las plantas la toma de agua y nutrientes como nitrógeno (ej., NO3‾, NH4+), fósforo (ej., PO43‾), potasio y algunos micronutrientes (ej., hierro, zinc, molibdeno, etc.). Este efecto podría ser atribuido al aumento generalizado del volumen del sistema radicular que está directamente relacionado con la secreción de fitohormonas por parte de la bacteria; o bien a mecanismos específicos que actúan incrementando la absorción de minerales (Morgenstern y Okon, 1987; Bashan y Holguin, 1997). El fósforo, un elemento fundamental para el crecimiento de la planta, se presenta en la naturaleza como fósforo orgánico en la biomasa y como fósforo inorgánico, asociado al hierro y aluminio en el suelo, siendo siempre insoluble o muy poco soluble. Sin embargo, las bacterias del género Azospirillum son capaces de solubilizar fosfatos insolubles que serán luego absorbidos por las plantas (El-Komy, 2005). Este fenómeno puede explicarse en parte por la acidificación del medio debido a los protones y ácidos orgánicos sintetizados por Azospirillum spp. que favorecen la solubilización de P; la naturaleza de los ácidos orgánicos producidos por las bacterias depende directamente de los azúcares presentes en los exudados radiculares (Deubel et al., 2000; Bashan y de-Bashan, 2010). 8 Capítulo 1 Por otro lado, la producción de sideróforos, compuestos de bajo peso molecular que acomplejan la mayor parte de los iones férricos formando complejos estables, constituye otra característica que permite a las plantas inoculadas con bacterias productoras de sideróforos, beneficiarse en la competencia por nutrientes. Además de otorgarle una ventaja competitiva en ambientes pobres en hierro, los sideróforos sintetizados por Azospirillum spp. pertenecientes al grupo de los catecoles presentaron actividad antimicrobiana frente a varios aislados microbianos y fúngicos (Shah et al., 1992; Tortora et al., 2011; 2012). D. Síntesis de Vitaminas y Enzimas Algunas cepas de Azospirillum son capaces de producir, en medios de cultivo definidos, todas o algunas de las vitaminas solubles en agua del grupo B, tales como niacina, ácido pantoténico, tiamina, riboflavina y biotina (Rodelas et al., 1993). Las vitaminas son moléculas orgánicas que cumplen numerosas funciones en plantas pero principalmente actúan como reguladores del crecimiento y antioxidantes (DellaPenna y Pogson, 2006). Entre las enzimas más importantes se encuentra la 1-aminociclopropano-1carboxilato (ACC) desaminasa que cataliza la escisión de ACC en amonio y α-cetobutirato , y por lo tanto, es responsable de la inhibición de la síntesis de etileno por la planta (Glick et al., 1999; Dobbelaere et al., 2003). Sin embargo, las cepas salvajes de Azospirillum spp. no poseen ACC-desaminasa con la única excepción de A.lipoferum 4B (Prigent-Combaret et al., 2008), descripta hasta el presente. Azospirillum posee también una enzima nitrato reductasa (NR) asimilatoria que contribuye, junto con las NRs localizadas en las raíces de las plantas, a la reducción de nitrato (NO3-) a amonio (NH4+) que será luego incorporado a moléculas orgánicas (Steenhoudt et al., 2001). 9 Capítulo 1 E. Biocontrol El biocontrol es un mecanismo indirecto para promover el crecimiento vegetal; consiste en disminuir o prevenir los efectos deletéreos producidos por los microorganismos patógenos de plantas, mediante la síntesis de compuestos antibióticos, ya sean bactericidas y/o fungicidas (Schippers et al., 1987). En este sentido, se conoce que algunos aislados de Azospirillum producen bacteriocinas que inhiben el crecimiento de distintas bacterias (Hartmann y Baldani, 2006) y que A. brasilense sintetiza ácido fenilacético, una molécula antimicrobiana del tipo-auxina (Somers et al., 2005). También se comprobó que la cepa REC3 de Azospirillum brasilense es capaz de inducir una respuesta sistémica contra el agente causal de la antracnosis en frutilla, Colletotrichum acutatum M11 (Tortora et al., 2012). La cepa REC3, que sintetiza sideróforos con actividad antimicrobiana bajo condiciones limitantes de hierro, redujo los síntomas de antracnosis en plantas infectadas con el hongo, y este efecto fue mayor a medida que aumentaba el tiempo entre la inoculación bacteriana y la infección con el hongo. Los estudios bioquímicos y transcripcionales revelaron que se produjo una acumulación transitoria de ácido salicílico junto con la inducción de genes relacionados a la defensa vegetal en las 96 horas posteriores a la inoculación. Además, se demostró que este efecto de biocontrol ejercido sobre C. acutatum estuvo directamente relacionado con modificaciones estructurales a nivel de la pared celular de las hojas como consecuencia de la acumulación de calosa y el aumento de compuestos fenólicos solubles totales (Tortora et al., 2012). Por lo tanto, se demostró que A. brasilense REC3 confiere una repuesta sistémica a las plantas de frutilla contra C. acutatum M11 mediante la activación directa de mecanismos de defensa (Tortora et al., 2012). 10 Capítulo 1 4. Hipótesis aditiva de los mecanismos de Azospirillum La hipótesis aditiva de los mecanismos de promoción de crecimiento vegetal de Azospirillum considera la participación de múltiples mecanismos activados simultánea o secuencialmente durante la asociación planta-bacteria, en lugar de un sólo mecanismo responsable por el efecto positivo ejercido sobre el desarrollo vegetal (Bashan y Holguin 1997; Bashan y de-Bashan, 2010). Se observó que la contribución de un mecanismo aislado fue significativamente menor cuando se evaluó individualmente (Bashan y Levanony, 1990), por lo que algunos investigadores proponen que es la suma de distintas actividades llevadas a cabo por las PGPB, bajo las condiciones ambientales adecuadas, la responsable de los cambios observados en el crecimiento vegetal (Bashan y de-Bashan, 2010). 5. Mecanismos de defensa vegetal Las plantas son constantemente atacadas por microorganismos fitopatógenos, sin embargo sólo una pequeña proporción de ellos invade exitosamente a la planta causando la enfermedad (Chrisholm et al., 2006). Esto ocurre gracias a que la planta puede ser no hospedante, o bien, cuenta con mecanismos de defensa que le permiten hacer frente a los potenciales invasores. Las plantas se defienden mediante estructuras morfológicas que actúan como barreras físicas impidiendo la entrada del patógeno y por medio de reacciones bioquímicas que tienen lugar en diferentes tejidos vegetales generando condiciones que inhiben la entrada y crecimiento de los mismos en la planta (Taíz y Zeiger, 2002). De manera general, las plantas utilizan dos modos de reconocimiento para detectar un microorganismo perjudicial. Primero ocurre la percepción de moléculas microbianas conservadas comúnmente llamadas MAMPs (por sus siglas en inglés: microbe associated molecular patterns), mediante receptores de reconocimiento de 11 Capítulo 1 patrón (PRR: pattern recognition receptos) que están localizados principalmente en la superficie celular vegetal. Este reconocimiento inicial induce una resistencia basal en plantas huésped y no-huésped, también llamada inmunidad inducida por MAMPs, que actúa como una primera barrera para detener la infección patogénica (Zipfel et al., 2004). En segundo lugar ocurre el reconocimiento, dentro de la célula, mediante los productos de los genes de resistencia (R) de moléculas efectoras específicas suministradas a la planta por los patógenos que han atravesado la primera barrera de resistencia basal (Jones y Dangl, 2006). Esta respuesta es designada como inmunidad inducida por el efector (ETI: effector-triggered inmunity) y está generalmente acompañada por una respuesta de hipersensibilidad (HR: hipersensibility response) que corresponde a una forma de muerte celular programada local que restringe la invasión por el patógeno (Chrisholm et al., 2006; Jones y Dangl, 2006). Las respuestas inmune inducidas por PRRs y por los productos de los genes R son muy similares. Sin embargo, los componentes de defensa constitutiva y los eventos de señalización asociados pueden ser diferentes. Generalmente, estas respuestas incluyen el flujo de iones a través de la membrana plasmática, la generación de especies reactivas del oxígeno, el óxido nítrico, las deposiciones de calosa, la activación de proteínas quinasas dependientes de calcio y las activadas por mitógenos y la transcripción de numerosos genes de defensa, muchos de los cuales son activados por la compleja red de señalización hormonal del ácido salicílico (AS), ácido jasmónico (AJ) y etileno (ET) (Thomma et al., 2001; Jones y Dangl, 2006; Pieterse et al., 2009; 2012). Sin embargo, los patógenos también han evolucionado sus estrategias para invadir los tejidos vegetales incluso mediante la inactivación de la defensa vegetal (Lopez et al., 2008). Teniendo en cuenta que los microorganismos patogénicos y benéficos utilizan mecanismos similares para colonizar las plantas, su estudio resulta de gran importancia. 12 Capítulo 1 6. La Frutilla 6. 1. Descripción de la planta La frutilla es una planta herbácea, estolonífera y de buen porte. Pertenece a la familia Rosaceae, tribu Potentillae, clase Angiospermae – Dicotyledoneae, género Fragaria, siendo Fragaria ananassa Duch. la especie más cultivada comercialmente (Hancock et al., 1991; Hummer y Hancock, 2009). El sistema radicular es fibroso y está formado por raíces principales engrosadas, responsables del anclaje de la planta y del almacenamiento de reservas junto con un sistema de raicillas más finas agrupadas en ramificaciones laterales. La planta posee un tallo corto y engrosado llamado corona de donde emergen, desde los nudos, las hojas y las yemas axilares a partir de las que pueden desarrollarse estolones. Los estolones son tallos superficiales de crecimiento horizontal, de longitud y tamaño variable. En la extremidad del estolón hay una serie de entrenudos cortos que conforman la corona del futuro plantín, allí se encuentra también la yema axilar que puede emitir un nuevo estolón y así sucesivamente (Darrow, 1966; Hummer y Hancock, 2009). Los frutos son de tipo múltiple, cuyo receptáculo constituye la parte comestible. Los aquenios, son frutos secos que se encuentran en la superficie del receptáculo insertados superficialmente o en pequeñas depresiones denominadas criptas. En la base del fruto se encuentra el cáliz con sépalos adherentes (Darrow, 1966; Hummer y Hancock, 2009). 6. 2. Importancia del cultivo de frutilla El cultivo de frutilla tiene una gran importancia comercial a nivel mundial y es de gran interés social por la alta demanda de mano de obra, tanto en la producción en 13 Capítulo 1 campo como en el empaque y en la industria (Pérez y Mazzone, 2004; Rodriguez y Pérez, 2013). La producción mundial de frutilla estimada por la FAO en el año 2011 fue de aproximadamente 4.349.498 toneladas, siendo Estados Unidos el primer productor ya que aporta un 50% de la producción total (http://faostat3.fao.org). En Argentina se produce frutilla durante todo el año, concentrándose en las provincias de Santa Fe y Tucumán el 70% de la producción total del país (Rodriguez et al., 2010). Tucumán es el segundo productor nacional debido a que presenta zonas con excelentes condiciones agro-ecológicas para este cultivo que se produce prácticamente los doce meses del año (Pérez y Mazzone, 2004). A pesar de que este cultivo se realiza en suelos con buena fertilidad natural en la provincia de Tucumán, igualmente se aplican fertilizantes químicos, principalmente nitrógeno, en niveles superiores a 290 kg· ha-1· año-1, para incrementar la producción (Pedraza et al., 2007). Tucumán posee ventajas respecto a otras zonas productoras de frutilla en Argentina, tanto para la producción de fruta como para la de plantines, ya que existen diferentes regiones agroclimáticas que permiten obtener fruta primicia y poseer un período de cosecha más extenso que otros centros productores del país. La zona frutillera tradicional en Tucumán es el departamento de Lules que actualmente cuenta con 230 hectáreas. Las características agroclimáticas de Lules son óptimas para la producción de fruta en el invierno: esta estación carece de lluvias de importancia, tiene un amplio período libre de heladas, los suelos son de pH neutro a ácido y existe una abundante dotación de agua para riego, de muy buena calidad. La otra región productora es el departamento de Tafí del Valle, donde se obtienen plantines propagados asexualmente por fijación de estolones y también fruta fresca. En los valles 14 Capítulo 1 de altura existen unas 60 hectáreas cultivadas, con características agroecológicas diferentes a las de Lules. Las posibilidades de expansión de la actividad frutillera están dadas por la demanda comercial (exportación a los Estados Unidos y a Europa), habiéndose realizado con éxito experiencias en este sentido. Otra demanda importante es la del sector industrial, que la emplea para la fabricación de algunos lácteos, mermeladas, jugos, etc. Este segmento absorbe el 30% de la producción actual de la provincia (http://www.sagpya.mecon.gov.ar/new/nuevositio/agricultura/cultivos/perfiles/frutilla). Actualmente se conoce que la producción de frutilla es un cultivo intensivo que requiere grandes cantidades de fertilizantes y pesticidas para aumentar los rendimientos de frutos, lo que puede ser peligroso para el ambiente y la salud humana cuando no se aplican correctamente (Ajwa et al., 2003). Por lo tanto, el uso de bacterias PGPB como Azospirillum se presenta como una alternativa biotecnológica y ecológica para mejorar los rindes y disminuir los costos de producción. 7. Interacción Azospirillum-Frutilla En base a sus efectos en la planta, los microorganismos que interactúan con las plantas se pueden clasificar como patógenos, saprofitos y benéficos. Los microorganismos benéficos se utilizan a menudo como inoculantes (Bloemberg y Lugtenberg, 2001) y pueden ser clasificados de acuerdo con el objetivo de su aplicación en: biofertilizantes (como los rizobios, que se han aplicado en el mercado desde hace más de un siglo), fitoestimulantes (como Azospirillum y otros género productores de auxina que estimula el desarrollo radical), rizoremediadores (degradadores de contaminantes que utilizan el exudado radicular como fuente de carbono) y biopesticidas (Lugtenberg et al., 2002). Actualmente ninguna de las numerosas interacciones microorganismo-planta está completamente dilucidada pero sí está claro 15 Capítulo 1 que sin importar si el microorganismo es benéfico o patógeno, a menudo utilizan los mismos mecanismos, aunque en diferentes combinaciones y para diferentes propósitos (Lugtenberg et al., 2002; Pieterse et al., 2009). En estudios previos se han aislado y caracterizado cepas de Azospirillum brasilense a partir de distintos tejidos de plantas de frutilla en la Provincia de Tucumán, demostrando la asociación natural con plantas de frutilla y la naturaleza ubicua de ésta especie (Pedraza et al. 2007). Tales cepas demostraron tener capacidad para fijar nitrógeno atmosférico, sintetizar índoles, solubilizar fosfatos y presentar quimiotáxis positiva hacía los exudados radiculares de frutilla, siendo éstas características importantes dentro del grupo de las PGPB. Algunas cepas fueron inoculadas en plantas de frutilla en condiciones ambientales controladas (fitotrón e invernadero), y en condiciones de campo, observándose en todos los casos un efecto positivo sobre la promoción del crecimiento vegetal ejercido por A. brasilense, aunque dependiente de los genotipos planta-bacteria asociados (Pedraza et al., 2010). Además, como se mencionó anteriormente, también se demostró que éstas cepas fueron capaces de ejercer mecanismos de biocontrol contra la antracnosis a través de la producción de sideróforos, la activación de la vía del ácido salicílico y el aumento de la expresión de genes de defensa relacionados a la patogénesis (Pedraza et al., 2010; Tortora et al., 2011, 2012). Sin embargo, no se obtuvieron evidencias morfológicas y moleculares de la colonización de Azospirillum brasilense en tejidos de raíces y estolones de frutilla. Si bien se han propuestos diferentes mecanismos para explicar la promoción del crecimiento y el biocontrol mediado por Azospirillum, las señales bioquímicas, fisiológicas, estructurales y moleculares que se activan durante la interacción Azospirillum-frutilla todavía son poco conocidas. 16 Capítulo 1 7. 1. Perspectivas del estudio de la interacción Azospirillum-frutilla Este trabajo de investigación nos permitirá avanzar en nuestro conocimiento de la interacción Azospirillum-frutilla dilucidando los mecanismos desencadenados y los genes activados en las plantas como respuesta a la inoculación. El mejor entendimiento de la performance de los bioinoculates permitirá en un futuro cercano mejorar los efectos de las cepas de Azospirillum, ya sea mediante la optimización de la tecnología utilizada para su aplicación, o bien mediante modificación genética de las cepas seleccionadas. Por otro lado, el análisis de la efectiva colonización de Azospirillum desde una planta madre inoculada a las plantas hijas no inoculadas a través de los estolones, plantea la posibilidad de obtener plantines portadores de cepas seleccionadas de Azospirillum brasilense con interesantes perspectivas de aplicación en el campo, teniendo en cuenta que los cultivos de frutilla son de gran interés económico-social. 17 Capítulo 2 Capítulo 2 18 Capítulo 2 HIPÓTESIS DE TRABAJO Azospirillum brasilense es capaz de asociarse benéficamente con plantas de frutilla y ésta interacción desencadena señales bioquímicas y moleculares. 19 Capítulo 2 OBJETIVO GENERAL Estudiar las señales bioquímicas, estructurales y moleculares que se generan durante la interacción Azospirillum-frutilla, utilizando distintas cepas de Azospirillum brasilense, capaces de asociarse en forma benéfica con plantas de frutilla (Fragaria ananassa). OBJETIVOS ESPECÍFICOS 1. Analizar las distintas formas de asociación entre Azospirillum brasilense y raíces de frutilla: rizosférica y/o endofítica, mediante microscopía electrónica de barrido y transmisión, respectivamente; y mediante microscopía de fluorescencia utilizando una cepa de A. brasilense marcada con el gen reportero gfp. 2. Determinar mediante estudios microbiológicos, ultraestructurales y moleculares la colonización de Azospirillum brasilense a través de los estolones desde una planta madre inoculada a las hijas sin inocular. 3. Evaluar la contribución de A. brasilense en la nutrición mineral de plantas de frutilla y su efecto en la promoción del crecimiento. 4. Investigar a nivel de modificaciones estructurales las deposiciones de calosa y el engrosamiento de la pared celular de hojas de frutilla inoculadas con Azospirillum. 5. Analizar la cinética del estallido oxidativo por determinación de peróxido de hidrógeno (H2O2) y radical superóxido (O2•–), la peroxidación de lípidos y la producción de compuestos fenólicos (solubles y unidos a la pared celular), en raíces y hojas de plantas de frutilla inoculadas con Azospirillum y plantas control. 6. Evaluar la participación y cuantificar la producción de moléculas señales de frutilla tales como el ácido salicílico y ácido indol-acético, durante la interacción con Azospirillum. 7. Estudiar la expresión de genes/ EST (“Expressed Sequence Tags”) de frutilla que se expresen como resultado del proceso de colonización de Azospirillum. 20 Capítulo 3 Capítulo 3 21 Capítulo 3 Análisis de la colonización rizosférica y/o endofítica de Azospirillum brasilense en raíces y estolones de plantas de frutilla INTRODUCCIÓN 1. Los sitios de colonización de Azospirillum La colonización de la raíz es el factor clave en la exitosa interacción Azospirillum-planta, la cual se sabe que afecta positivamente el crecimiento vegetal (Okon, 1985; Bashan, 1986). Normalmente se puede encontrar a Azospirillum a lo largo de todo el sistema radical, aunque está principalmente concentrado en las zonas de elongación, de pelos radicales (Bashan et al., 1986; Okon y Kapulnik, 1986) y en la zona de aparición de las raíces laterales (Patriquin et al., 1983). El hecho de que la mayoría de las cepas de A. brasilense se adsorban en estas áreas, puede deberse a que las regiones mencionadas están constantemente exudando compuestos que las atraen y proveen nutrientes para esta asociación metabólicamente activa (Bashan et al., 1986). 2. Proceso de colonización de Azospirillum La unión de Azospirillum a la raíz de la planta hospedera es un proceso que se cumple en dos etapas, según el modelo propuesto por Michelis et al. (1991), cuyo esquema se muestra en la Figura 1. El mismo consiste en una fase de adsorción seguida de una fase de anclaje. En la etapa de adsorción, mediada por la flagelina del flagelo polar, la bacteria se adhiere a la raíz como una célula individual en forma rápida, débil y reversible. El flagelo polar glicosilado participa en la colonización como una adhesina que permite la adhesión a la superficie radical y, en algunos casos, la especificidad de tejido a través de un proceso de reconocimiento célula-tejido (Croes et al., 1993). 22 Capítulo 3 Figura 1. Proceso bifásico de unión de A. brasilense a la superficie de la planta hospedera. a. Superficie de la planta hospedera; b. Células de A. brasilense; c. Flagelo polar; d. Flagelo Laterales; e. Exopolisacáridos. (Tomado de Steenhoudt y Vanderleyden, 2000). En la etapa de anclaje se forman agregados bacterianos que están firme e irreversiblemente anclados a la raíz. Esta fase se caracteriza por la producción de largas fibras bacterianas (Bashan et al., 1991). La disposición final de las bacterias en el proceso de colonización descrito, como agregados bacterianos anclados a la raíz por los exopolisacáridos, sugiere que Azospirillum brasilense es capaz de formar biopelículas. Las biopelículas son comunidades de microorganismos que suelen crecer en una superficie abiótica o biótica (como la superficie radicular) y están embebidos en una matriz extracelular que ellos mismos sintetizan. Las biopelículas pueden estar formadas por una sola especie bacteriana, pero frecuentemente contienen otras especies como así también hongos, algas, protozoarios y moléculas orgánicas e inorgánicas (Ramey et al., 2004). El desarrollo de la biopelícula y la íntima interacción resultante con las plantas, a menudo requieren de la comunicación célula a célula entre las bacterias colonizadoras (Ramey et al., 2004). La formación de biopelículas otorga varias ventajas a las bacterias que los componen ya que promueven la resistencia a ciertos estreses ambientales, así como la tolerancia antimicrobiana, la protección de la depredación por los protozoarios, metabolismo concertado y/o la oportunidad para la transferencia horizontal de genes 23 Capítulo 3 (Danhorn y Fuqua, 2007). Su alta densidad demográfica proporciona la oportunidad de realizar ciertos procesos que las células individuales no pueden lograr de manera eficiente, como la excreción de metabolitos o exoenzimas que son efectivas sólo a partir de un determinado umbral de concentración. La formación de biopelículas es un modo de mantener una masa crítica de células en un lugar específico durante períodos suficientemente largos para iniciar interacciones benéficas o antagónicas con plantas hospederas (Danhorn y Fuqua, 2007). 3. Factores que intervienen en la colonización Para alcanzar una colonización eficiente, se requiere que la bacteria posea ciertas cualidades. Primeramente, la motilidad bacteriana es un prerrequisito para responder quimiotácticamente y desplazarse hacia las raíces de la planta donde pueden beneficiarse de los exudados radiculares. Una vez que llegan a las inmediaciones de la raíz, se produce la adhesión a las células blanco de la superficie radical (Vanbleu y Vanderleyden, 2003). 3. 1. Componentes bacterianos que participan en la colonización Flagelos: la motilidad es necesaria para alcanzar el nicho más favorable y para competir con otros microorganismos por esos nichos. Azospirillum es móvil debido a la presencia de flagelos. El flagelo es una estructura cilíndrica fina, hueca y rígida, con aspecto helicoidal que está constituido por subunidades idénticas de una proteína llamada flagelina. Croes et al. (1993) han demostrado que además de las propiedades locomotoras, el flagelo polar de A. brasilense posee propiedades adhesivas. Dentro del género Azospirillum, A. brasilense, A. lipoferum, y A. irakense poseen flagelación mixta: un flagelo polar cuando es cultivado en medio líquido y flagelos adicionales laterales cuando es cultivado en medio sólido (Tarrand, 1978; Hall y Krieg, 1984; 24 Capítulo 3 Moens et al., 1996). El flagelo polar de A. brasilense rota en ambas direcciones tanto en sentido horario como en sentido antihorario; esto permite al microorganismo el movimiento natatorio (swimming) en medios líquidos (Zhulin, 1993). Los flagelos laterales son más delgados y cortos, son inducidos en medios semigelificados y son necesarios para el movimiento sobre superficies sólidas (motilidad superficial o swarming) (Hall, 1983; Hall y Krieg, 1984). La motilidad natatoria en Azospirillum interviene en el movimiento de la bacteria hacia las raíces de plantas siendo la quimiotaxis hacia los exudados la etapa inicial de colonización (Zhulin, 1993). Sin embargo, la motilidad superficial (swarming) a través de las superficies de las raíces puede ser importante para la colonización a largo plazo (Alexandre, 1999). Polisacáridos Extracelulares: se considera que la etapa irreversible de colonización de Azospirillum en las raíces de las plantas está directamente relacionada con los exopolisacáridos (EPS) producidos por la bacteria. Además, éstos juegan un papel esencial en la interacción planta-bacteria (Vanbleu y Vanderleyden, 2003). Así como los expolisacáridos posibilitan el anclaje de las células bacterianas a la superficie de la raíz, también establecen conexiones entre células dentro de los agregados bacterianos (Levanony y Bashan, 1991). Un rasgo único de la colonización de raíces por A. brasilense es el anclaje bacteriano a través de una red de material fibrilar que cumple la función de arraigar a las bacterias a la superficie radicular (Levanony y Bashan, 1991). El material fibrilar puede estar compuesto por hebras simples o múltiples proporcionando resistencia a la separación de las células. Gracias al mismo, las bacterias son adsorbidas fuerte y permanentemente sobre las raíces y sobre las partículas de suelo debido a que la red de material fibrilar proporciona resistencia contra fuerzas físicas externas aplicadas, tales como el lavado y la agitación (Levanony y Bashan, 1991). 25 Capítulo 3 3. 2. Componentes vegetales que participan en la colonización Lectinas: las lectinas son proteínas que reconocen y se unen reversiblemente a residuos de azúcares específicos de moléculas glicosiladas. Se ha observado que las lectinas de las raíces están involucradas en el proceso de colonización de Azospirillum (UmaliGarcia et al., 1980; Patriquin et al., 1983; Elmerich, 1984). Moens et al. (1995) determinaron que la principal proteína del flagelo polar de Azospirillum brasilense es una flagelina glicosilada (Fla1) y sugirieron que las lectinas presentes en las raíces pueden unirse al segmento glicano de Fla1. Exudados radicales: los exudados de las raíces están constituidos principalmente por sustancias de bajo peso molecular (aminoácidos y azúcares) que están disponibles para los microorganismos que se encuentren en la rizósfera, que es la zona del suelo adyacente a las raíces donde existe una interacción dinámica con los microorganismos (Sorensen, 1997). La producción de exudados implica un cierto costo para la planta, por lo tanto debe proporcionar alguna ventaja selectiva a la misma. Los exudados pueden brindar beneficios químicos y físicos para la planta; por ejemplo, los mucílagos de las raíces reducen la fricción entre las puntas de las raíces y el suelo, minimizan la desecación del ápice de la raíz, promueven la transferencia de nutrientes a la raíz y/o afectan la interacción entre los microorganismos del suelo y las raíces (Russel, 1977). Muchas bacterias son atraídas por las sustancias presentes en los exudados (quimiotaxis) y al dirigirse hacia ellas se acercan a la superficie de las raíces donde suele ocurrir la colonización (Vande Broek y Vanderleyden, 1995). 4. Objetivo del capítulo En esta primera parte del presente trabajo de tesis doctoral se planteó un estudio a nivel ultraestructural de la colonización rizosférica y endofítica de raíces de plantas de frutilla por métodos microbiológicos, ultraestructurales y moleculares. 26 Capítulo 3 Asimismo, se analizó la posible colonización de Azospirillum desde una planta madre de frutilla inoculada a sus plantas hijas no-inoculadas a través de los estolones. A tal fin, se utilizaron técnicas de microscopía óptica y de fluorescencia, microscopía electrónica de barrido y transmisión, cuantificación de bacterias viables por el número más probable, y a nivel molecular se realizó la amplificación de un gen marcador de bacterias diazotróficas, nifD (esencial para la fijación biológica de N2), y la identificación de las bacterias mediante amplificación del gen 16S ADNr, ARDRA (amplified 16S ribosomal DNA restriction analysis) y secuenciamiento del gen 16S ADNr. MATERIALES Y MÉTODOS 1. Microorganismos Se emplearon dos cepas de Azospirillum brasilense aisladas del cultivar de frutilla `Camarosa´ en la provincia de Tucumán: A. brasilense REC3 (FJ012319.1) (Raíz Estéril `Camarosa´- cepa endofítica de la raíz) A. brasilense PEC5 (Primer Estolón `Camarosa´- cepa endofítica de estolón). Las mismas fueron caracterizadas microbiológica y molecularmente en un trabajo previo de Pedraza et al. (2007). Dentro de las características PGPB que las bacterias presentaron (como la fijación de nitrógeno, producción de indoles y sideróforos), se consideró a la producción de indoles totales como la más importante y como criterio de selección de las cepas. 27 Capítulo 3 1. 1. Medios de cultivo El medio NFb sólido, semisólido y líquido se utilizó para el crecimiento y el mantenimiento de las cepas puras de Azospirillum (Döbereiner, 1995). El medio NFb semisólido carece de fuente nitrogenada y otorga un ambiente adecuado para el crecimiento de las bacterias en condiciones microaeróbicas que permiten fijar nitrógeno. Además, se utilizaron los medios de cultivo K-lactato, K-malato, y LB, cuyas composiciones química se describen a continuación: NFb semisólido: Ácido málico 5 g· l-1; MgSO4·7H2O 0,2 g· l-1; CaCl2·2H2O 0,02 g· l-1; K2HPO4 0,5 g· l-1; NaCl 0,1 g· l-1; KOH 4,5 g· l-1; solución de micronutrientes 2 ml· l-1; Fe-EDTA (sol. 1,64%) 2 ml· l-1; azul de bromotimol (sol. 0,5% KOH 0,2 N) 2 ml· l-1 y agar 1,75 g· l-1; pH 6,8. Solución de micronutrientes: CuSO4·5H2O 0,04 g· l-1; ZnSO4·7H2O 1,2 g· l-1; H3BO3 1,4 g· l-1; NaMoO4·2H2O 1 g· l-1; MnSO4·H2O 1,175 g· l-1. NFb sólido: Posee la misma composición química que el anteriormente descrito aunque la concentración de agar es mayor (15 g· l-1) y está suplementado con extracto de levadura 0,5 g· l-1 y colorante rojo congo 15 ml· l-1 (solución acuosa 1/400 p/v); pH 6,8. NFb líquido: Los componentes químicos son los mismos que para el medio NFb semisólido pero suplementado con NH4Cl al 0,5 % (p/v) y sin azul bromotimol; pH 6,8. K-Lactato: KH2PO4 0,87 g·l-1; K2HPO4 1,67 g·l-1; MgSO4·7H2O 0,29 g·l-1; NaCl 0,48 g·l-1; Lactato de sodio 0,38 g·l-1; NH4Cl 0,02 g·l-1; CaCl2 0,007 g·l-1; FeCl3 0,001 g·l-1; NaMoO4·2H2O 0,0025 g·l-1; solución de oligoelementos 10 ml·l-1; agar 15 g·l-1; pH 6,9. 28 Capítulo 3 K-Malato: KH2PO4 0,87 g· l-1; K2HPO4 1,67 g· l-1; MgSO4·7H2O 0,29 g· l-1; NaCl 0,48 g· l-1; Ácido Málico 4,53 g· l-1; NH4Cl 0,02 g· l-1; CaCl2 0,007 g· l-1; FeCl3 0,001 g· l-1; NaMoO4·2H2O 0,0025 g·l-1; solución de oligoelementos 10 ml·l-1; agar 15 g·l-1; pH 6,9. Solución de oligoelementos: MgSO4·7H2O 0,25 g·l-1; ZnSO4·7H2O 0,07 g·l-1; CoSO4·7H2O 0,014 g· l-1; CuSO4·7H2O 0,0125 g· l-1; H3BO3 0,003 g· l-1. Medio LB (Luria Bertani): triptona 10 g·l-1, extracto de levadura 5 g·l-1; NaCl 10 g·l-1; agar 15 g· l-1; pH 7,0. Medio LB modificado: medio LB suplementado con CaCl2 2,5 mM y MgSO4 2,5 mM. Todos los medios de cultivo se esterilizaron en autoclave a 120 ºC durante 20 minutos. 1. 2. Observaciones macroscópicas El desarrollo bacteriano se analizó en 5 ml de medio NFb semisólido contenido en frasco de vidrio de 10 ml, considerando el viraje del indicador azul de bromotimol, de azul a verde, y el desarrollo de una película blanquecina subsuperficial luego de 48-72 h de incubación a 30ºC. 1. 3. Observaciones microscópicas Las observaciones microscópicas se realizaron con un microscopio óptico ZEISS Standar 25 (ZEISS, Alemania) sobre preparados de cultivos frescos con el fin de analizar la morfología y motilidad de las bacterias. También se realizaron frotis y coloración de la pared celular con el método de Gram, utilizando las soluciones de coloración de Laboratorios Britania. 29 Capítulo 3 1. 4. Estudios de la ultraestructura celular de A. brasilense Las cepas REC3 y PEC5 se cultivaron en medio NFb líquido, a partir de una colonia pura, desarrollada previamente en medio NFb sólido. El volumen de cultivo fue de 5 ml, con tres repeticiones por cada cepa, las que se incubaron a 30 ºC durante 48 h con agitación (180 rpm). Finalizado este tiempo se colectaron las células (1 ml) concentrándolas por centrifugación (14.000 rpm por 5 min) 5 veces hasta formar una pastilla de aproximadamente 0,5 cm de espesor. 1. 4. 1. Microscopía Electrónica de Transmisión (MET) Las muestras de las bacterias colectadas en la etapa anterior fueron fijadas en el fijador de Karnovsky (1965) durante 3 horas a 4 ºC, posteriormente lavadas tres veces en tampón fosfato 0,1M pH 7,4, incluidas en agar y postfijadas durante toda la noche en tetróxido de osmio (OsO4) al 1% a 4 ºC. Finalmente las muestras fueron tratadas con una solución acuosa de acetato de uranilo al 2% durante 40 min. Después de la fijación, fueron deshidratadas en una serie de graduación creciente de etanol 96° (de 25 % a 100 %) seguida de acetona (100 %). La infiltración se llevó a cabo en una mezcla de acetona y resina plástica Spurr y finalmente la inclusión en la resina pura. A partir de los bloques obtenidos se realizaron cortes ultrafinos que se montaron en grillas de cobre, se contrastaron con acetato de uranilo y citrato de plomo (Venable y Coggeshall, 1965) y se examinaron en el microscopio electrónico de transmisión ZEISS EM 109 (ZEISS, Alemania) del Centro Integral de Microscopía Electrónica (CIME, UNT-CONICET). 1. 4. 2. Microscopía Electrónica de Barrido (MEB) Las muestras bacterianas fueron procesadas de igual manera que para MET hasta la etapa de deshidratación; luego fueron desecadas por punto crítico, montadas 30 Capítulo 3 sobre un portaespecimen de aluminio empleando pintura de plata y finalmente metalizadas con oro para su observación en los microscopios electrónicos de barrido JEOL 35CF (JEOL, Alemania) y ZEISS SUPRA 55VP (ZEISS, Alemania) del Centro Integral de Microscopía Electrónica (CIME, UNT-CONICET). 1. 5. Obtención de una cepa transgénica A. brasilense REC3::gfp (green fluorescent protein) por conjugación triparental Con el fin de obtener una construcción estable de A. brasilense que exprese el gen gfp para monitorear la colonización de plantas de frutilla, se transformó la cepa A. brasilense REC3 con el plásmido pRU1156-ChsA provisto por el Laboratorio de Ciencias Microbiológicas de la Benemérita Universidad Autónoma de Puebla, México. Este es una fusión del plásmido pRU1156 (Karunakaran et al., 2005) que contiene las secuencias que codifican los genes reporteros gfpmut3.1 y gusA sin promotor, al que se le insertó el promotor del gen ChsA de A. brasilense Sp7 (ATCC 29145) corriente arriba. Este plásmido además expresa constitutivamente genes de resistencia a tetraciclina (Tc) y genes parADCDE responsables de la segregación de éstos plásmidos durante la división celular. La transformación se realizó por conjugación triparental utilizando una cepa E. coli DH5α pRU1156-ChsA como donadora, la cepa E. coli HB101 que conteniene el plásmido “helper” pRK2013 (Figurski y Helinski, 1979) y la cepa A. brasilense REC3 como receptora. Alícuotas de 50 µl de cultivos frescos de cada cepa se hicieron crecer en 5 ml de medio líquido fresco (1:100) con agitación y con sus correspondientes antibióticos (ATB): Cepa E. coli pRU1156-ChsA - Tc10 - medio LB, 18 h a 37ºC, 200 rpm Cepa E. coli pRK2013 - Km20 - medio LB, 18 h a 37ºC, 200 rpm 31 Capítulo 3 Cepa A. brasilense REC3 - medio LB modificado, s/ATB, 24 h a 30ºC, 200 rpm Posteriormente, 50 µl de estos precultivos se sembraron en 5 ml de medio líquido fresco sin antibióticos: Cepa E. coli pRU1156-ChsA, medio LB, s/agitación, s/ATB, 2 h a 37ºC Cepa E. coli pRK2013, medio LB, s/agitación, s/ATB, 2 h a 37ºC Cepa A. brasilense REC3, medio Lb modificado, s/ATB, 6 h a 30ºC, 200 rpm Luego de la incubación, se sembraron 10 µl de cada cultivo en una placa de Petri con medio LB modificado sólido sin antibióticos, esperando 20 min entre cada siembra y en el siguiente orden: E. coli pRK2013, E. coli pRU1156-ChsA y A. brasilense REC3. Para conseguir la relación 1:1:10, se concentró la cepa receptora mediante centrifugación de 1 ml de cultivo a 8.000 rpm por 2 min y posterior resuspención en un volumen menor (15 µl). Luego de 48 h de incubación se estrió la conjugación en una placa con medio K-Lactato+Tc15. Este medio es selectivo para Azospirillum porque E. coli no puede crecer con NH4Cl como fuente de N. Las colonias que crecieron en KLactato+Tc15 fueron purificadas mediante repiques periódicos en el mismo medio líquido y sólido. 1. 5. 1. Microscopía de Fluorescencia Se logró confirmar la expresión de la proteína GFP en los transconjugantes de A. brasilense REC3::gfp utilizando un microscopio de fluorescencia Olympus BX51 equipado con un sistema de fluorescencia reflectiva U-LH100HG (Olympus, Japón). Cuando la proteína es excitada con luz azul mediante el filtro U-MWB2 (420-490 nm) la bacteria fluoresce verde y cuando es excitada con luz UV (filtro U-MWU2, 330-385 nm) la expresión de la proteína le otorga fluorescencia azul brillante a la bacteria. 32 Capítulo 3 1. 5. 2. Control de estabilidad de la construcción A. brasilense REC3::gfp La estabilidad de esta construcción se comprobó haciendo crecer la cepa transconjugante en medio líquido y sólido con y sin presión de selección (Tc) por numerosas generaciones; el número de UFC se determinó por el método de cuantificación de las gotas de Miles y Misra (1973). Para ello, se cultivó la cepa A. brasilense REC3::gfp en dos condiciones distintas: medio Lb líquido con Tc15 y Lb sin ATB, a 30 ° C durante 24 h con agitación, y se la consideró como la primera generación (G1). A partir de ésta se tomaron 50 µl y se inocularon nuevamente en 5 ml de medio Lb con y sin Tc15 (G2); esto se repitió 10 veces cada 24 h de incubación. En cada generación, se tomaron 100 µl de cultivo, se realizaron diluciones seriadas con buffer fosfato de potasio (pH 6,8) y se sembraron 5 gotas de 10 µl de cada dilución (103 , 10-4, 10-5, 10-6) en medio NFb sólido con y sin Tc15 respectivamente. Las UFC·ml-1 se determinaron de acuerdo a la siguiente fórmula, donde el volumen sembrado corresponde a 50 µl (5 gotas de 10 µl): La expresión de GFP fue controlada en cada generación por microscopia de fluorescencia (U-MWU2, 330-385 nm). 1.5.3. Análisis estadístico El análisis estadístico de los datos de UFC·ml-1 se realizó utilizando el software Infostat (ver. 2008 para Windows) para el análisis de la varianza (ANOVA) y las diferencias significativas utilizando el test de diferencias múltiples de Tukey con un valor de p <0,05. 33 Capítulo 3 2. Material Vegetal Se emplearon tres variedades de frutilla: `Camarosa´, `Milsei´ y `Selva´, que son cultivadas comercialmente en la provincia de Tucumán. Las plantas empleadas en este trabajo fueron saneadas por cultivos in vitro y las mismas fueron facilitadas por el Banco de Germoplasma Activo perteneciente al Instituto Superior de Investigaciones Biológicas (INSIBIO). Se controló la esterilidad de las plantas saneadas por cultivo in vitro sembrando un macerado de las mismas en placas de Petri con medio LB y se incubaron a 30 ° C por 120 h. 3. Inoculación de plantas de frutilla con A. brasilense en soporte líquido 3. 1. Modelo experimental Para evaluar ultraestructuralmente la colonización de las plantas de frutilla con A. brasilense, se realizó un ensayo de inoculación; para ello se prepararon cultivos puros de las cepas REC3 y PEC5 crecidas en el medio NFb líquido con una concentración final de aproximadamente 106 UFC· ml-1. Se emplearon en total 27 plantas de frutilla: 9 var. `Camarosa´, 9 var. `Milsei´ y 9 var. `Selva´. En cada variedad de frutilla se realizaron tres tratamientos cada uno de ellos por triplicado: (i) tres plantas fueron inoculadas con REC3, (ii) tres plantas fueron inoculadas con PEC5 y (iii) tres plantas control sin inocular. 3. 2. Acondicionamiento de las plantas en soporte líquido Las plantas se colocaron en tubos de vidrio estériles con un soporte de guata y 20 ml de solución nutritiva de Hoagland diluida al 50% (Hoagland y Arnon, 1950) como medio de cultivo hidropónico. La parte superior de los tubos se cerró con un film plástico y se cubrió la parte inferior hasta la altura del soporte con papel de aluminio con el objeto de proteger la zona radicular de la luz directa, simulando el área 34 Capítulo 3 correspondiente al suelo. Esta forma de cultivo permite realizar observaciones microscópicas de la superficie de las raíces de plantas de frutilla sin la interferencia que generan las partículas de suelo adheridas a ellas cuando se utiliza soporte sólido. 3. 3. Preparación del inóculo Para el inóculo se prepararon cultivos puros de las cepas de A. brasilense REC3 y PEC5, sembrando una colonia (1 UFC) de aproximadamente 0,5 mm de diámetro en un tubo con 5 ml de medio de cultivo NFb líquido. Se incubaron durante 48 h a 30 ºC y 180 rpm. Se ajustó la concentración final del inóculo a DO560= 0,2 que corresponde a aproximadamente 106 UFC· ml-1. 3. 4. Inoculación Tres plantas de cada variedad de frutilla (`Camarosa´, `Milsei´ y `Selva´) fueron inoculadas por riego, y de forma independiente, con: (i) 1 ml de la suspensión bacteriana REC3, (ii) 1 ml del inóculo de PEC5 y (iii) 1 ml de H2O destilada estéril que correspondían al tratamiento control sin inoculación. Todas las plantas se mantuvieron durante 13 días en cámara de cría en condiciones controladas: 14 h de luz y 10 h de oscuridad, temperatura (25 ± 2) ºC y 80% de humedad relativa (HR). 3. 5. Estudios Ultraestructurales: Microscopía Electrónica de Transmisión (MET) y de Barrido (MEB) Para estudiar la colonización superficial y endofítica de Azospirillum brasilense se tomaron muestras de raíces de las plantas de frutilla cultivadas en soporte líquido, las que fueron procesadas para su observación por microscopía electrónica de acuerdo a la técnica explicada en la sección (1.1.4.). La única variante de la metodología 35 Capítulo 3 empleada en MET y en MEB, consistió en que las muestras una vez fijadas en la solución de Karnovsky no fueron incluidas en agar. 4. Inoculación de plantas de frutilla con A. brasilense en soporte sólido 4. 1. Modelo experimental La inoculación de plantas de frutilla en soporte sólido permitió evaluar por métodos microbiológicos, ultraestructurales y moleculares la colonización de Azospirillum brasilense. Con este fin, se realizó un ensayo de inoculación repitiendo el modelo descrito en la sección (2.1). 4. 2. Inoculación La inoculación se realizó sumergiendo las raíces de las plantas en la suspensión bacteriana (106 UFC· ml-1) durante 20 min. Los inóculos utilizados en este ensayo se prepararon de acuerdo a lo descrito en el ítem (2.3). Para el tratamiento control las raíces fueron sumergidas en agua destilada estéril. Las plantas de frutilla, tres por cada tratamiento, se plantaron individualmente en macetas estériles (desinfectadas con etanol 70º) utilizando sustrato estéril (compost orgánico: resaca de río: acículas de pino; 1: 1: 1). El sustrato se esterilizó tres veces en autoclave a 121ºC durante 20 min, con períodos de 24 h entre cada esterilización. El control de esterilización se realizó sembrando el sustrato esterilizado en placas de Petri con medio Lb sólido; si al cabo de 48 h no había crecimiento microbiano, se consideraba estéril y apto para el ensayo. Las macetas (0,5 litros) se colocaron en bandejas plásticas y se taparon con una película plástica para crear una cámara húmeda durante los primeros treinta días de aclimatación. Para evitar la contaminación externa o cruzada entre los distintos tratamientos, se utilizaron distintas bandejas para cada tratamiento. 36 Capítulo 3 Una vez aclimatadas, y durante los siguientes seis meses, todas las plantas de frutilla se mantuvieron en un fitotrón en condiciones controladas: temperatura de 25 ºC ± 2 ºC, 70% de HR y 16 h de fotoperíodo. Las plantas se regaron con agua destilada estéril por capilaridad dos o tres veces por semana. En esta etapa se produjo el crecimiento y la reproducción vegetativa de las plantas; cuando ellas producían estolones (con dos hojitas) se fijaban en otra maceta con sustrato estéril para formar nuevas plantas hijas, sin cortar los estolones. Cada planta de frutilla produce numerosos estolones, que darán lugar a varias hijas, por lo tanto, a fin de simplificar el diseño experimental y reducir el número de plantas a analizar, se siguió solamente una línea de plantas hijas hasta la segunda o tercera generación, según se esquematiza en la Figura 2. 1°st estolón 1 Planta madre (inoculada con A. brasilense) 2° 2ndestolón 1° Planta hija 2° Planta hija 3° estolón 4° estolón 3° Planta hija Figura 2. Representación esquemática de la propagación asexual de frutilla. Al cabo de siete meses, cuando las plantas habían crecido lo suficiente, teniendo como mínimo dos generaciones de plantas hijas cada una, se tomaron muestras de raíces y estolones para realizar la determinación del número más probable de diazótrofos, la extracción de ADN y los estudios ultraestructurales. 37 Capítulo 3 4. 3. Ensayos microbiológicos. Determinación del Número Más Probable (NMP) de A. brasilense en distintos tejidos de plantas de frutilla 4. 3. 1. Toma de muestras Las 27 plantas iniciales se reprodujeron dando lugar a numerosas plantas hijas, de éstas se tomaron 55 muestras de raíces y estolones con distintos tratamientos. De cada planta se cortaron raíces con una tijera esterilizada por flameado, las que luego fueron lavadas con agua destilada estéril para eliminar el suelo adherido a ellas. Los estolones se esterilizaron superficialmente con alcohol 70º. 4. 3. 2. Determinación del NMP Se determinó el número más probable de bacterias diazotróficas por gramo de raíces y de estolones utilizando la tabla de McCrady para tres repeticiones siguiendo el método descrito por Döbereiner et al. (1995). Se pesó 1 g de cada tejido vegetal (raíces y estolones) y se maceraron en un mortero de porcelana con 9 ml de buffer fosfato (pH 6,8). A partir de esto, se realizaron diluciones seriadas y se sembraron 100 μl de cada dilución en el medio de cultivo NFb semisólido, por triplicado. Luego de incubar por 48 h a 30 ºC, se determinó el NMP. Se realizaron también observaciones macroscópicas y microscópicas para observar la morfología y motilidad característica de Azospirillum, a fin de poder confirmar el reaislamiento de Azospirillum y no de otra bacteria. Para ello, se verificó si los tubos presentaban crecimiento característico en el medio NFb semisólido y a partir de los tubos con crecimiento positivo, se observaron muestras colocadas entre porta y cubre objetos en el microscopio óptico ZEISS Standar 25 (ZEISS, Alemania) con un objetivo 100x. 38 Capítulo 3 4. 4. Estudios ultraestructurales. Microscopía Electrónica de Transmisión (MET) y de Barrido (MEB) Se utilizó la microscopia electrónica para investigar la presencia de Azospirillum brasilense en los tejidos de raíces y estolones, y de esta manera, comprobar la colonización bacteriana. El estudio ultraestructural de las raíces se realizó por MET siguiendo la metodología descrita en la sección (1.1.4.1). En el caso de los estolones, se tomaron muestras de aproximadamente 1 cm de longitud de la parte media entre dos nudos, se procesaron de acuerdo a la técnica descrita en la sección (1.1.4.2) y se cortaron longitudinalmente para observar los tejidos internos en el microscopio electrónico de barrido ZEISS SUPRA 55VP (ZEISS, Alemania) del Centro Integral de Microscopía Electrónica (CIME, UNT-CONICET). 4. 5. Estudios Moleculares Los genes nif son propios de las bacterias diazotróficas y no están presentes en el genoma de las plantas; son esenciales para los procesos biológicos de fijación de N2 debido a que codifican para el complejo enzimático nitrogenasa. A partir de muestras de tejidos vegetales, se extrajo el ADN y se amplificó por la reacción en cadena de la enzima polimerasa (PCR) un fragmento del gen nifD que codifica a la subunidad nitrogenasa lo que confirmaría la presencia de bacterias diazotróficas en los tejidos vegetales. La confirmación de la identidad de esas bacterias diazotróficas se realizó mediante ARDRA (amplified 16S ribosomal DNA restriction analysis) y secuenciación del gen 16S ADNr del ADN de las bacterias re-aisladas de raíces y estolones de frutilla. 39 Capítulo 3 4. 5. 1. Extracción de ADN de tejidos vegetales La extracción del ADN molde para la reacción en cadena de la polimerasa se hizo por el método del CTAB descrito por Doyle y Doyle (1987), adecuado para pequeñas cantidades de material vegetal fresco. Las muestras de raíces y estolones se molieron con nitrógeno líquido en un mortero de porcelana. El material obtenido se colocó en microtubos y se sumergió en CTAB caliente (65 º C). Posteriormente fue necesario sólo una extracción con cloroformo: alcohol isoamílico (24 : 1) y una precipitación con isopropanol. Luego de dos lavados de la pastilla con etanol 70º a 4 ° C y una precipitación con etanol absoluto. Las muestras de ADN se resuspendieron en buffer TE (Tris HCl- EDTA) (Sambrook et al. 1989). A fin de eliminar cualquier tipo de interferencia y purificar las muestras de ADN se realizó una ulterior limpieza con una mezcla de cloroformo: fenol (50:50; pH 8,0), seguida de dos extracciones- precitaciones con etanol absoluto y etanol 70º a 4 ° C. Para verificar la presencia y calidad del ADN obtenido se realizó una electroforesis horizontal sembrando alícuotas de 8 μl de ADN con 2 μl de buffer de siembra (Biodynamics, Argentina) en un gel de agarosa al 1% en buffer TBE 1X (Trisácido borico- EDTA) (Sambrook et al. 1989). Los geles se tiñeron con bromuro de etidio (0,5 μg ml-1) durante 10 min, se lavaron con agua destilada 5 min y se visualizaron sobre luz UV (320 nm) en un transiluminador Vilber Lourmat TFX-20M (Vilber Lourmat, Francia). Las fotografías se tomaron con un equipo de digitalización de imágenes Kodak (EEUU). 40 Capítulo 3 4. 5. 2. Amplificación por PCR del gen nifD Se amplificó por PCR un fragmento de 710 bp del gen nifD, usando los cebadores y las condiciones descritas por Potrich et al. (2001). Primer directo: 5´ATCATCGGTGACTACAAC 3´ (18 bp) y reverso: 5´ATCCATGTCGCGGCGAA 3´ (17 bp). La mezcla de reacción se realizó en 25 μl de volumen final: 0,2 unidades de la enzima ADN-Taq polimerasa (Promega, EE UU), 1 μl de dNTPs 10 mM, 1,5 μl de MgCl2 1,5 mM, 5 μl de buffer de la enzima y 1 μl de cada cebador 10 μM; se trabajó con distintas cantidades de ADN molde (2, 1 y 0,5 μl). En la reacción de PCR sólo fue posible amplificar el fragmento esperado cuando se utilizó 0,5 μl de ADN molde en la mezcla de reacción. El programa de PCR utilizado consistió en: un calentamiento de desnaturalización inicial a 95 º C durante 3 min, seguido de 40 ciclos de desnaturalización a 95 º C por 1 min, hibridación a 48 º C por 1 min y extensión a 72 º C por 2 min. La reacción concluyó con un ciclo de extensión final a 72 º C durante 5 min y luego las muestras se mantuvieron a 4 º C. Las amplificaciones se realizaron no menos de 3 veces en un Termociclador Apollo ATC 201 (Apollo, EEUU). En la reacción de PCR se incluyó un control positivo, cuyo ADN molde (1 μl) provino de la lisis térmica de la bacteria Azospirillum brasilense Sp7 (ATCC 29145) utilizada como cepa de referencia, provista por EMBRAPA-Agrobiología, Brasil. Para la disrupción térmica se suspendió una colonia de la cepa Sp7 en 30 μl en agua destilada estéril a una temperatura de 95 ºC durante 10 min y luego se enfrió a temperatura ambiente. El control negativo fue la mezcla de reacción con el agregado de agua destilada estéril en lugar de ADN. Los productos de amplificación se analizaron por electroforesis horizontal de acuerdo a la técnica descrita en la sección (4.5.1). 41 Capítulo 3 4. 5. 3. Extracción de ADN bacteriano, amplificación por PCR del gen 16S ADNr y restricción enzimática La amplificación por PCR del 16S ADNr se realizó directamente de colonias bacterianas puras de los re-aislamientos obtenidos a partir de tejidos de frutilla, que fueron sometidas a una lisis térmica (explicada anteriormente). Se incluyeron también las cepas A. brasilense REC3, PEC5 y Sp7 como controles positivos. Para amplificar un fragmento de 1450 bp del gen 16S ADNr se utilizaron los primers universales 27f (5´-GAGAGTTTGATCCTGGCTCAG 3´) y 149r (5’CTACGGCTACCTTGTTACGA 3´) que tienen una temperatura de hibridación 60 ºC (Grifoni et al., 1995). La técnica de ARDRA (amplified 16S ribosomal DNA restriction analysis) se basa en la amplificación por PCR y digestión enzimática del gen 16S ADNr. Para la identificación de los aislados correspondientes a la especie A. brasilense, los amplicones positivos de 16S ADNr (15 μl) fueron digeridos con 5 U de la enzima de restricción AluI (Promega, EEUU) durante 3 h a 37 ° C. La reacción tuvo un volumen final de 30 μ1. Finalmente, los fragmentos de la digestión se separaron por electroforesis en gel de agarosa (1,5 % p/v) para obtener los perfiles de ARDRA (sección 4.5.1.). 4.5.4. Secuenciación automática del 16S ADNr La secuenciación del gen 16S ADNr de cuatro aislamiento representativos (bacterias aisladas de plantas madre, 1era, 2da y 3era hija) se realizó por el método de dideoxi de Sanger et al., (1977). La reacción de secuenciación se llevó a cabo utilizando un equipo de 4 capilares ABI 3130/Hitachi Genetic Analyzer (Applied Biosystems, EEUU ) y los oligonucleótidos 27f y 149r previamente descriptos. El análisis de secuencia se realizó por comparación con las secuencias nucleotídicas disponibles en las bases de datos del GenBank, EMBL, DDBJ y PBD 42 Capítulo 3 utilizando el programa BLASTN 2.2.25 (Zhang et al., 2000) a través del servidor del Centro Nacional de Información Biotecnologica (NCBI). 5. Inoculación de plantas de frutilla en condiciones hidropónicas con la cepa transgénica A. brasilense REC3::gfp Con el fin de monitorear la colonización de A. brasilense en raíces de plantas de frutilla inoculadas se obtuvo la cepa transformada A. brasilense REC3::gfp y se realizaron ensayos de inoculación en condiciones hidropónicas para estudiar la colonización hasta los 28 días post-inoculación. En contraste con la microscopía electrónica (MEB y MET), en la cual las muestras deben ser fijadas, deshidratadas y contrastadas parar su observación, la microscopía de fluorescencia permite la observación de las bacterias vivas y fisiológicamente activas. 5. 1. Optimización de las condiciones hidropónicas para plantas de frutilla Se realizó un ajuste metodológico del cultivo de plantas de frutilla en hidroponía para trabajar con un sistema radicular limpio, libre de sustancias que pudieran interferir en las observaciones microscópicas. Manteniendo constante el fotoperiodo (16 h), la temperatura (28 ° C) y la humedad relativa (70 % HR), se probaron distintas soluciones minerales: solución de Hoagland al 100 %, 75 % y 50 % (Hoagland y Arnon, 1950), solución de Hoagland modificada (Epstein, 1972) y medio Vine sin hormonas (Vine, 1968). También se probaron distintos soportes para el medio líquido como guata, telgopor (poliestireno expandido), arena inerte y un medio agarificado (agar 0,6 % p/v), en distintos recipientes (tubos de ensayo, frascos y bandejas), con y sin aireación (pO2= 20 kPa). 43 Capítulo 3 5. 2. Modelo Experimental Para el cultivo de frutilla en condiciones hidropónicas se utilizaron bandejas estériles que contenían solución de Hoagland modificada (Epstein, 1972) estéril con soportes de telgopor, aireación contante (pO2= 20 kPa) y condiciones controladas (fotoperíodo 16 h, 28 º C, 70 % HR), siendo este sistema el más adecuado para el cultivo de hidropónico de frutilla durante períodos largos (alrededor de 2 meses). Se inocularon con A. brasilense REC3::gfp ocho plantas de Fragaria ananassa var. `Camarosa ´ saneadas por cultivo in-vitro y se incluyeron ocho plantas no-inoculadas como control. Las plantas inoculadas y control se mantuvieron en bandejas diferentes. Para las observaciones microscópicas, se tomaron muestras por duplicado a distintos tiempos post-inoculación: 2, 7, 14 y 28 días. 5. 3. Inoculación La inoculación se realizó sumergiendo las raíces de frutilla en una suspensión bacteriana de A. brasilense REC3::gfp (106 UFC ·ml-1) durante 30 min. Al cabo de ese tiempo las plantas retornaron a las bandejas aireadas con solución de Hoagland (Epstein, 1972). 5. 4. Observación por microscopía óptica de fluorescencia Las observaciones por microscopía de fluorescencia se realizaron montando muestras de raíces inoculadas y controles (de 2 a 3 cm de longitud aproximadamente) en portaobjetos para su directa observación utilizando un microscopio de fluorescencia Olympus BX51/U-LH100HG (Olympus, Japón) con filtro U-MWB2 (420-490 nm) que permite la visualización de la cepa transconjugante A. brasilense REC3::gfp. 44 Capítulo 3 RESULTADOS 1. Estudios de la ultraestructura celular de Azospirillum brasilense 1. 1. Observaciones macroscópicas Las dos cepas de Azospirillum en estudio, REC3 y PEC aisladas de raíz estéril y primer estolón de ˋCamarosa´ respectivamente, crecieron en el medio NFb semisólido desarrollando una delgada película blanquecina subsuperficial al cabo de las 48 h de incubación y produciendo el viraje del indicador azul de bromotimol, de verde a azul (Fig. 3). Figura 3. Crecimiento de Azospirillum brasilense REC3 en medio NFb semisólido. Luego de 48 h de incubación a 30 ºC se observa el viraje del indicador, de verde a azul y la formación de una película blanquecina subsuperficial. La película subsuperficial se formó a aproximadamente 1 mm por dejado de la superficie del medio de cultivo donde se establece una condición microaeróbica y la tasa de difusión del oxígeno está en equilibrio con la tasa de respiración de las bacterias. 1. 2. Observaciones microscópicas Las observaciones realizadas en un microscopio óptico de los preparados frescos de REC3 y PEC5 permitieron comprobar la morfología bacilar de las células no agrupadas y que éstas se desplazan con movimientos espiralados, típicos de Azospirillum. La tinción de la pared celular por el método de Gram, mostró que la misma es de color rosa intenso, correspondiendo a bacterias Gram (-). 45 Capítulo 3 1. 3. Microscopía electrónica Se analizaron las características ultraestructurales de Azospirillum cuando éste se presenta como una bacteria de vida libre (Fig. 4 a 6). Las cepas REC3 y PEC5 exhibieron similares características morfológicas. La microscopía electrónica de barrido muestra que Azospirillum brasilense presenta forma de bacilos de 1,5 μ a 2 μ de longitud y 0,5 μ de ancho aproximadamente (Fig. 4). 1,0 µ 1,0 µm Figura 4. Micrografía electrónica de barrido de A. brasilense (x15.000). Nótese que la superficie es lisa y aparentemente no hay conexiones entre las células. En las micrografías electrónicas de transmisión se observa que Azospirillum brasilense exhibe características morfológicas típicas de bacterias Gram (-) (Fig. 5 y 6). Estas presentan un sistema de membranas doble en el que la membrana plasmática está rodeada por una membrana externa y separadas por un área electrolúcida que corresponde al espacio periplásmico. En algunas imágenes es posible visualizar un material de naturaleza fibrilar asociado a la membrana externa que se dispone en forma radial y que correspondería a lipopolisacáridos (estructura lipídica compleja que contiene azúcares poco frecuentes y ácidos grasos) (Fig. 5a). En la Figura 5b se observan en el citoplasma celular estructuras electrolúcidas que corresponderían a gránulos de β-polihidroxibutirato (material de reserva común en algunas células procariotas). 46 Capítulo 3 a. b. Figura 5. Micrografías electrónicas de transmisión de Azospirillum brasilense. a. microfibrillas cortas en forma radial (x82.640). b. las flechas señalan los gránulos de βpolihidroxibutirato (x33.300). También se pudo observar que desde la superficie celular y en un extremo de la bacteria se proyecta un flagelo polar (Fig. 6), necesario para la motilidad y adhesión de la bacteria a la planta hospedera. a. b. c. Figura 6. a. Micrografías electrónicas de transmisión del flagelo polar de A. brasilense. a. (x50.080). b. (x82.640). c. (x140.600). 47 Capítulo 3 1. 4. Microscopía de fluorescencia Los transconjugantes de A. brasilense REC3::gfp positivos fueron fácilmente observados e identificados mediante microscopía de fluorescencia. La cepa A. brasilense REC3::gfp resultante es resistente a Tc15 y expresa la proteína GFP que le otorga fluorescencia verde brillante bajo luz azul mediante el filtro U-MWB2 (420-490 nm) como se muestra en la Fig. 7. a. b. Figura. 7. Micrografía de A. brasilense REC3::gfp tomada mediante (a) microscopía óptica y (b) de fluorescencia utilizando el filtro de luz azul (U-MWB2 420-490 nm). Magnificación 100x. Se determinó que la construcción es genéticamente estable ya que el plásmido se mantuvo dentro de la cepa transformada por más de 25 generaciones con y sin presión de selección (Tc) y durante más de tres años de repiques periódicos en nuestro laboratorio. En la Figura 8 se muestra los resultados del análisis de estabilidad de la construcción A. brasilense REC3::gfp durante 10 generaciones en medio NFb con y sin antibiótico, expresados en porcentaje de UFC ∙ml-1, y determinado por el método de cuantificación de las gotas (drop-count) como se ilustra en la Fig. 9. A pesar que se observó una disminución significativa del porcentaje de UFC∙ml-1 en todas las generaciones cultivadas con Tc15 (p <0,05), el porcentaje de bacterias viables que expresaban la resistencia a Tc, conferida por el plásmido pRU1156-ChsA, fue mayor al 50% en todas las generaciones analizadas indicando la estabilidad de la transconjugante. 48 Capítulo 3 Porcentaje de UFC ∙ml-1 en medio NFb con y sin Tc Medio NFb sin Tc Medio NFb con Tc 120,00 100,00 a a a a a a b b 80,00 b b 60,00 a a a a % UFC ∙ml-1 a a b b b b 40,00 20,00 0,00 N1 N2 N3 N4 N5 N6 N7 N8 N9 N10 Generaciones Figura 8. Porcentaje de Unidades Formadoras de Colonias (UFC ∙ml-1 ) en medio NFb sólido con y son presión de selección (Tc) durante 10 generaciones (N1 a N10) determinado por el método de cuantificación de las gotas. Prueba de diferencias por el test de Tuckey (p <0,05). a b Figura 9. Método de cuantificación de células viables de A. brasilense REC3::gfp. por el método de cuantificación de las gotas. En cada generación se sembró 50 µl de cada dilución (10-4, 10-5, 10-6, 10-7) en medio NFb sólido sin presión de selección (a) y medio NFb sólido con Tc15 (b). Las colonias de Azospirillum presentan la coloración típica del género, rojo escarlata, cuando son cultivadas en presencia del colorante Rojo Congo. 49 Capítulo 3 2. Estudios ultraestructurales de las raíces de plantas desarrolladas en soporte líquido inoculadas con A. brasilense Muestras de raíces de plantas madre inoculadas con Azospirillum brasilense, de raíces de plantas hijas sin inocular y de estolones fueron estudiadas mediante microscopía electrónica de barrido y de transmisión. En las raíces se analizaron las zonas de alargamiento y el ápice de acuerdo al esquema mostrado en la Figura 10. a. b. 100,0 µm Figura 10. a. Representación esquemática de una raíz. b. Micrografía electrónica de barrido de una raíz de frutilla inoculada con A. brasilense (x60). La microscopía electrónica permitió confirmar la existencia de dos procesos diferentes de colonización. En uno de ellos las bacterias se disponen inicialmente de manera perpendicular a la superficie radicular. En una etapa posterior se posicionan de manera horizontal, paralela a la superficie radical, a la vez que un material filamentoso contribuye a un proceso de agregación que finalmente lleva a la formación de una biopelícula (Fig. 11). 50 b. 1,0 µm 1,0 µm e. d. 1,0 µm f. 1,0 µm Figura 11. Proceso de adhesión y formación del biopelícula bacteriana. a. Superficie radicular de frutilla sin inocular (x5.400). b. Azospirillum brasilense en estado de vida libre (x16.000). c. Flagelo polar (x140.600) d. Azospirillum unido a un pelo radicular (x15.000) e. A. brasilense unido a la superficie radicular (x15.000). f. Bacterias unidas a la superficie radicular y recubiertas por material fibrilar (x7.200). e. Biopelícula producida por Azospirillum sobre la superficie de la raíz (x7.200) 1,0 µm a. 1,0 µm c. g. Capítulo 3 51 Capítulo 3 En un segundo mecanismo, algunas bacterias aisladas se adhieren individualmente a la superficie radicular por uno de sus polos y pueden observarse parcialmente incluidas en los tejidos superficiales. En esta modalidad de colonización no se observó la asociación de bacterias entre sí, ni la presencia de material fibrilar que las aglutine (Fig. 12). b . a. 1,0 µm 1,0 µm Figura 12. Micrografías electrónicas de barrido que muestran a Azospirillum en estrecha asociación con los tejidos radiculares. a. y b. Bacterias dispuestas perpendiculamente a la superficie radicular (a. x16.000) y parcialemente incluídas en la pared celular (b. x7.200). Además del material segregado por las bacterias (Fig. 13a), la superficie radicular presentó un material de aspecto granuloglobular (Fig. 13b). Fue en estas áreas donde se observó una mayor concentración de bacterias asociadas. También se visualizaron en algunas raíces zonas con baja densidad de bacterias asociadas (Fig. 14 a), áreas que exhiben la formación de agregados bacterianos (Fig. 14 b) y áreas con biopelículas que tapizan la superficie radicular (Fig. 14 c, d). 52 Capítulo 3 a. b. 1,0 µm 1,0 µm Figura 13. Micrografías electrónicas de barrido de bacterias adheridas a la superficie de la zona de elongación de la raíz. a. material de naturaleza fibrilar sobre las bacterias (x7.200). b. material granuloglobular sobre la superficie radicular (x15.000). b . a . 1,0 μm 1,0 μm c . 1,0 μm d . 10,0 µm Figura 14. Micrografías electrónicas de barrido que muestran los distintos grados de agregación bacteriana. a. bajo (x7.200). b. moderado (x13.000). c. alto (x7.200). d. Nótese la formación de una biopelícula con alta densidad de bacterias (x600). 53 Capítulo 3 La microscopía electrónica de transmisión también mostró la formación de biopelículas sobre las células epidérmicas de la raíz con numerosas bacterias en activa división celular (Fig. 15). a. b. Figura 15. Micrografías electrónicas de transmisión que muestra la biopelícula formada por las bacterias sobre las células epidermicas de la raíz y sobre los pelos absorbentes. a. (x10.950). b. (x10.950). La figura 16 muestra las interacciones que se establecen entre las distintas variedades de frutilla ensayadas con las dos cepas de Azospirillum inoculadas. En las variedades `Camarosa´ y `Milsei´ se observó una mayor densidad de bacterias de la cepa A. brasilense REC3 unidas a la superficie radicular (Fig. 16 b, e) en comparación con la cepa PEC5 (Fig. 16 c, f). A diferencia de éstas dos variedades de frutilla, en la variedad `Selva´ (Fig. 16 g, h, i), se observó cualitativamente mayor número de bacterias de la cepa PEC5 adheridas a la superficie de las raíces (Fig. 16 i). 54 Figura 16. Micrografías electrónicas de barrido que muestran la superficie de raíces var. `Camarosa´, `Milsei´ y `Selva´ sin inocular (control) e inoculadas con las cepas de Azospirillum brasilense REC3 y PEC5. a. `Camarosa´-Control (x2.000). b. `Camarosa´-REC3 (x2.000). c. `Camarosa´-PEC5 (x2.400). d. `Milsei´-Control (x7.200). e. `Milsei´-REC3 (x7.200). f. `Milsei´-PEC5 (x7.200). g. `Selva´-Control (x7.200). h. `Selva´-REC3 (x15.000). i. `Selva´-PEC5 (x15.000). Capítulo 3 55 Capítulo 3 Por otra parte, las observaciones realizadas con bajo aumento permitieron demostrar que en todas las raíces de las plantas inoculadas aumentó el número y la longitud de los pelos radiculares en comparación con las plantas control (Fig. 17). Sin embargo, este fenómeno fue más evidente en las variedades `Camarosa´ (Fig. 17 b) y `Milsei´ (Fig. 17 d) inoculadas con la cepa REC3 y en la var. `Selva´ (Fig. 17 f) cuando se asocia con PEC5. Figura 17. Micrografías electrónicas de barrido de raíces de frutilla var. `Camarosa´, `Milsei´ y `Selva´. a. Camarosa-Control (x200). b. Camarosa-REC3 (x200). c. Milsei -Control (x60). d. MilseiREC3 (x60). e. Selva-Control (x60). f. Selva-PEC5 (x60). Nótese que en las variedades `Camarosa´ y `Milsei´ las raíces inoculadas con la cepa REC3 presentan una mayor densidad de pelos en su superficie, mientras que en la var. `Selva´ presentaron mejores resultados las inoculadas con PEC5. 56 Capítulo 3 La microscopía electrónica de transmisión permitió observar también la presencia de bacterias en los tejidos internos de las raíces de todas las plantas inoculadas. En la Figura 18 b se muestra la variedad de frutilla con mayor número de bacterias asociadas, que corresponde a la var. `Camarosa´ inoculada con la cepa REC3.En las plantas control no se detectó la presencia de bacterias (Fig. 18a). a. b. Figura 18. Micrografías electrónicas de transmisión de los tejidos internos de las raíces. a. `Camarora´-Control (x10.950). b. `Camarosa´-REC3. Nótese la gran densidad de bacterias colonizando el interior de las raíces (x7.000). De manera similar a lo observado cuando Azospirillum se encuentra en estado de vida libre, éste presentó fibrillas cortas y entrelazadas íntimamente asociadas a la membrana externa cuando estaba asociado a los tejidos internos de la raíz (Fig. 19). 57 Capítulo 3 Figura 19. Micrografía electrónica de transmisión de Azospirillum en los tejidos internos de la raíz (x18.700). Nótese la disposición radial de las microfibrillas en la superficie de la bacteria. Por otra parte, las imágenes de microscopía electrónica de transmisión muestran que tanto las bacterias individuales como las asociadas entre sí, exhiben a su alrededor un material filamentoso dispuesto concéntricamente que no está en contacto directo con la membrana celular externa (Fig. 20). a. b. Figura 20. Micrografías electrónicas de transmisión de Azospirillum en los tejidos internos radiculares. a. (x82.640). b. (x18.700). Nótese el material fibrilar dispuesto en forma concéntrica indicado con flechas. 58 Capítulo 3 3. Inoculación de plantas de frutilla con Azospirillum brasilense en soporte sólido: En un análisis macroscópico cualitativo de las plantas de frutilla a los 40 días de ser inoculadas con Azospirillum brasilense se observó que éstas presentaban un mayor desarrollo que las plantas no inoculadas (Fig. 21). b . a. c. Figura 21. Plantas de frutilla a los 40 días de ser inoculadas con A. brasilense. a. Control (no-inoculadas). b. Inoculadas con REC3. c. Inoculadas con PEC5. En la Figura 22 se muestran las plantas de frutilla luego de 6 meses de haber sido inoculadas con ambas cepas de A. brasilense y las plantas control no inoculadas. Estas últimas presentaron menor desarrollo y en algunos casos clorosis, mientras que las plantas inoculadas no mostraron clorosis y su tamaño fue mayor. a . b . c . Figura 22. Plantas de frutilla a los seis meses de ser inoculadas con A. brasilense. a. Control. b. Inoculadas con REC3. c. Inoculadas con PEC5. Nótese que algunas plantas control muestran clorosis (hojas amarillas) mientras que las inoculadas con A. brasilense se presentan sanas. Al cabo de siete meses desde la inoculación, la mayoría de las plantas madres produjeron numerosas plantas hijas, mediante la producción de estolones, de las 59 Capítulo 3 que se tomaron 56 muestras de raíces y estolones. En la Tabla 1 se indican las variedades de frutilla, los tratamientos aplicados y los diferentes tejidos a partir de los cuales se tomaron las muestras para posteriores análisis microbiológicos, ultraestructurales y moleculares. Tabla 1. Variedades de frutilla con los tratamientos aplicados y tejidos a partir de los cuales se tomaron muestras para los ensayos microbiológicos, ultraestructurales y moleculares. Control Cepa REC3 Cepa PEC5 Camarosa Raíz Planta Madre 1º Estolón Raíz 1º Planta Hija 2º Estolón Raíz 2º Planta Hija Milsei Raíz Planta Madre 1º Estolón Raíz 1º Planta Hija 2º Estolón Raíz 2º Planta Hija Raíz Planta Madre 1º Estolón Raíz 1º Planta Hija 2º Estolón Raíz 2º Planta Hija 3º Estolón Raíz 3º Planta Hija 4º Estolón Raíz Planta Madre 1º Estolón Raíz 1º Planta Hija 2º Estolón Raíz 2º Planta Hija Raíz Planta Madre 1º Estolón Raíz 1º Planta Hija 2º Estolón Raíz 2º Planta Hija 3º Estolón Raíz 3º Planta Hija 4º Estolón Raíz Planta Madre 1º Estolón Raíz 1º Planta Hija 2º Estolón Raíz 2º Planta Hija Selva Raíz Planta Madre 1º Estolón Raíz 1º Planta Hija 2º Estolón Raíz 2º Planta Hija 3º Estolón Raíz Planta Madre 1º Estolón Raíz 1º Planta Hija 2º Estolón Raíz 2º Planta Hija 3º Estolón Raíz 3º Planta Hija Raíz Planta Madre 1º Estolón Raíz 1º Planta Hija 2º Estolón Raíz 2º Planta Hija 3º Estolón Raíz 3º Planta Hija 3. 1. Ensayos microbiológicos: Determinación del NMP de A. brasilense en tejidos de plantas de frutilla La cuantificación de bacterias en los distintos tejidos de la planta (raíces y estolones) se realizó con el método del Número Más Probable (NMP), utilizando la tabla de McCrady para tres repeticiones. Finalizado el tiempo de incubación de las muestras sembradas en medio 60 Capítulo 3 NFb semisólido, se observó macroscópicamente el desarrollo característico de Azospirillum en dicho medio, por el viraje del indicador (de verde a azul), y por la formación de una película blanquecina subsuperficial en los viales correspondientes a las diluciones 10-1 a 10-6 (Fig. 23). A los viales con tales características se los consideró positivos para la determinación del número característico de ingreso a la tabla de McCrady. Las observaciones microscópicas realizadas sobre los desarrollos bacterianos de los viales positivos ratificaron la presencia de Azospirillum debido a que se pudo observar su distintiva motilidad, forma y tamaño. 10 -1 10 -2 10 -3 10 -4 10 -5 10 -6 10 -7 10 -8 10 -9 10 -10 Figura 23. Viales conteniendo medio de cultivo NFb semisólido sembrado con diluciones decimales (10-1 a 10-10) de los macerados de raíces para determinar el NMP, al cabo de 48 h de incubación a 30 º C. Tanto el reaislamiento de Azospirillum como la determinación de su NMP fue posible en todas las muestras de raíces provenientes de las plantas madre inoculadas, de las plantas hijas sin inocular y de sus estolones. En todos los casos se pudo observar que los valores obtenidos a partir de raíces fueron mayores que los de estolones, observando en algunos casos diferencias del orden de 100.000 bacterias. En las plantas sin inocular (control) de las tres variedades no se detectó la presencia de bacterias. En la Tabla 2 se presentan los resultados de la cuantificación de bacterias por el método del NMP en las tres variedades de frutilla estudiadas. 61 Tabla 2. Número Más Probable de Azospirillum en raíces y estolones de las variedades `Camarosa´, `Milsei´ `Selva´. La prueba de diferencia se realizó aplicando el Test de Tuckey (p <0,05). n.d.: no detectado Capítulo 3 62 Capítulo 3 Para la var. `Camarosa´, el valor máximo de bacterias por gramo de tejido vegetal fresco se encontró en las raíces de la planta madre inoculada con la cepa REC3 (1,6 x 105), mientras que el tercer estolón proveniente de plantas tratadas con la misma cepa presentó un valor mínimo de 7,5 x 101. Por otro lado, pudo observarse una respuesta marcadamente diferente para las plantas inoculadas con las cepas REC3 y PEC5, siendo mejor con la cepa REC3: mayor título, mayor número de plantas hijas (hasta una tercera hija) y más estolones (hasta un cuarto estolón). De manera similar, las plantas de la var. `Milsei´ tratadas con REC3 produjeron mayor cantidad de estolones, mayor número de plantas hijas y títulos bacterianos más altos que aquellas inoculadas con PEC5. El máximo valor de microorganismos por gramo de tejido vegetal encontrado fue 9,5 x 105 en las raíces de la segunda planta hija cuya madre fue inoculada con REC3, mientras que la menor concentración de bacterias (1,1 x 101), se pudo observar en el primer estolón de las plantas tratadas con la cepa PEC5. En el caso de las plantas de frutilla de la variedad `Selva´, el máximo valor obtenido en la cuantificación fue de 1,5 x 106 bacterias por gramo de raíz que corresponde a las raíces de la tercera planta hija tratada con la cepa de Azospirillum brasilense PEC5. El mínimo, de 2,5 x 101 bacterias por gramo de estolón, se obtuvo en el primer estolón de las plantas tratadas con la cepa REC3. Las plantas de ésta variedad tratadas con las cepas PEC5 y REC3 dieron igual número de plantas hijas y estolones, pero las concentraciones de microorganismos fueron mayores en las raíces y estolones de las plantas tratadas con PEC5. A diferencia de lo observado en las otras dos variedades, la variedad `Selva´ presentó mayor afinidad por la cepa A. brasilense PEC5. Asimismo, en los estolones de esta variedad se pudo constatar una tendencia creciente en la concentración de bacterias desde el primer al último estolón: 63 Capítulo 3 Estolones provenientes de plantas inoculadas con REC3: 1º Estolón (2,5 x 101); 2º Estolón (9,5 x 101); 3º Estolón (1,5 x 102). Estolones provenientes de plantas inoculados con PEC5: 1º Estolón (4,5 x 102); 2º Estolón (4,5 x 103); 3º Estolón (4,5 x 104). 3. 2. Estudios ultraestructurales de raíces y estolones de plantas desarrolladas en soporte sólido inoculadas con A. brasilense La colonización de Azospirillum brasilense desde la planta madre a sus hijas a través de los estolones se confirmó mediante microscopía electrónica de transmisión y barrido. Se observó la presencia de bacterias en los tejidos radiculares internos de las plantas madres inoculadas y de sus plantas hijas sin inocular (Figura 24). a. c. b. d. Figura 24. Micrografías electrónicas de raíces de plantas de la var. `Camarosa´ desarrolladas en soporte sólido. a. Planta madre inoculada con la cepa REC3 (x7.500). b. Primera planta hija (x33.300). c. Segunda planta hija (33.300). d. Tercera planta hija (x18.700). Nótese la presencia de bacterias en la primera, segunda y tercera planta hija no inoculada. 64 Capítulo 3 La microscopía electrónica de barrido permitió la visualización de bacterias individuales y agrupadas en la zona de los haces vasculares de los estolones (Fig. 25). Cuando se encuentran agrupadas (Fig. 25 b) las bacterias están inmersas en un material a la manera de una cápsula. Esta imagen se corresponde con lo observado a nivel de microscopía electrónica de transmisión en la Figura 25 c. b. a. c. d. Figura 25. a. Micrografías electrónicas de barrido que muestran a Azospirillum brasilense colonizando el interior del estolón. b. detalle a mayor aumento. c. Micrografía electrónica de transmisión de bacterias inmersas en una matriz formada por un material dispuesto concéntricamente (X18.700). d. Micrografía de barrido con falso color donde las bacterias están representadas en color rosa intenso y los tejidos internos del estolón se encuentran en color verde. 65 Capítulo 3 Conforme a lo anterior, se determinó que las bacterias encapsuladas observadas en el interior del estolón poseían características ultraestructurales similares a las colonias puras de Azospirillum brasilense cultivadas en NFb sólido (Fig. 26), reafirmando su identidad. Figura 26. Micrografía electrónica de barrido de una colonia pura de Azospirillum brasilense cultivada en medio NFb sólido. a. A. brasilense PEC5; b. Magnificación de (a) que muestra a las bacterias agrupadas y envueltas por un material fibrilar formando una cápsula. 3. 3. Estudios Moleculares. Determinación del gen nifD. En la Figura 24 se muestran los productos de la amplificación por PCR de un fragmento del gen nifD a partir de ADN extraído de raíces (Fig. 27 a) y estolones (Fig. 26 b) de frutilla. Además se incluyó al control positivo que correspondía a la amplificación a partir de ADN de la cepa de referencia A. brasilense Sp7 (Fig. 27 a, calle 12). En todos los casos de plantas inoculadas con Azospirillum se observó la presencia de una banda específica de 710 bp. En la misma figura, también se observa la falta de producto amplificado de nifD en los casos de plantas no inoculadas. 66 Capítulo 3 a. M 1 2 3 4 5 6 7 8 9 10 11 12 1,000 bp 700 bp 500 bp b. 710 bp M 1 2 1,000 bp 700 bp 500 bp 3 4 5 6 7 710 bp Figura 27. a. Productos de la amplificación del gen nifD a partir del ADN extraído de raíces de frutilla. Calles: 1. Planta Madre `Camarosa´-REC3; 2. Primera Hija `Camarosa´-REC3; 3. `Camarosa´-Control; 4. Planta Madre `Milsei´-REC3; 5. Primera Hija `Milsei´-REC3; 6. Primera Hija `Milsei´-PEC5; 7. `Milsei´-Control; 8. Planta Madre `Selva´-PEC5; 9. Primera Hija `Selva´-PEC5; 10. Segunda Hija `Selva´-PEC5; 11. `Selva´-Control; 12. Control Positivo Azospirillum brasilense Sp7; M. Marcador de Peso Molecular (DirecLoad Wide Range DNA Marker 50_10.000 bp Sigma). b. Productos de amplificación del gen nifD a partir de ADN extraído de estolones de frutilla. Calles: 1. Primer Estolón `Camarosa´-REC3; 2. Estolón `Camarosa´-Control; 3. Primer Estolón `Milsei´-REC3; 4. Estolón `Milsei´-Control; 5. Primer Estolón `Selva´-REC3; 6. Estolón `Selva´-Control; 7. Control Positivo Azospirillum brasilense Sp7; M. Marcador de Peso Molecular (DirecLoad Wide Range DNA Marker 50_10.000 bp - Sigma). 3. 4. Amplificación del gen 16S ADNr, ARDRA y secuenciación automática Los productos de amplificación del gen 16S ADNr de las cepas de A. brasilense REC3, PEC5 y Sp7, y de los re-aislamientos de plantas madres e hijas colonizadas por Azospirillum, mostraron un banda específica de 1450 bp (Fig. 28 a). Los perfiles de restricción del ADNr 16S obtenidos por digestión con la endonucleassa AluI de los controles positivos (REC3, PEC5 y Sp7) y de las bacterias reaisladas de los distintos tejidos de frutilla fueron idénticos (Fig. 28 b). Estos resultados confirman que los reaislamientos también correspondían a la especie Azospirillum brasilense (identidad nivel de especie). 67 Capítulo 3 a. M 1 2 3 4 5 6 7 8 9 10 11 2,000 bp 1,500 bp 1,450 bp 1,000 bp b. 3,000 bp M 1 2 3 4 5 6 7 8 9 10 11 2,000 bp 1,000 bp 500 bp 100 bp Figura 28. a. Productos de amplificación del gen 16S ADNr. Calles 1 a 3 corresponden a controles positivos: 1. A. brasilense REC3; 2. A. brasilense PEC5; 3. A. brasilense Sp7; Calles 4 a 11 corresponden a cepas re-aisladas de raíces y estolones de frutilla: 4. Raíz planta madre `Camarosa´-REC3; 5. Raíz 1era hija `Milsei´-REC3; 6. 1er estolón `Camarosa´REC3; 7. Raíz planta madre `Milsei´- REC3; 8. Raíz 1era hija `Milsei´-PEC5; 9. 1er estolón `Milsei´-REC3; 10. Raíz 2da hija `Selva´-PEC5; 11. 1er estolón `Selva´-PEC5; M. Marcador de peso molecular (100 bp DNA Ladder; Genbiotech). b. Perfiles de ARDRA. Digestión enzimática con Alu1 del producto de amplificación del ADNr 16S. Calles 1 a 11 y M: como se indicó anteriormente. Adicionalmente, el análisis de las secuencias parciales del 16S ADNr (500 bp) confirmó que los re-aislamientos secuenciados pertenecían a Azospirillum brasilense con un porcentaje de similitud ≥99 %. 4. Estudios de colonización por microscopía de fluorescencia Se estudió la colonización radicular de A. brasilense en raíces de plantas de frutilla utilizando la cepa transgénica A. brasilense REC3::gfp. La utilización de esta cepa permitió monitorear la colonización de A. brasilense durante 28 días debido a su estabilidad y fácil identificación, ya que la expresión de la proteína GFP le otorga fluorescencia verde brillante cuando es excitada con luz azul mediante el filtro UMWB2 (420-490 nm). La figura 29 muestra plantas control e inoculadas con la cepa 68 Capítulo 3 transconjugante a los 2, 7, 14 y 28 días post-inoculación (dpi). Se observaron bacterias no agrupadas adheridas a la superficie radicular a partir de los 2 dpi, localizadas principalmente en los espacios intercelulares que constituyen zonas ricas en nutrientes. En tiempos mayores se observó un incremento en el número de bacterias sobre la superficie radicular alcanzando un máximo a los 28 dpi. Figura. 29. Micrografías de raíces de plantas de frutilla var. `Camarosa´ controles e inoculadas con la cepa transconjugante A. brasilense REC3::gfp tomadas mediante microscopía de fluorescencia (U-MWB2, 420-490 nm) a los 2, 7, 14 y 28 días post-inoculación (dpi). Nótese un incremento en la densidad de células bacterianas asociadas a la superficie radicular a medida que transcurre el tiempo post-inoculación alcanzando un máximo en los 28 dpi. 69 Capítulo 3 DISCUSIÓN En forma paralela a la determinación del NMP de bacterias, también se pudo reaislar Azospirillum de raíces de las plantas madre (inoculadas), raíces de plantas hijas (no inoculadas) y de los estolones de las tres variedades de frutilla analizadas; la presencia de Azospirillum en los dos últimos tejidos confirmaría que éste es capaz de colonizar distintas plantas de frutilla a través de los estolones. La cuantificación reveló una gran diferencia entre la cantidad de bacterias presentes en las raíces y los estolones, demostrando que las raíces constituyen un nicho ecológico más favorable para el desarrollo de las mismas debido a que es una región rica en nutrientes y que proporciona las condiciones microaeróbicas adecuadas para llevar a cabo la fijación de nitrógeno (Baldani et al. 1986). De acuerdo a los resultados obtenidos en el presente trabajo, Azospirillum tendría una preferencia natural en colonizar las raíces de las plantas de frutilla, mientras que utilizaría a los estolones como una vía de paso en su camino a las nuevas plantas hijas. En general, se encontraron títulos bacterianos altos tanto en las raíces de las plantas tratadas con la cepa REC3 como en las inoculadas con la cepa PEC5, respecto de los valores determinados para estolones, lo que corrobora la preferencia rizosférica de Azospirillum, según lo informado en trabajos anteriores (Umali-García et al., 1980; Gafni et al., 1986; Bashan y Levanony, 1987; Okon y Vanderleyden, 1997). Sin embargo, las tres variedades de frutilla interaccionaron desigualmente con cada una de las cepas, lo que demuestra que el éxito de una mejor colonización depende de la interacción entre genotipos específicos de la bacteria y de la planta. La var. `Camarosa´ mostró una mayor afinidad por la cepa REC3 lo cual se manifestó por el mayor número de bacterias aisladas por gramo de tejido vegetal. En el mismo tiempo, las plantas inoculadas con esta cepa, produjeron un mayor número de estolones y plantas hijas, lo que indicaría que esta variedad presenta una mejor respuesta 70 Capítulo 3 a la inoculación con la cepa homóloga REC3 de A. brasilense. Un comportamiento parecido al de `Camarosa´ se observó entre la var. `Milsei´ y REC3, reflejado en una mayor producción de estolones, mayor número de plantas hijas y títulos más altos que aquellas inoculadas con PEC5. Y contrariamente, las plantas de frutilla de la variedad `Selva´ tendrían mayor afinidad por la cepa homóloga de A. brasilense PEC5, en donde se observaron títulos más altos que con REC3. Sin embargo, se constató que en las tres variedades, tanto las plantas inoculadas con Azospirillum como en las plantas control, el número de estolones producidos, y consecuentemente, el número de plantas hijas fue similar, de manera que estas características serían propias de las plantas y no estarían asociadas a su interacción con Azospirillum. Por otro lado, el hecho de haber observado una tendencia creciente del título de Azospirillum entre el primer y último estolón en la var. `Selva´, indicaría que la colonización ocurre más fácilmente en el tejido en desarrollo con un activo metabolismo, en donde la colonización bacteriana acompañaría al crecimiento del estolón. Esto podría apoyarse en el hecho de que los tejidos radiculares en activo desarrollo son los lugares de preferencia asociativa de Azospirillum, según lo informado en otros trabajos (Bashan et al., 1986; Bilal et al., 1993; Vande-Broek et al., 1993; Vanbleu y Vanderleyden, 2003). Además esta observación estaría de acuerdo con Sturz et al. (1999), quienes informaron que las bacterias endófitas no son sólo huéspedespecíficas, sino que también serían sensibles del tejido vegetal a colonizar. No obstante, el hecho de observar una menor cantidad de Azospirillum en los primeros estolones, respecto a los últimos, también podría deberse a que éstos eran de mayor edad y lignificación, con actividad metabólica menor, constituyendo de este modo un nicho ecológico menos apto para el desarrollo de Azospirillum. Una consideración similar podría hacerse sobre los valores de NMP determinados entre las 71 Capítulo 3 plantas madres inoculadas con Azospirillum (con NMP menor), respecto de las plantas hijas (con NMP mayor). Los estudios ultraestructurales con MEB y MET permitieron evidenciar en raíces y estolones de plantas de frutilla la colonización rizosférica y endofítica de A. brasilense. Además, la microscopía de fluorescencia permitió la observación de la cepa transconjugante A. brasilense REC3::gfp viva y fisiológicamente activa, de manera tal que permitió monitorear la colonización de las raíces de frutilla desde los 2 hasta los 28 días post-inoculación. En éste trabajo se observaron dos aspectos que deben considerarse en el proceso de interacción bacteria-planta. El primero es el modo de adhesión de las bacterias a la superficie de la planta y el segundo es el modo de colonización que emplean las bacterias para asociarse con los tejidos de la planta. Analizando morfológicamente el modo de adhesión de Azospirillum, este presentó un modelo unicelular de adhesión a la superficie radicular, en el que participan bacterias individuales y aisladas y un modelo pluricelular donde Azospirillum se dispone formando agregados bacterianos. Estos modelos son similares a los descritos previamente por Bashan y Levanony (1989). Los agregados bacterianos pueden ser el resultado de una activa división celular o producto de la confluencia de bacterias hacia un determinado sitio de la raíz, probablemente debido a la quimiotaxis positiva que presenta Azospirillum brasilense hacia los exudados de las plantas (Barak et al., 1983; Vande Broek y Vanderleyden, 1995). El material de naturaleza fibrilar observado tanto con MEB como con MET sobre la superficie celular de las bacterias en estudio, cumpliría un papel importante en la adhesión de las mismas a las raíces, permitiendo el anclaje y estableciendo conexiones entre ellas para conformar los denominados agregados bacterianos, de 72 Capítulo 3 acuerdo a lo informado en otros estudios (Bashan, 1986; Levanony y Bashan, 1991). El material fibrilar de referencia estaría formado por polisacáridos extracelulares (Michielis et al., 1990; Burdman et al., 2000a, b), como así también por proteínas de la membrana externa de la bacteria (Burdman et al., 1999). En los procesos de adhesión de las bacterias a las plantas también estarían implicadas lectinas específicas que participarían en los procesos de reconocimiento bacteria-planta y también los exudados producidos y secretados por la propia planta (Zhulim y Armitage, 1993; Vande-Broek et al., 2000). El material granuloglobular que se observó en la superficie de los tejidos vegetales correspondería a dichos exudados vegetales y/o rizodeposiciones. Los cúmulos de bacterias asociadas a la raíz, en muchos casos, pueden desarrollar agregados celulares diferenciados y especializados, llamados también `fase a base de enjambres´ donde todas las células se mueven coordinadamente, lo que revela la naturaleza dinámica de las biopelículas. Adicionalmente, la formación de biopelículas facilitaría la colonización, ya que protegen a las bacterias benéficas de las respuestas de defensa de las plantas (Danhorn y Fuqua, 2007). Uno de los procesos de colonización de Azospirillum observados en nuestros estudios ultraestructurales coincide con el mecanismo bifásico descrito por Steenhoudt y Vanderleyden (2000). El otro mecanismo observado, en el que las bacterias ingresarían de manera individual hacia los tejidos internos de la raíz, hasta el presente no ha sido descrito en la literatura. Nuestros resultados mostraron que las células bacterianas se encontraron adheridas mayoritariamente a la superficie radicular y en menor proporción sobre los pelos radiculares, como lo proponen Bashan y Levanony (1989). La disposición horizontal de las bacterias brindaría una mayor superficie de contacto entre éstas y la planta. 73 Capítulo 3 La microscopía electrónica de transmisión permitió observar a las bacterias dentro de las células vegetales, en tanto que Levanony y Bashan (1991) sólo demostraron que ocupan los espacios intercelulares del cortex de las raíces de trigo. Para explicar este suceso hay que recordar que en este trabajo todas las observaciones se realizaron en la zona de alargamiento y el ápice de la raíz, que son zonas en desarrollo con una activa división celular; probablemente esto permite a la bacteria colonizar fácil y masivamente el citoplasma vegetal. El que las células bacterianas esten presentes dentro de las células vegetales, indicaría que las mismas han sido capaces de atravesar la barrera impuesta por la pared celular por un mecanismo que hasta el presente no hemos podido dilucidar. Las microfibrillas capsulares con una disposición concéntrica que muestran las micrografías electrónicas de transmisión alrededor de un grupo de bacterias, sólo se presentan cuando las mismas están asociadas endofíticamente a la planta. Esta pseudocápsula crearía un ambiente adecuado para que las bacterias fijen nitrógeno, pues la expresión de los genes nif, que codifican para la enzima nitrogenasa, está estrictamente regulada por concentraciones de oxígeno y amonio intracelular (Elmerich, 1997, Zhang et al., 1993). Las estructuras capsulares sobre las bacterias se han observado principalmente cuando éstas colonizan el interior de los estolones, lo que indicaría que Azospirillum ha desarrollado estrategias especiales para protegerse de concentraciones elevadas de oxígeno, como así también de las condiciones de estrés sufridas por la limitación de nutrientes. Por lo tanto, esto demuestra que los estolones no constituyen el mejor hábitat para la bacteria. En todos los casos analizados, la inoculación aumentó el número, la densidad y la longitud de los pelos radiculares. Este fenómeno fue observado previamente en cereales y otras plantas gramíneas por otros autores (Umali-Garcia et 74 Capítulo 3 al., 1980; Jain y Patriquin, 1984; Bashan y Levanony, 1989). Kapulnik et al. (1985 a, b) han propuesto que estos cambios mejoran la absorción de minerales y de agua en las plantas inoculadas con Azospirillum. Las variedades de frutilla estudiadas presentaron diferentes afinidades por las dos cepas de A. brasilense. Las variedades `Camarosa´ y `Milsei´ presentaron una mejor interacción cuando fueron inoculadas con la cepa REC3, lo que se manifestó en un mayor desarrollo de los pelos radiculares, una mayor densidad de células adheridas a la superficie radicular y un importante número de bacterias endofíticas asociadas a los tejidos internos y superficiales. Por otra parte, la variedad `Selva´ presentó una mayor afinidad por la cepa bacteriana PEC5, que se manifestó de manera similar: una mayor proliferación de pelos radiculares y una alta densidad bacteriana colonizando superficial y endofíticamente las raíces. Estas observaciones mostraron un paralelismo con los resultados obtenidos en la cuantificación de bacterias por métodos microbiológicos. La diversidad de respuestas que presenta la inoculación de cada variedad de frutilla con distintas cepas bacterianas indica que existe una fuerte interacción entre los genomas bacterianos y vegetales y esta interacción es la que determina la respuesta de la planta a la inoculación. Por tal motivo, la especificad entre los genomas es un aspecto importante que deberá tenerse en cuenta para la selección de cepas que se utilizarán como biofertilizantes. La cepa transconjugante A. brasilense REC3::gfp presentó gran estabilidad en medios de cultivos con y sin presión de selección durante numerosas generaciones. Esto se debería a la expresión de los genes parADCDE responsables de la segregación de éstos plásmidos durante la división celular (Karunakaran et al., 2005). Teniendo en consideración que la transformación de Azospirillum no es una tarea fácil (Steenhoudt y Vanderleyden, 2000) se debe destacar la exitosa obtención de la cepa transconjugante 75 Capítulo 3 A. brasilense REC3::gfp que expresa constitutivamente los genes gfpmut3.1 y gusA ya que se encuentran corriente debajo del promotor ChsA de A. brasilense Sp7. En trabajos previos realizados en nuestro laboratorio por Tortora et al. (2012), fue posible obtener una cepa de Azospirillum transconjugante a partir de una mutante de A. brasilense REC3 resistente a rifampicina (Rf), la que fue transformada con el plásmido pHRGFPTC que contenía el gen gfpmut3 bajo el control del promotor constitutivo pgen de E. coli (Ramos et al., 2002). Sin embargo, la construcción obtenida mediante la transformación de A. brasilense con éste plásmido no fue estable: ésta transconjugante perdía la expresión del plásmido durante sucesivos repiques (aproximadamente 3) en medio de cultivo con presión de selección y no permitía el monitoreo de la colonización por tiempos mayores a 20 días debido a la pérdida de fluorescencia por la falta de expresión de la proteína GFP. Por lo anteriormente expuesto, la utilización de la cepa A. brasilense REC3::gfp, obtenida en este estudio, sería apropiada para realizar estudios ecológicos, como el seguimiento de la colonización bacteriana en diferentes tejidos vegetales y en distintos cultivos durante períodos más prolongados de tiempo, debido a su gran estabilidad y sus altos niveles de expresión. El monitoreo de la colonización en raíces de frutilla con A. brasilense REC3::gfp mostró una mayor colonización de la superficie radicular a los 28 dpi donde se observó una mayor densidad de células adheridas a las raíces. Estas observaciones confirmaron los resultados obtenidos mediante microscopía electrónica de barrido. La presencia endofítica de Azospirillum en el interior de las plantas madres inoculadas con la bacteria, en sus plantas hijas no inoculadas y en sus estolones, se ratificó mediante la amplificación por PCR de los genes nifD (nitrogenasa) y la amplificación, digestión y secuenciación del gen 16S ADNr. La utilización de estos métodos moleculares confirmaron la naturaleza endofítica de las cepas de A. brasilense 76 Capítulo 3 REC3 y PEC5 demostrado anteriormente sólo mediante técnicas microbiológicas por Pedraza et al. (2007). Mientras que la detección por PCR del gen nifD a partir de ADN de tejidos vegetales indicó la presencia de bacterias diazotróficas en raíces y estolones de plantas madres inoculadas e hijas no-inoculadas, la confirmación de la identidad de esos aislamientos se realizó mediante ARDRA y secuenciación del ADN. Los perfiles de ARDRA indicaron que éstos correspondían a la especie Azospirillum brasilense y el análisis de secuencias del 16S ADNr confirmaron su pertenencia a esta especie (similitud ≥99 %). En nuestros ensayos microbiológicos se pudo determinar el NMP de Azospirillum a partir de 22 muestras de raíces y 18 muestras de estolones colonizados por las cepas REC3 y PEC5. Pero sólo fue posible amplificar por PCR el fragmento de 710 bp del gen nifD a partir del ADN extraído de 11 muestras (8 de raíces y 3 de estolones). Esto podría deberse a que las muestras de ADN fueron extraídas de material vegetal en el cual es común la presencia de aceites vegetales, polisacáridos, polifenoles y otros metabolitos secundarios que pueden unirse a los ácidos nucleicos formando complejos que obstaculizan o inhiben la reacción de amplificación llevada a cabo por la Taq polimerasa (Guillemaut y Maréchal-Drouard, 1992). En el presente trabajo sólo se detectó la presencia del gen nifD dentro de las raíces y estolones de frutilla, pero otros investigadores probaron también la expresión de los genes nif de Azoarcus BH72 dentro de las raíces de arroz indicando que la bacteria es metabólicamente activa dentro de los tejidos de la planta (Miché et al., 2006). 77 Capítulo 3 CONCLUSIONES Las cepas REC3 y PEC5 de Azospirillum brasilense utilizadas en este estudio colonizan rizosférica y endofíticamente las raíces de las plantas de frutilla de las variedades `Camarosa´, `Milsei´ y `Selva´. Las cepas REC3 y PEC5 de A. brasilense colonizan endofíticamente los estolones de las plantas de frutilla y se traslocan a través de ellos desde la planta madre inoculada a las plantas hijas no inoculadas. Según los valores del NMP, las raíces de las plantas de frutilla constituyen el mejor hábitat para la instalación y proliferación de las cepas de A. brasilense estudiadas, mientras que los estolones son utilizados sólo como una vía de paso en su camino a las plantas hijas. De acuerdo con los estudios microbiológicos y ultraestructurales, las variedades de frutilla `Camarosa´, `Milsei´ y `Selva´ presentan diferentes afinidades por las cepas REC3 y PEC5. Los estudios ultraestructurales permitieron establecer que Azospirillum coloniza las raíces mediante dos mecanismos diferentes: un proceso bifásico en el que las bacterias se adhieren a la superficie radicular y luego forman biopelículas sobre las mismas y un segundo proceso en el que las bacterias individuales penetran los tejidos radiculares. La inoculación de las plantas de frutilla con A. brasilense aumenta la proliferación de los pelos radiculares. La cepa transconjugante A. brasilense REC3::gfp obtenida presentó altos niveles de expresión del gen gfp y gran estabilidad en medios de cultivos con y sin presión de selección durante numerosas generaciones. 78 Capítulo 3 La utilización de la cepa A. brasilense REC3::gfp permitió el seguimiento de la colonización radicular de plantas de frutilla durante al menos 28 días postinoculación. La amplificación del gen nifD a partir de ADN extraído de raíces y estolones de plantas de frutilla colonizadas por A. brasilense, confirmó la naturaleza endofítica de las cepas utilizadas y evidenciaron su presencia en los tejidos analizados. Los perfiles de ARDRA permitieron la identificación de los reaislamientos bacterianos como Azospirillum brasilense y el análisis de secuencias del 16S ADNr confirmaron su pertenencia a dicha especie. 79 Capítulo 4 Capítulo 4 80 Capítulo 4 Análisis de la composición elemental de plantas de frutilla inoculadas con A. brasilense REC3 mediante microscopía electrónica de barrido acoplada al análisis de dispersión de rayos X y su efecto en la promoción del crecimiento INTRODUCCIÓN 1. Microscopía electrónica de barrido acoplada a la espectroscopia de energía dispersiva de rayos-X (MEB-EDS) La microscopía electrónica de barrido (MEB) acoplada a la espectroscopia de energía dispersiva de rayos-X (EDS) es un potente método basado en el análisis de la dispersión de rayos-X producida por cada elemento contenido en una muestra que puede producir información cualitativa y cuantitativa de los elementos presentes en ella. Por lo tanto, además de la observación microscópica, permite la comparación y caracterización de diferentes materiales (Goldstein et al., 2003). Los fotones de rayos-X que salen del espécimen bajo análisis tienen energías específicas de los elementos presentes en la muestra; estos son los rayos-X característicos que proporcionan las capacidades analíticas del SEM-EDS (Goldstein et al., 2003). Convencionalmente el estudio de la nutrición de las plantas se lleva a cabo por métodos que requieren extracciones químicas, homogeneización y disolución de los componentes vegetales para cuantificar un único elemento a la vez, por ejemplo, el contenido total de N o de C orgánico que suelen ser determinado por los métodos de Kjeldahl (Bremner y Mulvaney, 1982) y Walkey-Black (Nelson y Sommers, 1982), respectivamente. Incluso, existen métodos que permiten la cuantificación de varios elementos a la vez, como la espectrometría de masa inductivamente acoplada a plasma (Esitken et al., 2010) y la espectroscopia de absorción atómica (Rojas- Tapias et al., 2012); 81 Capítulo 4 sin embargo, las muestras necesitan de todas formas ser sometidas a incineración, extracción húmeda y otros procedimientos de digestión, que no facilitan la metodología. La técnica de MEB-EDS requiere una pequeña muestra sólida, es relativamente rápida, no destructiva y permite la determinación de los diferentes elementos químicos simultáneamente (Szynkowska et al., 2011). Esta técnica se utilizó en los tejidos vegetales principalmente para estudiar la bioacumulación, biodegradación, la inmovilización del metal y la biodisponibilidad (Küpper et al., 2000; Rivera-Becerril et al., 2002; Chen et al., 2007). La bibliografía disponible sobre el uso de microanálisis MEB-EDS para el estudio de la nutrición vegetal es escasa. Sin embargo, éste método se ha utilizado con éxito para examinar la composición química de plantas de arándanos, pepino y medicinales (Samuels et al., 1991; Morikawa y Saigusa, 2004; Muruganantham et al., 2009). También existe un trabajo previo que utiliza MEB-EDS en plantas de trigo y soja inoculadas con diferentes cepas de Azospirillum (Bashan et al., 1990), pero hasta el momento no se realizó este microanálisis para el estudio de la interacción frutilla- Azospirillum, asociado al efecto promotor del crecimiento vegetal. 2. Objetivo del capítulo El objetivo del presente capítulo fue analizar la composición elemental de plantas de frutilla inoculadas y no-inoculados con A. brasilense REC3 mediante la técnica de microscopía electrónica de barrido acoplada al análisis de la energía dispersiva de rayos-X (SEM-EDS); a fin de evaluar la contribución de A. brasilense a la nutrición mineral de las plantas de frutilla y su efecto en la promoción del crecimiento. 82 Capítulo 4 MATERIALES Y MÉTODOS 1. Material vegetal y condiciones de cultivo Se utilizaron plantas de frutilla (Fragaria ananassa) variedad `Macarena´ saneadas por cultivos in vitro cultivadas en macetas con sustrato sólido estéril (humus: perlome, 2:1) y condiciones controladas en fitotrón (28 º C, humedad relativa 70 %, fotoperíodo de 16 h a 250 µmol fotones m2 s−1) durante 2 meses. Luego de este tiempo las plantas fueron cuidadosamente removidas de sus macetas, se lavaron las raíces con agua destilada estéril para remover las partículas de suelo adheridas a las raíces y se transplantaron a bandejas desinfectadas y aireadas (pO2 = 20 kPa) que contenían solución de Hoagland optimizada (Epstein, 1972) al 100 % o 50 %, correspondientes a un medio hidropónico con concentraciones de nutrientes óptimas o limitantes, respectivamente. La solución de Hoagland optimizada (Epstein, 1972) fue la siguiente: 6 mM KNO3; 4 mM Ca(NO3)2·4H2O; 2 mM NH4H2PO4; 1 mM MgSO4·7H2O; 50 µM KCl; 25 µM H3BO3; 2 µM MnSO4·H2O; 2 µM ZnSO4·7H2O; 0.5 µM CuSO4·5H2O; 0.5 µM Na2MoO4; 26 µM FeEDTA. Durante todo el ensayo el volumen del medio hidropónico fue medido periódicamente y se mantuvo constante añadiendo agua destilada para conservar la concentración de nutrientes de acuerdo a los parámetros descriptos. 2. Microorganismos e inoculación Al cabo de 10 días posteriores al trasplante al medio hidropónico (tiempo requerido para la adaptación de las plantas al nuevo ambiente), 10 plantas fueron inoculadas sumergiendo las raíces 20 min en una suspensión de Azospirillum brasilense 83 Capítulo 4 REC3 (aproximadamente 106 UFC ∙ml-1) mientras que las raíces de otras 10 plantas control se sumergieron en agua destilada estéril. 3. Diseño experimental El experimento consistió de 4 tratamientos con 5 plantas por tratamiento que fueron colocadas en diferentes bandejas: i- Control- 100 % Hoagland; ii- REC3- 100 % Hoagland; iii- Control- 50 % Hoagland; iv- REC3- 50 % (Fig. 30). El ensayo concluyó luego de 10 días posteriores a la inoculación. Figura 30. Plantas de frutilla cv. `Macarena´ en bandejas aireadas con medio hidropónico. Los diferentes tratamientos aplicados fueron: i- Control- 100 % Hoagland; ii- A.brasilense REC3- 100 % Hoagland; iii- Control- 50 % Hoagland; iv- A. brasilense REC3- 50 % 4. Determinación de peso seco Cumplido el tiempo del cultivo hidropónico las plantas fueron cosechadas, se separaron hojas de raíces, se secaron en horno a 65 º C durante 72 h (hasta peso constante) y se determinó el peso seco de cada tejido. Se determinó la biomasa total como la suma del peso seco de hojas y raíces, y el índice de crecimiento fue calculado de acuerdo a la siguiente fórmula: ( ) 84 Capítulo 4 5. Microscopía electrónica de barrido acoplada a energía dispersiva de rayos-X Se tomaron pequeñas muestras frescas de raíces y hojas jóvenes que fueron fijadas en glutaraldehído 3 % (v/v) para su análisis por MEB-EDS de acuerdo a lo descrito en el capítulo 3. Las micrografías de barrido y los espectros de EDS fueron obtenidos con un microscopio electrónico ZEISS SUPRA 55VP (Carl Zeiss Co., Germany) equipado con un espectrómetro de energía dispersiva de rayos-X OXFORD (INCA, EEUU). La energía utilizada para incidir la muestra fue de 20 keV. Los valores de la composición química elemental determinados en este ensayo corresponden al promedio de tres repeticiones de espectros para cada tejido y cada tratamiento. Cabe aclarar que ésta es una determinación relativa y la cantidad de cada elemento corresponde a un porcentaje relativo a los otros elementos detectados en la muestra (expresado como % del Peso); consecuentemente, la suma de todos los elementos es igual a 100 %. 6. Análisis estadístico El análisis estadístico de los datos (ANOVA) se llevó a cabo con el software Infostat (ver. 2008 para Windows) y las diferencias significativas se determinaron con un valor de p<0,05 utilizando el test de diferencias múltiples de Tukey. Los datos se expresaron como la media ± desviación estándar. 85 Capítulo 4 RESULTADOS 1. Promoción del crecimiento El valor promedio del peso seco de las raíces de las plantas cultivadas en Hoagland 50 % e inoculadas con A. brasilense REC3 fue mayor que los otros tratamientos (Fig. 31 a; p<0,05). Los valores de peso seco de hojas (Fig. 31 b) fueron 4 veces (75 %) mayores que los valores de raíces (Fig. 31 a); y por ello los valores del peso seco de hojas tuvieron mayor influencia en la determinación de biomasa total e índice de crecimiento (Fig. 31 c). Además, las medias de la biomasa de las hojas de frutilla fueron significativamente mayor en las plantas inoculadas con A. brasilense REC3 cuando las mismas fueron cultivadas en ambas concentraciones de la solución de Hoagland (50% o 100 %) (Fig. 31 b; p<0,05). Entre las plantas control no-inoculadas (Control-100% y Control-50 %), aquellas que fueron cultivadas en Hoagland 100 % presentaron mayor masa de hoja que en Hoagland 50 % (Fig. 1 b; p<0,05); este resultado era esperado considerando que la primera solución (100 %) es un medio rico en nutrientes mientras que el segundo tenía sólo la mitad de los nutrientes considerados como óptimos para el crecimiento vegetal. Esta diferencia no fue observada entre los tratamientos inoculados (REC3- 50 % y REC3- 100 %), que fueron estadísticamente similares en ambas concentraciones de Hoagland (Fig. 31 b; p<0,05). Azospirillum brasilense REC3 promovió el crecimiento vegetal en ambas concentraciones de medio hidropónico, aunque el efecto de la inoculación bacteriana fue más evidente en solución de Hoagland 50 % donde las plantas inoculadas con REC3 crecieron 80 % más que sus controles, mientras que en el tratamiento REC3- Hoagland 100% sólo se observó un aumento igual a 45 % respecto a su control Hoagland 100 %. 86 Capítulo 4 Figura 31. Peso seco de (a) raíces y (b) hojas de plantas de frutilla control e inoculadas con A. brasilense REC3, cultivadas en la solución de Hoagland 50 % y 100 %. (c) índice de crecimiento y el porcentaje de incremento de crecimiento por la inoculación con REC3. p <0,05; * comparación entre los controles, p <0,05. 2. Observaciones microscópicas En el análisis microscópico se observó que la concentración de la solución de Hoagland no afectó la capacidad de colonización de Azospirillum. Las bacterias se adhirieron a la superficie radicular de las plantas de frutilla de manera similar en ambas concentraciones de Hoagland 50 % y 100 % como se muestra en la Figura 32 c. Así también, independientemente de la concentración del medio hidropónico, se observó un aumento de los pelos radiculares en plantas inoculadas (Fig. 32 b) respecto a los controles no inoculados (Fig. 32 a). 87 Capítulo 4 Figura 32. (a). Micrografías electrónicas de barrido de raíz de control no inoculada. (b). MEB de raíz inoculada con REC3 mostrando la proliferación de pelos radiculares en las plantas cultivadas en medio pobre en nutrientes (Hoagland 50 %). (c). Aumento de (b); nótese las bacterias adheridas a la superficie de la raíz de las plantas inoculadas (se observó un patrón similar en medio rico en nutrientes correspondiente a Hoagland 100 %). 3. Microanálisis por SEM-EDS Los resultados del microanálisis por MEB-EDS de hojas y raíces de plantas inoculadas con A. brasilense REC3 y plantas control, que fueron cultivadas en dos concentraciones de solución de Hoagland (50 % y 100 %) y cosechadas 10 días después de la inoculación se muestran en las Figuras 33 y 34. Los espectros de MEB-EDS mostraron la composición elemental de hojas y raíces de frutilla, mientras que los mapas de MEBEDS permitieron observar la distribución relativa de los macro y micronutrientes en los tejidos de frutilla. Los espectros de EDS no sólo permitieron la cuantificación de los siguientes elementos: C, O, N, Na, P, K, Ca, Cu, Si y Cl, sino además el mapeo por EDS permitió el estudio de la distribución relativa de estos elementos y otros nutrientes no determinados por 88 Capítulo 4 el espectro, como Fe y Zn. Se determinó que todos los elementos eran ubicuos y estaban uniformemente distribuidos en ambos tejidos. Figura 33. MEB-EDS microanálisis de la composición mineral de hojas de plantas de frutilla inoculadas con Azospirillum y plantas control no inoculadas cultivadas en 50% y 100% de la solución de Hoagland (promedio de tres repeticiones). (a) Fracción orgánica representada por C, O y N; (b) Fracción mineral representado por Na, P, K, Ca y Cu. * p <0,05; NS no significativo. (c) micrografía de barrido de área foliar analizado (1000 x). (d -l) Mapeo de EDS de la distribución relativa de los elementos en las hojas de frutilla inoculadas con Azospirillum: (d) C; (e) O; (f) P, (g) Na, (h) N, (i) Fe, (j) Zn, (k) K, (l) Ca. 89 Capítulo 4 Figura 34. MEB-EDS microanálisis de la composición mineral de raíces de plantas de frutilla inoculadas con Azospirillum y plantas control no inoculadas cultivadas en 50% y 100% de la solución de Hoagland (promedio de tres repeticiones). (a) Fracción orgánica representada por C, O y N; (b) Fracción mineral representado Na, Si, P, Cl, K, Ca y Cu. * p <0,05; NS no significativo. (c) micrografía de barrido de área foliar analizada (1000 x). (d -l) Mapeo de EDS de la distribución relativa de los elementos en las raíces de frutilla inoculadas con Azospirillum: (d) C; (e) O; (f) P, (g) Na, (h) N, (i) Fe, (j) Zn, (k) K, (l) Ca. Los espectros de EDS mostraron una composición química similar en hojas y raíces y no se observaron diferencias significativas en las medias del contenido de cada 90 Capítulo 4 elemento, expresada como % del peso. Sin embargo, cualitativamente fue posible observar diferencias en la composición elemental de estos dos tejidos: las hojas estaban compuestas por C, O, N, Na, K, Ca y Cu, mientras que las raíces tenían también Si y Cl. La fracción orgánica, representada por los elementos no-minerales, C, O y N, fueron significativamente mayores que los otros macro- y micro-nutrientes en ambos tejidos, siendo las medias de C y O mucho mayores que las de N. Sin embargo, para cada uno de estos elementos no se observaron diferencias que puedan atribuirse a los tratamientos de inoculación con Azospirillum ni a la concentración de la solución mineral (Fig. 33 a y 34 a; p<0.05). De acuerdo con los espectros de EDS, sólo estos tres elementos sumaban el 96,3 % del total de la composición mineral de la planta. Los micronutrientes Na, Ca y P, fueron encontrados tanto en tejidos de hojas como de raíces, siendo sus valores promedios mayores en hojas. El sodio fue el elemento mineral más abundante en las hojas y raíces de frutilla (Fig. 33 b, 34 b). En hojas, el Na fue 11,36 %, 28,84 %, 9,65 % y 7,46 % mayor que el P, K, Ca y Cu respectivamente, y en raíces fue 19,45 %, 24,43 %, 26,90 %, 7,88 %, 26,52 % y 29,89 % mayor que el P, K, Ca, Cu, Si y Cl, respectivamente. El valor más alto del porcentaje de P fue encontrado en plantas inoculadas con REC3 y cultivadas en Hoagland 50 % en ambos tejidos (p<0.05; Fig. 33 b, 34 b). Los valores de las medias de P en plantas inoculadas fueron 34,33 % y 42,26 % mayores que sus respectivos controles en raíces y hojas, respectivamente. El potasio fue detectado en ambos tejidos, pero sin diferencias respecto a los tejidos o el tratamiento, mientras que el silicio fue detectado sólo en las raíces y su contenido fue mayor en raíces inoculadas con REC3. El micronutriente Cu fue observado en hojas y raíces, sin embargo, el análisis estadístico de este elemento mostró un descenso significativo de éste en raíces inoculadas 91 Capítulo 4 con REC3, equivalente a 35,16 % menos que en plantas control (Fig. 34 b). Mientras que no se observó diferencias significativas en el porcentaje de Cu en las hojas por efecto de los tratamientos. DISCUSIÓN De acuerdo a los resultados obtenidos, el máximo valor de biomasa de raíces observado en plantas inoculadas con A. brasilense REC3 y crecidas en Hoagland 50% se debe probablemente al incremento del área radicular por el aumento del número y longitud de los pelos radiculares. Esto coincide con trabajos previos realizados en plantas de frutilla var. `Camarosa´, `Milsei´ y `Selva´, en donde la cepa REC3 aumentó el peso seco de las raíces y el área radicular por estimulación de la proliferación de los pelos radiculares en sustrato sólido (Pedraza et al., 2010). Este efecto fue observado también en otros cultivos inoculados con Azospirillum (Okon y Kapulnik, 1986; Morgenstern y Okon, 1987). Además, debido a que en este trabajo se observó la proliferación de pelos radiculares en REC3- Hoagland 50% y REC3- Hoagland 100%, se concluye que este efecto es independiente de la concentración del medio mineral y que estaría directamente relacionado con la capacidad de Azospirillum para sintetizar auxinas. Así también, la capacidad de colonización de Azospirillum resultó ser independiente de la concentración de Hoagland utilizada, ya que en ambas concentraciones se observó una densidad similar de células bacterianas adheridas a la superficie radicular. También se observó que hubo una mejor respuesta de las plantas a la inoculación bacteriana, expresada como una mayor promoción del crecimiento, en el medio limitado en nutrientes (Hoagland 50 %). Resultados similares fueron observados en el campo con suelos pobres en nutrientes donde REC3 tuvo un mayor efecto en la promoción 92 Capítulo 4 del crecimiento vegetal en comparación con un suelos rico sin limitaciones de nutrientes (Lovaisa et al., 2012). También existen otros estudios que indican que en suelos erosionados las inoculaciones con Azospirillum presentaron un mejor efecto en la promoción del crecimiento vegetal (Cakmacki et al., 2006; Bacilio et al., 2006). Los espectros de EDS de hojas mostraron una composición química similar que las muestras de raíces y no se observaron diferencias significativas en las medias del contenido de cada elemento, expresada como % del peso. La imposibilidad de determinar diferencias entre las medias de la composición elemental de hojas y raíces probablemente se debe a la limitación de la técnica, ya que los resultados son presentados como valores relativos (% Peso) en lugar de números absolutos. La fracción orgánica fue la mayoritaria en estas determinaciones. Como bien se sabe, las plantas obtienen el C, O e H del agua y del dióxido de carbono, conformando estos el 95 % de la composición elemental vegetal. El hidrógeno no fue identificado en este análisis debido a que el detector de EDS no es capaz de registrar elementos con número atómico menor de seis (Goldstein et al., 2003; Kutchko y Kim, 2006). Los espectros de EDS mostraron la presencia de N pero en menor proporción de la esperada, considerando que A. brasilense REC3 es una bacteria fijadora de nitrógeno. Para explicar este fenómeno se debe tener en cuenta que los experimentos fueron llevados a cabo en bandejas con cultivo hidropónico aireado (pO2= 20 kPa), lo cual probablemente estaría inhibiendo la fijación de N2 debido a que la actividad nitrogenasa es negativamente regulada por la presencia de N combinado y de O2 (cuando la pO2 es superior a 7 kPa; Hartman y Burris, 1987). Las condiciones hidropónicas de cultivo utilizadas en este trabajo fueron ajustadas de manera tal de favorecer el crecimiento vegetal sin consideración de la estricta regulación bajo la que se encuentra la enzima bacteriana nitrogenasa; la cual se 93 Capítulo 4 encontraría probablemente inhibida bajo estas condiciones. También, Kapulnik et al. (1985a) reportaron que no hubo actividad fijadora de nitrógeno en raíces de trigo inoculadas con Azospirillum brasilense bajo condiciones hidropónicas. Sin embargo, las pequeñas diferencias observadas en este trabajo entre el contenido de nitrógeno de las raíces inoculadas y no-inoculadas, pueden quizás deberse a la mejora en la toma de nutrientes como consecuencia de la promoción del crecimiento en raíces inoculadas con Azospirillum. El azufre es un elemento presente en todos los tejidos orgánicos como componente de algunas proteínas; sin embargo, en este estudio no fue detectado. En este ensayo las muestras para MEB fueron metalizadas con oro, en lugar de carbono, lo cual se recomienda cuando se analizan muestras orgánicas por EDS (Goldstein et al., 2003). Por lo tanto, dicho cambio metodológico pudo hacer interferido en la detección de azufre. El sodio fue el elemento mineral que se encontró en mayor proporción en hojas y raíces. Aun cuando el Na ha sido clasificado como un elemento benéfico (Epstein, 1972) y no como un nutriente esencial para el crecimiento de las plantas, éste fue muy acumulado por las plantas de frutillas. Este requerimiento de Na fue observado por Esitken et al., (2010) en plantas de frutilla cv. ˋFernˊ; ellos determinaron mediante espectrometría de masas inductivamente acoplada a plasma, que las plantas de frutilla acumulaban dicho elemento en gran medida, incluso en plantas controles no inoculadas (841,6 mg l-1). Se conoce que cuando las plantas se encuentran expuestas a cantidades excesivas de Na se vuelven cloróticas y necróticas y su crecimiento no puede continuar (Marschner, 2011). Sin embargo, estos síntomas no fueron observados en las plantas de frutilla utilizadas en este trabajo a pesar del alto contenido de Na reportado. La frutilla es considerada como un cultivo muy sensible a la salinidad; no obstante, Martínez Barroso y Alvarez (1997) han 94 Capítulo 4 reportado que los síntomas tóxicos observados en plantas de frutilla var. ˋToroˊ y ˋDouglasˊ irrigadas con diferentes contenidos salinos (NaCl, KCl, Na2SO4, NaHCO3), se debían a la acción específica del ion Cl- en lugar del Na+. La toxicidad fue consecuencia de niveles excesivos de este anión en hojas y no se vio intensificado por la presencia de Na+. Por lo tanto, esto explicaría la alta tolerancia de las plantas de frutilla al Na. Aún más, en un estudio realizado por Saied (2005) se determinó que el Na+ ejerció efectos benéficos en el crecimiento de plantas de frutilla var. ˋKoronaˊ bajo estrés salino. Esto estaría relacionado con efecto de sustitución de K+ por Na+ que ayuda a la osmorregulación, contribuyendo a mantener un alto contenido de agua en los tejidos vegetales, y que en última instancia, aumenta el peso fresco vegetal (Thuran y Eris, 2004). El incremento de P en ambos tejidos y de Si en raíces de frutilla inoculadas con A. brasilense en comparación con sus controles, se explicaría por la estimulación del crecimiento radicular ejercido por las auxinas producidas por Azospirillum. Cuanto más grande sea el sistema radicular, la captación de nutrientes estará más favorecida. Esitken et al. (2010) observaron un incremento similar de la captación de P en plantas de frutilla inoculadas con otras cepas PGPB: Pseudomonas BA-8, Bacillus OSU-142 y Bacillus M-3. Como se mencionó en el capítulo 3 y de acuerdo a lo reportado previamente por Bashan y de-Bashan (2010), Azospirillum coloniza principalmente los tejidos radiculares y produce su mayor efecto a este nivel, aumentando el área radicular y por lo tanto mejorando la nutrición mineral de la planta. Respecto al contenido de cobre determinado en este trabajo, recientemente se ha reportado que dos bacterias de referencia de Azospirillum brasilense, Sp7 y Sp245, fueron capaces de crecer en presencia de Cu II (0,1 mM Cu2+), y que este elemento indujo la biosíntesis de poli-3-hidroxybutirato (PHB) en la cepa Sp7 (Kamnev et al. 2012). En 95 Capítulo 4 concordancia con esto, se infiere que la cepa A. brasilense REC3 podría también ser capaz de tomar el Cu y competir con la planta por este elemento, lo cual explicaría la disminución de Cu observada en las raíces de las plantas inoculadas con Azospirillum. Cabe mencionar que durante el período que duró el ensayo las plantas de frutilla no mostraron ningún síntoma visible de deficiencia de nutrientes. CONCLUSIONES La inoculación con Azospirillum brasilense REC3 aumentó la biomasa y el índice de crecimiento de las plantas de frutilla en comparación con los controles no inoculados, especialmente cuando las plantas fueron cultivadas en solución de Hoagland 50%. Se observó que tanto la estimulación de la proliferación de pelos radiculares ejercido por A. brasilense REC3, como la capacidad de colonización de la cepa REC3, son procesos independientes de la concentración de nutrientes en el medio hidropónico. La microscopía electrónica de barrido acoplada a la espectroscopia de energía dispersiva de rayos-X permitieron estudiar la nutrición mineral de plantas de frutilla inoculadas con A. brasilense REC3 y cultivadas en dos concentraciones de la solución de Hoagland. La fracción orgánica (C, O y N) representó el 96,3% del contenido químico elemental total en hojas y raíces. Cualitativamente hubieron diferencias en la composición elemental de los tejidos analizados: las hojas estuvieron compuestas por C, O, N, Na, K, P, Ca y Cu, mientras que las raíces también tuvieron Si y Cl. Las raíces de las plantas inoculadas mostraron un aumento en el contenido de P y una disminución en el contenido de Cu respecto a las plantas control sin inocular con Azospirillum. 96 Capítulo 5 Capítulo 5 97 Capítulo 5 Análisis de los cambios estructurales producidos en plantas de frutilla por la inoculación con Azospirillum brasilense REC3 INTRODUCCIÓN 1. Mecanismos de defensa vegetal: barreras estructurales En su hábitat natural, las plantas están rodeadas de un enorme número de potenciales enemigos como virus, bacterias, hongos, nematodos, ácaros, insectos, mamíferos y otros animales herbívoros. En el caso de los fitopatógenos, las plantas se defienden de estos a través de estructuras morfológicas, que actúan como barreras físicas que inhiben la entrada y desarrollo del patógeno; o bien lo hacen a través de reacciones bioquímicas que tienen lugar en los diferentes tejidos de la planta y que producen sustancias tóxicas para el patógeno generando condiciones que inhiben su entrada y crecimiento en la planta (Van Etten et al., 1994; Taiz y Zeiger, 2002). Entre las barreras físicas preformadas se encuentran estructuras como la cutícula (capa exterior de cera), la peridermis (tejido protector secundario), paredes celulares lignificadas, paredes impregnadas con suberina, y la forma/tamaño de los estomas, etc. (Manners, 1993). Todas las partes de las plantas expuestas a la atmósfera están recubiertas con capas de material lipídico que reducen la pérdida de agua y ayudan a bloquear la entrada de patógenos. Los principales tipos de recubrimientos son la cutina, suberina y ceras. La cutina, principal constituyente de la cutícula, se encuentra en la mayoría de las partes aéreas mientras que la suberina está presente en las partes subterráneas, tallos leñosos y heridas cicatrizadas (Taiz y Zeiger, 2002). Además, existen metabolitos secundarios que participan en la defensa, ya sea por su naturaleza tóxica para los 98 Capítulo 5 organismos invasores o porque actúan como soporte estructural bloqueando físicamente su propagación, como es el caso de la lignina (Taiz y Zeiger, 2002). Muchas especies reaccionan a la invasión por hongos o bacterias mediante la síntesis de lignina o calosa. La calosa se forma en la placa celular normalmente como parte de los procesos básicos del desarrollo vegetal, como la formación de nuevas paredes en células que se encuentran en división. La calosa es sintetizada en la membrana plasmática y se deposita entre ésta y la pared celular. También se localiza en los granos y tubos de polen, elementos muertos del floema, plasmodesmatas y traqueidas (Kauss, 1992). Sin embargo, la deposición de 1,3-β-glucano de calosa también puede ser activada como una respuesta de defensa que a menudo se asocia con el “estado de alerta” o “priming” inducido por las PGPB durante el desarrollo de la resistencia sistémica inducida (ISR induced systemic resistance) (Benhamou et al., 2000; Van Loon et al., 1998; Pieterse et al., 2009;). Además, puede contribuir a la resistencia a enfermedades mediante el refuerzo de la pared celular vegetal por debajo de los sitios de penetración de hongos (Kauss, 1992). Entre los cambios que pueden observarse en las paredes celulares de las plantas sometidas a un estrés biótico está el engrosamiento de la pared en el apoplasto, que ocurre con el fin de impedir la penetración del patógeno en las interacciones incompatibles hongo-planta (Sherwood y Vance, 1980). Esto se ha reportado en numerosas especies de poaceas como cebada, trigo, avena, centeno, sorgo y maíz (Sherwood y Vance, 1980); y en plantas de frutilla también se observaron respuestas de este tipo a cortos tiempos post-infección con el hongo avirulento Colletotrichum fragariae F7. Este fue capaz de inducir el engrosamiento de la pared celular y la acumulación de pigmentos y cristales amorfos (Salazar et al., 2007). 99 Capítulo 5 2. Objetivo del capítulo Analizar los cambios estructurales producidos en las plantas de frutilla a distintos tiempos posteriores a la inoculación con Azospirillum brasilense REC3 mediante observaciones microscópicas de las deposiciones de calosa y el engrosamiento de la pared celular. MATERIALES Y MÉTODOS 1. Material vegetal y condiciones de cultivo Se utilizaron plantas de frutilla (Fragaria ananassa, Duch) var. `Camarosa´ micropropagadas in vitro y que se obtuvieron del Banco de Germoplasma Activo de Frutilla de la Universidad Nacional de Tucumán. Las plantas se cultivaron en macetas desinfectadas con sustrato estéril (humus: perlome; 2:1) durante tres meses; al cabo de este tiempo se desenterraron y lavaron sus raíces con agua destilada estéril y se trasplantaron a bandejas de plástico que contenía solución nutritiva de Hoagland estéril modificada según Epstein (1972) con aireación constante (pO2= 20 KPa), y se mantuvieron en cámara de crecimiento durante 10 días a 28 ° C, humedad relativa 70 % y 16 h de fotoperiodo (250 µmol photons m2 s−1). 2. Inóculo Como inóculo se utilizó un cultivo puro de Azospirillum brasilense REC3. La suspensión bacteriana se preparó en NFb líquido a partir de una colonia aislada tomada del medio NFb sólido (ver composición de los medios en capítulo 3). El cultivo se incubó a 28 ° C durante 48 h, y posteriormente se ajustó a una densidad óptica (DO560) igual a 0,2 correspondiente a una concentración celular de 106 UFC·ml-1. 100 Capítulo 5 3. Inoculación y diseño experimental Se inocularon 15 plantas de frutilla (3 plantas por cada tiempo de muestreo) en cultivo hidropónico con A. brasilense REC3 sumergiendo las raíces en la suspensión bacteriana (106 CFU·ml-1) durante 20 min y luego se colocaron nuevamente en las bandejas de plástico con solución hidropónica estéril y aireación constante. Las 15 plantas control se sumergieron 20 min en agua destilada estéril. Muestras de hojas fueron tomadas en las 12, 24, 48, 72 y 96 horas postinoculación (hpi) para las observaciones de calosa y la pared celular. Hojas de tres plantas por tratamiento fueron seleccionadas al azar en cada tiempo de muestreo. 4. Tinción de calosa Se analizaron las deposiciones de calosa en la pared celular de las hojas de plantas de frutilla control e inoculadas con REC3 a las 12, 24, 48, 72 y 96 hpi de acuerdo con el método descrito por Currier y Strugger (1956). Luego del aclarado y deshidratación de las hojas con etanol absoluto (100 % v/v) durante 12 h, éstas se rehidrataron secuencialmente a través de concentraciones crecientes de buffer K2HPO4 67 mM (pH 12) desde 0 % hasta 100 % (v/v). Las muestras hidratadas fueron teñidas con azul de anilina 0,01 % (p/v) (Sigma-Aldrich, Bélgica) en K2HPO4 67 mM (pH 12) durante 1 hora a 25 ° C en oscuridad. El material teñido se montó en portaobjetos con glicerol 30 % para su observación bajo luz UV (filtro UV U-MWU2, 330-385 nm) utilizando un microscopio de fluorescencia Olympus BX51 (Olympus, Japón). Las deposiciones de calosa se identificaron como puntos de color verde brillante bajo la luz fluorescente. Todos los experimentos que se muestran en este estudio se realizaron al menos tres veces con resultados similares, las imágenes que se muestran como resultados son representativas de la observación de al menos tres hojas de cada planta. 101 Capítulo 5 5. Fortificación de la pared celular Para evaluar la fortificación de las paredes celulares, se tomaron muestras de hojas a las 24, 48, 72, 96 hpi, se fijaron en FAA (formaladehído- alcohol- ácido acético) y se diafanizaron. Para esto, se decoloraron en etanol 96 % (v/v) hirviendo, se rehidrataron en dos etapas de 30 minutos cada una, primero con KOH 10% (p/v): etanol 96% (v/v) 50:50 y posteriormente con KOH 10% (p/v) y finalmente fueron aclaradas con HClO 50% (v/ v) por 1 min. Para lograr un mejor contraste, se tiñeron las hojas con safranina por 1 min y se lavaron con agua destilada. Las muestras se montaron en portaobjetos con glicerol 30% y las observaciones se realizaron con un microscopio Olympus BX51 (Olympus, Japón). Las imágenes que se muestran como resultados son representativas de la observación de al menos tres hojas de cada planta. RESULTADOS En la Figura 35 se muestran las micrografías de las hojas de plantas control (no inoculadas) e inoculadas con A. brasilense REC3, teñidas con azul de anilina 0,01% a las 12, 24, 48 y 96 h post-inoculación (hpi). Las observaciones mostraron que REC3 estimuló la síntesis de calosa en las paredes celulares de las hojas de frutilla con un máximo de acumulación a las 72 hpi, persistiendo este efecto hasta las 96 hpi. En los tejidos de plantas control no se observó deposiciones de calosa en ningún tiempo evaluado. 102 Capítulo 5 Figura 35. Deposiciones de calosa en hojas de frutilla (indicado por las flechas; Magnificación 40x). Las micrografías corresponden a las plantas inoculadas con A. brasilense REC3 (106 UFC·ml-1) y plantas control no-inoculadas, tomadas a las 12, 24, 48, 72 y 96 horas post-inoculación (hpi). Las barras de la escala equivalen 100 μm. El análisis microscópico de las secciones paradermales de las hojas inoculadas con Azospirillum (Fig. 36) mostró un engrosamiento de las paredes celulares 103 Capítulo 5 a las 72 hpi en comparación con las plantas de control no inoculadas, como consecuencia del engrosamiento/aumento de los espacios intercelulares. Figura 36. Observaciones microscópicas del engrosamiento de la pared celular en hojas de frutilla (indicado por las flechas; Magnificación 100x). Las micrografías corresponden a las plantas inoculadas con A. brasilense REC3 (106 UFC· ml-1) y plantas control no-inoculadas, tomadas a las 24, 48, 72 y 96 horas post-inoculación (hpi). DISCUSIÓN Los estudios histológicos realizados mostraron acumulación de calosa en las hojas de las plantas de frutilla var. `Camarosa´ inoculadas con la cepa REC3 a partir de las 72 hpi y esto coincidió con los datos reportados por Tortora et al. (2012), quien observó la deposición de calosa en el mismo cultivar de frutilla 3 días después de la 104 Capítulo 5 inoculación con A. brasilense. Esta modificación estructural de las paredes celulares ha sido muy investigada ya que puede constituir un importante mecanismo asociado con la resistencia sistémica adquirida (SAR) y el “priming” de las plantas. Kohler et al. (2002) informaron que el pretratamiento con benzotiadiazol o con ácido salicílico alerta a las plantas de Arabidopsis para mejorar la inducción de ciertas respuestas de defensa como la formación de calosa y la inducción inmediata del gen PAL que codifica para la enzima fenilalanina-amonio-liasa. La otra característica morfológica estudiada fue el engrosamiento de las paredes celulares de plantas de frutilla inoculadas con la cepa REC3 y plantas controles. Se observó que A. brasilense REC3 indujo un aumento de los espacios intercelulares de la pared celular a las 72 hpi, coincidente con el tiempo de máximo nivel de deposición de calosa observado. Esto sugiere que existiría una activación de mecanismos de defensa estructurales inducidos por Azospirillum brasilense en plantas de frutilla. De manera similar, Salazar et al. (2007) observaron la activación de la fortificación de la pared celular en plantas de frutilla desafiadas con una cepa no virulenta del hongo Colletotrichum fragariae F7 como uno de los mecanismos de la respuesta SAR que participa en la protección contra la cepa virulenta de Colletotrichum accutatum M23. El refuerzo de las paredes celulares observado en este trabajo probablemente se debe a la formación de enlaces cruzados entre la pectina, la lignina y otros componentes insolubles de la pared celular, contrariamente a las deposiciones de calosa que son constituidas como el resultado de la polimerización de residuos de azúcar (Kauss, 1992). Ambos procesos permiten a las plantas defenderse de potenciales invasores porque constituyen una barrera física que impide su entrada. La acumulación de calosa y el engrosamiento de paredes celulares en hojas de plantas inoculadas radicularmente con REC3, sugiere que A. brasilense REC3 sería capaz de inducir respuestas estructurales en tejidos foliares cuando se asocia con las 105 Capítulo 5 raíces de frutilla; y teniendo en cuenta que la inoculación se realizó en las raíces de las plantas, las modificaciones estructurales observadas en los tejidos foliares confirman la capacidad de la cepa REC3 para desencadenar respuestas sistémicas (en tejidos distantes al tejido inoculado). CONCLUSIONES La cepa Azospirillum brasilense REC3 activó mecanismos de defensa estructurales como la deposición de calosa y el engrosamiento de las paredes celulares en hojas de plantas de frutilla inoculadas radicularmente. Azospirillum brasilense REC3 indujo respuestas estructurales sistémicas en las plantas de frutilla var. `Camarosa´. 106 Capítulo 6 Capítulo 6 107 Capítulo 6 Análisis de las señales bioquímicas disparadas en plantas de frutilla inoculadas con Azospirillum brasilense REC3 INTRODUCCIÓN 1. Resistencia sistémica inducida Numerosas bacterias promotoras del crecimiento vegetal (PGPB), como Azospirillum brasilense, son capaces de inducir respuestas de defensa a enfermedades en plantas, exhibiendo éstas niveles aumentados de resistencia a un amplio espectro de patógenos mediante la previa activación de vías de defensa genéticamente programadas (Vleesschauwer et al., 2006). La inoculación radicular con PGPB puede elicitar un tipo de inmunidad sistémica en plantas llamada resistencia sistémica inducida (ISR, induced systemic resistance) (Van Loon et al., 1998; Pieterse et al., 2009). Cuando las plantas reconocen diferentes patrones asociados a microorganismos benéficos (MAMP microbeassociated molecular patterns), una débil pero efectiva respuesta inmune es activada en tejidos sistémicos (Pieterse et al., 2009). Además, las plantas que expresan ISR pueden reaccionar más rápido y/o fuerte al ataque por un patógeno mediante la activación de un “estado de alerta” denominado “priming”, mejorando su habilidad para activar repuestas de defensa celulares (Conrath et al., 2006). Esta sensibilización de los tejidos vegetales debido al priming inducido por bacterias PGPB, mejora la expresión de defensa y es una característica común de la ISR que permite explicar su efectividad contra un amplio espectro de microorganismos fitopatógenos (Conrath et al., 2006). 108 Capítulo 6 2. Mecanismos de defensa: señales bioquímicas Uno de los primeros eventos en la respuesta de defensa sistémica es la producción de un estallido del metabolismo oxidativo que lleva a la generación del anión radical superóxido (O2•–) y del peróxido de hidrógeno (H2O2) (Pieterse et al., 2009). Debido a su reactividad química estas especies reactivas del oxígeno (ERO) pueden actuar directamente protegiendo contra los microorganismos invasores, o indirectamente a través de la activación de la biosíntesis de fitoalexinas, la producción enlaces cruzados oxidativos en los componentes de la pared celular y/o la inducción de numerosos genes de defensa (Mittler et al., 2004; Møller et al., 2007; Foyer y Noctor, 2005, 2009). Sin embargo, la acumulación de estas ERO puede perturbar seriamente el metabolismo normal a través del daño oxidativo generado en lípidos, proteínas y ácidos nucleicos (Møller et al., 2007). Un indicador común de la peroxidación de lípidos de membrana es el contenido de ácido malonaldehido (MDA, malonaldehyde acid), un producto secundario de la oxidación de ácidos grasos poliinsaturados, que generalmente aumenta durante condiciones de estrés como ser la infección patogénica (Møller et al., 2007). Con el fin de regular los niveles de ERO, las células vegetales han desarrollado mecanismos enzimáticos y no-enzimáticos, como los sistemas antioxidantes depuradores de ERO y numerosas clases de metabolitos reductores (Mittler et al., 2004; Møller et al., 2007). En sintonía con lo anterior, se sabe que los polifenoles son antioxidantes cruciales para el funcionamiento y desarrollo vegetal. Estos juegan roles estructurales en distintos tejidos de soporte o protección, están involucrados en estratégicas de defensa y tienen propiedades como señalizadores, particularmente en las interacciones entre las plantas y su ambiente (Boudet, 2007; Huda-Faujan et al., 2009). Estos metabolitos 109 Capítulo 6 secundarios son antioxidantes especialmente importantes debido a su elevado potencial redox, que permite su acción como agentes reductores, donadores de hidrógeno y depuradores de oxígeno singlete (Kähkönen et al., 1999). El refuerzo del metabolismo fenólico en plantas está frecuentemente asociado con fenómenos de resistencia inducida contra numerosas bacterias, hongos y virus causantes de enfermedades vegetales (Boudet, 2007). En este sentido, los compuestos fenólicos pueden actuar como compuestos solubles antimicrobianos y antialimentarios, o bien, pueden formar enlaces cruzados con calosa, proteínas y polisacáridos dentro de las paredes celulares frenando la penetración de patógenos y la absorción de nutrientes por éstos (Hukkanen et al., 2007). 3. Objetivos del capítulo El presente capítulo tuvo como objetivo evaluar fenómenos bioquímicos activados durante la interacción Azospirillum-frutilla, como la ocurrencia de estallido oxidativo, la síntesis de compuestos fenólicos solubles y unidos a las paredes celulares, y la peroxidación de lípidos de membrana. 110 Capítulo 6 MATERIALES Y MÉTODOS 1. Material vegetal y condiciones de cultivo Se utilizaron plantas de frutilla (Fragaria ananassa, Duch) var. `Camarosa´ micropropagadas in vitro, que se obtuvieron del Banco de Germoplasma Activo de Frutilla de la Universidad Nacional de Tucumán. Todo el ensayo fue llevado a cabo en condiciones de esterilidad y se controló la ausencia de microorganismos en las plantas saneadas por cultivo in vitro sembrando un macerado de las mismas en placas de Petri con medio LB (composición capítulo 3) que se incubaron a 30 °C por 120 h. Cumplido este tiempo, los lotes que estaban libre de desarrollo microbiano se consideraron para los ensayos. Las plantas se cultivaron en macetas desinfectadas con sustrato estéril (humus: perlome; 2:1) durante tres meses, al cabo de este tiempo se lavaron sus raíces con agua destilada estéril y se trasplantaron a bandejas de plástico con solución nutritiva de Hoagland estéril modificada según Epstein (1972) y aireación constante (pO2= 20 KPa). Las mismas se mantuvieron en cámara de crecimiento durante 10 días a 28 ° C, humedad relativa 70% y 16 h de fotoperiodo (250 µmol fotones m2 s−1). 2. Inóculo Para el preparar el inóculo se sembró una colonia aislada de Azospirillum brasilense REC3 en medio NFb líquido (composición en capítulo 3) y se incubó durante 48 h a 28 ° C y 600 rpm. Concluido el tiempo de incubación, se ajustó la concentración de la suspensión bacteriana en aproximadamente 106 UFC·ml-1 (DO560 =0,2). 111 Capítulo 6 3. Inoculación y toma de muestras Se inocularon 35 plantas de frutilla (5 plantas por cada tiempo de muestreo) en cultivo hidropónico sumergiendo las raíces en la suspensión de A. brasilense REC3 (106 CFU·ml-1) durante 20 min y luego se colocaron nuevamente en las bandejas de plástico con solución hidropónica estéril y aireación constante. Por otro lado, como control se sumergieron las raíces de 35 plantas durante 20 min en agua destilada estéril. Las raíces y hojas de cinco plantas por tratamiento fueron seleccionadas al azar en cada tiempo de muestreo: 0, 12, 24, 48, 72, 96 y 120 horas post-inoculación (hpi). De cada planta se tomaron muestras sólo una vez para evitar eventuales efectos debidos al corte. El pool de hojas de cinco plantas muestreado a cada tiempo se utilizó para evaluar el estallido oxidativo, el contenido de compuestos fenólicos y la peroxidación lipídica. 4. Determinación histoquímica del radical superóxido y peróxido de hidrógeno La capacidad de Azospirillum para inducir un estallido oxidativo de forma local o sistémica se evaluó mediante tinciones hitoquímicas en raíces y hojas de frutilla, respectivamente, de manera tal de detectar la producción de peróxido de hidrogeno y/o radical superóxido. Las hojas y raíces de plantas control e inoculadas con REC3, muestreadas en distintos tiempos post-inoculación (0, 12, 24, 48, 72, 96, 120 hpi), se tiñeron con nitro-blue tetrazolio (NBT; Sigma-Aldrich, Bélgica) para la detección de superóxido (GrelletBournoville y Díaz- Ricci, 2011). Los tejidos vegetales se enjuagaron con agua destilada y se incubaron en una solución de NBT 0,1 % (p/v) y azida de sodio 10 mM preparada en buffer fosfato de potasio 50 mM (pH 7,8) durante 8 h, en oscuridad y a 25 °C. La 112 Capítulo 6 producción de superóxido se visualizó como un depósito de formazan púrpura sobre los tejidos. Similarmente, se utilizó la tinción con 3,3-diaminobencidina (DAB; SigmaAldrich, Bélgica) para evaluar la acumulación de peróxido de hidrógeno en hojas y raíces (Vleesschauwer et al., 2006). Luego del lavado suave con agua destilada, las raíces se sumergieron en una solución que contenía DAB 0,1 % (p/v) y Triton-X-100 0,01% (v/v) durante 12 h, en oscuridad y a 25 °C. El mismo procedimiento se realizó en hojas desprendidas simplemente sin Triton-X-100. Como resultado positivo se observó la producción de un precipitado de color marrón-rojizo por la reacción del DAB con el H2O2 catalizada por peroxidasas. Los controles positivos de la tinción con NBT se prepararon sumergiendo los tejidos vegetales en buffer fosfato de potasio 50 mM (pH 7,8) que contenía riboflavina 27 mM y metionina 17 mM durante 1 h, a 25 °C y con luz blanca. Para la reacción positiva de DAB, los tejidos vegetales se sumergieron en H2O2 10 mM durante 30 min a 25 °C, y para el control negativo de DAB, los tejidos se sumergieron en ácido ascórbico 10 mM (depurador de peróxidos). Luego de la fijación del colorante (NBT o DAB), las hojas fueron clarificadas por calentamiento en etanol 95% (v/v) y posterior inmersión en una solución de ácido láctico: glicerol: H2O (3:3:4) por 24 h. 113 Capítulo 6 5. Extracción y cuantificación de compuestos fenólicos Para la extracción de compuestos fenólicos solubles totales, se pesó 1 g de hojas o raíces frescas y se homogeneizaron con 20 ml de etanol: agua (80:20; v/v). Los extractos se centrifugaron a 3.000 g durante 10 min y el sobrenadante, conteniendo la fase alcohólica rica en compuestos fenólicos solubles, fue sonicada durante 30 min a 4 °C. La extracción de compuestos fenólicos unidos a la pared celular, hidrolizables con NaOH, se realizó por el método descrito por Hukkanen et al. (2007). Para ello, el precipitado restante de la extracción anterior se lavó una vez con metanol 100% para eliminar las trazas de compuestos fenólicos solubles residuales. A continuación, se añadió 1 ml de NaOH 1 M cada 20 mg de tejido fresco, se hidrolizaron a 70 ° C durante 1 h, y se centrifugaron a 10.000 g durante 10 minutos. Los sobrenadantes se neutralizaron con un volumen de HCl 1 M, se evaporaron al vacío a 25 °C y se resuspendieron en 1 ml de etanol: agua (80:20; v/v). Para los controles positivos se utilizaron plantas irradiadas con luz UV durante 1 h y plantas sumergidas en H2O2 10 mM durante 30 min. El contenido total de fenoles de los extractos obtenidos, correspondientes a compuestos fenólicos solubles o unidos a la pared celular, se determinó utilizando el reactivo de Folin-Ciocalteu según el método de Singleton y Rossi (1965). De cada extracto se tomaron 100 µl y se mezclaron con 2,5 ml de reactivo de Folin-Ciocalteu 0,2 N y 2 ml de Na2CO3 7,5 % (p/v), por triplicado. Luego de incubar a 25 °C durante 10 min, se midió la absorbancia de todas las muestras a 765 nm. Los resultados se expresaron en miligramos de equivalentes de ácido gálico (GA) por gramo de peso fresco de hojas o raíces, calculados a partir de una curva patrón de GA puro. 114 Capítulo 6 6. Peroxidación lipídica La peroxidación lipídica se determinó midiendo la concentración de ácido malondialdehído (MDA) de acuerdo con el método TBARS (thiobarbituric acid reactive species) que mide las sustancias reactivas del ácido tiobarbitúrico (TBA; thiobarbituric acid) según lo descripto por Hodges et al. (1999). A tal fin, se pesó 1 g (peso fresco) de tejido de hoja o raíz y se homogeneizó con 20 ml de etanol: agua (80:20; v/v), seguido por una centrifugación a 3.000 g durante 10 min. Se tomaron dos alícuotas de 0,5 ml del extracto alcohólico (sobrenadante): una alícuota se mezcló con 0,5 ml de la solución denominada “+TBA” (ácido tricloroacético 20 %; p/v), hidroxitolueno butilado 0,01 % (p/v) y TBA 0,65% (p/v), y la otra alícuota se mezcló con la solución denominada “-TBA” con una composición similar a la anterior, pero sin TBA. Las mezclas se calentaron a 95 ºC durante 25 min, se enfriaron y después se centrifugaron a 4.000 g durante 10 min. Las absorbancias se midieron a 450 nm, 532 nm y 600 nm en un espectrofotómetro Beckman DU Modelo #640 (Beckman Coulter Inc., EEUU). Los equivalentes de MDA se calcularon de acuerdo con las siguientes fórmulas (Hodges et al., 1999): 1) A= [(Abs 532 +TBA – Abs 600 +TBA) – (Abs 532 –TBA – Abs 600 –TBA)] 2) B= [(Abs 440 +TBA – Abs 600 +TBA) 0,0571] 3) MDA (nmol ·ml-1) = [(A-B/157000)106] La máxima absorbancia del complejo MDA-TBA se registra a 532 nm; la absorbancia medida a 600 nm corresponde a la corrección de turbidez no específica; la absorbancia de 440 nm mide sacarosa; 0,0571 es la relación de absorbancia molar de sacarosa a 532 nm y 440 nm, respectivamente; y 157.000 es el coeficiente de extinción molar de MDA. 115 Capítulo 6 Plantas que fueron irradiadas con luz UV durante 1 h y plantas sumergidas en H2O2 10 mM durante 30 min también se utilizaron como controles positivos. 7. Diseño experimental y análisis estadístico. Se utilizó un diseño factorial con bloques completamente aleatorios de dos tratamientos (inoculados con REC3 y controles no inoculados) con 35 plantas por cada tratamiento y 7 tiempos de muestreo (0, 12, 24, 48, 72, 96 y 120 hpi), de manera tal que hubo cinco plantas/tiempo/tratamiento. El análisis estadístico de los datos se procesó mediante análisis de la varianza (ANOVA) y la significancia estadística de las medias aritméticas se evaluaron mediante la prueba de diferencias múltiple LSD Fisher utilizando el programa Infostat (versión 2008 para Windows). Las diferencias entre tratamientos se consideraron significativas si p<0,05. RESULTADOS 1. Detección del estallido oxidativo La producción del radical superóxido y de peróxido de hidrógeno en raíces y hojas de plantas de frutilla cultivadas hidropónicamente fueron evaluados con NBT y DAB, respectivamente, en diferentes tiempos post-inoculación: 12, 48, 72, 96 y 120 hpi. Las hojas de las plantas no-inoculadas e inoculadas radicularmente con Azospirillum brasilense REC3 no mostraron tinción positiva con DAB ni con NBT en los tiempos evaluados (Fig. 37). 116 Capítulo 6 Controles positivos Figura 37. Estallido oxidativo en hojas de plantas de frutilla inoculadas con A. brasilense REC3 (106 UFC·ml-1) y controles no–inoculadas muestreadas a las 12, 24, 48, 72, 96 y 120 horas postinoculación. El reactivo 3,3-diaminobencidina (DAB) se utilizó para evaluar la acumulación de H2O2 y el Nitro-blue tetrazolio (NBT) para la detección del radical O2•-. La columna “controles” corresponde a las reacciones positivas de NBT y DAB. De manera similar, las raíces inoculadas mostraron la misma cantidad de precipitados de DAB y NBT que las raíces de plantas control no-inoculadas (Fig. 38), lo que confirma la incapacidad de REC3 para inducir el aumento de H2O2 y O2•- en los tiempos del experimento. 117 Capítulo 6 Controles positivos Figura 38. Estallido oxidativo en raíces de plantas de frutilla inoculadas con A. brasilense REC3 (106 UFC·ml-1) y controles no–inoculadas muestreadas a 24, 48, 72 y 96 horas post-inoculación. El reactivo 3,3-diaminobencidina (DAB) se utilizó para evaluar la acumulación de H2O2 y el Nitro-blue tetrazolio (NBT) para la detección del radical O2•-. La columna “controles” corresponde a las reacciones positivas de NBT y DAB. Sin embargo, se observó una fuerte acumulación de H2O2 y O2•- en las raíces y hojas previamente tratados con H2O2 (control positivo de DAB) o riboflavina-metionina (control positivo de NBT), respectivamente, confirmando la especificidad de las tinciones realizadas (Fig. 37 y 38). También se incluyeron controles negativos que consistieron en hojas y raíces tratadas previamente con un depurador de H2O2 como el ácido ascórbico donde no se observaron precipitados. 118 Capítulo 6 2. Cuantificación de compuestos fenólicos solubles totales y unidos a la pared celular La Figura 39 muestra la cuantificación de compuestos fenólicos solubles totales de hojas y raíces de plantas de frutilla controles (no-inoculadas) e inoculadas con A. brasilense REC determinados en las 0, 12, 24, 48, 72, 96 y 120 hpi y expresados como mg de ácido gálico (GA) ·g-1 peso fresco. Los datos corresponden a las medias ± desvío estándar de tres repeticiones. La prueba de diferencia estadística LSD Fisher mostró que la inoculación con A. brasilense REC3 aumentó los niveles de compuestos fenólicos solubles en hojas y raíces a partir de las12 hpi (p<0,05; Fig. 39). Sin embargo, no hubo diferencias entre las medias por efecto del tiempo. Los valores promedio de los controles positivos de plantas irradiadas con luz UV fueron: 3,83 ± 0,24 mg GA· g-1 hojas y 2,03 ± 0,13 mg GA· g-1 raíces; y en plantas tratadas con H2O2 los valores fueron: 5,89 ± 0,16 mg GA· g-1 hojas, y y 2,49 ± 0,15 mg GA· g-1 raíces. 119 Capítulo 6 Figura 39. Compuestos fenólicos solubles totales de hojas (a) y raíces (b) de plantas de frutilla controles (no-inoculadas) e inoculadas con A. brasilense REC3 (106 cfu·ml-1) determinados a las 0, 12, 24, 48, 72, 96 y 120 horas post-inoculación (hpi) y expresados como mg de ácido gálico (GA) ·g-1 peso fresco. Los datos corresponden a las medias ± desvío estándar de cinco repeticiones. El análisis de la varianza tiene un nivel de significación: p <0,05 (*) y las pruebas de diferencias con el test LSD Fisher se llevaron a cabo por separado para cada uno de los tejidos vegetales. En comparación con los compuestos fenólicos solubles, las concentraciones de fenólicos unidos a la pared celular (hidrolizables con NaOH) fueron 10 veces más bajas (Fig. 40). Cualitativamente, hubo una disminución del contenido de compuestos fenólicos ligados a la pared celular en plantas inoculadas con REC3 durante las primeras 96 hpi. Sin 120 Capítulo 6 embargo, el análisis de ANOVA de estos datos indicó que no hubo diferencias significativas entre las medias de los tejidos inoculados y los controles no-inoculados (p<0,05; Fig. 40). Figura 40. Compuestos fenólicos unidos a pared celular de hojas (a) y raíces (b) de plantas de frutilla controles (no-inoculadas) e inoculadas con A. brasilense REC3 (106 cfu·ml-1) determinados a las 0, 12, 24, 48, 72, 96 y 120 horas post-inoculación (hpi) y expresados como mg de ácido gálico (GA) · g-1 peso fresco. Los datos corresponden a las medias ± desvío estándar de cinco repeticiones. El análisis de la varianza tiene un nivel de significación: p <0,05 (*) y las pruebas de diferencias con el test LSD Fisher se llevaron a cabo por separado para cada uno de los tejidos vegetales. 121 Capítulo 6 3. Análisis de la peroxidación lipídica El contenido de MDA (ácido malonaldehído) es un indicador de la peroxidación lipídica y el daño oxidativo de las membranas. La Figura 41 muestra los resultados de las concentraciones de MDA en tejidos de plantas de frutilla controles e inoculadas con A. brasilense REC3 expresados como nmoles de MDA·g-1 peso fresco. Figura 41. Peroxidación lipídica expresada en nmol de ácido malondialdehído (MDA) ·g-1 peso fresco de hojas (a) o raíces (b) de plantas de frutilla controles (no-inoculadas) e inoculadas con A. brasilense REC (106 cfu·ml-1) y determinada a las 0, 12, 24, 48, 72, 96 y 120 horas post-inoculación (hpi). Los datos corresponden a las medias ± desvío estándar de cinco repeticiones. El análisis de la varianza tiene un nivel de significación: p <0,05 (*) y las pruebas de diferencias con el test LSD Fisher se llevaron a cabo por separado para cada uno de los tejidos vegetales. 122 Capítulo 6 Los resultados mostraron una tendencia similar en ambos tejidos analizados. Se observó que durante las primeras 48 h posteriores a la inoculación (hpi) con Azospirillum, hubo una disminución de TBARS (especies reactivas del ácido tiobarbitúrico) en las hojas y raíces de frutilla; mientras que a las 96 y 120 hpi la inoculación con Azospirillum causó un incremento en el contenido de MDA en comparación con las plantas control. Se observó un punto de inflexión en las 72 hpi cuando los tejidos del control e inoculados mostraron concentraciones de MDA similares. La prueba de diferencia múltiple LSD Fisher mostró que la inoculación con REC3 disminuyó significativamente la peroxidación lipídica de las hojas y raíces en las 24 hpi (Fig. 41; p<0,05). En contraste, el contenido de MDA de hojas inoculadas aumentó significativamente en las 120 hpi, en comparación con los tejidos de control, y lo mismo se observó en las raíces a las 96 hpi (Fig. 41; p<0,05). Resumiendo, el daño oxidativo a los lípidos de membrana en plantas inoculadas con Azospirillum disminuyó durante las primeras 48 hpi, tuvo un punto de inflexión a las 72 hpi y aumentó después de las 96 hpi. DISCUSIÓN Las plantas han desarrollado estrategias sofisticadas para percibir y defenderse de los diferentes tipos de patógenos mediante el disparo de una gran diversidad de señales. Estas respuestas de defensa incluyen el estallido de especies reactivas de oxígeno que culminan en una muerte celular llamada respuesta hipersensible (RH), la fortificación de la pared celular a través de la síntesis de calosa y lignina, la producción de metabolitos secundarios antimicrobianos y la acumulación de proteínas relacionadas con patogénesis (PR) (Pieterse et al., 2009). 123 Capítulo 6 En este capítulo se muestra que la inoculación de plantas de frutilla con A. brasilense REC3 indujo la acumulación de compuestos fenólicos solubles en las raíces y las hojas a partir de las 12 hpi hasta las 120 hpi. Una inducción similar se ha observado en plantas de betel (Piper betel L.) luego de la inoculación con la cepa PGPB Serratia marcescens NBRI1213, donde hubo un aumento de la cantidad y diversidad de compuestos fenólicos debido a la activación de la ruta de los fenilpropanoides (Lavania et al., 2006). Se conoce que en plantas biotizadas, el incremento de los compuestos fenólicos solubles podría actuar como barreras antimicrobianas que conducirían a una mayor resistencia contra diversos fitopatógenos (Hukkanen et al., 2007; Tortora et al., 2012). Por su lado, Cowan (1999) informó que los compuestos fenólicos solubles también pueden ser tóxicos para algunos microorganismos en diferentes modos: por alteración de las membranas bacterianas, unión a proteínas o sustratos, o bien, afectando la actividad de algunas enzimas. Además, los cambios en los compuestos fenólicos unidos a las paredes celulares vegetales estarían involucrados en procesos de defensa debido a la formación de enlaces cruzados entre los compuestos fenólicos y otros materiales insolubles de las paredes celulares, afectando la capacidad de penetración de los agentes patógenos (Hukkanen et al., 2007). Estos mismos autores, observaron que el tratamiento con benzotiodiazol aumentó la acumulación de fenoles solubles y unidos a pared celular en las hojas de plantas de frutilla, mejorando la resistencia a la infección por oidio en condiciones de invernadero. A nivel molecular, algunos autores han resaltado la correlación de manera directa del aumento de la expresión génica y actividad de la enzima fenilalanina-amoniacoliasa (PAL) con el aumento de los compuestos fenólicos en respuesta a diferentes estímulos (Boudet 2007, Ruíz-Sánchez et al., 2011). Un ejemplo de esta correlación se observó anteriormente en plantas de frutilla inoculadas con A. brasilense REC3, donde el aumento 124 Capítulo 6 de la expresión de PAL a las 96 hpi ocurrió en paralelo con el aumento del contenido de polifenoles totales (Tortora et al., 2012). Además, PAL es una enzima clave en la ruta del fenilpropanoide que conduce a una variedad de metabolitos secundarios de plantas relacionados con la defensa, tales como el ácido salicílico, fitoalexinas y polímeros como la lignina (Hahlbrock y Scheel, 1989). Por lo tanto, el papel de los polifenoles como moléculas señales debe ser considerado de gran importancia debido a su participación en procesos de crecimiento y desarrollo, así como también en la activación de respuestas de defensa (Foyer y Noctor, 2009). Además de su actividad antimicrobiana, los polifenoles pueden funcionar como sistemas antioxidantes no enzimáticos permitiendo mejorar la tolerancia de las plantas al estrés oxidativo (Huda-Faujan et al., 2009.). El estallido oxidativo inducido por estrés y su señalización redox asociada son procesos muy complejos y a menudo implican eventos de producción de ERO aislados, provenientes de diferentes fuentes dentro de la célula vegetal, algunas locales y otras alejadas del lugar donde se produjo el estímulo inicial, seguido por olas de señales amplificadas (Foyer y Noctor, 2005). En este trabajo, el análisis histoquímico de hojas de plantas de frutilla inoculadas con A. brasilense REC3 reveló que no hubo acumulación de H2O2/O2•- a nivel local ni sistémico en los tiempos ensayados. Por lo tanto, se infiere que los compuestos fenólicos solubles, que fueron incrementados por la inoculación con Azospirillum, podría actuar como depuradores de ERO inhibiendo el estallido oxidativo en los tejidos de frutilla. Esto mejoraría la sostenibilidad y rendimiento del cultivo gracias a su mayor tolerancia al estrés. Las técnicas de tinción con DAB y NBT son ampliamente conocidas y utilizadas para identificar ERO, pero en este estudio dichas especies no fueron detectadas. 125 Capítulo 6 Teniendo en cuenta que las reacciones de control positivo mostraron tinción positiva en los tejidos tratados previamente con sustancias generadoras de ERO, la incapacidad para detectar el estallido oxidativo no puede ser atribuido a la falta de precisión del método utilizado. Entonces, la ausencia de estallido oxidativo probablemente se deba al estricto control de las reacciones oxido-reducción llevado a cabo por las plantas, donde la intensidad, duración y localización de las diferentes señales de ERO son el resultado de la sincronización entre las tasas de producción y depuración de las mismas (Mittler et al., 2004). Además, esta red de señalización es muy dinámica, dificultando la detección y cuantificación de ERO debido a su inestabilidad y movilidad (Foyer y Noctor, 2005). Y aunque el H2O2 es el menos reactivo de estas especies, es aún muy difícil de evaluar ya que es generado continuamente a lo largo de la vía de señalización, o bien hay una señal móvil que es inducida por el H2O2 en un punto de partida y genera H2O2 en un punto de llegada (Foyer y Noctor, 2009). Los resultados negativos de la tinción de NBT y DAB de este trabajo sugieren que hay un nivel reducido de estrés oxidativo en plantas de frutilla inoculadas con la cepa REC3, de manera similar a lo informado por Weyens et al. (2012) en plantas de álamo inoculado con la cepa PGPB Pseudomonas putida W619. Estos autores observaron una disminución de la actividad de la glutatión reductasa en las raíces y de la superóxido dismutasa en raíces y hojas de plantas inoculadas. Este resultado no descarta la hipótesis de que la supresión de la acumulación de ERO puede deberse a una reacción específica del huésped como un mecanismo evasivo que permitiría a A. brasilense colonizar tejidos vegtales y escapar al sistema inmune innato de la planta. Aunque no se pudo detectar efectivamente el estallido oxidativo, se pudo cuantificar una señal más estable de la producción de ERO como es la peroxidación lipídica 126 Capítulo 6 de las membranas celulares de hojas y raíces de frutilla. En primer lugar, se esperaba encontrar una disminución en el contenido de MDA, producto secundario de la degradación oxidativa de lípidos, en plantas inoculadas con Azospirillum debido al incremento de los compuestos fenólicos y su acción antioxidante. Sin embargo, esto fue cierto sólo durante las primeras 24 hpi, cuando los valores de peroxidación lipídica de las plantas colonizadas por REC3 fueron significativamente menores que en los tejidos de los controles. Posteriormente, se observó un aumento del contenido de MDA en las 96 hpi en plantas inoculadas con Azospirillum, en comparación con las plantas control no-inoculadas. Si bien la peroxidación de ácidos grasos poliinsaturados podría resultar perjudicial para las células vegetales debido a que disminuye la fluidez de la membrana y aumenta su permeabilidad (Moller et al., 2007), desde un punto de vista energético, esto podría ser ventajoso ya que una molécula lipídica dañada (como un ácido poliinsaturado) es más simple de eliminar y reemplazar que una molécula proteica (Moller et al., 2007). Recientemente, Ruiz Sánchez et al. (2011) también observaron incrementos en el contenido de MDA en plantas de arroz a los 30 días posteriores a la inoculación con Azospirillum brasilense; ellos explicaron este efecto afirmando que las plantas inoculadas eran más grandes, y por lo tanto, se verían más afectadas por el estrés impuesto. En el presente trabajo, el incremento de MDA también podría explicarse teniendo en cuenta las cantidades reducidas de compuestos fenólicos unidos a la pared celular en plantas inoculadas y a la reducida capacidad de amortiguación redox del apoplasto vegetal (Foyer y Noctor, 2005). En general, el estallido oxidativo en el protoplasto ha sido estudiado en relación al estrés abiótico principalmente, mientras que las ERO generadas en la membrana plasmática se asocia a menudo con una respuesta a estreses bióticos mediada por una 127 Capítulo 6 NADPH-oxidasa (Bolwell et al., 2002). Por lo tanto, la posible acumulación de ERO en las membranas celulares y las cantidades reducidas de compuestos fenólicos unidos a la pared celular en plantas inoculadas con A. brasilense REC3, así como también la menor capacidad amortiguadora de redox del apoplasto, podrían explicar el incremento del contenido de MDA observado en este trabajo durante los últimos tiempos de muestreo. Por el contrario, la disminución del daño oxidativo observado durante las primeras 48 hpi estaría en concordancia con el incremento de compuestos fenólicos solubles y con la aparente ausencia de acumulación de ERO. Por otro lado, debido a que el contenido de oxígeno es significantemente más alto en las células fotosintéticas, respecto al resto de las células heterotróficas de la planta, las mayores concentraciones de MDA y compuestos fenólicos determinados en los tejidos foliares en comparación con las raíces, puede estar relacionado con el mayor efecto de las ERO en respuesta al estrés en los tejidos fotosintéticos (Foyer y Noctor, 2009). La ausencia de diferencias entre las concentraciones de compuestos fenólicos unidos a la pared celular de plantas inoculadas y controles, se debería al corto tiempo de ensayo (120 h), lo cual no sería suficiente para sintetizar nuevos compuestos estructurales de la pared celular. Los compuestos fenólicos unidos a la pared celular no presentaron diferencias significativas entre las plantas inoculadas y controles en todos los tiempos analizados; este resultado se explicaría teniendo en cuenta el método utilizado para la extracción de los compuestos unidos a la pared celular y la naturaleza química de los mismos. La técnica descrita por Hukkanen et al. (2007) y utilizada en este trabajo, se centra en compuestos fenólicos unidos mediante enlaces éster a los polisacáridos de la pared celular, y no considera los polímeros fuertemente unidos a la pared, tales como la lignina. Los 128 Capítulo 6 compuestos determinados por este método se consideran que derivan de los materiales con uniones éster, ya que son liberados durante la primera hora de hidrólisis con una base débil como NaOH (1 M) y temperatura moderada (70 ºC); mientras que la lignina y otros compuestos unidos mediante enlaces éter no son fácilmente liberados de la matriz de la pared, y por lo tanto, deben utilizarse condiciones de hidrólisis más fuertes para su extracción (von Röpenack et al., 1998; Martens, 2002). CONCLUSIONES La cepa Azospirillum brasilense REC3 no indujo una señal de estallido oxidativo local ni sistémica en las plantas de frutilla entre las 12 hpi y 120 hpi. La inoculación de las plantas de frutilla con A. brasilense REC3 produjo un aumento en los niveles de compuestos fenólicos solubles totales en hojas y raíces a partir de las 12 hpi hasta las 120 hpi, actuando como factores antioxidantes y/o antimicrobianos. Los niveles de compuestos fenólicos unidos a la pared celular no mostraron diferencias significativas entre los tejidos de plantas de frutilla inoculadas y controles noinoculados. La peroxidación de lípidos disminuyó significativamente durante las primeras 24 h en raíces y hojas de plantas de frutilla inoculadas con A. brasilense REC3. La señales bioquímicas activadas por A. brasilense REC3, como la ausencia de estallido oxidativo, el aumento de compuestos fenólicos solubles totales y la diminución de la peroxidación de lípidos de membrana, indicaron la activación de un “estado de alerta” o “priming” en plantas de frutilla inoculadas, siendo éste un proceso importante de la resistencia sistémica inducida de plantas. 129 Capítulo 7 Capítulo 7 130 Capítulo 7 Evolución temporal de la producción del ácido salicílico y ácido indol-3-acético en plantas de frutilla inoculadas con Azospirillum brasilense INTRODUCCIÓN 1. El sistema inmune vegetal: señalización hormonal Las fitohormonas son moléculas pequeñas que en bajas concentraciones regulan procesos vitales en las plantas como el crecimiento, desarrollo, reproducción y respuestas a distintos estímulos de origen biótico y abiótico. Las principales hormonas que inducen respuestas a través de las vías de señalización hormonal son el ácido salicílico (AS), ácido jasmónico (AJ) y etileno (ET) (Bari y Jones, 2009; Pieterse et al., 2009, 2012). No obstante, numerosos estudios han demostrados que otras hormonas, como las auxinas, giberelinas, citocininas, ácido absícico, oxilipinas y brasinoesteroides, también juegan roles importantes en la defensa vegetal (Bari y Jones, 2009; Pieterse et al., 2012). Luego del ataque por un fitopatógeno, las plantas modifican los niveles hormonales, y la expresión de los genes asociados, para activar respuestas de defensa efectivas permitiendo su supervivencia. Por otro lado, los patógenos pueden contraatacar esta estrategia interfiriendo con los cambios hormonales vegetales, y a tal fin, ellos mismos producen fitohormonas como parte de su estrategia de invasión (López et al., 2008). Para inducir la inmunidad vegetal es crítico que ocurra una apropiada relocalización de recursos hacia las respuestas de defensa que es energéticamente costoso, en lugar de satisfacer los requerimientos para el crecimiento y reproducción. El mantenimiento de un equilibrio entre estos procesos es fundamental para la supervivencia vegetal y la efectiva competencia con otras especies de plantas (Taiz y Zeiger, 2002). 131 Capítulo 7 Abundantes datos fisiológicos sugieren que todas las hormonas vegetales interactúan con una o más hormonas adicionales. Dependiendo del contexto, la interacción hormonal puede implicar cambios en el nivel de la distribución hormonal o en la respuesta de defensa, ya que interactúan a nivel de la expresión génica (Santner et al., 2009); por lo tanto, modulando las vías de señalización hormonal las plantas controlan procesos vitales para la resistencia (López et al., 2008). Por otro lado, las relaciones antagónicas o sinérgicas entre señalizaciones hormonales permiten regular en forma precisa la respuesta de una planta a un determinado estrés. Se ha demostrado que la acumulación de AS endógeno antagoniza la activación de defensas dependientes de AJ (Koornneef et al., 2008) y a la vez este efecto es regulado por ET (Leon-Reyes et al., 2009). Existe una estricta regulación conservada durante la evolución entre las vías dependientes de AS y AJ. Sin embargo, existen datos contradictorios respecto a su interacción; mientras algunos autores afirman que existe una relación antagónica entre las mencionadas vías, debido al efecto supresor de AS sobre los genes inducidos por AJ (Koornneef et al., 2008), otros describieron efectos sinérgicos entre las mismas (Van Wees et al., 2000; Mur et al., 2006). 2. El ácido salicílico El ácido salicílico (AS) es la hormona vegetal más conocida por su papel central en la defensa (Delaney et al., 1994; Kawano et al., 2004; Vlot et al., 2009) y está involucrada en numerosos procesos vegetales como la geminación de semillas, desarrollo de plántulas, crecimiento celular, respiración, respuesta de estomas, senescencia, nodulación en fabáceas, producción de frutos y termogénesis (Vlot et al., 2008). Es un compuesto fenólico formado por un grupo hidroxilo unido a un anillo aromático que se 132 Capítulo 7 sintetiza a partir del corismato (metabolito primario) a través de la vía del isocorismato en dos pasos catalizados por las enzimas isocorismato sintasa (ICS) e isocorismato piruvato liasa (IPL); o a través de la fenilalanina que es transformada en ácido cinámico por la fenilalanina-amonio liasa (PAL) (Fig. 42; Garcion y Métraux, 2006; Vlot et al., 2009). Figura 42. Ruta biosintética del ácido salicílico y sus derivados a través de las vías del fenilpropanoide y del isocorismato en plantas superiores. Abreviaciones: PAL, fenilalanina amonio liasa; ICS, isocorismato sintasa; IPL, isocorismato piruvato liasa; BA2H, ácido benzoico-2hidroxilasa; SA, ácido salicílico (AS); SAGT, AS glucosiltransferasa; SAMT, AS metiltransferasa; aa, aminoácidos; SABP2, proteína de unión a AS 2; MES, metil esterasa; SGE, éster de glucosa saliciloil; SAG, AS O-β-glucósido; MeSA, metil salicilato; MeSAG, O-β-glucósido de metil salicilato. Traducciones: Phenylalanine, fenilalanina; Cinnamic acid, ácido cinámico; O-cumaric acid, ácido O-cumárico; Benzoate intermediates, intermediarios benzoatos; Chorismate, corismato; Isochorismate, isocorismato; SA-aa conjugates, conjugados de AS-aa. Tomado de Vlot et al., 2009. El AS participa como molécula señal en la inducción de una vía de defensa que proporciona protección sistémica, perdurable y contra una amplia gama de fitopatógenos, conocida como resistencia sistémica adquirida o SAR (systemic acquired resistance; Delaney et al., 1994; Durrant y Dong, 2004). La infección de las plantas por distintos fitopatógenos resulta en un aumento de los niveles de AS, tanto en el sitio de la infección 133 Capítulo 7 como en tejidos distantes (Vlot et al., 2008). Esta respuesta parece requerir la síntesis, en el sitio de la infección, de un compuesto volátil llamado metil-salicilato (MeSA). Santner et al. (2009) sugieren que el MeSA se mueve entonces a otras partes de la planta, incluso a veces hacia plantas vecinas, en donde es convertido nuevamente en AS por la proteína de unión a AS, SABP2 (salicylic acid biding protein 2). Muchos de los detalles de la señalización y percepción del AS no han sido elucidados aún; no obstante, está claro que la respuesta de AS depende de una proteína NPR1 (nonexpresor of PR genes). Cuando aumentan los niveles de AS, NPR1 se transloca al núcleo donde promueve la transcripción de una gran familia de genes relacionados a patogénesis llamados PR (pathogenesis related). Algunas proteínas PR tienen actividad antimicrobiana, pero, en general, la función de estas proteínas no ha sido claramente definida (Santner et al., 2009). Así como la SAR, dependiente de AS, es disparada luego de la infección por un patógeno, existe una vía dependiente de AJ/ET llamada resistencia sistémica inducida o ISR (induced systemic resistance) que es activada por rizobacterias no patogénicas, como es el caso de las PGPB (Van Wees et al., 2001; Pieterse et al., 2009). Sin embargo, se ha informado que las bacterias del género Azospirillum (A. lipoferum y A. brasilense) son capaces de producir sideróforos del grupo de los catecoles bajo condiciones limitantes de hierro y entre éstos se encuentra el AS (Saxena et al., 1986; Shah et al., 1992; Tortora et al., 2011). Por tal motivo, se ha propuesto que las bacterias productoras de AS podrían inducir mecanismos de defensa en plantas mediante esta vía de señalización, a pesar del controversial rol de AS producido por las PGPB en la resistencia sistémica inducida (Siddiqui y Shaukat, 2005; Cornelis y Matthisj, 2007). Sin embargo, Van Wees et al. (2000) han demostrado que las vías de SAR e ISR son compatibles y que su activación 134 Capítulo 7 simultanea resultó en un efecto aditivo a nivel de la protección inducida contra Pseudomona syringae pv. tomato. Entonces, el AS sintetizado por bacterias tiene una doble función, ya que puede actuar como sideróforo, mejorando la nutrición vegetal y disminuyendo la disponibilidad del hierro para los organismos invasores (Tortora et al., 2011; 2012), o como molécula señal induciendo en las plantas una resistencia sistémica de amplio espectro (Delaney et al., 1994; Van Wees et al., 1997; 2000). 3. El ácido indol-3-acético La principal auxina natural es el ácido indol-3-acético (AIA). El AIA está implicado en prácticamente todos los aspectos del crecimiento y desarrollo de las plantas, así como en las respuestas de defensa. Entre otros procesos, promueve la elongación y división celular, la formación de raíces adventicias, induce el crecimiento en tallos y coleoptilos, favorece la dominancia apical (espigamiento), retarda la absición de hojas, flores y frutos jóvenes y es un regulador central en formación del brote floral y desarrollo del fruto (Taiz y Zeiger, 2002). Esta diversidad de funciones se refleja en la extraordinaria complejidad de sus vías de síntesis, transporte y señalización. Se han propuesto cinco vías principales para la biosíntesis vegetal de AIA: una independiente del triptófano (Trp) y cuatro vías dependientes de Trp. Las vías Trp-dependiente han sido denominadas a partir de sus precursores: (i) indol-3-acetamida (IAM), (ii) ácido indol-3-pirúvico (IPA), (iii) la triptamina (TAM) y (iv) indol-3-acetaldoxima (IAOX) (Fig. 43; Mano y Nemoto, 2012). Al menos en Arabidopsis thaliana, los estudios indican que estas vías tienes funciones entrecruzadas, porque las plantas deficientes en cualquiera de ellas presentan deficiencias de crecimiento, y todo esto sugiere que los niveles de auxina son altamente regulados, lo que es coherente con su papel central en el crecimiento vegetal (Mano y Nemoto, 2012). 135 Capítulo 7 Figura 43. Ruta biosintética del ácido indol-3-acético en plantas superiores a través de la vía independiente del triptófano (Trp) y las cuatro vías Trp-dependientes: (i) el indol-3-acetamida (IAM), (ii) el ácido indol-3-pirúvico (IPA), (iii) la triptamina (TAM) y (iv) el indol-3-acetaldoxima (IAOX). Abreviaciones: IAA, ácido indol-3-acético (AIA); IAD, indol-3-acetaldehído; IAM, indol-3-acetamida; IAN, indol-3-acetonitrilo; IAOX, indol-3-acetaldoxima; IPA, ácido indol-3-pirúvico. Las flechas verdes indican la ruta de síntesis del triptófano en el cloroplasto. Una flecha negra discontinua delgada indica la ruta de biosíntesis de AIA independiente de Trp. Las flechas azules indican los pasos de la ruta biosintética de AIA Trp-dependiente para los que el gen y su función enzimática son conocidos. Las flechas rojas indican las rutas biosintéticas del indol-alcaloide y la serotonina. Las flechas de color ocre indican la vía de síntesis específica de especies Brassicaceae. Las letras mayúsculas en cursiva muestran los genes implicados en el proceso de síntesis y las letras minúsculas en cursiva indican los genes bacterianos implicados. Tomado de Mano y Nemoto, 2012. Una vez sintetizada, la auxina se distribuye por toda la planta a través de un sofisticado sistema de transporte de célula a célula, de manera tal que ésta será sintetizada localmente o en gradiente, de acuerdo a los requerimientos de la planta. Por ejemplo, el 136 Capítulo 7 inicio de las hojas en el flanco de la yema apical requiere acumulación local de la auxina en el lugar de formación del primordio del órgano (Taiz y Zeiger, 2002). La fuente primaria de auxinas exógenas en plantas superiores proviene de la flora microbiana rizosférica. Muchas especies bacterianas, como Azospirillum brasilense, son capaces de sintetizar auxinas y se observó que hay un alto grado de similitud entre las vías biosintéticas de AIA en plantas y bacterias (Spaepen et al., 2007). Las vías de síntesis bacterianas también se clasificaron en base a su dependencia del precursor Trp; existen 4 vías Trp-dependiente: (i) la ruta del indol-3-acetonitrilo (IAN), (ii) indol-3-acetamida (IAM), (iii) indol-3-piruvato (IPyA) y (iv) triptamina (TAM), así como una vía Trpindependiente o vía del antranilato (Fig. 44; Spaepen et al., 2007). Las 4 últimas fueron descriptas en Azospirillum (Spaepen et al., 2007; Spaepen y Vanderleyden, 2011). IAN IAM IPyA TAM Figura 44. Ruta biosintética del ácido indol-3-acético en bacterias a través de la vía independiente del triptófano (Trp) y las vías Trp-dependientes: IAN, indol-3-acetonitrilo; IAM, indol-3- acetamida; IPyA, indol-3-piruvato; TAM, triptamina. El intermedio subrayado con una línea discontinua hace referencia al nombre de la vía. Otras abreviaciones: IAAld, indol-3acetaldehído; IPDC, indol-3-piruvato descarboxilasa. Tomado de Spaepen et al., 2007. 137 Capítulo 7 3.1. Reciprocidad de señalización de AIA entre plantas y bacterias La mayoría de los sustratos para la actividad microbiana en el rizósfera derivan de las plantas; estos pueden representar hasta el 40% de la materia seca producida por las plantas, dependiendo de la especie vegetal y de las condiciones ambientales (Lambrecht et al., 2000). Los sustratos incluyen aminoácidos, ácidos orgánicos, azúcares, vitaminas, nucleótidos, enzimas y otros metabolitos de plantas, incluyendo las auxinas. La presencia de AIA de origen vegetal en la rizósfera podría ser suficiente para que A. brasilense aumente la expresión del gen ipdC, lo que aumentará la síntesis bacteriana de AIA, debido a que hay cantidades suficientes de precursores disponibles, como Trp (Vande Broek et al., 1999). El AIA bacteriano estimulará entonces la proliferación de las raíces y pelos radiculares de las plantas. Sin embargo, se sabe que por encima de cierta concentración de AIA suministrado exógenamente, el desarrollo radicular es inhibido (Fallik et al., 1994). Por lo tanto, la producción de AIA en las raíces colonizadas por A. brasilense es controlado por diversos factores. Algunos autores sugieren que la regulación podría estar en el nivel de la concentración del precursor de AIA, y habría controles adicionales a nivel del transcriptoma regulando la expresión de genes involucrados en sus vías de síntesis; además, la compensación de niveles muy altos de AIA estaría a nivel de la regulación de su metabolismo (Lambrecht et al., 2000; Vande Broek et al., 2005). 4. Objetivo del capítulo El objetivo de este capítulo fue evaluar la capacidad de Azospirillum brasilense de modular la síntesis de ácido salicílico y ácido indol-3-acético en plantas de frutilla. Para ello se evaluó la evolución temporal de la producción de ambas fitohormonas en plantas de frutilla inoculadas con A. brasilense REC3 y controles no-inoculados 138 Capítulo 7 mediante cromatografía líquida de alta resolución en fase reversa (RP-HPLC: reverse phase- high pressure liquid cromatography). MATERIALES Y MÉTODOS 1. Material vegetal y condiciones de cultivo Se utilizaron plantas de frutilla (Fragaria ananassa, Duch) var. `Camarosa´ micropropagadas in vitro, que se obtuvieron del Banco de Germoplasma Activo de Frutilla de la Universidad Nacional de Tucumán. Todo el ensayo fue llevado a cabo en condiciones de esterilidad y se controló la ausencia de microorganismos en las plantas saneadas por cultivo in vitro sembrando un macerado de las mismas en placas de Petri con medio LB (composición capítulo 3) y se incubaron a 30 °C por 120 h. Cumplido este tiempo, en aquellos lotes de plantas en que no se observó desarrollo microbiano fueron considerados para los ensayos. Las plantas se cultivaron en macetas desinfectadas con sustrato estéril (humus: perlome; 2:1) durante tres meses; al cabo de este tiempo se lavaron sus raíces con agua destilada estéril y se trasplantaron a bandejas de plástico con solución nutritiva de Hoagland estéril modificada según Epstein (1972) y aireación constante (pO2= 20 KPa). Las mismas se mantuvieron en cámara de crecimiento durante 10 días a 28 °C, humedad relativa 70% y 16 h de fotoperiodo (250 µmol fotones m2 s−1). 139 Capítulo 7 2. Inoculación y diseño experimental El inóculo se preparó sembrando una colonia aislada de Azospirillum brasilense REC3 en medio NFb líquido (composición en capítulo 3) y se incubó durante 48 h a 28 °C y 600 rpm. Concluido el tiempo de incubación, se ajustó la concentración de la suspensión bacteriana en aproximadamente 106 UFC·ml-1 (DO560 =0,2). Se inocularon 21 plantas de frutilla (3 plantas por cada tiempo de muestreo) en cultivo hidropónico sumergiendo las raíces en la suspensión de A. brasilense REC3 (106 CFU·ml-1) durante 20 min y luego se colocaron nuevamente en las bandejas de plástico con solución hidropónica estéril y aireación constante. Por otro lado, se sumergieron las raíces de 21 plantas durante 20 min en agua destilada estéril (control). Las mediciones de AS y AIA por RP-HPLC se realizaron en las 0, 12, 24, 48, 72, 96 y 120 horas post-inoculación (hpi), por triplicado. El ensayo completo se realizó 2 veces con diferentes lotes de plantas de la misma variedad: Camarosa´. 3. Obtención de los fluidos peciolares Para la cuantificación de AS y AIA, se colectó el fluido de los pecíolos de tres hojas centrales y completamente expandidas de cada planta por extrusión de los mismos y con ayuda de una micropipeta (20 µl) provista de un capilar fino. Los fluidos peciolares fueron mezclados inmediatamente en 1 ml de etanol absoluto a 4 °C y acidificados con HCl concentrado a pH 2,0 para producir la precipitación de azúcares y otros compuestos de alto peso molecular. Luego se centrifugó a 10.000 rpm durante 15 min y el sobrenadante se recuperó en un nuevo microtubo y se llevó a sequedad bajo vacío para concentrarlos utilizando un equipo Model SVC 200 Speed Vac Sample Concentrator (Savant Instruments 140 Capítulo 7 Co., EEUU) a fin de obtener el peso seco de cada muestra. Estas se resuspendieron con 100 µl de metanol 20% (v/v) para el análisis por cromatografía líquida. 2. Cuantificación simultánea de AS y AIA por RP-HPLC Los extractos de los fluidos peciolares se analizaron mediante cromatografía liquida de alta resolución en fase reversa (RP-HPLC) utilizando una columna de fase reversa C18 (Prodigy 5 ODS-2, Phenomenex, EEUU) en un gradiente de ácido acético (CH3COOH) 0,1 % (solvente A) y metanol (CH3OH) 100% (solvente B), ambos con ácido trifluoroacético 0,01% (v/v). La rampa del gradiente se realizó en 20 min desde A:B 80:20 (v/v) hasta B 100%, seguida de una fase isocrática con B 100% (v/v) durante 10 min más; ambos pasos se realizaron a una velocidad de flujo de 0,5 ml·min-1. La elución de la columna fue monitoreada midiendo la absorbancia a dos longitudes de onda: λAIA 280 nm y λAS 303 nm. Las cuantificaciones se realizaron mediante el método del estándar externo utilizando curvas de calibración (curva de AS puro de 0,025 µg a 5 µg; curva de AIA puro de 0,25 µg a 5 µg). Las fracciones conteniendo AS fueron seleccionadas de acuerdo al tiempo de retención de estándares puros de AS. Estas se colectaron, se secaron al vacío, se resuspendieron en CH3OH 20% (v/v) y se cuantificaron mediante espectrometría de fluorescencia (λex= 296 nm, λem= 408 nm) en un espectrofluorómetro (Multidimensional Fluorescence Spectrometer equipado con software VINCI; ISS, EEUU). Cada valor obtenido correspondió al promedio de 20 lecturas de fluorescencia adquiridas en 20 seg. En el caso de AIA, las concentraciones fueron determinadas directamente mediante la integración del área del pico correspondiente, obtenido del cromatograma y posterior comparación con la curva patrón. 141 Capítulo 7 El contenido de AS o AIA se expresó en ng·mg-1 de peso seco (PS) de fluído peciolar. Además se calculó la tasa de cambio para referir los resultados obtenidos en plantas inoculadas a su control no-inoculado, para cada tiempo de ensayo, de acuerdo a la siguiente fórmula siendo T1= control y T2 = A. brasilense REC3: ( ) Los valores obtenidos para cada una de las muestras analizadas corresponden al promedio de tres repeticiones y se utilizaron tres plantas por cada tratamiento. RESULTADOS 1. Patrones puros de AS y AIA En las Figuras 45, 46 y 48 se muestran los cromatogramas obtenidos a partir de los estándares puros de AS, AIA y una mezcla de ambos, respectivamente. Se demostró que fue posible llevar a cabo la cuantificación simultánea de ambas hormonas, utilizando la técnica aquí descripta, debido a que los compuestos analizados fueron eluídos en fracciones diferentes. Además, en la Fig. 47 se muestra el cromatograma de la mezcla de triptófano (Trp), AIA y ácido indol-3-butírico (AIB) confirmando la elución de AIA en una única fracción separado de compuestos muy similares. 142 Capítulo 7 Figura 45. Cromatograma del patrón de AS analizado mediante RP-HPLC. Condiciones: columna Prodigy C18 (Phenomenex); en gradiente de CH3OH 100% (A): CH3COOH 0,1 % (B) (v/v) (con TFA 0,01%) desde 20:80 v/v (gradiente 20 min) hasta metanol 100% (isocrático 10 min); velocidad de flujo 0,5 ml min-1. λ= 280 nm; λ= 303 nm; ---- A: CH3COOH 0,1%; ---- B: CH3OH 100% Figura 46. Cromatograma del patrón de AIA analizado mediante RP-HPLC. Condiciones: columna Prodigy C18 (Phenomenex); en gradiente de CH3OH 100% (A): CH3COOH 0,1 % (B) (v/v) (con TFA 0,01%) desde 20:80 v/v (gradiente 20 min) hasta metanol 100% (isocrático 10 min); velocidad de flujo 0,5 ml min-1. λ= 280 nm; λ= 303 nm; ---- A: CH3COOH 0,1%; ---- B: CH3OH 100% 143 Capítulo 7 Figura 47. Cromatograma de la mezcla de patrones de Trp, AIA y AIB analizado mediante RPHPLC. Condiciones: columna Prodigy C18 (Phenomenex); en gradiente de CH3OH 100% (A): CH3COOH 0,1 % (B) (v/v) (con TFA 0,01%) desde 20:80 v/v (gradiente 20 min) hasta metanol 100% (isocrático 10 min); velocidad de flujo 0,5 ml min-1. λ= 280 nm; λ= 303 nm; ---- A: CH3COOH 0,1%; ---- B: CH3OH 100% Figura 48. Cromatograma de la mezcla de patrones de AIA y AS analizado mediante RP-HPLC. Condiciones: columna Prodigy C18 (Phenomenex); en gradiente de CH3OH 100% (A): CH3COOH 0,1 % (B) (v/v) (con TFA 0,01%) desde 20:80 v/v (gradiente 20 min) hasta metanol 100% (isocrático 10 min); velocidad de flujo 0,5 ml min-1. λ= 280 nm; λ= 303 nm; ---- A: CH3COOH 0,1%; ---- B: CH3OH 100% 144 Capítulo 7 2. Contenido de AS en plantas de frutilla inoculadas con A. brasilense y controles Las plantas de frutilla inoculadas con A. brasilense REC3 mostraron un aumento en el contenido de AS en las 12, 24 y 48 hpi respecto a los controles no inoculados; notando un máximo en las 24 horas post-inoculación (hpi) con un valor equivalente a 164,7 ng de AS ·mg-1 peso seco () de fluido peciolar (Fig. 49). El mayor incremento en el nivel relativo de AS en plantas inoculadas respecto a los controles noinoculados fue igual a 107 % en las 24 hpi (Fig. 50). También se observó que luego de las 72 hpi hubo una disminución del nivel relativo de AS (menores a 40%) indicando que en esos tiempos las plantas controles e inoculadas presentaban contenidos similares de esta hormona (Fig. 50). Cuantifícación de AS en plantas frutilla CONTROL 200 REC3 ng de AS ·mg-1 PS 180 160 140 120 100 80 60 40 20 0 0 12 24 48 72 96 120 hpi Figura 49. Contenido de ácido salicílico en el fluido peciolar de plantas de frutilla inoculadas con A. brasilense REC3 y plantas control no inoculadas. hpi: horas post-inoculación. 145 Capítulo 7 120 % Tasa de cambio 100 80 60 40 107 % 20 0 0 12 24 48 72 96 120 hpi Figura 50. Nivel relativo de la concentración de AS en plantas de frutilla inoculadas con A. brasilense REC3 respecto a plantas control no inoculadas. hpi: horas post-inoculación. %= (T2-T1)/T1)*100; T1: valor de [AS] en plantas control; T2: valor de [AS] en plantas REC3. 3. Contenido de AIA en plantas de frutilla inoculadas con A. brasilense y controles Se observó también un incremento en el contenido de AIA en los fluidos peciolares de las plantas inoculadas con A. brasilense respecto de las plantas controles a partir de las 12 hpi y con una tendencia creciente hasta las 120 hpi. Las plantas inoculadas presentaron un máximo de 404,5 ng de AIA ·mg-1 peso seco (PS) de fluido peciolar en las 120 hpi (Fig. 51) y el análisis de los porcentajes de tasa de cambio mostró una misma tendencia con un incremento de AIA respecto al control equivalente a 136 % en el mismo tiempo (Fig. 52). Sin embargo, se observó que a las 12 hpi también hubo un incremento significativo del nivel relativo de AIA igual a 104 % (Fig. 52). Aunque los valores de AIA fueron mayores en plantas inoculadas en todos los tiempos evaluados, en las 72 hpi se observó que los valores del control e inoculado estaban más próximos, y por lo tanto, hubo una disminución en la tasa de cambio en este tiempo (50%). 146 Capítulo 7 Cinética de producción de AIA en plantas frutilla CONTROL REC3 ng de AIA ·mg-1 PS 500 400 300 200 100 0 0 12 24 48 72 96 120 hpi Figura 51. Niveles de ácido salicílico en plantas de frutilla inoculadas con A. brasilense REC3 y plantas control no inoculadas. hpi: horas post-inoculación. % Tasa de cambio 160 140 120 100 80 60 136 % 40 20 0 0 12 24 48 72 96 120 hpi Figura 52. Nivel relativo de la concentración de AIA en plantas de frutilla inoculadas con A. brasilense REC3 en comparación con plantas control no inoculadas. hpi: horas post-inoculación. %= (T2-T1)/T1)*100; T1: valor de [AIA] en plantas control; T2: valor de [AIA] en plantas REC3. En general, las plantas no inoculadas utilizadas como control, no presentaron modificaciones significativas en los niveles endógenos de AS o AIA. 147 Capítulo 7 DISCUSIÓN A fin de establecer si el AS y/o AIA están implicados entre los mecanismos disparados en plantas de frutilla por la inoculación con Azospirillum brasilense, se estudió la evolución temporal de estas hormonas en plantas inoculadas y controles no-inoculados a diferentes horas post-inoculación. En este trabajo se observó un rápido aumento en los niveles de AS y AIA luego de la inoculación con la cepa Azospirillum brasilense REC3; se observaron incrementos de ambas homonas a partir de las 12 hpi. El máximo incremento de los niveles de AS en las plantas inoculadas respecto a las plantas control ocurrió en las primeras 24 h después de la inoculación. Por su lado, el contenido de AIA presentó un incremento significativo de su nivel relativo al control en las 12 hpi mientras que el máximo de los tiempos evaluados se observó a las 120 hpi (en concordancia con la tendencia creciente observada). Se consideró que el rápido aumento de los niveles de ambas en el fluido peciolar ocurrió debido a la liberación de AS y AIA que se encuentra conjugado en los tejidos vegetales y no por una síntesis de novo de éstas hormonas, requiriendo la última más tiempo. Se conoce que en las plantas ambos ácidos se encuentran conjugados con azúcares y aminoácidos; de ésta manera, evitan la degradación y permiten su almacenamiento, transporte y homeostasis (Bari y Jones, 2009). Esta explicación es soportada por la ausencia de una expresión aumentada de la enzima de síntesis de AS, PAL, como se muestra en el siguiente capítulo. La conjugación reversible de hormonas en las plantas es un modo esencial de regulación de los niveles endógenos de las fitohormonas biológicamente activas. Los conjugados de ácido salicílico, auxinas, giberelinas y citocininas son ampliamente reconocidos por su función de almacenamiento que sirve para la rápida movilización o 148 Capítulo 7 inmovilización de estas fitohormonas, dependiendo de una amplia variedad de factores ambientales, de desarrollo y fisiológicos (Kleczkowski et al., 1995). La mayor parte del contenido total de auxinas en plantas se encuentra en su forma conjugada y constituye un importante mecanismo regulatorio para la activación e inactivación de AIA (Bari y Jones, 2009). En Arabidopsis thaliana se ha descripto que existen varios genes GH3 que codifican AIA-amido sintasas responsables de la síntesis de conjugados de AIA con los aminoácidos (aa) Ala, Asp, Phe y Trp, los cuales ayudan a mantener la homeostasis de auxina mediante la conjugación del exceso de AIA con aa (Staswick et al., 2005). Además, se ha demostrado que el producto del gen GH3.5 es un modulador dual de las vías de señalización de AS y auxinas durante la infección por patógenos (Zhang et al., 2007). La enzima GH3.5 es capaz de llevar a cabo también la conjugación AS-aa, afectando la funcionalidad de AS, y por lo tanto, la resistencia a enfermedades (Staswick et al., 2005), lo cual revela la existencia de una fina regulación de ambas vías a este nivel. Por otro lado, el AS producido por la planta también es convertido en AS O-βglucósido (SAG: salicylic acid O-β-glucoside) o en éster de glucosa saliciloil (SGE: salicyloyl glucose ester), a través de la AS glucosiltransferasa (SAGT: salicylic acid glucosyltransferase) inducida por patógenos (Dean y Mills, 2004; Dean et al., 2005; Dean y Delaney, 2008). De acuerdo a lo informado por Wildermuth et al., (2001), el AS es sintetizado en los cloroplastos; mientras que la enzima SAGT está localizada en el citosol (Dean et al., 2005). Entonces, el SAG sería transportado desde el citosol hasta las vacuolas, donde es almacenado en su forma inactiva pudiendo ser convertido nuevamente en AS (Hennig et al., 1993; Dean et al., 2005). 149 Capítulo 7 Es importante remarcar que existe otro nivel de diálogo cruzado entre estas hormonas: se ha observado que el AS reprime la expresión local y sistémica de genes que responden a auxinas para promover la resistencia a patógenos (Wang et al., 2007). Estos genes incluyen un importador auxina AUX1, un exportador auxina PIN7, los receptores de auxinas TIR1 y AFB1, y genes inducidos por auxinas pertenecientes a las familias SAUR y Aux/IAA (Wang et al., 2007). Del mismo modo, se encontró que la mayoría de estos genes auxina-inducibles también fueron reprimidos en los tejidos sistémicos después de la inducción de SAR, indicando que la respuesta SAR implica la regulación negativa de genes de respuesta a auxinas. Sin embargo, los niveles de auxina libre (no conjugada) no cambiaron después del tratamiento con AS (Wang et al., 2007). Por otro lado, la acumulación de auxina podría causar la activación de expansinas que debilitan la pared celular vegetal de modo tal de promover la extensibilidad de las células y el crecimiento vegetal (Ding et al., 2008). Sin embargo, el debilitamiento de las paredes celulares debido a elevados niveles de auxina, reduciría la capacidad del huésped para defenderse, favoreciendo la susceptibilidad durante el ataque por patógenos (Navarro et al., 2006; Ding et al., 2008); en consecuencia, ante una infección por patógenos se activa la respuesta SAR y el AS reprime la señalización de AIA con el fin de reducir la susceptibilidad vegetal (Wang et al., 2007). En sintonía con los estudios que muestran una relación antagónica entre AS y AIA, en este trabajo observamos que también habría una interacción entre estas hormonas: los resultados obtenidos mostraron una tendencia creciente en los niveles de AIA en plantas inoculadas en todos los tiempos, no obstante los valores promedios alcanzaron sus valores máximos luego de las 72 hpi que coincide con la finalización del pico de AS cuando los valores de éste disminuyen. 150 Capítulo 7 Estos resultados sugieren que habría interacción entre estas hormonas pero como es ampliamente conocido que cuando ocurre la colonización de diferentes especies de plantas con bacterias PGPB, se desencadena la activación de las respuestas de defensa del tipo ISR dependientes de AJ/ET, que conducen a la supresión de las respuestas de defensa dependientes de AS, permitiendo la efectiva colonización por parte de las bacterias benéficas para las plantas (Pieterse et al., 2009; 2012). Otro mecanismo regulador negativo de la señalización de AS es la producción de deposiciones de calosa que induce la activación de la vía de defensa dependiente del AJ (Nishimura et al., 2003). Esto explicaría la disminución de AS a las 72 hpi coincidente con el máximo de deposiciones de calosa observado en el capítulo 5. Los niveles de AIA en plantas inoculadas con A. brasilense REC3 fueron significativamente mayores que en las plantas control en todos los tiempos ensayados, excepto a las 72 hpi. La cepa REC3 fue seleccionada en base a su capacidad productora de AIA, que induce el crecimiento radicular (mejorando la absorción de nutrientes), y que a su vez estimularía la síntesis de AIA vegetal, lo que explicaría los incrementos observados. Sin embargo, como se mencionó anteriormente, cantidades excesivas de AIA pueden resultar deletéreos para la planta, inhibiendo el crecimiento (Fallik et al., 1994); por ello, las plantas modulan el contenido endógeno de AIA libre, siendo este control esencial para la promoción del crecimiento (Spaepen et al., 2007; Pieterse et al., 2012). La compensación de los niveles de AIA parecería ocurrir a las 72 hpi en nuestros resultados, pero se requerirían más estudios para analizar si esta regulación ocurre a nivel metabólico o de regulación génica. Además, las bacterias también podrían regular la concentración de AIA por conjugación con aa, pero hasta el momento sólo se ha descripto una especie PGPB, 151 Capítulo 7 Pseudomonas savastanoi, capaz de formar conjugados AIA-aa (Glass y Kouge, 1988; Spaepen y Vanderleyden, 2011). CONCLUSIONES Fue posible realizar la cuantificación simultánea de ácido salicílico y ácido indol-3acético, dos importantes hormonas vegetales, en plantas de frutilla por cromatografía liquida de alta resolución en fase reversa. El contenido de ácido salicílico en plantas inoculadas con Azospirillum brasilense REC3 fue mayor que en plantas controles en las 12, 24 y 48 hpi con un máximo 164,7 ng de AS·mg-1 peso seco de fluido peciolar en las 24 horas post-inoculación. Los niveles de ácido indol-3-acético mostraron una tendencia creciente con valores mayores en plantas inoculadas con Azospirillum brasilense REC3, respecto a plantas controles no-inoculadas. El máximo valor determinado fue de 404,5 ng de AIA·mg-1 peso seco de fluido peciolar al final del experimento, 120 hpi. Existiría un diálogo cruzado entre ácido salicílico y ácido indol-3-acético en plantas de frutilla var. ˋCamarosa´ inoculadas con la cepa PGPB Azospirillum brasilense REC3. 152 Capítulo 8 Capítulo 8 153 Capítulo 8 Análisis cuantitativo de la expresión de genes involucrados en la interacción Azospirillum-frutilla INTRODUCCIÓN Las plantas han desarrollado una gran variedad de estrategias defensivas para poder sobrevivir a los continuos ataques de los microorganismos fitopatógenos. La rapidez y eficiencia con la que se desencadenen los mecanismos de defensa determinarán si la interacción de la planta con el patógeno es compatible (planta susceptible) o incompatible (planta resistente) (Jones y Dangl, 2006). Las bacterias promotoras del crecimiento vegetal (PGPB) pueden estimular el crecimiento ya sea directamente por fijación de nitrógeno, producción de fitohormonas, solubilización de minerales, etc, o indirectamente protegiéndolas del ataque de diferentes patógenos mediante la síntesis de compuestos con actividad antimicrobiana como sideróforos, enzimas o antibióticos, o bien, induciendo mecanismos de resistencia sistémicos (Lugtenberg y Kamilova, 2009). 1. Genes involucrados en las respuestas de defensa de las plantas de frutilla La resistencia sistémica inducida (ISR) por las bacterias PGPB se caracteriza por conferir a las plantas una capacidad incrementada para resistir posibles ataques de patógenos, proceso conocido como „priming‟ (Conrath et al. 2006; Ahn et al., 2007). La ISR se caracterizó como una vía dependiente de la señalización por ácido jasmónico (AJ) y etileno (ET), por lo que la inducción de esta vía de defensa está relacionada con un elevado nivel de expresión de los genes luego de la infección con el patógeno (Pieterse et al., 2012). Por otro lado, ante el ataque por un patógeno, las plantas pueden responder mediante la activación de la resistencia sistémica inducida (SAR), que es una vía de 154 Capítulo 8 defensa mediada por el ácido salicílico (AS). Entre las modificaciones bioquímicas y moleculares que se inducen en la planta después del ataque del patógeno se encuentran la producción de EROs, el reforzamiento de las paredes celulares a través de la acumulación de lignina y calosa (Ramamoorthy et al., 2000; Ahn et al., 2007) y el aumento en la síntesis de proteínas de defensa relacionadas a la patogénesis (PRs), quitinansas y glucanasas (Timmusk and Wagner, 1999; Ramamoorthy et al., 2000). En frutilla algunos genes codificantes de este tipo de proteínas se identifican como: FaPR1, FaChi2.1, FaChi2.2, FaBG2-3, FaOGBG5 (Yong et al., 2009; Martínez Zamora et al., 2012). Si bien la vía de defensa mediada por el AS, o SAR, está asociada a la interacción de las plantas con microorganismos patógenos, muchos autores han demostrado que en algunas interacciones planta-PGPB existiría un aumento en los niveles endógenos de AS y una acumulación de la proteína de defensa PR1 (Maurhofer et al., 1994; Chen et al., 1999; De Meyer y Hofte 1999), mecanismos indicadores de la respuesta SAR. 2. Genes involucrados en la síntesis, percepción y transducción de señal del etileno El etileno (ET) es una fitohormona que participa en diversos procesos del desarrollo vegetal tales como la maduración de frutos, la epinastía foliar, la germinación, favorece la senescencia de las hojas (balance hormonal con citoquininas) y la abscisión de hojas y frutos (balance hormonal con auxinas) (Taiz y Zeiger, 2002). También juega un papel importante en la señalización de las interacciones plantasbacterias: en la formación de nódulos en la simbiosis rizobios/leguminosas (Penmetsa y Cook, 1997) y en la defensa de patógenos (Ohme-Takagi et al., 2000). La diversidad de funciones del ET y su especificidad de acción implica una gran complejidad en su vía de señalización (Chen et al., 2005). 155 Capítulo 8 El ET se forma a partir del aminoácido metionina a través de S-adenosilmetionina (SAM), que se convierte en ácido 1-amino-ciclopropano-1-carboxílico (ACC) por la enzima ACC sintasa. El ACC es posteriormente hidrolizado por la ACC oxidasa (ACO) (Wang et al., 2002). Esta hormona es percibida por una familia de receptores de membrana integral similar a las histidinas quinasas bacterianas de dos componentes. En Arabidopsis thaliana hay al menos cinco receptores de etileno: ETR1 y ETR2, receptor de etileno 1 y 2; ERS1 y ERS2, sensor de respuesta de etileno 1 y 2; y EIN4, etileno insensible 4 (Guo y Ecker, 2004). Trainotti et al. (2005) han reportado homólogos de estos receptores en plantas de frutilla (F. ananassa cv. Chandler): FaERS1, FaETR1 y FaETR2 así como también dos enzimas biosintéticas de ET: FaACO1 y FaACO2. La señalización dependiente de etileno está regulada por la proteína CTR1 (respuesta triple constitutiva 1). En condiciones normales (atmosfera de aire), los receptores de etileno mantienen a CTR1 en un estado activo que sirve para reprimir las respuestas de ET, como se muestra en la Figura 53. En presencia de etileno (C2H4), la represión se libera y la unión de ET inactiva los receptores, de modo tal que inactiva CTR1. Y como resultado, EIN2 se activa y se inicia una cascada transcripcional que implica a los factores de transcripción EIN3/EIL y ERF. Ambas familias de factores de transcripción están implicadas en la regulación de las respuestas de etileno. El nivel de proteína de EIN3 es más bajo en ausencia de ET (que en la presencia de ET), debido a la degradación por la vía de la ubiquitina-proteosoma. La Figura 53 también incorpora componentes sobre los que se han reportado datos contradictorios, como un módulo de funcionamiento de MAPK cuesta abajo de CTR1 y una vía de señalización de dos componentes (AHP y ARR) que funcionarían independientemente de la vía mediada por CTR1 (Chen et al. 2005). 156 Capítulo 8 AIRE C2H4 Receptores de etileno Transportadores de membrana EIN3/EIL factores de transcripción ERF factores de transcripción Respuestas de etileno Figura 53. Modelo de la transducción de señal del etileno que incorpora características bioquímicas de los componentes de la ruta de ET. Los dominios de proteína solubles se muestran como círculos y las estructuras transmembrana se muestran como líneas. Adaptado de Chen et al., 2005. 3. Genes involucrados en la depuración de especies reactivas del oxígeno La enzima ascorbato peroxidasa (APX) existe al menos en tres isoformas en las plantas superiores: citosólicas, del estroma y unidas a la membrana tilacoide. La APX citosólica (APXc) de frutilla ha sido hallada y caracterizada por Kim y Chung (1998). Ésta es una enzima depuradora de peróxido de hidrógeno con una alta especificidad por el ascorbato, agente reductor que cataliza la siguiente reacción: 2 ascorbato + H2O 2 2 monodehidroascorbato + 2 H2O En distintas especies de plantas sometidas a varios tipos de estrés como la sequía (Mittler y Zilinskas, 1994), el ozono (Kubo et al., 1995) y la infección microbiana (Hammond-Kosack y Jones, 1996) se ha observado el aumento de los 157 Capítulo 8 niveles de ARNm de la APX y, en menor grado, de su actividad. La APX citosólica de frutilla es codificada por el gen FaAPXc y fue descripta por Kim y Chung (1998). 4. Objetivo del capítulo El presente capítulo tuvo como fin analizar cuantitativamente por PCR en tiempo real (RT-qPCR: real time -quantitative polymerase chain reaction) la expresión de los siguientes genes involucrados en la interacción Azospirillum-frutilla: FaGAPDH1 (gliceraldehído-3-fosfato deshidrogenasa), FaActin (Actina-1), FaPR1 (proteína PR1), FaChi2.1 (quitinasa CHI2.1), FaChi2.2 (quitinasa CHI2.2), FaOGBG5 (endo-β-1,3glucanasa), FaPAL3 (fenilalanina amonio-liasa 3), FaAPXc (ascorbato peroxidasa citosólica), FaEtr1(receptor de etileno ETR1), FaEin1(factor de transcripción EIN1), FaErs1 (sensor de respuesta de etileno ERS1), FaACO1 (ACC oxidasa1) y FaACO2 (ACC oxidasa2). Estos fueron evaluados luego de 24 h y 48 h post-inoculación. MATERIALES Y MÉTODOS 1. Material vegetal y condiciones de cultivo Se utilizaron plantas de frutilla (Fragaria ananassa, Duch) var. `Camarosa´ micropropagadas in vitro, que se obtuvieron del Banco de Germoplasma Activo de Frutilla de la Universidad Nacional de Tucumán. Las plantas se cultivaron en macetas desinfectadas con sustrato estéril (humus: perlome; 2:1) durante tres meses, al cabo de éste tiempo se lavaron sus raíces con agua destilada estéril y se trasplantaron a bandejas de plástico con solución nutritiva de Hoagland estéril modificada según Epstein (1972) y aireación constante (pO2= 20 KPa). Las mismas se mantuvieron en cámara de crecimiento durante 10 días a 28 °C, humedad relativa 70% y 16 h de fotoperiodo (250 µmol fotones m2 s−1). 158 Capítulo 8 2. Inoculación y diseño experimental El inóculo se preparó sembrando una colonia aislada de Azospirillum brasilense REC3 en medio NFb líquido (composición en capítulo 3) y se incubó durante 48 h a 28 °C y 600 rpm. Concluido el tiempo de incubación, se ajustó la concentración de la suspensión bacteriana en aproximadamente 106 UFC·ml-1 (DO560 = 0,2). Se inocularon 6 plantas de frutilla (3 plantas por cada tiempo de muestreo) en cultivo hidropónico sumergiendo las raíces en la suspensión de A. brasilense REC3 (106 CFU·ml-1) durante 20 min y luego se colocaron nuevamente en las bandejas de plástico con solución hidropónica estéril y aireación constante. Por otro lado, se sumergieron las raíces de 12 plantas control durante 20 min en agua destilada estéril. El análisis de la expresión génica se realizó en hojas de plantas control e inoculadas. Las muestras se tomaron en las 24 h y 48 h post-inoculación y fueron inmediatamente congeladas en nitrógeno líquido y almacenadas a -70 °C hasta su evaluación. 2. Extracción del ARN total y retrotranscripción del ARNm El ARN total se obtuvo a partir de 100 mg de hojas (peso fresco) usando el kit RNAqueous-4PCR (Ambion, EEUU). Las muestras de ARN crudo se trataron con DNasa I (Ambion, EE.UU.) para eliminar la contaminación de ADN genómico antes de la reacción de transcripción reversa. La cantidad y calidad del ARN total obtenido se determinó por espectrofotometría a 230 nm, 260 nm y 280 nm de longitud de onda (Sambrook et al., 1989). Las reacciones de retrotranscripción del ARN total (5 µg) se realizaron usando los cebadores Oligo(dT)18 y la retrotramscriptasa M-MuLV (Thermo, EEUU), para obtener el ADNc utilizado como molde en las reacciones de PCR. 159 Capítulo 8 4. Diseño de cebadores para RT-qPCR La Tabla 4 muestra los cebadores diseñados a partir de secuencias de Fragaria ananassa disponibles en GenBank (NCBI: National Center for Biotechnology Information) mediante el software Primer Express 3.0 (Applied Biosystems, EEUU). Tabla 4. Secuencias de los cebadores utilizados para el análisis de la expresión génica. Nombre del Primer FaGAPDH1 FaActin FaPR1 FaChi2.1 FaChi2.2 FaOGBG5 FaPAL3 FaAPXc FaETR1 FaEIN1 FaERS1 FaACO1 FaACO2 Secuencia del cebador directo Secuencia del cebador reverso GCCGAGGAGCTGCTCAGA GAACTTTTCCAACAGCCTTTGC Th* (° C) 59 CCCAGAAGAGCACCCAGTTC CACGATTAGCCTTGGGATTCA 59 TGGCCCTTATGGTGAAAACC CACAGCAGATGTGCCTGATAAGT 58 CGGCACCACCGGAAGTC TGAGCAAGAAATGCTGCAATCT 59 CCTCAGGGAAACAAACCATCA CGCAGATGGATTCCAACGT 58 CCTCGGTGTCCCAAACTCA CCACTTTTGCGCATTGGAA 59 TCGCCTACATTGACGATCCTT TTGCCTTAGCCTTTGCATCA 58 CGCTCACGGCGCTAACA GCTCCTTGATCGGCTCCAA 59 CAGTTTATGCGATTGGTGATGAA ACAGCATTCCCAACAACATTTAGA 59 GGTTTCAAACTCGACCATCCA TGCTCTGATGATCCTCCAGGTT 58 AACTGTTGCCATCGTGATGACT AGTGCTGTTGCACATGACACAA 58 AGCACCTTCTACCTCAAACACCTT CGTCGAGATCTGGGACTTCTG 58 GGGACTTGGGAAATGTTGGA 58 GGACTGGGAAAGCACCTTCTT Th: temperatura de hibridación * 5. PCR cuantitativa en tiempo real (RT-qPCR) La PCR cuantitativa en tiempo real (RT-qPCR) es una variante de la PCR convencional utilizada para amplificar y, simultáneamente, cuantificar de forma absoluta y/o relativa el producto de amplificación del ADN(c) con una mayor sensibilidad y precisión. La amplificación del ADNc se llevó a cabo en un termociclador 7500 RealTime PCR System (Applied Biosystems, EEUU), utilizando la master-mix iQ SYBR Green Supermix (BioRad, EEUU) que contiene el fluorocromo SYBR Green (λexcitación= 160 Capítulo 8 488 nm; λemisión= 522 nm). Cada reacción se realizó por triplicado y se incluyeron controles negativos (sin ADNc) en cada ocasión. Se determinó la eficiencia de amplificación de cada gen mediante la realización de curvas estándar con cada par de cebadores y concentraciones crecientes de ADNc (12,5; 25; 50 y 100 ng·µl-1). Siendo la Eficiencia (E) ideal igual a 2, que corresponde al 100%, se aplicaron las siguientes fórmulas, donde m corresponde a la pendiente de la recta: E = 10 -1/m % E = (E - 1)*100 Mediante el software BestKeeper (versión 1; Pfaffl et al., 2004) se determinó cuál de los genes endógenos (de referencia), FaGAPDH1 (gliceraldehído-3fosfato deshidrogenasa) o FaActin (Actina-1), era el más apropiado para el análisis de la cuantificación relativa. La expresión génica relativa (RQ: relative quantity) se calculó utilizando el método 2-ΔΔCt (Livak y Schmittgen, 2001), de acuerdo a las siguientes fórmulas: ∆𝐶𝑡𝑐𝑜𝑛𝑡𝑟𝑜𝑙 ∆𝐶𝑡𝑖𝑛𝑜𝑐𝑢𝑙𝑎𝑑𝑜 = 𝐶𝑡𝑡𝑎𝑟𝑔𝑒𝑡, 𝑐𝑜𝑛𝑡𝑟𝑜𝑙 − 𝐶𝑡𝑒𝑛𝑑ó𝑔𝑒𝑛𝑜, 𝑐𝑜𝑛𝑡𝑟𝑜𝑙 = 𝐶𝑡𝑡𝑎𝑟𝑔𝑒𝑡, 𝑖𝑛𝑜𝑐𝑢𝑙𝑎𝑑𝑜 − 𝐶𝑡𝑒𝑛𝑑ó𝑔𝑒𝑛𝑜, 𝑖𝑛𝑜𝑐𝑢𝑙𝑎𝑑𝑜 ∆∆𝐶𝑡 2 ∆∆ = ∆𝐶𝑡𝑐𝑜𝑛𝑡𝑟𝑜𝑙 − ∆𝐶𝑡𝑖𝑛𝑜𝑐𝑢𝑙𝑎𝑑𝑜 = 𝐸𝑥𝑝𝑟𝑒𝑠𝑖ó𝑛 𝑟𝑒𝑙𝑎𝑡𝑖𝑣𝑎 𝑜 𝑅𝑄 𝑟𝑒𝑙𝑎𝑡𝑖𝑣𝑒 𝑞𝑢𝑎𝑛𝑡𝑖𝑡𝑦 6. Análisis estadístico Los datos se procesaron mediante análisis de la varianza (ANOVA) y la significancia estadística de las medias aritméticas se evaluaron mediante la prueba de diferencias múltiple de Dunnett utilizando el programa Infostat (versión 2008 para Windows). Las diferencias entre tratamientos se consideraron significativas si p<0,05. Las pruebas de diferencias se realizaron por separado para cada gen. Los datos 161 Capítulo 8 presentados en las Figuras 54-57 corresponden a las medias ± desvío estándar de tres repeticiones técnicas y tres biológicas. RESULTADOS Los patrones de expresión de los genes de frutilla: FaGAPDH1 (gliceraldehído-3-fosfato deshidrogenasa), FaActin (Actina-1), FaPR1 (proteína PR1), FaChi2.1 (quitinasa CHI2.1), FaChi2.2 (quitinasa CHI2.2), FaOGBG5 (endo-β-1,3glucanasa), FaPAL3 (fenilalanina amonio-liasa 3), FaAPXc (ascorbato peroxidasa citosólica), FaEtr1(receptor de etileno ETR1), FaEin1(factor de transcripción EIN1), FaErs1 (sensor de respuesta de etileno ERS1), FaACO1 (ACC oxidasa1) y FaACO2 (ACC oxidasa2), fueron investigados en repuestas a la asociación con Azospirillum brasilense REC3. Todos los pares de cebadores mostraron valores de eficiencia entre 95% y 105% lo que se considera aceptable para el análisis por RT-qPCR, con excepción de FaACO1, del cual no se consiguió la amplificación efectiva, requiriéndose el diseño y síntesis de nuevos cebadores para lograr su amplificación. Por otro lado, se determinó que el gen codificante de la gliceraldehído-3-fosfato deshidrogenasa, FaGAPDH1, fue el más adecuado para ser utilizado como gen endógeno en los análisis de cuantificación relativa. Los resultados de la PCR cuantitativa mostraron que la inoculación de plantas de frutilla con la cepa REC3 de Azospirillum brasilense produce cambios en la expresión de los genes relacionados con la inmunidad vegetal. En el caso de los genes FaPR1, FaChi2.1 y FaChi2.2, codificantes de la proteína relacionada a la patogénesis PR1 y las quitinasas CHI2.1 y CHI2.2, respectivamente, se observó una gran inducción en las 24 hpi; no obstante, los mismos fueron luego significativamente reprimidos en las 48 hpi (Fig. 54). Por otro lado, el gen FaOGBG5 que codifica una endo-β-1,3-glucanasa 162 Capítulo 8 y está también relacionado a la defensa, fue fuertemente inducido en las 24 hpi y 48 hpi (Fig. 54). Figura 54. Expresión relativa (RQ) de los genes FaPR1, FaChi2.1, FaChi2.2 y FaOGBG5 en hojas de plantas de frutilla control (plantas no inoculadas) y en plantas inoculados con A. brasilense REC3 a las 24 y 48 h post-inoculación. Nivel de significancia estadística: p <0,05. El gen FaPAL3, codificante de la fenilalanina amonio-liasa 3, una enzima involucrada en la vía síntesis de ácido salicílico, y por lo tanto, en la señalización de ésta vía, no aumentó su expresión en ningún tiempo analizado (24 hpi y 48 hpi; Fig. 55). 163 Capítulo 8 Figura 55. Expresión relativa (RQ) del gen FaPAL3 en hojas de plantas de frutilla control (plantas no inoculadas) y en plantas inoculados con A. brasilense REC3 a las 24 y 48 horas post-inoculación. Nivel de significancia estadística: p <0,05. El producto de la traducción del gen FaAPXc es una ascorbato peroxidasa citosólica de F. ananassa que participa en la depuración de peróxido de hidrógeno y que mostró un incremento de su expresión en las 24 hpi (Fig. 56); similarmente a lo ocurrido con las proteínas relacionadas a la defensa, fue fuertemente inhibido en las 48 hpi. Figura 56. Expresión relativa (RQ) del gen FaAPXc en hojas de plantas de frutilla control (plantas no inoculadas) y en plantas inoculados con A. brasilense REC3 a las 24 y 48 horas post-inoculación. Nivel de significancia estadística: p <0,05. 164 Capítulo 8 A su vez, se observaron modificaciones en la expresión de los genes implicados en la vía de defensa dependiente de etileno. Los genes que codifican para los receptores de etileno FaETR1, FaEIN1 y FaERS1 presentaron una expresión diferencial (Fig. 57): FaETR1 aumentó su expresión en plantas inoculadas en ambos tiempos, FaEIN1 aumentó en las 24 hpi y disminuyó en las 48 hpi mientras que FaERS1 presentó un comportamiento inverso. El gen FaACO2, implicado en la síntesis de etileno a partir de su precursor el ácido 1-aminociclopropano carboxílico (ACC), aumentó su expresión sólo en las 24 hpi, mientras que en las 48 hpi su expresión fue igual al control no inoculado con Azospirillum. Figura 57. Expresión relativa (RQ) de los genes FaETR1, FaERS1, FaEIN1 y FaACO2 en hojas de plantas de frutilla control (plantas no inoculadas) y en plantas inoculados con A. brasilense REC3 a las 24 y 48 h post-inoculación. Nivel de significancia estadística: p <0,05. 165 Capítulo 8 DISCUSIÓN Fue posible estudiar a nivel molecular los patrones de expresión de algunos genes de la planta de frutilla que estarían involucrados en diferentes procesos durante su interacción con Azospirillum. Para ello se realizó un análisis cuantitativo por PCR en tiempo real (qRT-PCR) con el fin de evaluar la expresión génica en tejidos foliares de plantas de frutilla inoculadas con A. brazilense REC3 y los controles no-inoculados a las 24 y 48 h post-inoculación. Considerando el incremento de los niveles endógenos de AS en plantas de frutilla inoculadas con Azospirillum brasilense REC3 (determinado en el capítulo 6), se analizó la expresión de genes relacionados a la vía de defensa dependiente de AS. En primer lugar, se evaluó la expresión del gen FaPR1, codificante de la proteína PR1 que es la indicadora por excelencia de la respuesta de defensa de tipo SAR (respuesta sistémica adquirida), y se observó un aumento de la expresión del mismo en las 24 h posteriores a la inoculación con REC3, que estaría en sintonía con el máximo incremento en los niveles de AS endógeno observado en las 24 hpi (capítulo 6). Ambos resultados permiten inferir que la cepa REC3 produce la activación temprana de la vía de señalización dependiente de AS. Sin embargo, ésta sería una señal transitoria que es rápidamente apagada en las 48 hpi si se considera la represión del gen FaPR1 y la disminución del contenido de AS observado en este tiempo. Por otro lado, la ausencia de la inducción temprana de los transcriptos del gen FaPAL3, correspondiente a la enzima que cataliza el primer paso de la vía de síntesis del AS a partir de la fenilalanina (Vlot et al., 2008), confirmaría la hipótesis esbozada en el capítulo 6; donde se planteó que el rápido aumento del contenido de AS observado en los fluidos peciolares de plantas inoculadas con REC3, provendría de la movilización del AS conjugado y no a partir de la síntesis de novo a través de la vía de la fenilalanina, que sería más lenta. 166 Capítulo 8 Los genes FaChi2.1 y FaChi2.2 están implicados en la síntesis de quitinasas y en este trabajo se observó un incremento de su expresión en las 24 h posteriores a la inoculación con la cepa REC3 de A. brasilense. Coincidentemente, Tortora et al., (2012) observaron aumento de la expresión de estos genes en plantas de frutilla inoculadas con A. brasilense en los 3, 4 y 5 días post-inoculación; mientras que Bellone et al. (1995) observaron un incremento en la actividad de las quitinasas en plantas de frutilla inoculadas con la misma especie bacteriana (Bellone et al., 1995). En el presente trabajo se determinó que el gen FaOGBG5, que codifica una endo-β-1,3glucanasa y está también relacionado a la defensa, fue fuertemente inducido por la inoculación con Azospirillum en las 24 hpi y 48 hpi; este dato es consistente con el aumento de la expresión de un gen codificante de una glucanasa, FaBG2-2, inducida por la inoculación con A. brasilense en las 72, 96 y 120 hpi (Tortora et al., 2012). La inducción de quitinasas y glucanasas vegetales ha sido asociada con la resistencia sistémica inducida por PGPB contra hongos fitopatógenos (Benhamou et al., 1996, 2000; Saravanakumar et al., 2007), ya que la acumulación de enzimas hidrolíticas en el lugar de penetración de las hifas del hongo resultaría en la degradación de las paredes celulares fúngicas (Benhamou et al., 2000). Mientras que la fuerte inducción de la glucanasa FaOGBG5 coincide con lo reportado por Martínez Zamora et al. (2012), quienes observaron una fuerte inducción de la misma luego del tratamiento de plantas de frutilla con un hongo virulento (Collectotrichum acutatum), un avirulento (Collectotrichum fragariae) y con las hormonas AS y ET, por lo que la endo-β-1,3glucanasa estaría implicada en respuestas de defensa contra estreses bióticos y abióticos. Otro gen que fue activado rápida y transitoriamente luego de la inoculación con REC3 fue el de la ascorbato peroxidasa citosólica, FaAPXc, encargada de la depuración de peróxido de hidrógeno. Esta inducción podría explicar la ausencia del fenómeno de estallido oxidativo en plantas de frutilla inoculadas con REC3 observada 167 Capítulo 8 en este trabajo (capítulo 5). Particularmente, este gen se ve sobreexpresado a las 24 hpi y posteriormente a las 48 hpi es fuertemente inhibido, lo que permite inferir que si hubiera una generación de ERO luego de la colonización por Azospirillum, éstas serían rápidamente depuradas durante las primeras horas post-inoculación y luego ya no sería necesaria su acción debido a la ausencia de peróxidos. Soportan esta explicación los datos informados por otros autores (Szechynska-Hebda et al., 2010), quienes afirmaron que la ascorbato peroxidas citosólica de Arabidopsis, APX2, actúa como un mecanismo de protección contra la acumulación de ERO de origen cloroplastídico inducida por exceso de luz. Debido a que las bacterias PGPB inducen la respuesta de defensa del tipo ISR dependiente de ET, se evaluó la modificación de la expresión de genes asociados a ésta vía en plantas de frutilla luego de la inoculación con REC3. Según el modelo regulatorio aceptado, cuando hay ET en el ambiente, esta hormona se une al receptor inactivando a CTR1 y se produce la transducción de señal por acción de EIN2 (etileno insensibles 2) en plantas de Arabidopsis (Guo y Ecker, 2004). EIN2 estimula la actividad de varios factores de transcripción, incluyendo EIN3; y a su vez, EIN3 induce la transcripción de otros genes implicados en las respuestas de etileno (Guo y Ecker, 2004). El gen FaEIN1 de F. ananassa es un análogo de EIN2 de A. thaliana. En el presente trabajo se observó que en las plantas inoculadas con REC3 también habría una transducción de señal similar: FaEIN1 es sobreexpresado en las 24 hpi, estimulando el posterior aumento de la transcripción de FaERS1 en las 48 hpi, mientras que FaETR1 aumentó su expresión en ambos tiempos. Además, se observó un aumento de la expresión de FaACO2, implicado en la síntesis de etileno, en las 24 hpi. De estos resultados se concluye que estos genes involucrados en la respuesta de ET parecerían estar altamente regulados y funcionarían de manera coordinada para activar respuestas dependientes de ET en plantas de frutilla inoculadas con Azospirillum. La 168 Capítulo 8 activación de esta vía se deduce por un incremento rápido de la transcripción de una enzima de síntesis, ACO2, el aumento del receptor de ET en ambos tiempos analizados y el disparo de la transducción de señal desde FaEIN1a FaERS1 aquí propuesto. Conforme a esto, en un estudio realizado en plantas de tomate inoculado con A. brasilense se determinó que la promoción del crecimiento inducida por la cepa PGPB requeriría la activación de la vía dependiente de ET, y que éste se comporta como regulador positivo del desarrollo radicular en respuesta a la inoculación (Ribaudo et al., 2006). Por otro lado, los mismos autores afirmaron que en las plantas inoculadas con A. brasilense, los niveles de auxina y etileno serían regulados paralelamente. Entonces, la activación de la vía de ET observada en el presente capítulo y la inducción del aumento de los niveles de ácido indol-3-acético observado e informado en el capítulo 7 estarían directamente relacionados. Finalmente, la inducción temprana de los genes involucrados en la defensa vegetal en tiempos tan cortos como 24 h post-inoculación confirman la inducción del estado de alerta o “priming” disparado en plantas de frutilla por la bacteria promotora del crecimiento vegetal A. brasilense REC3. Es probable que este efecto de “priming”, juegue un papel importante activando las respuestas de defensas endógenas de las plantas de frutilla proporcionando una resistencia de larga duración y amplio espectro; que en última instancia mejoraría el rendimiento de la planta. 169 Capítulo 8 CONCLUSIONES La PCR cuantitativa en tiempo real (qRT-PCR) permitió el estudio a nivel molecular de la expresión de algunos genes de frutilla involucrados durante el establecimiento de la asociación Azospirillum-frutilla. La sobreexpresión de genes de frutilla relacionados a la defensa vegetal, como FaPR1, FaChi2.1, FaChi2.2 y FaOGBG5, luego de la inoculación con A. brasilense REC3, indicaron que la inoculación con Azospirillum activó la resistencia sistémica adquirida (SAR) dependiente del ácido salicílico. La ausencia de una expresión diferencial del gen FaPAL3 en plantas inoculas con A. brasilense REC3 y controles no-inoculados, sugiere que el incremento de los niveles de ácido salicílico no se deben a su síntesis de novo a través de la vía de la fenilalanina, aunque no se puede descartar la vía de ISC cloroplastídica. La activación temprana post-inoculación con REC del gen FaAPXc, sugirió la activación de un mecanismo de protección contra la acumulación de ERO. El aumento de la expresión de los genes FaEIN1, FaERS1, FaETR1 y FaACO2 a posteriori de la inoculación con A. brasilense REC3, confirmaron que Azospirillum es capaz de activar la resistencia sistémica inducida (ISR) dependiente de etileno. La activación de genes de frutilla en los tiempos cortos posteriores a la inoculación con Azospirillum brasilense (24 y 48 hpi) demostró que las vías de señalización estudiadas probablemente son activadas en las etapas iniciales de la colonización vegetal por Azospirillum. 170 Capítulo 9 Capítulo 9 171 Capítulo 9 CONCLUSIONES GENERALES La hipótesis planteada en la presente tesis doctoral fue confirmada cumpliendo satisfactoriamente con todos los objetivos específicos programados. Este trabajo constituye el primer estudio de las señales bioquímicas, estructurales y moleculares desencadenadas durante la interacción Azospirillum brasilense –frutilla (Fragaria ananassa); aportando datos valiosos al conocimiento de ésta interacción que podría tener una relevante aplicación biotecnológica considerando el gran interés económico-social del cultivo de frutilla. Las conclusiones generales surgidas de esta tesis son las siguientes: Azospirillum brasilense fue capaz de asociarse benéficamente con las plantas de frutilla promoviendo su crecimiento y sin causar síntomas visibles de enfermedad. Se determinó que A. brasilense coloniza rizosférica y endofíticamente las raíces de distintas variedades de frutilla (`Camarosa´, `Milsei´ y `Selva´). Asimismo, se determinó la colonización endofítica de los estolones de plantas madre inoculadas e hijas no-inoculadas. Se obtuvo la cepa transgénica A. brasilense REC3::gfp con altos niveles de expresión del gen gfp y gran estabilidad que permitió realizar el seguimiento de la colonización radicular de plantas de frutilla durante un largo período de tiempo. La microscopía electrónica de barrido acoplada a la espectroscopia de energía dispersiva de rayos-X permitieron evaluar la nutrición mineral de plantas de frutilla inoculadas con Azospirillum brasilense y cultivadas en un medio óptimo o limitado en nutrientes. En las hojas se cuantificaron los siguientes elementos: C, O, N, Na, K, P, Ca y Cu; mientras que en las raíces se pudo determinar también Si y Cl. La inoculación con A. brasilense produjo un aumento del contenido de P y la diminución de Cu en las raíces. 172 Capítulo 9 Azospirillum brasilense promovió el crecimiento de plantas de frutilla en condiciones hidropónicas, aumentando la biomasa total, el índice de crecimiento y la proliferación de pelos radiculares, siendo este efecto más notorio cuando las plantas crecieron en un medio limitado en nutrientes. La inoculación de las raíces de plantas de frutilla con Azospirillum brasilense activó mecanismos de defensa estructurales sistémicas, como la deposición de calosa y el engrosamiento de las paredes celulares en las hojas de dichas plantas. Entre las señales bioquímicas activadas por Azospirillum brasilense se observó el aumento de los niveles de compuestos fenólicos solubles totales, en todos los tiempos evaluados, y la diminución de la peroxidación lipídica de membranas vegetales durante las primeras 24 hpi, en raíces y hojas de plantas de frutilla. Sin embargo, en plantas de frutilla inoculadas con A. brasilense no se determinó una señal de estallido oxidativo local ni sistémica entre las 12 hpi y 120 hpi. En plantas de frutilla inoculadas con Azospirillum brasilense se determinó la existencia de un diálogo cruzado entre dos importantes fitohormonas, el ácido salicílico (AS) y el ácido indol-3-acético (AIA). La inoculación aumentó el contenido de AS durante los primeros tiempos (12 hpi a 48 hpi), mientras que los niveles máximos de AIA se determinaron en tiempos posteriores (entre 96 hpi y 120 hpi) cuando los niveles del primero disminuían. El estudio a nivel molecular indicó que ocurriría una regulación de la expresión génica de las plantas de frutilla como respuesta a la colonización por Azospirillum brasilense. La inoculación produjo la sobreexpresión de genes relacionados a la defensa vegetal (FaPR1, FaChi2.1, FaChi2.2 y FaOGBG5) que son marcadores de la resistencia sistémica adquirida (SAR) dependiente del ácido salicílico; así como también activó la expresión de genes indicadores de la resistencia sistémica inducida (ISR) dependiente de etileno (FaEIN1, FaERS1, FaETR1 y FaACO2). De lo que se concluye que Azospirillum brasilense es capaz de inducir mecanismos de defensa en plantas de frutilla por ambas vías, SAR e ISR, y las mismas sería activadas en cortos tiempos posteriores a la inoculación (entre 24 hpi y 48 hpi). 173 Capítulo 9 La señales estructurales, bioquímicas y moleculares activadas por Azospirillum brasilense, como las deposiciones de calosa, el engrosamiento de las paredes celulares, el aumento de compuestos fenólicos solubles totales, la diminución de la peroxidación lipídica, la inducción de la síntesis de fitohormonas y la activación de la expresión temprana de genes relacionados a la defensa vegetal, indicaron que esta bacteria PGPB activa un “estado de alerta” o “priming” en las plantas de frutilla, siendo éste un proceso importante de la resistencia sistémica inducida. En conjunto, los resultados obtenidos constituyen un importante aporte al conocimiento de la interacción benéfica que se establece entre plantas de frutillas y la especie PGPB Azospirillum brasilense. 174 Capítulo 10 Capítulo 10 175 Capítulo 10 Referencias bibliográficas 1. Ahn, I.P., Lee, S.W., and Suh, S.C. (2007) Rhizobacteria-induced priming in Arabidopsis is dependent on ethylene, jasmonic acid and NPR1. Molecular plantmicrobe interactions 20: 759-768. 2. Ajwa, H.A., Klose, S., Nelson, S.D., Minuto, A., Gullino, M.L., Lamberti, F., and Lopez-Aranda J.M. (2003) Alternatives to methyl bromide in strawberry production in the United States of America and the Mediterranean region. Phytopathology Mediterranean 42: 220-244. 3. Alexandre, G., Rohr, R., and Bally, R. (1999) A phase variant of Azospirillum lipoferum lacks a polar flagellum and constitutively expresses mechanosensing lateral flagella. Applied and Environmental Microbiology 65: 4701-4704. 4. Baca, B.E. (2004). Azospirillum, un modelo de estudio de una PGPR. pp. 1-18. 5. Bacilio, M., Hernandez, J P., and Bashan, Y. (2006) Restoration of giant cardon cacti in barren desert soil amended with common compost and inoculated with Azospirillum brasilense. Biology and Fertility of Soils 43: 112-119. 6. Baldani, V.L.D., Alvarez, M.A., Baldani, J.I., and Döbereiner, J. (1986) Establishment of inoculated Azospirillum spp. in the rhizosphere and in roots of field grown wheat and sorghum. Plant and Soil 90:35–46. 7. Baldani, V.L.D., Baldani, J.I., and Döbereiner, J. (1983) Effects of Azospirillum inoculation on root infection and nitrogen incorporation in wheat. Canadian Journal of Microbiology 29: 924–929. 8. Barak, R., Nur, I., and Okon, Y. (1983) Detection of chemotaxis in Azospirillum brasilense. Journal of Applied Bacteriology 53: 399-403. 9. Bari, R. and Jones, J.D.G. (2009) Role of plant hormones in plant defense responses. Plant molecular biology 69: 473–88. 10. Bashan, Y. (1986) Enhancement of wheat root colonization and plant development by Azospirillum brasilense Cd. following Temporary Depression of Rhizosphere Microflora. Applied and Environmental Microbiology 33: 1067-1071. 11. Bashan, Y. and De-Bashan, L.E. (2010) How the plant growth-promoting bacterium Azospirillum promotes plant growth - A Critical Assessment. Advances in Agronomy 108: 77-136. 12. Bashan, Y. and Holguin, G. (1997) Azospirillum-plant relationships: environmental and physiological advances (1990–1996). Canadian Journal of Microbiology 43: 103–121. 13. Bashan, Y. and Levanony, H. (1987) Horizontal and vertical movement of Azospirillum brasilense Cd. in the soil and along the rhizosphere of wheat and weeds in controlled and field enviroments. Journal of General Microbiology 133: 3473-3480. 176 Capítulo 10 14. Bashan, Y. and Levanony, H. (1989) Factors affecting adsorption of Azospirillum brasilense Cd. to root hairs as compared with root surface of wheat. Canadian Journal of Microbiology 35: 936–944. 15. Bashan, Y. and Levanony, H. (1990) Current status of Azospirillum inoculation technology: Azospirillum as a challenge for agriculture. Canadian Journal of Microbiology 36: 591–608. 16. Bashan, Y., Harrison, S.K., and Whitmoyer, R.E. (1990) Enhanced growth of wheat and soybean plants inoculated with Azospirillum brasilense is not necessarily due to general enhancement of mineral uptake. Applied and Environmental Microbiology 56: 769-775. 17. Bashan, Y., Holguin, G., and de-Bashan, L.E. (2004) Azospirillum-plant relationships: physiological, molecular, and environmental advances (1997–2003). Canadian Journal of Microbiology 50: 521–577. 18. Bashan, Y., Levanony, H., and Klein, E. (1986) Evidence for a weak active external adsorption of Azospirillum brasilense Cd to wheat roots. Journal of General Microbiology 98: 1230-1236. 19. Bashan, Y., Levanony, H., and Whitmoyer, R.E. (1991) Root surface colonization of non cereal crop plants by pleomorphic Azospirillum brasilense Cd. J. Gen. Microbiol. 132: 3069-3073. 20. Bellone, C.H., Bellone, S.C., and Pedraza, R.O. (1995) Chitinase expression in strawberry root colonized by Azospirillum brasilense and VA Mycorrhiza. Azospirillum VI and related microorganisms 37: 161-165. 21. Benhamou, N., Gagné, S., Le Quéré, D., and Dehbi, L. (2000) Bacterial-mediated induced resistance in cucumber: beneficial effect of the endophytic bacterium Serratia plymuthica on the protection against infection by Pythium ultimum. Phytopathology 90: 45-56. 22. Benhamou, N., Kloepper, J. W., Quadt-Hallman, A., and Tuzun, S. (1996) Induction of defense-related ultrastructural modifications in pea root tissues inoculated with endophytic bacteria. Plant physiology 112: 919-929. 23. Bilal, R., Rasul, G., Arshad, M., and Malik, K.A. (1993) Attachment, colonization and proliferation of Azospirillum brasilense and Enterobacter spp. on root surface of grasses. European Journal of Microbiology and Biotechnology 9: 63-69. 24. Bloemberg, G.V. and Lugtenberg, B.J. (2001) Molecular basis of plant growth promotion and biocontrol by rhizobacteria. Current opinion in plant biology 4: 343350. 25. Bolwell, G.P., Bindschedler, L.V., Blee, K., Butt, V.S., Davies, DR., Gardner, SL., Gerrish, C., and Minibayeva, F. (2002) The apoplastic oxidative burst in response to biotic stress in plants: a three-component system. Journal of experimental botany 53: 1367-1376. 26. Bottini, R., Cassan, F., and Piccoli, P. (2004) Gibberellin production by bacteria and its involvement in plant growth promotion and yield increase. Applied microbiology and biotechnology 65: 497-503. 177 Capítulo 10 27. Boudet, A.M. (2007) Evolution and current status of research in phenolic compounds. Phytochemistry 68: 2722–2735. 28. Bremner, J.M. and Mulvaney, C.S. (1982) Nitrogen-total. In: Page, A.L., Miller, R.H., Keeney, D.R. (Eds.), Methods of Soil Analysis, Part 2. Chemical and Microbiological Properties, second ed. American Society of Agronomy Inc., Soil Science Society of America Inc., Publisher, Madison, WI, pp. 595–624. 29. Burdman, S., Jurkevitch, E., Schwartsburd, B., and Okon, Y. (1999) Involvement of outermembrane proteins in the aggregation of Azospirillum brasilense. Microbiology 145:1145–52. 30. Burdman, S., Jurkevitch, E., Soria-Díaz, M.E., Gil Serrano, A.M., and Okon, Y. (2000a). Extracellular polysaccharide composition of Azospirillum brasilense and its relation with cell aggregation. FEMS Microbiology Letters 189: 259-264. 31. Burdman, S., Kigel, J., and Okon, Y. (1997) Effects of Azospirillum on nodulation and growth of common bean (Phaseolus vulgaris L.) Soil Biology and Biochemistry 29: 923-929. 32. Burdman, S., Okon, Y., and Jurkevitch, E. (2000b) Surface characteristics of Azospirillum brasilense in relation to cell aggregation and attachment to plant roots. Critical Review of Microbiology 26: 91–110. 33. Ҫakmaҫki, R., Dönmez, F., Aydm, A., Şahin, F. (2006) Growth promotion of plants by plant growth-promoting rhizobacteria under greenhouse and two different field soil conditions. Soil Biology and Biochemistry 38: 1482-1487. 34. Chen, C., Bélanger, R.R., Benhamou, N., and Paulitz, T.C. (1999) Role of salicylic acid in systemic resistance induced by Pseudomonas spp. against Pythium aphanidermatum in cucumber roots. European Journal of Plant Pathology 105: 477486. 35. Chen, S., Xu, M., Ma, Y., and Yang, J. (2007) Evaluation of different phosphate amendments on availability of metals in contaminated soil. Ecotoxicology and Environmental Safety 67: 278-285. 36. Chen, Y.F., Etheridge, N., and Schaller, G.E. (2005). Ethylene signal transduction. Annals of botany 95: 901–915. 37. Chisholm, S.T., Coaker, G., Day, B., and Staskawicz, B.J. (2006) Host-microbe interactions: shaping the evolution of the plant immune response. The Cell 124: 803-814. 38. Conrath, U., Beckers, G.J.M., Flors, V., García-Agustín, P., Jakab, G., Mauch, F., Newman, M.A., Pieterse, C.M.J., Poinssot, B., Pozo, M.J., Pugin, A., Schaffrath, U., Ton, J., Wendehenne, D., Zimmerli, L., and Mauch-Mani, B. (2006) Priming: Getting ready for battle. Molecular Plant-Microbe Interactions 19: 1062-1071. 39. Cornelis, P. and Matthisj. S. (2007) Pseudomonas siderophores and their biological significance. In: Ajit V, Chincholkar SB (eds) Microbial siderophores (Soil Biology). Heidelberg, Berlin, Germany, pp 193–200. 178 Capítulo 10 40. Costacurta, A. and Vanderleyden, J. (1995) Synthesis of Phytohormones by PlantAssociated Bacteria. Critical Reviews in Microbiology 21: 1–18. 41. Cowan, M.M. (1999) Plant products as antimicrobial agents. Clinical Microbiology Reviews 12: 564-582. 42. Croes, C.L., Moens, S., Vanbastelaere, E., Vanderleyden, J., and Michiels, K.W. (1993) The polar flagellum mediates Azospirillum brasilense adsorption to wheat roots. Journal of General Microbiology 139: 2261–2269. 43. Currier, H., and Strugger, S. (1956) Aniline blue and fluorescence microscopy of callose in bulb scales of Allium cepa L. Protoplasma 45: 552-559. 44. Danhorn, T. and Fuqua, C. (2007) Biofilm Formation by Plant-Associated Bacteria. Annual Reviews of Microbiology 61: 401-422. 45. Darrow, G. M. (1966) The strawberry. History, breeding and physiology. Pp.1-221. 46. De Meyer, G., Audenaert, K., and Höfte, M. (1999) Pseudomonas aeruginosa 7NSK2-induced systemic resistance in tobacco depends on in planta salicylic acid accumulation but is not associated with PR1a expression. European Journal of Plant Pathology 105: 513-517. 47. Dean, J.V. and Delaney, S.P. (2008) Metabolism of salicylic acid in wild-type, ugt74f1 and ugt74f2 glucosyl- transferase mutants of Arabidopsis thaliana. Physiology of Plants 132: 417–25. 48. Dean, J.V., and Mills J.D. (2004) Uptake of salicylic acid 2-O-β-D-glucose into soybean tonoplast vesicles by an ATP-binding cassette transporter-type mechanism. Physiology of Plants 120: 603–12 49. Dean, J.V., Mohammed, L.A., and Fitzpatrick T. (2005) The formation, vacuolar localization, and tonoplast transport of salicylic acid glucose conjugates in tobacco cell suspension cultures. Planta 221: 287–296. 50. Delaney, T. P., Uknes, S., Vernooij, B., Friedrich, L., Weymann, K., Negrotto, D., Gaffney, T., Gut-Rella, M., Kessmann, H., Ward, E., and Ryals, J. (1994) A central role of salicylic acid in plant disease resistance. Science 266: 1247-1250. 51. Della-Penna, D. and Pogson, B. J. (2006) Vitamin synthesis in plants: tocopherols and carotenoids. Annual Reviews of Plant Biology 57: 711-738. 52. Deubel, A., Gransee, A., and Merbach, W. (2000) Transformation of organic rhizodepositions by rhizosphere bacteria and its influence on the availability of tertiary calcium phosphate. Journal Plant Nutrition and Soil Science 163: 387-392. 53. deZamaroczy, M., Delorme, F., and Elmerich, C. (1989) Regulation of transcription and promoter mapping of the structural genes for nitrogenase (nifHDK) of Azospirillum brasilense Sp7. Molecular and General Genetics 220: 33-42. 54. Ding, X., Cao, Y., Huang, L., Zhao, J., Xu, C., Li, X., and Wang, S. (2008) Activation of the indole-3-acetic acid–amido synthetase GH3-8 suppresses expansin expression and promotes salicylate-and jasmonate-independent basal immunity in rice. The Plant Cell 20: 228-240. 179 Capítulo 10 55. Dobbelaere, S., Croonenborghs, A., Thys, A., Ptacek, D., Vanderleyden, J., Dutto, P., Labandera-González, C., Caballero-Mellado, J., Aguirre, J.F., Kapulnik, Y., Brener, S., Burdman, S., Kadouri, D., Sarig, S., and Okon, Y. (2001) Responses of agronomically important crops to inoculation with Azospirillum. Australian Journal Plant Physiology 28: 871–879. 56. Dobbelaere, S., Vanderleyden, J., and Okon, Y. (2003) Plant Growth-Promoting Effects of Diazotrophs in the Rhizosphere. Critical reviews in plant sciences 22: 107-149. 57. Döbereiner, J. and Pedrosa, F.O. (1987) Nitrogen fixing-bacteria in nonleguminous crop plants. Brock Springer Series in Contemporary Bioscience. Science Tech. Publishers, Madison, WI. pp. 1-155. 58. Döbereiner, J., Baldani, V.L.D., and Baldani, J.I. (1995) Como isolar e identificar bacterias diazotróficas de plantas nao-leguminosas. Brasilia-DF: EMBRAPA-SPI. 59. Doyle, J.J. and Doyle. J.L. (1987) A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochemical Bulletin 19: 11-15. 60. Durrant, W.E., and Dong, X. (2004) Systemic acquired resistance. Annual Reviews of Phytopathology 42: 185-209. 61. Eckert, B., Weber, O. B., Kirchhof, G., Halbritter, A., Stoffels, M., and Hartmann, A. (2001) Azospirillum doebereinerae sp. nov., a nitrogen-fixing bacterium associated with the C4-grass Miscanthus. International journal of systematic and evolutionary microbiology 51: 17-26. 62. El-Komy, H.M.A. (2005) Coimmobilization of Azospirillum lipoferum and Bacillus megaterium for successful phosphorus and nitrogen nutrition of wheat plants. Food Technol. Biotechnol. 43: 19-27. 63. Elmerich, C. (1984) Molecular biology and ecology of diazotrophs associated with nonleguminous plants. Biotechnology 2: 967-978. 64. Elmerich, C., Zamaroczy, M., Arsene, F., Perez, L., Paquelin, A., and Kaminski, A. (1997) Regulation of nif gene expresion and nitrogen metabolism in Azospirillum. Soil Biology and Biochemistry 29: 847-852. 65. Epstein, E. (1972) Mineral Nutrition of Plants: Principles and Perspectives. Wiley, New York. 66. Esitken, A., Yildiz, H.E., Ercisli, S., Figen Donmez, M., Turan, M., and Gunes, A. (2010) Effects of plant growth promoting bacteria (PGPB) on yield, growth and nutrient contents of organically grown strawberry. Scientia Horticulturae 124: 62– 66. 67. Fallik, E., Sarig, S., and Okon, Y. (1994) Morphology and physiology of plant roots associated with Azospirillum. Azospirillum/plant associations pp. 77-85. 68. FAO production yearbook 2001. FAO statistics series nº156. Production volume 53. Food and Agricultural Organization of the United States. 180 Capítulo 10 69. Figurski, D.H. and Helinski, D.R. (1979) Replication of an origincontaining derivative of plasmid RK2 dependent on a plasmid function provided in trans. Proceedings of Natural Academy of Science USA 76: 1648–1652. 70. Foyer, C., y Noctor, G. (2005) Redox homeostasis and antioxidant signaling: A metabolic interface between stress perception and physiological responses. The Plant Cell 17: 1866–1875. 71. Foyer, C.H. and Noctor, G. (2009) Redox regulation in photosynthetic organisms: Signaling, acclimation, and practical implications. Antioxidants & Redox Signaling 11: 861-905. 72. Gafni, R., Okon, Y., Kapulnik, Y., and Fsicher, M. (1986) Adsorption of Azospirillum brasilense to corn roots. Soil biology and Biochemistry 18: 69-75. 73. Galimand, M., Perroud, B., Delorme, F., Paquelin, A., Vieille, C., Bozouklian, H., and Elmerich, C. (1989) Identification of DNA regions homologous to nitrogen fixation genes nifENX, nifUSV and fixABC in Azospirillum brasilense Sp7. Journal of General Microbiology 135: 1047-1059. 74. Gambardella, M. and Pertuzé, R. (2004) Strawberry production in South American. V International Strawberry Symposium. Acta Horticulturae 708: 25-43. 75. Garcion, C. and Métraux, J.P. (2006) Salicylic acid. In Plant Hormone Signaling, Oxford: Blackwell Publishing Ltd. 24:229–255. 76. Glass, N.L. and Kosuge, T. (1988) Role of indoleacetic acid lysine synthetase in regulation of indoleacetic acid pool size and virulence of Pseudomonas syringae subsp savastanoi. Journal of Bacteriology 170: 2367–2373. 77. Glick, B. R., Todorovic, B., Czarny, J., Cheng, Z., Duan, J., and McConkey, B. (2007) Promotion of plant growth by bacterial ACC deaminase. Critical Reviews in Plant Sciences 26: 227-242. 78. Glick, B.R., Patten, C.L., Holguin, G., and Penrose, D.M. (1999) Biochemical and genetic mechanisms used by plant growth promoting bacteria. Imperial College Press. 79. Goldstein, J., Newbury, D.E., Joy, D.C., Lyman, C.E., Echlin, P., Llfshin, E., Sawyer, L., and Michael, J.R. (2003) Scanning Electron Microscopy and X-ray Microanalysis, 3rd edition. Springer, New York. 80. Grellet-Bournonville, C.F. and Díaz-Ricci, J.C. (2011) Quantitative determination of superoxide in plant leaves using a modified NBT staining method. Phytochemical analysis 22: 268-271. 81. Grifoni, A., Bazzicalupo, M., Di Serio, C., Fancelli, S., and Fani, R. (1995) Identification of Azospirillum strains by restriction fragment length polymorphism of the 16S rDNA and of the histidine operon. FEMS microbiology letters 127:85-91 82. Guillemaut, P. and Maréchal-Drouard, L. (1992) Isolation of plant DNA: A fast, inexpensive, and reliable method. Plant Molecular Biology Reporter 10: 60-65. 83. Guo, H. and Ecker, J.R. (2004) The ethylene signaling pathway: new insights. Current opinion in plant biology 7: 40-49. 181 Capítulo 10 84. Hahlbrock, K. and Scheel, D. (1989) Physiology and molecular biology of phenylpropanoid metabolism. Annual Reviews of Plant Physiology and Plant Molecular Biology 40: 347–369. 85. Hall, P.G. and Krieg, N.R. (1984) Application of the indirect immunoperoxidase stain technique to the flagella of Azospirillum brasilense. Applied and Environmental Microbiology 47: 433-435. 86. Hall, P.G. (1983) Antigenic and functional differences between the Polar and Lateral Flagella of Azospirillum. Virginia Polytechnic Institute and State University. 87. Hammond-Kosack, K.E. and Jones, J.D.G. (1996) Resistance gene-dependent plant defense responses Plant Cell 8: 1773–1791 88. Hancock, J.F., Maas, J.L., Shanks, C.H., Breen, P.J., and Luby, J.J. (1991) Strawberries (Fragaria) Genetic Resources of Temperate Fruit and Nut Crops 290: 491-548. 89. Harari, A., Kigel, J., and Okon, Y. (1988) Involvement of IAA in the interaction between Azospirillum brasilense and Panicum miliaceum roots. Plant and Soil 110: 275-282. 90. Hartmann, A., and Baldani, J.I. (2006) The genus Azospirillum. In The prokaryotes, Springer New York. pp. 115-140. 91. Hartmann, A.N.T. and Burris, R.H. (1987) Regulation of nitrogenase activity by oxygen in Azospirillum brasilense and Azospirillum lipoferum. Journal of bacteriology 169: 944-948. 92. Hartmann, A.N.T., Fu, H. A.I.A.N., and Burris, R.H. (1986) Regulation of nitrogenase activity by ammonium chloride in Azospirillum spp. Journal of bacteriology 165: 864-870. 93. Hennig, J., Malamy, J., Grynkiewicz, G., Indulski, J., and Klessig, D.F. (1993) Interconversion of the salicylic acid signal and its glucoside in tobacco. Plant Journal 4: 593–600. 94. Hoagland, D.R. and Arnon, D.I.(1950) The water-culture method for growing plants without soil, California Agricultural and Experimental Circular No. 347. 347: 1–32. 95. Hodges, D.M., DeLong, J.M., Forney, C.F., and Prange, R.K. (1999) Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds. Planta 207: 604-611. 96. Holguin, G., Bashan, Y., Puente, E., Carrillo, A., Bethlenfalvay, G., Rojas, A., Vázquez, P., Toledo, G., Jiménez, M.B., Glick, B. R., González de Bashan, L., Lebsky, V., Moreno, M., and Hernández, J.P. (2003) Plant Growth Promotion by Rhizosphere Bacteria. Agricultura Técnica en México 29: 201-211. 182 Capítulo 10 97. Horemans, S., Koninck, K., Neuray, J., Hermanss, R., and Vlassak, K. (1986) Production of plant growth substances by Azospirillum sp. and other rhizosphere bacteria. Symbiosis 2: 341-346. 98. Huda-Faujan, N., Noriham, A., Norrakiah, A., and Babji, A. (2009) Antioxidant activity of plant extracts containing phenolic compounds. African Journal of Biotechnology 8: 484-489. 99. Huergo, L.F., Chubatsu, L.S., Souza, E.M., Pedrosa, F.O., Steffens, M.B., and Merrick, M. (2006) Interactions between PII proteins and the nitrogenase regulatory enzymes DraT and DraG in Azospirillum brasilense. FEBS letters 580: 5232-5236. 100. Hukkanen, AT., Kokko, H.I., Buchala, A.J., McDougall, G.J., Stewart, D., Kärenlampi, S.O., and Karjalainen, R.O. (2007) Benzothiadiazole induces the accumulation of phenolics and improves resistance to powdery mildew in strawberries. Journal of agricultural and food chemistry 55: 1862-1870. 101. Hummer, K. E., and Hancock, J. (2009) Strawberry genomics: botanical history, cultivation, traditional breeding, and new technologies. In Genetics and Genomics of Rosaceae, Springer New York. pp. 413-435. 102. Jain, D.K. y Patriquin, D.G. (1984) Root Hair Deformation, Bacterial Attachment, and Plant Growth in Wheat-Azospirillum Associations. Applied and Environmental Microbiology 48: 1208-1213. 103. Janzen, R., Rood, S., Dormar, J., and McGill, W. (1992) Azospirillum brasilense produces gibberellins in pure culture and chemically-medium and in co-culture on straw. Soil Biology Biochemistry 24: 1061-1064. 104. Jones, J.D. and Dangl, J.L. (2006) The plant immune system. Nature 444: 323-329. 105. Kähkönen, M.P., Hopia, A.I., Vuorela, H.J., Rauha, J.P., Pihlaja, K., Kujala, T.S., and Heinonen, M. (1999) Antioxidant activity of plant extracts containing phenolic compounds. Journal of agricultural and food chemistry 47: 3954–3962. 106. Kajdzanoska, M., Petreska, J., and Stefova, M. (2011) Comparison of different extraction solvent mixtures for characterization of phenolic compounds in strawberries. Journal of agricultural and food chemistry 59: 5272-8. 107. Kamnev, A.A., Tugarova, A.V., Tarantilis, P.A., Gardiner, P.H., and Polissiou, M.G. (2012) Comparing poly-3-hydroxybutyrate accumulation in Azospirillum brasilense strains Sp7 and Sp245: The effects of copper (II). Applied Soil Ecology 61: 213-216. 108. Kapulnik, Y., Okon, Y., and Henis, Y. (1985b) Changes in root morphology of wheat caused by Azospirillum brasilense. Canadian Journal of Botany 31: 881-887. 109. Kapulnik, Y., Gafny, R., and Okon, Y. (1985) Effect of Azospirillum spp. inoculation on root development and uptake in wheat (Triticum aestivum cv. Miriam) in hydroponic systems. Canadian Journal of Botany 63: 627-631. 110. Karnovsky, M.J.(1965) A formaldehyde-glutaraldehyde fixative of high osmolarity for use in electron microscopy. J. Cell Biol. 27: 137. 183 Capítulo 10 111. Karunakaran, R., Mauchline, T.H., Hosie, A.H.F., and Poole, P.S. (2005) A family of promoter probe vectors incorporating autofluorescent and chromogenic reporter proteins for studying gene expression in Gram-negative bacteria. Microbiology, 151: 3249–3256. 112. Kauss, H. (1992) Callose and callose synthase. In SJ Gurr, MJ McPherson, DJ Bowles, eds, Molecular Plant Pathology, Vol 2. Oxford University Press, Oxford, pp 1–8. 113. Kawano, T., Furuichi, T., and Muto, S. (2004). Controlled salicylic acid levels and corresponding signaling. Molecular Biology 21: 319–335. 114. Khammas, K.M., Ageron, E., Grimont, P.A.D., and Kaiser, P. (1989) Azospirillum irakense sp. nov., a nitrogen-fixing bacterium associated with rice roots and rhizosphere soil. Research in microbiology 140: 679-693. 115. Kim, I.J. y Chung, W.I. (1998) Molecular characterization of a cytosolic ascorbate peroxidase in strawberry fruit. Plant Science 133: 69–77. 116. Kleczkowski, K., Schell, J., and Bandur, R. (1995) Phytohormone conjugates: nature and function. Critical Reviews in Plant Sciences 14: 283-298. 117. Kloepper, J.W., Lifshitz, R., Zablotowicz, R.M. (1989) Free-living bacterial inocula for enhancing crop productivity. Trends in Biotechnology. 7: 39-44. 118. Kohler, A., Schwindling, S., and Conrath, U. (2002) Benzothiadiazole-induced priming for potentiated responses to pathogen infection , wounding , and infiltration of water into leaves requires the NPR1 / NIM1 gene in Arabidopsis. Plant Physiology 128: 1046-1056. 119. Koornneef, A. and Pieterse, C.M. (2008) Cross talk in defense signaling. Plant physiology 146: 839-844. 120. Kubo, A., Tanaka, K., and Kondo, N., (1995) Expression of Arabidopsis cytosolic ascorbate peroxidase gene in response to ozone or sulfur dioxide. Plant Molecular Biology 29:479–489. 121. Küpper, H., Lombi, E., Zhao, F.J., and McGrath, S.P. (2000) Cellular compartimentation of cadmium and zinc in relation to other elements in the hyperaccumulator Arabidopsis halleri. Planta 212: 75-84. 122. Kutchko, B. and Kim, A. (2006) Fly ash characterization by SEM–EDS. Fuel 85: 2537-2544 123. Lambrecht, M., Okon, Y., Vande Broek, A., and Vanderleyden, J. (2000) Indole3-acetic acid: a reciprocal signalling molecule in bacteria–plant interactions. Trends in Microbiology 8: 298-300. 124. Lavania, M., Singh Chauhan , P., Chauhan, S.V.S., Singh, H.B., and Nautiyal, C.S. (2006) Induction of plant defense enzymes and phenolics by treatment with plant growth–promoting rhizobacteria Serratia marcescens NBRI1213. Current Microbiology 52: 363-368. 125. Lavrinenko, K., Chernousova, E., Gridneva, E., Dubinina, G., Akimov, V., Kuever, J., Lysenko, A., and Grabovich, M. (2010) Azospirillum thiophilum sp. nov., a 184 Capítulo 10 diazotrophic bacterium isolated from a sulfide spring. International journal of systematic and evolutionary microbiology 60: 2832-2837. 126. Leon-Reyes, A., Spoel, S.H., De Lange, E.S., Abe, H., Kobayashi, M., Tsuda, S., Millenaar, F.F., Welschen, R.A.M. Ritsema, T., and Pieterse, C.M.J. (2009) Ethylene modulates the role of NONEXPRESSOR OF PATHOGENESISRELATED GENES1 in cross talk between salicylate and jasmonate signaling. Plant physiology 149: 1797–809. 127. Levanony, H. y Bashan, Y. (1991) Active attachment of Azospirillum brasilense to root surface of non-cereal plants and to sand particles. Plant and Soil 137: 91-97. 128. Lin, S.Y., Young, C.C., Hupfer, H., Siering, C., Arun, A.B., Chen, W.M., Lai, W.A., Shen, F.T., Rekha, P.D. and Yassin, A. F. (2009) Azospirillum picis sp. nov., isolated from discarded tar. International journal of systematic and evolutionary microbiology 59: 761-765. 129. Lin, S.Y., Liu, Y.C., Hameed, A., Hsu, Y.H., Lai, W.A., Shen, F.T., and Young, C.C. (2013) Azospirillum fermentarium sp. nov., a novel nitrogen-fixing species isolated from a fermenter in Taiwan. International journal of systematic and evolutionary microbiology. 61: 45-49. 130. Lin, S.Y., Shen, F.T., Young, L.S., Zhu, Z.L., Chen, W.M., and Young, C.C. (2012) Azospirillum formosense sp. nov., a diazotroph from agricultural soil. International journal of systematic and evolutionary microbiology 62: 1185-1190. 131. Livak, K.J., and Schmittgen, T.D. (2001) Analysis of Relative Gene Expression Data Using Real-Time Quantitative PCR and the 2−ΔΔCT. Method. Methods 25: 402-408. 132. López, M.A., Bannenberg, G., and Castresana, C. (2008) Controlling hormone signaling is a plant and pathogen challenge for growth and survival. Current opinion in plant biology 11: 420-427. 133. Lovaisa, N.C., Salazar, S.M., and Pedraza, R.O. (2012) Effect of inoculation with Azospirillum and Burkholderia in strawberry plants grown in two different soils. Proceedings of Argentine Microbiology Association Symposium. CD ROM, Tucumán. 134. Lugtenberg, B., and Kamilova, F. (2009) Plant-growth-promoting rhizobacteria. Annual review of microbiology 63: 541-556. 135. Lugtenberg, B.J.J., Chin-A-Woeng, T.F.C., and Bloemberg, G.V. (2002) Microbeplant interactions: principles and mechanisms. Antonie van Leeuwenhoek 81: 373– 83. 136. Madigan, M., Martinko, J., and Parker, J. (2000) Brock Biology of Microorganisms 9na Edición. New Jersey: Prentice Hall. 137. Magalhaes, F.M., Baldani, J.I., Souto, S.M., Kuykendall, J.R., and Döbereneir, J. (1985) A new acid-tolerant Azospirillum species. Annals Academy Brasil Genetics 55:417-430. 185 Capítulo 10 138. Manners, J.G. (1993) Principles of Plant Pathology. Cambridge Univ. Press, pp.1343. 139. Marschner, H. (2011) Marschner's mineral nutrition of higher plants. Ed. Petra Marschner. Vol. 89. Elsevier, Amsterdam. 140. Martens, D.A. (2002) Identification of phenolic acid composition of alkaliextracted plants and soils. Soil Science Society of America Journal 66: 1240-1248. 141. Martínez Barroso, M.C. and Alvarez, C.E. (1997) Toxicity symptoms and tolerance of strawberry to salinity in the irrigation water. Scientia horticulturae 3: 177-188. 142. Martínez-Morales, L.J., Soto-Urzúa, L., Baca, B.E., and Sánchez-Ahédo, J.A. (2003) Indole-3-butyric acid (IBA) production in culture medium by wild strain Azospirillum brasilense. FEMS Microbiology Letters 228:167–173. 143. Martínez-Zamora, M.G., Grellet-Bournonville, C.F., Castagnaro, A.P., and DíazRicci, J.C. (2012) Identification and characterization of a novel class I endo-β-1, 3glucanase regulated by salicylic acid, ethylene and fungal pathogens in strawberry. Functional Plant Biology 39: 412-420. 144. Maurhofer, M., Hase, C., Meuwly, P., Metraux, J.P., and Defago, G. (1994) Induction of systemic resistance of tobacco to tobacco necrosis virus by the rootcolonizing Pseudomonas fluorescens strain CHA 0: Influence of the gacA gene and of pyoverdine production. Phytopathology 84: 139-146. 145. Mehnaz, S., WeselowskI, B., and Lazarovits, G. (2007a) Azospirillum zeae sp. nov., a diazotrophic bacterium isolated from rhizosphere soil of Zea mays. International journal of systematic and evolutionary microbiology 57: 2805-2809. 146. Mehnaz, S., WeselowskI, B., and Lazarovits, G. (2007b) Azospirillum canadense sp. nov., a nitrogen-fixing bacterium isolated from corn rhizosphere. International journal of systematic and evolutionary microbiology 57: 620-624. 147. Miché, L., Battistoni, F., Gemmer, S., Belghazi, M., and Reinhold-Hurek, B. (2006) Upregulation of jasmonate-inducible defense proteins and differential colonization of roots of Oryza sativa cultivars with the endophyte Azoarcus sp. Molecular plant-microbe interactions 19: 502-511. 148. Michiels, K.W., Croes, C.L., and Vanderleyden, J. (1991) Two different modes of attachment of Azospirillum brasilense Sp7 to wheat roots. J. Gen. Microbiol. 137: 2241-2246. 149. Miles, A.A. and Misra, S.S. (1938) The estimation of the bactericidal power of the blood. Journal of Hygiene 38, 732-738. 150. Mittler, R. and Zilinskas, B.A. (1994) Regulation of pea cytosolic ascorbate peroxidase and other antioxidant enzymes during the progression of drought stress and following recovery from drought. Plant Journal 5: 397–405. 151. Mittler, R., Vanderauwera, S., Gollery, M., and Van Breusegem, F. (2004) Reactive oxygen gene network of plants. Trends in plant science 9: 490–498. 186 Capítulo 10 152. Moens, S., Schloter, M., and Vanderleyden, J. (1996) Expression of the structural gene, laf1, encoding the flagellin of the lateral flagella in Azospirillum brasilense Sp7. Journal of Bacteriology 178: 5017-5019 153. Møller, I.M., Jensen, P.E., and Hansson, A. (2007) Oxidative modifications to cellular components in plants. Annual review of plant biology 58: 459–81. 154. Morgenstern, E. and Okon, Y. (1987) Promotion of plant growth and NO3‐and Rb+ uptake in Sorghum bicolor×Sorghum sudanense inoculated with Azospirillum brasilense‐Cd. Arid Land Research and Management 1: 211-217. 155. Morikawa, C.K. and Saigusa, M. (2004) Mineral composition and accumulation of silicon in tissues of blueberry (Vaccinum corymbosus cv. Bluecrop ) cuttings. Plant and Soil 258: 1-8. 156. Mur, L.A., Kenton, P., Atzorn, R., Miersch, O., and Wasternack, C. (2006) The outcomes of concentration-specific interactions between salicylate and jasmonate signaling include synergy, antagonism, and oxidative stress leading to cell death. Plant Physiology 140: 249-262. 157. Muruganantham, S., Anbalagan, G., and Ramamurthy, N. (2009) FT-IR and SEMEDS comparative analysis of medicinal plants, Eclipta alba Hassk. and Eclipta prostrata Linn. Romanian J Biophys 19(4): 285–294. 158. Navarro, L., Dunoyer, P., Jay, F., Arnold, B., and Dharmasiri, N. (2006) A plant miRNA contributes to antibacterial resistance by repressing auxin signaling. Science 312: 436–39. 159. Nelson, D.W. and Sommers, L.E. (1982) Total carbon, organic carbon and organic matter. In: Page, A.L., Miller, R.H., Keeney, D.R. (Eds.), Methods of Soil Analysis, Part 2. Chemical and Microbiological Properties, second ed. American Society of Agronomy Inc., Madison, WI, pp. 539–579. 160. Nishimura, M.T., Stein, M., Hou, B H., Vogel, J.P., Edwards, H., and Somerville, S.C. (2003) Loss of a callose synthase results in salicylic acid-dependent disease resistance. Science 301: 969-972. 161. Ohme-Takagi, M., Suzuki, K., and Shinshi, H. (2000) Regulation of ethyleneinduced transcription of defense genes. Plant and Cell Physiology 41: 1187-1192. 162. Okon, Y. (1985) Azospirillum as a potential inoculant for agriculture. Trends in Biotechnology 3:223-228. 163. Okon, Y. and Vanderleyden, J. (1997) Root-associated Azospirillum species can stimulate plants. ASM News 63:366-370. 164. Okon, Y., and Kapulnik, Y. (1986) Development and function of Azospirilluminoculated roots. Plant and Soil 90: 3-16. 165. Oliveira, R.G.B. and Drozdowicz, A. (1988) Are Azospirillum bacteriocins produced and active in soil? Azospirillum IV: Genetics, physiology, ecology. W. Klingmüller Ed. Springer-Verlag, Berlin, Heidelberg. pp 101–108. 166. Pacovsky, R.S. (1990) Development and growth effects in the sorghumAzospirillum association. Journal of Applied Bacteriology 68: 555–563 187 Capítulo 10 167. Patriquin, D.G., Doebereiner, J., and Jain, D.K. (1983) Sites and processes of association between diazotrophs and grasses. Canadian Journal of Microbiology Vol. 29, pp. 900-915. 168. Paul, E.A. and Clark, F.E. (1996) Soil Microbiology and Biochemistry. Second Edition. Academic Press. San Diego. CA. 169. Pedraza R.O., Guerrero-Molina M.F., Winik B.C., Tortora M.L., Ragout A.L., Teixeira K.R. y Baca B.E. (2010). “Association between Azospirillum brasilense and strawberry plants (Fragaria ananassa): chemotaxis and root colonization”. Rhizophere , Biodiversity and Sustainable Agriculture (TIRBAS). pp. 195-213. 170. Pedraza, R.O., Motok, J., Tortora, M.L., Salazar, S.M., Díaz Ricci, J.C. (2007) Natural occurrence of Azospirillum brasilense in strawberry plants. Plant and Soil 295: 169-178. 171. Peng, G., Wang, H., Zhang, G., Hou, W., Liu, Y., Wang, E.T., and Tan, Z. (2006) Azospirillum melinis sp. nov., a group of diazotrophs isolated from tropical molasses grass. International journal of systematic and evolutionary microbiology 56: 1263-1271. 172. Penmetsa, R.V. and Cook, D.R. (1997) A legume ethylene-insensitive mutant hyperinfected by its rhizobial symbiont. Science 275: 527-530. 173. Pérez, D. and Mazzone, L. (2004) La actividad frutillera en la provincia de Tucumán y Argentina. EEAOC Publicación Especial Nº 26, 100 pp. 174. Pfaffl, M.W., Tichopad, A., Prgomet, C., and Neuvians, T.P. (2004) Determination of stable housekeeping genes, differentially regulated target genes and sample integrity: BestKeeper–Excel-based tool using pair-wise correlations. Biotechnology letters 26: 509-515. 175. Pieterse, C.M., Van der Does, D., Zamioudis, C., Leon-Reyes, A., and Van Wees, S. C. (2012) Hormonal modulation of plant immunity. Annual review of cell and developmental biology 28: 489-521. 176. Pieterse, C.M.J., Leon-Reyes, A., Van der Ent, S., and Van Wees. S.C.M. (2009) Networking by small-molecule hormones in plant immunity. Nature chemical biology 5: 308–16. 177. Potrich, D.P., Passaglia, L.M.P., and Schrank, I.S. (2001) Partial characterization of nif genes from the bacterium Azospirillum amazonense. Brazilian Journal of Medical and Biological Research 34: 1105–1113. 178. Prigent‐Combaret, C., Blaha, D., Pothier, J.F., Vial, L., Poirier, M.A., Wisniewski‐ Dyé, F., and Moënne‐Loccoz, Y. (2008) Physical organization and phylogenetic analysis of acdR as leucine‐responsive regulator of the 1‐aminocyclopropane‐1‐ carboxylate deaminase gene acdS in phytobeneficial Azospirillum lipoferum 4B and other Proteobacteria. FEMS microbiology ecology 65: 202-219. 179. Prinsen, E., Costacurta, A., Michiels, K., Vanderleyden, J., Van Onckelen, H. (1993) Azospirillum brasilense indole-3-acetic acid biosynthesis: evidence for a non-tryptophan dependent pathway. Molecular Plant Microbe Interactions 6: 609609. 188 Capítulo 10 180. Ramamoorthy, V., Viswanathan, R., Raguchander, T., Prakasam, V., and Samiyappan, R. (2001) Induction of systemic resistance by plant growth promoting rhizobacteria in crop plants against pests and diseases. Crop protection 20: 1-11. 181. Ramey, B.E., Koutsoudis, M., Von Bodman, S.B., and Fuqua, C. (2004) Biofilm formation in plant–microbe associations. Current Opinion in Microbiology 7: 602– 609. 182. Ramos, H.J., Roncato-Maccari, L.D., Souza, E.M., Soares-Ramos, J.R., Hungria, M., and Pedrosa, F.O. (2002) Monitoring Azospirillum-wheat interactions using the gfp and gusA genes constitutively expressed from a new broad-host range vector. Journal of Biotechnology 97: 243-252. 183. Reinhold, B., Hurek, T., Fendrik, I., Pot, B., Gillis, M., Kersters, K., Thielei, S., and De Ley, J. (1987) Azospirillum halopraeferens sp. nov., a nitrogen-fixing organism associated with roots of Kallar grass (Leptochloa fusca (L.) Kunth). International Journal of Systematic Bacteriology 37: 43-51. 184. Ribaudo, C.M., Krumpholz, E.M., Cassán, F.D., Bottini, R., Cantore, M.L., and Curá, J.A. (2006) Azospirillum sp. promotes root hair development in tomato plants through a mechanism that involves ethylene. Journal of Plant Growth Regulation 25: 175-185. 185. Rivera‐Becerril, F., Calantzis, C., Turnau, K., Caussanel, J. P., Belimov, A.A., Gianinazzi, S., Strasser R.J., and Gianinazzi‐Pearson, V. (2002) Cadmium accumulation and buffering of cadmium‐induced stress by arbuscular mycorrhiza in three Pisum sativum L. genotypes. Journal of Experimental Botany 53: 1177-1185. 186. Rodelas, B., Salmerón, V., Martínez-Toledo, M.V., and González-López, J. (1993) Production of vitamins by Azospirillum brasilense in chemically-defined media. Plant and Soil 153: 97-101. 187. Rodriguez, G. and Pérez, D. (2013) Cultivo de frutilla: actividad comercial en la Argentina y Tucumán. Gastos de producción estimados en Tucumán, campaña 2012 y perspectivas para 2013. Reporte agroindustrial, Eds. Estación Experimental Agroindustrial Obispo Colombres. 79: 1-7. 188. Rodriguez, G., Pérez, D., and Paredes, P. (2010) Cultivo de frutilladinámica comercial de la Argentina y Tucumán (2005-2009) y gastos de producción estimados para Tucumán (2010) Reporte agroindustrial, Eds. Estación Experimental Agroindustrial Obispo Colombres. 48: 1-7. 189. Rojas-Tapias, D., Moreno-Galván, A., Pardo-Díaz, S., Obando, M., Rivera, D., and Bonilla, R. (2012) Effect of inoculation with plant growth-promoting bacteria (PGPB) on amelioration of saline stress in maize (Zea mays). Applied Soil Ecology 61: 264-272. 190. Ruíz-Sánchez, M., Armada, E., Muñoz, Y., García de Salamone, I.E., Aroca, R., Ruíz-Lozano, J.M., and Azcón, R. (2011) Azospirillum and arbuscular mycorrhizal colonization enhance rice growth and physiological traits under well-watered and drought conditions. Journal of plant physiology 168: 1031-1037. 191. Russell, R. S. (1977) Plant Root Systems: Their Function and Interaction with the Soil. McGraw-Hill, London. 189 Capítulo 10 192. Saied, A.S., Keutgen, A.J., and Noga, G. (2005) The influence of NaCl salinity on growth, yield and fruit quality of strawberry cvs. „Elsanta‟ and „Korona‟. Scientia Horticulturae 103: 289-303. 193. Salazar, S.M., Castagnaro, A.P., Arias, M.E., Chalfoun, N.R., Tonello, U., and Díaz-Ricci, J.C. (2007) Induction of a defense response in strawberry mediated by an avirulent strain of Colletotrichum. European Journal of Plant Pathology 117: 109-122. 194. Sambrook, J., Fritsch, E.F. y Maniatis, T. (1989) Molecular Cloning. In: Ford N (ed) A laboratory manual, 2nd edn. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY. 195. Samuels, A.L., Glass, A.D.M., Ehret, D.L., Menzies, J.G. (1991) Mobility and deposition of silicon in cucumber plants. Plant Cell Environ 14: 485-492. 196. Sanger, F., Nicklen, S., and Coulson, A.R. (1977) DNA sequencing with chainterminating inhibitor. Proceedings of National Academy of Sciences 74: 5463-5467 197. Santner, A., Calderon-Villalobos, L.I.A., and Estelle, M. (2009) Plant hormones are versatile chemical regulators of plant growth. Nature chemical biology 5:301-307. 198. Saravanakumar, D., Vijayakumar, C., Kumar, N., and Samiyappan, R. (2007) PGPR-induced defense responses in the tea plant against blister blight disease. Crop Protection 26: 556-565. 199. Saubidet, M.I., Fatta, N., and Barneix, A.J. (2002) The effect of inoculation with Azospirillum brasilense on growth and nitrogen utilization by wheat plants. Plant Soil 245: 215–222. 200. Saxena, B., Modi, M., and Modi, V.V. (1986) Isolation and characterization of siderophores from Azospirillum lipoferum D-2. Journal of general microbiology 132: 2219-2224. 201. Schippers, B., Bakker, A.W., and Bakker, P.A.H.M. (1987) Interactions of deleterious and beneficial rhizosphere microorganisms and the effect of cropping practices. Annual Reviews of Phytopathology 25: 339– 58. 202. Shah, S., Karkhanis, V., and Desai, A. (1992) Isolation and characterization of siderophore, with antimocrobial activity, from Azospirillum lipoferum. Current Microbiology 25: 347–351. 203. Sherwood, R.T. and Vance, C.P. (1980) Resistance to fungal penetration in Gramineae. Phytopathology 70: 273–279. 204. Siddiqui, I.A. and Shaukat, S. (2005) Pseudomonas aeruginosa mediated induction of systemic resistance in tomato against root knot nematode. Journal of Phytopathology 4:21–25. 205. Singleton, V.L. and Rossi, J. (1965) Colorimetry of total phenolics with phosphomolybdic-phosphothungstic acid reagents. American Journal of Enology and Viticulture 16: 144-158. 206. Sly, L.I. and Stackebrandt, E. (1999) Description of Skermanella parooensis gen. nov., sp. nov. to accommodate Conglomeromonas largomobilis subsp. parooensis 190 Capítulo 10 following the transfer of Conglomeromonas largomobilis subsp. largomobilis to the genus Azospirillum. International journal of systematic bacteriology 49: 541-544. 207. Somers, E., Ptacek, D., Gysegom, P., Srinivasan, M., and Vanderleyden, J. (2005) Azospirillum brasilense produces the auxin-like phenylacetic acid by using the key enzyme for indole-3-acetic acid biosynthesis. Applied and environmental microbiology 71: 1803-1810. 208. Sorensen, J. (1997) The rhizosphere as a habitat for soil microorganisms. Modern Soil Microbiology, Marcel Dekker, New York. pp. 21-45. 209. Spaepen, S. and Vanderleyden, J. (2011) Auxin and plant-microbe interactions. Cold Spring Harbor perspectives in biology 3: 1-13. 210. Spaepen, S., Vanderleyden, J., and Remans, R. (2007) Indole-3-acetic acid in microbial and microorganism-plant signaling. FEMS microbiology reviews 31: 425–48. 211. Staswick, P.E., Serban, B., Rowe, M., Tiryaki, I., Maldonado, M.T., Maldonado, M.C., and Suza, W. (2005) Characterization of an Arabidopsis enzyme family that conjugates amino acids to indole-3-acetic acid. The Plant Cell 17: 616-627. 212. Steehnoudt, O. and Vanderleyden, J. (2000) Azospirillum a free living nitrogenfixing bacterium closely associated with grasses: genetic, biochemical and ecological aspects. FEMS Microbiology Reviews 24:481-506. 213. Steenhoudt, O., Keijers, V., Okon, Y., and Vanderleyden, J. (2001) Identification and characterization of a periplasmic nitrate reductase in Azospirillum brasilense Sp245. Archives of Microbiology 175: 344-352. 214. Sturz, A.V., Christie, B.R., Matheson, B.G., Arsenault, W.J., and Buchanan, N.A. (1999) Endophytic bacterial communities in the periderm of potato tubers and their potential to improve resistance to soil-borne plant pathogens. Plant pathology 48: 360-369. 215. Subbarao, K.V., Kabir, Z., Martin, F.N., Koike, S.T. (2007) Management of soilborne diseases in strawberry using vegetable rotation. Plant disease 91: 964-972 216. Szechyńska-Hebda, M., Kruk, J., Górecka, M., Karpińska, B., and Karpiński, S. (2010) Evidence for light wavelength-specific photoelectrophysiological signaling and memory of excess light episodes in Arabidopsis. The Plant Cell 22: 2201-2218. 217. Szynkowska, M.I., Pawlaczyk, A., and Rogowski, J. (2011) Characterization of Particles Transmitted by Wind from Waste Dump of Phosphatic Fertilizers Plant Deposited on Biological Sample Surfaces. 218. Taiz, L. and Zeiger, E. (2002) Plant Physiology. Massachusetts: Sinauer Associates Inc. Publishers. 219. Tarrand, J.J., Krieg, N.R., and Döbereiner, J.(1978) A taxonomic study of the Spirillum lipoferum group, with description of a new genus, Azospirillum gen. nov. and two species, Azospirillum lipoferum (Beijerinck) comb. nov. and Azospirillum brasilense sp. nov. Canadian Journal of Microbiology 24: 967-980. 191 Capítulo 10 220. Tchan, Y.T. (1988) Some aspects of non-rhizobial diazotrophs, their past and their future. J.R. Kennedy (ed) Microbiology in action. Research Studies Press Ltd. Letchworth. 221. Thomma, B.P., Penninckx, I.A., Cammue, B., and Broekaert, W.F. (2001). The complexity of disease signaling in Arabidopsis. Current opinion in immunology 13: 63-68. 222. Timmusk, S. (2003) Mechanism of action of the plant growth promoting bacterium Paenibacillus polymyxa.Acta Universtaties Upsaliensis. Comprehensive Summaries of Uppsala dissertation from the Faculty of Science and Technology. pp. 1-40. 223. Timmusk, S. and Wagner, E.G.H. (1999) The plant-growth-promoting rhizobacterium Paenibacillus polymyxa induces changes in Arabidopsis thaliana gene expression: a possible connection between biotic and abiotic stress responses. Molecular Plant-Microbe Interactions 12: 951-959. 224. Tortora, M.L., Díaz-Ricci, J.C., and Pedraza, R.O. (2011) Azospirillum brasilense siderophores with antifungal activity against Colletotrichum acutatum. Archives of Microbiology 193: 275-286. 225. Tortora, M.L., Díaz-Ricci, J.C., and Pedraza, R.O. (2012) Protection of strawberry plants (Fragaria ananassa Duch.) against anthracnose disease induced by Azospirillum brasilense. Plant and Soil 356: 279-290. 226. Trainotti, L., Pavanello, A., and Casadoro, G. (2005) Different ethylene receptors show an increased expression during the ripening of strawberries: does such an increment imply a role for ethylene in the ripening of these non-climacteric fruits? Journal of experimental botany 56: 2037–46. 227. Turhan, E. and Eris, A. (2004) Effects of sodium chloride applications and different growth media on ionic composition in strawberry plant. Journal of plant nutrition 27: 1653-1665. 228. Umali-García, M., Hubbell, D.H., Gaskins, M.H., and Dazzo, F.B. (1980) Association of Azospirilum with grass roots. Applied Environmental Microbiology 39: 219–226. 229. Van Etten, H.D., Mansfield, J.W., Bailey, J.A., and Farmer, E.E. (1994) Two classes of plant antibiotics phytoalexins versus “phytoanticipins”. Plant Cell 6: 1191–1192. 230. Van Loon, L.C., Bakker, P.A.H.M., and Pieterse, C.M.J. (1998) Systemic resistance induced by rhizosphere bacteria. Annual review of phytopathology 36: 453–483. 231. Van Puyvelde, S., Cloots, L., Engelen, K., Das, F., Marchal, K., Vanderleyden, J., and Spaepen, S. (2011) Transcriptome analysis of the rhizosphere bacterium Azospirillum brasilense reveals an extensive auxin response. Microbial ecology 61: 723-728. 232. Van Wees, S.C., Pieterse, C M., Trijssenaar, A., Van't Westende, Y.A., Hartog, F., and Van Loon, L.C. (1997) Differential induction of systemic resistance in 192 Capítulo 10 Arabidopsis by biocontrol bacteria. Molecular Plant Microbe Interactions 10: 716724. 233. Van Wees, S.C., De Swart, E.A., Van Pelt, J.A., Van Loon, L.C., and Pieterse, C.M. (2000) Enhancement of induced disease resistance by simultaneous activation of salicylate-and jasmonate-dependent defense pathways in Arabidopsis thaliana. Proceedings of the National Academy of Sciences 97: 8711-8716. 234. Vanbleu, E. and Vanderleyden, J. (2003) Molecular genetics of rhizosphere and plant root colonization. Associative and Endophytic Nitrogen-fixing Bacteria and Cyanobacterial Asociations 5: 1-27. 235. Vande Broek, A., Gysegom, P., Ona, O., Hendrickx, N., Prinsen, E., Van Impe, J., and Vanderleyden, J. (2005) Transcriptional analysis of the Azospirillum brasilense indole-3-pyruvate decarboxylase gene and identification of a cis-acting sequence involved in auxin responsive expression. Molecular Plant Microbe Interactions 18: 311-323. 236. Vande-Broek, A. and Vanderlyden, J. (1995) The role of bacterial motility, chemotaxis and attachment in Bacteria-Plant interactions. Molecular Plant Microbe Interactions 8: 800-810. 237. Vande-Broek, A., Dobberlaere, S., Vanderleyden, J. y Van Dommelen, A. (2000) Azospirillum plant roots interactions: signalling and metabolic interactions. Horizon Specific Press, Wymondham, UK. 761-777. 238. Vande-Broek, A., Michiels, J., Van Gool, A., and Vanderleyden, J. (1993) Spatialtemporal colonization patterns of Azospirillum brasilense on the wheat root surface and expression of the bacterial nifH gene during association. Molecular Plant Microbe Interactions 6: 592–600. 239. Venable, J.H. and Coggeshall, R. (1965) A simplified lead citrate stain for use in electron microscopy. The Journal of Cell Biology 25: 407-408. 240. Vleesschauwer, D.D., Cornelis, P., and Höfte, M. (2006) Redox-active pyocyanin secreted by Pseudomonas aeruginosa 7NSK2 triggers systemic resistance to Magnaporthe grisea but enhances Rhizoctonia solani susceptibility in rice. Molecular Plant Microbe Interactions 19: 1406–1419. 241. Vlot, A.C., Dempsey, D.M.A., and Klessig, D.F. (2009) Salicylic acid, a multifaceted hormone to combat disease. Annual reviews of phytopathology 47: 177-206. 242. Vlot, A.C., Klessig, D.F., and Park, S.W. (2008) Systemic acquired resistance: the elusive signal(s). Curr. Opin. Plant Biol. 11: 436–442 243. Von Röpenack, E., Parr, A., and Schulze-Lefert, P. (1998) Structural analyses and dynamics of soluble and cell wall-bound phenolics in a broad spectrum resistance to the powdery mildew fungus in barley. Journal of Biological Chemistry 273: 9013-9022. 244. Wang D, Pajerowska-Mukhtar, K., Hendrickson Culler, A., and Dong, X. (2007) Salicylic acid inhibits pathogen growth in plants through repression of the auxin signaling pathway. Current Biology 17: 1784–90 193 Capítulo 10 245. Wang, K.L.C., Li, H., and Ecker, J.R. (2002) Ethylene biosynthesis and signaling networks. The Plant Cell 14: 131-151. 246. Weyens, N., Boulet, J., Adriaensen, D., Timmermans, J.P., Prinsen, E., Van Oevelen, S., D‟Haen, J., Smeets, K., Van der Lelie, D., Taghavi, S., and Vangronsveld, J. (2012) Contrasting colonization and plant growth-promoting capacity between wild type and a gfp-derivative of the endophyte Pseudomonas putida W619 in hybrid poplar. Plant and Soil 356: 217-230. 247. Wildermuth, M.C., Dewdney, J., Wu, G., and Ausubel, F.M. (2001) Isochorismate synthase is required to synthesize salicylic acid for plant defence. Nature 414: 562571. 248. Xie, C. H., and Yokota, A. (2005) Azospirillum oryzae sp. nov., a nitrogen-fixing bacterium isolated from the roots of the rice plant Oryza sativa. International journal of systematic and evolutionary microbiology 55: 1435-1438. 249. Yong, Z., Hao-Ru, T., Ya, L., Hao, J., and Ou Yanxia, H. (2009) Cloning and sequencing of strawberry chitinase gene CHI2. Research Journal of Biological Sciences 4: 624-628. 250. Young, C.C., Hupfer, H., Siering, C., Ho, M.J., Arun, A.B., Lai, W.A., Rekha, P.D., Shen, F.T., Hung, M.H., Chen, W.M., and Yassin, A.F. (2008) Azospirillum rugosum sp. nov., isolated from oil-contaminated soil. International journal of systematic and evolutionary microbiology 58: 959-963. 251. Zhang, Y.A., Burris, R.H., Ludden, P.W., and Roberts, G.P.(1993) Posttranslational regulation of nitrogenase activity by anaerobiosis and ammonium in Azospirillum brasilense. Journal of bacteriology 175: 6781-6788. 252. Zhang, Z., Li, Q., Li, Z., Staswick, P.E., Wang, M., Zhu, Y., He, Z. (2007) Dual regulation role of GH3. 5 in salicylic acid and auxin signaling during ArabidopsisPseudomonas syringae interaction. Plant Physiology 145: 450–464. 253. Zhang, Z., Schwartz, S., Wagner, L., and Miller, W. (2000) A greedy algorithm for aligning DNA sequences. Journal of Computational biology 7: 203-214. 254. Zhou, S., Han, L., Wang, Y., Yang, G., Zhuang, L., and Hu, P. (2012) Azospirillum humicireducens sp. nov., a nitrogen-fixing bacterium isolated from a microbial fuel cell. International journal of systematic and evolutionary microbiology 63: 126-130. 255. Zhou, Y., Wei, W., Wang, X., Xu, L., and Lai, R. (2009) Azospirillum palatum sp. nov., isolated from forest soil in Zhejiang province, China. The Journal of general and applied microbiology 55: 1-7. 256. Zhulin, I.B. and Armitage, J.P. (1993) Motility, chemokinesis, and methylation independent chemotaxis in Azospirillum brasilense. Journal of Bacteriology 175: 952-958. 257. Zipfel, C., Robatzek, S., Navarro, L., Oakeley, E.J., Jones, J.D., Felix, G., and Boller, T. (2004) Bacterial disease resistance in Arabidopsis through flagellin perception. Nature 428: 764-767. 194