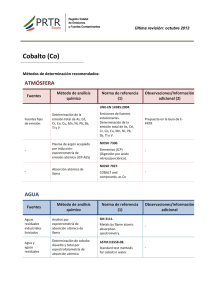
- Ninguna Categoria
universidad nacional autónoma de méxico
Anuncio
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE ESTUDIOS SUPERIORES CUAUTITLAN CUANTIFICACIÓN DE METALES PESADOS EN ALIMENTOS POR ESPECTROMETRÍA DE ABSORCIÓN ATÓMICA TRABAJO PROFESIONAL QUE PARA OBTENER INGENIERO P R E EL TITULO EN S GUILLERMINA E DE: ALIMENTOS N GARCÍA T A : GONZÁLEZ ASESOR: I.A. PATRICIA MUÑOZ AGUILAR Cuautitlán Izcalli Edo. de México, 2010 AGRADECIMIENTOS A la universidad Nacional Autónoma de México por darnos una formación de excelencia a través de la Facultad de Estudios Superiores Cuautitlán, sus instalaciones, su personal académico y su alumnado. A la maestra Patricia Muñoz Aguilar por su guía, asesoría y enseñanzas a lo largo del desarrollo de este trabajo. Al jurado asignado por su apoyo, su tiempo y por el honor de participar en este trabajo. DEDICATORIAS A Dios, por sus regalos: mi familia, mis seres queridos y la vida A mis padres, por darme la vida, por sus sabios consejos, por su apoyo incondicional y por sus esfuerzos para darme lo mejor. A mi esposo, por su gran apoyo y comprensión para concluir esta meta, gracias por aceptar estar conmigo y por todo el amor que me has dado eres lo mejor que me ha pasado. A mis hijos, por que son mi más preciado tesoro y mi motivo de seguir superándome. A mis suegros por su gran apoyo, comprensión, preocupación y cariño que me han brindado. ÍNDICE RESUMEN 1 1. OBJETIVOS DEL PROYECTO 2 1.1.Antecedentes 1.2.Descripción del desempeño profesional 1.1.1. Puesto desempeñado 1.1.2. Perfil del analista 1.1.3. Objetivos del puesto 1.1.4. Responsabilidad y autoridad del analista 1.1.5. Estructura de la empresa y organigrama 2 3 3 4 4 4 5 2. CONTRIBUCIÓN DE LA FORMACIÓN EN EL DESEMPEÑO PROFESIONAL 6 3. DESARROLLO DEL PROYECTO 8 3.1.Generalidades de los metales 3.1.1. Plomo 3.1.2. Cadmio 3.1.3. Arsénico 3.1.4. Mercurio 3.1.5. Estaño 8 9 10 11 12 13 3.2.Principios generales de espectroscopia de absorción atómica 3.2.1. Análisis cuantitativo por absorción atómica 3.2.2. Instrumento de absorción atómica 3.2.2.1. Fuente de energía 3.2.2.2. Nebulizador 3.2.2.3. Quemador y flama 3.2.2.4. Monocromador 3.2.2.5. Sistema de detección 3.2.3. Principales interferencias en absorción atómica 3.2.3.1. Interferencias de matriz 3.2.3.2. Interferencias químicas 3.2.3.3. Interferencias por ionización 15 16 17 17 19 20 21 21 22 22 23 23 3.3.Metodología utilizada en la empresa para el análisis de metales pesados 3.3.1. Acondicionamiento del instrumento Perkin Elmer 3100 3.3.1.1. Alineación de la lámpara 3.3.1.2. Alineación del quemador 3.3.1.3. Encendido de la flama 3.3.1.4. Verificación de la alineación con estándar de Cu. 3.3.1.5. Análisis de la muestra por flama 3.3.1.6. Selección del número de estándares 3.3.1.7. Generador de hidruros 24 24 26 28 29 30 30 31 33 3.3.1.8. Instalación de la celda de cuarzo 3.3.1.9. Análisis de la muestra por generador de hidruros 3.3.1.10.Mantenimiento del espectrofotómetro 3.3.1.11.Principales fallas comunes en absorción atómica 33 34 36 37 3.3.2. Preparación de la muestra en base a la NOM-117-SSA1-1994 3.3.2.1. Reactivos y material 3.3.2.2. Aparatos e instrumentos 3.3.2.3. Preparación y digestión de las muestras 3.3.2.4. Digestión por vía húmeda para estaño 3.3.2.5. Digestión por sistema cerrado para mercurio 3.3.2.6. Digestión por vía seca para arsénico 3.3.2.7. Determinación de metales en agua potable y purificada 3.3.2.8. Expresión de resultados 3.3.2.9. Informe de la prueba 38 38 39 39 41 42 43 44 44 45 3.4.Determinación de metales en atún enlatado en agua 3.4.1. Resultados y Discusión 4. ANÁLISIS GENERAL SOBRE EL PROYECTO PRESENTADO 46 48 54 CONCLUSIONES 56 RECOMENDACIONES 58 REFERENCIAS CITADAS 60 GLOSARIO 64 ÍNDICE DE FIGURAS Figura 1. Figura 2. Figura 3. Figura 4. Figura 4a Figura 5. Figura 6. Figura 7. Figura 8. Figura 9. Figura 10. Figura 11. Figura 12. Figura 13. Figura 14. Proceso de absorción atómica Espectrofotómetro de absorción atómica Lámpara de cátodo hueco Lámpara de descarga sin electrodos Generador de voltaje Nebulizador Tipos de quemador Monocromador Espectrofotómetro Perkin Elmer 3100 Parte lateral del espectrofotómetro Perkin Elmer 3100 Instalación de la lámpara Tornillos para la alineación del quemador Rotámetro Instalación de la celda de cuarzo Generador de hidruros 15 17 18 19 19 20 20 21 24 26 27 28 29 34 36 ÍNDICE DE TABLAS Tabla 1. Tabla 2. Tabla 3. Tabla 4. Tabla 5. Tabla 6. Tabla 7. Tabla 8. Tabla 9. Tabla 10. Tabla 11. Tabla 12. Parámetros de operación Especificaciones del equipo 3100 Relación de gases Intervalos de trabajo Limites máximos (Nom-028-SSA1-1993) Especificaciones de estándares Concentraciones utilizadas de estándares Porciento de recuperación Calculo de mercurio en mg/l Calculo de mercurio en mg/kg Resultados obtenidos del lote 1 Resultados obtenidos del lote 2 25 25 29 32 46 47 47 51 51 51 53 53 RESUMEN El presente trabajo está enfocado a describir las actividades desarrolladas en la empresa de Jorge Rodríguez García denominada Laboratorio Microanalítico de Control, así como mencionar el importante papel que desempeña un Ingeniero en Alimentos en las áreas de control de calidad. Dicha empresa es un Laboratorio Tercero autorizado donde se realizan análisis químicos en alimentos, agua potable, agua residual y ambiente laboral. Los metales pesados son de gran interés debido a que tienen efectos negativos sobre la salud humana, ya que la presencia de estos en los alimentos ocasionan daño a quien los consume. La vía oral es la fuente primaria para adquirir esta contaminación, por esto la importancia que representa el estudio de los alimentos como fuente principal de la presencia de metales en el organismo. La técnica analítica utilizada para la cuantificación de metales pesados está basada en la Norma Oficial Mexicana NOM-117-SSA1-1994 para la determinación de cadmio, arsénico, plomo, cobre, fierro, zinc y mercurio en alimentos, agua potable y agua purificada utilizando un Espectrofotómetro de Absorción Atómica Perkin Elmer 3100 con generador de hidruros. Este informe contempla primeramente algunos antecedentes de la empresa, señalando el puesto profesional desempeñado (Químico Analista), el perfil, los objetivos, la responsabilidad y autoridad del analista, evidenciando la estructura de la empresa mediante un organigrama. De igual manera se muestra la contribución académica en el desempeño profesional por parte del egresado, posteriormente se presenta el desarrollo del proyecto considerando algunas generalidades de metales pesados, instrumentación y componentes básicos de la absorción atómica, principales interferencias encontradas en la cuantificación de estos contaminantes y las formas de eliminarlas o controlarlas. Después se describe la metodología utilizada en la empresa para la determinación de metales como primer paso: el ajuste, optimización y manejo del Espectrofotómetro de Absorción Atómica Perkin Elmer 3100, indicando los puntos a seguir en el acondicionamiento de dicho instrumento para su posterior utilización en la determinación de metales. Como segundo paso se menciona la preparación de las muestras de acuerdo a la norma citada, la expresión de resultados y el informe final de la prueba. Como tercer paso se ejemplifica el trabajo desempeñado con una muestra de atún enlatado en agua que ingresó a la empresa mostrando los valores encontrados, las curvas de calibración y un análisis de los resultados obtenidos. Finalmente se da una breve discusión sobre el informe presentado, aportando también algunas conclusiones y recomendaciones a la empresa para la mejora y agilización de resultados. Con base a la experiencia laboral, logros y la problemática enfrentada durante el desempeño profesional, para desarrollar el presente trabajo se plantean los siguientes objetivos: 1. OBJETIVOS DEL PROYECTO 1. Realizar un informe en el cual se reflejen las actividades profesionales desempeñadas en la empresa de Jorge Rodríguez García. Mencionando la técnica utilizada para la cuantificación de metales pesados en alimentos por Espectrometría de Absorción Atómica en base a la Norma Oficial Mexicana NOM-117-SSA1-1994; así como la técnica para la optimización del Espectrofotómetro de Absorción Atómica Perkin Elmer 3100. 2. Identificar y cuantificar plomo, cadmio, mercurio y estaño en una muestra de atún enlatado en agua aplicando los conocimientos adquiridos durante la formación universitaria en la carrera de Ingeniero en Alimentos, obteniendo resultados confiables. 1.1 ANTECEDENTES En los últimos años uno de los mayores problemas que enfrenta el ser humano es la contaminación global del planeta, para tratar de controlar algunos de estos problemas y conservar al máximo las características de nuestro medio ambiente, en México se han creado secretarías encargadas de regular, desarrollar y normalizar programas para el control de agentes contaminantes. Por otro lado junto con los programas mencionados se han desarrollado empresas dedicadas al monitoreo, control y cuantificación de dichos contaminantes basándose en los programas y normas propuestos por las secretarías y organismos correspondientes. Una de las empresas dedicadas a las actividades ya mencionadas es la empresa de Jorge Rodríguez García, la cual se fundo 20 años atrás aproximadamente, ubicada en la calle Privada Jardín No.8, Colonia Atlántida, Delegación Coyoacán, México DF. Dicha empresa es un Laboratorio Tercero autorizado donde se realizan análisis químicos en alimentos, agua residual, agua potable y ambiente laboral. Dicho laboratorio está acreditado ante la Entidad de Acreditación Mexicana (EMA), Centro Nacional de Metrología (CENAM) y Comisión Nacional del Agua (CNA), por lo que sus procedimientos de análisis se apegan a las Normas Oficiales Mexicanas vigentes así como el uso de materiales de referencia certificados: Centro Nacional de Metrología ( CENAM), National Institute of Standards and Technology (NIST), y/o High Purity. El laboratorio se encuentra dividido en las siguientes áreas: a) Absorción atómica. Donde se analizan diferentes tipos de metales pesados en alimentos, agua potable, agua residual y filtros empleando un Espectrofotómetro de Absorción Atómica 3100. b) Química húmeda. Aquí se realizan análisis bromatológicos, titulométricos, gravimétricos etc. En esta área se encuentran las siguientes secciones: balanza, estufas y muflas, extracciones con solventes orgánicos, espectrometría de uv-vis, infrarrojo y fluorescencia. c) Cromatografía. Esta área se divide en: § Cromatografía de gases, donde se realizan perfiles de ácidos grasos y la determinación de varios compuestos orgánicos volátiles entre otros. § Cromatografía de líquidos, en la cual se analizan algunas vitaminas, principios activos de medicamentos, colorantes, etc. § Cromatografía de iones, aquí se cuantifican iones como fluoruros, cloruros, nitratos, nitritos, sulfatos etc. d) Microbiología. En esta sección se realizan diferentes tipos de análisis microbiológicos en alimentos, aguas potables y residuales principalmente. 1.2. DESCRIPCIÓN DEL DESEMPEÑO PROFESIONAL EN LA EMPRESA 1.2.1. PUESTO DESEMPEÑADO Químico analista en el área de absorción atómica donde se determinan metales pesados. 1.2.2. PERFIL DEL ANALISTA De acuerdo a los lineamientos de Gestión de la Calidad y a los procedimientos internos de la empresa, el perfil del analista es determinado por los siguientes puntos: § Tener una carrera profesional en cualquier rama de ciencias químico-biológicas. § Tener conocimientos sobre el manejo e interpretación de las normas, métodos e instrumentos de prueba. § Tener iniciativa y disposición para mejorar la empresa. 1.2.3. OBJETIVOS DEL PUESTO § El analista tiene como función básica realizar el análisis de las muestras en forma confiable. § Optimizar, crear y adaptar nuevas técnicas. § Realizar el trabajo analítico a fin de entregar oportunamente los resultados obtenidos. § Obtener resultados analíticos confiables en las pruebas que realiza. § Trabajar con ética y profesionalismo. 1.2.4. RESPONSABILIDAD Y AUTORIDAD DEL ANALISTA § Mantener registros de todas las actividades de control de calidad de acuerdo a los procedimientos establecidos y métodos de prueba. § Manejar las muestras y realizar los análisis de acuerdo a los procedimientos y métodos de prueba. § Elaborar los reportes cuando sean designados por la autoridad competente. § Mantener y calibrar el equipo. § Reportar las deficiencias o fallas al supervisor. § Identificar, registrar y corregir las no conformidades. 1.2.5. ESTRUCTURA DE LA EMPRESA De acuerdo a los procedimientos internos la empresa esta organizada de acuerdo al siguiente organigrama: ORGANIGRAMA Director general Gerente de calidad Representante legal Gerente de finanzas Jefe de laboratorio analítico Analistas de absorción atómica Analistas de química húmeda Analistas de cromatografía Personal de limpieza Analistas de microbiología Personal de captura de datos 2. CONTRIBUCIÓN DE LA FORMACIÓN ACADEMICA EN EL DESEMPEÑO PROFESIONAL Los egresados de la carrera de Ingeniería en Alimentos reúnen el perfil para desarrollarse en diferentes ámbitos laborales, estos atributos son debidos a la formación de excelencia que otorga la Universidad Nacional Autónoma de México a través de la Facultad de Estudios Superiores Cuautitlán , producto de los planes de estudio y de los profesores que imparten las diferentes asignaturas. Lo anterior otorga una gran ventaja, o mejor dicho, una gran fortaleza ya que el alumno cuenta con una capacidad de análisis que lo lleva a una situación de resolver problemas, proponer soluciones e innovar mecanismos en pos del progreso de la Empresa en que labore y la comunidad donde viva. Los retos a los que se enfrenta el Ingeniero en Alimentos son muy grandes, pues se encuentra a un mundo cambiante y globalizado, donde los sistemas de producción, conservación, industrialización y distribución de alimentos deben ser efectivos para satisfacer la cada vez más demandante situación humana, y el egresado cuenta con las herramientas para lograr lo anterior exitosamente. Por otra parte el control de calidad es un área importante ya que asegura la inocuidad y aceptación de los alimentos, es aquí donde los egresados pueden desarrollarse satisfactoriamente utilizando una serie de instrumentos, como el que se describirá en este trabajo (Espectrofotómetro de Absorción Atómica), donde éstos juegan un papel determinante para lograr los objetivos de la calidad. Sin embargo existen muchos otros equipos altamente sensibles (como Espectrometría de Masas, de Infrarrojo, Ultravioleta-Visible, Cromatografía de Líquidos de Alta Resolución, Cromatografía de Gases, etc.), pero si no se cuenta con el criterio, la capacidad analítica y la formación de un profesionista, éstos pasan a ser simples aditamentos dentro de un Laboratorio o una Industria. La aplicación del instrumento de Absorción Atómica es muy variada y versátil, ya que permite analizar una gran variedad de muestras no importando la matriz en la cual se encuentran las mismas, es decir, es posible analizar tanto muestras en estado natural como muestras tratadas o acondicionadas industrialmente. Naturalmente es necesario aplicar diversas técnicas para cada tipo de muestra y estas técnicas dependerán del conocimiento y la destreza del profesionista, ya que teniendo una serie de metodologías a la mano deberá seleccionar la más apropiada, y si no es así deberá diseñar y desarrollar una que le permita alcanzar su objetivo, asegurando que en cualquier momento y en cualquier lugar funcionara, es decir, el método será validado. Durante el desempeño profesional el Ingeniero en Alimentos puede enfrentar y encarar una serie de debilidades y fortalezas. Las primeras son sin lugar a dudas que durante la vida universitaria que el estudiante atraviesa, difícilmente es puesto en contacto con situaciones reales del ambiente laboral, es decir, en la escuela se estudian y analizan situaciones y procesos controlados y probados. Esto representa un problema, pues cuando el estudiante sale al mundo laboral se encuentra con pruebas que no están descritas en los manuales de laboratorio o en los libros de texto, situaciones que sólo pueden ser manejadas gracias a la experiencia y el conocimiento que dan los años de practicar una carrera utilizando y aplicando todo lo aprendido durante la Universidad, en ocasiones es necesario tomar cursos externos para complementar los conocimientos adquiridos durante la carrera como es éste caso ya que se tomaron cursos de: Espectrometría de Absorción Atómica, infrarrojo, ultravioleta-visible y cromatografía de gases para el manejo, entendimiento y funcionamiento de estos instrumentos ampliando así los conocimientos del egresado lo cual dará mayores oportunidades en el área de control de calidad. 3. DESARROLLO DEL PROYECTO Este informe se enfoca específicamente al área de absorción atómica en la determinación de metales pesados de acuerdo a la Norma Oficial Nom-117-SSA1-1994 la cual es aplicable a todo tipo de alimentos (frescos, industrializados, marinos enlatados etc.), agua potable y purificada, utilizando un Espectrofotómetro de Absorción Atómica Perkin Elmer 3100. Mencionando primeramente algunas generalidades de metales pesados y de espectroscopia de absorción atómica posteriormente se da una breve introducción al ajuste, optimización y manejo del instrumento, finalmente se muestran los pasos para el tratamiento previo al análisis de las muestras ejemplificándolo con un lote de atún enlatado en agua ingresado a la empresa. 3.1. GENERALIDADES DE METALES PESADOS A continuación se mencionan algunas generalidades de metales pesados y su importancia para determinarlos: Los metales pesados son de gran interés debido a que tienen efectos negativos sobre la salud humana, ya que la presencia de éstos en los alimentos ocasionan daño a quien los consume. La vía oral es la fuente primaria para adquirir esta contaminación, por esto la importancia que representa el estudio de los alimentos como fuente principal de la presencia de metales en el organismo humano (Raimon, 2002). La contaminación por estos metales en los alimentos puede ser adquirida durante el cultivo, ya sea por las condiciones ambientales del lugar, el agua de riego y el suelo en el que se encuentren, los fertilizantes químicos y plaguicidas empleados en la agricultura; el uso de materiales para la recolección, transporte, manipulación, envasado o cocinado. En el caso de alimentos de origen marino su contaminación es ocasionada por las descargas industriales vertidas en mares, ríos y lagos (Delgado y Balbuena, 2006). Existen algunos metales que son esenciales para nuestro cuerpo ya que la deficiencia de éstos puede crearnos problemas de salud, pero hay otros metales que son nocivos ya que la exposición crónica a estos contaminantes se presenta asintomática durante un tiempo prolongado de vida (Tolonen, 1995). Los efectos tóxicos o la gravedad dependerá de la naturaleza, cantidad y forma química de los metales, de la concentración en los alimentos y de la resistencia del organismo a los efectos de los contaminantes químicos (Rodríguez y Col., 2005; Russell, 1992). A continuación se hablará brevemente de algunos efectos tóxicos ocasionados por metales pesados: 3.1.1 PLOMO (Pb) El plomo constituye un problema de salud pública en nuestro país ya que la industrialización y el uso de la gasolina han incrementado la cantidad de éste en el medio ambiente y por consecuencia en el cuerpo humano. Está presente en algunos artículos cerámicos como jarras y platos, en pinturas usadas en paredes lo que provoca toxicidad crónica, en aleaciones para pilas y baterías (plomo-antimonio), en soldadura (plomo-estaño). Algunos compuestos de plomo sirven como aditivos en la gasolina, en estabilizadores de PVC, en barnices de cerámicas, en pigmentos rojo, amarillo (cromato de plomo, PbCrO4) y naranja (molibdato de plomo, PbMoO4) (Lars y Col., 1986). 3.1.1.1 ABSORCIÓN Y TOXICIDAD Las vías principales de absorción son el tracto gastrointestinal y el sistema respiratorio, en menor proporción se presenta un ingreso a través de la piel. La absorción depende de factores propios del organismo, tales como la edad, el estado fisiológico y la integridad de los tejidos (Klaassen y Watkins, 2001). Las partículas finas de plomo pueden ser altamente peligrosas porque se adhieren con facilidad a la piel, son más solubles que las partículas gruesas en el tracto gastrointestinal y se absorben fácilmente a través del sistema respiratorio incorporándose a los alvéolos (Dreisbach, 1984) Los signos y síntomas de una intoxicación crónica reciben el nombre de saturnismo lo cual produce dolores intestinales, perdida de apetito y diarrea. Aparece una línea obscura delgada en las encías la cual se forma por depósitos de sulfuro de plomo. Produce debilidad muscular y fatiga, perturbación de la biosíntesis de la hemoglobina, disminución de la presión sanguínea, dolor de cabeza, vértigo, migrañas, psicosis, insomnio, mal funcionamiento renal, anemia y desordenes en el sistema nervioso (mareos, convulsiones, pérdida de equilibrio en niños, pérdida de movimientos musculares), incluyendo daño cerebral en niños (Rodríguez y Col., 2005). Debido al tamaño y al estado de oxidación del plomo éste puede tomar el lugar del calcio en el organismo por lo que los infantes presentan mayor susceptibilidad, pues al estar en crecimiento requieren una alta acumulación de calcio. El plomo se deposita principalmente en huesos y órganos internos como hígado y riñón (Arroyo, 2007). 3.1.2 CADMIO (Cd) Se encuentra principalmente en forma natural en minerales, suelos y combustibles fósiles, siendo está ultima la principal fuente de contaminación por cadmio debido a su alto contenido del metal. Es un metal pesado que se ha encontrado en altas concentraciones en aire, agua y tierra; su origen es asociado con la industria minera y el refinado de metales (Caballero, 1996). Se emplea para la fabricación de materiales plásticos, cables eléctricos, colorantes, fusibles, soldaduras, funguicidas, textiles, joyería, vidrio, cerámica, lámparas incandescentes, etc. Se deben incluir los desechos de los talleres de galvanoplastia, los barros industriales cada vez más utilizados como fertilizantes. Su incorporación a la cadena alimenticia es a través de la dispersión en el suelo y aguas (Albert, 1999). 3.1.2.1 ABSORCIÓN Y TOXICIDAD El cadmio puede ingresar al cuerpo por vía gastrointestinal, por vía respiratoria dependiendo del tamaño de la partícula se absorbe de 30 a 60 % de cadmio inhalado; por vía cutánea se considera de menor importancia por que se carece de estudios en seres humanos (Lara, 1982). El organismo lo absorbe muy lentamente, como consecuencia se va acumulando en el riñón, hígado, pulmones, páncreas, intestino delgado, bazo y ovarios progresivamente. Una ingesta prolongada altera el metabolismo del calcio, resultando en osteoporosis y problemas con el esmalte de los dientes (Flanagan y Col.,2007). La ingestión de alimentos y bebidas altamente contaminados con cadmio producen agudos efectos gastrointestinales como: diarrea y vomito. La inhalación aguda de gases de soldadura con cadmio produce daño alveolar, cáncer de pulmón; alteraciones reproductivas (agudas) enfisema pulmonar, anemia, alteraciones del sistema nervioso central y disfunción renal (Castro, 2005). 3.1.3 ARSÉNICO (As) Es un metal pesado que se encuentra en aguas contaminadas de forma natural ya que son ricas en este elemento, por lo tanto pescados y crustáceos contienen un alto nivel. El arsénico que se encuentra en el medio ambiente ha sido como resultado de quemar combustibles fósiles que contienen niveles altos de esté elemento, la minería y la fundición de metales y el tirado indiscriminado de derivados industriales (Albert, 1999). Se utiliza en plaguicidas, pesticidas, herbicidas, rodenticidas, otros usos han sido en agentes de bronceado y decoloración en la fabricación de vasos, pinturas, preservadores de la madera y aleaciones. El gas mortal arsina (AsH3) se usa en la fabricación de microchips en la industria de semiconductores. Este metal se puede incorporar a la cadena alimentaría a través de plaguicidas y vertidos en las aguas (Lars y Col.,1986). Los arseniatos de calcio y plomo, Ca3(AsO4) y Pb3(AsO4), se emplean en insecticidas y herbicidas en cultivos tan variados como la vid, el algodón, verduras, café, cocoa etc. como esterilizantes del suelo y preservadores de la madera (Khairiah y Col., 2004). 3.1.3.1 ABSORCIÓN Y TOXICIDAD El arsénico es absorbido vía tracto gastrointestinal; a través del sistema respiratorio, ocasionando cáncer pulmonar; y escasamente por la piel. Después de la absorción vía respiratoria o gastrointestinal el arsénico es transportado a través de la sangre hacia otras partes del cuerpo, depositándose en poca concentración en tiroides y esqueleto; en concentraciones altas en uñas, pelo y piel. Se ha encontrado que mujeres embarazadas pueden transmitir este metal hacia la placenta (Lara, 1982). El arsénico produce lesiones en la piel como dermatosis con erupciones, pigmentaciones incluso cáncer de piel; afecta el sistema nervioso, sistema circulatorio y cardiovascular; en casos crónicos produce anemia y leucemia (Dreisbach, 1984). 3.1.4 MERCURIO (Hg) Se utiliza en termómetros debido a que su coeficiente de dilatación es casi constante, la variación del volumen por cada grado de aumento o descenso de temperatura es la misma. Se usan lámparas de vapor de mercurio como fuente de rayos ultravioletas en los hogares y para esterilizar agua. El vapor de mercurio se utiliza en lugar de vapor de agua en calderas de algunos motores de turbina. Éste metal se combina con todos los metales comunes, excepto hierro y platino, formando aleaciones llamadas amalgamas (Hernández, 2001). Algunos compuestos como metilmercurio (CH3Hg) son usados en funguicidas para semillas. Otros como el cloruro mercuroso (HgCl) se encuentra presente en aguas marinas en dosis bajas (Klaassen y Watkins, 2001). La exposición de este metal en la población se da por la alimentación o por la presencia de amalgamas dentales, el riesgo más frecuente lo constituye el consumo de semillas mal lavadas y contaminadas por este tipo de compuestos, por el consumo de carnes de animales alimentados con semillas o harinas impregnadas de este elemento y/o por peces que viven en lagos, ríos y mares contaminados (Flanagan y Col.,2007). La exposición crónica a vapores de este elemento se da en personas que laboran en lugares poco ventilados como empresas electrónicas, productoras de cloro álcalis, plásticos, funguicidas y elaboración de amalgamas (Albert, 1999). 3.1.4.1 ABSORCIÓN Y TOXICIDAD Los vapores de mercurio son absorbidos escasamente por el tracto gastrointestinal, sin embargo su inhalación alcanza rápidamente al pulmón y una parte del cerebro causando daños neurológicos, síndrome vegetativo, cambios de conducta y personalidad, pérdida de memoria e insomnio (Lidner,1995). Los compuestos organomercuriales (CH3Hg) se absorben con mayor facilidad y de forma casi completa por su mayor liposolubilidad. Por esta característica logran atravesar la placenta. Su distribución es más uniforme en el organismo (Lidner, 1995). Los compuestos inorgánicos de mercurio (HgCl) son deficientemente absorbidos y afectan a los riñones, tienen afinidad por enzimas y catalizadores del cuerpo humano; son tóxicos fuertes que destruyen el tejido celular provocando parálisis y finalmente la muerte (Dreisbach, 1984). 3.1.5 ESTAÑO (Sn) El estaño es un metal que se encuentra en el ambiente principalmente como casiterita o piedra de estaño (SnO2), la cual es su principal fuente de producción. Cerca de la mitad del estaño producido es usado en galvanizado, y el resto es empleado para la producción de aleaciones como: soldaduras, bronce y peltre. Los compuestos inorgánicos de estaño (SnO2) son usados en la industria de cerámica y textilera. En la industria química los compuestos orgánicos de estaño (CH3SnCH3) son usados como estabilizadores de calor en la producción de PVC como catalizadores en la producción de poliuretano algunos tienen propiedades biocidas como: moluscocidas, fungicidas, insecticidas y acaricidas (Leonard, 1978). El estaño entra a la cadena alimenticia por medios terrestres y acuáticos provocando que la mayoría de alimentos naturales contengan estaño en cantidades traza. Las concentraciones de éste, en alimentos son poco incrementadas por el uso de pesticidas organoestaños, el almacenaje de líquidos en contenedores de PVC o en latas. Se ha encontrado que los vegetales cultivados en suelos con alta cantidad de estaño contienen menos de un mg/Kg y las dietas que consisten en vegetales frescos carne y cereales contribuyen con menos de un mg a la ingesta diaria. En alimentos enlatados el contenido de estaño es incrementado por la ausencia de película interior (resina o laca) la presencia de oxidantes, (nitratos) pH bajo, incremento en la temperatura de almacenaje, y el retraso en el consumo del alimento después de abrir la lata (Lars y Col.,1986). 3.1.5.1 ABSORCIÓN Y TOXICIDAD Los compuestos de estaño se absorben por inhalación, por contacto con la piel e ingestión, donde son absorbidos pobremente después de una dosis oral (Rusell, 1992). Los compuestos inorgánicos de estaño pueden causar síntomas gastrointestinales en humanos tales como náuseas y diarrea. En el sistema respiratorio producen una fibrosis no significante que no decrece la función pulmonar y que es llamada estanosis presentándose ocasionalmente después de tres años de exposición al oxido de estaño (Albert, 1999). Los compuestos orgánicos de estaño producen frecuentemente lesiones en la piel o lesiones en los ojos. El contacto prolongado con ropa contaminada produce dermatosis difusa. En la mayoría de los casos la exposición a compuestos de estaño producen hiperactividad, insomnio, defectos de la memoria, anorexia y desorientación, además de eventos epilépticos. Estos compuestos dañan el hígado de manera irreversible. (Dreisbach, 1984). 3.2 PRINCIPIOS GENERALES DE ESPECTROSCOPIA DE ABSORCIÓN ATOMICA El átomo se encuentra formado por un núcleo rodeado de electrones. Cada elemento tiene un número específico de electrones que se encuentra asociado con el núcleo del átomo en una estructura orbital que es única para cada elemento. Los electrones ocupan posiciones orbitales en forma ordenada y predecible. El estado más bajo de energía conocido como estado basal, es la configuración electrónica normal de un átomo. Si una energía de una magnitud adecuada es aplicada a un átomo, la energía será absorbida por éste, y el electrón de la capa más lejana al núcleo será promovido a una configuración menos estable conocida como estado excitado como se muestra en la figura 1(a). Como este estado es inestable, el átomo inmediata y espontáneamente regresará a su configuración de estado estable. El electrón al regresar a su posición orbital inicial desprenderá energía radiante equivalente a la cantidad de energía inicialmente absorbida en el proceso de excitación. Como se ilustra en la figura 1(b) (Beaty, 2004). + Energía + Átomo en estado basal Átomo en estado excitado Figura 1(a). Excitación (Beaty, 2004). Átomo en estado excitado Átomo en estado basal l Energía luminosa Figura 1(b). Decaimiento La longitud de onda de la energía radiante emitida se encuentra directamente relacionada con la transición de electrones que ha ocurrido: Debido a que cada elemento tiene una configuración única de electrones, la longitud de onda de la luz emitida es una propiedad única de cada elemento. La característica de interés en las medidas por absorción atómica, es la cantidad de luz, a la longitud de onda, que es absorbida cuando la luz pasa a través de una nube atómica. Conforme el número de átomos se incrementa en el paso de la luz la cantidad de ésta será absorbida y se incrementará en una forma predecible. Se puede efectuar una determinación cuantitativa del analito presente, midiendo la cantidad de luz absorbida. La nube de átomos requerida para las mediciones en absorción atómica, es producida por la adición de suficiente energía térmica a la muestra para disociar los compuestos químicos en átomos libres. La aspiración de una solución de la muestra, dentro de una llama alineada con el rayo de luz, sirve para este propósito. Bajo condiciones apropiadas de llama, muchos de los átomos permanecerán en la forma de su estado basal y serán capaces de absorber luz de longitud de onda apropiada proveniente de una fuente de luz. La facilidad y la velocidad a la cual se pueden hacer determinaciones precisas y exactas con esta técnica han hecho que la absorción atómica sea uno de los métodos más populares para la determinación de metales (Day y Underwood, 1989). 3.1.6 ANALISIS CUANTITATIVO POR ABSORCIÓN ATOMICA En el proceso de absorción atómica el haz de luz a la longitud de onda con una intensidad inicial Io, es enfocada a la flama que contiene a los átomos en estado basal. La intensidad inicial de la luz es disminuida en una cantidad determinada por la concentración de los átomos en la llama. Luego la luz es dirigida sobre el detector donde se mide la intensidad disminuida, I. La cantidad de luz absorbida se determina por comparar I a Io. La transmitancia es definida como la razón de la intensidad final a la intensidad inicial (Harris, 1992). T = I/Io ec. (1) La transmitancia es una medida de la fracción de luz inicial que pasa a través de la llama para incidir en el detector. El porcentaje de transmisión es: %T= 100 X I/I0 ec. 2 El porcentaje de absorción es el complemento del porcentaje de transmisión y define el porcentaje de luz inicial que es absorbida en la llama. %A = 100 - %T ec. (3) El término absorbancia es puramente una expresión matemática y se define: %A= log I/I0 ec. (4) La absorbancia es el término más conveniente para caracterizar la absorción de la luz en la espectrofotometría de absorción, pues esta cantidad guarda una relación lineal con la concentración. La ley Beer define esta relación: A = ebc ec. (5) En donde “A” es la absorbancia, “e” es el coeficiente de absorción constante que es característica de las especies que absorben, “b” es la longitud del paso de luz ocupado por la celda de absorción, y “c” es la concentración de las especies absorbentes en la celda de absorción. Esta ecuación 5 simplemente establece que la absorbancia es directamente proporcional a la concentración de las especies absorbentes para unas condiciones instrumentales dadas. Este comportamiento directamente proporcional entre la absorbancia y la concentración es observado en la absorción atómica. Cuando las absorbancias de las soluciones estándar de valor conocido son medidas y los datos de absorbancia son graficados contra concentración, la región de la grafica que sigue la ley de Beer se podrá identificar como una línea recta (Harris, 1992). 3.1.7 INSTRUMENTO DE ABSORCIÓN ATÓMICA Esencialmente el Espectrofotómetro de Absorción Atómica (EAA) se divide en seis componentes principales: fuente de energía o de luz, sistema de introducción de la muestra (nebulizador), quemador y flama ó celda de muestra, monocromador, sistema de detección y lector; como se muestra en la fig.2. Figura 2. Espectrofotómetro de Absorción Atómica (Beaty, 2004). 3.1.7.1 FUENTE DE ENERGÍA La fuente de energía más ampliamente usada y aceptada en EAA es la Lámpara de Cátodo Hueco (LCH), la cual posee un cátodo cilíndrico hueco hecho del elemento de interés. El ánodo y el cátodo se encuentran en un cilindro de vidrio sellado y lleno ya sea de neón o argón. Al extremo del cilindro se encuentra una ventana transparente a la radiación emitida. Cuando se aplica un potencial eléctrico entre el ánodo y el cátodo, algunos de los átomos del gas de relleno se ionizan. Los iones cargados positivamente se aceleran a través del campo eléctrico y colisionan con el cátodo cargado negativamente, desalojando átomos metálicos individuales del mismo. Los átomos del metal desalojados son entonces excitados por la emisión, por los impactos subsecuentes que tienen con más iones del gas de relleno. Para cada elemento es necesaria una lámpara, ya que emite sólo el espectro específico del elemento del cual esta hecha; también existen algunas lámparas multielementales en donde el cátodo está hecho de dos a cinco elementos con propiedades similares. La figura 3 muestra como está construida una lámpara de cátodo hueco y sus procesos (Skoog, 1984). Figura 3. Lámpara de Cátodo Hueco (Beaty, 2004). Lámpara de Descarga sin Electrodos (LDE). En las lámparas LDE una pequeña cantidad del elemento de interés, se encuentra sellada en el interior de un bulbo de cuarzo. Este bulbo es colocado en el interior de un cilindro cerámico sobre el cual se enrolla la antena de un generador de Radio Frecuencia (RF). Cuando se aplica un campo RF de suficiente potencia, la energía asociada con él, vaporizará y excitará a los átomos en el interior del bulbo, emitiendo su espectro característico. Se requiere un accesorio (generador de voltaje) que suministre potencia para operar una lámpara LDE. Típicamente estas lámparas son más intensas que las de cátodo hueco y ofrecen una mayor precisión y limites de detección más bajos para algunos elementos (Castro, 2005). La Lámpara de Descarga sin Electrodos se muestra en la figura 4. El generador de voltaje mencionado arriba se ilustra en la figura 4a Inicio bulbo del embobinado Bulbo de cuarzo Figura 4. Lámpara de Descarga sin Electrodos Vista frontal Vista posterior Figura 4a. Generador de voltaje (Perkin, 1982). 3.1.7.2 NEBULIZADOR En la cámara del nebulizador mostrada en la figura 5, se lleva a cabo la mezcla de los gases empleados, luego son llevados a la cabeza del quemador, el flujo de los gases empleados produce una presión negativa al final de la salida del tubo capilar teniendo como resultado la succión de la muestra a través del capilar hacia la cámara del nebulizador, la muestra se aspira a un flujo de 2 a 6 ml/min. Y se encuentra en forma de aerosol dentro de la cámara, con gotas de diferente tamaño. Se emplea una esfera de impacto o un reflector de flujo para romper las gotas e incrementar la turbulencia en el flujo. Las gotas de mayor tamaño chocan con las paredes de la cámara o con el reflector de flujo y condensan siendo drenadas o desechadas. El flujo turbulento arrastra las gotas de menor tamaño y las lleva a la cabeza del quemador. Resumiendo, las funciones del nebulizador son succionar la muestra a un flujo constante, crear un aerosol fino de la muestra y llevar a cabo la mezcla de los gases para su introducción al quemador (Arroyo, 2007). nebulizador quemador Reflector de flujo Tubo capilar Drenaje Cámara de l nebulizador Figura 5. Sistema de quemador y Nebulizador (Perkin, 1982). 3.2.2.3 QUEMADOR Y FLAMA La función de la flama es convertir el aerosol de la muestra, proveniente del nebulizador en vapor atómico, rompiendo los enlaces químicos para obtener átomos libres en su estado basal, llamado proceso de atomización, donde dichos átomos absorberán la luz proveniente de la lámpara. Los combustibles empleados en absorción atómica son aire-acetileno, el aire actúa como oxidante y el acetileno como combustible, y oxido nitroso-acetileno ( el oxido nitroso es el oxidante). La mezcla de aire-acetileno se emplea en la determinación de aproximadamente 35 elementos y se alcanza una temperatura de aproximadamente 2300o C, utilizando el quemador de 10 cm. En cambio el oxido nitroso-acetileno alcanza una temperatura de 3000o C (usando el quemador de 5 cm.), y se emplea en la determinación de elementos que pueden formar óxidos refractarios (Harris. 1992). En la figura 6 se muestra el quemador de 10 cm. El quemador de 5 cm. es de la misma forma sólo que de menor longitud. Figura 6. Quemador de 10 cm. (Beaty, 2004). 3.2.2.4 MONOCROMADOR La principal función del monocromador en EAA es aislar la longitud de onda de interés de otras longitudes emitidas en la flama o en la lámpara por otros elementos, así como dispersar las longitudes de onda por medio de una red o superficie reflectiva rayada por muchas líneas finas paralelas muy cercanas unas de otras. La reflexión de esta superficie rayada genera un fenómeno de interferencia conocido como difracción, en el cual diferentes longitudes de onda divergen de la red con diferentes ángulos (Castro, 2005). En la figura 7 se representa un monocromador típico. La luz de la fuente entra al monocromador por la apertura espectral de entrada y es dirigida hacia la red de difracción en donde tiene lugar la dispersión. Las longitudes de onda divergentes son dirigidas hacia la apertura espectral de salida. Ajustando el ángulo de la red, se permite que una línea de emisión preseleccionada de la fuente pase a través de la apertura de salida e incida sobre el detector. Todas las otras líneas son bloqueadas en la salida. El ángulo de dispersión en la red de difracción se puede controlar por la densidad de rayado de las líneas de la rejilla. Para una buena resolución (separación clara de líneas) es necesario que la apertura de entrada y salida sean del mismo tamaño (Beaty, 2004). Abertura espectral de salida fotomultiplicador Red de difracción Lámpara Abertura espectral de entrada Figura 7. Monocromador (Beaty, 2004). 3.2.2.5. SISTEMA DE DETECCIÓN O MICROCOMPUTADOR Un microcomputador es un circuito integrado simple, capaz de controlar y manipular datos para un número de operaciones enlazadas, si le añadimos un juego de instrucciones pre-programadas, una memoria para datos y alguna forma de entrada y salida para comunicarse con el mundo exterior obtendremos un microcomputador totalmente funcional. Una contribución importante del microcomputador a la absorción atómica es la capacidad de calibrar y registrar datos de absorbancia dando concentraciones en la región lineal de la curva (Day y Underwood, 1989). 3.2.3 PRINCIPALES INTERFERENCIAS EN LA ABSORCIÓN ATOMICA La absorción atómica es una técnica muy específica con pocas interferencias, las cuales están bien definidas así como los medios para tratarlas. El proceso de la llama es un paso importante donde pueden existir algunas interferencias, debido a que la temperatura de la llama es la responsable de la producción de las especies que absorben. Cuando algún componente de la muestra altera un paso en la llama, es decir cuando algún componente diferente al analito absorbe energía proveniente de la lámpara, existirá una interferencia resultando entonces que la medida de la concentración será errónea si es que no se reconoce la interferencia (Mc-Murry, 2004). 3.2.3.1 INTERFERENCIA DE MATRIZ El primer lugar del proceso de la llama sujeto a interferencia es la nebulización. Si la muestra es más viscosa o tiene una tensión superficial diferente a la de los patrones la velocidad de aspiración de la muestra o la eficiencia de nebulización puede ser diferente entre las muestras y patrones; si éstos no son introducidos a la misma velocidad, es de esperarse que el número de átomos en el rayo de luz aumente o disminuya dependiendo de la velocidad de aspiración. Por consiguiente la absorbancia no correlacionara entre las muestras y patrones. Entonces existirá una interferencia generada por la matriz. Las interferencias de matriz pueden producir errores positivos y negativos, en el primer caso la presencia de un solvente orgánico en una muestra producirá un mejoramiento de la eficiencia de nebulización, lo que resulta en un incremento de la absorción. Los errores negativos ocurren cuando la muestra contiene altas concentraciones de ácido o sólidos disueltos principalmente, lo que ocasionará una disminución en la eficiencia de nebulización. Una forma de compensar este tipo de interferencia es la de asemejar lo más que sea posible los componentes mayores de la matriz en los patrones y muestras. Algún ácido o cualquier otro reactivo, añadidos a la muestra durante su preparación deberán ser añadidos a los patrones en las mismas concentraciones (Beaty, 2004). 3.2.3.2 INTERFERENCIAS QUÍMICAS En un segundo lugar durante el proceso en la llama, en el cual se pueden producir interferencias. En este paso se debe disponer de suficiente energía para disociar las moléculas del analito y crear átomos libres. Si la muestra contiene un componente el cual forma un compuesto térmicamente estable con el analito y no es completamente descompuesto por la energía disponible de la llama, entonces existirá una interferencia química. Existen dos formas de proceder con este problema, una consiste en eliminar la interferencia añadiendo un exceso de otro elemento, el cual forma con la interferencia un compuesto térmicamente estable (ejemplo lantano) y dejando libre al analito, que será atomizado teniendo una absorbancia independiente de la cantidad de la interferencia La segunda forma para solucionar el problema de la interferencia química: si el problema es originado por la insuficiente energía para descomponer el compuesto del analito, térmicamente estable, se puede eliminar este problema incrementando la cantidad de energía usando una llama más caliente. La llama del oxido nitroso-acetileno la cual es considerablemente más caliente que la llama del aire-acetileno y puede ser usada para minimizar las interferencias químicas para elementos generalmente determinados con aire-acetileno ( Harris, 1992). 3.2.3.3 INTERFERENCIA POR IONIZACIÓN Esta interferencia a menudo se encuentra en llamas calientes. El proceso de la disociación del analito no termina necesariamente en el átomo en estado fundamental. Si se aplica energía adicional el átomo en estado fundamental puede ser térmicamente elevado al estado excitado o si la energía térmica es suficiente el electrón puede ser completamente removido el átomo originando un ión. De esta forma disminuye el número de átomos disponibles en estado basal para absorción de luz, reduciendo la absorción atómica a la longitud de onda de resonancia. Cuando un exceso de energía destruye al átomo en estado basal, existe una interferencia por ionización ( Beaty, 2004). Se puede eliminar la interferencia por ionización añadiendo un exceso de un elemento que sea muy fácil de ionizar, lo que originará un gran número de electrones libres en la llama y que a su vez eliminará la ionización del analito. Comúnmente se usa el sodio o el potasio como supresores de ionización. Los efectos de la ionización pueden ser eliminados por la adición de 2000 mg/l a 5000 mg/l de potasio a todas las soluciones patrón y muestras (Arroyo, 2007). 3.3 METODOLOGÍA UTILIZADA EN LA EMPRESA PARA EL ANALISIS DE METALES PESADOS En esta parte se describirán las técnicas para la determinación de metales pesados utilizando un espectrofotómetro de absorción atómica (EAA), marca Perkin Elmer 3100, al cual se le acopló un generador de hidruros, así también se menciona el tratamiento que reciben las muestras. 3.3.1 ACONDICIONAMIENTO DEL INSTRUMENTO EN BASE AL MANUAL DE OPERACIÓN, UTILIZANDO UNA FLAMA AIRE- ACETILENO Y UN QUEMADOR DE 10 cm. A continuación se presenta de manera general cómo se ajusta, optimiza y maneja el instrumento antes de iniciar un análisis, mostrando primeramente las condiciones y especificaciones a las cuales se debe manejar el espectrofotómetro. La figura 8. muestra una imagen del Espectrofotómetro de Absorción Atómica Perkin Elmer 3100. Figura 8. Espectrofotómetro de Absorción Atómica. La tabla 1, muestra las condiciones que debe tener el espectrofotómetro para iniciar su utilización dependiendo del metal a analizar. Tabla 1. Parámetros de Operación Sensitivity Check Rango Lineal (mg/l) As 193.7 0.7 A-Ac 45 0.1* Cd 228.2 0.7 A-Ac 1.5 2.0 Cu 324.8 0.7 A-Ac 4 5.0 Fe 248.3 0.7 A-Ac 5 5.0 Hg 253.7 0.7 A-Ac 200 0.1* Pb 283.3 0.7 A-Ac 20 20 Sn 286.3 0.7 A-Ac 150 0.1* Fuente: Manual de operación del espectrofotómetro de absorción atómica 3100. Elemento l (nm) Slit (nm) Gases *Técnica por generador de hidruros (Perkin, 1982). A-Ac: aire- acetileno. Slit: ancho de ventana expresada en nanometros Sensitivity Check, también llamada concentración característica: es la concentración del elemento (mg/l) a la cual se obtiene una lectura de absorbancia de aproximadamente 0.2 unidades. Con este valor se verifica la funcionalidad correcta del espectrofotómetro (Perkin, 1982). La tabla 2, muestra algunas especificaciones del espectrofotómetro que deben ser ajustadas en éste antes de su utilización. Tabla 2. Especificaciones de EAA. Rango de longitud de onda 189 a 860 nm Densidad de rayado 1800 líneas/mm Ancho de ventana 0.2 y 0.7 Altura de ventana Alto y bajo Fuente: Manual de operación del espectrofotómetro de absorción atómica 3100. En la figura 9, se muestra el panel lateral del instrumento en el cual se pueden ajustar algunos parámetros mencionados en las tablas 1 y 2. Ancho de ventana o slit altura de ventana Rango de longitud de onda Perilla de longitud de onda Figura 9. Panel lateral del espectrofotómetro de absorción atómica 3100 (Perkin, 1982). La figura 9a muestra el panel lateral del espectrofotómetro para que el lector pueda darse una idea en que parte del equipo se realizan los ajustes de los parámetros mencionados en al tabla 1. Panel lateral Figura 9a. Vista lateral del espectrofotómetro (Perkin, 1982). 3.3.1.1 ALINEACIÓN DE LA LÁMPARA a) Seleccionar e instalar la lámpara, ver figura 10. b) Conectar el cable de energía de la lámpara en el contacto del instrumento, ver figura 10. c) Seleccionar el ancho de la ventana o slit y la longitud de onda de acuerdo a la tabla 1. d) Encender la lámpara, introduciendo la corriente de ésta de acuerdo a la recomendación de la misma. e) Maximizar la energía de la lámpara girando lentamente la perilla de control de longitud de onda ¼ de nm. a ambos lados hasta obtener la máxima energía. f) Alinear la lámpara girando los tornillos de alineación hasta obtener un máximo de energía. g) Calentar durante 10 minutos aproximadamente. h) Seleccionar el modo del instrumento para dar lectura continua en absorbancia con un tiempo de integración de aproximadamente 0.5 seg. Tornillos de alineación Instalación de la lámpara Conexión del cable de la lámpara Figura 10. Instalación de la lámpara en el equipo (Perkin, 1982). 3.3.1.2 ALINEACIÓN DEL QUEMADOR a) La pantalla del instrumento debe estar en cero. b) Ajustar la posición del quemador, utilizando la perilla de ajuste de altura, los botones de ajuste horizontal y rotacional mostrados en la figura 11, de manera que la cabeza del quemador esté abajo del paso de luz de la lámpara encendida (flama apagada) levantando la cabeza del quemador de manera que apenas bloquee el haz luminoso, esto es cuando en la pantalla aparezcan valores numéricos, luego bajar el quemador para obtener una lectura de cero. c) Bajar la posición de la cabeza 1 cm. (usualmente un ¼ de vuelta de la perilla de ajuste de altura). perilla de ajuste de altura Botón de ajuste horizontal Botón de ajuste rotacional Figura 11. Tornillos para la alineación del quemador (Perkin, 1982). 3.3.1.3 ENCENDIDO DE LA FLAMA AIRE-ACETILENO a) Verificar que los seguros del quemador se encuentran en su lugar. b) Abrir la válvula del tanque de acetileno y asegurar que el regulador tenga una presión de 12 a 14 psig. c) Encender la compresora de aire y asegurar que esté suministrando una presión de 50 a 65 psig. d) Cambiar la posición del switch de inicio a Air y presione el botón de ignición e) Ajustar el flujo de gases hasta obtener una flama azul débil, moviendo las válvulas de control de combustible y oxidante del rotámetro hasta obtener el color de flama deseado, ver tabla 3. La figura 12, muestra el esquema del rotámetro así como las válvulas reguladoras de combustible y oxidante. Tabla 3. Relación de gases recomendada Metal As Cd Cu Fe Hg Pb Sn Oxidante 3.0 5.0 3.0 2.5 3.0 2.5 3.0 combustible 2.0 2.0 2.0 2.0 2.0 2.0 2.0 Referencia: Manual de operación del equipo 3100 Figura 12. Rotámetro (Perkin, 1982). 3.3.1.4 VERIFICACIÓN DE LA ALINEACIÓN DEL QUEMADOR CON EL ESTÁNDAR DE COBRE a) Aspirar la solución de blanco y realizar autocero en el instrumento. b) Aspirar el elemento estándar de ajuste para evaluar la operación del instrumento: el elemento de ajuste ideal es cobre debido a que no es sensible a cambios ligeros de condiciones de flama, su longitud de onda es mayor a 250 nm (disminuye interferencias potenciales), es un estándar fácil de preparar y produce una señal de aproximadamente 0.200 de absorbancia a una concentración de 4.0 mg/l de Cu (usando nebulizador estándar, deflector de flujo y cabeza de quemador de 10 cm.). c) Ajustar la cabeza (horizontal y vertical) para máxima absorbancia, girando los botones rotacional y horizontal. d) Ajustar el nebulizador hasta una máxima absorbancia y posteriormente comience a disminuir, girando lentamente el nebulizador, hasta la absorbancia requerida. e) Verificar la concentración característica o sensitivity check: los valores típicos se muestran en la tabla 1. f) Con la apropiada selección del elemento de ajuste, la posición del nebulizador y la cabeza no necesitan ser modificadas para analizar otro elemento. 3.3.1.5 ANÁLISIS DE MUESTRAS POR FLAMA EN EL ESPECTROFOTÓMETRO PERKIN ELMER 3100 a) Introducir los parámetros de operación dependiendo del analito, mostrados en la tabla 1. b) Aspirar el blanco y realizar autocero. c) Calibrar el instrumento para el analito a determinar usando los estándares analíticos preparados de acuerdo a las concentraciones de la tabla 3. utilizando materiales de referencia Nist, Cenam y/o High Purity, así como material de vidrio volumétrico y calibrado. d) Aspirar los estándares en orden decreciente de acuerdo a su concentración y registrar tres réplicas de la absorbancia de cada uno. e) Elaborar curva de calibración graficando absorbancia contra concentración. f) Aspirar las muestras en forma ordenada, identificadas y digeridas previamente. g) Analizar un blanco de reactivo, una muestra fortificada y una muestra control por cada diez muestras leídas, para comprobar la correcta funcionalidad del instrumento calculando la exactitud como porciento de recuperación. h) Registrar los valores obtenidos. i) Realizar los cálculos correspondientes. 3.3.1.6 SELECCIÓN DEL NÚMERO DE ESTÁNDARES La selección del número y concentración de los estándares de calibración se realiza sólo en el rango lineal del instrumento. El rango lineal para la mayoría de los elementos es entre 0.25 y 0.3 unidades de absorbancia. En la Tabla 4, se indican los límites de linealidad que se han validado en el equipo Perkin Elmer 3100, y que serán utilizados como intervalo de trabajo. Tabla 4. Intervalos de trabajo Elemento Concentración del elemento (mg/l) As (0.0), (0.03), (0.05), (0.08), (0.1) Cd (0.0), (0.5), (1.0), (1.5), (2.0) Cu (0.0), (1.0), (2.0), (3.0), (5.0) Fe (0.0), (1.0), (2.0), (3.0), (5.0) Hg (0.0), (0.03), (0.05), (0.08), (0.1) Pb (0.0), (3.0), (5.0), (8.0), (10.0) Sn (0.0), (0.03), (0.05), (0.08), (0.1) Zn (0.0), (0.3), (0.5), (0.8), (1.0) Referencia: Laboratorio de Jorge Rodríguez. Para la preparación de los estándares se utilizan materiales de referencia certificados, es decir patrones primarios; los cuales son sustancias cuyas propiedades o al menos una de ellas, son suficientemente estables para ser usados en la calibración de aparatos, evaluación de métodos de medición o para caracterizar otros materiales. Este va acompañado de un certificado en el cual uno o más valores están certificados por un procedimiento que establece su trazabilidad, cada valor certificado se acompaña de una incertidumbre con la indicación de un nivel de confianza (García y Col., 2002). Los materiales de referencia certificados utilizados en el lugar de trabajo son del Centro Nacional de Metrología (CENAM), National Institute of Standards and Technology ( NIST), y/o High Purity. Los materiales de referencia son utilizados para: § Calibrar y/o verificar patrones y equipos de medición. § Validar métodos analíticos. § Comprobar la exactitud de los resultados. § Comprobar el desempeño de un laboratorio o analista. § Asignar valores e incertidumbres de medición de magnitudes del mismo tipo a otros materiales (Arroyo, 2007). Los materiales de referencia certificados utilizados tienen una concentración específica en ppm establecida en el certificado. A partir de esta concentración se realizan diluciones sucesivas para alcanzar las concentraciones deseadas. El material de vidrio utilizado para las diluciones debe ser volumétrico y calibrado. El agua de dilución debe ser tridestilada. 3.3.1.7 GENERADOR DE HIDRUROS La absorción atómica con llama convencional, es limitada en su sensibilidad, debido a que sólo una pequeña fracción de la muestra aspirada llega a la llama; la mayoría de la solución sale al drenaje; pero existe una gran variedad de accesorios que mejoran la capacidad del limite de detección, más allá de los limites de la llama. Una de las técnica para mejorar la sensibilidad de la absorción atómica es el generador de hidruros. En esta técnica el hidruro es formado por la adición de borohidruro en solución a la muestra que se encuentra en el frasco de reacción. Los hidruros gaseosos son arrastrados por nitrógeno hacia la celda de cuarzo calentada con la llama aire-acetileno, produciendo una señal de forma Gaussiana, altura de la cual es proporcional a la cantidad del analito en la muestra. Con la generación de hidruros se es capaz de analizar elementos de naturaleza compleja como son arsénico, mercurio, antimonio, estaño y selenio, que son difíciles de analizar por algún otro método. Los elementos determinados por esta técnica son de gran importancia ambiental o toxicológica, por lo que los pequeños límites de detección de la técnica, la hacen atractiva para este tipo de aplicaciones ( Perkin 1982). Otra técnica para mejorar la sensibilidad de la absorción atómica es el sistema para mercurio por vapor frío. El mercurio es el único elemento que a temperatura ambiente, permite químicamente generar átomos en estado basal que son requeridos para la absorción atómica. En el método del vapor frío los átomos de mercurio se producen en una botella de reacción por reducción química con borohidruro de sodio. Los átomos volátiles salen de la solución al burbujear nitrógeno a través de ella. El nitrógeno acarrea el mercurio a través de un tubo para llevarlo finalmente a la celda de cuarzo de absorción atómica. Conforme el mercurio pasa a través de la celda y sale de ella, se registra una señal de absorción de forma Gaussiana (Beaty, 2004). 3.3.1.8 INSTALACIÓN DE LA CELDA DE CUARZO a) Colocar la montura metálica sobre el quemador de 10 cm. fijándola con los tornillos que está tiene en los extremos como se muestra en la figura 13. b) Colocar la cabeza del quemador en el lugar correspondiente cerciorándose de colocar todos los seguros. c) Colocar la celda en la montura, como se muestra en la figura 13. d) Alinear la celda de cuarzo: instalar y alinear la lámpara de cátodo hueco de cobre. Sosteniendo una tarjeta blanca al final de la celda de cuarzo, ajustar la posición vertical, horizontal y rotacional de la celda hasta que el rayo de luz pase a través de la celda. e) Colocar la lámpara del elemento deseado. f) Encender la flama regulando los gases, permitir que la celda se caliente por 10 minutos antes de comenzar el análisis. g) Abrir la válvula del gas inerte y ajuste la presión a 36 psig (nitrógeno) Tornillo sujetador Celda de cuarzo Montura metálica quemador Montura metálica Celda de cuarzo Tornillo sujetador Figura 13. Instalación de la celda de cuarzo sobre el quemador (Perkin, 1982). 3.3.1.9 ANÁLISIS DE MUESTRA POR GENERADOR DE HIDRUROS (Perkin, 1982) a) Verificar que la lámpara y la celda de cuarzo se encuentren alineados. b) Introducir los parámetros de operación de acuerdo a la tabla 1. c) Pipetear una alícuota de 10 ml del blanco de reactivo colocarlos en el frasco de reacción e instalar éste al generador de hidruros, ver figura 14. d) Presionar el botón del generador de hidruros por 10 segundos para introducir el gas inerte y así permitir que el aire sea purgado del frasco de reacción, ver figura 14. e) Pipetear una alícuota de 5 ml del estándar y 5 ml de ácido clorhídrico 2 N en el frasco de reacción e instalar el frasco de reacción al generador de hidruros. f) Presionar el botón del generador de hidruros por 10 segundos o hasta alcanzar un valor máximo de absorbancia cuyo valor es registrado por el analista. g) Analizar un blanco de reactivos, una muestra fortificada y una muestra control por cada diez muestras leídas para comprobar la correcta funcionalidad del instrumento calculando la exactitud como porciento de recuperación. h) Pipetear una alícuota de 5 ml agua destilada y 5 ml de ácido clorhídrico 2 N en el frasco de reacción e instalar el frasco al generador de hidruros. para limpieza del sistema después de cada lectura. i) Repetir los pasos e) y f) para cada estándar y muestras, elaborando las curvas de calibración correspondientes. j) Los valores de absorbancia son mostrados en la pantalla del instrumento. k) Realizar los cálculos correspondientes. Botón del generador de hidruros Contenedor de la solución de borohidruro Varilla de soporte Frasco de reacción Charola para goteo Entrada de gas inerte Figura 14. Generador de hidruro (Perkin, 1982). 3.3.1.10 MANTENIMIENTO DEL ESPECTROFOTÓMETRO DE ABSORCIÓN ATÓMICA (Perkin, 1982) a) Limpiar el equipo y el área de trabajo, siempre que se termine de usar para que se mantenga libre de polvos o gases corrosivos. b) La cabeza del quemador deberá de proveer una flama uniforme sobre toda la longitud de la ranura del quemador. Si la flama no es uniforme indica que la cabeza del quemador necesita limpieza: Una vez terminado el análisis dejar enfriar la cabeza del quemador y remover los depósitos carbonizados con una laminilla de limpieza. c) Cerrar los gases y quitar la cabeza del quemador. d) Dejar la cabeza del quemador toda la noche en una solución de detergente y después enjuagarla con abundante agua y secarla. e) Reinstalar la cabeza del quemador y alinear nuevamente. f) Limpiar los capilares del nebulizador: Aspirar un solvente puro con la flama encendida hasta que las lecturas de absorbancia sean adecuadas. Si el solvente no puede limpiar el capilar nebulizador, introducir un cable de cobre a través del lado de entrada del capilar, mueva el cable de adentro hacia fuera para quitar cualquier partícula sólida que haya bloqueado el nebulizador. 3.3.1.11 PRINCIPALES FALLAS COMUNES EN ABSORCIÓN ATOMICA Si la señal del analito exhibe pobre sensibilidad puede ser causado por: § Alineación de cabeza del quemador: vertical u horizontal. § Ajuste del nebulizador. § Las condiciones de la flama. § La concentración del estándar no es exacta. § Condiciones pobres de lámpara. § Longitud de onda incorrecta. Si la señal del analito exhibe ruido excesivo con flama apagada, el problema es electrónico o espectral: § Calidad de la lámpara. § Alineación de la lámpara. § Ajuste de longitud de onda. § Configuración de la abertura espectral. § Óptica sucia. Si la señal del analito exhibe ruido excesivo con la flama encendida, el problema puede ser en el sistema introductor de muestra: § Cabeza del quemador sucia. § Mal funcionamiento del nebulizador. § Mal funcionamiento del sistema de drenaje. § Cámara de atomización sucia. § Partículas presentes en la muestra. 3.3.2 PROCEDIMIENTO PARA LA PREPARACIÓN DE MUESTRAS EN BASE A LA NOM-117-SSA1-1994 La metodología utilizada en este trabajo para la determinación de metales pesados esta basada en la Norma Oficial Mexicana 117-SSA1-1994 que describe la preparación y digestión de las muestras para la determinación de cadmio, arsénico, plomo, estaño, cobre, fierro, zinc y mercurio en alimentos (frescos, industrializados ó de cualquier naturaleza), agua potable y agua purificada por espectrofotometría de absorción atómica. 3.3.2.1 REACTIVOS Y MATERIALES · Agua tridestilada. · Ácido nítrico, grado suprapuro · Ácido clorhídrico, grado suprapuro · Ácido sulfúrico, grado suprapuro · Hidróxido de sodio, grado R.A. · Borohidruro de sodio, grado R.A · Pipetas calibradas de diferentes capacidades. · Vidrios de reloj. · Vasos de precipitados. · Matraces aforados de diferentes capacidades. · Crisoles Vycor de 40 a 50 ml de capacidad. · Papel filtro Whatman N0 2. · Perlas de ebullición embudos de filtración. · Material común de laboratorio. Todo el material utilizado debe ser lavado con jabón neutro, enjuagado con agua corriente, sumergirlo en ácido nítrico al 30%, taparlo y dejar reposar por 24 horas. Quitar el exceso de ácido nítrico con agua desionizada, escurrir y secar. 3.3.2.2 APARATOS E INSTRUMENTOS · Campana de extracción. · Placa de calentamiento con regulador de temperatura. · Lámparas de cátodo hueco para determinar Cd, Fe, Cu, Pb, Sn, Zn, Hg. · Lámpara de descarga para determinar As. · Fuente de radiofrecuencia para usar lámpara de descarga. Los instrumentos que a continuación se indican deben estar calibrados y ajustados antes de su operación: · Espectrofotómetro de absorción atómica: Perkin Elmer 3100 equipado con generador de hidruros. · Balanza analítica con sensibilidad de 0.1 mg. · Mufla a temperatura de 5500C. · Estufa de secado a 120 +/- 5 0 C. 3.3.2.3 PREPARACIÓN Y DIGESTIÓN DE LA MUESTRA PARA LA DETERMINACIÓN DE CADMIO, COBRE, FIERRO, PLOMO, ZINC, (DIGESTIÓN VÍA SECA) 1. Pesar con precisión de +/- 0.1 mg, una cantidad apropiada de muestra. Pesar como máximo 40g de jugo o bebida, 20g de alimentos que contengan del 50 al 75% de agua y 10g de alimentos sólidos y semisólidos. Limite el contenido de grasa a un máximo de 4g y el total de materia orgánica a 5g. 2. Añadir 10 ml de ácido nítrico concentrado y dejar reposar toda la noche o iniciar directamente la digestión. En productos con alto contenido de proteína adicionar una solución de nitrato de magnesio al 7 % p/v y mezclar completamente, llevar a sequedad aproximadamente durante 6 horas en estufa a una temperatura de 90 a 95 0C. 3. Colocar la muestra en una mufla y elevar la temperatura lentamente de 2 a 40C por minuto hasta 3500 C. Mantener la temperatura hasta que cesen los humos. 4. Elevar gradualmente la temperatura de 500 a 5500C para evitar que la muestra se incinere y mantener la temperatura durante 16 horas o toda la noche. 5. Apagar la mufla y dejar enfriar. 6. Un segundo paso de calcinación puede ser requerido para remover algunos residuos de carbón, mediante el siguiente procedimiento: Lavar las paredes del crisol con 2 ml de ácido nítrico al 50%. Colocar la muestra en una placa de calentamiento puesta a 1200 C para remover el exceso de ácido. Colocar la muestra en una mufla fría y elevar la temperatura gradualmente de 500°C a 5500 C, manteniéndola por el tiempo necesario. Repetir esta operación cuantas veces sea necesario hasta que quede libre de carbón remanente. 7. Disolver las cenizas completamente en 5 ml de ácido clorhídrico 1 N, transferir la muestra disuelta a un matraz de volumen conocido, enjuagar el crisol con dos alícuotas de 5 ml de ácido clorhídrico 1 N y transferir al mismo matraz, llevar al aforo el matraz tapar y mezclar, si hay presencia de partículas o materia insoluble, filtrar en papel Whatman No. 2, antes de la determinación. 8. Correr un blanco de reactivos, una muestra fortificada y muestra control por cada serie de digestión. 9. Leer en el aparato de absorción atómica Perkin Elmer 3100. Previamente ajustado y optimizado como se muestra en el punto 3.3.1. 3.3.2.4. DIGESTION POR VÍA HUMEDA PARA LA DETERMINACIÓN DE ESTAÑO 1. Proceder igual que el paso 1 del punto anterior. 2. No adicionar ácido nítrico si no se realiza la digestión total en el mismo día. 3. Adicionar 30 ml de ácido nítrico concentrado al matraz y calentar suavemente por 15 minutos en campana de extracción para iniciar la extracción, evitando una excesiva producción de espuma. 4. Hervir suavemente hasta tener un remanente de 3 a 6 ml o hasta que la muestra empiece a secarse en el fondo. No dejar que la muestra se calcine. Retirar la muestra del calor. 5. Al mismo tiempo correr dos blancos de reactivo. 6.Adicionar 25 ml de ácido clorhídrico concentrado, calentar suavemente aproximadamente 15 minutos, hasta que todo el cloro sea liberado. Aumentar la temperatura gradualmente hasta ebullición. 7. Evaporar hasta obtener de 10 a 15 ml, usando un matraz similar con 15 ml de agua como patrón de volumen. 8. Adicionar aproximadamente 40 ml de agua. Agitar y pasar a un matraz de 100 ml y enjuagar con 10 ml de agua. 9. Cuando al ácido clorhídrico esta presente en la digestión, las muestras se pueden quedar toda la noche o por más tiempo. 10. Agregar 1 ml de la solución de cloruro de potasio en cada matraz. Enfriar a temperatura ambiente. 11. Diluir con agua y adicionar mas agua para compensar el volumen en el matraz. 12. Mezclar perfectamente y filtrar de 30 a 50 ml a través de un papel filtro Whatman No. 2 y recoger el filtrado en un recipiente de propileno, Polipropileno o polietileno. 13. No filtrar los blancos. Tapar las botellas durante el análisis. Las soluciones son estables por varios meses. 14. Correr un blanco de reactivos, una muestra fortificada y muestra control por cada serie de digestión. 15. Leer en el espectrofotómetro de absorción atómica Perkin Elmer 3100, previamente ajustado y optimizado como se muestra en el punto 3.3.1.7 3.3.2.5 DIGESTION POR SISTEMA CERRADO PARA LA DETERMINACIÓN DE MERCURIO 1. Pesar con precisión de +/- 0.1 mg, la cantidad apropiada de muestra, dependiendo el tipo de ésta, en el recipiente de digestión. 2. Agregar la cantidad necesaria de ácido nítrico concentrado. 3. Tapar y sellar perfectamente el matraz Erlenmeyer de digestión. Colocar en una autoclave a 15 lb por 30 minutos. 4. Enfriar a temperatura ambiente. En caso de que la digestión no sea completa adicionar peroxido de hidrógeno y repetir la digestión. 5. Filtrar en caso de que exista grasa o cera y analizar el contenido de Hg. 6. Correr un blanco de reactivo, una muestra fortificada y una muestra control por cada serie de digestión. 7. Leer en el espectrofotómetro de absorción atómica de vapor frío Perkin Elmer 3100. previamente ajustado como se muestra en el punto 3.3.1.7. 3.3.2.6 DIGESTIÓN POR VIA SECA PARA LA DETERMINACIÓN DE ARSÉNICO 1. Pesar con precisión de +/- 0.1 mg, la cantidad apropiada de muestra en un crisol Vycor o de platino. 2. Añadir el volumen necesario de nitrato de magnesio al 50 % p/v. Homogenizar con una varilla limpia de plástico extendiendo la mezcla en el crisol. 3. Colocar la muestra en una mufla subiendo gradualmente la temperatura hasta 3000C por 2 horas. Posteriormente subir gradualmente la temperatura hasta 5000C por 16 horas o durante toda la noche. 4. Enfriar a temperatura ambiente y humedecer las cenizas con ácido nítrico al 50 % v/v. Calentar en parrilla hasta eliminar el ácido. 5. Llevar los crisoles a una mufla elevando gradualmente la temperatura de 23 a 5000C, manteniendo ésta 30 minutos hasta evaporación total. 6. Transferir las cenizas del crisol a un matraz aforado usando una porción de 10 ml de ácido clorhídrico 0,5 N. 7. Enjuagar los crisoles con 5 ml de agua destilada y transferir al matraz, añadir 1 ml de solución de yoduro de potasio al 15 % y mezclar. Dejar reposar durante 15 minutos y llevar al aforo. 8. Correr un blanco de reactivos, una muestra fortificada y muestra control por cada serie de digestión. 9. Leer en el espectrofotómetro de absorción atómica con generador de hidruros Perkin Elmer 3100, previamente ajustado como se muestra en el punto 3.3.1.7. 3.3.2.7 DETEMINACIÓN DE METALES EN AGUA POTABLE Y PURIFICADA Las muestras incoloras, transparentes e inodoras y de una sola fase, pueden analizarse directamente por espectrometría de absorción atómica sin digestión. Previo a dicho análisis, adicionar a 100 ml de muestra, 1 ml de ácido nítrico, en caso de que se observe un precipitado, realizar una digestión adicionando 1 ml más de ácido nítrico concentrado calentar a 850C hasta reducir su volumen a 20 ml cuidando de que no hierva. Calentar a reflujo 30 minutos y transferir a un matraz volumétrico de 50 ml. Centrifugar a 1600 rpm por 30 minutos o dejar reposar toda la noche y analizar el sobrenadante 3.3.2.8 EXPRESIÓN DE RESULTADOS 3.3.2.8.1 Método de cálculo Interpolar los valores de absorbancia o altura de pico de la muestra analizada en la curva de calibración y obtener mg/kg del elemento en la muestra y realizar los cálculos empleando la siguiente fórmula: mg/kg = A x B / C x 1000 En donde: A = Concentración en mg/ l de la muestra a interpolar en la curva de calibración. B = Volumen final al que se llevo la muestra (l) C = Peso de la muestra (g) o Volumen de la muestra (ml) en el caso de agua. 1000 = factor de conversión. ec. (6) 3.3.2.9 INFORME DE LA PRUEBA El reporte de la prueba deberá contener la siguiente información: 1) Tipo e identificación del producto analizado. 2) El método usado para determinación. 3) El resultado debe estar expresado en mg/kg del elemento a determinar. 4) Nombre del analista. 5) Fecha de recepción de muestra. 6) Fecha de análisis de muestra. 7) Firma de supervisión y aceptación. 3.4 DETERMINACIÓN DE CADMIO, PLOMO, MERCURIO Y ESTAÑO EN ATÚN ENLATADO EN AGUA En esta sección se muestra el análisis de dos lotes ingresados a la empresa, a las cuales se les determinaron metales pesados. Para complementar el procedimiento establecido en el lugar de trabajo, se investigaron las normas involucradas con el alimento a analizar (atún enlatado en agua), las normas encontradas fueron NOM-130-SSA1-1995 y la NOM-028-SSA1-1993, relacionadas con alimentos enlatados y productos de la pesca respectivamente, obteniendo de éstas los metales requeridos en México para este tipo de alimentos, también se obtuvieron los limites máximos permisibles de metales mostrados en la tabla 5. En la determinación de los parámetros se utilizó un Espectrofotómetro de Absorción Atómica con generador de hidruros, siguiendo los pasos descritos en el punto 3.3.1 para la optimización y manejo del Espectrofotómetro, así como el procedimiento utilizado en la preparación y digestión de las muestras presentado en el punto 3.3.2. Tabla 5. Muestra los limites máximos de metales de acuerdo a la NOM-028-SSA1-1993. Tabla 5. Limites máximos. Metal Cadmio Mercurio Plomo Estaño L.M. (mg/kg) 0.5 1.0 1.0 100 L.M: Limite máximo. Materiales: § Balanza analítica Ohaus 2000, con capacidad de 202 g y una sensibilidad de 0.1 mg. § Mufla Lindberg/Moldatherm, con temperatura regulable hasta 1100°C y controlador digital. § Estufa de secado Riossa H-41, con temperatura regulable de 50 a 200 °C, con sensibilidad de +/- 2 grados. centígrados y con termostato hidráulico. § Espectrofotómetro de absorción atómica Perkin Elmer 3100. § Material de vidrio volumétrico. Como primer paso para el análisis: de los dos lotes de atún enlatado en agua ingresados a la empresa de trabajo, se tomaron muestras al azar, homogenizándolas perfectamente con el fin de obtener porciones representativas y suficientes para efectuar las determinaciones correspondientes representando con esto lo mejor posible las características de las muestras, éstas se prepararon por duplicado para cada lote, Posteriormente se siguieron los pasos descritos en el punto 3.3.2 para la digestión de las muestras dependiendo del metal a analizar y basándose en la norma NOM-117-SSA11994. se prepararon blancos de reactivos, muestras fortificadas y muestras control, las concentraciones se indican en la tabla 7, obteniendo lecturas de absorbancia por triplicado para cada muestra, con el objetivo de asegurar la certeza y confiabilidad de los resultados. Posteriormente se prepararon las curvas de calibración, utilizando estándares de referencia certificados con características mostradas en la tabla 6. A partir de las concentraciones mencionadas en la tabla se prepararon soluciones madre de 1000 ppm para posteriormente realizar diluciones con agua tridestilada, hasta obtener las concentraciones requeridas en el análisis, descritas en la tabla 7. Esta etapa se realiza con el fin de asegurar la confiabilidad de los resultados tanto del espectrofotómetro como de la digestión adecuada de las muestras ya que las curvas de calibración se preparan en el rango establecido y validado por la empresa de trabajo, las cuales deben ser lineales con un coeficiente de correlación mínimo de r=0.997. Tabla 6. Especificaciones de estándares Metal Marca lote Concentración (mg/l) Cadmio Nist 60531 10000 Estaño Nist 70330 10000 Mecurio Nist 61204 10000 Plomo Nist 30721 10000 Referencia : Empresa de Jorge Rodríguez Tabla 7. Concentraciones utilizadas Elemento Cd Sn Hg Pb Concentración del elemento (mg/l) M.C (mg/l) (0.0), (0.5), (1.0), (1.5), (2.0) (0.5) (0.0), (0.03), (0.05), (0.08), (0.1) (0.05) (0.0), (0.03), (0.05), (0.08), (0.1) (0.05) (0.0), (3.0), (5.0), (8.0), (10.0) (5.0) Referencia: Empresa de Jorge Rodríguez MC: muestra control las cuales llevan el mismo procedimiento de preparación y digestión que las muestras ingresadas al laboratorio. 3.4.1 RESULTADOS Y DISCUSIÓN En esta parte se presentan los gráficos de calibración obtenidos en cada metal, representando en ellos las absorbancias, concentraciones y la muestra analizada, también se localizan los valores obtenidos en la regresión lineal y las condiciones de operación del espectrofotómetro, las cuales se ajustan dependiendo del parámetro a analizar y se muestran en la tabla 1. De igual manera se presentan los criterios de aceptación, tablas de resultados y un ejemplo del cálculo de los metales en la curva de calibración. Graficando concentración contra absorbancia se obtiene la linealidad mediante una regresión lineal con el coeficiente de correlación (r2) que para un caso ideal debe ser igual a uno (García y Col., 2002), está linealidad nos indica que los valores obtenidos en el espectrofotómetro son confiables siempre y cuando sea mayor a 0.997, criterio establecido en la empresa de trabajo. El gráfico 1 muestra una linealidad de 0.9997 lo cual indica que la funcionalidad del equipo es correcta y por lo tanto la extracción, el análisis y resultado de las muestras son confiables, también se observa que el valor obtenido en los lotes analizados caen dentro del rango de concentraciones de la curva de calibración, evidenciando la confiabilidad del resultado. Gráfico 1. Curva de Calibración del Plomo curva de calibración Pb Pb a bs Analito Curva de calibración mg/l abs 0.00 0.001 3.00 0.031 5.00 0.049 8.00 0.077 10.00 0.098 0.120 0.100 0.080 0.060 0.040 0.020 0.000 0.00 4.00 6.00 mg/l r=0.9997 b=0.0007 m=0.0097 y=mx+b, 2.00 x= y-b/m CONDICIONES DE OPERACIÓN l= 283.3 Slit= 0.7 Oxidante= 2.5 Combustible= 2 Muestra= 8.00 10.00 En el gráfico 2 se observa una linealidad de 0.9988 lo cual nos indica que la funcionalidad del equipo es correcta y por lo tanto el análisis de la muestra es confiable. Gráfico 2. Curva de calibración de Cadmio curva de calibración Cd Cd abs Analito Curva de calibración mg/l abs 0.00 0.000 0.50 0.060 1.00 0.130 1.50 0.181 2.00 0.255 0.300 0.250 0.200 0.150 0.100 0.050 0.000 0.00 0.50 1.00 1.50 2.00 2.50 mg/l CONDICIONES DE OPERACIÓN l= 228.8 Slit= 0.7 Oxidante= 5 Combustible= 2 r=0.9988 b=-0.0010 m=0.1262 y=mx+b x= y-b/m El gráfico 3 muestra una linealidad de 0.9992 lo cual nos indica que la funcionalidad del equipo es correcta y por lo tanto el análisis y resultado de las muestras son confiables, también se observa que el valor obtenido del analito cae dentro del rango de concentraciones de la curva de calibración evidenciando que el resultado es confiable. Gráfico 3. Curva de Calibración de Mercurio. curva de calibración Hg Hg 0.400 0.300 abs Analito Curva de calibración mg/l abs 0.00 0.012 0.03 0.098 0.05 0.159 0.08 0.264 0.10 0.326 0.200 0.100 0.000 0.00 0.04 0.06 0.08 mg/l r=0.9992 b=0.0067 m=3.1755 y=mx+b, 0.02 x= y-b/m CONDICIONES DE OPERACIÓN 253.7 l= Slit= 0.7 Oxidante= N.A Combustible= N.A Muestra 0.10 0.12 En el gráfico 4 se observa una linealidad de 0.9992 lo cual nos indica que la funcionalidad del equipo es correcta y por lo tanto el análisis y resultado de las muestras son confiables. El valor de la muestra analizada se salió del intervalo de concentraciones de la curva de calibración por lo que se realizó una dilución 1:25, obteniendo así un valor dentro del rango de la curva. El valor fuera de rango no se muestra ya que no es confiable. Gráfico 4. Curva de Calibración de Estaño curva de calibración Sn Sn a bs 0.300 0.250 Analito Curva de calibración mg/l abs 0.00 0.007 0.03 0.076 0.05 0.125 0.08 0.207 0.10 0.261 0.050 0.000 0.00 0.02 0.04 0.06 0.08 0.10 0.12 mg/l r=0.9992 b=0.0024 m=2.5538 y=mx+b, 0.200 0.150 0.100 x= y-b/m CONDICIONES DE OPERACIÓN 286.3 l= Slit= 0.7 Oxidante= 3 Combustible= 2 Muestra= Otra forma de verificar los resultados obtenidos es mediante el porcentaje de recuperación, el cual es un punto importante en todo método analítico que pretenda identificar y cuantificar compuestos inmersos en alguna matriz, y que además se refiere a la extracción del analito así como a su purificación ya que de ambos depende la eliminación de toda contaminación que pueda ocasionar interferencias o falsos resultados. Este parámetro se obtiene dividiendo la cantidad recuperada del analito entre la cantidad adicionada del mismo por 100. Para obtener este punto se analizaron 6 muestras independientes que recibieron igual acondicionamiento que los lotes; calculando el promedio de los resultados los cuales se muestran en la tabla 8. El criterio de aceptación de esté parámetro en la empresa de trabajo es de 90-110%; con base a esto puede establecerse que el proceso es confiable ya que los valores obtenidos entran dentro del rango de aceptación. Tabla 8. Porciento de recuperación. Metal Cd Pb Hg Sn Cantidad Cantidad % recuperación Adicionada recuperada 1.0 1.02 102.20 5.0 4.993 99.87 0.05 0.048 97.83 0.05 0.049 98.36 Para calcular los resultados reportados al cliente se interpolan los valores de absorbancia obtenidos en la curva de calibración, considerando que ésta es lineal se utiliza la ecuación de la recta. De dicha ecuación se despeja x para conocer la concentración del analito en mg/l. Los valores de b (ordenada al origen), y (absorbancia) y m (pendiente) encontrados se sustituyen en la ecuación para calcular x como se muestra en el cálculo de mercurio utilizando los datos obtenidos durante el análisis. La tabla 9 ilustra el ejemplo: Tabla 9. Cálculo del mercurio en mg/lt Datos Ec. de la recta Despejando x Sustituyendo Resultado mg/l Abs(y) = 0.125 b = 0.0067 y = mx + b x = y–b/m (0.125 – 0.0067)/3.1755 0.0373 m = 3.1755 En el punto 3.3.2.8 expresión de resultados, se muestra la ecuación 6, la cual nos sirve para calcular los valores finales de nuestro analito en mg/kg. Utilizando el valor encontrado en mg/l se realiza el cálculo como se muestra en la tabla 10. Tabla 10. Cálculo del mercurio en mg/kg Datos Ec. 6 Sustituyendo Resultado mg/kg A= 0.0373 mg/l B= 0.025 l mg/kg = A x B / C x 1000 (0.0373 x 0.025)/ 3.5172 x 1000 0.26 C= 3.5172 g. Nota: Los metales restantes se calculan de la misma forma utilizando los valores correspondientes para cada uno. Los resultados encontrados se hacen llegar al cliente indicándole los métodos y normas utilizadas para la obtención de éstos, así también se le indican los limites máximos permisibles de los contaminantes y éste toma las decisiones para con su producto. En las tablas 11 y 12 se muestra la concentración promedio de los metales analizados. Como puede observarse se detectó la presencia de plomo, mercurio y estaño excepto cadmio, los valores obtenidos no superan los limites máximos permisibles establecidos en la NOM-028-SSA1-1993 y la NOM-130SSA1-1995 que son las que rigen el tipo de producto analizado. Se observa el estaño con el valor de mayor promedio mientras que el mercurio con el valor menor entre los metales analizados. A pesar de que dichos valores no superan los limites, no es recomendable consumir productos enlatados ya que los metales pesados se acumulan en diversos órganos del cuerpo humano, causando daños a la salud a largo plazo (Russell, 1992). Comparando los resultados obtenidos con los limites máximos permisibles que señala el Codex Alimentarius, se muestran en las tablas 11 y 12, que es un organismo conjunto de la FAO y la OMS, encargado de elaborar normas para el comercio mundial de alimentos, dichos resultados obtenidos entran dentro de los limites establecidos por este organismo, por lo que se podría decir que el producto analizado cumple con las normas mexicanas y mundiales. Comparando los valores de mercurio encontrados en este trabajo, con un artículo publicado en la revista Internacional de Contaminación Ambiental donde se cuantifico el mismo metal en 84 muestras de atún y sardinas enlatadas de seis marcas comerciales producidas en México, mediante un espectrofotómetro de absorción atómica con generador de hidruros, los contenidos oscilaron entre 0.18 a 4.52 mg/kg para el caso de atún (Velasco y Col., 2001). Se observa que los valores obtenidos en este proyecto caen en el rango anterior, aunque no superan los establecidos en la norma que rige estos productos en nuestro país. Se concluye que en el atún enlatado en agua se detectaron metales pesados debido a que los productos del mar son vulnerables a este tipo de contaminación por los desechos industriales vertidos a mares y ríos (Delgado y Balbuena, 2006), por la composición misma de la lata ya que algunas presentan soldaduras de plomo-estaño los cuales migran al alimento en ocasiones con mayor facilidad dependiendo del pH del producto, del tiempo de almacenamiento, por la calidad del barnizado en las latas, por la fabricación, elaboración, preparación y tratamiento de estos productos (Lara, 1982). Tabla 11. Resultados obtenidos al analizar el Lote 1 Peso (g) Vol. (L) Resultado Media M.C L.M.P.1 L.M.P.2 (mg/Kg) (mg/Kg) (mg/Kg) Cadmio 1. 3.5172 0.025 0.00 0.00 1.02 0.5 2.0 Cadmio 2. 3.6425 0.025 0.00 Plomo 1. 3.5172 0.025 0.98 0.96 4.99 1.0 1.0 Plomo 2. 3.6425 0.025 0.95 Mercurio 1. 3.5172 0.025 0.26 0.26 0.048 0.5 0.5 Mercurio 2. 3.6425 0.025 0.25 Estaño 1. 3.5172 0.025 16.33 100 250.0 16.05 0.049 Estaño 2. 3.6425 0.025 15.77 1:muestra, 2:duplicado. Los resultados mostrados son el promedio de tres lecturas de absorbancia Metal L.M.P.1= limite máximo permisible establecido en la NOM-028-SSA1-1993. L.M.P.2 =limite máximo permisible establecido en el CODEX ALIMENTARIUS. Tabla 12. Resultados obtenidos al analizar el Lote 2. Metal Peso (g) Vol. (L) Resultado Media M.C L.M.P.1 L.M.P.2 (mg/Kg) (mg/Kg) (mg/Kg) Cadmio 1. 3.5384 0.025 0.00 0.00 1.02 0.5 2.0 Cadmio 2. 3.5733 0.025 0.00 Plomo 1. 3.5384 0.025 0.98 0.97 4.99 1.0 1.0 Plomo 2. 3.5733 0.025 0.97 Mercurio 1. 3.5384 0.025 0.26 0.5 0.5 0.26 0.048 Mercurio 2. 3.5733 0.025 0.26 Estaño 1. 3.5384 0.025 16.30 100 250.0 16.24 0.049 Estaño 2. 3.5733 0.025 16.19 1: muestra, 2: Duplicado. Los resultados mostrados son el promedio de tres lecturas de absorbancia 4. ANÁLISIS GENERAL SOBRE EL PROYECTO PRESENTADO Cómo ya es sabido, la Universidad Nacional Autónoma de México desde su fundación ha sido la máxima productora de profesionales de la más alta calidad y capacidad en este país. En mi caso particular tuve el privilegio y la fortuna de ser formada en la carrera de Ingeniería en Alimentos con una educación de excelencia. Gracias a la formación que recibí, a la iniciativa de investigación, al sentido analítico y explorador, al liderazgo y al deseo de superación y mejora continua, tuve la oportunidad de ejercer mis conocimientos en la vida laboral de México. Por otro lado gracias a la gran riqueza y diversidad cultural que existe dentro de la Universidad, desde que somos estudiantes nos fomenta una cultura de cooperación e interacción interdisciplinaria, lo cual me permitió en mi vida laboral adaptarme en grupos de trabajo con personas de otras ramas científicas y también sociales para la discusión de los resultados que se obtenían, así como de las decisiones que se tomaban. De la misma manera cuento con el gran sentido y responsabilidad social que me inspiró la Universidad durante mi formación, pues como se ha tratado en éste trabajo, el monitoreo de los metales pesados en alimentos es de suma importancia pues se debe garantizar que la población, personas de cualquier edad, condición social o económica, reciban alimentos de calidad e inocuos para su salud. Dentro de mis actividades diarias fui capacitada para la utilización del Espectrofotómetro de Absorción Atómica, un instrumento de la más alta tecnología que permite la aplicación de diversas técnicas para el monitoreo de sustancias dañinas y que lamentablemente se encuentran en productos necesarios para nuestra supervivencia: Alimentos. Por lo anterior es muy importante saber y entender el funcionamiento de esté instrumento así como el manejo e interpretación de las normas con el fin producir resultados analíticos confiables para garantizar productos seguros al consumidor. Hoy en día los hábitos alimenticios han cambiado por diversos factores como tener que comer fuera de casa, en poco tiempo y abajo costo; por lo que el consumo de productos enlatados sea incrementado ya que además de lo anterior se consiguen fácil, no requieren de gran preparación y son económicos. Siendo éstos productos una fuente importante de contaminación de metales pesados para el hombre, además de encontrarlos en el medio ambiente de manera natural o por acción del hombre, por lo anterior nuestra exposición a éstos contaminantes a través de los alimentos difícilmente puede evitarse. Aunque sí puede minimizarse, intentando productores y demás personal técnico que se reduzca en lo posible y razonable su entrada a la cadena alimenticia. Desgraciadamente en nuestro país existe muy poca investigación, difusión y control del contenido de metales pesados en alimentos. En realidad es poca la información disponible de las concentraciones de estos contaminantes en alimentos, por lo que es necesario desarrollar un órgano que se encargue de vigilar, controlar y establecer los limites máximos permisibles con base en investigación sobre la ingesta de estos metales y su posible efecto perjudicial sobre la salud, considerando las características y condiciones ambientales de nuestro país; ya que las Normas existentes se basan en los limites internacionales actualmente vigentes. CONCLUSIONES 1) El método de absorción atómica es altamente específico, reproducible, exacto, sencillo, rápido y fácil, haciéndolo una herramienta muy versátil por su capacidad para usar una variedad de accesorios que mejoran el limite de detección (horno de grafito, generador de hidruros, llama convencional etc.) 2) Las interferencias que pudieran surgir están completamente estudiadas por lo que pueden ser controladas, haciendo esta técnica útil para determinación de metales con resultados confiables. 3) Los equipos analíticos con los que se cuenta en la industria (como el mencionado en éste trabajo) ofrecen una oportunidad inmensa de poder medir sustancias dañinas para las especies o el hombre mismo, es decir permiten medir grados de contaminación de productos tan importantes como son los alimentos, por lo que sería recomendable aumentar los conocimientos sobre estas técnicas y equipos de medición en la carrera de ingeniero en Alimentos. 4) En México existe muy poca investigación, difusión y control del contenido de metales pesados en los alimentos principalmente en enlatados, por lo que seria necesario desarrollar e incrementar una vigilancia sanitaria sobre este tipo de contaminantes con el fin de proteger la salud pública. 5) Las concentraciones de plomo, cadmio, mercurio y estaño encontradas en las muestras analizadas se encuentran dentro de las normas Mexicanas establecidas. 6) El consumo de productos enlatados constituye un riesgo de toxicidad para el sector de la población que los consume como parte de su dieta normal, ya que estos contaminantes son acumulativos en el organismo causando daños a la salud a largo plazo. 7) En el presente trabajo se describieron las técnicas utilizadas en la empresa de Jorge Rodríguez García en la cuantificación de metales pesados en alimentos por espectrometría de absorción atómica, en base a la Norma Oficial Mexicana NOM-117-SSA1-1994. 8) El atún enlatado en agua presento concentraciones de metales por abajo de los limites máximos permitidos está contaminación puede ser ocasionada por varios factores como: vertidos industriales a mares y ríos, por la composición de las latas, ya que algunas presentan soldaduras de plomo-estaño los cual migran al alimento en ocasiones con mayor facilidad dependiendo del pH del producto y del tiempo de almacenamiento; por la calidad del barnizado en las latas, por la fabricación, elaboración, preparación y tratamiento de estos productos. 9) La carrera de Ingeniero en Alimentos proporciona la capacidad de observar, interpretar y analizar resultados a los egresados, para poder desarrollarse en diferentes ámbitos laborales generando opiniones, soluciones y analizando los fenómenos físicos ocurridos durante el desarrollo de una técnica, una investigación o una implementación de las mismas. 10) En base a los conocimientos y capacidades adquiridas en la carrera de Ingeniero en Alimentos se identificaron y cuantificaron algunos metales pesados en una muestra de atún enlatado en agua, obteniendo resultados confiables de acuerdo a lo establecido en el lugar de desempeño laboral. RECOMENDACIONES 1) Utilizar métodos de digestión más sencillos y rápidos como: horno de microondas, lo cual ahorraría tiempo de análisis, y rapidez en la entrega de resultados; utilizar instrumentos más sensibles, para poder incrementar la detección del analito hasta partes por billón, por ejemplo horno de grafito, acoplamiento con plasma, etc. 2) Adaptación de software al espectrofotómetro de absorción atómica Perkin Elmer 3100 con el fin de almacenar información como: curvas de calibración, validaciones de métodos, resultados obtenidos en las muestras y cálculo de resultados, agilizando así la entrega y búsqueda de datos. 3) Realizar mantenimiento periódicamente al instrumento, reparando los dispositivos de seguridad; colocarlo en una área independiente, libre de humos corrosivos y polvo; colocar una instalación eléctrica mayor a 100 volts, todo esto para evitar daños al instrumento y lograr una vida más útil de éste. 4) Se recomienda instalar una red electrónica en las áreas que integran la empresa para lograr reducir tiempos muertos, minimizar errores, agilizando así la entrega de resultados. 5) Se recomienda la creación de un órgano que realice investigaciones más a fondo sobre el consumo de alimentos contaminados con metales pesados para poder establecer limites máximos permisibles de ingesta y su posible efecto perjudicial sobre la salud considerando las características propias de nuestro país y condiciones ambientales. 6) De acuerdo a los resultados obtenidos y a la investigación realizada, se recomienda evitar una ingesta excesiva de alimentos enlatados debido a que los metales pesados se acumulan en diversos órganos del cuerpo humano, causando daños a la salud a largo plazo, especialmente en niños, mujeres embarazadas y lactando ya que son grupos más vulnerables a este tipo de contaminación. 7) Se recomienda realizar estudios para conocer el contenido de metales pesados en todos los productos enlatados presentes en el mercado. 8) Es necesario mostrar en las etiquetas de los productos enlatados el contenido de éstos contaminantes y el posible daño que pudieran ocasionar a la salud al consumirlos. 9) Se recomienda no comprar latas que presenten abolladuras, abombamientos y signos de oxidación, ya que esto puede indicar contaminación del producto y comerlo así es un riesgo para la salud. 10) Dado que el área de control de calidad es una fuente importante de empleo para los egresados de la carrera de Ingeniero en Alimentos se recomienda profundizar más los conocimientos sobre técnicas analíticas de laboratorio, así como la utilización de instrumentos de medición analítica como el mencionado en este trabajo y algunos otros (cromatógrafos de gases, líquidos, iones, espectrofotómetros de infrarrojo, uv-vis, fluorescencia etc.), para una formación académica más completa de acuerdo al punto de vista de un egresado. REFERENCIAS CITADAS Albert, A. (1999). Curso básico de toxicología ambiental. Editotial Limusa. 2ª edición. México D.F. 101-185. Arroyo, M. (2007). Detección de metales pesados en chile. Tesis. Facultada de Química. UNAM. 1-15. Beaty, D. (2004). Conceptos, instrumentación y técnicas de espectrofotometría por absorción atómica. Curso de Perkin Elmer. 40-54, Caballero, C. (1996). Cuantificación de metales pesados (Pb y Cd) en alimentos infantiles envasados. Tesis. Facultad de Química. UNAM. 19-24. Castro, C. (2005). Cuantificación de metales traza en café de grano de origen mexicano por espectroscopia de absorción atómica. Tesis. Facultad de Química. UNAM. 34-57. Day, A.; Underwood, L. (1989). Química Analítica Cuantitativa. Editorial Pearson educación. 5ª edición. Edo. de México. 459-506. Delgado, S.; Balbuena, V. (2006). Vigilancia y riesgo de metales pesados en alimentos en el área XI de la comunidad de Madrid. Revista tecnología e higiene de los alimentos. No. 371. 111-112. Dreisbach, H. (1984). Manual de toxicología clínica. Editorial El manual moderno. 5ª edición. México D.F. 203-219. Flanagan, J.; Taylor, A.; Watson, D.; Whelpton, R. (2007). Fundamentals of analytical toxicology. Editorial John Wiley y Sons. U.S.A. 286-289. García, E.; Cortés, M.; Rodríguez, R.; Herrera, L.; Alcantara, A. (2002). Guía de validación de métodos analíticos. Colegio Nacional de Químicos Farmacéuticos Biólogos, A.C. 8-10, 26-30. Harris, C. (1992). Análisis químico cuantitativo. Editorial Iberoamericana. México D.F. 580-594. Hernández, L. (2001). Compendio de aspectos toxicológicos de plomo, mercurio y arsénico. Departamento de Farmacia. Facultad de Química. UNAM. 43-49. Khairiah, J.; Zalifahn, M.; Aminah A. (2004). The uptake of heavy metals by fruti type vegetables grown in selected agricultural areas. Pakistan-Journal-of-Biological-Sciences, vol.7, 1438-1442. Klaassen, C.; Watkins, J. (2001) Manual de toxicología, la ciencia básica de los tóxicos. Editorial MacGraw-Hill Interamerican. México D.F. 383-388. Lara, H. (1982). Evaluación de los contaminantes metálicos plomo y cadmio en jugos enlatados de acuerdo al tiempo de almacenamiento y acidez de los mismos. Tesis. Facultad de Química. UNAM. 15-16 Lars, F.; Gunnar, F.; Nordberg, V.; Vook, B. (1986). Hand book on the toxicology of metals. Editorial Elsevier Science Publishers. 2ª edición. Vol.1 y 2. Capítulos 3, 7, 16, 23. Leonard, B. J. (1978). Toxicology aspects of food safety. Editorial Springer-Verlang. New York. 47-51. Lidner, E. (1995). Toxicología de los alimentos. Editorial Acribia. 2ª edición. Zaragoza España. 132- 141. Perkin, E. (1982), Manual de operación del espectrofotómetro de absorción atómica 3100. Perkin Elmer. Mc-Murry, J. (2004). Química orgánica. Editorial Thomson. 6ª edición. México D.F. 405406. Mubbasher, S., Waheed K., Hayat I. (2003). Effect of enviromental pollution on quality of meat in district Bagh. Pakistan Journal of Nutrition. Vol. 2, 98-101. Norma Oficial Mexicana Nom-117-SSA1-1994. Bienes y servicios. Método de prueba para la determinación de cadmio, arsénico, plomo, estaño, cobre, fierro, zinc y mercurio en alimentos, agua potable y agua purificada por espectrometría de absorción atómica. Norma Oficial Mexicana Nom-028-SSA1-1993. Bienes y servicios. Productos de la pesca. Pescados en conserva. Especificaciones sanitarias. Norma Oficial Mexicana Nom-130-SSA1-1995 Bienes y servicios. Alimentos envasados en recipientes de cierre hermético y sometidos a tratamiento térmico. Disposiciones y especificaciones sanitarias. Profeco. (2005). Estudio de algunos productos de atún en agua y de atún en aceite. http://www. Panorámica acuícola. com. Consulta 28 de Mayo del 2009. Raimon, G. (2002). Los residuos de metales en los alimentos. http://www.consumer.es/seguridad-alimentaria/ciencia. Consulta 29 de Noviembre del 2008. Rodríguez, F., Sánchez A., Vidales C. (2005). Metales pesados en leche de bovino. Revista Salud Pública y Nutrición. No.4. 1-6. Russell, L. (1992). Minerals in animal and Human nutrition. U.S.A. Academic Press Capitulo 5, 7, 8, 11, 28. Skoog, D. (1984). Química analítica. Editorial Mc Graw Hill. 4ª edición. México. 444-472. Tolonen, M. (1995). Vitaminas y minerals en la salud y la nutrición. Editorial Acribia. Zaragoza España. Capitulo 5. Velasco, G; Echavarría, A; Pérez, L; Villanueva, F. (2001). Contenido de mercurio y arsénico en atún y sardinas enlatadas en México. Revista Internacional de Contaminación Ambiental. No. 17. 31-35. GLOSARIO § Blanco de reactivos. Es la solución que contiene todos los reactivos usados en los mismos volúmenes y concentraciones en el procesamiento de la muestra, siguiendo los pasos de digestión y preparación de la muestra. § Muestra fortificada. Es la porción representativa del material a evaluar, a la que se le adicionan cantidades conocida del analito. § Muestra control es una muestra que contiene una alícuota de concentración del analito, cuyos valores de absorbancia deben estar comprendidos en el rango lineal del método. § Analito. Componente específico de una muestra a medir en un análisis. § Disolución estándar. Disolución de concentración conocida preparada a partir de un patrón primario. § Disolución madre. Disolución de máxima concentración en un análisis. A partir de esta disolución se preparan las disoluciones de trabajo. § Estándar de referencia. Sustancia de uniformidad reconocida destinada a utilizarse en comprobaciones analíticas físicas, químicas o mocribiológicas en el transcurso de las cuales sus propiedades se comparan con la sustancia en evaluación. § Estándar de referencia certificado. Sustancia que es designada o reconocida por tener la más alta calidad metrológica, cuyas propiedades se aceptan sin referencia a otras sustancias. § Validación del método analítico. Proceso por el cual se demuestra, por estudios de laboratorio, que la capacidad del método satisface los requisitos para la aplicación analítica deseada. § Matriz. Muestra que contiene todos los componentes de u producto a excepción del analito. § Limite máximo permisible. Se define como la concentración permisible de residuo en un alimento destinado al consumo humano, depende de factores como ingestión diaria aceptable, peso promedio del peso de consumidor y factor alimenticio. § Rotámetro. Dispositivo para medir el gasto de fluidos. § Espectro. Diseño de luz producido por la dispersión de un haz de luz en las longitudes de onda componentes. La luz emitida por una sustancia en un estado excitado produce un espectro de líneas en el cual sólo ciertas longitudes de onda aparecen. § Estado estable del átomo. Es la configuración más estable y de más bajo contenido energético. § Espectroscopia. Es un área de la física y la química dedicada al estudio de la generación, medición e interpretación de los espectros de energía (electromagnético o partícula) que resulta ya sea de la emisión o absorción de energía radiante o partículas de una sustancia cuando se le bombardea con radiación electromagnética, electrones, neutrones, protones, iones o bien por calentamiento, excitación con un campo eléctrico magnético, usada para investigar estructura nuclear y atómica. § Espectrometría. Es una rama de la espectroscopia relacionada con la medición de espectros. § Supresor de ionización. Elemento que fácilmente se ioniza, originando un gran número de electrones libres en la llama eliminando la ionización del analito, los más empleados son sodio y potasio.
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados