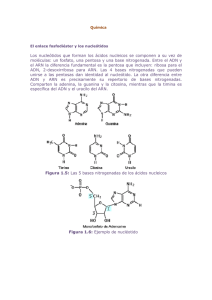
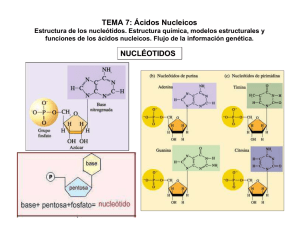
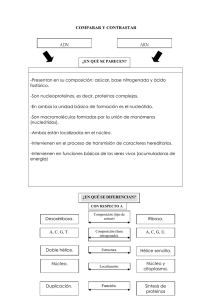
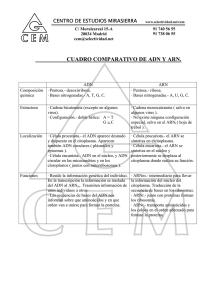
acidos nucleicos que contienen ciclohexeno.
Anuncio

19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS C07D 473/34 (2006.01) A61K 31/70 (2006.01) C07H 21/00 (2006.01) ESPAÑA 12 11 Número de publicación: 2 261 270 51 Int. Cl.: TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 00990110 .9 86 Fecha de presentación : 27.12.2000 87 Número de publicación de la solicitud: 1244667 87 Fecha de publicación de la solicitud: 02.10.2002 54 Título: Ácidos nucleicos que contienen ciclohexeno. 30 Prioridad: 30.12.1999 US 173728 P 73 Titular/es: K.U. LEUVEN RESEARCH & DEVELOPMENT Benedenstraat 59A, Groot Begijnhof 3000 Leuven, BE 45 Fecha de publicación de la mención BOPI: 16.11.2006 72 Inventor/es: Wang, Jing y Herdewijn, Piet 45 Fecha de la publicación del folleto de la patente: 74 Agente: Aragonés Forner, Rafael Ángel ES 2 261 270 T3 16.11.2006 Aviso: En el plazo de nueve meses a contar desde la fecha de publicación en el Boletín europeo de patentes, de la mención de concesión de la patente europea, cualquier persona podrá oponerse ante la Oficina Europea de Patentes a la patente concedida. La oposición deberá formularse por escrito y estar motivada; sólo se considerará como formulada una vez que se haya realizado el pago de la tasa de oposición (art. 99.1 del Convenio sobre concesión de Patentes Europeas). Venta de fascículos: Oficina Española de Patentes y Marcas. Pº de la Castellana, 75 – 28071 Madrid ES 2 261 270 T3 DESCRIPCIÓN Ácidos nucleicos que contienen ciclohexeno. 5 Campo de la invención La presente solicitud se refiere a oligonucleótidos que contienen ciclohexeno. Se ha descubierto que dichos compuestos presentan resistencia a la nucleasa, activan la ribonucleasa H, e hibridan con el ARN o el ADN complementario. 10 Antecedentes de la invención 15 Se ha descubierto que la sustitución del anillo de furanosa de cinco elementos del ADN y el ARN natural por un anillo de seis elementos aumenta la rigidez conformacional de los oligómeros resultantes. Desde el punto de vista estructural, dichos oligómeros pueden dividirse en tres grupos: (1) aquellos con la región básica situada en la posición 1’ (ácidos nucleicos de piranosa); (2) aquellos con la región básica situada en la posición 2’ (ácidos nucleicos de hexitol); y (3) ácidos nucleicos que carecen de átomo de oxígeno en el anillo. Se ha descubierto que los oligómeros conocidos del primer tipo no hibridan con los ácidos nucleicos naturales, mientras que los de los otros dos tipos sí lo hacen. 20 Sumario de la invención 25 30 En un aspecto, la presente invención proporciona unos compuestos oligoméricos que comprenden una pluralidad de unidades de nucleósidos unidas mediante enlaces covalentes que individualmente comprenden una base nucleosídica y una región furanosilo o una región ciclohexenilo unida por enlace covalente a la base. Por lo menos una de las unidades de dichos compuestos comprende una base nucleosídica unida por enlace covalente a una región ciclohexenilo. Los compuestos preferidos según la invención son aquellos en los que las unidades nucleosídicas se encuentran unidas por enlace covalente de tal modo que las porciones básicas de las mismas forman una secuencia mixta de bases que resulta complementaria a la secuencia de bases del ARN o a la secuencia de bases del ADN. Las unidades nucleosídicas pueden comprender grupos sustituyentes (tales como los grupos hidroxilo y/o metoxi) en cualquiera de sus porciones básicas, sus regiones furanosilo y/o sus regiones ciclohexenilo. Las unidades pueden unirse entre sí mediante enlaces fosfodiéster, enlaces fosforotioato o cualquier variedad de enlaces internucleósidos conocidos en la técnica. 35 En otro aspecto, la presente invención proporciona métodos que implican poner en contacto un ser humano o cualquier otro mamífero con uno o más de los compuestos anteriormente mencionados. En determinadas formas de realización preferidas, el mamífero presenta o se sospecha que presenta una enfermedad asociada a una producción no deseada de una proteína, y se detecta por lo tanto una reducción real en la producción de una proteína. 40 La presente invención proporciona también una composición farmacéutica. Las composiciones preferidas comprenden uno de los compuestos de la invención junto con un excipiente o diluyente farmacéuticamente aceptable. Las composiciones de la invención pueden encontrarse, por ejemplo, en cualquier forma física (por ejemplo, líquido, comprimido, o polvo) conocida por los expertos en la materia. 45 En otro aspecto, la presente invención proporciona unos métodos que comprenden poner en contacto uno de los compuestos mencionados anteriormente con ARN o ADN. Dicho contacto puede realizarse in vitro o in vivo y preferentemente produce la hibridación del compuesto con el ARN o el ADN. Breve descripción de las figuras 50 La Figura 1 ilustra un esquema sintético de la unidad estructural de fosforamidita de la 9-[(1S,4R,5S)-5-hidroxi-4hidroximetil-2-ciclohexeneil]adenina. La Figura 2 ilustra una esfera conformacional del ciclohexeno disgregado. 55 La Figura 3 ilustra el equilibrio entre dos conformaciones de media silla de un nucleósido de ciclohexeno. La Figura 4 ilustra la estructura de unos nucleósidos modificados con una región básica de adenina: ciclohexenilo A (A1 ) y anhídrido de hexitol A (A2 ). 60 La Figura 5 ilustra las curvas de mezcla de UV del (A1 )13 y la dT13 realizadas a un pH de 7,5 en NaCl 0,1 M. La Figura 6 ilustra los espectros de dicroísmo circular (CD) del ADN bicatenario antes y después de la incorporación del A1 y el A2 en una de las cadenas de ADN. 65 La Figura 7 ilustra los espectros de CD de unos complejos de ADN y ARN antes y después de la incorporación del A1 y el A2 en una de las cadenas de ADN. 2 ES 2 261 270 T3 La Figura 8 ilustra los espectros CD del ARN bicatenario antes y después de la incorporación del A1 y el A2 en una de las cadenas de ADN. 5 La Figura 9 ilustra: (a) la secuencia del dodecámero de Dickerson modificado, que forma un híbrido simétrico; (b) región imino de los espectros 1D Watergate NOESY (espectrometría de efecto Overhauser nuclear) (período de 250 ms) del dodecámero modificado en un 90% de H2 O/10% de D2 O (KH2 PO4 10 mM, ácido edético 10 µM, a un pH de 7,5); y (c) región imino de los espectros bidimensionales Watergate NOESY (período de 250 ms) del dodecámero modificado en un 90% de H2 O/10% de D2 O (KH2 PO4 10 mM, ácido edético 10 µM, a un pH de 7,5). Las asignaciones y las conectividades (líneas continuas) se indican en relación con las resonancias imino. 10 15 20 25 La Figura 10 ilustra (a) la región protónica 1D H1’ y H5 del compuesto (I); (b) región (H8/H6H2) - H1’/H5 de la NOESY con un período de 250 ms del compuesto (I) a 20ºC en D2 O al 100%. Las conectividades secuenciales H8/H6(n) -H1’(n) -H8/H6(n+1) iniciándose a partir del extremo 5’ (Cl) (indicado con una flecha) se ilustran con líneas continuas (las resonancias a 7,42 y 7,61 ppm corresponden a A5H2 y A6H2 respectivamente); y (c) región H5-H6 de la DQF COSY (espectrometría de correlación con filtro cuántico doble) del compuesto (I) a 20ºC en D2 O al 100%. La Figura 11 ilustra el diagrama de conectividad entre las espectrometrías NOESY y COSY para las asignaciones secuenciales mediante los NOEs (efectos Overhauser nucleares) entre los protones de la base y los protones 2’C utilizando la NOESY con un período de mezcla de 50 ms y la DQF COSY representando la región de los picos cruce H1’ - H2’/H2”. En el espectro NOESY (a), los picos cruce sucesivos ds (2”; 6,8) y dj (6,8; 2’) se encuentran conectados mediante líneas verticales de trazos. En el espectro COSY (b), los picos cruce H1’ - H2’ y H1’ - H2” de cada nucleótido se conectan mediante líneas verticales de trazos. Las líneas horizontales conectan los picos cruce dj (6,8; 2’) con los picos cruce H1’ - H2’ del mismo nucleótido y los picos cruce H1 - H2” se conectan con los picos cruce ds (2”; 6,8). Al seguir las flechas, puede observarse la asignación secuencial desde C1 hasta G12. Las asignaciones específicas de secuencia desde los protones de la base y los protones H1’ se indican en la parte superior. Los picos cruce indicados con el asterisco representan los picos cruce H4’ - H5’/H6. La Figura 12 ilustra los híbridos quiméricos dobles utilizados para estudiar las actividades de la ribonucleasa H (M: 2’-OMe; r: ribo; d: desoxi). 30 35 40 La Figura 13 ilustra la hidrólisis en la que interviene la ribonucleasa H del oligonucleótido quimérico 2’-O-metil ARN-ARN. carril 1: ARN diana; carril 2: hidrólisis alcalina parcial (Na2 CO3 0,2 M, a 80ºC, período de 5 minutos) de ARN diana; carriles 3 a 5: actividad de la ribonucleasa H en relación con el híbrido de ADN y ARN (períodos de incubación 1 h, 3 h, 6 h); carriles 6 a 8: actividad de la ribonucleasa H en relación con el híbrido de CeNA (ácido nucleico de ciclohexeno) y ARN (períodos de incubación 1 h, 3 h, 6 h); carriles 9 a 11: actividad de la ribonucleasa H en relación con el híbrido de HNA (ácido nucleico de hexitol) y ARN (períodos de incubación 1 h, 3 h, 6 h). La Figura 14 ilustra la estabilidad de oligoadenilatos en suero (suero fetal de ternera al 50% en PBS) a 0, 5, 10, 30, 60 y 180 minutos de período de incubación a 37ºC. A. dA13 . B. oligonucleótido de (A1 )13 . C. oligonucleótido de (A2 )13 . La Figura 15 consiste en una tabla que ilustra la estabilidad térmica de los híbridos de ADN y ADN, y de ADN y ARN tras la incorporación del A1 y el A2 . 45 La Figura 16 consiste en una tabla que ilustra la influencia de la incorporación del A1 en la estabilidad de los híbridos de ARN y ADN, y de ARN y ARN. La Figura 17 consiste en una tabla que ilustra la estabilidad térmica del oligonucleótido de (A1 )13 completamente modificado con el ADN complementario y el ARN complementario. 50 La Figura 18 consiste en una tabla que ilustra los cambios químicos (ppm) del híbrido modificado (I) para los protones aromáticos y anoméricos comparados con los del híbrido de Dickerson (II). Descripción detallada de la invención 55 60 En los ácidos nucleicos de piranosa con la base del nucleótido en el centro anomérico, la base del nucleótido presenta una orientación ecuatorial tanto a nivel de monómero como a nivel de oligómero. Dichos oligómeros forman híbridos autocomplementarios fuertes en el caso de que se impida la hibridación por motivos estéricos. No hibridan con los ácidos nucleicos naturales. En los ácidos nucleicos de hexitol con una base en la posición 2, las nucleobases presentan una orientación axial a nivel de monómero así como a nivel de oligómero. Se observa hibridación autocomplementaria fuerte e hibridación con ácidos nucleicos naturales. La hibridación selectiva con el ARN se explica por las similitudes entre el anillo de hexitol y un anillo de furanosa congelado en su configuración 3’-endo. Los ácidos nucleicos de piranosa presentan una relación de tipo 1,3 entre la base del nucleótido y el grupo funcional hidroximetilo. Los nucleósidos basados en el hexitol presentan una relación de tipo 1,4 entre ambos grupos funcionales. 65 En los ácidos nucleicos de ciclohexano (CNA), se supone que la conformación del nucleósido es distinta cuando se analiza como monómero y tras la incorporación a un oligonucleótido. A nivel de monómero, la base del nucleótido presenta una orientación ecuatorial, mientras que a nivel de oligómero la base del nucleótido presenta una orientación 3 ES 2 261 270 T3 5 10 15 20 25 30 35 40 45 50 55 60 65 axial. Se prefiere la orientación axial en la hibridación del CNA con ácidos nucleicos naturales. Los ácidos nucleicos de ciclohexano ocupan una posición entre los otros grupos (piranosas y hexitoles). Un anillo de ciclohexano adopta normalmente una conformación en silla y la interconversión silla - silla se caracteriza por un límite de activación de ± 12 kcal/mol. La introducción de un doble enlace en el anillo del ciclohexano origina un anillo de ciclohexeno con una configuración de semisilla como mínimo global. En la Figura 2 se ilustra la esfera conformacional de un ciclohexeno disgregado. Las formas de silla se ubican en los polos. En el plano ecuatorial, se alternan las formas de bote y de bote torcido. El Trópico de Cáncer en el hemisferio norte y el Trópico de Capricornio en el hemisferio sur son las ubicaciones de la envoltura y las formas de semisilla. Las formas de semisilla se sitúan a θ = 52,7º; ∅2 = 210º y θ = 127,3º; ∅2 = 30º y se interconvierten pasando por las formas de bote, a lo largo de la elipse indicada. El límite energético de la interconversión semisilla - semisilla pasando por la forma de bote es de ± 5,5 kcal/mol. El sistema del ciclohexeno es mucho más flexible que el sistema de ciclohexano y resulta más próximo a la flexibilidad del anillo de furanosa. Cuando se comparan los dos extremos de las conformaciones en semisilla (3 H2 y 2 H3 ) puede llegarse a la conclusión de que el anillo de ciclohexeno en su forma 3 H2 constituye un buen mimético del anillo de furanosa en su conformación C3’-endo (Figura 3). Además, un anillo de ciclohexeno en su conformación 2 H3 puede considerarse como un buen mimético de una furanosa disgregada C2’endo. Hemos calculado que la diferencia energética entre ambas conformaciones (para un nucleósido de purina) es de aproximadamente 1,6 kJ/mol y que se prefiere la configuración en semisilla con la base en una posición pseudoaxial (3 H2 ). La baja diferencia energética entre ambos confórmeros puede explicarse por la estabilización de la forma 3 H2 mediante las interacciones π - σ*, mientras que la forma 2 H3 presenta una menor demanda estérica. Debido a dicho interesante equilibro se empezaron las investigaciones sobre la incorporación de nucleósidos de ciclohexeno en oligonucleótidos y se investigó: (a) si el nucleósido de ciclohexeno puede adoptar o no distintas conformaciones cuando se incorpora en una cadena de ADN o de ARN; (b) si el nucleósido de ciclohexeno puede estabilizar o no los híbridos de ADN y/o ARN; (c) si el CeNA es estable o no ante la degradación por parte de la nucleasa; y (d) si el híbrido de CeNA y ARN modificado es capaz o no de provocar la escisión de la cadena de ARN por parte de la ribonucleasa H. Esta última hipótesis se basa en el hecho de que la ribonucleasa H discrimina entre el ARN bicatenario y los híbridos de ARN y ADN, y reconoce el surco estrecho de los ácidos nucleicos de doble cadena. Resulta muy probable que la ribonucleasa H reconozca la estructura tridimensional de un híbrido de ARN y ADN mejor de que lo hace con un ARN de doble cadena. El surco estrecho del híbrido de ARN y ADN presenta unas menores dimensiones que el de los híbridos de forma A (ARN bicatenario) pero más ancho que el de los híbridos de forma B (ADN bicatenario). Debido a dichas menores dimensiones del surco estrecho, puede esperarse que la ribonucleasa H sea capaz de enlazarse a través del surco estrecho contactando simultáneamente con las cadenas de ARN y de ADN mientras que no pueden producirse interacciones próximas con un surco ancho tal como en la forma A del ARN bicatenario. El análisis conformacional en fase de solución demuestra que el híbrido de ADN y ARN presenta una estructura intermedia entre las típicas forma A y forma B, pero que se encuentra en conjunto más próxima a la forma A que a la forma B. Las partes ribosa de la cadena de ARN presentan una conformación N mientras que las partes de desoxirribosa de la cadena de ADN se apartan de la conformación S típica. Se ha observado que los glúcidos de la cadena de ADN en un híbrido de ADN y ARN pueden adoptar la conformación 04’-endo (P: 100 a 130º). Además, existe una flexibilidad mucho mayor en los híbridos de ADN y ARN que en los híbridos de ADN o los híbridos de ARN. Por lo tanto se puede plantear la hipótesis que el sistema de ciclohexeno flexible puede constituir un mimético excelente del anillo de furanosa natural, y que el híbrido de CeNA y ARN puede activar la ribonucleasa H. Para investigar las propiedades de los ácidos nucleicos que contiene ciclohexeno, primero se sintetizó el nucleósido de fosforamidita protegido con una región básica de adenina. La síntesis se inicia a partir de la R-(-)-carvona. La síntesis del nucleósido de ciclohexeno se expone de un modo general en Wang, et al., J. Org. Chem., 1999, 64, 7820 - 7827. La región de la base adenina se protegió con un grupo benzoílo y el grupo hidroxilo primario con un grupo monometoxitritilo (Figura 1). El grupo hidroxilo secundario se hace reaccionar con 2-cianoetil-N,N-diisopropilclorofosforamidita para producir la unidad estructural del nucleótido. El acoplamiento de los monómeros en oligonucleótidos se realizó de un modo general según Maurinsh, et al., P. Chem. Eur. J., 1999, 5, 2139 - 2150. Se recogió el excedente de amidita utilizada durante el acoplamiento, se hidrolizó a H-fosfonato tras lo que se escindió la región fosfonato tal como se describe de un modo general en Song, et al., Tetrahedron Lett., 1999, 40, 4153 - 4156, permitiendo la síntesis de un segundo grupo de amiditas. Ello permitió la síntesis a gran escala de los oligómeros para el estudio de los híbridos de Dickerson mediante RMN y de los oligómeros para los estudios de la ribonucleasa H. Como prueba de la incorporación correcta de la unidad estructural de ciclohexenilo, se realizó la desalinización de uno de los oligonucleótidos sintetizados [5’-d(CGC GAA1 TTC GCG-3’)] mediante perlas de intercambio de cationes y se analizó mediante espectrometría de masas. El espectro ESI-MS (espectrometría de masas por electroespray) presentó diversos picos que corresponden a múltiples iones cargados de la muestra en los estados de carga (M - 3H]3 - a [M - 6H]6− . El espectro desespiralizado, calculado mediante el Max Ent I Processing, indica que la masa monoisotópica experimental es de 3654,71 daltonios, confirmando la identidad del oligonucleótido (calculado: 3654,74 daltonios). Además, el análisis MS/MS del pico (M - 4H]4− a 912,68 daltonios permitió asignar diversos picos de fragmentos. A fin de analizar la influencia del nucleósido de ciclohexenilo en la estabilidad de las secuencias del ADN bicatenario, del híbrido de ADN y ARN, y del ARN bicatenario, se incorporaron nucleósidos de ciclohexenilo (Figura 4, A1 ) en una mezcla de purina, una secuencia de ADN pirimidínico (5’-CCAGTGATATGC-3’) y en la misma secuencia de ARN (5’-CCAGUGAUAUGC-3’). La influencia del nucleósido de ciclohexenilo en la estabilidad del híbrido se comparó con la del nucleósido de anhídrido de hexitol (Figura 4, A). En ambos casos se observó un ∆Tm/mod de 4 ES 2 261 270 T3 -0,5ºC, con independencia de si se incorporaron 1, 2 ó 3 nucleósidos modificados. Se encontró un descenso similar en la estabilidad tras la incorporación del anhídrido de hexitol A (A2 ). La influencia del A1 y el A2 en la estabilidad del híbrido de ADN bicatenario no parece ser significativamente distinta. 5 10 15 20 25 30 35 40 45 50 55 60 65 Probablemente resulta más interesante la influencia del ciclohexenilo A en la estabilidad del híbrido de ADN y ARN. La incorporación de 1, 2 ó 3 nucleósidos de ciclohexenilo A en la cadena de ADN incrementa la estabilidad del híbrido en +1,1ºC, +1,6ºC y + 5,2ºC respectivamente, lo que significa un ∆Tm/mod de +1,1ºC, +0,8ºC y +1,7ºC. Tal como era de esperar, la influencia en la estabilidad del híbrido depende de la zona de incorporación del A1 . El efecto estabilizador del A2 sobre el híbrido de ADN y ARN es del doble que el A1 , y el efecto selectivo de la secuencia es el mismo. Cuando se incorpora ciclohexenilo A en la cadena de ARN de un híbrido de ADN y ARN, se observa un ∆Tm/mod de -0,5ºC (Figura 16). Sin embargo, se ha de resaltar que la diferencia en la estabilidad del complejo de ADN y ARN y del complejo de ARN y ADN es de 5ºC. La incorporación de tres residuos de A1 en una secuencia de ARN bicatenario produce un incremento en la estabilidad del híbrido de + 0,6ºC. El incremento de la estabilidad del híbrido tras la incorporación del A1 , utilizando ARN como cadena complementaria, sugiere que la conformación del A1 en el híbrido ha de encontrarse relacionada con la conformación 3’-endo del glúcido ribofuranosa. La conformación 3 H2 del A1 resulta de hecho la conformación más estable del ciclohexenilo A y la preorganización conformacional puede ser la base de dicha estabilización del híbrido. Se comparó la estabilidad de los complejos formados entre un oligoadenilato de ciclohexenilo o un oligoadenilato de anhídrido de hexitol y una poli(dT) o un poli(U) (Figura 17). El complejo formado entre el oligoadenilato de ciclohexenilo y el poli(U) presenta una estabilidad similar que el formado entre el oligoadenilato del anhídrido de hexitol y el poli(U). Sin embargo, resulta interesante observar que el complejo formado entre oligoadenilato de ciclohexenilo y poli (dT) es mucho más estable (∆Tm: +10ºC) que el correspondiente complejo formado entre el oligoadenilato del anhídrido de hexitol y la poli(dT). La naturaleza del complejo formado entre el oligoadenilato del ciclohexenilo y la poli(dT) se determinó mediante un experimento de valoración (Figura 5) y se descubrió también un origen triple [(dT) 13-(dT)13-(DT)13]. El complejo formado entre el oligoadenilato del ciclohexenilo y su ADN (poli(dT) o ARN (poli (U) complementario presenta una estabilidad similar. Dichos resultados pueden indicar que las moléculas de CeNA son flexibles y que los nucleótidos de ciclohexeno pueden acomodarse en distintos tipos de complejos. Se utilizó el análisis espectral de dicroísmo circular (CD) para determinar si la incorporación del ciclohexenilo A presenta una influencia significativa en la conformación en la estructura de doble hélice. Se realizó una comparación entre los espectros de los híbridos que contenían tres residuos de A1 , los híbridos naturales de referencia y los mismos complejos con tres residuos A2 incorporados. Se demostró que los oligonucleótidos de (A1 ) y los oligonucleótido de (dT) forman un complejo en una proporción de 1:2. El espectro de CD de las otras secuencias de ADN bicatenario (Figura 6) se caracterizan por el efecto Cotton positivo a 264 nm y el efecto Cotton negativo a 241 nm. Tras la incorporación de tres residuos A1 (A1 - ADN/ADN), el espectro es similar pero no es el mismo. La banda de CD positiva a 264 nm es más intensa mientras que la banda de CD negativa a 238 nm es menos intensa. Dicha tendencia continúa cuando se incorporan tres residuos A2 (A2 - ADN/ADN). La señal negativa a 238 nm se vuelve más débil a medida que aumenta la intensidad de la banda a 264 nm. El espectro del complejo A2 - ADN/ADN se vuelve más similar al híbrido de ADN y ARN mientras que el espectro del complejo A1 - ADN/ARN se encuentra en una posición intermedia entre la del híbrido de ADN y ARN, y el híbrido de ARN y ADN. Ello constituye el primer indicio de que las estructuras del complejo A1 - ADN/ADN y el complejo A2 - ADN/ADN son distintas. El espectro de CD de los complejos ARN/A1 = ADN; ARN/A2 -ADN; ADN/ARN; ARN/ADN y ADN/A1 -ARN resultan muy similares (Figura 7). Se observa una banda de CD positiva intensa alrededor de los 260 nm mientras que no se encuentran presentes señales negativas (o bandas de intensidad muy baja) en las proximidades. La intensidad de la banda positiva disminuye en el orden dado. Todos los complejos parecen poseer la misma forma geométrica general. Lo mismo puede decirse de los espectros del ARN bicatenario y los complejos ARN/A1 - ARN (Figura 8), a pesar de que la banda positiva de algún modo se desplaza a una longitud de onda más corta. El análisis espectral de CD demuestra una conformación similar para todos los complejos que contienen ARN. Tres residuos A2 incorporados a una cadena de ADN parecen provocar un cambio conformacional de un híbrido de ADN bicatenario en la dirección de una estructura del tipo ADN/ARN. Tres residuos A1 no parecen provocar dicho efecto y la conformación ADN/A1 -ADN permanece próxima a la forma típica del ADN bicatenario. Ello puede explicarse por una distinta conformación del ciclohexenilo A en el ADN bicatenario y en el híbrido de ADN y ARN. Los cambios en la conformación (inversión de la silla) del A2 significan un gasto muy elevado de energía, mientras que se espera que el A1 experimente más fácilmente la inversión de su conformación en semisilla. A fin de estudiar el efecto de la incorporación del ciclohexenilo A sobre la conformación del híbrido de ADN en más detalle se incorporó un residuo de D-ciclohexenilo A (A1 ) en el muy conocido dodecámero de Dickerson autocomplementario, 5’-d[CGCGAA1 TTCGCG]2 -3’ (I), y se investigó la conformación del estado de la disolución mediante RMN. Bajo las condiciones experimentales adecuadas (oligómero 1,4 mM, KH2 PO4 10 mM, ácido edético 10 µM, a un pH de 7.5 en 90% de H2 O/10% de D2 O), los protones imino de la guanina y la timina provocaron unos picos en la RNM en el intervalo de 12 a 14 ppm en el espectro ID Watergate (Figura 8b). En un espectro bidimensional Watergate NOESY 17 (Figura 8c) los picos diagonales corresponden con los protones imino del espectro ID (Figura 8b). Cada uno de los pares de bases unidas por enlaces puente de hidrógeno de tipo Watson y Crick G-C y AT presenta un protón implicado en el enlace puente de hidrógeno. No se observa la resonancia del G-imino terminal debido al desenrollamiento. Los protones imino de los pares de bases vecinos en una región helicoidal de pares de bases se encuentran suficientemente próximos para proporcionar picos cruce de NOE en un espectro bidimensional y en la Figura 8c, los picos cruce NOE imino - imino entre los pares de bases próximos aparecen muy claros. La 5 ES 2 261 270 T3 5 10 15 20 25 30 35 40 45 50 55 60 65 conectividad NOE aparece en el espectro bidimensional (Figura 8c) y las asignaciones de los protones imino secuenciales corresponden a un híbrido simétrico (Figura 8a). Los NOEs para la adenina H2 (AH2) de los pares de bases AT para el protón imino de su propia T y para los protones iminos de los pares de bases próximas demuestran además la presencia de un híbrido. Las asignaciones de los protones no intercambiables se basan en un análisis de los datos de la NOESY del espacio, de la COSY de los enlaces, la TOCSY (espectrometría de correlación total) y la HETCOR (correlación heteronuclear) 1 H-31 P utilizando procedimientos bien descritos para los híbridos de ADN. La Figura 9b ilustra un fragmento de un espectro NOESY (250 ms) del híbrido (I) a 20ºC en D2 O mostrando los picos cruce entre los protones de la base (H6 en las pirimidinas o H8/H2 en las purinas) y los protones anoméricos y los protones H5 de la pirimidina que se utilizaron para asignar los protones de la base (H8/H6/H2) y los protones H1’ de modo secuencial. El recorrido secuencial se vio interrumpido por la ausencia del pico cruce A6H1’ - T7H6. La Figura 18 contiene los desplazamientos químicos de los protones aromáticos y los protones H1’ del híbrido modificado (I) a 20ºC y 25ºC y del híbrido sin modificar (II) 5’-d[CGCGAATTCGCG]2-3. Los desplazamientos químicos constituyen la indicación de cambios estructurales asociados a la introducción de nucleótidos modificados. La Figura 18, sin embargo, muestra unos cambios insignificantes en el desplazamiento químico (máxima diferencia de 0,1 ppm) para todos los demás residuos implicando que el A1 no altera la estructura B del híbrido. Los cambios se limitan al propio nucleótido modificado. La Figura 11 ilustra el diagrama de conectividad NOESY COSY para las asignaciones secuenciales mediante un espectro NOESY (50 ms) entre los protones de la base y los protones 2’C utilizando la NOESY con un período de mezcla de 50 ms y un espectro DQF COSY que contiene los picos cruce entre 1’H y 2’-CH2. Las observaciones de que (i) la mayoría de los protones H2” presentan un desplazamiento a campo más bajo en el desplazamiento químico que los protones H2’; (ii) los intrarresiduos e interresiduos NOES entre H8/H6, y H2’ y H2” respectivamente resultan más intensos que el intrarresiduo NOES entre H8/H6 y H2”; y (iii) los picos cruce H1’ - H2’, H1 - H2” presentan unos multipletes sensitivos de fase del tipo B, confirman asimismo la existencia de una estructura de ADN de tipo B regular. Sin embargo, el espectro NOESY (Figura 9b) y el espectro DQF COSY (Figura 9c), representando la región de picos cruce entre los protones de la base (H6/H8) y los protones anoméricos (H1’) y entre los protones H5 y H6 de los residuos pirimidínicos y la región del protón H1’/H5 del espectro ID (Figura 9a) demuestra la presencia de picos cruce protónicos amplios y de resonancias múltiples (algunas de las cuales se destacan con un recuadro gris en la Figura 9b), sugiriendo la presencia de múltiples especies. No se observa que los picos se vuelvan más agudos al variar la temperatura dentro del intervalo de 25 a 40ºC o al cambiar la concentración salina. La existencia de más de una estructura dificulta la determinación de una estructura altamente refinada utilizando los procedimientos de RMN. Otra característica notable de dicho híbrido (I) es la ausencia total de picos cruce H1’-H2’/H2”; H3-H2’/H2” y H’3H4’ (Figura 10b) y la presencia únicamente de los picos cruce H4’-H6’ y H4’-H5’ muy débiles (indicados con un asterisco en la Figura 10b) para el residuo ciclohexenilo A en los espectros de DQF COSY y TOCSY. Los picos cruce A6H8-H2’/H2” de la NOESY también resultan muy débiles. Los picos probablemente son demasiado amplios para ser detectados. En conclusión, la incorporación del residuo ciclohexenilo A (A1 ) no produce prácticamente efecto alguno en la estructura global del dodecámero de Dickerson y los cambios se ponen de manifiesto por sí mismos únicamente en el 6º residuo modificado (A1 ). Sin embargo, el ensanchamiento de la línea y las resonancias múltiples sugieren que el residuo ciclohexenilo A (A1 ) provoca una movilidad conformacional que impide el análisis estructural detallado. Para analizar la susceptibilidad de la ribonucleasa H al híbrido CeNA/ARN se utilizó un enfoque de doble recombinación (Figura 12). Se sintetizó un oligonucleótido híbrido de 2’-O-metil ARN y ARN que es complementario al oligonucleótido híbrido ADN-CeNA (Figura 12, II). No se puede utilizar un oligonucleótido de ARN completo como complementario del híbrido ADN - CeNA debido a que puede producirse la escisión de la cadena fuera de la región CeNA/ARN. Se ha observado que los híbridos de 2’-O-metil ARN y ADN no constituyen sustratos para la ribonucleasa H y que los oligonucleótidos híbridos parcialmente modificados que contienen zonas incompletas desoxi de 5 residuos o más activan la ribonucleasa H in vitro, a pesar de que lo hace de un modo menos eficaz que el desoxinucleótido uniforme original. Además, las variaciones específicas de secuencia en la estructura de los híbridos de ADN y ARN afectan la anchura de los surcos y la susceptibilidad de escisión por parte de la ribonucleasa H. Se ha observado por ejemplo que los híbridos de segmentos locales de polipurina - ARN/ADN son resistentes a la escisión por parte de la actividad como ribonucleasa H de la transcriptasa inversa. También se ha observado experimentalmente que los complejos oligoadenilato-poli(rU) [(dA) 13:poli(rU)] constituyen un mal sustrato para la ribonucleasa H de la E. coli. Se utilizó como control positivo un híbrido quimérico oligonucleótido de (rU)/oligonucleótido de (dA) (Figura 12, 1) para estudiar la escisión de la cadena de rU por parte de la ribonucleasa H, y se utilizó como control negativo el híbrido doble quimérico tal como se ha descrito en el caso del oligómero de CeNA (HNA sustituyendo el CeNA) (Figura 12, III). Se utilizó el enzima de la E. coli en el estudio de la susceptibilidad de los híbridos para ser escindidos por la ribonucleasa H debido a que dicho enzima se obtiene con facilidad y sus propiedades de escisión no resultan muy distintas del enzima en los mamíferos. La Figura 13 ilustra la pauta de escisión de tres complejos (Figura 12, I - III) tras la incubación durante 1 h, 3 h y 6 h con la ribonucleasa H de la E. coli. El complejo I se degrada con rapidez, mientras que el complejo que contiene HNA formado entre el oligómero de ciclohexenilo y su ARN complementario constituye un sustrato eficaz para la ribonucleasa H. Se observaron dos zonas de escisión en la cadena de ARN del complejo II, una de ellas entre (U)7 y (U)8 y la otra entre (U)9 y (U)10 . Se ha de señalar que la pauta de escisión en una secuencia de oligonucleótido de (rU) depende de la modificación de los glúcidos del tramo de adeninas complementarias. De hecho, el complejo I (Figura 12) no únicamente se degrada de algún modo más rápidamente, sino que se produce la escisión preferentemente entre 6 ES 2 261 270 T3 (U)8 y (U)9 y entre (U)9 y (U)10 . El desplazamiento del A2 por el más móvil desde el punto de vista conformacional A1 provoca una gran diferencia en la susceptibilidad de escisión. 5 10 15 20 25 30 35 La estabilidad del oligonucleótido modificado se analizó asimismo en suero (Figura 14). Dicho experimento demuestra que el CeNA presenta una estabilidad en suero similar al HNA. Ambos oligonucleótidos modificados resultan mucho más estables ante la degradación enzimática (no se produce degradación tras la incubación durante 3 h en suero a 37ºC) que el ADN (prácticamente se degrada la mitad tras 3 h de incubación). El CeNA combina la interesante característica de la estabilidad en suero y las propiedades para provocar la acción de la ribonucleasa H. Un oligonucleótido ideal de la cadena antisentido es aquél que hibrida fuertemente con su ARN complementario y que resulta capaz de provocar que la ribonucleasa H escinda su objetivo. La hibridación fuerte de ácidos nucleicos cargados con el ARN significa una preorganización en forma de híbrido de tipo A para un apilamiento máximo entre cadenas. Se ha observado la estabilización de híbridos con diversos oligonucleótidos modificados en sus hidratos de carbono. A partir de dicha investigación puede llegarse a la conclusión de que cuanto más se preorganiza la unidad estructural del nucleósido en un confórmero de furanosa de tipo N, mayor resulta la estabilidad del híbrido formado entre el oligómero modificado y su ARN complementario. Sin embargo, la anchura del surco menor de los híbridos estables de tipo A resulta demasiado grande para un reconocimiento eficaz por parte de la ribonucleasa H. Parece por lo tanto que un compromiso entre ambos es la mejor solución y que un pequeño incremento en la estabilización del híbrido (basándose en la preorganización de la conformación de por ejemplo un O4’-endo) puede ser compatible con la activación de la ribonucleasa H. La ribonucleasa H se ve activada por los híbridos de ARN y ADN en los que la cadena de ADN presenta oligonucleótidos de fosfodiéster o de fosforotioato. Estos últimos oligómeros presentan un enlace “fosfato” modificado entre nucleósidos. Por lo que se conoce, los únicos oligonucleótidos con los glúcidos modificados que activan la ribonucleasa H (E. coli) son los ácidos arabinonucleicos con un 2’-hidroxilo o un 2’fluoro como sustituto. Los ácidos oligonucleótido - arabinonucleico (2’-OH) desestabilizan el híbrido de ARN Y ADN considerablemente y no presentan ventaja alguna sobre los oligonucleótidos de fosforotioato. Los ácidos nucleicos de ciclohexeno de la invención, cuando se incorporan en una secuencia de ADN, aumentan la estabilidad del híbrido formado entre dicho ADN y su ARN complementario. En la secuencia estudiada, la media de los ∆Tm/mod es de + 1,2ºC. Se analizó la capacidad del nucleótido de ciclohexeno para experimentar cambios conformacionales cuando se incorpora en un oligonucleótido a tres niveles distintos. El complejo que se forma entre el CeNA (oligonucleótido de A) y el ADN (oligonucleótido de dT) presenta un origen helicoidal triple y tiene una estabilidad similar a la del complejo que se forma entre el CeNA (oligonucleótido de A) y el ARN (oligonucleótido de rU) (que no es el caso del HNA/ADN y el HAN/ARN). Segundo, el espectro de CD de un híbrido de A1 y ADN/ADN es similar al espectro del ADN bicatenario (que no es el caso del híbrido de A2 y ADN/ADN). El espectro de CD de un complejo ARN/A1 - ADN es similar al espectro del complejo ARN/ADN y el espectro de CD de un complejo ARN/A1 - ARN y del ARN bicatenario resultan idénticos. Dichos resultados indican que un nucleótido de ciclohexeno puede acomodarse con facilidad a distintas estructuras de ácidos nucleicos. La relación estructural entre el A1 y un nucleósido natural de furanosa puede resultar fundamental para dichas propiedades. Tercero, el análisis por RMN de un dodecámero de Dickerson que contiene A1 sugiere la movilidad conformacional del dicho residuo. 40 45 50 55 60 65 El ácido nucleico de ciclohexeno cuando hibrida con el ARN puede también activar la ribonucleasa H. Contrariamente, el híbrido de HNA y ARN no se degrada. Puede esperarse que la anchura del surco menor del híbrido de CeNA y ARN sea comparable al de un híbrido de ADN y ARN (9A) y que la ribonucleasa H pueda unirse eficazmente con el complejo del ARN bicatenario con una anchura del surco menor de 11A que no se degrade en absoluto. Los híbridos de CeNA y ARN resultan más estables térmicamente que los homólogos naturales y el CeNA es estable ante la degradación en suero. Por lo tanto, puede considerarse el CeNA como un nuevo oligonucleótido que combina la ventaja de la estabilización de los híbridos con el potencial para activar la ribonucleasa H, lo que significa que dichos oligómeros constituyen los principales candidatos para analizar como constructos antisentido en un sistema celular. Se conoce en la técnica que un nucleósido normalmente comprende una base y un glúcido unidos por un enlace covalente. La región básica del nucleósido consiste normalmente en una base heterocíclica. Los dos tipos más comunes de dichas bases heterocíclicas son las purinas y las pirimidinas. En los nucleósidos que comprenden un glúcido pentofuranosilo, el grupo fosfato puede unirse a las regiones hidroxilo 2’, 3’ ó 5’ de dicho glúcido. Al formar los oligonucleótidos, los grupos fosfato unen los nucleósidos adyacentes entre sí mediante un enlace covalente formando de este modo un compuesto polimérico lineal. Los extremos respectivos de dicha estructura polimérica lineal pueden formar estructuras lineales abiertas o pueden unirse para formar una estructura circular. En la estructura del oligonucleótido, habitualmente se hace referencia a los grupos fosfato como formadores del “esqueleto” interglucídico de los oligonucleótidos. Los enlaces normales del esqueleto del ARN y del ADN consisten en un enlace fosfodiéster 3’ → 5’. El esqueleto de un oligonucleótido (u otro compuesto antisentido) dispone una serie de bases en un orden específico, encontrándose la representación escrita de dicha serie ordenada de bases en el sentido 5’ → 3’ excepto cuando se indica lo contrario, conociéndose dicho orden como secuencia de nucleótidos o secuencia de bases de los nucleótidos. Los oligonucleótidos pueden comprender secuencias de nucleótidos suficientes en identidad y número para efectuar una hibridación específica con un ácido nucleico particular. Dichos oligonucleótidos que hibridan específicamente con una región de la cadena homosentido de un gen se describen normalmente como “antisentido”. En el contexto de la invención, “hibridación” significa el establecimiento de enlaces puente de hidrógeno, que pueden ser del tipo Watson 7 ES 2 261 270 T3 5 10 15 20 25 30 35 40 45 50 55 60 65 y Crick, Hoogsteen o Hoogsteen inverso, entre los nucleótidos complementarios. Por ejemplo, la adenina y la timina constituyen un par de nucleobases complementarias mediante la formación de enlaces puente de hidrógeno. “Complementario”, tal como se utiliza en la presente memoria, se refiere a la capacidad para realizar el apareamiento preciso entre dos nucleótidos. Por ejemplo, si un nucleótido en una posición determinada de un oligonucleótido puede realizar un enlace puente de hidrógeno con un nucleótido de la misma posición de una molécula de ADN o de ARN, se considera que el oligonucleótido y el ADN o el ARN son complementarios entre sí en aquella posición. El oligonucleótido y el ADN o ARN resultan complementarios entre sí cuando un número suficiente de posiciones correspondientes de cada molécula se encuentran ocupadas por nucleótidos que pueden establecer enlaces puente de hidrógeno entre sí. Los términos “hibrida específicamente” y “complementario” son por lo tanto términos que se utilizan para indicar un grado suficiente de complementariedad o apareamiento preciso de modo que se producen enlaces específicos y estables entre el oligonucleótido y el ADN o ARN diana. Un oligonucleótido hibrida específicamente con su secuencia diana debido a la formación de pares de bases entre nucleobases asociadas en el interior de un híbrido de ácido nucleico. Entre las nucleobases naturales, la guanina (G) enlaza con la citosina (C), y la adenina (A) enlaza con la timina (T) o el uracilo (U). A parte de la equivalencia entre el U (ARN) y la T (ADN) como asociados a la A, se conocen otras nucleobases naturales equivalentes, comprendiendo la 5-metilcitosina y la 5-hidroximetilcitosina (HMC) (equivalentes a la C), y el 5-hidroximetiluracilo (equivalente al U). Además, se conocen en la técnica nucleobases sintéticas que conservan la especificidad hacia su asociado y comprenden, por ejemplo, la 7-deazaguanina, que conserva la especificidad hacia su asociado, la C. De este modo, la capacidad de un oligonucleótido para hibridar específicamente con su secuencia diana no se verá alterada por una modificación química de una nucleobase de la secuencia de nucleótidos del oligonucleótido que no altere su especificidad hacia su nucleobase asociada del ácido nucleico diana. Se conoce en la técnica que la secuencia de nucleobase de un oligonucleótido u otro compuesto antisentido no ha de ser complementaria al 100% con la secuencia del ácido nucleico diana para poder hibridar específicamente. Un compuesto antisentido hibrida específicamente con su ácido nucleico diana cuando existe un grado suficiente de complementariedad para evitar un enlace no específico del oligonucleótido con secuencias no diana bajo condiciones en las que se pretenden enlaces específicos, es decir, bajo condiciones fisiológicas en el caso de los análisis in vivo o de tratamiento terapéutico, o en el caso de análisis in vitro, bajo las condiciones del análisis. Los oligonucleótidos antisentido se utilizan habitualmente como reactivos en investigación, como ayuda en el diagnóstico y como agentes terapéuticos. Por ejemplo, los oligonucleótidos antisentido, que pueden inhibir la expresión genética con una gran especificidad, con frecuencia son utilizados por los expertos en la materia para determinar la función de genes particulares, por ejemplo, para distinguir entre las funciones de distintos elementos de una vía metabólica. Dicho efecto inhibidor específico, por lo tanto, ha sido utilizado por parte de los expertos en la materia en sus investigaciones. La especificidad y la sensibilidad de los oligonucleótidos se han aprovechado también por los expertos en la materia para utilizarlos con fines terapéuticos. La presente invención proporciona unas composiciones terapéuticas y farmacéuticas que comprenden ácidos nucleicos de ciclohexeno. Las composiciones para la administración de los ácidos nucleicos de ciclohexeno de la invención pueden comprender disoluciones acuosas estériles que pueden contener también disoluciones amortiguadoras del pH, diluyentes y otros excipientes adecuados. Las composiciones farmacéuticas de la invención, que pueden presentarse convenientemente en forma de dosis unitarias, pueden prepararse según técnicas convencionales bien conocidas en la industria farmacéutica. Dichas técnicas comprenden la etapa de asociar el/los principio(s) activo(s) con los excipientes farmacéuticamente aceptables. En general, las composiciones farmacéuticas se preparan asociando uniformemente e íntimamente el/los principio(s) activo(s) con excipientes líquidos o excipientes sólidos divididos finamente o ambos, y a continuación, si resulta necesario, dando forma al producto. Las composiciones farmacéuticas y terapéuticas que comprenden uno o más de los compuestos antisentido de la invención pueden comprender además disoluciones acuosas estériles que pueden contener también disoluciones amortiguadoras del pH, diluyentes y otros excipientes adecuados. Pueden utilizarse sustancias adecuadas que no reaccionen deteriorándose con los compuestos antisentido como excipientes orgánicos o inorgánicos farmacéuticamente aceptables para la administración no parenteral. Las composiciones farmacéuticas pueden esterilizarse y, si se desea de este modo, mezclarse con agentes auxiliares, por ejemplo, lubricantes, conservante, estabilizantes, agentes humectantes, emulsionantes, sales que afectan la presión osmótica, sustancias amortiguadoras del pH, colorantes, aromatizantes y/o sustancias aromáticas y similares que no reaccionan con el/los oligonucleótido(s) de la composición farmacéutica deteriorando el producto. Las composiciones farmacéuticas en forma de suspensiones acuosas pueden contener sustancias que aumenten la viscosidad de la suspensión comprendiendo, por ejemplo, carmelosa sódica, sorbitol y/o dextrano. Opcionalmente, dichas composiciones pueden contener uno o más estabilizantes, compuestos excipientes o excipientes farmacéuticamente aceptables. Tal como se utiliza en la presente memoria, “compuesto excipiente” se refiere a un compuesto que es inerte (es decir, no posee actividad biológica alguna por sí mismo) pero es reconocido por procesos in vivo que disminuyen la biodisponibilidad del principio bioactivo, por ejemplo al degradar el principio bioactivo o provocar su eliminación del torrente circulatorio. La administración conjunta de un principio bioactivo y un compuesto excipiente, normalmente con un excedente de esta última sustancia, puede provocar una reducción sustancial de la cantidad del principio bioactivo recuperado en el hígado, los riñones u otros depósitos extracirculatorios, se supone que debido a la competición 8 ES 2 261 270 T3 5 10 15 20 25 30 35 40 entre el compuesto excipiente y el principio bioactivo para un receptor común. Por ejemplo, la recuperación de un oligonucleótido parcialmente fosforotioado en el tejido hepático disminuye cuando se administra conjuntamente con el ácido poliinosínico, el sulfato de dextrano, el ácido policitídico o el ácido 4-acetamido-4’-isotiociano-estilbeno2,2’-disulfónico (Miyao et al., Antisense Res. Dev., 1995, 5, 115; Takakura et al., Antisense & Nucl. Acid Drug Dev., 1996, 6, 177). En contraste a un compuesto excipiente, un “excipiente farmacéuticamente aceptable” (excipiente propiamente dicho) es un disolvente, un agente de suspensión o cualquier otro vehículo farmacológicamente inerte farmacéuticamente aceptable destinado a la administración de uno o más principios bioactivos a un animal. El excipiente farmacéuticamente aceptable puede ser líquido o sólido y se selecciona considerando el modo de administración planificado de modo que se proporcione la masa, consistencia, etc., deseadas cuando se combina con un ácido nucleico y los otros componentes de una composición farmacéutica. Los excipientes farmacéuticamente aceptables comprende, pero no se limitan a ellos, aglutinantes (por ejemplo almidón pregelatinizado, povidona, hipromelosa, etc.); sustancias con función de relleno (por ejemplo, lactosa y otros glúcidos, celulosa microcristalina, pectina, gelatina, sulfato cálcico, etilcelulosa, poliacrilatos o hidrofosfato cálcico, etc.); lubricantes (por ejemplo, estearato magnésico, talco, sílice, dióxido de silicio coloidal, ácido esteárico, estearatos metálicos, aceites vegetales hidrogenados, almidón de maíz, polietilenglicoles, benzoato sódico, acetato sódico, etc.); disgregantes (por ejemplo, almidón, glicolato sódico de almidón, etc.); o agentes humectantes (por ejemplo, laurilsulfato sódico, etc.). Los excipientes farmacéuticamente aceptables comprenden, pero no se limitan a ellos, agua, disoluciones salinas, alcohol, polietilenglicoles, gelatina, lactosa, amilosa, estearato magnésico, talco, ácido silícico, hidroximetilcelulosa, parafina viscosa de povidona y similares. Las composiciones de la presente invención pueden contener además otros componentes adjuntos que se encuentran en composiciones farmacéuticas convencionales, en unas concentraciones de utilización tal como se establece en la técnica. De este modo, por ejemplo, las composiciones pueden contener materiales farmacéuticamente activos compatibles adicionales tales como, por ejemplo, antirpuriginosos, astringentes, anestésicos locales o antiinflamatorios, o pueden contener materiales adicionales útiles en la formulación física de diversas formas farmacéuticas de composición de la presente invención, tales como tintes, aromatizantes, conservantes, antioxidantes, opacificantes, espesantes y estabilizantes. Sin embargo, cuando se añaden, no han de interferir excesivamente con las actividades biológicas de los componentes de las composiciones de la invención. Se supone que la administración de las composiciones terapéuticas o farmacológicas que comprenden el ácido nucleico de ciclohexeno de la invención forma parte de la capacidad de los expertos en la materia. En general, a un paciente que necesite tratamiento o profilaxis se le administra una composición que comprende un ácido nucleico de ciclohexeno según la invención, habitualmente en un excipiente farmacéuticamente aceptable, en unas dosis comprendidas entre 0,01 µg y 100 g por kg de peso corporal en función de la edad del paciente y de la gravedad del trastorno o de las condiciones patológicas a tratar. La dosificación depende de la gravedad y la respuesta de las condiciones patológicas a tratar, durando el ciclo de tratamiento desde varios días a varios meses, o hasta que se consigue la curación o se alcanza una disminución o prevención de las condiciones patológicas. Las pautas posológicas óptimas pueden calcularse a partir de las determinaciones de la acumulación del fármaco en el cuerpo del paciente. Los expertos en la materia pueden determinar fácilmente las dosificaciones óptimas, las metodologías de dosificación y la frecuencia de repetición. Las dosificaciones óptimas pueden variar en función de la potencia relativa de los compuestos antisentido individuales, y pueden estimarse de un modo general basándose en la CE50 (concentración efectiva media) que se ha demostrado que resulta eficaz en modelos animales in vitro e in vivo. 45 50 En el contexto de la invención, el término “régimen de tratamiento” abarca las modalidades de administración terapéutica, paliativa y profiláctica de una o más composiciones farmacéuticas de la invención. Un régimen de tratamiento particular puede durar un período de tiempo que variará en función de la naturaleza de la enfermedad o trastorno particular, su gravedad y la condición general del paciente, y puede prolongarse desde una vez al día hasta una vez cada 20 años. Tras el tratamiento, se realiza el seguimiento del paciente en relación con su cuadro clínico y en relación con el alivio de los síntomas del trastorno o de las condiciones patológicas. La dosificación de la composición farmacéutica puede incrementarse en el caso de que el paciente no responda significativamente a los niveles de dosificación actuales, o bien puede disminuirse si se observa un alivio de los síntomas del trastorno o de las condiciones patológicas, o si ha terminado el trastorno o las condiciones patológicas. 55 60 65 Una pauta posológica óptima se utiliza para administrar una cantidad terapéuticamente eficaz de la composición farmacéutica de la invención mediante un modo particular de administración. El término “cantidad terapéuticamente eficaz”, para los propósitos de la invención, se refiere a la cantidad de la composición farmacéutica que contiene el oligonucleótido que resulta eficaz para alcanzar el propósito que se pretende sin efectos secundarios indeseados (tales como toxicidad, irritación o una respuesta alérgica). A pesar de que las necesidades individuales pueden variar, la determinación de los intervalos óptimos de las cantidades eficaces de las composiciones farmacéuticas resulta propia de la técnica. Las dosificaciones humanas pueden extrapolarse a partir de los estudios realizados con animales (Katocs et al., capítulo 27 en: Remington’s Pharmaceutical Sciences (“Ciencias Farmacéuticas de Remington”), 18º Ed., Gennaro, ed., Mack Publishing Co., Easton, PA, 1990). Generalmente, un experto en la materia puede ajustar la dosis requerida para proporcionar una cantidad eficaz de la composición farmacéutica, y variará en función de la edad, la salud, las condiciones físicas, el peso, el tipo y el alcance de la enfermedad o trastorno del receptor, la frecuencia de tratamiento, la naturaleza del tratamiento actual (si hay alguno), y la naturaleza y el alcance del/de los efecto(s) deseado(s) (Nics et al., capítulo 3 en: Goodman & Gilman’s The Pharmacological Basis of Therapeutics (“Las bases 9 ES 2 261 270 T3 farmacológicas del tratamiento de Goodman & Gilman”), 9ª ed., Hardman et al., ed., McGraw-Hill. New York, NY, 1996). 5 10 15 20 25 30 35 40 45 50 55 60 65 Tras un tratamiento satisfactorio, puede ser aconsejable someter al paciente a un tratamiento de mantenimiento para evitar que vuelvan a presentarse las condiciones patológicas, en el que la composición farmacéutica se administra en dosis de mantenimiento, que varían desde 0,01 µg hasta 100 g por kg de peso corporal, una o más veces al día hasta una vez cada 20 años. Por ejemplo, en el caso de un paciente del que se conoce o se supone que es propenso a trastornos autoinmunitarios o inflamatorios, pueden conseguirse unos efectos profilácticos mediante la administración de dosis preventivas, una o más veces al día hasta una vez cada 20 años. De este modo, un paciente puede hacerse menos susceptible a un trastorno inflamatorio que se espera que tenga lugar como resultado de algún tratamiento médico, por ejemplo, el rechazo de un injerto en el caso de un trasplante celular, tisular o de un órgano a un paciente. La presente invención abarca también las modalidades profilácticas para los pacientes con un riesgo elevado. Tal como se utiliza en la presente memoria, el término “paciente con un riesgo elevado” se refiere a un paciente del que se ha determinado mediante, por ejemplo, los antecedentes personales o familiares o mediante un análisis genético, que existe una probabilidad significativamente superior a la normal de ser susceptible de la aparición o la recaída de una enfermedad o trastorno. Como parte de un régimen de tratamiento para un paciente con un riesgo elevado, el paciente puede tratarse profilácticamente para evitar la aparición o la recaída de la enfermedad o trastorno. El término “cantidad profilácticamente eficaz” se refiere a una cantidad de la composición farmacológica que produce un efecto observado como la prevención de la aparición o la recaída de una enfermedad o un trastorno. Las cantidades profilácticamente eficaces de una composición farmacéutica se determinan normalmente mediante el efecto que producen en comparación con el efecto observado cuando se administra a un paciente en condiciones similares una segunda composición farmacéutica que carece del principio activo. Las composiciones terapéuticas y farmacéuticas de la presente invención pueden administrarse de diversos modos en función de si se pretende un tratamiento local o sistémico y en función de la zona a tratar. Normalmente se utiliza la administración parenteral. El término “administración parenteral” se refiere a la administración de uno o más compuestos antisentido de la invención a un animal por una vía distinta al tracto digestivo La administración parenteral comprende la administración por venoclisis (i.v.), subcutánea, intraperitoneal (i.p.) o la inyección intramuscular, o la administración intratecal o intraventricular. Las composiciones para la administración parenteral, intratecal o intraventricular pueden comprender disoluciones acuosas estériles que pueden contener también disoluciones amortiguadoras del pH diluyentes y otros aditivos adecuados. Los sistemas de preparación y de administración de las composiciones farmacéuticas parenterales resultan conocidas en la técnica (véase, por ejemplo, Avis, capítulo 84 en: Remington’s Pharmaceutical Sciences (“Ciencias Farmacéuticas de Remington”), 18ª ed., Gennaro, ed., Mack Publishing Co., Easton, PA, 1990, páginas 1545 - 1569). Los sistemas de administración parenteral comprenden, pero no se limitan a ellos, los siguientes ejemplos ilustrativos. La administración intravenosa de formulaciones farmacéuticas que comprenden principios bioactivos resulta muy conocida en la técnica. Los agente bioactivos administrados por vía i.v. comprenden un fármaco antineoplásico, la doxorubicina, y un fármaco antimicótico, la amfotericina B (véase Riaz et al., capítulo 16 en Pharmaceutical Dosage Forms: disperse Systems (“Presentaciones farmacéuticas: sistemas dispersos”), Vol. 2, Lieberman et al., ed., Marcel Dekker, Inc., New York, NY, 1989, páginas 567 - 603). Teniendo particularmente en cuenta los compuestos antisentido, la administración antisentido de dichos compuestos a diversos mamíferos no humanos ha sido descrita por Iversen (capítulo 26 en: Antisense Research and Applications (“Investigaciones y aplicaciones de las cadenas antisentido”, Crooke et al., ed., CRC Press, Boca Raton, FL, 1993, páginas 461 - 469), y la administración sistémica de oligonucleótido a mamíferos no humanos por vía intraperitoneal ha sido también descrita (Dean et al., Proc. Natl. Acad. Sci. EE.UU., 1994, 91, 11766). Puede pretenderse la administración intraluminal de fármacos, para la administración de un fármaco a una parte aislada de un órgano o tejido tubular (por ejemplo, una arteria, vena, uréter o uretra), en el tratamiento de pacientes con enfermedad o trastornos que afectan la luz de dichos órganos o tejidos. Para realizar dicho modo de administración, se ha de introducir quirúrgicamente un catéter o cánula mediante el sistema apropiado. Por ejemplo, en el tratamiento de la arteria carótida común izquierda, se inserta una cánula en la misma vía la arteria carótida externa. Tras el aislamiento de una parte del órgano o tejido tubular al que se dirige el tratamiento, se infunde una composición que comprende los compuestos antisentido de la invención a través de la cánula o catéter en el segmento aislado. Tras la incubación durante un período comprendido entre 1 y 120 minutos, durante el que el principio bioactivo es absorbido por las células del interior de la luz del vaso, se extrae la cánula o catéter de venoclisis y se restablece el flujo en el interior del órgano o tejido tubular al extraer las ligaduras que realizan el aislamiento del mismo (Morishita et al., Proc. Natl. Acad. Sci. EE.UU., 1993, 90, 8474). Los principios bioactivos pueden combinarse también con una matriz biocompatible, tal como un material de hidrogel, y aplicarse directamente al tejido vascular in vivo (Rosenberg et al., patente US No. 5.593. 974, publicada el 14 de enero de 1997). En el tratamiento de pacientes con enfermedades o trastornos cerebrales, se puede pretender la administración intraventricular del fármaco, para realizar la administración directa del fármaco al cerebro del paciente. Para realizar dicho modo de administración se introduce quirúrgicamente un catéter de silicona en un ventrículo cerebral de un paciente humano y se conecta a una bomba subcutánea de venoclisis (Medtronic Inc., Minneapolis, MN) que se ha implantado en la parte abdominal (Zimm et al., Cancer Research, 1984, 44,1698; Shaw, Cancer, 1993, 72 (11 Supl., 3416). Se utiliza la bomba para inyectar el principio bioactivo y permite ajustar la dosificación precisa y las 10 ES 2 261 270 T3 5 10 15 20 25 30 variaciones en la pauta posológica con la ayuda de un dispositivo de programación externo. La capacidad del depósito de la bomba es de 18 a 20 ml y los índices de venoclisis pueden variar de 0,1 ml/h a 1 ml/h. En función de la frecuencia de administración, que varía de diaria a mensual, y la dosis del fármaco a administrar, varía de 0,01 µg a 100 g por kg de peso corporal, el depósito de la bomba puede rellenarse en intervalos de 3 a 10 semanas. La bomba se rellena mediante la punción percutánea de la membrana de autosellado de la bomba. En el tratamiento de pacientes con enfermedades del sistema nervioso central (SNC) puede ser conveniente la administración intratecal del fármaco para introducir el fármaco en la columna vertebral de un paciente. Para llevar a cabo dicha ruta de administración se introduce quirúrgicamente un catéter de silicona en el espacio intervertebral lumbar L3 - L4 de un paciente humano y se conecta a una bomba subcutánea de venoclisis que se ha implantado en la región abdominal superior (Luer & Hatton, The Annals of Pharmacotherapy (“Anales de farmacoterapia”) 1993, 27, 912, 1993; Ettinger et al., Cancer, 1978, 41, 1270; Yaida et al., Regul. Pept., 1985, 59, 193). Se utiliza la bomba para inyectar la composición farmacéutica y permite ajustar la dosificación precisa y las variaciones en la pauta posológica con la ayuda de un dispositivo de programación externo. La capacidad del depósito de la bomba es de 18 a 20 ml y los índices de venoclisis pueden oscilar entre 0,1 ml/h y 1 ml/h. En función de la frecuencia de administración, que varía de diaria a mensual, y la dosis del fármaco a administrar, que varía de 0,01 µg a 100 g por kg de peso corporal, el depósito de la bomba puede rellenarse en intervalos de 3 a 10 semanas. La bomba se rellena mediante una única punción percutánea de la membrana de autosellado de la bomba. La distribución, estabilidad y farmacocinética del principio bioactivo (tal como un oligonucleótido) dentro del SNC se realiza según métodos conocidos (Whitesell et al., Proc. Natl. Acad. Sci. EE.UU.,1993, 90, 4665). Si se pretende realizar la administración de principios bioactivos a partes distintas del cerebro o de la columna vertebral mediante dicho procedimiento, el catéter de silicona se configura para conectar la bomba de venoclisis subcutánea a, por ejemplo, la arteria hepática, para la administración al hígado (Kemeny et al., Cancer, 1993, 71, 1964). También pueden utilizarse bombas de venoclisis para realizar una administración sistémica de los principios bioactivos (Ewel et al., Cancer Res., 1992, 52, 3005; Rubenstein et al., J. Surg. Oncol., 1996, 62, 194). La administración vaginal proporciona el tratamiento local y evita los primeros pasos del metabolismo, la degradación por parte de los enzimas digestivos, y los efectos secundarios sistémicos potenciales. Dicho modo de administración puede preferirse en el caso de principios bioactivos dirigidos a organismos patógenos para los que la vagina constituye un hábitat habitual, por ejemplo, Trichonomas vaginalis. Los supositorios vaginales (Block, capítulo 87 en: Remington’s Pharmaceutical Sciences (“Ciencias Farmacéuticas de Remington”), 18ª ed., Gennaro, ed., Mack Publishing Co., Easton, PA, 1990, páginas 1609 - 1614) o los ungüentos tópicos pueden utilizarse para llevar a cabo dicho tipo de administración. 35 40 45 La administración intravesical proporciona un tratamiento local y evita los primeros pasos del metabolismo, la degradación por parte de los enzimas digestivos, y los efectos secundarios sistémicos potenciales. Sin embargo, el método requiere el cateterismo uretral del paciente y un personal especializado. No obstante, dicho modo de administración puede preferirse para principios bioactivos dirigidos a organismos patógenos, tales como la T. vaginalis, que pueden invadir el tracto urogenital. La inyección intravítrea, para una administración directa del fármaco al humor vítreo de un ojo de un mamífero, se describe en la patente US nº 5.591.720, cuyos contenidos se incorporan en la presente memoria por referencia. Los sistemas de preparación y administración de preparaciones oftalmológicas resultan conocidas en la técnica (véase, por ejemplo, Mullins et al., capítulo 86 en: Remington’s Pharmaceutical Sciences (“Ciencias Farmacéuticas de Remington”), 18ª ed., Gennaro, ed., Mack Publishing Co., Easton, PA,1990, páginas 1581 - 1595). Experimental 50 55 Los espectros ultravioleta de la ribonucleasa se registraron con un espectrómetro Philips PU8740 UV/Vis. Los espectros de RNM 1 H y de RNM 13 C se registraron en un espectrómetro Varian Gemini 200. Se utilizó tetrametilsilano como estándar interno para el espectro de RNM 1 H (s = singlete, d = doblete, t = triplete, m = multiplete) CDCl3 (δ = 76,9) o CD3 OD (δ = 49,0) para los espectros de RMN 13 C. Las determinaciones por espectrometría de masas se obtuvieron utilizando un espectrómetro de masas 1H Kratos Concept. Se hizo refluir la piridina durante la noche en hidróxido potásico y se destiló. Se almacenó el diclorometano en hidruro cálcico, se hizo refluir y se destiló. Se utilizaron placas prerrecubiertas Macherey-Nagel Alugram® SIL G/UV 254 para la TLC (cromatografía en placa fina) y se visualizaron los productos con luz UV. Se realizó la columna cromatográfica en un gel de sílice Acros Chimica (0,2 - 0,5 mm, tamaño de poro de 4 nm). 60 N6-Benzoil-9-[(1S,4R,SS)-5-hidroxil-4-hidroximetil-2-ciclohexenoil]adenina (2) 65 A una disolución de 1 (500 mg, 1,67 mmol, secada tres veces con piridina seca) en piridina seca (20 ml) a 0ºC bajo nitrógeno se añadió gota a gota TMSCl (1,06 ml, 8,38 mmol, 5 eq.). Tras agitar durante una hora se añadió lentamente BzCl (0,97 ml, 8,38 mmol, 5 eq.). Se agitó la mezcla de la reacción durante 1 hora a 0ºC, se calentó a temperatura ambiente y se agitó durante otras 13 horas adicionales. La mezcla de la reacción se enfrió a continuación en un baño de hielo y se enfrió rápidamente con agua (3 ml). Tras agitar durante 5 minutos, se añadió una disolución de NH4 OH 25% (5 ml). La mezcla resultante se agitó a temperatura ambiente durante 15 minutos y se concentró. Se disolvió el residuo en MeOH (15 ml) y una disolución de NH4 OH al 25% (10 ml) y se agitó a temperatura ambiente durante 0,5 11 ES 2 261 270 T3 5 horas. Tras la concentración, se purifico el residuo en gel de sílice (CH2 Cl2 -MeOH en una proporción 50:1, 20:1, y 10:1) para proporcionar 2 (385 mg, 63%) como espumas blancas. RMN 1 H (DMSO-d6 ) δ 2,01 (m, 1H), 2,15 (m, 2H), 3,60 (m, 2H), 3,78 (m, 1H), 4,76 (t, 1H, J = 5,1 Hz, -CH2 OH) , 5,42 (m, 1H), 5,88 (dm, 1H, J = 9,9 Hz), 6,05 (dm, 1 H, J = 9,9 Hz), 7,59 (m, 3H), 8,04 (m, 2H), 8,34 (s, 1H), 8,76 (s, 1H), 11,17 (br-s, 1H, -NH) ; RMN 13 C (CD3 OD) δ 36,9 (t), 47,7 (d), 63,1 (t), 64,9 (d), 125,3 (d) 129.5 (d), 129,9 (d), 134.0 (d), 135,1 (s), 136,1 (d) 144,8 (d), 151,2 (s), 153,1 (d), 153,3 (s), 168,3 (s) ; UV λmáx (MeOH) = 280 nm; LISMS (THGLY) 366 (M+H)+ ; HRMS calculado para C19 H20 N5 O3 (M+H)+ 366,1566, se encontró 366,1571. N6-Benzoil-9-[(1S,4R,SS)-5-hidroxi-4-monometoxitri-tiloximetil-2-ciclohexenoil]adenina (3) 10 15 20 25 30 A una disolución de 2 (240 mg, 0,66 mmol, secada tres veces con piridina seca) en piridina seca (5 ml) a 0ºC bajo nitrógeno se añadió MMTrCl (305 mg, 0,99 mmol, 1,5 eq.) en partes. Tras agitar a 0ºC durante una 0,5 horas, se calentó la reacción a temperatura ambiente y se mantuvo a dicha temperatura durante 22 horas. La mezcla de la reacción se enfrió en un baño de hielo y se trató con MeOH (5 ml). Tras agitar a temperatura ambiente durante 0,5 horas, se concentró la mezcla resultante. El residuo se evaporó conjuntamente con tolueno para eliminar las trazas de piridina y se realizó la cromatografía en gel de sílice (CHCL3 -MeOH en una proporción 100:1, Et3 N al 1%) para proporcionar 3 (240 mg, 57%) como espuma blanca. RMN 1 H (CDCl3 ) δ 2,12 (m, 2H), 2,54 (m, 1H), 3,24 (t, 1 Hm J = 8,8 Hz), 3,49 (s, 1H, -OH), 3,52 (dd, 1H, J = 8,8, 4,4 Hz), 3,78 (s, 3H), 3,85 (m, 1H), 5,43 (m, 1H), 5,82 - 5,96 (m, 2H), 6,84 (d, 2H, J = 7,8 Hz), 7,19 - 7,61 (m, 15), 7,88 (s, 1H), 8.01 (d, 1H, J = 7,3 Hz), 8,75 (s, 1H), 9,35 (s, 1H, NH); RMN 13 C (CDCl3 ) δ 35.6 (t), 44,3 (q), 49,5 (d), 55,2 (d), 65,6 (t), 66,4 (d), 87,2 (s), 113,3 (d), 123,4 (s), 123,9 (d), 127,2 (d), 128,0 (d), 128,3 (d), 128,8 (d), 130,2 (d), 132,7 (d), 133,8 (s), 133,9 (d), 135,1 (s), 141,8 (d), 143,9 (s), 144,0 (s), 149,6 (s), 151,6 (s), 152,4 (d), 158,8 (s), 164,8 (s); UV λmáx (MeOH) = 280, 254 nm; LISMS (THGLU/NBA) 660 (M+Na)+ ; HRMS calculado para C39 H35 N5 O4 Na (M +Na)+ 660, 2587, encontrado 660, 2589. Preparación del monómero de amidita 4 El nucleósido modificado 3 (500 mg, 0,78 µmol) fue fosfitilado con 2-cianoetil-N,N-diisopropilclorofosforamidita de un modo general según Song, et al., Tetrahedron Lett., 1999, 40, 4153 - 4156. Siguiendo la columna cromatográfica con n-hexano/acetona/trietilamina (58/40/2) y la precipitación en hexano frío, se aisló una cantidad de 550 mg (0,66 µmol, 85%) de amidita. R1: (n-hexano/acetona/trietilamina 49/49/2) 0,38 LSIMS (modo positivo, NPOE) 838 [M+H]+ . Síntesis de oligonucleótidos en fase sólida 35 Se realizó el ensamblaje a una escala de 1 µmol (10 µmol para la secuencia de Dickerson) en un sintetizador ABI 381 A DN siguiendo los procedimientos estándar tales como los descritos por Song, et al., Tetrahedron Lett., 1999, 40, 4153 - 4156, excepto por el uso de una disolución 0,12 M de amidita sintética con un período de acoplamiento de tres minutos. El período de eliminación del tritilo del grupo monometoxitritilo se dobló. Los ribooligonucleótidos fueron ensamblados por Eurogentec. 40 Espectrometría de masas 45 Se disolvió el ADN 12-mer(5’-d(CGC GAA1 TTC GCG-3’)] en agua y acetonitrilo (en una proporción 50:50) y se desaló con perlas de intercambio de cationes Dowex-50W. Se diluyó el sobrenadante mediante la adición de un volumen multiplicado por diez de agua, acetonitrilo y amoníaco (en una proporción de 50:50:0,3%). Se obtuvieron los datos de electroespray MS y MS/MS en un espectrómetro Micromass Q-Tofmass (Whytenshawe, Manchester, RU) equipado con una fuente iónica con nanospray (ESI-MS) accionándose en modo negativo. Se calibró el instrumento con una calibración de dos puntos empleando un ion de carga simple del monómero y el dímero de rafinosa. 50 Experimentos de CD 55 Los espectros de CD se determinaron con un espectropolarímetro Jasco 600 en cubetas de 1 cm controladas termostáticamente conectadas con un baño Lauda R CS 6. Se disolvieron los oligonucleótidos y se analizaron en una disolución de NaCl (0,1 M) con una disolución amortiguadora del pH de fosfato potásico (20 mM), a un pH de 7,5, ácido edético 0,1 mM a 25ºC y a una concentración de 5 µM para cada cadena. Experimento con la ribonucleasa H 60 65 Se realizó el radiomarcaje (32 P) del oligonucleótido 5’-CmGmGmCmGmrUrUrUrUrUrUCmAmGmGmAm-3’ en el extremo 5’ utilizando la polinucleótido cinasa T4 (Gibco BRL) y (γ-32 P) ATP(4500 Ci/mmol, ICN) mediante procedimientos estándar y se purificó en una columna NAP-5® (Pharmacia). El oligonucleótido radiomarcado (2,5 pmol) y el oligonucleótido complementario (50 nm) con unidades estructurales de desoxiciclohexeno y anhídrido de hexitol respectivamente, se incubaron en un volumen total de 50 µl que contenían 10 mM de tris-cloruro, a un pH de 7,5, 25 mM de KCl y 0,5 mM de MgCl2 a 37ºC durante 15 minutos, permitiendo que se formase el híbrido. Las reacciones de escisión se iniciaron mediante la adición 30 U de ribonucleasa H (ribonucleasa H de E. coli, Amersham) a la mezcla. Los tubos de control no recibieron enzima alguno. Se tomaron alícuotas en los intervalos de tiempo adecuados, mezclados con un volumen equivalente de la mezcla de interrupción (ácido edético 50 mM, xilencianol FF al 0,1% y azul de bromofenol al 0,1% en formamida al 90%) y se enfrió en hielo. Se analizaron las muestras con gel de po12 ES 2 261 270 T3 liacrilamida (PAGE) desnaturalizante al 20% que contenía urea (50%) con una disolución amortiguadora del pH de TBE a 1000 V durante 1,25 horas. Se visualizaron los resultados mediante imagen fosforescente (Packard Cyclone, Optiquant software). 5 10 15 Estabilidad enzimática Se radiomarcaron (32 P) los oligonucleótidos (dA)13 -propanodiol, (A1 )13 -propanodiol y (A2 )13 -propanodiol en el extremo 5’ utilizando la polinucleótido cinasa T4 (Gibco BRL) y (γ-32 P) ATP(4500 Ci/mmol, ICN) mediante procedimientos estándar y se purificó en una columna NAP-5® (Pharmacia). A fin de analizar un amplio intervalo de actividad enzimática, se incubaron 20 pmol de oligonucleótidos radiomarcados en 20 µl de suero fetal de ternera al 50% en PBS a 37ºC. Se tomaron alícuotas en los intervalos de tiempo adecuados, mezclados con un volumen doble de la mezcla de interrupción (ácido edético 50 mM, xilencianol FF al 0,1% y azul de bromofenol al 0,1% en urea 7 M) y se enfrió en hielo. Se analizaron las muestras con PAGE desnaturalizante al 20% que contenía urea (50%) con una disolución amortiguadora del pH de TBE a 1000 V durante 1,25 horas. Se visualizaron los resultados mediante imagen fosforescente (Packard Cyclone, Optiquant software). Curva de mezcla de rayos UV 20 25 30 35 40 45 50 Se realizaron los experimentos en una disolución amortiguadora del pH que contenía 0,1 M de NaCl, 0,02 M de fosfato potásico a pH 7,5 y 0,1 µM de ácido edético a 10ºC. Las distintas muestras se prepararon mezclando disoluciones 4 µM de ambas cadenas, (A1 )13 y dT13 en la proporción adecuada. Se dejó que se estabilizaran las muestras durante 2 horas tras las que se determinó la absorbancia de los rayos UV con un espectrómetro Varian Cary 300 Bio a 260 nm. Se obtuvo la curva mediante regresión lineal. Preparación de la muestra de RMN y espectrometría por RMN Se prepararon las muestras para la RMN disolviendo el oligómero en 300 µl de disolución amortiguadora del pH para la RMN que consistía en 0,1 M de NaCl, 10 mM de KH2 PO4 , 10 µM de ácido edético a pH 7,5. Se liofilizó la muestra a partir de D2 O al 99,96%. La muestra se disolvió finalmente en 30 µl de D2 O al 99,96% (o H2 O al 90% y D2 O al 10%) en los experimentos de RMN de protones intercambiables). Se templaron las muestras calentando hasta 80ºC y enfriando lentamente a continuación. La concentración total del híbrido fue de 1,4 mM. Se registraron los espectros de RMN en una unidad de espectrometría Varian 500 (funcionando a 499,505 MHz) utilizando una sonda (ACP) de resonancia triple de 3 mm. La detección de la cuadratura se consiguió mediante el modo hipercomplejo de States-Haverkom tal como se ha descrito de un modo general en States, et al., J. Magn. Res., 1982, 48, 286 - 292. Se procesaron los espectros utilizando los programas NMRPipe (Delaglio, et al., J. Biomol. NMR 1995, 6, 277 - 293) y XEASY (Xia, et al., Institute of Molecular Biology and Biophysics (“Instituto de Biología Molecular y Biofísica”), 1994, Zürich, Suiza) funcionando en una terminal de trabajo Silicon Graphics O2 (IRIX version 6.5). Los espectros de RMN de protones intercambiables se disolvieron en H2 O al 90% y D2 O al 10% y se registraron a 20ºC utilizando la secuencia de impulsos Watergate. Se utilizó una anchura de barrido de 12000 Hz en ambas dimensiones con 32 escáneres, 2048 puntos de datos en t2 y 600 FIDs en t1. Se eliminaron o se disminuyeron las discontinuidades agudas de los datos con una función cuadrática seno-campana desplazada en ambas dimensiones y se procesaron en una matriz de 4K x 2K. Los espectros de la 2D DQF-COSY, la TOCSY y la NOESY de la muestra en D2 O se registraron a 20ºC con una anchura de barrido de 5000 MHz en ambas dimensiones. El pico HDO residual se suprimió mediante presaturación. El espectro de la DQF COSY desacoplado 31 P (desacoplamiento continuo en la resonancia) consistió en 4096 puntos de datos en t2 y 512 incrementos en t1. Se eliminaron o se disminuyeron las discontinuidades agudas de los datos con una función cuadrática seno-campana desplazada en ambas dimensiones y se procesaron en una matriz de 4K x 2K. Para el experimento de la TOCSY, se utilizó un Clean MLEV versión 17 con un período de mezcla de la TOCSY de 65 minutos. Se adquirió el espectro con 32 escáneres, 2048 puntos de datos en t2 y 512 FIDs en t1. Se eliminaron o se disminuyeron las discontinuidades agudas de los datos con una función cuadrática seno-campana desplazada en ambas dimensiones y se procesaron en una matriz de 4K x 2K. Los experimentos de la NOESY se realizaron con unos períodos de mezcla de 50, 100, 150 y 250, y se adquirieron con 32 escáneres, 2048 puntos de datos en t2 y 512 FIDs en t1. Se adquirió el A 1 H-31 P HETCOR con 128 escáneres, 2048 puntos de datos en la dimensión protónica, t2, y 512 puntos de datos reales en la dimensión fosfórica, t1, con unas anchuras de barrido de anchuras de 5000 Hz y 2000 Hz, respectivamente. 55 60 65 13 ES 2 261 270 T3 REIVINDICACIONES 5 10 1. Compuesto que comprende una pluralidad de unidades estructurales unidas mediante enlace covalente que individualmente comprenden una base nucleosídica y una región furanosilo o una región ciclohexenilo unida mediante enlace covalente a dicha base, siempre que dicho compuesto comprenda por lo menos una unidad estructural que comprenda una región ciclohexenilo. 2. Compuesto según la reivindicación 1, en el que la región ciclohexenilo se une mediante enlace covalente a una base adenina. 3. Compuesto según la reivindicación 1 ó 2, en la que dichas unidades estructurales se encuentran unidas por enlace covalente de tal modo que las regiones básicas de las mismas forman una secuencia de bases mixta que es complementaria a una secuencia de bases de ARN o a una secuencia de bases de ADN. 15 20 4. Compuesto según cualquiera de las reivindicaciones 1 a 3, en el que por lo menos dichas regiones furanosilo comprenden un grupo 2’-hidroxilo. 5. Compuesto según cualquiera de las reivindicaciones 1 a 4, en el que un enlace fosfodiéster o un enlace fosforotioato une por lo menos dos de dichas unidades estructurales. 6. Compuesto según cualquiera de las reivindicaciones 1 a 5, que provoca la actividad de la ribonucleasa H. 7. Compuesto según cualquiera de las reivindicaciones 1 a 6, para utilizar como medicamento. 25 8. Compuesto según la reivindicación 7, en el que dicho medicamento se utiliza en el tratamiento de una enfermedad asociada a la producción no deseada de una proteína. 9. Compuesto según la reivindicación 7 ó 8, que provoca una reducción en la producción de una proteína. 30 10. Composición farmacéutica que comprende un compuesto según cualquiera de las reivindicaciones 1 a 6 y un excipiente o diluyente farmacéuticamente aceptable. 11. Composición farmacéutica según la reivindicación 10, en la que dicha composición presenta la forma de líqui- 35 do. 12. Composición farmacéutica según la reivindicación 10, en la que dicha composición presenta la forma de polvo. 40 13. Método que comprende poner en contacto un compuesto según cualquiera de las reivindicaciones 1 a 6 con ARN o ADN in vitro. 14. Uso del compuesto según cualquiera de las reivindicaciones 1 a 6 en un procedimiento no terapéutico, no diagnóstico que comprende poner en contacto el compuesto con ARN o ADN in vivo. 45 50 55 60 65 14 ES 2 261 270 T3 15 ES 2 261 270 T3 16 ES 2 261 270 T3 17 ES 2 261 270 T3 18 ES 2 261 270 T3 19 ES 2 261 270 T3 20 ES 2 261 270 T3 21 ES 2 261 270 T3 22 ES 2 261 270 T3 23 ES 2 261 270 T3 24 ES 2 261 270 T3 25 ES 2 261 270 T3 26 ES 2 261 270 T3 27 ES 2 261 270 T3 28 ES 2 261 270 T3 29 ES 2 261 270 T3 30 ES 2 261 270 T3 31