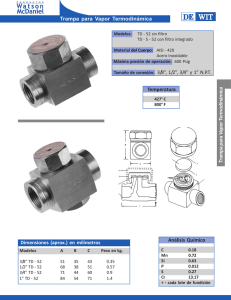
UNIDAD 2: SEGUNDA LEY Y APLICACIONES DE LA
Anuncio

UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA UNIDAD 2: SEGUNDA LEY Y APLICACIONES DE LA TERMODINÁMICA Nombre de la Unidad Introducción Justificación Intencionalidades Formativas Denominación de capítulos Entalpia segunda ley y aplicaciones de la termodinámica Segunda ley de la termodinámica; ciclos termodinámicos; aplicaciones de la termodinámica CAPITULO 4: SEGUNDA LEY DE LA TERMODINAMICA Introducción A esta altura del curso Ud. habrá podido apreciar la gran importancia que tiene la primera ley en aplicaciones relacionadas con la energía ya que constituye el fundamento de cualquier balance energético, sin embargo la primera ley tiene limitaciones, no nos dice nada sobre la posibilidad o probabilidad de que ocurra un determinado suceso, por ejemplo que se efectúe una reacción bajo determinadas condiciones, o sobre la dirección en la cual los procesos termodinámicos se realizan, ni sobre la calidad de la energía. Por ejemplo el trabajo se puede convertir completamente en calor pero el calor por ningún medio se puede convertir completamente en trabajo, aunque ambos procesos cumplen con la primera ley. Surge la pregunta ¿cuál será la máxima cantidad de trabajo que se puede obtener a partir de una determinada cantidad de calor? ¿Qué dispositivos se utilizan para ello? Por otra parte la experiencia cotidiana indica que si se ponen en contacto dos objetos a diferente temperatura se produce una transferencia de calor del objeto caliente al objeto frío, nunca se ha observado el proceso inverso, es decir, que el objeto a mayor temperatura se caliente más y el objeto frío se enfríe en una proporción equivalente; fíjese que también en estos procesos se cumple la primera ley. El calor se transfiere espontáneamente desde una región de alta temperatura a una de menor temperatura, ¿será posible el proceso contrario? Estas inquietudes se podrán abordar con el estudio de la segunda ley de la termodinámica y la propiedad que se deduce de ella, la entropía. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Lección 16: Aplicación de la primera ley en gases ideales Energía Interna como función de la temperatura. Experimento de joule La primera Ley de la Termodinámica nos dice que un cambio de energía interna del sistema termodinámico es igual a la suma del trabajo y del calor involucrado en dicho cambio. Debemos averiguar ahora si la energía interna es una función de la presión, de la temperatura o del volumen, para tener una propiedad termodinámica que nos diga cuándo el sistema pierde o gana energía interna. Para resolver este interrogante, Joule diseñó un experimento muy sencillo que buscaba relacionar los cambios de presión con la temperatura. El procedimiento es como sigue, el sistema termodinámico tiene dos compartimientos A y B con paredes diatérmicas, separados por una llave C. En el compartimiento A se encuentra un gas a una presión dada y en el B se ha hecho vacío; este es el estado inicial del sistema. En este momento se gira la llave C permitiendo que el gas pase a B, se observa la temperatura del termómetro T y se determina su variación. Como el gas se expande libremente en el vacío, su trabajo de expansión es igual a cero, 𝑊 = 0. Como la temperatura final e inicial es la misma no hay variación en la energía interna, esta permanece constante. Figura 1: Experimento de Joule En este experimento de Joule (no debe confundirse con el del equivalente mecánico del calor) variamos simultáneamente la presión y el volumen del gas perfecto y observamos el efecto sobre la temperatura. Por consiguiente, debemos concluir que la energía interna es exclusivamente función de la temperatura, es decir, se sabe que hay cambio en la energía interna cuando observamos un cambio en la temperatura. Debemos recordar que el gas perfecto se ha definido para presiones bajas y que, por lo tanto, la energía interna será una función de la temperatura, cuando la presión del gas contenido en A e pequeña, entonces: 𝑼 = 𝒇(𝑻) Ecuación 1 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Esta ecuación se conoce como la Ley de Joule. La energía interna, U, de un gas ideal es función exclusiva de la temperatura. Esta ley tiene consecuencias importantes para cuantificar la relación entre las capacidades caloríficas a presión y a volumen constantes. Por la Ley de Joule: U U 0 y 0 P T V T Por consiguiente, las derivadas parciales de 𝑈 se convierten en derivadas totales. De la definición de capacidad calorífica, se tiene: CV dU dH ; CP dT dT La integración de estas dos ecuaciones nos conduce a: T2 U 2 U 1 CV .dT T1 T2 H 2 H 1 C P .dT T1 Ecuación 2 Ecuación 3 En donde los subíndices 1 y 2 se refieren a los estados inicial y final, respectivamente. En el caso de que las capacidades caloríficas, Cp y Cv constantes, su integración es inmediata: U 2 U1 CV T2 T1 y H 2 H1 CP T2 T1 Procesos Isotérmicos para un Gas Ideal Ahora se va a estudiar las variaciones que sufre la energía interna de un sistema termodinámico compuesto por un gas ideal, teniendo en cuenta la trayectoria que sigue el proceso termodinámico. Tomemos la expansión isotérmica reversible desde un volumen inicial V1 a un volumen final V2; como la temperatura es constante, T1 = T2 y ∆𝑇 = 0. Como la energía interna es una función de temperatura ∆𝑈 = 0. La primera Ley nos dice: 𝑈 = 𝑄 + 𝑊 = 0 𝑊 = −𝑄 = −𝑃. 𝑑𝑉 Para el gas ideal 𝑃 = integración: 𝑛.𝑅.𝑇 , 𝑉 reemplazando en la ecuación anterior y efectuando la UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 𝑽 𝑾 = −𝑸 = −𝒏. 𝑹. 𝑻𝒍𝒏 ( 𝟐) 𝑽𝟏 Ecuación 4 El signo negativo en la expresión derecha de la ecuación significa que el sistema hace una expansión sobre los alrededores. Calculemos ahora la variación de entalpía para este mismo proceso: ∆𝑯 = ∆𝑼 + ∆(𝑷. 𝑽) = 𝟎 + ∆(𝒏. 𝑹. 𝑻) = 𝟎 Ecuación 5 Puesto que la expansión isotérmica no tiene cambio en el número de moles, n, y tampoco en la temperatura. En el caso de que la expansión sea libre (contra vacío) el problema se simplifica notablemente ya que W = 0, por ser isotérmico ∆U = 0, por consiguiente Q = 0, y nos queda: ∆𝑯 = ∆𝑼 + ∆(𝑷. 𝑽) = 𝟎 Ecuación 6 Ejemplo 39 El sistema termodinámico está constituido por un mol de gas ideal encerrado a presión constante de 2 atmósferas. La temperatura varía de 100°C hasta 25°C. Calcular: a. El trabajo realizado por el sistema. 𝑐𝑎𝑙 b. Dado que 𝐶𝑉 = 3 𝑚𝑜𝑙.𝐾 Cv, calcule ∆𝑄, ∆𝑈 y ∆𝐻. Análisis del problema Para el primer caso, vamos a estudiar el efecto de enfriar un gas ideal y analizar los cambios en las funciones termodinámicas. Para el segundo caso, vamos a realizar el cálculo de las funciones termodinámicas. La primera que podemos calcular es ∆𝑈, ya que conocemos 𝐶𝑉 y ∆𝑇. Solución del problema a. Dado que es un gas ideal podemos calcular todas sus propiedades termodinámicas así: 𝑎𝑡𝑚. 𝑙 𝑛. 𝑅. 𝑇1 1𝑚𝑜𝑙 (0.08205 𝑚𝑜𝑙. 𝐾 ) 373.15𝐾 𝑉1 = = = 15.39𝑙 𝑃1 2𝑎𝑡𝑚 De la misma manera podemos conocer 𝑉2 debido a que la presión es constante: 𝑉2 = 12.29𝑙 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Finalmente, podemos calcular el trabajo realizado por el sistema, a presión constante es: W P.dV P.V V2 V2 V1 V1 𝑊 = −2𝑎𝑡𝑚(12.29𝑙 − 15.39𝑙) = 6.2 𝑎𝑡𝑚. 𝑙 𝑊 = 6.2𝑎𝑡𝑚. 𝑙 (24.22 𝑐𝑎𝑙 ) = 150.16 𝑐𝑎𝑙 𝑎𝑡𝑚. 𝑙 Como el trabajo tiene signo positivo el sistema se comprime. b. Para este caso: ∆𝑈 = 𝐶𝑉 ∆𝑇 = 𝐶𝑉 (𝑇𝑓 − 𝑇𝑖 ) ∆𝑈 = 3 para 𝐶𝑉 = 𝑐𝑜𝑛𝑠𝑡𝑎𝑛𝑡𝑒 𝑐𝑎𝑙 (298𝐾 − 373.15𝐾)(1𝑚𝑜𝑙) = −225 𝑐𝑎𝑙 𝑚𝑜𝑙. 𝐾 ∆𝑈 = −225 𝑐𝑎𝑙 El sistema pierde energía puesto que el signo de ∆𝑈 es negativo. Ahora, mediante la aplicación de la primera ley podemos calcular 𝑄: ∆𝑈 = 𝑄 + 𝑊 𝑄 = ∆𝑈 − 𝑊 𝑄 = −225 𝑐𝑎𝑙 − 150.16 𝑐𝑎𝑙 = 375.16 𝑐𝑎𝑙 Como el proceso se realiza a presión constante: 𝑄 = ∆𝐻 y el valor de Q es igual a la variación de entalpía. Procesos Adiabáticos para un Gas Ideal Para el proceso adiabático es imposible el intercambio de calor entre el sistema y sus alrededores. Por lo tanto su variación de calor ∂Q será igual a cero. Luego en la primera ley nos queda: 𝜹𝑾 = 𝒅𝑼 = 𝒏. 𝑪𝑽 . 𝒅𝑻 Ecuación 7 En donde 𝑛 es número de moles y 𝐶𝑉 la capacidad calorífica a volumen constante. Para un gas ideal 𝐶𝑉 es una constante y se puede efectuar la integración directamente: 𝑾𝒂𝒅𝒊𝒂𝒃á𝒕𝒊𝒄𝒐 = 𝑼𝟐 − 𝑼𝟏 = 𝒏. 𝑪𝑽 (𝑻𝟐 − 𝑻𝟏 ) Ecuación 8 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA El significado de esta ecuación nos dice que el trabajo de expansión adiabática se realiza a expensas de la variación de la energía interna del sistema. En consecuencia, a la expansión adiabática del gas (trabajo que hace el sistema sobre los alrededores) le sigue un enfriamiento del gas; lo contrario también es cierto; es decir, que a una comprensión adiabática le sigue un calentamiento del gas. En un proceso reversible la transformación adiabática puede ser expresada como función de la presión y del volumen. Al reemplazar el valor de temperatura por P.V del gas ideal, n.R tenemos: 𝑾𝒂𝒅𝒊𝒃á𝒕𝒊𝒄𝒐 = − 𝑪𝑽 𝑹 (𝑷𝟏 𝑽𝟏 − 𝑷𝟐 𝑽𝟐 ) Ecuación 9 De acuerdo con la ecuación, 𝐶𝑃 = 𝐶𝑉 + 𝑅, se define un nuevo factor 𝛾 como el cociente: 𝜸= 𝑪𝑷 Ecuación 10 𝑪𝑽 Entonces: 𝑅 𝛾−1=𝐶 𝑉 y reemplazando en la ecuación 166. 𝑾𝒂𝒅𝒊𝒃á𝒕𝒊𝒄𝒐 = − 𝟏 𝜸−𝟏 (𝑷𝟏 𝑽𝟏 − 𝑷𝟐 𝑽𝟐 ) Ecuación 11 Así, tenemos una expresión para calcular el trabajo adiabático en función de las presiones y volúmenes iniciales y finales y además, del coeficiente 𝛾. Pero también se puede desarrollar una fórmula para conocer las temperaturas y volúmenes iniciales o finales para un proceso adiabático y reversible. Veamos el cálculo de energía para este tipo de proceso era: 𝑑𝑈 = 𝛿𝑊 = 0; reemplazando a la energía interna y al trabajo por sus valores: 𝒏. 𝑪𝑽 . 𝒅𝑻 = −𝑷. 𝒅𝑽 Para poder integrar debemos reemplazar a 𝑃 = 𝒏. 𝑪𝑽 𝒅𝑻 = − 𝒏.𝑹.𝑻 𝑽 Ecuación 12 𝑛.𝑅.𝑇 𝑉 𝒅𝑽 Ecuación 13 Al reorganizar los términos, se obtiene: 𝑪𝑽 𝒅𝑻 𝑹 . 𝑻 =− 𝒅𝑽 Ecuación 14 𝑽 De otra manera: 1 𝑑𝑇 𝑑𝑉 . + =0 𝛾−1 𝑇 𝑉 Efectuando la integración se obtiene: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 𝜸 𝜸 𝑻𝟏 𝑽𝟏 = 𝑻𝟐 𝑽𝟐 = 𝒄𝒐𝒏𝒔𝒕𝒂𝒏𝒕𝒆 Ecuación 15 Esta ecuación puede expresarse también en función de P y V obteniéndose: 𝜸 𝜸 𝑷𝟏 𝑽𝟏 = 𝑷𝟐 𝑽𝟐 = 𝒄𝒐𝒏𝒔𝒕𝒂𝒏𝒕𝒆 Ecuación 16 Esta ecuación en su forma diferencial se conoce con el nombre de Ecuación de Laplace: 𝒅𝑷 𝑷 +𝜸 𝒅𝑽 Ecuación 17 𝑽 Para la expresión en función de temperatura y presión nos resulta la ecuación: 𝟏−𝜸 𝜸 𝟏−𝜸 𝜸 𝑷𝟏 𝑻𝟏 = 𝑷𝟐 𝑻𝟐 Ecuación 18 Estas ecuaciones son válidas para procesos reversibles. Ejemplo 40 Un mol de gas perfecto a 0°C y 1 atm se comprime reversible y adiabáticamente hasta que su temperatura se eleva 10°C. Entonces se expande reversible e isotérmicamente hasta que su presión sea de 1 atm. Calcular: a. La presión alcanzada después de la compresión adiabática. b. Los valores totales de ∆𝑈 y ∆𝐻. c. El calor y el trabajo netos en todo el proceso. Se conoce: 𝐽 𝐽 𝐶𝑉 = 20.5 𝑚𝑜𝑙.𝐾 y 𝑅 = 8.314 𝑚𝑜𝑙.𝐾 Análisis del problema Los procesos que hemos visto en esta lección se aplican para calcular las funciones termodinámicas, combinándolas para dar la idea de ciclo. Solución del problema a. Proceso: Compresión reversible adiabática, la fórmula que nos relaciona presión y temperatura es: 𝑃1−𝛾 . 𝑇 𝛾 = 𝑐𝑜𝑛𝑠𝑡𝑎𝑛𝑡𝑒 𝐶 En donde 𝛾 = 𝐶𝑃 𝑉 Entonces: P1 1 P2 1 T1 T2 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA T Despejando P2: P2 2 T1 1 .P1 CP CV J mol.K 1.405 J 20.5 mol.K (20.5 8.3) Log P2 Log P1 T log 2 1 T1 283 Log P2 0 3.469 Log 0.052 273 𝑃2 = 1.13 𝑎𝑡𝑚 b. Los valores de ∆𝑈 y ∆𝐻 dependen exclusivamente de la temperatura, luego: ∆𝑈 = 𝐶𝑣. ∆𝑇 para 𝐶𝑣 = 𝐶𝑜𝑛𝑠𝑡𝑎𝑛𝑡𝑒. ∆𝐻 = 𝐶𝑝. ∆𝑇 para 𝐶𝑝 = 𝐶𝑜𝑛𝑠𝑡𝑎𝑛𝑡𝑒. ∆𝑈 = 20.5 𝑥 10 = 205 𝐽 ∆𝐻 = (20.5 + 8.3) 𝑥 10 = 288 𝐽 c. En el proceso de compresión adiabática 𝑄 = 0 y por consiguiente ∆𝑈 = 𝑊 ∆𝑈 = −𝑃. ∆𝑉 = 205 𝐽. El mismo valor anteriormente calculado. 𝑊 = −205 𝐽 En el proceso de expansión isotérmica ∆𝑈 = 0. El primer principio de la termodinámica dice: ∆𝑈 = 𝑄 + 𝑊 = 0 por consiguiente, 𝑄 = − 𝑊 El valor del trabajo para la expansión es: 𝑃2 𝑄 = −𝑊 = −2.3 𝑅 . 𝑇. 𝑙𝑜𝑔 ( ) 𝑃1 𝑄 = −2.3 (8.314 𝐽 ) (283𝐾)𝑙𝑜𝑔(1.13) = −287.2𝐽 𝑚𝑜𝑙. 𝐾 Valores netos en el ciclo completo, ciclo A más ciclo B: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 𝑄 𝑡𝑜𝑡𝑎𝑙 = 0 + 287.2 𝐽 = 286.7𝐽 𝑊 𝑡𝑜𝑡𝑎𝑙 = +205𝐽 – 287.2𝐽 = −82.2𝐽 Lección 17: Segunda ley de la termodinámica Enunciado KELVIN-PLANCK Establece que es imposible construir un dispositivo que funcionando en forma cíclica su único efecto sea convertir completamente en trabajo todo el calor procedente de una fuente térmica. Una fuente térmica es un sistema tan grande que cualquier cantidad finita de energía que se extraiga de ella o se le suministre no afecta su temperatura, frecuentemente el aire de la atmósfera, un río, un lago o el océano se pueden considerar como fuentes térmicas. Es necesario que entienda bien el alcance de este enunciado, se expresa como una negación no es posible transformar completamente el calor en trabajo. Si esto es así, ¿qué fracción de la energía en forma de calor se convierte en trabajo?, ¿qué pasa con la energía que no se utiliza en este proceso? Para responder a estos interrogantes precisemos que un dispositivo que utiliza el calor para la generación de trabajo se conoce como máquina térmica, la revolución industrial y los posteriores adelantos tecnológicos en los medios de producción y el transporte, tuvieron su inicio en las primitivas máquinas de vapor. En forma simplificada y esquemática toda máquina térmica recibe calor procedente de una fuente térmica y mediante un proceso cíclico parte de ese calor se convierte en trabajo y la otra parte se transfiere a una nueva fuente térmica a más baja temperatura según se ilustra en la figura 68. 𝑄𝐶 representa el calor transferido a la máquina desde la fuente a temperatura alta 𝑇𝐶 y 𝑄𝑓 el calor que no se convierte en trabajo y que es transferido a la fuente a la temperatura más baja 𝑇𝑓 . 𝑊 representa el trabajo producido durante el ciclo termodinámico mediante el cual funciona la máquina. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Figura 2: Máquina térmica En general la eficiencia de cualquier proceso se expresa por la relación entre el producto obtenido y los recursos invertidos en el proceso. Ahora, aplique este concepto para determinar la eficiencia de una máquina térmica. El producto de la máquina es el trabajo que realiza durante un ciclo y el recurso necesario es el calor procedente de la fuente de alta temperatura. Entonces la eficiencia de una máquina térmica se puede expresar mediante la relación. W Qc Ecuación 19 Donde η = eficiencia de la máquina térmica W = trabajo realizado por la máquina durante un ciclo Qc = magnitud del calor transferido entre una fuente de alta temperatura Tc y la máquina térmica Al aplicar la primera ley se obtiene: W Qc Q f Ecuación 20 Donde Qf = magnitud del calor transferido entre la máquina térmica y una fuente de baja temperatura Tf Remplazando W en la ecuación 176 se puede establecer otra ecuación muy útil para determinar la eficiencia de una máquina térmica. Qc Q f Qc 1 Qf Qc Ecuación 21 Observe que la segunda ley establece que Qf nunca puede valer cero lo que equivale a decir que una máquina térmica nunca puede tener un ciento por ciento de eficiencia. Entonces, ¿cuál será la máxima eficiencia que puede tener una máquina térmica? La respuesta a este interrogante la formuló el ingeniero francés Nicholas Leonard Sadi Carnot. TRANSFORMACIONES CÍCLICAS CON DOS FOCOS TÉRMICOS UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Al no poder extraer trabajo de un motor con un proceso cíclico monotérmico, conviene plantear la posibilidad de colocar nuestro sistema termodinámico (motor) entre dos focos caloríficos y examinar de qué forma podemos construir nuestro ciclo para extraer trabajo. Los focos térmicos que se van a considerar los designamos como 𝐹1 y 𝐹2 con sus respectivas temperaturas 𝑇1 y 𝑇2 , con la condición de 𝑇1 > 𝑇2 . Las cantidades de calor intercambiadas con el sistema termodinámico (motor) son 𝑄1 y 𝑄2 , respectivamente. Nuevamente debemos partir del análisis de la primera ley de la termodinámica para el sistema en un proceso cíclico. ∆𝑈 = 𝑄 + 𝑊; por ser un ciclo: ∆𝑈 = 0 = 𝑄 + 𝑊 Así, la cantidad de calor Q que aparece en nuestra ecuación será la suma algebraica, 𝑄 = 𝑄1 + 𝑄2 , proveniente de los dos focos caloríficos. La ecuación para el ciclo nos queda: 𝑄1 + 𝑄2 + 𝑊 = 0 Esta última ecuación debe ser reordenada, de acuerdo con nuestra intención, esto es que el sistema termodinámico produzca trabajo. En consecuencia, el signo de W es negativo así podemos reescribir la ecuación: 𝑸𝟏 + 𝑸𝟐 = −𝑾 Ecuación 22 Las posibles construcciones de los focos caloríficos 𝐹1 y 𝐹2 con nuestro sistema, serán dadas por las alternativas que ofrezcan los signos de las cantidades 𝑄1 y 𝑄2 . Veamos cuales son estas alternativas: Los valores de Q1 y Q2 son positivos (Q1 > 0 y Q2 > 0). Por consiguiente los dos focos caloríficos F1 y F2 ceden calor al sistema. Estos dos focos caloríficos pueden ser sustituidos por un solo foco calorífico, F3, que ceda la cantidad de calor correspondiente a la suma Q1 más Q2. Esta simplificación convierte este proceso en una transformación cíclica monotérmica, analizada en la sección anterior por el enunciado de Kelvin-Planck y cuyo resultado nos dice que el sistema no puede realizar trabajo sobre los alrededores. Para el caso de Q1 < 0 y Q2 > 0 y de │Q2│> │Q1│. La construcción de este motor implicaría, en un balance general, el traslado de calor de un foco frío de temperatura T 2 a un foco caliente de temperatura T1 y además, la realización de trabajo por parte del sistema sobre los alrededores. En la experiencia real estos dos procesos no se dan simultáneamente: no es posible que nuestro sistema, de manera espontánea, pase calor de una fuente fría a otra caliente y realice un trabajo sobre los alrededores. La última posibilidad que nos queda es: Q1 > 0 y Q2 < 0 con la condición de: 𝑇1 > 𝑇2 . Este es el último caso por analizar y es el único posible para construir un motor térmico. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA La diferencia entre el calor absorbido del foco F1 y el calor cedido al foco F2 es Q1 - Q2, es convertida totalmente en trabajo, -W, que se ejerce sobre los alrededores. En este proceso es necesario tener dos focos térmicos con diferentes temperaturas, para que espontáneamente el motor térmico tome calor del foco caliente y lo ceda al foco frío. Figura 3: Diagrama de flujo de energía para la máquina térmica En esta máquina térmica que acabamos de diseñar, nos interesa conocer la eficiencia con la cual transforma la energía que recibe. La eficiencia de la máquina será el cociente entre el calor absorbido Q1, y el trabajo realizado, W. La eficiencia o rendimiento térmico es representada por η. Así, nos queda que: W Q1 Ecuación 23 EL CICLO DE CARNOT El resumen de los conceptos expuestos en los dos numerales anteriores nos lleva a concluir que: en todo proceso cíclico donde se pretenda realizar un trabajo sobre los alrededores, son necesarios dos focos térmicos con diferentes temperaturas; y, que la diferencia entre el calor absorbido y el cedido se transforma en trabajo. Con estas dos premisas se puede elaborar el modelo de una máquina térmica. Desde el punto de vista histórico, la primera máquina que se desarrolló fue la llamada máquina de Carnot. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Ejemplo 41 En el diagrama que se muestra a continuación aparece representado un refrigerador térmico que tiene las siguientes condiciones de operación: 𝑇1 > 𝑇2 y 𝑄2 = −𝑄1 Aplique la primera ley al proceso y diga si se puede diseñar una máquina que cumpla con el flujo de energía que se presenta en el esquema. Figura 4: Esquema de un refrigerador térmico Análisis del problema La primera ley de la termodinámica nos dice que: ∆𝑈 = 𝑄 + 𝑊. En el esquema, no parece que el sistema termodinámico o motor reciba o ceda trabajo a los alrededores, luego 𝑊 = 0 y ∆𝑈 = 𝑄; en donde 𝑄 es la variación de calor: 𝑄 = 𝑄1 − 𝑄2 , calor ganado menos calor cedido. Solución del problema Como 𝑄1 = 𝑄2 , entonces queda que ∆𝑈 = 0. El motor térmico no sufre cambio en su energía interna. El efecto neto de proceso ejecutado por el sistema sería el de llevar calor de una fuente fría 𝐹2 a una fuente caliente 𝐹1 , lo cual no es posible. Como respuesta al problema se puede concluir que la variación de energía interna para el motor térmico es nula y que dicho motor no se puede construir, no es un motor real. Hay que dejar claramente establecido que esta máquina es un modelo netamente teórico, en donde no tienen cabida los fenómenos propios de la vida real, como son la fricción, la radiación de calor, etc., y en consecuencia se debe tomar en cuenta únicamente, los fundamentos termodinámicos del proceso en el cual se basa la máquina de Carnot. El proceso cíclico de la máquina de Carnot se conoce como el ciclo de Camot y su fundamento es el siguiente: trabaja con dos focos de diferente temperatura T 1 y T2 y el proceso es totalmente reversible; esto exige que la ganancia y la cesión de calor sigan una UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA trayectoria isotérmica y que el paso entre un foco y otro sea una trayectoria adiabática. El instrumento físico para estudiar el ciclo de Carnot será un gas Ideal encerrado dentro de un cilindro con un pistón móvil. Como se habla de realizar un trabajo, es decir, de realizar una variación en las propiedades termodinámicas de presión y volumen, es lógico escoger el diagrama P-V para representar el ciclo de Carnot. El ciclo de Carnot tiene las siguientes etapas: a) Punto 1 2. Expansión isotérmica a la temperatura T1: calor absorbido Q1 >0. b) Punto 2 3. Expansión adiabática de T1 a T2. Variación de calor Q = O c) Punto 3 4. Compresión isotérmica a la temperatura T2: calor cedido Q2 < 0. d) Punto 4 1. Compresión adiabática de T2 a T1. Variación de calor Q = O. Figura 5: Trayectoria cíclica de una máquina térmica que sigue el ciclo de Carnot El ciclo de Carnot representado en los pasos sucesivos del mecanismo propuesto por las trayectorias termodinámicas se muestra en la Figura 6. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Figura 6: Representación gráfica de un pistón que sigue la trayectoria del ciclo de Carnot. La explicación de los pasos que constituyen el ciclo es la siguiente: El pistón que encierra el gas a P1, V1 se desplaza cuando absorbe calor Q1 del foco que está a la temperatura T1 (trayectoria isotérmica T1). El desplazamiento se efectúa hasta llegar al punto 2 (P2, V2). En este momento se quita el contacto diatérmico con el foco y el pistón, por efecto de la inercia, continuará haciendo su expansión, pero en este caso adiabática (sin intercambio de calor) hasta llegar al punto 3 (P3, V3). Es obvio que la expansión adiabática ocasiona una disminución de la energía interna del gas, produciendo una disminución de la temperatura del mismo al llevarla de T1 a T2. En el punto 3 el cilindro se pone en contacto con el foco a temperatura T 2 y lentamente este le va quitando calor, Q2 lo que se traducirá en una compresión isotérmica, esto es en una reducción de volumen para llevarlo al punto 4 (P4, V4). La inercia que trae el pistón al llegar al punto 4, es aprovechada para retirar el foco de T2 y hacer una compresión adiabática Q = O, la cual se traducirá en un aumento de energía interna ∆U manifestada por el paso de la temperatura T2 a T1, punto en el cual el sistema termodinámico vuelve a las condiciones iniciales y completa su ciclo. Después de estudiar el ciclo nos queda por calcular la cantidad de trabajo realizado por el sistema hacia los alrededores. Obviamente la diferencia de energía, calor ganado menos calor cedido, será la cantidad de trabajo -W realizada por el sistema o motor térmico. Por consiguiente, tenemos: El primer principio de la termodinámica: ∆𝑈 = 𝑄 + 𝑊 Por ser un proceso cíclico: ∆𝑈 = 0 = 𝑄 + 𝑊 𝑄 = 𝑄1 − 𝑄2 Luego: −𝑊 = 𝑄1 − 𝑄2 = ∮ −𝑃𝑑𝑉 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA El rendimiento térmico de la máquina: 𝜼= 𝑾 𝑸𝟏 = 𝑸𝟏 −𝑸𝟐 Ecuación 24 𝑸𝟏 Para el caso particular de un gas ideal la ecuación 6 puede ser expresada en función de las temperaturas T1 y T2 de los focos térmicos. La ecuación 181, del rendimiento térmico de la máquina, las cantidades Q1 y Q2 pueden expresarse en función de los volúmenes iniciales y finales para cada uno de los procesos. Así, tenemos: 𝑉2 𝑄1 = 𝑊1 = 𝑛. 𝑅. 𝑇1 . 𝑙𝑛 ( ) 𝑉1 𝑉2 𝑄2 = 𝑊2 = 𝑛. 𝑅. 𝑇2 . 𝑙𝑛 ( ) 𝑉1 Reemplazando en η de la ecuación 181: 𝜂= 𝜼= 𝑉 𝑉 𝑛. 𝑅. 𝑇1 . 𝑙𝑛 (𝑉2 ) − 𝑛. 𝑅. 𝑇2 . 𝑙𝑛 (𝑉2 ) 1 1 𝑉 𝑛. 𝑅. 𝑇1 . 𝑙𝑛 (𝑉2 ) 1 𝑽 𝑽 𝑻𝟏 .𝒍𝒏( 𝟐 )−𝑻𝟐 .𝒍𝒏( 𝟐 ) 𝑽𝟏 𝑽𝟏 𝑽 𝑻𝟏 .𝒍𝒏( 𝟐 ) 𝑽𝟏 Ecuación 25 En esta última ecuación el rendimiento térmico de la máquina es una función de las temperaturas de las trayectorias isotérmicas T1 y T2 y de los volúmenes V1, V2, V3, y V4, en los cuales se interceptan las trayectorias isotérmicas y adiabáticas. Teniendo en cuenta que: 𝛾−1 𝑇1 . 𝑉2 𝛾−1 = 𝑇2 . 𝑉3 𝛾−1 y 𝑇1. 𝑉1 𝛾−1 = 𝑇2 . 𝑉4 Dividiendo miembro a miembro en estas dos ecuaciones: 𝑽𝟐 𝑽𝟏 = 𝑽𝟑 Ecuación 26 𝑽𝟒 Reemplazando en la ecuación 7 los volúmenes hallados por la relación de volúmenes de la ecuación 8, y efectuando las debidas simplificaciones, nos queda: 𝜼= 𝑸𝟏 −𝑸𝟐 𝑸𝟏 = 𝑻𝟏 −𝑻𝟐 𝑻𝟏 Ecuación 27 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA La aclaración que debe hacerse a la ecuación 9, es que las temperaturas deben expresarse en grados Kelvin. Existen numerosas máquinas cuyo intercambio energético puede estudiarse tomando como modelo el ciclo de Carnot. Para un ejemplo de la vida práctica, basta considerar la carga y la descarga de una pila recargable (proceso reversible), con sus trayectorias adiabáticas e isotérmicas, o bien, el funcionamiento de la máquina de vapor donde se tiene la isoterma de la caldera; en donde se produce el vapor por calentamiento de agua (temperatura mayor); y la isoterma del condensador de menor temperatura; los procesos adiabáticos en la máquina de vapor corresponden a las llamadas carreras de trabajo que realiza el pistón para mover la rueda de la misma. Ejemplo 42 En la construcción de una máquina térmica se utilizaron dos focos compuestos por una masa de agua a diferentes temperaturas. El foco caliente tiene agua a 80°C, mientras que en el foco frío la temperatura es de 30°C. Calcule cuál sería el rendimiento total de la máquina térmica hasta cuando la temperatura del foco caliente sea igual a la temperatura del foco frío. Figura 7: Esquema de una máquina térmica Análisis del problema La situación que aquí se plantea es diferente a la que se ha expuesto en el ciclo de Carnot. En dicho ciclo las temperaturas de los focos permanecen constantes, con el objeto de simplificar los cálculos. En el problema planteado, dicha diferencia de UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA temperatura no es constante. La cesión de calor del foco caliente al sistema, lo va enfriando paulatinamente a aquel, a medida que efectúa dicha cesión de calor. En este ciclo el rendimiento siempre será una función de las temperaturas de los focos caliente y frío. De esta manera podemos comprender cómo a medida que se cede el calor va disminuyendo la temperatura del foco caliente, hasta llegar a la temperatura del foco frío, momento en el cual se detiene la máquina ya que no puede extraer más energía. Por supuesto, hay que hacer la aclaración de que la masa del foco frío es tan grande que el calor proveniente del sistema no altera su temperatura. Solución del problema El rendimiento en cada ciclo de Carnot viene expresado por: 𝜂= 𝑊 𝑊 = 𝑄1 𝑄1 En cada pequeño ciclo en donde se varíe infinitesimalmente el calor cedido al sistema la ecuación que nos presenta esta alteración será: 𝛿𝑤 = 𝜂. 𝛿𝑄 En donde el rendimiento 𝜂 estará expresado por las temperaturas 𝑇 y 𝑇2 que se van representando en cada momento, luego: 𝛿𝑤 = 𝑇 − 𝑇2 . 𝛿𝑄 𝑇 El reemplazo que debe hacerse aquí, será buscar una ecuación en la cual el calor sea una función de la temperatura: 𝑄 = 𝑚. 𝐶𝑝. ∆𝑇, y así: 𝛿𝑄 = 𝑚. 𝐶𝑝. 𝑑𝑇 Luego nos queda: 𝛿𝑤 = 𝑇 − 𝑇2 . 𝑚. 𝐶𝑝. 𝑑𝑇 𝑇 El trabajo total, W, realizado será la integral de la ecuación antes expuesta, cuyos límites de integración serán las temperaturas T1 y T2 iniciales. Teniendo en cuenta que es un proceso de enfriamiento: T2 T T 2 W 1 .m.C P .dT T1 T T1 T W 1 2 .m.C P .dT T2 T1 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA T W m.C P T1 T2 m.C P .T2 .Ln 1 T2 El calor cedido por el foco caliente es: 𝑄 = 𝑚. 𝐶𝑝. (𝑇1 − 𝑇2 ) Por consiguiente el rendimiento total, ηt, para la máquina térmica es: T m.C P T1 T2 m.C P .T2 .Ln 1 W T2 t Q m.C P .T1 T2 t T T1 W 303 353 1 .Ln 1 1 .Ln Q T1 T2 50 303 T2 t 1 0.93 0.07 El rendimiento total para la máquina térmica expresado en porcentaje será de un 7%. Como se podrá observar el rendimiento es muy bajo y la máquina así diseñada sólo tiene interés para el estudio teórico. Cuando se quiera averiguar el rendimiento de una máquina térmica dada, éste nunca podrá sobrepasar el valor del rendimiento de la máquina de Carnot. La razón es muy sencilla: la serie de simplificaciones que se hacen en su construcción obliga a pensar que cualquier máquina real comparada con ella tendrá una serie de pérdidas de energía debidas a fricción, disipación térmica, escape de gases, etc., que hacen que la energía disponible para efectuar trabajo sea menor y de ahí, su rendimiento también será menor. El efectuar estos cálculos y compararlos con la máquina de Carnot nos permite conocer qué tan bien está construida la máquina, en la medida que su rendimiento se acerca al de la máquina de Carnot. Lección 18: Segunda ley de la termodinámica (Continuación) El Ciclo de Carnot Inverso El ciclo de Carnot que acabamos de estudiar es el fundamento de toda máquina que toma energía y produce trabajo mecánico; pero también es importante el proceso contrario; es decir, el proceso de refrigeración. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Si examinamos globalmente el ciclo de Carnot vemos cómo nuestro sistema (motor térmico) toma una cantidad de calor del foco caliente, pasando parte de él al foco frío y convirtiendo el resto en trabajo. En la refrigeración sucede exactamente lo contrario, esto es, se toma calor de un foco frío, se le suministra trabajo al sistema y estas dos energías se ceden a un foco caliente. El sistema termodinámico que efectúa esta operación recibe el nombre de refrigerador de Carnot. Figura 8: Diagrama de flujo de energía para un refrigerador de Carnot Para hacer el estudio de la variación de energía interna para el sistema hay que tener en cuenta que el sistema opera en ciclo y, por lo tanto, la variación de energía interna será cero para el ciclo. Así tenemos: ∆𝑈 = 𝑄1 + 𝑊– 𝑄2 = 0 𝑸𝟏 + 𝑾 = 𝑸𝟐 Ecuación 28 Para el ciclo de refrigeración podemos definir, también, un rendimiento del proceso, η, como el cociente: 𝜂= 𝑄1 𝑊 Esta relación de eficiencia para el refrigerador nos mostrará qué tan bien se aprovecha el suministro de trabajo, 𝑊, en la extracción de calor Q1, del foco frío. La refrigeración es un método de conservación muy utilizado y de ahí la importancia en comprender el proceso global del mismo y los flujos e intercambios de energía. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA En forma general, de este proceso termodinámico se deduce un principio o enunciado que constituye uno de los aspectos que implica la segunda ley de la termodinámica. El enunciado es de Clausius y nos dice: “No existe ningún proceso espontáneo y no es posible construir una máquina, cuyo único resultado sea el paso de calor de un foco frío a otro caliente”. Al traducir este enunciado a nuestra forma corriente de ver los fenómenos, se podría afirmar que los cuerpos calientes espontáneamente (sin la presencia de otro agente) tienden a ceder calor a los cuerpos fríos y para realizar el proceso contrario, es necesario colocar una máquina (refrigerador) a la cual se le suministre trabajo. El enunciado de Kelvin-Planck y el de Clausius son totalmente equivalentes. El análisis teórico de los rendimientos de las máquinas térmicas y de los refrigeradores permite postular un teorema muy importante, llamado el teorema de Camot, que dice que cualquier máquina real o teórica que opere entre dos focos térmicos de diferente temperatura, tendrá un rendimiento menor o igual al rendimiento de la máquina de Carnot respectiva. Es necesario hacer énfasis en estos enunciados y teoremas tan sencillos y de una utilidad tan marcada. Su correcto uso permitirá conocer los flujos de energía entre nuestro sistema termodinámico y los focos térmicos, los valores de dichos intercambios de energía y las condiciones termodinámicas necesarias para realizar el proceso termodinámico. Este ciclo consta de cuatro procesos reversibles: 1. Compresión adiabática o isentrópica de 1 a 2 2. Compresión isotérmica de 2 a 3 3. Expansión adiabática o isentrópica de 3 a 4 4. Expansión isotérmica de 4 a 1 Los anteriores procesos se muestran en los diagramas Pv y Ts de la figura 75. El ciclo inverso de Carnot solo tiene importancia teórica ya que en la práctica es difícil realizar tales procesos pero su coeficiente de operación sirve como referencia para comparar el rendimiento de otros ciclos. En el diagrama Ts, los procesos adiabáticos corresponden a líneas rectas de entropía constante, limitadas por las líneas isotermas. El área encerrada entre estas líneas representa el calor intercambiado durante el ciclo. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Figura 9: Ciclo inverso de Carnot Ejemplo 43 El motor de un refrigerador de Carnot (también llamado ideal) tiene una potencia de 100 W. La temperatura exterior al refrigerador es de 45°C. ¿Cuánto tiempo demorará el refrigerador en congelar 4 kg de agua, paso de agua líquida a hielo a la temperatura de 0°C, sabiendo que el calor de fusión del hielo es de 80 cal/g? Análisis del problema Este es un ejemplo en el cual se utiliza un refrigerador. El uso dado es producir hielo a la temperatura de 0°C. El paso de agua a hielo requiere extraer energía en una cantidad de calor igual a 80 cal/gr., este calor se conoce como calor de fusión o de congelación, según sea el sentido del proceso. Así, el calor quitado al hielo, Q1, por el motor que tiene una potencia de 100 W, será trasladado junto a la fuente caliente a 45°C. Hay que recordar el significado de potencia en física, definido como, P = W/t, en donde P es potencia, W es trabajo y es tiempo. Solución del problema Vimos como para el refrigerador que trabaja en ciclo ∆𝑈 = 0 y, por lo tanto: 𝑄1 + 𝑊 = 𝑄2 . Por definición: 𝜂 = 𝑄1 𝑊 =𝑄 𝑄1 2 −𝑄1 . En este caso, al igual que en la máquina térmica de Carnot, los calores Q1 y Q2 pueden ser expresados en función de las temperaturas de sus focos, y al hacer la consideración de que las capacidades caloríficas Cp sean iguales, nos quedaría: 𝜂= 𝑄1 𝑇1 = 𝑄2 − 𝑄1 𝑇2 − 𝑇1 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Esta última ecuación es muy útil puesto que η se expresa en función de las temperaturas de los locos fríos y calientes, fácilmente medibles. Así, tenemos: 273.16 K 273.16 K 6.07 318.16 K 273.16 K 45.0 K La cantidad de calor que se retira para formar el hielo, Q1, será: 𝑄1 = 4000𝑔 (80 Sabiendo que: 6.07 Entonces: W Q1 𝑐𝑎𝑙 𝐽 ) 4.184 = 1338880𝐽 𝑔 𝑐𝑎𝑙 Q1 W 1338880 J 220.6 KJ 6.07 El tiempo necesario será: t W 220600 J 2206s 36m,46s P 100W De aquí se puede concluir que los cambios de estado (paso de líquido a sólido) que se llevan a cabo a una temperatura fija requieren de un intercambio de energía (calor) y de la relación que tiene la potencia de una máquina para calcular el trabajo suministrado. Teorema Clausius Este segundo enunciado establece que no es posible construir un dispositivo que funcionando en forma cíclica su único efecto sea conducir calor de una fuente térmica a baja temperatura hacia otra de mayor temperatura. En otras palabras la segunda ley establece que no es posible que el calor se transfiera desde una temperatura baja a otra más alta, es decir fija la dirección en la cual se presenta en forma espontánea la transferencia de calor. Para llevar calor desde Tf (temperatura baja) hasta Tc (temperatura alta) se requiere suministrar energía en forma de trabajo como se ilustra en la figura 76, mediante dispositivos conocidos como refrigeradores o bombas de calor. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Figura 10: Bomba térmica o refrigerador Un refrigerador es un dispositivo que funciona en forma cíclica realizando trabajo sobre un fluido conocido como refrigerante con el objeto de retirar calor (enfriar) de una fuente a baja temperatura y conducirlo a una fuente de mayor temperatura. El ciclo de refrigeración más generalizado es el ciclo de refrigeración por compresión de vapor el cual se ilustra en forma esquemática en la figura 76, allí se pueden distinguir cuatro componentes: el compresor, el condensador, la válvula de expansión y el evaporador. El refrigerante entra al compresor como vapor donde se comprime hasta alcanzar temperatura y presión más altas, luego pasa al condensador donde al libera calor el refrigerante se enfría y condensa. En seguida el líquido formado pasa a través de la válvula de expansión en donde la presión y la temperatura descienden drásticamente por el efecto de estrangulamiento. Finalmente el refrigerante a baja temperatura entra al evaporador, región donde se realiza la refrigeración, debido a la absorción de calor que implica toda evaporación. Para completar el ciclo el vapor producido pasa nuevamente al compresor. La eficiencia de un refrigerador se expresa en términos del coeficiente de operación COP, aplicando el concepto de eficiencia planteado para una máquina térmica, se puede deducir el coeficiente de operación como una relación entre el calor retirado del sitio de refrigeración y el trabajo suministrado durante el ciclo. COP Qf Ws Ecuación 162 Ws indica la magnitud del trabajo que se suministra al sistema. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Figura 11: Componentes de un refrigerador por compresión de vapor Una bomba de calor tiene como propósito proporcionar calor a un sitio que se encuentra a una temperatura más alta que la fuente de donde se extrae el calor. Funciona con el mismo ciclo que un refrigerador con la diferencia que el calor que interesa es Qc o sea el calor transferido a la fuente de mayor temperatura. El coeficiente de operación para una bomba de calor se expresa en los siguientes términos: COPBC Qc Ws Ecuación 163 Ejemplo 44 Determine la eficiencia y el trabajo producido por una máquina que trabaja en forma cíclica, la cual recibe de una fuente a temperatura alta 100000 kcal y cede 80000 kcal a otra de temperatura menor. Figura 12: Datos del ejemplo UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Análisis del problema El trabajo producido está dado por la diferencia entre el calor recibido y el calor cedido. Teniendo el trabajo se puede halla la relación entre éste y el calor recibido. Otra forma alternativa completamente equivalente consiste en determinar primero la eficiencia y luego el trabajo. Solución del problema W Qc Q f 100000 kcal 80000 kcal 20000 kacl 20000 kcal W 0.20 Qc 100000 kcal Ejemplo 45 Determine la potencia que debe tener el compresor de un sistema de refrigeración si se desea congelar en 5 minutos 1 kg de agua que se encuentra a temperatura de 25 ºC. Si el coeficiente de operación del refrigerador es de 3.0. Figura 13: Datos del ejemplo Análisis del problema La potencia es igual al trabajo sobre el tiempo. Como se conoce el coeficiente de operación del refrigerador, solo es necesario calcular la cantidad de calor que se requiere retirar. Para el agua se conoce el calor específico y el calor latente de fusión. Entonces primero se deben calcular estas cantidades. Solución del problema Q f Qsencible Qlatente Qsencible mc p t 1000 g (1.0 cal )(25º C ) 25000 cal g.º C Qlatente m(h fusión ) 1000 g (79.7 cal ) 79700 cal g UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Q f 25000cal 79700cal 104700 cal Ws Qf COP 104700 4.187 J 34900cal 146126 J 3.0 1cal . 146126 J P 487 wat s 5 min( 60 ) min Ejemplo 46 Para mantener un recinto caliente se necesita proporcionar 360000 kcal/h, lo cual se logra utilizando una bomba de calor que tiene un coeficiente de operación de 2.4 y extrae calor del aire frío. Determine la potencia consumida y la cantidad de calor extraída por hora. Figura 14: Datos del ejemplo Análisis del problema La potencia que se debe suministrar a la bomba de calor se puede obtener a partir del coeficiente de operación y aplicando la primera ley se obtiene la cantidad de calor que sería necesario retirar de la fuente de baja temperatura. Solución del problema Ws Qc COPBC Q f Qc Ws 360000 Lección 19: Entropía kcal h 150000 kcal 2.4 h 360000 kcal kcal kcal 150000 210000 h h h UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA La entropía es la propiedad termodinámica que se encuentra asociada al estado de aleatoriedad de las partículas de un sistema, por ejemplo los gases tienen una entropía mayor que la los líquidos y éstos a su vez una entropía mayor que la los sólidos, ya que en los gases las moléculas se mueven libremente chocando unas con otras y con las paredes del recipiente que las contienen, siguiendo trayectorias al azar; en los líquidos, el movimiento es más restringido, se presentan deslizamientos de unas capas de moléculas sobre otras debido a las asociaciones intermoleculares características de este estado; en los sólidos no se presentan desplazamiento de las moléculas, ya que se encuentran fuertemente unidas unas con otra y solamente se presentan movimientos de vibración o rotación. Así entonces, los procesos de fusión y evaporación van acompañados de un aumento en el grado de distribución aleatorio de las moléculas y por lo tanto de un aumento de la entropía. En cualquier fase de un sistema, un aumento de la temperatura conlleva un aumento de la energía cinética molecular, un aumento en la incertidumbre de la posición de las moléculas en un determinado instante, lo que equivale a decir una aumento en la aleatoriedad en la distribución molecular y por consiguiente, un aumento también en su entropía. Por otra parte en todo proceso de mezcla hay aumento de entropía. Por estas razones la entropía se asocia al nivel de “desorden” o distribución al azar de sus elementos que se presenta en un sistema. La Entropía está fundamentada en la necesidad que tenemos de convertir calor en trabajo y como una conclusión es imposible convertir todo el calor absorbido por el sistema en trabajo. Obviamente, parte de ese calor se cede a un foco frío y esta es una energía que no podemos aprovechar en nuestro ciclo. Pero no hemos examinado qué sucede en el interior del sistema cuando realizamos dicho ciclo. Los cambios ocasionados por la absorción y cesión de energía deberán evidenciarse en sus propiedades termodinámicas P, V y T. Por consiguiente, el ciclo podrá representarse en un diagrama P - V, tal como lo muestra la figura 81. El sistema evoluciona reversiblemente, siguiendo la trayectoria A entre 1 y 2 y la B entre 2 y 1; para lo cual el teorema de Clausius nos dice que: QR T 0 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Figura 15: Ciclo en función de las propiedades termodinámicas P y V El subíndice A indica la reversibilidad del proceso. Esta ecuación puede descomponerse según las dos trayectorias que sigue el sistema; A y B: QR T QR 2 1( A) T QR 1 2( B ) T 0 Como la trayectoria B representa también un proceso reversible, se puede hacer el cambio en los límites de integración, así: 2 1( A) QR T 2 QR 1( B ) T Esta última ecuación nos dice que cualquiera que sea la trayectoria, A o B, el valor de QR T no varía, y que solo va a depender de los estados inicial y final del proceso. Por consiguiente, de las propiedades termodinámicas en el estado inicial y final del sistema se puede definir una nueva función termodinámica. Para el caso que estamos estudiando, la variación: 2 QR T 1 S 2 S1 Ecuación 29 En donde S representa la entropía del sistema en el estado 1 del proceso y S la entropía el mismo en el estado 2. Por lo tanto, se ha definido una nueva función termodinámica llamada entropía. La entropía es una función de estado del sistema cuya variación viene dada por el valor de la integral QR T ; para un proceso irreversible. Una consecuencia que se deriva del teorema de Clausius es que para un proceso cíclico reversible la variación de entropía es cero. De otra parte, la ecuación 14 presenta una integral para definir la función termodinámica entropía y como corresponde a este tipo de ecuaciones su diferencial deberá ser exacta, luego: QR T dS Ecuación 30 En esta ecuación aún aparece el calor como una diferencial inexacta, 𝛿𝑄. Este problema se resuelve dado que el inverso de la temperatura, 1/T, es el factor integrante, lo cual convierte a 𝛿𝑄 en la diferencial exacta 𝑑𝑆. La entropía no reemplaza a las funciones termodinámicas de entalpía y energía interna anteriormente mencionadas. De hecho, la primera ley de la termodinámica indica que UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA cualquier cambio en la energía del sistema considerado, va a afectar a la energía interna del mismo y como la entalpía representa una forma de calcular el cambio de energía a una condición de presión constante para el proceso termodinámico; pero como se puede observar en la ecuación de la definición de entalpía (𝐻 = 𝑈 + 𝑃. 𝑉), ésta está referida a la energía interna del sistema. Al recordar los enunciados de Kelvin-Planck y de Clausius, la entropía nos indica claramente que el calor que posee un sistema no puede ser convertido íntegramente en trabajo y siempre habrá una pequeña fracción de calor cedida a los alrededores o a otro sistema, según el caso y que este calor cedido se llama entropía. Se podrá pensar que el calor no convertido en trabajo pudiera ser empleado por otra máquina para producir trabajo y tratar de lograr el mayor porcentaje de conversión posible. Este planteamiento es cierto; pero hay que recordar que en cada ciclo siempre quedará una pequeña fracción de calor que no es convertida en trabajo. De otro lado, el enunciado de Clausius es más exigente todavía: obliga a que el foco caliente ceda calor al foco frío de una manera espontánea. Esto quiere decir que nuestros procesos tienen una dirección claramente marcada: el enfriamiento del foco caliente y el calentamiento del foco frío, producen, al cabo del tiempo, un aumento de entropía. Esto conlleva a lo que se ha llamado la muerte entrópica del universo. Dicho en otras palabras, es un estado en el cual todos los cuerpos tendrán la misma temperatura. Se habla de muerte porque en ese momento no habría diferencia de temperatura (entre dos cuerpos) utilizable para producir un trabajo. La tendencia al desorden con el concepto de entropía y la relación desde el punto de vista termodinámico no es inmediata. En termodinámica clásica, la entropía mide la energía que no se puede utilizar y que obliga al intercambio de calor, hasta alcanzar una temperatura uniforme para todos los cuerpos. Pero antes de llegar a este punto, tenemos focos calientes y focos fríos, que pueden estar revueltos unos con otros; si quisiéramos colocar los fríos en un lado y los calientes en otro (ordenarlos), sería necesario gastar cierta cantidad de energía que llamamos entropía. Es en este sentido que podemos asociar a la entropía con el desorden. En la termodinámica estadística, la función entropía tiene un mejor desarrollo conceptual: el hecho de tener pequeñas canicas en movimiento perpetuo (moléculas) obliga a que en promedio todas tengan la misma energía cinética, ya que todas las moléculas ocupen en promedio todo el espacio disponible para su movimiento; por ejemplo, no puede presentarse la situación de que, espontáneamente, las moléculas que componen el aire se coloquen todas en un rincón de una habitación y dejen el resto en un perfecto vacío. La visión macroscópica del hecho de que todas las moléculas tengan la misma energía cinética, se muestra en la obligación que hay de ceder calor de un cuerpo caliente a otro frío; y en segundo lugar, la tendencia que tienen las moléculas de ocupar todo el espacio disponible, se muestra en la expansión de un gas por todo el espacio de un recipiente. Esta es pues, la descripción microscópica y macroscópica de la función entropía. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA CAMBIOS DE ENTROPÍA EN PROCESOS REVERSIBLES Todos los casos que vamos a considerar aquí corresponden a esta condición de reversibilidad, para de esta manera, desarrollar las ecuaciones que nos permitan calcular los cambios de entropía en las transformaciones energéticas del sistema. Transformaciones adiabáticas Como su nombre lo indica este proceso implica 𝛿𝑄 = 0. Luego: S 2 S1 adiabático 1 QR 2 T 0 Ecuación 31 En consecuencia la entropía permanece constante y este tipo de procesos adiabáticos reciben el nombre de isentrópicos. Transformaciones isotérmicas Los procesos isotérmicos son muy importantes en termodinámica, ya vimos como el ciclo de Carnot utiliza dos isotermas para tomar o ceder calor. Los cálculos son: S 2 S1 T 1 QR T 2 Q 1 2 QR R T 1 T Esta ecuación implica que cuando 𝑄 > 0, la variación de entropía (S2 – S1)T será también mayor que cero, y el sistema aumenta su entropía. El proceso inverso nos muestra que si 𝑄 < 0 y (S2 – S1)T < 0, el sistema disminuye su entropía. Existen procesos en los cuales el sistema absorbe calor y mantiene su temperatura constante, son los llamados cambios de fase. El paso de sólido a líquido para el agua se realiza a temperatura constante de 0°C cuando la presión es de una atmósfera; lo mismo sucede para los cambios de líquido a vapor y sólido a vapor. Los procesos contrarios también se realizan a temperatura constante y, en general, se conocen con los nombres de fusión, solidificación, vaporización, licuefacción, sublimación, etc. Los cambios de calor son típicamente cambios de entropía y así tenemos: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA S 2 S1 T Q L T T Ecuación 32 En donde L es el calor de cambio de fase. Transformaciones a volumen constante (isocóricas o isostéricas) que conllevan cambio en la temperatura. El calor involucrado en este proceso, expresado en forma diferencial, es: δQ = CV.dT, luego: S 2 S1 V 1 CV . dT T 2 Ecuación 33 La solución matemática de esta ecuación depende del comportamiento de Cv con la temperatura. Para el caso de que Cv sea independiente de la temperatura: S 2 S1 V CV . 2 1 T dT CV . ln 2 T T1 Ecuación 34 Para el caso de que Cv sea dependiente de la temperatura, se toma la ecuación del virial para la variación de Cv en función de T: 𝐶𝑉 = 𝛼 + 𝛽𝑇 + 𝛾𝑇 2 S 2 S1 V 1 T .dT . ln T2 T2 T1 T22 T12 T 2 T 2 1 Ecuación 35 Transformaciones a presión constante (isobáricas) con variación de la temperatura El desarrollo matemático para esta transformación es similar al anterior. El calor involucrado es 𝛿𝑄 = 𝐶𝑝. 𝑑𝑇, con lo cual queda: S 2 S1 P 1 C P . QR T 2 Ecuación 36 Si Cp es independiente de la temperatura: S 2 S1 P C P . 2 1 QR T C P . ln 2 T T1 Ecuación 37 Si es dependiente de la temperatura y 𝐶𝑃 = 𝛼 + 𝛽𝑇 + 𝛾𝑇 2 , entonces: S 2 S1 P T ' '.Ln 2 ' T2 T1 T22 T12 2 T1 Ec. 8Ecuación 38 Transformaciones en gases ideales donde varían simultáneamente: a) Volumen y temperatura UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA T2 C .dT P.dV T V S 2T2 ,V2 S1T1 ,V1 V CV .Ln 2 n.R. ln 2 T1 T T1 V1 Ec. 9Ecuación 39 Para hallar la ecuación 9 hemos supuesto que Cv constante. Esta ecuación puede ser reordenada colocando los subíndices a uno y otro lado. Se debe tener en cuenta que de aquí en adelante se va a trabajar con un mol de sustancia, por consiguiente 𝑛 = 1: S 2 CV . ln T2 R. ln V2 S1 CV . ln T1 R. ln V1 Esta reordenación de la ecuación 9 nos permite plantear la posibilidad de elegir más condiciones de S, T y V para establecer una entropía de referencia para calcular los cambios entrópicos como una función de T y V. Si se denomina S a la entropía de referencia a la temperatura T* (*se refiere a las condiciones de referencia) y V la ecuación 9 se transforma en: 𝑆 = 𝐶𝑉 . 𝑙𝑛𝑇 + 𝑅. 𝑙𝑛 𝑉 + (𝑆 ∗ − 𝐶𝑉 . 𝑙𝑛𝑇 ∗ − 𝑅. 𝑙𝑛𝑉 ∗ ) 𝑺 = 𝑪𝑽 + 𝑹. 𝒍𝒏𝑽 + 𝑺𝟎 Ecuación 40 Nos permite calcular y representar la entropía en tablas, referida a un estado determinado. b) Presión y temperatura: T2 S 2T2 , P2 S1T1 , P1 T1 C P .dT V .dP T Tomando G independiente de la temperatura: T P S 2T2 , P2 S1T1 , P1 C P .Ln 2 n.R. ln 2 T1 P1 Ecuación 41 c) Presión y volumen V P S 2V2 , P2 S1V1 , P1 C P . ln 2 CV . ln 2 V1 P1 Ecuación 42 La solución matemática de esta última ecuación es un tanto tediosa y no se justifica para 𝑃.𝑉 nuestros-fines; pero el tratamiento implica el reemplazo de 𝑇 = 𝑛.𝑅, y la relación de capacidades caloríficas: 𝐶𝑃 − 𝐶𝑉 = 𝑛. 𝑅, para calcular los cambios de calor y posteriormente hacer la integración. Lógicamente se sigue manteniendo el criterio de que Cp y Cv son independientes de la temperatura en el intervalo considerado. Ejemplo 47 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Calcule la variación de entropía para el calentamiento de 1 mol de agua en las condiciones: 𝐻2 𝑂(𝑙,273 𝐾,1 𝑎𝑡𝑚) 𝐻2 𝑂(𝑣,473 𝐾,3 𝑎𝑡𝑚) Considérense los siguientes datos para la resolución del problema: 1. El agua líquida mantiene su densidad constante y una capacidad calorífica 𝐽 también constante, 𝐶𝑃 = 75.3 𝑚𝑜𝑙.𝐾. 2. Calor de vaporización molar: ∆𝐻𝑉(𝐻2 𝑂, 373𝐾) 𝐽 = 40292 𝑚𝑜𝑙. 3. El vapor de agua se comporta como un gas ideal y su capacidad calorífica es: 𝐶𝑃 = 36.86 − 7.9𝑥10−3 𝑇 + 9.2𝑥10−6 𝑇 2. Análisis del problema El problema que aquí se presenta corresponde a un caso industrial, el calentamiento de agua. El proceso es interesante en sí mismo, dado que ocurre una serie continua de pasos en los cuales se aumenta la temperatura del agua, se cambia el estado de la misma (paso de líquido a vapor) y por último se calienta el vapor, con variación en la presión. Cada uno de estos procesos se debe analizar por separado para después calcular la variación de entropía total. Además de realizar estos cálculos en secuencia, observaremos cómo se relacionan íntimamente las funciones termodinámicas: entalpía y entropía. Solución del problema Sistema termodinámico = 1 mol de agua líquida, 273 K. Hagamos un esquema de la serie de pasos que se presentan en el problema: a. Calentamiento de agua líquida de 273 K a agua líquida de 373 K. (Los decimales que expresan 0°C en grados Kelvin 273.16 muchas veces no se tienen en cuenta, para facilitar los cálculos). Este calor absorbido por nuestro sistema a presión constante se llama calor sensible y se puede calcular así: 𝛿𝑄 = 𝐶𝑃 . 𝑑𝑇 En donde Cp es independiente de temperatura. Ahora bien, este aumento en entalpía tiene relación con el aumento de entropía del sistema; puesto que el proceso es reversible (se puede perder calor y llegar a las mismas condiciones iniciales sin sufrir ninguna alteración). Para calcular la variación de entalpía: Δ𝐻 = 𝐶𝑃 Δ𝑇, por ser Cp independiente de T. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Δ𝐻 = 75.3 𝐽 (373𝐾 − 273𝐾). 1𝑚𝑜𝑙 = 7530.0 𝐽 𝑚𝑜𝑙. 𝐾 Para calcular la variación de entropía, se va a utilizar la ecuación 6: T2 QR T1 T S1 S 373K S 273K T2 T1 C P .dT J 373 75.3 ln mol T mol.K 273 S1 23.5 J K b. Transformación de agua líquida de 373 K a vapor, a temperatura constante. La temperatura a la cual se lleva esta transición, vaporización, es propia para la sustancia considerada, en este caso agua. Para la vaporización a presión constante: 𝐽 1𝑚𝑜𝑙 = 40292 𝐽 𝑚𝑜𝑙 Δ𝐻𝑉𝑎𝑝. = 𝑄𝑉𝑎𝑝. = 40292 A partir de la ecuación 2: Δ𝑆2 = Δ𝑆𝑉𝑎𝑝., Δ𝑆2 = Δ𝑆𝑉𝑎𝑝., 373𝐾 373𝐾 = = Δ𝐻𝑉𝑎𝑝. 𝑇 40292𝐽 𝐽 = 108.8 373𝐾 𝐾 𝐽 Recordemos que las unidades de entropía son 𝐾 o 𝑐𝑎𝑙 . 𝐾 c. En este momento tenemos agua en estado de vapor a la temperatura de 373 K; es necesario suministrar calor para elevar su temperatura hasta 473 K. Luego: T2 H C P .dT T1 Como es una función de la temperatura, por la segunda condición del problema: T2 H 36.86 7.9 x10 3 T 9.2 x10 6 T 2 .dT T1 T 9.2 x10 6 H 36.86 xT2 T1 7.9 x10 3 x ln 2 x T23 T13 3 T1 Δ𝐻 = 3686𝐽 − 0.0018𝐽 + 165.4𝐽 = 3851.4 𝐽 A partir de la ecuación 6, el cálculo para la variación de entropía ∆𝑆 será: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA T2 S 3 S 2, 473 S1, 373 T1 3 6 2 T2 36.86 7.9 x10 T 9.2 x10 T .dT C P .dT T1 T T Δ𝑆3 = 𝑆2, 473𝐾 − 𝑆1, = 8.3 373𝐾 Ec. 6 𝐽 𝐾 d. Finalmente, el último paso implica un aumento en la presión del vapor de agua, el cual veníamos trabajando a 1 atmósfera; luego efectuamos un proceso para llevarlo a una presión de 3 atmósferas, manteniendo la temperatura constante de 473 K. Este proceso sólo puede hacerse mediante una compresión isotérmica, y de esta manera, variamos P y V. Tomando la ecuación 11, se obtiene: V P S 4 S 2V2 , P2 S1V1 , P1 C P ln 2 Cv ln 2 V1 P1 Por tomarse el vapor de agua como un gas ideal y como la temperatura se mantiene constante: 𝑃1 . 𝑉1 = 𝑃2 . 𝑉2, y reemplazando en la ecuación anterior: S 4 C P ln P1 P P P CV . ln 2 C P ln 1 CV ln 1 P2 P1 P2 P2 S 4 C p CV . ln P1 P2 Aplicando la ecuación 7 de la segunda unidad: 𝐶𝑃 − 𝐶𝑉 = 𝑛. 𝑅 𝑃 Con lo que queda: Δ𝑆4 = 𝑛. 𝑅. 𝑙𝑛 (𝑃1 ) 2 S 4 1 mol x 8.3 J J 1 ln 9.1 mol.K 3 K La variación de entropía para este último paso es negativa, puesto que se ha realizado una compresión isotérmica. La variación total de entropía para el proceso será igual a la suma de las variaciones de cada uno de los pasos: Δ𝑆𝑇𝑜𝑡𝑎𝑙 = Δ𝑆1 + Δ𝑆2 + Δ𝑆3 + Δ𝑆4 Δ𝑆𝑇𝑜𝑡𝑎𝑙 = 23.5 𝐽 𝐽 𝐽 𝐽 + 108.0 + 8.3 − 9.1 𝐾 𝐾 𝐾 𝐾 Δ𝑆𝑇𝑜𝑡𝑎𝑙 = 130.7 𝐽 𝐾 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Como conclusiones a este problema: un proceso tan simple como el calentamiento de agua, puede implicar una serie de pasos que es necesario analizar, aislar y efectuar el cálculo para cada paso; las trayectorias termodinámicas deben ser perfectamente establecidas para poder escoger la ecuación adecuada y aplicarla correctamente al cálculo de la variación de energía; hay que tener mucho cuidado con el calentamiento o enfriamiento de sustancias, dado que pueden presentarse cambios de estado (también llamados cambios de fase) en los cuales se presentan intercambios de energía, pero la temperatura permanece constante; y toda variación de entalpía va correspondida por una variación de entropía. CÁLCULOS DE LA VARIACIÓN DE ENTROPÍA PARA PROCESOS IRREVERSIBLES Después de analizar los cambios de entropía para procesos reversibles, nos dedicaremos a realizar el mismo procedimiento para los irreversibles. Para ello debemos recordar que los procesos que ocurren en la naturaleza son irreversibles y, en consecuencia, pondremos una mayor atención en nuestro estudio para la comprensión y aplicación de los cálculos para esta clase de procesos. Para todos estos cálculos hay que tener en cuenta que la entropía es una función termodinámica de estado: es decir, en el cálculo de su variación sólo hay que considerar el estado inicial y final del proceso, sin que la trayectoria influya en ella. Como punto de partida para realizar el cálculo, se tomará la trayectoria reversible entre los estados inicial y final del proceso y a partir de ella calcular ∆𝑆 para el proceso irreversible. Lección 20: Entropía (continuación) CALENTAMIENTO IRREVERSIBLE DE UN SISTEMA TERMODINÁMICO Para el calentamiento irreversible se va a considerar que la temperatura del sistema es T la temperatura del foco T1, la capacidad calorífica del sistema es c y su masa m. Para facilitar el cálculo del flujo de calor tomamos T2 > T1 y la variación de calor se hace en forma reversible. Hay que recordar que la variación reversible de una magnitud dada, en este caso el calor, implica solamente el hecho de que el paso de calor sea en forma infinitesimal para llevar nuestro sistema de una temperatura T1 a T2 y la condición para un UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA proceso irreversible es que la variación de entropía del universo (sistema + alrededores) sea mayor que cero. Con estas dos aclaraciones ya podemos iniciar los cálculos: T2 S sistema T1 T2 m.c.dt T QR m.c. ln 2 T1 T T T1 Ecuación 43 Como el cociente T2/T1 es mayor que uno, por la condición de T2 > T1 la variación de entropía para el sistema es mayor que cero y, por consiguiente, positiva. Para calcular la variación de entropía del universo se debe considerar el ∆S para el foco térmico. Mientras que el sistema ganó calor, el foco térmico debió perderlo exactamente en la misma cantidad para cumplir con la primera ley de la termodinámica. Como la temperatura del foco térmico permanece constante, por su calidad de foco, tenemos: S foco T T Q m.c. 2 1 T2 T1 La variación de entropía del universo será: T S universo S foco S sistema m.c ln 2 T1 T1 1 0 T2 Ecuación 44 Esta última expresión se comprueba fácilmente que es mayor que cero al reemplazar T1 y T2 por valores cualesquiera. El proceso de calentamiento de un sistema nos deja varias conclusiones: el sistema, o cuerpo que se calienta, aumenta entropía; el foco que pierde calor disminuye su entropía; el conjunto sistema-foco, en el doble proceso calentamientoenfriamiento, aumenta entropía (∆Suniverso > 0); el cuerpo, sistema o foco que tenga una temperatura mayor está obligado a ceder calor a aquel que tiene una temperatura menor. Esta es la razón por la cual los cuerpos se calientan de una manera espontánea al ponerlos en contacto con otro cuerpo a mayor temperatura. EXPANSIÓN LIBRE DE UN GAS IDEAL El experimento de Joule de la expansión de un gas contra el vacío, nos muestra también el carácter de irreversibilidad de aquellos procesos en los cuales intervienen diferencias de presiones. La expansión libre consiste en abrir la llave que separa los compartimientos del gas y vacío y observar si el gas pasa hacia la parte que previamente se le ha hecho vacío, figura 82. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Figura 16: Esquema del experimento de Joule para la expansión libre La experiencia nos muestra que sí, que el gas trata de llenar todos los espacios vacíos, y que, además, el gas espontáneamente no vuelve a colocarse en el sitio original; es decir, no retorna a las condiciones del comienzo del experimento. En consecuencia el volumen ocupado por el gas V1 pasa a un volumen V2 en donde V2 > V1. La ley de la termodinámica nos dice que para la expansión libre, W = 0, Q = 0 y ∆U = 0, la energía interna del gas al final del proceso es la misma que al comienzo. Si no hay cambio en ∆U y Q = 0, podría llegar a pensarse que ∆S es igual a cero; pero no es así, los cálculos que se van a realizar así lo demuestran. La expansión libre del gas se puede asemejar a la expansión cuasi-estática isotérmica de un gas del volumen V1 al volumen V2. En esta expansión el gas absorbería una cierta cantidad de calor Q equivalente al trabajo W, que realiza el sistema durante la expansión, luego: S gas Para un gas ideal: P V2 P.dV Q W V1 T T T n.R.T V Reemplazando: V2 S gas V1 V2 dV V n.R.T .dV n.R. n.R. ln 2 0 V1 V T .V V1 Ecuación 45 Nuevamente, V2 > V1 y el valor de la ecuación 18 será mayor que cero. En consecuencia la entropía del gas aumenta. Como conclusiones de este experimento: el gas tiende a ocupar el mayor espacio posible, haciendo su distribución homogénea e todo el espacio; sistemas que posean una mayor presión que sus alrededores tiende a expandirse hasta que la presión interna sea igual a la externa; lo contrario también cierto, cuando la presión interna es menor que la exterior, el sistema se comprime hasta igualar las presiones; la expansión de un gas es un proceso irreversible, esto es, el gas por sí solo no va a ocupar el volumen inicial que tenía y dejar el restante vacío; y en los casos que acabamos de mencionar, la entropía del universo aumenta. Cuando dos sistemas interactúan mecánicamente por diferencia de presiones, el sistema que gana presión aumenta su entropía, mientras que el que disminuye su presión disminuye su entropía; pero la nueva situación obtenida: dos sistemas con igualdad en su presión dan un universo con mayor contenido entrópico. MEZCLA DE DOS GASES IDEALES UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA El caso que se va a considerar aquí puede aplicarse a la mezcla de dos líquidos de naturaleza diferente, o bien, a la mezcla de un sólido con un líquido. En estos procesos de mezcla hay también una variación de entropía que puede ser calculada para cada uno de los constituyentes en particular. Para el caso de la mezcla de dos gases ideales, es mucho más sencillo y facilita enormemente el cálculo de ∆S. La mezcla de los dos gases ideales está confinada en un cilindro en el cual existen dos membranas semipermeables (M1, y M2) que permiten el paso selectivo de una u otra molécula de acuerdo con el tipo de membrana, figura 83. Los gases están representados por esferas puntos. Figura 17: Separación de una mezcla de dos gases utilizando membranas semipermeables Los espacios A y B tienen el mismo volumen. Una de las membranas M1 se mueve sincrónica y simultáneamente con la tapa T. El desplazamiento de la tapa y de la membrana se hace lentamente, evitando fricciones. Al final cuando la tapa y la membrana hayan llegado a su posición final, los gases se habrán ubicado cada uno en el espacio A o en el B, según se lo permita la membrana semipermeable. Todo el proceso se ha realizado a temperatura constante y en cada instante del desplazamiento de la tapa y membrana las presiones están equilibradas y no es necesario aplicar un trabajo para separar los gases, por consiguiente, W = 0 y Q = 0; luego, para este caso particular la variación de entropía es ∆S = 0. Cabe preguntarnos si es posible separar dos gases sin hacer ningún trabajo y sin variar la entropía del universo, en un proceso reversible. ¿Qué objeto tiene colocar aquí este tipo de experimento si estamos hablando de procesos irreversibles? Este experimento muestra las ventajas de un experimento mental y las desventajas de la tecnología. El experimento en su constitución es válido, sin embargo, hasta ahora no se ha podido construir un material que logre separar átomos de dos gases, y por consiguiente este experimento es ideal. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Lo más común es tener dos gases diferentes en los recintos A y B de un cilindro separados por una pared. El volumen inicial de cada recinto es V1 y V2. Si se quita la pared que los separa, ambos gases se mezclarán el uno con el otro y el volumen ocupado por cada uno de ellos será V1 + V2. En este caso, parecido al anterior, sí se produce un aumento de entropía que puede calcularse como el de un proceso de expansión de cada uno de los gases que pasan de un volumen V2 a (V1 + V2) y el segundo de ellos pasa de V1 a (V1 + V2) el otro gas. Estas expansiones de gases se pueden asemejar al proceso mediante el cual un gas absorbe calor y realiza un trabajo de expansión. Para el gas 1, tendremos: S1 V1 V2 P.dV Q1 W1 V1 T T T La presión en todo momento de la mezcla se mantiene constante, puesto que la presión total es igual a la suma de las presiones parciales. Por ser gas ideal: V1 V2 S1 V1 V V2 n.R.T .dV n.R. ln 1 V .T V1 Ecuación 46 Para el gas 2, la expresión es la misma: V V2 S 2 n.R. ln 1 V 2 La variación total de entropía será: V V2 S S1 S 2 n.R ln 1 V1 V V1 ln 2 0 V2 El aumento de entropías se debe al aumento de volumen (V1 +V2) dentro del cual se moverá el gas ideal. Obsérvese que la variación de entropía es independiente de la naturaleza del gas; solamente debe existir la condición de que los dos gases mezclados sean diferentes. CÁLCULO DE ENTROPÍA EN PROCESOS IRREVERSIBLES Como el cambio de entropía se define sólo para procesos reversibles, en caso de querer determinar el cambio de entropía en un proceso irreversible se debe acudir a establecer una secuencia de procesos reversibles que sean equivalentes al proceso reversible. Por ejemplo considere un cambio de fase a condiciones que no sean las de equilibrio, digamos la fusión del hielo a la presión de una atmósfera pero una temperatura diferente a UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 0 ºC. Este es un proceso irreversible, no se puede determinar directamente el cambio de entropía, para ello es necesario considerar que este proceso se puede efectuar a través de tres procesos reversibles: proceso isobárico hasta que la temperatura del hielo sea de 0 ºC, el segundo es la fusión del hielo a 0 ºC y el tercero un proceso isobárico hasta alcanzar la temperatura original. Para cada uno de estos procesos reversibles es posible calcular el cambio de entropía. Entonces, debido a que la entropía es una propiedad termodinámica o una función de punto su cambio es independiente del proceso en sí ya que solo depende de los estados inicial y final. El cambio de entropía en un proceso irreversible será igual a la suma de los cambios de entropía de la secuencia de los procesos reversibles. Un proceso de mezcla de dos o más gases también es un proceso irreversible, para calcular el cambio de entropía se debe considerar como equivalente a dos procesos reversibles: el primero una expansión isotérmica de cada uno de los gases hasta ocupar el volumen final y el segundo por una mezcla adiabática en un arreglo que permita la reversibilidad del proceso, tal como se ilustra en la figura 84. Figura 18: Proceso de mezcla de dos gases El arreglo consiste en dos cilindros que tienen cada uno un volumen al volumen final de la mezcla gaseosa. Los cilindros están separados por medio de una pared fija permeable solamente al gas A y un émbolo móvil que contiene dos paredes, la de la izquierda impermeable y la de la derecha permeable solamente al gas B, el cual se desplaza muy lentamente, de tal manera que las condiciones de presión y temperatura se mantienen constante, el gas no realiza trabajo y no hay transferencia de calor. Si el émbolo se mueve hasta una posición intermedia se observa que se realiza una mezcla parcial de los gases. Al llegar al estado final los gases se encuentran completamente mezclados. Si se invierte la dirección del movimiento del émbolo los gases se vuelven a separar. Si VA representa el volumen inicial del gas A, VB el volumen del gas B y V el volumen cuando se mezclan los dos gases, entonces el cambio de entropía en el proceso irreversible será igual al cambio de entropía que experimenta cada gas durante la expansión mas el cambio UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA de entropía durante la mezcla adiabática, pero como en un proceso adiabático reversible el cambio de entropía es cero se tiene que: S mezcla S A S B S A n A R ln V V n A R ln A VA V S B n B R ln V V n B R ln B VB V S mezcla R(n A ln x A nB ln x B ) nR( (n A ln x A nB ln x B ) ) n S mezcla nR( x A ln x A nB ln xB ) Ecuación 47 La deducción que acabamos de realizar se puede generalizar para una mezcla de varios gases ideales o de líquidos que formen soluciones ideales y donde no se presentan interacciones entre sus componentes. Para estos casos se puede plantear la siguiente ecuación S mezcla nRxi ln xi Ecuación 48 Ejemplo 48 Calcule el cambio de entropía durante la fusión de 250 de hielo a una temperatura de 20 ºC. Para el c p ( S ) 0.5 agua: c p ( L ) 1.0 cal ; g.K cal cal ; y h fusión 79.7 g.K g Figura 19: Ilustración ejemplo 45 Análisis del problema La fusión del hielo a 20 ºC es un proceso irreversible por lo tanto para poder calcular el cambio de entropía se debe establecer una secuencia de procesos reversibles que sean equivalentes a este proceso irreversible. Las siguientes transformaciones expresan esta situación: El cambio de entropía, S , en el proceso irreversible UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA H 2O( S ) (20º C, 1 atm) H 2O( L) (20º C, 1 atm) es igual a la suma de los cambios de entropía en los siguientes procesos: H 2 O( S ) (20º C, 1 atm) H 2 O( S ) (0º C, 1 atm) 1. Proceso isobárico reversible H 2 O( S ) (0º C, 1 atm) H 2 O( L) (0º C, 1 atm) 2. Fusión de hielo reversible H 2 O( S ) (0º C, 1 atm) H 2 O( L) (20º C, 1 atm) 3. Proceso isobárico reversible S S1 S 2 S 3 Solución del problema S1 mc p ( S ) ln( S 2 T fusión T ) (250 g )(0.5 mh fusión T fusión S 3 mc p ( L ) ln( T T fusión cal 273 cal ) ln( ) 8.84 g.K 293 k (250 g )(79.7 273 K ) (250 g )(1.0 S S1 S 2 S 3 8.84 cal ) g 73.0 cal K cal 293 cal ) ln( ) 17.7 g.K 273 k cal cal cal cal 73.0 17.7 81.86 K K K K Observe que la contribución más grade al cambio de entropía corresponde al cambio de fase a condiciones de equilibrio. Ejemplo 49 En un recipiente de paredes adiabáticas se colocan 50 g de hielo a una atmósfera y 0 ºC con 120 g de agua líquida a 30 ºC. Determinar el cambio de entropía. Para el agua: c p 1.0 cal cal y h fusión 79.7 g.º C g UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Figura 20: Ilustración del ejemplo Análisis del problema Dado que el sistema es adiabático, cuando se ponen en contacto el hielo con el agua líquida ocurre un proceso espontáneo o sea irreversible donde el hielo absorbe calor del agua líquida y se funde trayendo como consecuencia un descenso en la temperatura del agua líquida hasta que se alcanza el equilibrio térmico. Surge la pregunta obvia ¿cuál es la temperatura final? La respuesta a esta pregunta depende de las masas de hielo y agua líquida y de las temperaturas, por ejemplo, si se tiene una pequeña cantidad de hielo y una cantidad mucho mayor de agua líquida a una temperatura alta, el hielo se fundirá completamente y la temperatura del agua descenderá ligeramente. Si se presenta la situación contraria la temperatura del agua desciende hasta cero grados Celsius y no se alcanza a fundir todo el hielo. Entonces, para determinar el estado final se debe realizar un balance energético entre el calor que se requiere para fundir el hielo y el calor proporcionado por el agua al enfriarse desde su temperatura inicial hasta la temperatura final. También es necesario considerar que si bien el proceso global es irreversible, este se puede considerar formado de dos procesos reversibles. El primero corresponde a la fusión del hielo a 0 ºC y 1 atmósfera, el segundo es un proceso de transferencia de calor a presión constante. Entonces el cambio de entropía global corresponde a la suma de cambios de entropía en cada uno de estos procesos. Solución del problema Qagua maguac p (Tequilibrio Tagua) Qhielo mhielo h fusión Qhielo Qagua mhielo h fusión maguac p (Tequilibrio Tagua) Tequilibrio Tagua mhielo h fusión maguac p cal ) g Tequilibrio 30 º C 3.2 º C cal (120 g )(1.0 ) g.º C (50 g )(79.7 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Como el sistema es adiabático la temperatura de equilibrio no puede ser menor de 0 ºC, por lo cual se concluye que no todo el hielo se funde y que el estado final corresponde a una masa de hielo en equilibrio con agua líquida a 0 ºC. Para determinar la cantidad de hielo fundido se despeja de la ecuación del balance energético. mhielo maguac p (Tequilibrio Tagua ) h fusión cal )(0 30 º C ) g.º C 45.2 g cal 79.7 g (120 g )(1.0 S S fusión hielo S agua S fusión hielo mhielo fundidoh fusión T fusión S agua maguac p ln( Tequilibrio Tagua (45.2 g )(79.7 273 K ) (120 g )(1.0 S 13.2 cal ) g 13.2 cal K 273 K cal cal ) ln( ) 12.5 g.K 303 K K cal cal cal 12.5 0.7 K K K Ejemplo 50 Calcular el cambio de entropía durante la mezcla isotérmica de 56 g de etileno con 112 g de nitrógeno. Figura 21: Ilustración del ejemplo Análisis del problema La mezcla de dos gases es un proceso irreversible, entonces el cambio de entropía se puede calcular mediante las consideraciones de que los gases inicialmente se expanden hasta ocupar el volumen final de la mezcla y luego se mezclan adiabáticamente, con lo cual se obtiene la ecuación 198. Entonces solo hace falta calcular el número de moles totales y la fracción molar de cada gas. Solución del problema UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 𝑔 𝑔 Masas moleculares: 𝑁2 = 28 𝑚𝑜𝑙, 𝐶2 𝐻4 = 28 𝑚𝑜𝑙. 1 mol nnitrógeno (112 g )( ) 4 moles 28 g 1 mol netileno (56 g )( ) 2 moles 28 g n 6 moles xN 2 4 0.67 6 S mezcla (6 moles )(8.314 y xC 2 H 4 2 0.33 6 J J )0.67 ln 0.67 0.33 ln 0.33 31.60 mol.K K SIGNIFICADO Y USO DE LA FUNCIÓN TERMODINÁMICA ENTROPÍA A esta altura del curso de termodinámica, se han presentando tres funciones termodinámicas: energía interna, entalpía y entropía. Es conveniente detenernos y comparar el significado y uso de cada una de estas tres funciones termodinámicas, para que no se presenten confusiones cuando se tenga que escoger la función respectiva para efectuar un cálculo termodinámico. La primera ley de la termodinámica nos dice simplemente que el calor ganado por el sistema tiene que haberlo cedido, o bien otro sistema o bien los alrededores. Lo contrario es también cierto: el calor ganado por los alrededores es igual al calor perdido por el sistema. Las dos funciones termodinámicas con las que trabaja el primer principio: energía interna y entalpía corresponden al tipo de trayectoria utilizado para efectuar el intercambio de calor; así, cuando el volumen se mantiene constante la función escogida es energía interna; mientras que si la presión se mantiene constante deberemos trabajar con entalpía. Ambas funciones se refieren a intercambios de calor, sistema-alrededores. De otro lado, el experimento del equivalente mecánico del calor de Joule muestra cómo se puede convertir el trabajo mecánico en calor dentro de nuestro sistema, y así, la función energía interna, que nos mide la variación de la energía del mismo estará compuesta por el calor y el trabajo. El hecho de que el trabajo pueda convertirse en calor, plantea el interrogante de sí es posible o no convertir todo el calor recibido por el sistema en trabajo. Aquí aparece entonces el segundo principio. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Lo primero que nos indica este principio, es la imposibilidad de trabajar con un solo foco térmico. Siempre que hablemos de intercambios de calor debernos tener, como mínimo, dos focos térmicos: uno frío y otro caliente y, en consecuencia, será necesario trabajar con dos temperaturas. Esta situación nos obliga a que una parte del calor tomado por el sistema del foco caliente sea cedida al foco frío y que la diferencia pueda ser convertida en trabajo. Sólo así nuestro sistema podrá realizar un trabajo sobre los alrededores. Esta relación entre el calor y la temperatura 𝛿𝑄𝑅 𝑇 la llamamos entropía y la podemos calcular tanto para el foco caliente como para el foco frío. Ahora bien, el calor cedido al foco frío y que no ha sido convertido en trabajo, constituye una energía no utilizable. En el lenguaje común se habla de degradación de la energía para referirnos a este fenómeno. Además de este aspecto de cuantificación de la energía disponible para realizar trabajo, la segunda ley tiene una serie de preceptos que nos facilita la posibilidad de predecir cual será la dirección que se debe seguir en un proceso termodinámico. Así, la entropía nos obliga a que un cuerpo ceda calor a otro que tiene una menor temperatura hasta que éstas se igualen; un sistema con presión mayor que otro, lo comprimirá hasta alcanzar un equilibrio mecánico y, por último, la variación de entropía del universo para procesos reversibles es nula, mientras que para los irreversibles será mayor que cero. Procesos con variación de entropía negativa no se presentan en la naturaleza. Todo esto nos hace pensar que la entropía del universo tiende hacia un máximo y que cuando se alcance ese máximo la temperatura de todos los cuerpos será la misma y no habrá diferencias de presión entre diferentes regiones del espacio; situación esta que no permitirá realizar ningún trabajo y, por consiguiente, habremos llegado a la muerte entrópica del universo. CAPITULO 5: CICLOS TERMODINAMICOS Introducción El estudio de los ciclos termodinámicos es muy interesante y de gran importancia tecnológica ya que constituye el fundamento conceptual de muchas aplicaciones directas en las diferentes disciplinas de la ingeniería. Por ejemplo para establecer parámetros para el diseño de máquinas térmicas y evaluar su eficiencia, para analizar el proceso de producción de energía en una central termoeléctrica, o para diseñar sistemas de refrigeración entre otros. Actualmente hay una problemática en el mundo entero y es el control de la contaminación que a diario producen millones de automotores, turbinas de los aviones, maquinaria industrial, de tal manera que mejorar la eficiencia de las máquinas térmicas sin contaminar el medio ambiente representa un constante reto para la ingeniería. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Por otra parte, en la industria de los alimentos la refrigeración es un proceso muy importante, ya que las bajas temperaturas inhiben el crecimiento microbiano y las reacciones enzimáticas, causantes de la descomposición de la mayoría de productos alimenticios. Surgen entonces varias preguntas, por ejemplo: ¿cómo producir frío?, ¿qué elementos constituyen un sistema de refrigeración?, ¿qué características debe poseer un material para que sea un buen refrigerante? Es necesario precisar que todo proceso de refrigeración implica que exista un sistema que retire calor de una región de baja temperatura y lo lleve a otra de mayor temperatura. Como Ud. debe conocer, del estudio de la unidad anterior, este proceso no se realiza en forma espontánea y para que ocurra se necesita que el sistema cumpla un ciclo donde se realice trabajo sobre él y como resultado se verifique la transferencia de calor en el sentido deseado. Al final de la unidad, se profundizará en el estudio de los ciclos de refrigeración y las características de las sustancias utilizadas como refrigerantes. Lección 21: La máquina de vapor. Ciclo de Rankine En la segunda unidad de nuestro curso vimos cómo la máquina de vapor diseñada por Thomas Newcomen y perfeccionada por James Watt, mostraba la relación que podría existir entre trabajo y calor; y sirvió como idea base para que Joule proyectara el experimento del equivalente mecánico del calor. Dos siglos después del invento de Watt, existen todavía numerosas máquinas que funcionan con el mismo principio termodinámico original y que nos muestran la utilidad y vigencia de la máquina de vapor en nuestra sociedad. El ciclo termodinámico de esta máquina fue estudiado por W.J. Rankine, un ingeniero escocés que en 1859 publicó su libro Manual de la Máquina de Vapor y que le dio su nombre al ciclo termodinámico de la máquina de vapor. El fundamento mecánico de esta máquina consiste en aprovechar la energía que posee el vapor de agua para mover un pistón dentro de un cilindro y a la utilización de dos elementos tan baratos como son el agua y el carbón. La figura 88 nos muestra un esquema muy sencillo de la máquina de vapor. El agua se lleva mediante una bomba hasta la caldera, en donde la presión y la temperatura que alcance el vapor saturado dependerán de las condiciones de operación propias de la máquina; así por ejemplo, a la presión de 10 atmósferas, la temperatura que alcanza el vapor saturado es de 180 ºC y a 15 atmósferas es de 200 °C. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Figura 22: Esquema elemental de una máquina de vapor La caldera o generador de vapor recibe el calor de la combustión del carbón y este proceso continúa mientras la máquina está funcionando. El vapor así producido se conduce hasta el pistón o émbolo de la máquina, el cual se mueve debido a la gran presión que ejerce dicho vapor. En las centrales termoeléctricas no existe el pistón, sino una turbina con una serie de aspas o alabes (similares a una hélice), contra las cuales se estrella el vapor, produciendo el movimiento de rotación del eje. En cualquiera de los dos casos anteriormente mencionados, el vapor utilizado se lleva posteriormente al condensador, lugar en donde cede calor para pasar al estado líquido a una presión menor que la atmosférica y a una temperatura menor que la de ebullición. El condensador cederá su contenido calorífico al foco frío y el agua condensada será llevada por la bomba, nuevamente, a la caldera para la producción de vapor, cerrando de esta manera el ciclo. Al llegar a este punto hay que hacer una aclaración. El vapor que se utiliza para mover el pistón o la turbina debe ser un vapor con unas características tales que cuando haga la expansión, en el pistón, no se vaya a producir agua en estado líquido, debido a la alta corrosión que presenta este líquido a elevadas temperaturas. Para eliminar este problema se sobrecalienta el vapor; es decir, pasamos de la isoterma de vapor saturado a una isoterma mayor. Todas las máquinas que trabajan hoy en día, lo hacen con el ciclo de vapor sobrecalentado. La temperatura del vapor sobrecalentado tiene un límite, que viene dado por la resistencia de los materiales utilizados a altas presiones; este límite supone una temperatura máxima de 550 °C y una presión máxima de 100 atmósferas, con una tolerancia de 10% de la humedad. Este límite se conoce con el nombre de límite metalúrgico. El ciclo termodinámico que describe todas las variaciones de presión, volumen y temperatura que sufre la máquina de vapor se llama ciclo Rankine, representado en la figura UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 89, y será explicado a continuación. Recordemos que la línea punteada describe el comportamiento de agua saturada con vapor a la izquierda del punto crítico (Cr) y del vapor saturado con agua a la derecha de dicho punto crítico. Figura 23: Diagrama termodinámico P-V para el ciclo de Rankine El ciclo de Rankine es una descripción de una máquina ideal de vapor; por consiguiente, el rendimiento calculado tiene un valor máximo comparado con las máquinas que se construyen en la industria. Esto se debe a que para nuestro estudio no consideramos los siguientes fenómenos: a) b) c) d) Aceleraciones y turbulencias del vapor que alteran la presión del mismo. Rozamiento producido sobre las paredes del pistón y de la bomba de agua. Pérdidas de calor en la conducción del vapor y durante la expansión en el pistón. Transferencia de calor irreversible entre la combustión del carbón y la caldera, con las consabidas pérdidas de calor por radiación. Para comenzar el ciclo, no vamos a considerar la energía calórica para llevar el agua de la temperatura ambiente hasta la temperatura de agua saturada de vapor a la presión P representada en la figura 89 por el punto a. Los procesos que componen el ciclo Rankine son los siguientes: a) a b. La bomba realiza una compresión adiabática del agua para llevarla de P2 a P1. La variación de temperatura es muy pequeña y prácticamente sigue la isoterma T. b) b c. El agua se calienta isobáricamente hasta llevarla a su temperatura de ebullición, T1. El calor consumido en este proceso es muy pequeño. Basta comparar la capacidad calorífica de un gramo de agua a la temperatura de ebullición, con el calor de vaporización del mismo gramo de agua a dicha temperatura. c) c d. El agua que entra en la caldera se evapora isobáricamente llegando al punto de vapor saturado. d) d e. Este proceso hace que el calor absorbido por el vapor lo sobrecaliente y pasemos de la isoterma T a T en una trayectoria isobárica. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA e) e f. En este momento el vapor se introduce en el pistón y realiza la llamada carrera de trabajo; por lo tanto, el vapor se expande adiabáticamente y el punto f representa la composición del vapor húmedo; esto es, vapor de agua y una pequeña proporción de agua en estado líquido. f) f a. El vapor húmedo se introduce en el condensador en contacto con el foco frío cediéndole calor, para llevar todo el vapor a agua líquida, punto a, con lo cual se cierra el ciclo. El agua que está a la temperatura T2, punto b, puede circular por las vecindades de la caldera antes de entrar a la misma, para alcanzar la temperatura T1. El recalentamiento del vapor T1 a T2 se logra haciéndolo recircular por un serpentín colocado dentro de la caldera. De esta forma, la zona donde se absorbe calor en una cantidad Q está dada por la trayectoria b c d e, todo a presión constante. Por consiguiente: 𝑄1 = 𝐻𝑒 − 𝐻𝑏 De otra parte, el calor cedido, Q2, en el condensador al foco frío será también a presión constante, trayectoria f a, y: 𝑄2 = 𝐻𝑓 − 𝐻𝑎 La definición de rendimiento, n, para la máquina térmica nos dice: 𝜂= 𝑊 𝑄1 − 𝑄2 (𝐻𝑒 − 𝐻𝑏 ) − (𝐻𝑓 − 𝐻𝑎 ) = = 𝑄 𝑄1 𝐻𝑒 − 𝐻𝑏 La entalpía del agua, Hb, no es fácilmente obtenible en las tablas; pero puede calcularse teniendo en cuenta las condiciones propias del proceso, así el paso de a b es adiabático y Hb puede expresarse en función de Ha y de la compresión adiabática que realiza la bomba: 𝐻𝑏 = 𝐻𝑎 + ∫ 𝑉. 𝑑𝑃 Ahora bien, el volumen V prácticamente no sufre cambio, debido a que es un líquido y la ecuación se transforma en: 𝐻𝑏 = 𝐻𝑎 + 𝑉(𝑃1 − 𝑃2 ) El rendimiento queda expresado: 𝑯𝒆 −𝑯𝒇 +𝑽(𝑷𝟏 −𝑷𝟐 ) 𝜼=𝑯 𝒆 −𝑯𝒂 +𝑽(𝑷𝟏 −𝑷𝟐 ) Ecuación 49 La ecuación 206, expresa el rendimiento de la máquina en función de las entalpías de vapor sobrecalentado, He, del vapor húmedo a la temperatura T2; del foco frío, Hf; del agua saturada a la temperatura T2, Ha, y del llamado término correspondiente a la bomba de alimentación: 𝑉(𝑃1 − 𝑃2 ). UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA En la ecuación 206 del rendimiento para la máquina de vapor, aparece el término Hf que se refiere a la entalpía de la mezcla líquido-vapor que se ha producido durante la expansión adiabática en el pistón de la máquina. El valor de Hf no se obtiene directamente de las tablas de vapor, pero puede calcularse en función de la entalpía del vapor saturado en la isoterma T2 y de las entropías de vapor sobrecalentado Se y del vapor saturado Sk. El proceso de expansión adiabática de e f es un proceso isentrópico, por consiguiente: 𝑆𝑓 = 𝑆𝑒 En consecuencia: 𝑯𝒇 = 𝑯𝒌 − 𝑻𝟐 (𝑺𝒌 − 𝑺𝒆 ) Ecuación 50 En esta última ecuación la entalpía de la mezcla agua-líquida-vapor de agua (también se le dice vapor húmedo) queda expresada en términos que sí aparecen en las tablas de vapor. El título del vapor o porcentaje de sequedad, se refiere a la cantidad de agua líquida que acompaña al vapor de agua después de efectuar la expansión adiabática. Este puede calcularse en función de las entropías involucradas sobre la línea de equilibrio líquido-vapor en la isoterma T2. Si llamamos xf el título del vapor en el punto f, su valor es: 𝒙𝒇 = 𝑺𝒆 −𝑺𝒂 𝑺𝒌 −𝑺𝒂 Ecuación 51 Ejemplo 51 Calcule la entalpía y la entropía de 1 kg de vapor de agua con un título de 0.85 a una presión de 5 atmósferas. Análisis del problema Este problema tiene como objeto ejercitar en la búsqueda y cálculo de las magnitudes necesarias para hallar el rendimiento térmico de una máquina de vapor. Se dan los datos y composición del vapor húmedo y se pide conocer la entalpía y entropía de dicho vapor. El título del vapor se puede expresar en función de las entropías, ecuación 3; mientras que la entalpía de vapor húmedo, Hf, se da en función de la entalpía de vapor saturado de las entropías de vapor saturado, y del título del vapor. Solución del problema Datos del problema: 𝑚 = 1 𝑘𝑔; 𝑃 = 5 𝑎𝑡𝑚, Título = 0.85 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Es necesario cambiar de unidades de presión de atmósferas a psia, luego: 𝑃 = 5𝑎𝑡𝑚 14.7 𝑝𝑠𝑖𝑎 = 73.5 𝑝𝑠𝑖𝑎 1 𝑎𝑡𝑚 Con este valor de presión, los datos que aparecen en las tablas son los siguientes: la presión más parecida a esta (73.5 psia) es la que aparece en la tabla de 73.25 psia. Es bastante cercana a la nuestra, por tal razón podemos tomar directamente los datos que en ella aparecen. Cuando el valor de nuestra presión difiere ostensiblemente, debe hacerse una interpolación y calcular todos los datos que en ella aparecen; después de esta consideración los valores son: 𝑃 = 73.5 𝑝𝑠𝑖𝑎; 𝑇 = 306.0 °𝐹; 𝐻𝑎𝑔𝑢𝑎 = 275.9; 𝐻𝑣𝑎𝑝𝑜𝑟 = 1181.4; 𝑆𝑎𝑔𝑢𝑎 = 0.4453; 𝑆𝑣𝑎𝑝𝑜𝑟 = 1 .6279 Las unidades de entalpía: 𝐵𝑇𝑈 𝑙𝑏𝑚 𝐵𝑇𝑈 Las unidades de entropía: 𝑙𝑏𝑚.℉ 𝑥𝑓 = 𝑆𝑒 − 𝑆𝑎 𝑆𝑘 − 𝑆𝑎 𝑆𝑒 = 𝑆𝑎 + 𝑥𝑓 (𝑆𝑘 − 𝑆𝑎 ) 𝑆𝑒 = 0.4453 𝐵𝑇𝑈 𝐵𝑇𝑈 𝐵𝑇𝑈 + 0.85 (1.6279 − 0.4453 ) 𝑙𝑏𝑚. ℉ 𝑙𝑏𝑚. ℉ 𝑙𝑏𝑚. ℉ 𝑆𝑒 = 1.4505 𝐵𝑇𝑈 𝑙𝑏𝑚. ℉ La entalpía para el vapor húmedo, Hf, según la ecuación 2: 𝐻𝑓 = 𝐻𝑘 − 𝑇2 (𝑆𝑘 − 𝑆𝑒 ) 𝐻𝑓 = 1181.4 𝐵𝑇𝑈 𝐵𝑇𝑈 𝐵𝑇𝑈 − 306℉ (1.6279 − 1.4505 ) 𝑙𝑏𝑚 𝑙𝑏𝑚. ℉ 𝑙𝑏𝑚. ℉ 𝐻𝑓 = 1127.1 𝐵𝑇𝑈 𝑙𝑏𝑚 Esta es la forma de buscar y calcular los datos en la tabla para después averiguar cuál el rendimiento de la máquina de vapor. MAQUINAS DE COMBUSTIÓN INTERNA UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Las máquinas que transforman el calor en trabajo mecánico se diferencian en la forma y lugar donde se genera el calor, para después ser convertido en movimiento. En el caso de la máquina de vapor, el calor se produce en el exterior de la caldera (por la combustión de madera, carbón, ACPM o cualquier otro combustible) y pasa al vapor debido a que la pared de la caldera es diatérmica, de hierro generalmente. Este tipo de máquinas reciben el nombre de máquinas de combustión externa. Existe otro tipo de máquinas muy comunes entre nosotros, que utilizan un sistema diferente. En ellas la combustión de los compuestos químicos se realiza dentro de la cámara (cilindro más pistón) en donde se va a realizar la expansión de los gases y por consiguiente el movimiento del pistón o émbolo. Este tipo de máquinas se llaman máquinas de combustión interna y a ellas pertenecen los motores que más se utilizan en la actualidad: el motor a gasolina o de cuatro tiempos y el motor Diesel. Ejemplo 52 En una planta termoeléctrica que trabaja mediante un ciclo ideal de Rankine, el vapor llega a la turbina a 3.5 MPa y 400 ºC y se condensa a una presión de 100 kPa. Se desea determinar la eficiencia de este ciclo, ¿qué solución puede ofrecer? Figura 24: Datos del ejemplo Análisis del problema Como se ha insistido pueden presentarse diversas soluciones, por ejemplo calcular el trabajo neto y relacionarlo con el calor suministrado; o bien calcular la eficiencia en función de las entalpías. A su vez las entalpías pueden consultarse en tablas o utilizar el software disponible. En este ejemplo se utilizará el software Propagua que ya se ha mencionado. En él los estados se especifican de la siguiente manera: Estado 1 Presión 100 kPa equivalente a 1 bar y calidad del vapor o título = 0 Estado 2 Presión 3.5 MPa o 35 bar y entropía igual a la del estado 1 Estado 3 Presión 3.5 MPa o 35 bar y temperatura 400 ºC Estado 4 Presión 100 kPa o 1 bar y entropía del estado 3. SOLUCIÓN DEL PROBLEMA Con los datos proporcionados por el software se construye la siguiente tabla: Estado 1 (a) Título x 0 Presión, 𝑏𝑎𝑟 Temperatura, ℃ 1 99.63 Entalpía, 𝑘𝐽 𝑘𝑔 417.50 Entropía, 𝑘𝐽 𝑘𝑔.𝐾 1.30270 Volumen, 𝑑𝑚3 𝑘𝑔 1.0434 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 2 (b) 3 (e) 4 (f) L V 0.9149 35 35 1 99.87 400.00 99.63 421.04 3224.20 2483.24 1.30270 6.84430 6.84430 1.0418 84.4940 1549.6434 Con los datos de entalpías se determina la eficiencia: (he hb ) (h f ha ) (he hb ) (3224.20 421.04) (2483.24 417.50) 0.26 (3224.20 421.04) Este resultado significa que la termoeléctrica convierte el 26% del calor suministrado en la caldera en trabajo neto. Lección 22: Motores de cuatro tiempos. Ciclo de Otto El motor de cuatro tiempos fue desarrollado por N.A. Otto, un ingeniero alemán, que en el último tercio del siglo pasado construyó la primera máquina con este tipo de motor. Debido al éxito alcanzado, el ciclo termodinámico que describe su proceso se conoce con el nombre de ciclo de Otto. Los componentes del motor, también llamado de explosión, son un cilindro provisto de un pistón o émbolo; una válvula de admisión que permite el paso de la mezcla formada por gasolina más aire, procedente del carburador; un electrodo o bujía para el encendido de la mezcla y una válvula de escape, por donde los gases, producto de la combustión, pueden escapar al exterior. El ciclo termodinámico y el diagrama de entropía se muestran en la figura 59. Loss pasos que componen el proceso de un motor de cuatro tiempos de combustión son: 1. Admisión (0 1). La válvula de admisión se abre y el pistón en su carrera impelente admite la mezcla gasolina-aire proveniente del carburador. Los gases entran debido la presión atmosférica. Figura 25: Diagramas para el ciclo de Otto: a) P vs V y b) T vs S UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 2. Compresión adiabática (1 2). La válvula de admisión se cierra y el pistón comprime los gases. 3. Ignición: se produce un aumento de la presión y temperatura (2 3). La corriente eléctrica ha pasado por la bujía y produce una chispa que inicia la combustión de la mezcla ocasionando un aumento de la presión y la temperatura, a volumen constante. 4. Expansión (3 4). Los gases producidos por la combustión mueven e pistón, produciendo lo que se llama la carrera de trabajo. 5. Disminución de la temperatura y presión a volumen constante (4 1). En el momento que el pistón llega al final de su carrera de trabajo se abre la válvula de escape y los gases que tienen una alta presión y temperatura, salen hacia el exterior a presión atmosférica. 6. Expulsión de los gases (1 0). La inercia que posee el pistón hace que éste, en la carrera de regreso a la posición original 0, expulse al exterior los gases que aun quedaban dentro del cilindro. El ciclo queda completo al regresar al punto 0. Los seis procesos que acabamos de describir se realizan en cuatro carreras del pistón, por lo cual se llama de cuatro tiempos. Este motor se ve mejorado por la implementación de volantes de peso considerable que hacen posibles los movimientos del pistón cuando no se realiza la carrera de trabajo; el uso de árboles de leva que abren o cierran las válvulas de admisión y escape sincronizadamente con el pistón y la refrigeración con agua de las paredes del cilindro, etc. El cálculo de la eficiencia térmica del ciclo de Otto se realiza teniendo en cuenta las siguientes suposiciones: el gas formado durante la combustión se comporta como un gas ideal de masa constante cuyas capacidades caloríficas a presión y volumen constantes, Cp y Cv respectivamente, no cambian durante el proceso y la combustión se asemeja a un proceso de transmisión de calor al gas ideal para producir la expansión del mismo. El cálculo de la eficiencia se realiza como sigue: el calor se absorbe durante 2 3 y su valor Q1 por ser a volumen constante: 𝑄1 = 𝑈3 − 𝑈2 = 𝐶𝑉 (𝑇3 − 𝑇2 ) De igual manera, de 4 1 es el momento durante el cual el sistema cede calor a los alrededores: 𝑄2 = 𝑈4 − 𝑈1 = 𝐶𝑉 (𝑇4 − 𝑇1 ) El rendimiento térmico viene dado por la ecuación de Carnot: 𝜂= 𝑄1 − 𝑄2 𝑄2 𝑇4 − 𝑇1 =1− =1− 𝑄1 𝑄1 𝑇3 − 𝑇2 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA De otro lado, los procesos 1 2 y 3 4 siguen una trayectoria adiabática, por lo que: 𝛾−1 𝑇1 𝑉1 En donde: 𝑉1 = 𝑉4 y 𝛾−1 = 𝑇2 𝑉2 y 𝛾−1 𝑇4 𝑉4 𝛾−1 = 𝑇3 𝑉3 𝑉2 = 𝑉3. Por consiguiente: 𝑇4 𝑇3 = 𝑇1 𝑇2 1− 𝑇4 𝑇3 =1− 𝑇1 𝑇2 𝑇1 − 𝑇4 𝑇2 − 𝑇3 = 𝑇1 𝑇2 𝑇1 𝑇1 − 𝑇4 = 𝑇2 𝑇2 − 𝑇3 La última ecuación reemplazada en el cálculo de rendimiento: 𝜼= 𝟏− 𝑻𝟏 𝑻𝟐 𝑽 = 𝟏 − ( 𝟐) 𝑉 𝑽𝟏 𝜸−𝟏 = 𝟏− 𝟏 Ecuación 52 𝜸−𝟏 𝒓𝑪 El cociente 𝑟𝐶 = 𝑉1 recibe los nombres de relación de compresión o grado de compresión 2 de la mezcla. Este cociente es un parámetro muy usado para caracterizar la potencia de un automóvil, juntamente con la capacidad del motor. A medida que la máquina tiene un motor de mayor capacidad y mayor relación de compresión, tiene más potencia. Obsérvese que para el ciclo de Otto el rendimiento no se expresa como una función de las temperaturas superior e inferior de los focos caloríficos, como se hace en el ciclo de Carnot. El rendimiento del ciclo de Otto es casi la mitad respecto al del ciclo de Carnot y pudiera pensarse que a medida que aumentamos la relación de compresión aumentamos el rendimiento. Teóricamente esto es aceptable, pero existe una limitante tecnológica: al llegar a un cierto valor de la relación de compresión la mezcla hace autoexplosión, antes de que salte la chispa y el proceso de combustión no puede controlarse. Ejemplo 53 Un motor de cuatro tiempos posee una relación de compresión de 7. Si el aire se admite a una presión de 1 atm y a una temperatura de 25°C y alcanza una temperatura máxima de 1200 °C, calcúlese: 1) la presión máxima que alcanza el aire en el ciclo y 2) el calor 𝑐𝑎𝑙 absorbido. Los datos para el aire son: 𝛾 = 1.4 y 𝐶𝑉 = 0.172 𝑔.𝐾. Análisis del problema UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Los cálculos que deben realizarse para saber la presión y la temperatura, deben corresponder a trayectorias adiabáticas para un gas ideal. Solución del problema 𝛾 𝛾 𝑃2 𝑉2 = 𝑃1 𝑉1 𝛾 𝑉 Luego: 𝑃2 = 𝑃1 (𝑉1 ) = 1𝑎𝑡𝑚(7.0)1.4 = 15.25 𝑎𝑡𝑚 2 𝛾−1 𝑇1 𝑉1 𝑉 𝛾−1 = 𝑇2 𝑉2 𝛾−1 Luego: 𝑇2 = 𝑇1 (𝑉1 ) 2 𝑇2 = 298 𝐾(7.0)(1.4−1) = 649 𝐾 El aumento de presión y temperatura, se realiza a volumen constante, paso 2 3: 𝑃3 = 𝑃2 (1200 + 373)𝐾 𝑇3 = 15.25𝑎𝑡𝑚 = 34.61 𝑎𝑡𝑚 𝑇2 649 𝐾 El calor absorbido por el aire será: 𝑄1 = 𝐶𝑣 (𝑇3 − 𝑇2 ) = 0.172 𝑐𝑎𝑙 𝑐𝑎𝑙 (1473 − 649)𝐾 = 141.73 𝑔. 𝐾 𝑔 𝑄1 = 592.4 Ejemplo 54 Se desea determinar los valores máximos de presión y temperatura que alcanzaría el aire en un ciclo ideal de Otto donde la relación de compresión es de 8; el aire inicialmente se encuentra a 20 ºC y 110 kPa y durante el proceso isocórico recibe 15600 kJ/kmol en forma de calor. Determine también la eficiencia del ciclo y el diagrama Ts. 𝑘𝐽 𝑘𝑔 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Figura 26: Diagrama Pv para el ciclo de Otto Análisis del problema La máxima presión y la mayor temperatura se alcanzan en el estado 3, al culminar el proceso isocórico de adición de calor, las cuales se determinan en función de las condiciones del estado 2 y éstas a su vez mediante las condiciones iniciales. Consideremos como sistema el aire con un comportamiento de gas ideal, del cual se conocen presión y temperatura del estado 1, entonces utilizando las tablas de propiedades termodinámicas o el software de propiedades de los gases se determinan las otras propiedades como volumen específico o volumen molar, energía interna, entalpía y entropía. Recuerde que dos propiedades definen el estado de un sistema gaseoso. El proceso entre 1 y 2 es isentrópico, por lo tanto la entropía del estado 2 será igual a la entropía del estado 1. El volumen del estado 2, dada las condiciones del problema será igual a 1/8 del volumen inicial; con estos datos se pueden calcular las propiedades restantes. El proceso entre 2 y 3 es isocórico, el volumen se mantiene constante y la energía interna aumenta en virtud del calor adicionado. Con los datos de energía interna y volumen es posible determinar la presión y la temperatura del estado 3, con lo cual se da respuesta al primer interrogante. La eficiencia se determina o bien en función de las temperaturas o en función de los volúmenes y teniendo en cuenta la relación entre las capacidades caloríficas molares a presión y a volumen constante que para el aire vale 1.4; como ya se ha calculado, en el ejemplo 26. SOLUCIÓN DEL PROBLEMA Para resolver este problema se utilizará el software Progases del Departamento de Química Física y Termodinámica Aplicada de la Universidad de Córdoba de España el cual está disponible en Internet (ver bibliografía). El software permite determinar los valores de las propiedades de diferentes gases para un estado determinado conociendo el valor de dos de ellas. Para el estado 1 𝑃1 = 110 𝑘𝑃𝑎 = 1.10 𝑏𝑎𝑟 y 𝑇1 = 293 𝐾 Con estos datos se obtienen los siguientes valores para el estado 1: Estado 1 Para el estado 2 Presión Temperatura Volumen Energía interna Entropía kPa K m3/kmol kJ/kmol kJ/kmolK 110 293 22.1463 6084.4 196.64 V2 V 1 22.1463 m3 2.7683 8 8 kmol UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Como el proceso entre 1 y 2 es isentrópico S 2 S 1 196.64 kJ kmol.K Por lo tanto: Estado Presión, kPa Temperatura, K Volumen, 2 1977 Para el estado 3 658.32 𝑚3 𝑘𝑚𝑜𝑙 𝑘𝐽 2.7683 V 3 V 2 2.7683 𝑘𝐽 Energía interna, 𝑘𝑚𝑜𝑙 Entropía, 𝑘𝑚𝑜𝑙.𝐾 13963 196.64 m3 (proceso isocórico) kmol U 3 U 2 Q 13963 15600 29563 kJ kmol Por lo que Estado Presión, kPa Temperatura, K Volumen, 3 3882 1292.42 𝑚3 𝑘𝑚𝑜𝑙 Energía interna, 2.7683 𝑘𝐽 𝑘𝑚𝑜𝑙 29563 Entropía, 𝑘𝐽 𝑘𝑚𝑜𝑙.𝐾 213.05 La eficiencia se calcula mediante cualquiera de las ecuaciones derivadas anteriormente: 𝜂 = 1 − 𝑟 (1−𝛾) = 1 − 8(1−1.4) = 0.56 También en función de las temperaturas: 1 T1 293 1 0.56 T2 658.32 Para realizar el diagrama Ts se deben conocer también la temperatura 4. ¿Cómo se podrían determinar las propiedades del estado 4? El proceso de 3 a 4 es isentrópico, entonces, teniendo en cuenta esta condición y que el volumen del estado 4 es igual al del estado 1, se determinan todas las otras propiedades del punto 4: 3 𝑘𝐽 𝑘𝐽 Estado Presión, kPa Temperatura, K Volumen, 𝑚 Energía interna, Entropía, 𝑘𝑚𝑜𝑙.𝐾 𝑘𝑚𝑜𝑙 𝑘𝑚𝑜𝑙 4 238 632.9 22.1463 13387.8 213.05 Con los valores anteriores de temperatura y entropía se construye el diagrama de temperatura contra entropía (Ts) como se muestra en la figura 95. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Figura 95: Diagrama Ts para el ciclo de Otto Se invita al estudiante a que explore otros resultados cambiando las condiciones iniciales del problema y formulándose otros interrogantes. Lección 23: Motores de ignición por compresión. Ciclo Diesel En la sección pasada vimos cómo el factor limitante del motor de cuatro tiempos era el valor de la relación de compresión, necesario para evitar la autoignición de la mezcla. Podríamos obviar este problema comprimiendo solamente aire y en el momento de su máxima compresión inyectar el combustible para que suceda la combustión y el pistón realice la carrera de trabajo. Este es el fundamento del motor de combustión o ignición por compresión, perfeccionado por R. Diesel, a finales del siglo pasado; cuyo nombre fue dado al ciclo termodinámico que describe el proceso que sigue esta clase de motor. Por supuesto, el motor Diesel no tiene carburador y la inyección del combustible se realiza por una bomba de inyección. Figura 27: Diagramas para el ciclo Diesel: a) P vs Ty b) T vs S UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Los diferentes pasos que contiene el ciclo Diesel son los siguientes: 1. Admisión (0 1). El aire pasa al cilindro a medida que el pistón se va retirando. La presión con la cual entra el aire es la presión atmosférica. 2. Compresión adiabática (1 2). Al llegar al extremo 1 la válvula de admisión se cierra y el pistón inicia el regreso y la compresión adiabática del aire. La presión dentro del cilindro puede ser de 40 a 50 atmósferas y la temperatura del orden de 600 °C. 3. Inyección del combustible e ignición de la mezcla (2 3). La presión de inyección de la bomba es de unas 70 atmósferas, lo cual, junto con el comienzo de la combustión, hace una expansión a presión constante. 4. Expansión adiabática (3 4). La expansión isobárica anterior solamente representa una décima parte del volumen del cilindro. Las nueve décimas partes restantes corresponden a la expansión adiabática. El paso anterior y éste conforman la llamada carrera de trabajo del pistón. 5. Disminución de temperatura y presión a volumen constante (4 1). Al llegar el pistón al final de la carrera de trabajo se abre la válvula de escape y debido a la alta presión y temperatura que tienen los gases, estos escapan al exterior a volumen constante. 6. Expulsión de los gases (1 0). El pistón de regreso de la carrera de trabajo, con la válvula de escape abierta, saca los gases producto de la combustión y regresa el sistema al punto inicial 0. Las consideraciones que se hicieron para el ciclo de Otto referentes al tipo de gas, deslizamientos sin fricción, etc., son las mismas que se aplican al ciclo Diesel. El cálculo de la eficiencia de un ciclo Diesel es como sigue: la trayectoria 2 3 es el momento en el cual el motor toma calor, luego: 𝑄1 = 𝐶𝑃 (𝑇3 − 𝑇2 ) y de 4 1, donde cede calor: 𝑄2 = 𝐶𝑉 (𝑇4 − 𝑇1 ) En consecuencia el rendimiento será: C T T Q1 Q2 Q 1 2 1 v . 4 1 Q1 Q1 C p T3 T2 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA T4 T1 T1 1 . T2 T3 T2 1 . 1 1 Las relaciones existentes en los puntos extremos del diagrama del ciclo Diesel son: T1V1 1 T2V2 1 T4V4 1 T3V3 1 𝑉1 = 𝑉4 Durante la trayectoria 2 3 a presión constante: T3 V3 r0 T2 V2 𝑉 El cociente 𝑟0 = 𝑉3, se llama relación de combustión. 2 Tomando las ecuaciones anteriores puede llegarse a la fórmula para el cálculo de eficiencia: V3 1 1 T1 V2 1 . T2 V3V2 1 1 𝑉 1 . 1 rC r0 1 1 r0 1 Ecuación 53 Donde 𝑟𝐶 = 𝑉1, se conoce como la relación de compresión. 2 La última ecuación nos muestra que el rendimiento térmico del ciclo Diesel aumenta con la relación de compresión rC, y con el coeficiente 𝛾 del gas utilizado y disminuye cuando aumenta r0. Ejemplo 55 La relación de compresión de un motor Diesel rC es igual a 15 y el calor suministrado 𝑄1 = 275 𝑘𝑐𝑎𝑙 . 𝑘𝑔 El aire penetra al motor a la presión de 1 atm y 25 °C de temperatura; UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 𝑐𝑎𝑙 sabiendo que 𝛾 = 1.4 y que 𝐶𝑃 = 0.241 𝑔.𝐾. Calcúlese la temperatura y la presión máxima del ciclo. Análisis del problema Los cálculos que debemos hacer se refieren a los procesos 1 2 para averiguar la presión máxima y de 2 3 sabremos la temperatura máxima alcanzada. Por tanto nuestros procesos serán: a) adiabático y b) isobárico. Solución del problema En la trayectoria adiabática: V P2 P1 1 V2 P1 .rC 1 atm 151.4 44.31 atm V T2 T1 1 V2 1 T1 .rC 1 29815 0.4 880.3 K En la trayectoria isobárica: 𝑄1 = 𝐶𝑃 (𝑇3 − 𝑇2 ) Por consiguiente: 𝑇3 = 𝑄1 + 𝑇2 𝐶𝑃 kcal kg T3 880.3 K 2021.4 K kcal 0.241 kg.K 275 Ejemplo 56 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Determine el trabajo producido y la eficiencia en un ciclo Diesel de aire estándar que efectúa las siguientes etapas: 1. Compresión isentrópica desde 100 kPa y 290 K hasta 900 kPa 2. Adición de 34760 kJ/kmol de calor a presión constante 3. Expansión adiabática hasta alcanzar el volumen inicial 4. Enfriamiento isocórico hasta llegar al estado inicial. Las capacidades caloríficas molares a las temperaturas promedio de operación: C p aire 33.08 kJ kmol.K Cvaire 23.64 kJ kmol.K Figura 28: Diagrama Pv ciclo Diesel Análisis del problema El trabajo en el ciclo es igual a la suma algebraica del trabajo en cada una de las etapas. Entonces para cada proceso en particular se deben determinar las condiciones de temperaturas que permitan calcular el trabajo. Para resolver este problema existen varias alternativas: primero utilizar los valores promedio de las capacidades caloríficas de aire, supuestas constantes en el intervalo de temperaturas, otra forma sería el de utilizar las tablas de propiedades termodinámicas del aire o bien utilizar el software para análisis de ciclos termodinámicos. En este ejemplo utilizaremos las capacidades caloríficas y el software Progases que ya se ha mencionado. Solución del problema T1 290 K Condiciones iniciales P1 100 kP Para calcular la temperatura del punto dos recuerde que la relación entre presión y temperatura se establece mediante la ecuación: P T2 T1 1 P2 ( 1 ) 100 kPa 290 K 900 kPa 11, 4 1, 4 543 K Donde representa la relación entre las capacidades caloríficas que para el aire es de 1.4. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA La temperatura del estado 3 se determina teniendo en cuenta que se trata de un proceso isobárico y en este tipo de procesos el cambio de entalpía es igual al calor intercambiado por tanto: Q H nC p(T3 T2 ) 34760 kJ Al despejar la temperatura 3 T3 Q T2 nC p 34760 kJ kJ (1 kmol)(33.08 ) kmol.K 543 K 1594 K Para determinar las condiciones del estado 4 se deben considerar simultáneamente el proceso adiabático o isentrópico entre 3 y 4 y el proceso isocórico entre 4 y 1. P Para el proceso adiabático T4 T3 3 P4 obtiene la ecuación: T4 228.3P 0, 286 1 900 kPa (1.594 K ) P4 11, 4 1, 4 de donde se . Para el proceso isocórico hay una relación directa entre presión y temperatura de tal P4 P1 manera que T4 T1 P4 T4 2.9 P4 (290 K ) 100 kPa Al resolver las dos ecuaciones simultáneas P4 452 kPa y T4 1310 K Trabajo en el proceso adiabático entre 1 y 2. W2 nCv(T2 T1 ) (1 kmol)(23.64 1 kJ )(543 290) K 5981 kJ kmol.K Trabajo en el proceso isobárico entre 2 y 3. W3 nR(T3 T2 ) (1 mol)(8.31 2 kJ )(1594 543) 8734 kJ kmol.K Trabajo en el proceso adiabático entre 3 y 4. W4 nCv(T4 T3 ) (1 kmol)(23.64 3 kJ )(1310 1594) K 6714 kJ kmol.K Para el proceso isocórico entre 4 y 1 el trabajo es cero. Con los datos encontrados se calcula el trabajo producido por el ciclo: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Wciclo 1W2 2W3 3W4 4W1 (5.981 8.734 6.714) kJ 9.467 kJ La eficiencia se calcula fácilmente de la relación entre el trabajo producido y el calor suministrado: kJ kmol 0.27 e kJ 34.760 kmol 9.467 Al utilizar el software PROGASES se obtienen resultados algo diferentes debido a la consideración realizada para resolver el problema de que las capacidades caloríficas son constantes. El software realiza las integraciones correspondientes al presentase variación de las capacidades caloríficas al cambiar la temperatura. Los estados que aparecen en negrilla se toman como referencia para determinar mediante el software las otras propiedades con los cuales se construye la siguiente tabla: 𝑘𝐽 𝑘𝐽 Estados Presión, kPa Temperatura, K Entalpía, Entropía, 𝑘𝑚𝑜𝑙.𝐾 𝑘𝑚𝑜𝑙 1 2 3 4 100 900 900 468 290 540,11 1.589,22 1353.45 8.433,3 15.825.9 50.682,9 42.594,3 197,133 197,133 232,364 232,364 𝑚3 Volumen, 𝑘𝑚𝑜𝑙 24,1115 4,9896 14,6814 24,1115 El software también proporciona el trabajo en cada una de las transformaciones W2 5267.6 1 W4 6067.2 3 kJ kmol kJ kmol W3 8722.7 2 kJ kmol W1 0 4 Wciclo 9522.3 kJ kmol kJ kmol 0.27 kJ 34769 kmol 9522.3 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Lección 24: Ciclo de Brayton Los motores de las turbinas de gas utilizadas en plantas generadoras de corriente eléctrica o en la propulsión de aeronaves funcionan mediante el ciclo de Brayton, el cual como en los ciclos estudiados anteriormente, también consta de cuatro etapas internamente reversibles: 1. Compresión adiabática de 1 a 2 2. Adición de calor a presión constante de 2 a 3 3. Expansión adiabática de 3 a 4 4. Liberación de calor a presión constante de 4 a 1 La figura 98 muestra los diagramas Pv y Ts para el ciclo Brayton en ellos el área inscrita dentro de las trayectorias de cada proceso representa en el diagrama Pv el trabajo desarrollado y en el diagrama Ts el calor intercambiado durante el ciclo. Figura 29: Diagramas Pv y Ts para el ciclo de Brayton En la práctica este ciclo se cumple cuando se considera como sistema el aire estándar que llega a un compresor y en forma adiabática se comprime, es decir se realiza trabajo sobre él, luego pasa a un quemador donde se introduce el combustible y a presión constante ocurre la reacción de combustión con la cual se introduce calor al sistema, el aire y los gases de combustión salen a gran presión y alta temperatura y pasan a través de una turbina, realizando un proceso de expansión adiabática hasta que la presión se iguala a la presión atmosférica, generando en este proceso el trabajo útil. El ciclo se completa liberando calor a presión constante hasta alcanzar las condiciones del estado inicial. Los gases en estos dispositivos salen a la atmósfera no se recirculan por lo que el ciclo es abierto. La figura 99 ilustra muestra los componentes de una maquina que trabaja mediante el ciclo de Brayton: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Figura 30: Máquina que trabaja mediante el ciclo de Brayton La eficiencia en un ciclo de Brayton, como en los ciclos anteriores, se determina en función de las relaciones de presiones y la relación de calores específicos bajo las suposiciones de que el fluido de trabajo es aire estándar. 1 Qf 1 Qc nC p (T4 T1 ) (T T ) 1 4 1 nC p (T3 T2 ) (T3 T2 ) Ecuación 54 si se factoriza T1 y T2 en 228 se llega a la siguiente expresión T4 T1 ( T 1) 1 1 T ( T3 1) 2 T 2 Ecuación 55 Dado que los procesos 1-2 y 3-4 son adiabáticos se establecen las siguientes relaciones entre la temperatura y la presión T2 P2 T1 P1 ( T3 P3 T4 P4 ( 1 ) Ecuación 56 1 ) Ecuación 57 Considerando que los procesos 2-3 y 4-1 son isobáricos, P2 = P3 y P4 = P1 por lo tanto si se remplazan convenientemente estos valores de presiones en 211 o en 212 se concluye que para el ciclo de Brayton existe la siguiente entre las temperaturas T T2 T3 T o también 4 3 T1 T4 T1 T2 Ecuación 58 Al simplificar los paréntesis en la expresión de la eficiencia y remplazar la relación de temperaturas según la ecuación 213 se obtiene T1 1 1 1 1 1 ( ) T2 T2 P 2 T1 P1 1 Ecuación 59 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA La relación P2 se conoce como relación de presiones y se representa por rp por lo que P1 finalmente la eficiencia del ciclo de Brayton se expresa como: 1 1 r Ecuación 60 ( 1) / p Ejemplo 57 Determine el trabajo y el calor en cada proceso, la relación de presiones y la eficiencia para un ciclo de Brayton donde el aire entra al compresor a 95 kPa y 300 K, sale de él a una presión de 750 kPa y entra a la turbina a 1000 K. Figura 31: Datos del ejemplo Análisis del problema Existen varias alternativas para resolver este problema, en este caso utilizaremos el software para determinar las propiedades en cada estado y el trabajo y el calor involucrados. Los estados se especifican teniendo en cuenta los datos del problema y las condiciones de entropía constante en los procesos de 1 a 2 y de 3 a 4; así como también de presión constante en los procesos de 2 a 3 y de 4 a 1. SOLUCIÓN DEL PROBLEMA Con los datos proporcionados por el software y las condiciones del problema se construye la tabla siguiente. En ella los datos en negrilla se toman como referencia para calcular las otras propiedades. Estados 1 2 3 4 𝑘𝐽 Presión, kPa Temperatura, K Entalpía, 𝑘𝑚𝑜𝑙 95 750 750 95 300 538 1000 581 8725.5 15772.8 30399.7 17066.8 Entropía, 𝑘𝐽 𝑘𝑚𝑜𝑙.𝐾 198.55 198.55 218.048 218.048 Volumen, 𝑚3 𝑘𝑚𝑜𝑙 26.2557 5.9680 11.0857 50.8585 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Figura 32: Diagrama Pv para el ciclo de Brayton Proceso 𝑘𝐽 𝑘𝐽 Trabajo, 𝑘𝑚𝑜𝑙 Calor, 𝑘𝑚𝑜𝑙 1-2 Isentrópico 2-3 Isobárico 3-4 Isentrópico 4-1 Isobárico -5020.9 3838.3 9774.3 -2337.3 0 14626.9 0 -8341.2 Wneto 5020.9 3838.3 9774.3 2337.3) Relación de Presiones 1 Eficiencia 1 r 1 p kJ kJ 6254.4 kmol kmol P2 750 kPa 7.895 P1 95 kPa 1 1 7.89 1.4 1 1.4 0.45 Lección 25: Máquinas frigoríficas Los motores que acabamos de estudiar, tanto de combustión interna como de combustión externa, utilizan el combustible para producir y mantener un foco caliente, del cual extraen calor y mediante la compresión de un gas, producen trabajo y pasan el calor no utilizado a un foco frío. Este es en resumen el funcionamiento de un motor térmico. El caso de una máquina refrigerante podríamos decir que es todo lo contrario del motor térmico. La máquina refrigerante o frigorífica utiliza una fuente de energía externa, generalmente corriente eléctrica como en el caso de una nevera o refrigerador común, para quitar calor de una fuente fría (enfriar) y dárselo a una fuente caliente. En la vida real la UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA fuente fría tiene una temperatura inferior a la del medio ambiente (interior de la nevera) y la fuente caliente es el aire que rodea la máquina y que sirve como disipador de calor. Los dos procedimientos más conocidos para efectuar la refrigeración son: compresión (ciclo de vapor) y absorción. Entre estos dos el más extendido es el de compresión, que estudiaremos a continuación. El refrigerador por compresión consta de cuatro partes fundamentales, figura 61: compresor, condensador, válvula de estrangulamiento y evaporador. Figura 33: Esquema de un refrigerador por compresión Las etapas que componen el ciclo de refrigeración son: 1. Compresión adiabática de P2 a P1 (1 2). El vapor saturado y seco se comprime adiabáticamente mediante el compresor. 2. Enfriamiento del vapor sobrecalentado (2 3). El vapor sobrecalentado por la compresión adiabática pasa al condensador, donde cede una cantidad de calor Q1 y el gas se convierte en una mezcla. 3. Expansión irreversible del líquido (3 4). La expansión de la mezcla líquido más vapor a través de la válvula de estrangulamiento enfría aun más el líquido, en el caso de una nevera lo lleva casi a 0 °C y queda listo para pasar al evaporador. 4. Evaporación del líquido (4 1). La mezcla del líquido con muy poco vapor entra al evaporador (interior de la nevera o del refrigerador), en donde absorbe calor para evaporarse y producir vapor regresando así al punto inicial del ciclo. Como particularidades del ciclo de refrigeración hay que recordar varias cosas. El ciclo, tal y como se ha explicado anteriormente, corresponde a un ciclo de Carnot inverso: figura UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 100a, en donde se muestran principalmente las zonas de condensación y evaporación en donde cede y absorbe calor, respectivamente. Pero la compresión adiabática produce un vapor sobrecalentado, proceso isentrópico, que se muestra en el pico de la derecha de la figura 100b. Figura 34: Diagrama para el refrigerador: a) de Carnot y b) real mostrando la región del vapor recalentado De otra parte, la expansión del líquido en la válvula de estrangulamiento no es un proceso isentrópico, sino isentálpico, similar al efecto Joule-Kelvin que se estudió previamente; lo cual se muestra por la línea punteada que aparece en la figura 100, literales a y b. La eficiencia del refrigerador de Carnot se define por el cociente entre la cantidad de calor extraída Q2 y el trabajo suministrado |𝑊| en valor absoluto, para no tener problemas de signos. Nos queda: Q2 Q2 T2 W Q1 Q2 T1 T2 Ecuación 61 Generalmente T2 > (T1 – T2), el rendimiento puede ser mayor que uno. Para evitar el problema de un rendimiento mayor que uno, la η de refrigeración se le da el nombre de efecto frigorífico o coeficiente de amplificación frigorífica. Para el caso del frigorífico que no cumple con el ciclo de Carnot, más bien se comporta algo parecido a un ciclo de Rankine inverso, la eficiencia puede ser calculada de otra manera. La eficiencia queda definida por: Q2 Q1 Q2 Dado que el paso (4’ 1) es un proceso isobárico: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 𝑄2 = 𝐻1′ − 𝐻4′ Como el paso (1’ 2 3) es también isobárico: 𝑄1 = 𝐻1′′ − 𝐻3 H 1' H 4' H 1'' H 3' H 1' H 4' Pero para el proceso isentálpico: 𝐻3 = 𝐻4′ H 1' H 4' H 1' H 3' H 1'' H 1' H 1'' H 1' De esta manera podemos calcular la eficiencia de un refrigerador no ideal (no del tipo de Carnot) de una manera similar a los cálculos que hicimos para la máquina de Rankine, con base en temperaturas, presiones, entalpías y entropías de vapor saturado, vapor sobre calentado, líquido saturado y títulos de vapor húmedo. Para el caso del título recordemos que viene dado por la fórmula: X H 4' H 4 H1'' H 4 La eficiencia o factor de amplificación de un refrigerador calculada por el ciclo de Carnot es siempre mayor, que para un ciclo no ideal. En general, los refrigeradores comerciales tienen una capacidad para producir temperaturas bajas, determinada empíricamente (experimentalmente); pero en cualquiera de los casos no puede ser mayor que la calculada teóricamente, con la cual esta sección se convierte en un punto de referencia para comparar la calidad de una máquina comercial. Ejemplo 58 Un refrigerador sigue un ciclo ideal en el cual consume una potencia de 100 W. La temperatura exterior (foco caliente) es de 45°C. ¿Cuánto tiempo gastará en congelar 4 kg de agua introducidos al refrigerador a la temperatura ambiente? Análisis del problema Generalmente los motores eléctricos que accionan el compresor, vienen caracterizados por un consumo de energía expresado por: caballos de fuerza, HP; caballos de vapor CV; watios, W; etc. En nuestro caso particular de W (watios) recordemos que se refiere al producto de la intensidad de corriente (amperios, A) por el voltaje (voltios, V), UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA necesarios para hacer mover el motor del compresor. La potencia de un motor es el 𝑃 cociente entre el trabajo y el tiempo 𝑃 = 𝑡 . De otro lado, el agua está a la temperatura de 45°C y hay que llevarla a hielo a 0°𝐶. Esto deberá hacerse en dos fases: la primera bajar la temperatura del agua de 45°C a 0°𝐶 y la segunda, pasar de agua líquida a 0°C a agua sólida a 0°𝐶. Las dos fases requieren que quitemos calor, teniendo en cuenta que el proceso se lleva a cabo a presión 𝑐𝑎𝑙 constante: 𝐶𝑃 = 1 𝑔.𝐾 y el calor de fusión es de 80 𝑐𝑎𝑙 . 𝑔 El factor de amplificación viene dado por las temperaturas del foco o fuente caliente: 𝑇 = 45°𝐶 y la del foco frío: 𝑇 = 0°𝐶; podemos calcular el trabajo neto (𝑊 = 𝑃. 𝑡) necesario para producir los 4 𝑘𝑔 de hielo. Solución del problema Cantidad de calor Q2 que se debe retirar: 𝑄2 = 4000𝑔. 1 𝑐𝑎𝑙 𝑐𝑎𝑙 (318 − 273)𝐾 + 4000𝑔. 80 𝑔. 𝐾 𝑔 𝑄2 = 180000 𝑐𝑎𝑙 + 320000 𝑐𝑎𝑙 = 500000 𝑐𝑎𝑙 = 500 𝑘𝑐𝑎𝑙 El coeficiente de amplificación frigorífica: Q2 T2 W T1 T2 Pero 𝑊 = 𝑃. 𝑡; entonces: J W .s 500000 cal (318 - 273)K 4.184 1.0 Q2 .T1 T2 cal J t 3444 s T2 .P 273 K 100 W CICLO INVERSO DE CARNOT El ciclo inverso de Carnot, mencionado ya en el capítulo 9, es el ciclo ideal estándar para los refrigeradores o bombas de calor. Este ciclo consta de cuatro procesos reversibles: 1. Compresión adiabática o isentrópica de 1 a 2 2. Compresión isotérmica de 2 a 3 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 3. Expansión adiabática o isentrópica de 3 a 4 4. Expansión isotérmica de 4 a 1 Los anteriores procesos se muestran en los diagramas Pv y Ts de la figura 106. El ciclo inverso de Carnot solo tiene importancia teórica ya que en la práctica es difícil realizar tales procesos pero su coeficiente de operación sirve como referencia para comparar el rendimiento de otros ciclos. En el diagrama Ts, los procesos adiabáticos corresponden a líneas rectas de entropía constante, limitadas por las líneas isotermas. El área encerrada entre estas líneas representa el calor intercambiado durante el ciclo. Figura 35: Ciclo inverso de Carnot CICLO IDEAL DE REFRIGERACIÓN POR COMPRESIÓN DE VAPOR La refrigeración por compresión de vapor se fundamenta en el principio de que toda sustancia líquida requiere necesariamente que se le suministre calor para que pueda evaporarse, si no se da esta condición no se presenta el cambio de fase. Dentro de la gran cantidad de sustancias líquidas hay algunas que pasan más fácilmente a la fase de vapor que otras. Por ejemplo si Ud. deja caer sobre una superficie plana, a temperatura ambiente, unas cuantas gotas de agua, acetona o alcohol etílico, ¿cuál cree que se va a evaporar más rápidamente? A igual temperatura, la presión de vapor de la acetona es mayor que la del alcohol etílico y la de éste, a su vez, es mayor que la del agua, por lo tanto, la acetona se vaporiza primero. Esta característica es muy importante considerar cuando haya que elegir un buen refrigerante. La capacidad de refrigeración de una sustancia se puede comprobar mediante una experiencia muy sencilla, se humedece un algodón con uno de los líquidos como los ya mencionados, se coloca junto al bulbo de un termómetro y se registran las temperaturas, es de esperarse que la temperatura más baja se presente en aquel líquido que tenga el menor punto de ebullición y el más alto calor de evaporación. Otras características que debe poseer un buen refrigerante son las de no ser tóxico, corrosivo o inflamable de ser químicamente estable y por su puesto de fácil acceso y económico. Históricamente y desde que comenzó a finales del siglo XIX la refrigeración mecánica, se han empleado numerosas sustancias como refrigerantes tales como el éter etílico, el UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA dióxido de azufre, hidrocarburos de bajo peso molecular, pero rápidamente fueron sustituidos debido a su inflamabilidad o a su alto grado de corrosión. El amoniaco también se utilizó ampliamente como refrigerante en los primeros refrigeradores domésticos pero en la actualidad, pese que es una sustancia tóxica, todavía se emplea en gran medida para refrigeración a nivel industrial. En los refrigeradores comerciales y cuartos fríos se utilizan todavía algunos de los refrigerantes desarrollados a partir de la tercera década del siglo XX, conocidos como clorofluoronarbonos (CFC), el principal de ellos es el diclorodifluorometano, también conocido como Freón 12 o simplemente refrigerante 12. Los investigadores han desarrollado muchos compuestos de esta familia como los R-11, R14, R22, R134, R218 entre otros, para brindar los refrigerantes apropiados a las condiciones particulares de refrigeración. Estos compuestos si bien tienen excelentes propiedades refrigerantes, tienen el inconveniente de que ocasionan el deterioro de la capa de ozono y favorecen el efecto invernadero, por esta razón en muchos países se están restringiendo sus aplicaciones. Los científicos trabajan en la consecución de otras sustancias que no tengan este problema como los CFC no halogenados completamente y entre los cuales se propone el uso del metilcloroformo. El ciclo termodinámico de refrigeración por compresión de vapor que realiza el refrigerante consta de cuatro procesos: 1. Compresión adiabática en el compresor (1 a 2). 2. Eliminación de calor a presión constante en el condensador (2 a 3). 3. Estrangulamiento a entalpía constante mediante un tubo capilar o una válvula de expansión (3 a 4). 4. Absorción de calor a presión constante en el evaporador (4 a 1). Es importante comprender y analizar los cambios que se dan en el refrigerante en cada uno de estos procesos para ello, este ciclo se representan en diagramas Ts y Ph como los de la figura 102. Observe detenidamente estos diagramas. Ubique en ellos el punto 1, observará que se encuentra sobre líneas que representan vapor saturado. Al aumentar la presión en forma reversible y adiabática la entropía se mantiene constante y hay un aumento de temperatura; entonces por acción del compresor, el refrigerante cambia de vapor saturado a vapor sobrecalentado (punto 2 del diagrama). En este estado el refrigerante entra al condensador; en él se llevan a cabo dos procesos reversibles: el primero corresponde a un enfriamiento a presión constante hasta que de vapor sobrecalentado se transforma a vapor saturado (punto a) y el segundo corresponde a la transformación hasta líquido saturado (punto 3). UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Figura 36: Diagramas Ts y Ph del ciclo de refrigeración por compresión de vapor El siguiente es un proceso especial ya que se trata de una expansión irreversible donde la entalpía se mantiene constante, como consecuencia disminuyen tanto la presión como la temperatura, se produce una vaporización parcial y aumentan el volumen específico y la entropía; el estado final de este proceso corresponde a una mezcla de líquido y vapor de baja calidad (punto 4). Finalmente a presión y temperatura constantes ocurre el último proceso que corresponde al cambio de fase de líquido a vapor saturado para de esa forma completar el ciclo termodinámico. Es conveniente resaltar que en el proceso entre 4 y 1 el refrigerante al evaporarse retira calor del medio circundante y en el proceso entre 2 y 3 al enfriarse y posteriormente condensarse cede calor al exterior y en el proceso entre 1 y 2 se efectúa trabajo sobre el refrigerante. Estos intercambios de energía son importantes para determinar el rendimiento o coeficiente de operación. Mediante este ciclo funcionan los refrigeradores domésticos, sistemas de aire acondicionado, bombas de calor y muchos de los sistemas de refrigeración industrial. En la figura 103 se muestran los componentes de un refrigerador doméstico. Los números corresponden a los estados por los que pasa sucesivamente el refrigerante en cada ciclo. Figura 37: Componentes de un refrigerador La parrilla posterior tiene un diseño que facilita la radiación e intercambio de calor. En refrigeradores pequeños el proceso de estrangulamiento o expansión isoentálpica donde el líquido es forzado a pasar de una región de alta presión a una región de más baja presión se realiza mediante un simple tubo capilar, es más económico y no presenta problemas de mantenimiento, en sistemas industriales se utilizan válvulas de expansión. El interior de la nevera y el congelador se encuentran aislados del medio exterior mediante aislantes térmico como poliuretano y lana de vidrio, de tal manera que la absorción de calor del interior provoca la disminución de la temperatura. El compresor es accionado por un motor eléctrico el cual se encuentra conectado a un sistema de termostato que permite ponerse en marcha cuando la temperatura alcanza un UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA valor superior al límite deseado o apagarse si la temperatura baja de un determinado valor. En promedio las temperaturas que se manejan son de 5 ºC en el espacio de refrigeración y -10 ºC en el congelador. La eficiencia para los ciclos de refrigeración se expresa como coeficiente de operación y constituye la relación entre el calor retirado del espacio refrigerado QF y el trabajo suministrado por el compresor W. COP Qf W h1 h4 h2 h1 Ecuación 62 Las propiedades termodinámicas del refrigerante influyen en el coeficiente de operación del refrigerador debido ya que éste depende de los valores de la entalpía del refrigerante en cada estado del ciclo. Ejemplo 59 Al compresor de un refrigerador entra, a razón de 0.06 kg/s, diclorodifluorometano, conocido como refrigerante 12, en estado de vapor saturado a 120 kPa y sale a 780 kPa. Determine la temperatura a la entrada y salida del compresor, temperatura a la salida del condensador, cantidad de calor por segundo retirado del congelador, la potencia de entrada del compresor y el coeficiente de operación. Figura 38: Diagrama Ph ANÁLISIS DEL PROBLEMA Para solucionar este tipo de problemas se deben conocer las propiedades termodinámicas del refrigerante, esto se consigue a partir de las tablas en manuales de refrigeración o mediante software. Utilizaremos en este caso tablas que aparecen en el apéndice de este módulo las cuales se construyeron a partir del software desarrollado por el National Institute of Standards and Technology NIST. Como se conoce que el estado 1 corresponde a vapor saturado, se determinan a partir de la presión y calidad igual a 1, la temperatura de saturación, la entalpía y la entropía del vapor saturado. Dado que el proceso entre 1 y 2 es isentrópico se toma como referencia el valor de la entropía del estado 1 y a la presión del estado 2 que es conocida se determinan la temperatura y la entalpía. Como el proceso entre 2 y 3 se realiza a presión constante, con esta presión se determina la entalpía de líquido saturado y la temperatura de saturación. El valor de entalpía del estado 3 es el mismo del estado 4 ya UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA que el proceso entre 3 y 4 es isoentálpico. Con el valor de las entalpías se realizan los cálculos correspondientes para dar respuesta al problema. SOLUCIÓN DEL PROBLEMA 𝑘𝐽 𝑘𝐽 Estado Título x Presión, kPa Temperatura, ºC Entalpía, 𝑘𝑔 Entropía, 𝑘𝑔.𝐾 1 2 3 4 1 V 0 0.3278 120 780 780 120 -25.66 44.93 31.85 -25.66 176.5 209.6 66.3 66.3 0.7146 0.7146 0.2453 0.2693 Temperatura a la entrada del compresor -25.7 ºC Temperatura a la salida del compresor 44.9 ºC Temperatura a la salida del condensador 31.9 ºC Calor retirado del congelador: QF m(h1 h4 ) (0.06 kg kJ kJ )(176.5 66.3) 6.61 s kg s Potencia del compresor: . W m(h2 h1 ) (0.06 COP kg kJ kW.s )(209.6 176.5) 1.0 1.99 kW s kg kJ h1 h4 (176.5 66.3) 3.32 h2 h1 (209.6 176.5) Dos refrigerantes tienen presiones de vapor similares a iguales temperatura pero el refrigerante A, tiene un valor de hfg mayor que el del refrigerante B. ¿Cuál considera Ud. que presente un mayor coeficiente de operación? Justifique su respuesta. CAPÍTULO 6: APLICACIONES DE LA TERMODINÁMICA INTRODUCCIÓN UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA En los siguientes capítulos vamos a estudiar el análisis dimensional y las aplicaciones de la termodinámica a procesos de flujo continuo y transitorio. Lección 26: Análisis dimensional El sistema que se utiliza en este módulo es el llamado Sistema Internacional de Unidades, abreviadamente SI, adoptado en 1960 por la Conferencia de Pesas y Medidas, para el uso en Ciencia y Tecnología. Los diferentes nombres de unidades, símbolos y equivalencias se dan en las tablas que aparecen a continuación. Tabla 1: Nombres y símbolos de la base de unidades SI Cantidad Longitud Masa Tiempo Corriente eléctrica Temperatura termodinámica Cantidad de sustancia Unidad metro kilogramo segundo amperio kelvin mol Símbolo m kg s A K mol Tabla 2: Unidades derivadas del sistema SI que tienen nombres y símbolos especiales Cantidad Unidad Símbolo Definición de la unidad Frecuencia Energía Fuerza Potencia Presión Carga eléctrica Diferencia de potencial eléctrico Resistencia eléctrica Conductancia eléctrica Capacitancia eléctrica Flujo magnético Inductancia Densidad de flujo magnético hertz joule newton watt pascal coulombio voltio ohmio siemens faradio weber henry tesla Hz J N W Pa C V Ω S F Wb H T s-1 m2.kg.s2 m.kg.s-2 = J.m-1 m2.kg.s-3 = J.s-1 m-1.kg.s-2 = J.m-3 s.A m2.kg.s-3.A-1 = J.s-1.A-1 m2.kg.s-3..A-2 = V.A-1 m2.kg-1. s3.A2 m2.kg-1. s4.A2 =C.V-1 m2.kg. s-2.A-1 = V.s m2.kg.s-2.A-2 =V.s.A-1 kg.s-2.A-1 = V.m2.s Tabla 3: Prefijos del sistema SI Submúltiplo Prefijo Símbolo Múltiplo Prefijo Símbolo 10-1 deci d 10 deca da 10-2 centi c 2 10 hecto h 10-3 mili m 3 10 kilo k 10-6 micro μ 6 10 mega M 10-9 nano n 9 10 giga G 10-12 pico p 12 10 tera T 10-15 femto f UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 10-18 atto a Tabla 4: Fracciones y múltiplos decimales que tienen nombre especial en el sistema SI Cantidad Física Unidad Símbolo Definición de la Unidad Longitud Angstrom Å 10-10 Longitud micrón μ 10-6m Área barn b 10-28m2 Fuerza dina dyn 10-5N Presión bar bar 105N.m2 Energía ergio erg 10-7J Viscosidad cinemática stockes St 10-4m2.s-1 Viscosidad poise P 10-1kg.m-1.s-1 Cantidad Física Longitud Masa Fuerza Presión Presión Presión Energía Energía Energía Energía Masa Momento dipolar elec. Carga por mol Tabla 5: Unidades no pertenecientes al sistema SI Unidad Símbolo Definición de la Unidad pulgada in 2.54 x 10-2m libra(avoir dupois) lb 0.45359237 kg kilogramo-fuerza kgf 9.80665 N atmósfera atm 101325 N.m-2 torr torr (101325/760)N.m-2 milímetro de Hg mmHg 13.5951x980.665x102 unidad térmica británica BTU Nm2 kilowatt-hora kWh 1 055.056J caloría termo-química cal 3.6 x 106J electrón voltio eV 4.184 J unidad de masa atómica u 1.6022 x 10-19 J unificada 1.66041 x 10-27 kg Debye D Faraday F 3.33564 x 10-30A.m.s 9.648 x 10 C moI-1 Tabla 6: Valores de la constante R de los gases R Energía = P.V n’ Temperatura R ergio g K 8.314x l07 caloría g K 1.987 joulio g K 8.314 atm-litro g K 0.08205 mm Hg-litro g K 62.36 kgf/cm2 litro g K 0.08478 mm Hg – ft3 lb K 998.9 atm-ft lb K 1.314 BTU lb °R 1.986 hp hr lb °R 7.805 x 10-4 kw hr lb °R 5.819x 10-4 3 atm - ft lb °R 0. 7302 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA mm Hg – ft3 in.Hg-ft3 lbf/in. - ft3 lbf/ft2 - ft3 lb lb lb lb °R °R °R °R 555.0 21.85 10.73 1.545 En donde n’ es el número de motes expresados en gramos mol (gr mol) o en libras mol (lb mol). Cuando se habla de longitud necesariamente se hace referencia a cualquiera de los sistemas de unidades que usualmente se utilizan, como son: el sistema métrico decimal (unidad = metro) y el sistema sajón de longitud (unidad = pulgada). Esta observación parece simple, pero la experiencia muestra que muchas veces en la resolución de un problema en donde intervienen diversas unidades, como es el caso de la termodinámica, el estudiante tiende a fijar su atención en las operaciones algebraicas que se realizan con los valores numéricos y no considera el tipo de unidad que está usando; en consecuencia, se produce el caso paradójico de que habiendo resuelto el problema conceptual perfectamente y, por supuesto, el algebraico, el estudiante obtiene una respuesta que no concuerda con la presentada en el solucionario. Por lo tanto, el análisis dimensional es el proceso que se ocupa de establecer que las unidades empleadas para resolver las ecuaciones sean las mismas, con el objeto de hacer las debidas simplificaciones de dichas unidades. De acuerdo con la definición anterior, el resultado de efectuar la simplificación consistiría en expresar la respuesta en un solo tipo de unidades de masa, tiempo, espacio, etc. En este caso hablamos que las magnitudes empleadas que poseían el mismo tipo de unidades, tenían consistencia dimensional o que eran dimensionalmente consistentes. Esta situación es particularmente interesante en termodinámica en donde el resultado puede expresarse en unidades científicas o en unidades técnicas. El estudiante deberá desarrollar especial atención y práctica al respecto, resolviendo problemas, ejercitándose en pasar del sistema métrico al sistema sajón y viceversa. Ejemplo 60 La capacidad calorífica de un gas viene dada por la ecuación 𝐶𝑃 = 3.38 + 18.04𝑥10−3 𝑇, siendo T la temperatura en grados Kelvin y las unidades de la capacidad calorífica en calorías/mol.K. Exprese el valor de Cp en función de la temperatura en: Grados Celsius o centígrados Grados Fahrenheit Grados Rankine Análisis del problema UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA El cambio de unidades es una situación bastante frecuente. Para esto es necesario ser cuidadosos con las unidades utilizadas y con el uso de factores de conversión. Solución del problema La capacidad calorífica de un cuerpo es la cantidad de calor que puede absorber un cuerpo para subir en un grado su temperatura. En este problema dicha capacidad es una función de la temperatura. Es así como su valor va a depender de la temperatura que tenga el cuerpo. Aquí la capacidad calorífica está expresada en grados Kelvin y se debe hacer su equivalencia a grados Celsius, Fahrenheit y Rankine respectivamente. Paso 1: Equivalencia de la escala Celsius y Kelvin: 𝐾 = ℃ + 273. Entonces, 𝐶𝑃 = 3.38 + 18.04𝑥102 (℃ + 273.15) 𝐶𝑃 = 8.30 + 18.04𝑥10−3 ℃ Paso 2: Equivalencia de la escala Celsius y Fahrenheit: ºF 9 5 º C 32 , o lo que es igual: º C º F 32 5 9 5 Luego: C p 8.30 18.04 x10 5 º F 32 9 C p 7.98 10.02 x103 º F Paso 3: Equivalencia de la escala Fahrenheit y de la escala Rankine: º𝑅 = ℉ + 459.67 Luego: ℉ = º𝑅 − 459.67 𝐶𝑃 = 7.98 + 10.02𝑥10−3 (º𝑅 − 459.67) 𝐶𝑃 = 3.37 + 10.02𝑥10−3 º𝑅 De esta manera quedaron expresadas las capacidades caloríficas en grados Celsius, Fahrenheit y Rankine. Ejemplo 61 Calcule la Unidad Térmica Británica (BTU) en su equivalencia de calorías por grado Celsius. La BTU se define como la cantidad de calor necesario para elevar la temperatura en un grado Fahrenheit de una libra inglesa de agua (454 grs). La cantidad de calor necesario para elevar la temperatura en un grado Celsius de un gramo de agua se llama una caloría. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Análisis del problema Es necesario consultar las tablas de conversión y buscar un factor que al usarlo se vayan cancelando las unidades. Solución del problema Una libra inglesa equivale a 454 gramos. Paso 1: Si se quisiera elevar la temperatura de 454 gramos de agua en un grado Celsius, la cantidad de calor que se tendría que suministrar: Cantidad de calor 454 g cal cal x1.0 454 lb g.º C lb.º C Paso 2: Del gráfico de equivalencias de escalas vemos que en el intervalo entre 32°F y 212°F hay 180°F, los cuales equivalen al intervalo entre 0°C y 100°C, en donde hay 100°C. Por consiguiente, 180°F = 100°C o lo que es igual: º C 9 ºF . 5 Reemplazando este valor en la cantidad de calor, tenemos: Cantidad de calor 454 cal cal 252 lb.º F 9 lb. º F 5 Es decir 1.0 BTU = 252 cal. Lección 27: Aplicación de la termodinámica a procesos de flujo estable Primero que todo, hay que tener en cuenta la masa que fluye hacia adentro y hacia afuera del volumen de control y la diferencia entre la masa que entra y la que sale da el incremento neto de masa dentro de dicho volumen. Considerando un volumen de control en un instante cualquiera, 𝑡, y haciendo que durante un intervalo de tiempo δt entre al volumen de control la masa 𝛿𝑚𝑖 y que salga de él la masa 𝛿𝑚𝑒 , tal como se muestra en la figura 105. Por otra parte, llamaremos 𝛿𝑚t a la masa dentro del volumen de control en el instante 𝑡 y 𝛿𝑚𝑡+𝛿𝑡 a la masa dentro del volumen de control en el instante 𝑡 + 𝛿𝑡. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Entonces, al aplicar el principio de la conservación de la masa, se puede escribir: 𝑚𝑡 + δ𝑚𝑖 = 𝑚𝑡+δ𝑡 + δ𝑚e . Figura 39: Diagrama esquemático de un volumen de control para analizar como puede aplicarse la ecuación de continuidad También se puede considerar la situación desde el punto de vista del cambio de masa en el volumen de control y el flujo neto de masa que cruza la superficie de control. Al aplicar la ley de conservación de masa, tendremos que el aumento de masa dentro del volumen de control en el intervalo 𝑑𝑡 será igual al flujo neto de masa dentro de dicho volumen durante el intervalo 𝑑𝑡. Es decir, se puede escribir: (𝛿𝑚𝑖 − 𝛿𝑚𝑒 ) = 𝑚𝑡+𝛿𝑡 − 𝑚𝑡 Reorganizando: (𝒎𝒕+𝜹𝒕 − 𝒎𝒕 ) + (𝜹𝒎𝒆 − 𝜹𝒎𝒊 ) = 𝟎 Por otra parte, en el análisis termodinámico de muchos problemas es conveniente expresar la ley de la conservación de masa como una ecuación de rapidez en el cambio para un volumen de control. Ello implica considerar el flujo de masa instantáneo que cruza la superficie de control y la rapidez del cambio de masa dentro del volumen de control. Para escribir dicha ecuación, podemos considerar la 𝑞 = ∆ℎ como punto de partida para expresar el promedio de flujo de masa que cruza la superficie de control durante el intervalo UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 𝛿𝑡 y el promedio de rapidez en el cambio de la masa existente en el interior del volumen de control durante 𝛿𝑡; lo cual se logra dividiéndola por 𝛿𝑡: mt t mt me mi t t 0 Ecuación 63 Ahora se va a desarrollar una ecuación que dé el valor instantáneo de la rapidez en el cambio para cada término de la Ecuación 220. Primero se considera el segundo término de dicha ecuación. En la figura 105 se muestra un elemento de la superficie de control, 𝛿𝐴𝑒 , ocurriendo a través de ella un flujo hacia afuera. La rapidez del flujo que sale cruzando 𝛿𝐴𝑒 es 𝛿𝑚𝑒 . Ser hace notar que m” se emplea para designar la rapidez del flujo de masa que cruza una superficie de control y, para el caso, δ significa que es la rapidez de flujo sólo en un elemento δAe de dicha superficie. La rapidez del flujo de salida a través de toda la superficie de control puede encontrarse integrando sobre el área completa; o sea, se puede escribir: me'' me'' A Análogamente, para el flujo de entrada podemos escribir: mi'' mi'' A La rapidez de flujo puede expresarse también en términos de velocidad y densidad, de acuerdo con la relación: 𝛥𝑚𝑒𝑜 = 𝛿𝑉𝑛 𝛿𝐴𝑒 Donde, como se muestra en la figura 106 Vn es la componente normal de Vr, velocidad relativa al área δAe en la dirección α relativa a la salida normal a δAe y ρ es la densidad de la masa que en ese punto cruza la superficie de control. De la figura 106, se puede notar también que: 𝑉𝑛 = 𝑉𝑟 𝑐𝑜𝑠 𝛼 Si el flujo es hacia adentro, la expresión también es válida, sólo que el 𝑐𝑜𝑠 𝛼 es negativo. Por tanto, el flujo neto hacia afuera que cruza el volumen de control completo puede escribirse como una integral de superficie para la ecuación: (δm′𝑒 )𝑛𝑒𝑡𝑜 = ρ𝑉𝑟 . cosα. dA Integrando: m ' e neto Vr . cos .dA Consideremos ahora el intervalo de tiempo 𝛿𝑡. Para ello, podemos designar: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA .V .cos .dA A r promedio Éste es el promedio de rapidez de flujo que cruza la superficie de control durante dicho intervalo de tiempo. Figura 40: Área en una superficie de control a través de la cual hay un flujo de masa hacia fuera Se puede concluir que (𝛿𝑚𝑒 − 𝛿𝑚𝑖 ), la masa neta que fluye a través de la superficie de control durante 𝛿𝑡 está dada por: me mi A .Vr . cos .dApromediot Que también puede escribirse como: me mi t .V .cos .dA A r promedio Ecuación 64 Consideremos ahora el primer término de la ecuación 220. Allí, (𝑚𝑡+δt − 𝑚𝑡 ) representa el cambio de masa del volumen de control durante 𝛿𝑡. Se puede escribir como una integral de volumen, si se considera un elemento de volumen, 𝑑𝑉, dentro del volumen de control, en donde la densidad es 𝜌, e integrando sobre el volumen de control. Es decir, en un instante dado, la masa en el volumen de control es dV , y por lo tanto: V mt t mt V dV Ahora, si consideramos el intervalo de tiempo 𝛿𝑡 se puede escribir: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA mt t mt t dV t V Ecuación 65 Sustituyendo la ecuación 223 en la 222, se obtiene: dV .Vr . cos .dA 0 promedio t Ecuación 66 Cuando 𝛿𝑡 → 0, en el límite, la rapidez instantánea del cambio de masa dentro del volumen de control y la rapidez instantánea del flujo de masa a través de la superficie de control serán: lím mt t mt t t 0 lím t 0 me mi t lím lím t 0 d dV dV V t dt V V .cos .dA t 0 A r promedio .Vr . cos .dA A Sustituyendo estas dos expresiones en la ecuación 223, tendremos que la ecuación de rapidez para la ley de la conservación de masa, relativa a un volumen de control y llamada comúnmente ecuación de continuidad, es: d dV dVr . cos .dA 0 A dt V Ecuación 67 Se debe notar que Vr es relativa a la superficie de control en el área dA. Se asumirá siempre que el volumen de control es fijo con relación a un sistema coordenado, lo que es razonable; por lo cual, si la superficie de control no se mueve con relación al sistema coordenado, 𝑉𝑟 = 𝑉 donde V es la velocidad del fluido relativa a dicho marco coordenado. En un volumen de control con flujo estable, la masa se mantiene constante con el tiempo, de tal manera que la cantidad de materia que entra al sistema en un intervalo de tiempo dado, debe ser igual a la cantidad de materia que sale del sistema. El volumen de control puede tener una o varias secciones de entrada y así mismo una o varias secciones de salida. Para este caso general, el principio de conservación de la masa se expresa mediante la siguiente ecuación: m. m. i Ecuación 68 j Donde el subíndice i representa cualquiera de las corrientes de entrada y el subíndice j representa cualquiera de las corrientes de salida. Si en la ecuación anterior los flujos másicos se remplazan por sus equivalencias en función de densidad, velocidad y área se llega a la siguiente ecuación general: V i i Ai j V j A j Ecuación 69 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Si el volumen de control posee solo una entrada y una salida, como en muchos de los dispositivos utilizados industrialmente, la ecuación anterior se expresa en forma más sencilla como: 1 V 1 A1 2 V 2 A2 Ecuación 70 Donde el subíndice 1 significa el punto a la entrada del sistema y el subíndice 2 el punto de salida. La ecuación 227 se conoce generalmente como la ecuación de continuidad y permite calcular la velocidad para un determinado diámetro de la tubería o el diámetro de una tubería para alcanzar una determinada velocidad si se conoce el flujo másico. Observe que entre la velocidad promedio del fluido y el área de la sección transversal existe una relación inversamente proporcional, es decir si se reduce el área aumenta la velocidad y al contrario si se aumenta el área la velocidad disminuye. Esta relación la puede comprobar fácilmente al reducir o aumentar la abertura de una boquilla de una manguera conectada a una línea de agua. Una de las características de mayor interés de la termodinámica es su gran aplicabilidad en el diseño de muchos equipos, instrumentos y dispositivos donde se intercambia energía. A continuación se analizarán diferentes casos de procesos termodinámicos con aplicación práctica y se desarrollarán ejemplos que ilustran los cálculos pertinentes. Se empezará por describir las condiciones termodinámicas de operación, bajo el régimen de flujo estable, de los equipos utilizados con más frecuencia en la industria química, farmacéutica y de alimentos, como es el caso de intercambiadores de calor, bombas y compresores, válvulas de estrangulamiento, toberas y difusores dispositivos de mezcla y flujo de fluidos. Intercambiadores de calor Los intercambiadores de calor son equipos que permiten realizar la transferencia de calor entre dos fluidos sin que haya mezcla entre ellos. Esta operación se realiza a nivel industrial con el objeto de adecuar las propiedades termodinámicas de uno de los fluidos a las exigencias del proceso en particular. Estos equipos son muy utilizados industrialmente y los hay de diferentes clases, tamaños y diseños dependiendo de cada necesidad, pero la forma más simple y generalizada de un intercambiador de calor es el arreglo formado por dos tubos concéntricos de diferente UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA diámetro, de tal manera que uno de los fluidos circula por el tubo interior y por el espacio anular entre las dos tuberías, el otro, como se indica en la figura 116. En ella la línea segmentada exterior representa el volumen de control referido a todo el intercambiador mientras que la línea segmentada interior representa volumen de control referido a uno de los fluidos. Observe que en el primer caso no hay transferencia de calor, en el segundo uno de los fluidos cede calor al otro. La elección del volumen de control apropiado depende de las variables que se conozcan y de las incógnitas que se requieran determinar. Figura 41: Intercambiador de calor Otros ejemplos de equipos donde se presenta transferencia de calor son los evaporadores, condensadores, calderas, serpentines, radiadores. Los cambios de velocidad y de altura en estos equipos generalmente son insignificantes por lo que no se presentarán cambios apreciables de energía cinética y de energía potencial y tampoco se realiza trabajo. Por lo tanto, si el volumen de control corresponde a uno de los fluidos, resultado de la aplicación de la primera ley de la termodinámica, bajo estas condiciones, se expresa como: q h Ecuación 71 Lo cual significa que el calor por unidad de masa cedido o ganado por uno de los fluidos es igual al cambio de su entalpía específica. Generalmente los intercambiadores de calor se encuentran bien aislados para evitar las pérdidas de energía hacia el exterior, si se elije el volumen de control para todo el intercambiador justo por debajo del aislamiento, entonces el calor será igual a cero lo cual significa que el cambio global de entalpía debe ser igual a cero y por lo tanto la suma de las entalpías de las corrientes que entran al intercambiador serán iguales a la suma de las entalpías de la corrientes que salen de él. Por lo tanto se establece que: . . . . m A h1 mB h1 m A h2 mB h2 Al factorizar se llega a que Ecuación 72 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA . . m A (h1 h2 ) mB (h2 h1 ) Ecuación 73 Esta ecuación permite determinar la relación de flujos másicos si se conocen las entalpías o determinar entalpías de entrada o salida si son conocidos los flujos másicos y algunos valores de temperatura. Ejemplo 62 Por el tubo interior de un intercambiador de calor experimental entra agua a razón de 10 kg/minuto a 100 kPa y 12 ºC y sale a 30 ºC. Por el tubo exterior en contracorriente entra agua caliente a 300 kPa y 70ºC. Si las caídas de presión son despreciables, determine el flujo másico de agua caliente y el calor retirado por minuto si el agua caliente sale a 20 ºC. Figura 42: Datos del ejemplo ANÁLISIS DEL PROBLEMA: Se puede considerar que el sistema es de flujo estable, no hay cambio de energía cinética y energía potencial, tampoco hay trabajo ni transferencia de calor del intercambiador a los alrededores por lo tanto es válido utilizar la ecuación 230. Las entalpías se determinan de las tablas o directamente del software Propagua que ya se ha utilizado. Otra alternativa de solución a este problema es la de considerar que el calor específico del agua líquida no cambia con la presión y a partir de este dato y las temperaturas se calculan los cambios de entalpía. SOLUCIÓN DEL PROBLEMA: Datos de entalpías del agua líquida a las diferentes presiones y temperaturas obtenidas del software Propagua. 𝑘𝐽 Temperatura, ºC Presión, kPa Entalpía, 𝑘𝑔 12 30 70 20 100 100 300 300 50.49 125.8 293.2 84.10 La ecuación 265 aplicada a este caso particular se convierte en: . . mac (hac1 hac2 ) maf (haf 2 haf 1 ) UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA . . m maf (haf 2 haf 1 ) ac . . (hac1 hac2 ) Q mac (hac1 hac2 ) (3.60 (10 kg )(125.8 50.49) kg min 3.60 (293.2 84.10) min kg kJ kJ )(293.2 84.10) 752.76 min kg min ¿Cómo varía la temperatura de salida del agua caliente, en el intercambiador de problema anterior, si se aumenta el flujo másico de este fluido? Le invitamos a que resuelva el problema utilizando el calor específico de agua líquida. ¿Qué concluye? Bombas, compresores, turbinas y ventiladores Estos equipos de amplio uso en la industria tienen en común que su proceso termodinámico involucra trabajo de eje ya sea que se realice trabajo sobre el sistema elegido como en el caso de bombas, compresores o ventiladores o bien que el sistema realice trabajo como en las turbinas. En estos casos el cambio de energía potencial generalmente es muy pequeño y con frecuencia se omite en los cálculos. Bajo estas condiciones, ∆𝑒𝑃 = 0. Las velocidades involucradas en bombas, compresores o ventiladores son generalmente muy bajas y no producen un cambio significativo en la energía cinética, con excepción de las turbinas donde se manejan velocidades mucho más altas, sin embargo en estos casos el cambio de entalpía es mucho mayor y de ordinario también se desprecia este término. Por lo tanto ∆𝑒𝑐 = 0. Los procesos en estos dispositivos generalmente son tan rápidos que no dan lugar a que se presente una transferencia de calor apreciable a menos que se haga en forma intencionada como en el caso de un compresor con sistema de refrigeración incluido; si . éste no es el caso, de ordinario se desprecia la transferencia de calor. Por tanto Q 0 . Teniendo en cuenta las anteriores restricciones: w h Ecuación 74 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Recuerde que el signo indica la dirección en la cual se efectúa el trabajo. Si la entalpía del sistema disminuye el trabajo será positivo, lo cual implica, que el sistema realiza trabajo; por el contrario si se presenta un aumento de entalpía, el trabajo será negativo, lo que significa que se realiza un trabajo sobre el sistema. Ejemplo 63 Una turbina de una planta termoeléctrica se alimenta con 6 kg/s de vapor de agua, a una presión de 25 bares, una temperatura de 420 ºC y un una velocidad de 110 m/s, si luego de la expansión, el vapor sale con una calidad del 90% a una presión de 0.75 bares y con una velocidad de 170 m/s, determine la potencia que suministra la turbina si se conoce que la transferencia de calor a los alrededores es de 20 kJ/kg. Figura 43: Datos del ejemplo ANÁLISIS DEL PROBLEMA: Para determinar la potencia que suministra la turbina se elige como volumen de control el espacio en el interior de la turbina y se considera que el proceso es de flujo estable en tal caso tiene aplicación la ecuación 260, de ella se despeja el trabajo por unidad de masa. El cambio de energía potencial es despreciable. El cambio de energía cinética se determina fácilmente ya que se conocen los valores velocidad de salida y de entrada del fluido al volumen de control. El vapor entra a la turbina como vapor sobrecalentado ya que a 25 bares la temperatura de saturación es de 224 ºC y el vapor se encuentra a 420 ºC, entonces la entalpía se determina de las tablas de vapor sobrecalentado o utilizando el software de propiedades del agua. La entalpía del vapor a la salida se determina teniendo en cuenta la presión de 0.75 bares la calidad del vapor. SOLUCIÓN DEL PROBLEMA: Determinación del cambio de entalpía durante el proceso. Las entalpías halladas usando el software “Propagua” se presentan en la siguiente tabla: Estado Vapor x = 0,90 Presión, 𝑘𝑃𝑎 Temperatura, º𝐶 25 0.75 420 92 h (h2 h1 ) (2435 3285) Determinación del cambio de energía cinética Entalpía, 3285 2435 kJ kJ 850 kg kg kJ kg UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA ec 2 2 2 1 V V 2 (170 2 110 2 )( m 2 kg 1kJ )( )( ) kJ s 2 kg 1000 J 8.4 2 kg Como: w q (ec e p h) w 20 kJ kJ kJ kJ 8.4 (850 ) 821.6 kg kg kg kg Observe que el calor es negativo porque sale del sistema. Finalmente la potencia que genera la turbina se calcula multiplicando el flujo másico por el trabajo realizado por unidad de masa. . Potencia m w (6 kg kJ )(821.6 ) 4930kW s kg Ejemplo 64 Desde el fondo de un depósito de agua donde la temperatura es de 15 ºC y la presión de 150 kPa, se desea extraer agua utilizando para ello una bomba, y llevarla a razón de 100 kg/minuto, hacia un tanque que se encuentra a una altura de 8 metros por encima de la base del depósito, mediante una tubería de 2.67 cm de diámetro interior; la presión en el punto de descarga es de 350 kPa. Si se consideran despreciables la pérdida de energía debida a la fricción en el interior de la tubería y la transferencia de calor con el medio exterior, ¿cuál debe ser la potencia de la bomba? Figura 44: Datos del ejemplo Análisis del problema Se define como volumen de control el espacio que ocupa el fluido en el interior de las tuberías y la bomba. Cuando la bomba se encuentra en funcionamiento el proceso se modela como un proceso de flujo estable, ya que las propiedades en cada punto son constantes con el tiempo. Para determinar la potencia de la bomba, se requiere conocer el cambio de energía cinética, el cambio de energía potencial y el cambio de entalpía ya que las pérdidas de calor son despreciables. Para calcular el cambio de energía cinética se debe calcular previamente la velocidad en el punto de descarga y considerar que la velocidad en el fondo del depósito es muy pequeña de tal manera que se asume como cero. El cambio de entalpía se determina de las tablas de propiedades del agua o del UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA software de propiedades del agua ya que se conocen las condiciones iniciales de presión y temperatura si se supone un proceso isentrópico, entonces con el valor de la entropía y el de la presión se obtiene la entalpía en el punto de descarga. Solución del problema Con las consideraciones realizadas, la primera ley de la termodinámica para este proceso se reduce a: w (ec e p h) Para calcular la velocidad en el punto de descarga primero es necesario calcular el área de la sección transversal en ese punto: 2.67 cm A2 R 2 2 2 1 m2 5.6 x10 4 m 2 2 10000 cm kg 1 min 100 * m min 60s V2 2.98 2 A2 1000kg s 4 2 * 5.6 x10 m 3 m m. Cambio de energía cinética V 2 V12 ec 2 2 m (2.98 ) 2 0 m2 J s 4.44 2 4.44 2 kg s Cambio de energía potencial e p g ( z 2 z1 ) (9.8 m J )(8m 0) 78.4 2 kg s Para determinar el cambio de entalpía se utiliza el software Propagua de donde se obtienen los siguientes datos: 𝑘𝐽 𝑘𝐽 Estado Presión, kPa Temperatura, ºC Entalpía, 𝑘𝑔 Entropía, 𝑘𝑔.𝐾 1 2 150 350 15 15 63.06 63.27 0.22429 0.22429 Cambio de entalpía: h h2 h1 (63.27 63.06) kJ kJ J 0.21 210 kg kg kg UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Trabajo por unidad de masa w (4.44 78.4 210) J J 292.84 kg kg El signo negativo indica que la bomba realiza trabajo sobre el sistema. La potencia de la bomba es: . . W m w 100 kg J kg 1 min J J * 292.84 100 * * 292.84 488 488W min kg min 60s kg s Lección 28: Aplicación de la termodinámica a procesos de flujo estable (Continuación) Dispositivos de estrangulamiento En general a cualquier medio que ocasione un descenso considerable en la presión de un fluido que se pasa a través de él, se le conoce como dispositivo de estrangulamiento, puede ser una válvula, un capilar o un tabique poroso. Cuando se somete a un fluido a cruzar a través de una sección de área reducida para así disminuir su presión, ocurren cambios que tienen muchas aplicaciones prácticas, principalmente en la refrigeración, debido a que de ordinario un descenso en la presión implica una disminución de la temperatura. Si el flujo se mantiene constante con el tiempo, el proceso será de flujo estable. En este caso son despreciables los cambios de energía cinética y de energía potencial ya que las velocidades de entrada y de salida al volumen de control definido, no cambian en forma significativa, igual sucede con la diferencia en altura de estos puntos. Tampoco se presenta trabajo y como el proceso es rápido o intencionalmente se aísla el sistema, la transferencia de calor es despreciable. Situación ilustrada en la figura 111, donde la línea segmentada representa el volumen de control elegido. Para tal proceso se tiene: h 0 (h2 h1 ) 0 h2 h1 Ecuación 75 Lo cual significa que las entalpías de entrada y salida al volumen de control son iguales, por eso y bajo esta consideración a un proceso de estrangulamiento se le conoce como proceso isentálpico. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA A la variación de la presión de un gas con respecto a la temperatura, a entalpía constante, se le denomina coeficiente Joule Thomson, el cual se representa con la letra , y define mediante la siguiente expresión matemática: T P H Ecuación 76 El coeficiente Joule Thomson de un gas puede ser positivo o negativo, dependiendo de los valores de presión y temperatura. Generalmente a presión y temperatura bajas, es positivo, lo cual significa que si disminuye la presión, la temperatura también disminuye. A presión y temperatura elevadas este coeficiente tiene signo negativo, lo cual implicaría que en un proceso de estrangulamiento bajo estas condiciones la temperatura aumentaría. Figura 45: Proceso de estrangulamiento Ejemplo 65 A la válvula de estrangulamiento de un sistema de refrigeración, llega refrigerante 12, en estado de líquido saturado, a una presión de 850 kPa. Luego de pasar por la válvula la presión se reduce hasta 150 kPa. Determine la temperatura y la calidad del refrigerante a salida de la válvula. Figura 46: Datos del ejemplo Análisis del problema Como ya se estudió, el proceso de estrangulamiento implica que la entalpía a la entrada de la válvula sea igual a la entalpía a la salida; por lo tanto, con la presión de entrada se calcula el valor de la entalpía de líquido saturado, con este valor y las entalpías de líquido saturado y de vapor saturado a la salida, las cuales a su vez, se determinan con el valor de la presión a la salida, se calcula la calidad del vapor. La temperatura corresponde a la temperatura de saturación a esa presión, ya que el refrigerante se encuentra como una mezcla de líquido y vapor. Solución del problema UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA El valor de la entalpía para líquido saturado del R-12 a 850 kPa, según las correspondientes tablas de propiedades termodinámicas, es 69.6 𝑘𝐽 𝑘𝐽 . 𝑘𝑔 𝑘𝐽 A 150 kPa ℎ𝑓 = 17.5 𝑘𝑔 y ℎ𝑔 = 179.1 𝑘𝑔 Por lo tanto x h hf hg h f 69.6 17.5 0.32 179.1 17.5 La temperatura de salida es de −20 º𝐶 que es la correspondiente a la temperatura de saturación según las tablas. Toberas y difusores Las toberas son dispositivos que permiten aumentar en forma considerable la velocidad del fluido al reducir gradualmente la presión; los difusores al contrario, experimentan un aumento de la presión al disminuir la velocidad. El diseño de toberas y difusores depende de la velocidad del fluido, para flujos subsónicos, es decir, con menor velocidad que la del sonido, las toberas se diseñan en forma convergente, de tal manera el área de la sección transversal se reduce gradualmente en la dirección del flujo, mientras que los difusores se diseñan en forma divergente, el área de la sección transversal aumenta en la dirección del flujo. Un comportamiento contrario se presenta cuando el flujo es supersónico. La figura 113 ilustra este comportamiento. Las toberas se utilizan principalmente en los motores de propulsión a chorro para aumentar la velocidad de salida de los gases de combustión y proporcionar por tanto un mayor empuje. Las toberas, conocidas como también boquillas, se utilizan para inyectar un fluido a un determinado proceso, por ejemplo un combustible a un motor, también se utilizan para proporcionar una mayor velocidad de descarga en mangueras ya sea con fines domésticos, industriales o para sofocar incendios. Las toberas también son utilizadas en sistemas de aire comprimido para producir chorros de alta velocidad que se requieren para accionar finos instrumentos odontológicos o simples pistolas para pintar. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Figura 47: Formas generales de toberas y difusores según tipo de flujo En estos dispositivos generalmente no se presentan cambios en la energía potencial, no hay trabajo y no es significativa la transferencia de calor. Para estos casos se expresa: ec h Ecuación 77 Remplazando los valores de las propiedades a la entrada y salida del volumen de control se obtiene: ec 2 ec1 (h2 h1 ) Ordenando las propiedades para cada punto: ec 2 h2 ec1 h1 Ecuación 78 De donde se concluye que la energía de un fluido por unidad de masa es constante como corresponde a un proceso de flujo estable. A continuación encontrará un problema de ejemplo que ilustra esta situación. Cámaras de mezcla Con frecuencia dos corrientes de fluidos de igual naturaleza se mezclan para que adquieran una determinada temperatura, al dispositivo que permite realizar esta operación, se le conoce como cámara de mezcla el cual, no necesariamente es un recipiente especial, por ejemplo una simple T de una tubería puede servir como medio para mezclar dos fluidos, como sucede en la regadera de un baño. La figura 124 representa una cámara de mezcla. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Figura 48: Cámara de mezcla En estos casos son despreciables los cambios de energía potencial, energía cinética, no se realiza trabajo y tampoco hay transferencia de calor hacia el exterior, en consecuencia, de la aplicación de las leyes de conservación de la masa se establece que: . . . m1 m2 m3 Ecuación 79 De la ley de conservación de energía se establece otra relación: . . . m1 h1 m2 h2 m3 h3 Ecuación 80 Ejemplo 66 Por una tobera circula 2.0 kg/s de vapor de agua, el cual entra a 350 ºC y 1700 kPa, y sale a con una velocidad de 270 m/s a 1300 kPa. Si el área de la sección transversal a la entrada es de 0.0186 m2 y se consideran despreciables las pérdidas de calor, ¿con qué velocidad entra el vapor? ¿Con qué temperatura sale? ¿Cuál será el área de la sección transversal a la salida? Figura 49: Datos del ejemplo Análisis del problema Al conocer el flujo másico y el área de la sección transversal, solo se requiere determinar la densidad del fluido para hallar la velocidad de entrada. Por otra parte la entalpía inicial se halla de las tablas de propiedades de vapor sobrecalentado con los datos de presión y temperatura. De la ecuación 270 se despeja el valor de la entalpía a la salida y con este dato y la correspondiente presión se encuentra la temperatura. El área se halla determinando primero la densidad del fluido al salir y se utilizan los datos del el flujo másico y la velocidad de salida del vapor. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Solución del problema De las tablas de propiedades del vapor sobrecalentado o del software correspondiente se obtiene el valor del volumen específico el cual es igual al recíproco de la densidad: Presión, kPa Temperatura, ºC Volumen específico, 1700 350 V1 𝑘𝑔 m. 1 A1 2 (6.099 kg s kg )(0.0186m 2 ) 3 m 𝑘𝐽 Densidad, 𝑚3 Entalpía, 𝑘𝑔 6.0990 3144.7 0.16396 2 De la ecuación 272 𝑚3 𝑘𝑔 17.63 m s 2 V1 V 2 h2 (ec1 ec 2 ) h1 ( ) h1 2 2 kJ 17.63 270 m kJ kJ kg h2 ( )( 2 )( ) 3144.7 3108.4 2 2 2 kg kg s m 1000 2 s 2 2 2 Para este valor de entalpía y 1300 kPa las propiedades del vapor son: 𝑚3 Presión, kPa Temperatura, ºC Volumen específico, 𝑘𝑔 1300 329.4 0.20822 𝑘𝑔 Entalpía, 𝑘𝑔 4.8026 3108.4 Área de la sección transversal de salida: kg s A2 0.001542m 2 kg m 2 V 2 (4.8026 3 )(270 ) s m . m 2 Ejemplo 67 En un proceso se requiere un suministro de 2,5 kg/s de agua a una temperatura de 40 ºC. Para suplir esta necesidad, se aprovecha el agua procedente de un condensador la cual sale a 60 ºC y se conduce mediante una tubería conectada a una unión en T donde se mezcla 𝑘𝐽 Densidad, 𝑚3 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA con agua procedente de un tanque de almacenamiento a 15 ºC. Si se consideran despreciables las pérdidas de calor y la mezcla se efectúa a 140 kPa, determine el caudal de agua fría y de agua caliente que se requiere para el proceso. Figura 50: Ilustración del ejemplo ANÁLISIS DEL PROBLEMA: El problema plantea dos incógnitas, los flujos másicos de las dos corrientes. En consecuencia se deben formular dos ecuaciones que relacionen a estas variables. Las ecuaciones 271 y 272 permiten calcular la relación en la cual se deben mezclar dos corrientes de un fluido a diferentes temperaturas para obtener una corriente a una temperatura intermedia que corresponde al caso de interés. Las entalpías se hallan con la presión y temperaturas de las tablas de propiedades del agua líquida o del software disponible. SOLUCIÓN DEL PROBLEMA: Datos obtenidos del software PROPAGUA: 𝑘𝐽 Presión, kPa Temperatura, ºC Entalpía, 𝑘𝑔 Estado Entrada 1 Entrada 2 Salida 140 140 140 60 15 40 251.20 63.06 167.60 . . kg s m.h m.h m.h kJ kJ kg kJ m.(251.20 ) m.(63.06 ) (2.5 )(167.60 ) m1 m2 2,5 1 1 1 2 kg 2 2 3 3 kg s kg Resolviendo este sistema de ecuaciones: . m1 1.11 kg s . m2 1.39 kg s UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Flujo en tuberías El transporte de fluidos a través de tuberías o ductos constituye un gran campo de estudio y aplicación de la ingeniería. Cuando un fluido se encuentra fluyendo de tal manera que sus propiedades son constantes con el tiempo, el proceso se considera como de flujo estable. El volumen de control se elige seleccionando un determinado tramo de tubería, de tal manera que las fronteras coincidan con las paredes interiores de la tubería que se quiere estudiar. En algunos casos la conducción del fluido puede requerir de tuberías de diferente diámetro, con lo cual se producen cambios apreciables en la velocidad; también puede necesitarse que el fluido llegue hasta alturas apreciables por lo cual son necesarios de considerar los cambios en la energía potencial. Durante la conducción los tubos pueden estar aislados o permitir el intercambio de calor entre el fluido y el medio exterior. Además un sistema de flujo de fluidos puede incluir una bomba o un compresor que realizan trabajo sobre el fluido o incluso pueden presentase otras formas de trabajo tales como trabajo eléctrico o trabajo de eje. Para el caso particular de flujo de fluidos incompresibles: h u vP y u c p T La ecuación general aplicable a fluidos incompresibles: q w ec e p c p T vP Ecuación 81 Si el sistema que se estudia es adiabático, isotérmico e incompresible y además no se incluye una bomba, los términos de calor, trabajo y el cambio de temperatura son cero, de tal manera que 0 ec e p vp Ecuación 82 o también 2 2 V 2 V 1 v( P2 P1 ) g ( z 2 z1 ) 2 Ecuación 83 Esta última educación se conoce como ecuación de Bernoulli la cual se estudia con mayor detenimiento en la mecánica de fluidos. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Ejemplo 68 Un sistema de calefacción sencillo, utiliza aire que circula por un ducto a razón 1.5 m3/s, el cual se calienta al pasar por una resistencia eléctrica de 9.0 kW. Si la transferencia de calor del aire al medio exterior a través del ducto es de 160 J/s y el aire, antes de pasar por la resistencia, se encuentra a 14 ºC y 75 kPa determine la temperatura con la cual sale el aire. Figura 51: Ilustración del ejemplo Análisis del problema El volumen de control se establece para el tramo del ducto alrededor de la sección de calentamiento. El proceso se considera de flujo estable donde no hay cambios de energía cinética ni de energía potencial, en consecuencia el intercambio de energía debido a la interacción de calor y trabajo es igual al cambio de entalpía. Con este dato se puede calcular la entalpía a la salida y con este dato y la presión determinar el valor de la temperatura. La entalpía a la entrada se determina mediante los correspondientes valores de la presión y la temperatura. Otra alternativa de solución del problema es determinar la capacidad calorífica del aire y calcular el cambio de temperatura a partir del cambio de entalpía. Solución del problema El volumen molar del gas a las condiciones de entrada es igual a 31,8161 m3/kmol y la entalpía molar es de 8.345,6 kJ/kmol (Datos obtenidos del software Progases). m3 kmol s Flujo molar n 0.0471 3 s m 31.8161 kmol . 1.5 . . 0.160 kJ (9.0 kJ ) s s 187.7 kJ H .n 0.0471 kmol kmol Q W s H 2 H H 1 (187.7 8345.6) kJ kJ 8533.3 kmol kmol Para este valor de la entalpía y la presión de 75 kPa corresponde una temperatura de 293.4 k equivalente a 20.4 ºC. (Dato obtenido de Progases). UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Segunda alternativa: capacidad calorífica molar del aire a las condiciones de entrada 29.08 kJ/(kmol K). H T Cp kJ kmol 6.45K kJ 29.08 kmol.K 187.7 T2 T1 T 287 6.45 293.45K Lección 29: Aplicación de la termodinámica a procesos de flujo transitorio y de flujo uniforme PROCESOS DE FLUJO TRANSITORIO En un proceso de flujo transitorio al contrario del proceso de flujo estable se presentan cambios en las propiedades del sistema con el tiempo. Para analizar estos procesos piense en un tanque de almacenamiento de combustible líquido conectado a tuberías de alimentación y descarga mediante sus respectivas válvulas, como se ilustra en la figura 118. Figura 52: Ejemplo de flujo transitorio Suponga que al comenzar el día está lleno hasta la mitad de su capacidad, luego se retira una determinada cantidad y el nivel del líquido baja, enseguida se carga y en consecuencia el nivel sube, esta situación se puede repetir varia veces. Por lo tanto las propiedades del volumen de control elegido, en este caso el líquido que permanece en el tanque en un determinado tiempo, representado en la gráfica por la línea segmentada, cambian cuando se llena o se descarga. Este es un ejemplo de flujo transitorio o no estable. El intercambio de materia y energía del volumen de control con el medio exterior o alrededores se evalúa teniendo como referencia un determinado intervalo de tiempo. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Observe la diferencia con el proceso de flujo estable donde se consideraba que masa y energía fluían desde o hacia el volumen de control indefinidamente en el tiempo. PROCESO DE FLUJO UNIFORME Un proceso de flujo uniforme se caracteriza por que las propiedades del volumen de control, en un instante determinado, son iguales en todas partes, aunque cambian con el tiempo, lo hacen en forma uniforme. Las propiedades de las corrientes de entrada o salida pueden ser diferentes entre sí, pero sus correspondientes valores deben ser constantes con respecto a la sección transversal de una entrada o salida. Si se presentan cambios, los valores se promedian y se los considera constantes durante el proceso. Entonces: EVC (Q W ) mi i m j j Ecuación 84 También como: 2 2 EVC Q W mi (hi ½ V i gz i ) m j (h j ½ V j gz j ) Ecuación 85 Se presentan otras considerables simplificaciones cuando se consideran situaciones donde no hay corrientes de salida o corrientes de entrada o cuando los cambios de energía cinética o potencial son despreciables. Algunas de estas situaciones se analizan en las siguientes aplicaciones. Llenado de recipientes rígidos Un problema común que se presenta en plantas industriales el cual se puede manejar bajo el modelo de proceso de flujo uniforme, es el del llenado o carga de un tanque o cilindro con un fluido que proviene de una línea de alimentación presurizada. Por ejemplo el llenado de cilindros con gas propano, dióxido de carbono, oxígeno o nitrógeno, figura 119. El recipiente rígido puede estar inicialmente vacío o contener una determinada masa antes de comenzar el proceso. Generalmente en estos casos se presenta una sola corriente de entrada y no hay corrientes de salida, tampoco se realiza trabajo y la transferencia de calor de ordinario se considera despreciable. Si la velocidad del fluido en la línea de flujo es baja y no hay elevación apreciable, las energías cinética y potencial en la línea de entrada y en el volumen de control son despreciables. Bajo estas consideraciones la ecuación 240 se transforma en: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA EVC mi hi Ecuación 86 Figura 53: Volumen de control elegido para llenado de un recipiente Pero a su vez EVC U VC (m2 u 2 m1u1 ) ya que en el volumen de control elegido la energía cinética y la energía potencial son despreciables, por lo tanto (m2 u 2 m1u1 ) mi hi Ecuación 87 Donde los subíndices 2 y 1 representan en estado final y el estado inicial del volumen de control y el subíndice 𝑖 a la corriente de entrada. Si inicialmente el recipiente se encuentra vacío, entonces 𝑚1 = 0, por lo tanto: m2 u 2 mi hi Ecuación 88 Teniendo en cuenta que necesariamente 𝑚2 = 𝑚𝑖 , ya que la masa que la masa del volumen de control en el estado 2, es igual a la masa que entra, se concluye que la ecuación de la primera ley de la termodinámica para este caso especial se reduce a: u 2 hi Ecuación 89 Es decir la energía interna final del volumen de control es igual a la entalpía del fluido en la corriente de entrada. Esta relación permite resolver muchos problemas de orden práctico, como se ilustra en el siguiente ejemplo. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Ejemplo 69 Calcular la temperatura y la masa en el interior de un tanque de 0.15 m3 que inicialmente se encuentra vacío y se llena con dióxido de carbono a 900 kPa y 350 K. Figura 54: Ilustración del ejemplo Análisis del problema El problema se puede resolver con el modelo de flujo uniforme, donde no hay trabajo, ni intercambio de calor; las energías, cinética y potencial no son significativas; solo hay una entrada de masa y no hay corrientes de salida. Para tal caso la entalpía del fluido a las condiciones de la corriente de entrada es igual a la energía interna del fluido al llenarse hasta alcanzar la presión de la corriente de entrada. Recuerde que con dos propiedades intensivas se establece el estado de un sistema, entonces con los valores de presión y temperatura se determina la entalpía, la cual será igual a la energía interna del fluido contenido en el tanque al final del proceso. Con este valor de la energía interna y la presión se determinan las propiedades del estado final. El software Progases permite calcular estas propiedades. Finalmente la masa del fluido se calcula conociendo el volumen molar a las condiciones del estado final. Solución del problema Presión Temperatura kPa K Estado Corriente de entrada Estado final 9.0 9.0 350 440 Energía interna Entalpía Volumen molar 𝑘𝐽 𝑘𝐽 𝑚3 𝑘𝑚𝑜𝑙 𝑘𝑚𝑜𝑙 𝑘𝑚𝑜𝑙 8947.3 11407.3 3.2333 11407.3 15068.8 4.0683 La temperatura final es de 440 K. Masa de CO2 = (0.15 m 3 )( 1 kmol 44 kg )( ) 1.62 kg 4.0683 m 3 1 kmol UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Descarga de recipientes rígidos Cuando se abre la válvula de un cilindro que contiene un gas o vapor a presión elevada, el fluido sale del recipiente, generando una disminución en su presión, este proceso puede ser considerado de estado uniforme si la descarga se realiza lentamente de tal manera que las propiedades en toda la extensión del volumen de control seleccionado, figura 121, sean iguales en un instante determinado. Figura 55: Volumen de control elegido para descarga de un recipiente Entre el proceso de descarga y el proceso de llenado existe una diferencia notoria y es la de que las propiedades de la corriente de salida cambian con el tiempo, debido a la disminución continua de masa del volumen de control. El llenado se realiza manteniendo constantes las propiedades de la corriente de entrada. Esta condición implica que los balances de masa y de energía para el proceso de descarga se deben establecer para elementos diferenciales de masa que cruzan la superficie de control y luego realizar las integraciones correspondientes en un determinado intervalo. En consecuencia, si se considera que 𝛿𝑚𝑗 corresponde al diferencial de masa que cruza la superficie de control y 𝑑𝑚 es la variación de la masa del volumen de control, la ley de conservación de la materia, para este proceso, establece que 𝛿𝑚𝑗 = −𝑑𝑚. Por otra parte, al aplicar la primera ley de la termodinámica, considerando, que no hay trabajo, ni transferencia de calor y que las energías cinéticas y potenciales en el volumen de control y en la corriente de salida son despreciables, la ecuación 240, en términos diferenciales, se reduce a la siguiente expresión: dU VC h j mj Ecuación 90 ya que en cada instante las propiedades del fluido que en la corriente de salida son las mismas que las del interior del volumen de control, la ecuación 295 se transforma en: d (mu) hdm Ecuación 91 Al diferenciar el término de la izquierda se obtiene mdu udm hdm , pero h u pv , entonces mdu udm udm pvdm ; de donde se obtiene la siguiente relación UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA dm du m pv Ecuación 92 Por otro lado, si se considera la definición de volumen específico V mv dV mdv vdm Como el volumen de control es constante, resulta que mdv vdm 0 equivalente a la siguiente relación: dm dv m v Ecuación 93 Finalmente combinando las ecuaciones 247 y 248 se llega a que du pdv 0 du dv , igual a pv v Ecuación 94 Esta relación de propiedades intensivas implica que el proceso que se realiza debe ser de entropía constante. Esta afirmación se demuestra si se aplica la primera ley a la masa total del fluido, considerándola como si se tratara de un sistema cerrado, entonces la ecuación en términos diferenciales y por unidad de masa establece que q w du , ecuación 89; si se remplaza los términos de calor y trabajo en función de las propiedades intensivas relacionadas, se tiene que Tds pdv du , la cual se puede escribir como: du pdv Tds Ecuación 95 La ecuación 252 relaciona las propiedades intensivas del fluido en un instante determinado; si se compara con la ecuación 251, se deduce que ds 0 , es decir entropía constante. Ejemplo 70 Un tanque de 0.60 m3, diseñado para contener, aire comprimido de se encuentra a una presión manométrica de 350 kPa y 305 K. Si se abre la válvula y se permite que el gas salga hasta que la presión en el interior se reduzca a 90 kPa. Determine la temperatura final del proceso si se considera despreciable la transferencia de calor y la masa de aire permanece en el tanque. La presión atmosférica es de 80 kPa. Figura 56: Tanque del ejemplo Análisis del problema Para el análisis energético se elige como volumen de control el aire en el interior del tanque. La presión en el interior del volumen de control disminuye de 500 a 90 kPa como consecuencia de flujo de materia hacia el exterior. Si este proceso se realiza de tal UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA manera que las propiedades del fluido en cualquier instante son las mismas, entonces el proceso es de descarga bajo estado uniforme. En estas condiciones y dado que no hay transferencia de calor el proceso será adiabático e internamente reversible, por lo tanto la entropía debe mantenerse constante durante este proceso. Esta condición permite calcular la temperatura final, para lo cual es necesario considerar al aire como gas ideal, lo cual se justifica, dado que el rango de presiones que se manejan no son grandes. Para determinar la masa que queda en el tanque, se debe calcular el volumen específico del estado inicial y el volumen específico al final del proceso. Solución del problema Un proceso adiabático de expansión o compresión de un gas ideal cumple con la relación dada por la ecuación P2V2 P1V1 , y por supuesto con la ecuación de estado PV nRT , la cual se puede escribir como P2V2 nRT2 , o también P1V1 nRT1 , según el estado al que se refiera; combinando apropiadamente estas ecuaciones se obtiene la relación P21 T2 P11 T1 , de donde: P T2 T1 1 P2 1 430 kPa (305 K ) 170 kPa 11, 4 1, 4 234 K Volumen específico del estado inicial: RT1 v1 MP1 kJ )(305K ) m3 kmol.K 0.2500 kg kg (28.96 )(350kPa) kmol (8.314 Recuerde que 𝑀 representa el peso molecular del air y que la presión absoluta es igual a la suma de la presión atmosférica más la presión manométrica, entonces: 1 1 P1 m 3 430kPa 1, 4 m3 v2 v1 (0.2500 ) 0.4850 kg 170kPa kg P2 Masa que permanece en el tanque m2 V2 v2 0.6m 3 1.24kg m3 0.4850 kg UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Masa inicial m1 V1 0.6m 3 2.40kg v1 m3 0.25 kg Masa que sale m j m1 m2 (2.4 1.24)kg 1.0kg Lección 30: Acondicionamiento de aire El acondicionamiento del aire surge de la necesidad de proporcionar un entorno cómodo y agradable para el trabajo, un ambiente apropiado para el almacenamiento de algunos materiales y para permitir el funcionamiento adecuado de equipos electrónicos. En la industria de alimentos con frecuencia se deben crear atmósferas especiales, por ejemplo, que permitan la maduración controlada de algunas variedades de frutas o el almacenamiento en grandes bodegas de productos alimenticios que requieran de una determinada humedad y temperatura. Por ello es necesario detenerse a estudiar los aspectos termodinámicos relacionados con los cambios en las condiciones del aire atmosférico, tales como presión, temperatura y humedad. En las siguientes secciones se estudiarán las relaciones entre estas variables, cómo determinar la humedad del aire atmosférico y utilizar esta información para dar solución a problemas relacionados con la adecuación del aire atmosférico a las condiciones que se requieran. Aire y vapor de agua El aire de la atmósfera contiene pequeñas cantidades de vapor de agua que le imprimen características especiales tan importantes que han permitido el desarrollo de la vida en este planeta. Tanto el aire como el vapor de agua a las condiciones climáticas ordinarias de presión y temperatura se pueden manejar como gases ideales, sin cometer un error apreciable. Como recordará de los estudios de química, para una mezcla de gases ideales se cumple la Ley de Dalton o de las presiones parciales. Tal ley establece que la presión total de la mezcla gaseosa es igual a la suma de las presiones parciales de cada uno de los gases que componen la mezcla. Se entiende como presión parcial, la presión que ejercería cada uno de los gases si se encontrara solo en el mismo recipiente donde se encuentra dicha mezcla y a la misma temperatura. Matemáticamente esta ley se expresa mediante la ecuación 253. P p A p B pc ... pi Ecuación 96 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Donde P = presión total pA = presión parcial del gas A pA = presión parcial del gas B pA = presión parcial del gas C pi = presión parcial de cualquier gas i También es pertinente recordar que la fracción molar de un componente cualquiera en una mezcla gaseosa es igual a la relación entre la presión parcial de ese componente y la presión total de la mezcla. Entonces ni p yi i n P Ecuación 97 Donde yi = fracción molar del gas i pi = presión parcial del gas i P = presión total ni = número de moles del gas i n = número de moles de la mezcla gaseosa La relación entre la cantidad de vapor de agua y la cantidad de aire seco se conoce como humedad absoluta, la cual puede expresarse como de masa de agua/masa de aire seco y en este caso recibe el nombre de humedad específica o también en moles de agua/moles de aire seco y en este otro caso se denomina humedad molar. Esta relación cambia de un sitio a otro del planeta o incluso en un mismo sitio, dependiendo de las condiciones climáticas, durante un determinado intervalo de tiempo. Muchos fenómenos biológicos y microbiológicos dependen de la humedad, una humedad excesiva puede deteriorar muy rápidamente un alimento al favorecer el crecimiento microbiano y la actividad enzimática, en cambio una escasa humedad traería como consecuencia la resequedad, endurecimiento o resquebrajamiento que cambian las propiedades organolépticas de algunos alimentos. Por ello es importante establecer las condiciones más apropiadas de humedad y temperatura para el correcto almacenamiento de muchos productos alimenticios. La humedad específica generalmente se representa mediante la letra y su expresión matemática es la siguiente: m H 2O mas Ecuación 98 Donde = humedad específica mH O = masa de agua en el aire (kg) 2 mas = masa de aire seco Tanto la masa de agua en el aire como la masa de aire seco se determinan mediante la ecuación de estado y la masa molecular respectiva. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Humedad relativa Cuando un gas o mezcla gaseosa cualquiera se encuentra en contacto con la superficie de un líquido se produce un paso espontáneo de materia de la fase líquida a la fase gaseosa hasta que la presión parcial del vapor en la mezcla gaseosa sea igual a la presión de vapor del líquido a la temperatura a la cual se encuentra dicha mezcla. En este punto se dice que el gas se encuentra saturado. En la figura 136 se ilustra esta situación: a una determinada temperatura, una mezcla de los gases A y B se encuentra en contacto con el líquido A. Inicialmente el número de moles de A en fase gaseosa es muy reducido de tal manera que la presión parcial de A es menor que la correspondiente presión de vapor a esa temperatura, por lo tanto, se produce la evaporación espontánea del líquido A y este proceso continúa hasta que el numero de moles de A es suficiente para que la presión parcial se iguale a la presión de vapor. Bajo estas condiciones se establece un equilibrio dinámico entre la velocidad de evaporación y la velocidad de condensación. Cuando el número de moles de A en fase gaseosa es tan alto que la presión parcial de A es mayor que la presión de vapor se produce la condensación espontánea del vapor hasta que nuevamente se alcanza el equilibrio. Figura 57: Mezcla de dos gases en contacto con la superficie de un líquido Este comportamiento es completamente general y se aplica a cualquier mezcla de gases en contacto con cualquier líquido. Para el caso del aire a una determinada temperatura, éste también tiene un límite en su capacidad de contener vapor de agua, a tal estado se le conoce como aire saturado; se presenta cuando la presión parcial del vapor de agua en el aire es igual a la presión de vapor del agua a esa temperatura, cualquier cantidad de agua adicional que contenga se condensará hasta alcanzar el equilibrio entre el agua líquida y el vapor de agua en el aire. Con mucha frecuencia la humedad del aire se expresa como la relación entre la cantidad de agua presente en el aire y la cantidad máxima de agua que el aire puede contener a una determinada temperatura. Esta relación se conoce como humedad relativa, la cual generalmente, se representa por la letra griega . Entonces, dado que la cantidad de agua presente en el aire es proporcional a su presión parcial, la humedad relativa se define como: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA p H 2O Ecuación 99 p H 2O Donde = humedad relativa p H 2O = presión parcial del agua en el aire p H 2O = presión de vapor del agua Recuerde que a una determinada temperatura la presión de vapor del agua es igual a su presión de saturación a esa temperatura. La humedad relativa también se acostumbra a expresar como porcentaje, de tal manera que el porcentaje de humedad relativa (%) es igual a 100. Así el aire tendrá una humedad relativa del 100% cuando se encuentra saturado y de cero cuando se encuentra seco. En el ejemplo siguiente se ilustra la relación existente entre la humedad específica, la humedad molar y la humedad relativa. Ejemplo 71 Si a 80 kPa y 10 ºC el aire de una bodega para el almacenamiento de productos vegetales tiene una humedad relativa del 75% ¿cuál será la humedad específica y la humedad molar? Análisis del problema Con los datos del porcentaje de humedad relativa y la presión de vapor del agua a 10 ºC, se calcula la presión parcial del agua en el aire. Utilizando la ecuación de estado se despeja el número de moles presente en el aire y con la masa molecular se establece la masa del agua. Como se conocen la presión total y la presión parcial del agua, aplicando la ley de Dalton se determina la presión parcial del aire y en forma similar se expresa el número de moles y correspondiente masa de aire seco. La humedad molar se establece dividiendo el número de moles de agua presentes en el aire entre el número de moles de aire seco. La humedad específica se establece mediante la relación entre la masa de agua presente en el aire y la masa se aire seco. Solución del problema En las tablas o en el software de propiedades termodinámicas del agua se encuentra que la presión de vapor del agua o presión de saturación a 10 ºC es de 1.23 kPa, entonces: Presión parcial, moles y masa del agua en el aire p H 2O ( p H 2O ) 0.75(1.23kPa) 0.92 kPa UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA ( p H 2O )V RT ( p )VM H 2O n H 2O M H 2O H 2O RT n H 2O m H 2O Presión parcial, moles y masa del aire seco pas P p H 2O (80 0.92)kPa 79.08 kPa ( p as )V RT ( p )VM as mas nas M as as RT nas Humedad molar n H 2O nas p H 2O p as 0.92 kPa 79.08 kPa 0.0116 moles de agua moles de aire sec o Humedad específica m H 2O mas p H 2O M H 2 O p as M as (0.92kPa)(18.0 kg agua ) kg de agua mol 0.0072 kg aire sec o kg de aire sec o (79.08kPa)(28.97 ) mol Del ejemplo anterior se puede deducir la relación existente entre la humedad específica y la humedad relativa: m H 2O mas p H 2O M H 2 O p as M as kg ) ( p H 2O )(0.622) mol kg ( P p H 2O ) ( P p H 2O )(28.97 ) mol ( p H 2O )(18.015 Al despejar la presión parcial del agua se obtiene p H 2O p H 2O P 0.622 P ( 0.622) y como p H 2O p H 2O entonces Ecuación 100 o también 0.622 ( p H 2O ) P ( p H 2O ) Punto de rocío Ecuación 101 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Usted seguramente ha observado que cuando se levanta en las mañanas y corre las cortinas, encuentra que los vidrios de las ventanas están empañados, cubiertos de finas gotitas de agua. Este fenómeno se debe a que en las madrugadas la temperatura del exterior es muy baja provocando que la presión de vapor del agua disminuya por debajo de la presión parcial del agua en el aire de la habitación con lo cual se dan las condiciones termodinámicas para que se produzca la condensación del agua presente en el aire. La temperatura a la cual se produce la condensación de una mezcla de aire y vapor de agua que se enfría a presión constante se denomina punto de rocío. Para una determinada presión de vapor de agua existe una correspondiente temperatura de saturación, esta temperatura corresponde al punto de rocío. Entonces, si se conoce la presión del vapor de agua, en las tablas de propiedades termodinámicas del agua o en el software que presenta esta información, fácilmente se determina el punto de rocío. Ejemplo 72 A 25 ºC la humedad relativa del aire en una bodega es del 70%, hasta que temperatura se puede enfriar el aire sin que se presente condensación. Análisis del problema Para que no se presente condensación se requiere que la presión parcial del agua en el aire sea inferior a la presión de vapor del agua a una determinada temperatura. Al descender la temperatura la presión de vapor del agua disminuye y llegará a un punto donde se iguala a la presión parcial del agua en el aire, en ese punto comienza la condensación, es decir se alcanzó el punto de rocío de la mezcla aire vapor de agua. Entonces para solucionar el problema planteado basta con encontrar el punto de rocío o temperatura de saturación del agua a una presión de vapor igual a la presión parcial del agua en el aire a 25 ºC. Solución del problema Consultando los datos de las propiedades termodinámicas del agua se encuentra que a 25 ºC la presión de vapor del agua es de 3.17 kPa. Entonces: Presión parcial del agua en el aire p H 2O ( p H 2O ) 0.70(3.17kPa) 2.22 kPa Para una presión de vapor del agua de 2.22 kPa la temperatura de saturación es de 19 ºC. Si se quiere evitar que condense el agua, la temperatura debe mantenerse por encima de este valor. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Una forma aproximada y sencilla de encontrar experimentalmente el punto de rocío del aire atmosférico y con este valor calcular la humedad relativa, consiste en colocar un termómetro en un vaso con una mezcla de hielo y agua, agitar y registrar la temperatura cuando comiencen a formarse gotas de agua sobre la superficie externa del vaso. Temperatura de saturación adiabática Cuando una corriente de aire circula en contacto con la superficie de agua líquida en un conducto de paredes adiabáticas, tal como el que se muestra en la figura 137, el agua pasa de la fase líquida hacia la fase gaseosa ocasionando que la humedad del aire aumente. Si la extensión de la superficie de contacto entre las fases es suficiente, el aire saldrá del conducto como aire húmedo saturado. ¿Cómo cree que cambie la temperatura en este proceso? Para responder a esta pregunta debe considerar el intercambio de energía que se presenta durante la evaporación del agua, como el dispositivo en el cual se realiza este proceso es adiabático, parte del calor que requiere el agua para evaporarse procede del aire, en consecuencia la temperatura va a descender hasta que se alcance la saturación. Esta temperatura se conoce como temperatura de saturación adiabática. La temperatura de saturación del agua se utiliza para determinar la humedad relativa del aire. Para establecer esta relación es necesario considerar un proceso de flujo permanente del aire que fluye y del agua la cual se suministra con la misma rapidez con la cual se evapora a la temperatura de saturación del aire. Bajo estas condiciones un balance de materia en el proceso de flujo permanente con dos entradas y una salida, como el ilustrado en la figura 124, permite determinar la cantidad de agua evaporada para alcanzar la saturación en un determinado intervalo de tiempo. ma2 ma1 mH 2O Ecuación 102 Donde ma2 flujo másico del aire saturado a la salida ma1 flujo másico del aire a la entrada mH 2O flujo másico del agua evaporada Figura 58: Proceso de saturación adiabática del aire con vapor de agua Dado que el flujo de aire seco permanece constante a la entrada y salida del proceso de saturación, también se puede establecer un balance solo para el agua, de la siguiente forma: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA m(H 2O)2 m(H 2O)1 mH 2O Ecuación 103 ( H 2O ) 2 = flujo másico del agua que acompaña al aire a la salida ( H 2O )1 = flujo másico del agua que acompaña al aire a la entrada Donde m m mH 2O = flujo másico del agua evaporada La masa de agua en el aire se puede expresar en función del producto de la masa de aire seco y la humedad específica como se deduce de la ecuación 255. Realizando las correspondientes substituciones la ecuación 260 se transforma en: mas 2 mas 1 mH 2O y por lo tanto la masa evaporada es igual a: mH 2O mas (2 1 ) Ecuación 104 Donde mas = flujo másico del aire seco 2 = humedad específica a la salida 1 = humedad específica a la entrada mH 2O = flujo másico del agua evaporada En el proceso de saturación adiabática los cambios de energía cinética y de energía potencial son despreciables, no hay transferencia de calor ni tampoco se realiza trabajo; por lo tanto la aplicación de la primera ley de la termodinámica en este tipo de procesos y para el volumen de control mostrado en la figura 124, se reduce a: H salida H entrada La suma de las entalpías de las corrientes que entran debe ser igual a la suma de las entalpías de salida. Aplicando este principio se obtiene la siguiente ecuación: ma s (has2 ) m(H 2O)2 h( H 2O)2 ma s (has1 ) m(H 2O)1 h( H 2O)1 mH 2O hH 2O Ecuación 105 Donde has2 = entalpía del aire seco a la temperatura de salida T2 has1 = entalpía del aire seco a la temperatura de entrada T1 m(H 2O ) 2 = flujo másico de agua que acompaña al aire seco a la salida mas = flujo másico del aire seco m( H 2O )1 = flujo másico de agua que acompaña al aire seco a la entrada h( H 2O )2 = entalpía de vapor saturado a la temperatura de salida T2 h( H 2O )1 = entalpía vapor saturado a la temperatura de salida T1 hH 2O = entalpía de líquido saturado a la temperatura T2 Si en la ecuación 262 el flujo másico del agua en función del flujo de aire seco y las correspondientes humedades específicas se llega a UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA mas (has2 ) mas 2 h( H 2O)2 mas (has1 ) mas 1h( H 2O)1 mas (2 1 )hH 2O Ecuación 106 Al cancelar el flujo másico del aire seco la ecuación 262 se reduce a: has2 2 h( H 2O)2 has1 1h( H 2O)1 (2 1 )hH 2O Ecuación 107 Despejando la humedad específica del aire a la entrada 1 (has2 has1 ) 2 (h( H 2O ) 2 hH 2O ) h( H 2O )1 hH 2O Ecuación 108 El cambio de entalpía para aire seco se puede expresar en función del calor específico y el cambio de temperatura. Entonces: 1 c p (T2 T1 ) 2 (h( H 2O ) 2 hH 2O ) h( H 2O )1 hH 2O Ecuación 109 La humedad específica del aire a la entrada al proceso de saturación, 1, queda perfectamente definida ya que todos los términos del lado derecho de la ecuación 266 se pueden determinar ya que se conocen las temperaturas T2 y T1. La humedad específica del aire a la salida, 2, se determina con la temperatura de salida y la humedad relativa del aire saturado que corresponde al 100%. Del análisis realizado se deduce que la humedad del aire a una determinada temperatura se puede establecer si se hace pasar por un dispositivo de saturación adiabática y se determina la temperatura con la cual sale. En resumen, podemos decir que si se conoce la temperatura de saturación de una mezcla de aire y vapor de agua, entonces se podrá determinar la humedad específica y la humedad relativa de dicha mezcla a una determinada temperatura. Ejemplo 73 Se desea determinar la humedad específica y la humedad relativa de una mezcla del aire atmosférico que encuentra a 22 ºC y 83.0 kPa si la temperatura de saturación adiabática es de 12.5 ºC. Análisis del problema Para determinar la humedad específica es necesario consultar el calor específico del aire, las entalpías del agua como líquido saturado y como vapor saturado a la temperatura de saturación adiabática, en este caso 12.5 ºC, y la entalpía del agua como vapor saturado a la temperatura de 22 ºC. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA También se debe calcular en primer lugar la humedad específica del aire saturado a partir de los datos de la presión total y la presión de vapor del agua a la temperatura de 12.5 ºC. Solución del problema Consultando los datos de las propiedades termodinámicas del agua se encuentra que: kJ kg kJ 2541 kg h( H 2O ) g 12,5ºC 2524 h( H 2O ) g 22ºC h( H 2O )l 12,5ºC 52.50 kJ kg p H 2O ( 22ºC ) 2.6kPa p H 2O (12,5ºC ) 1.4kPa c p aire 1.003 kJ kg.K Humedad específica para aire saturado a la temperatura de 12,5 ºC 2 0.622 ( p H 2O ) P ( p H 2O ) kg de agua 0.622(1.0)(1.4kPa) 0.011 ((83.0 (1.0)(1.4))kPa) kg de aire sec o Humedad específica del aire atmosférico 1 (1.003 1 c p (T2 T1 ) 2 (h( H 2O ) 2 hH 2O ) h( H 2O )1 hH 2O kJ kJ )(285.5 295) K 0.011(2524 52.5) kg.K kg kJ (2541 52.5) kg 1 0.0071 kg de agua kg de aire sec o Humedad relativa del aire atmosférico: 1 p H 2O 0.0071(83.0 kPa) 1 P 0.36 (1 0.622) 2.6(0.0071 0.622) Temperatura de bulbo húmedo Otra forma de encontrar la humedad del aire consiste leer directamente en termómetros corrientes las denominadas temperaturas de bulbo seco y de bulbo húmedo. La temperatura de bulbo seco es aquella que se mide directamente en el seno del aire, mientras que la temperatura de bulbo húmedo es la temperatura que registra un termómetro al cual se le ha recubierto el bulbo con una gasa embebida en agua, luego de alcanzar el equilibrio cuando circula una corriente de aire. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Si el aire no se encuentra saturado el agua que rodea al bulbo del termómetro, se evapora ocasionando un descenso en la temperatura de tal manera que entre más seco se encuentre el aire más bajo será el valor de la temperatura de bulbo húmedo. Si el aire se encuentra saturado no se presentará evaporación y en consecuencia la temperatura de bulbo húmedo será igual a la temperatura de bulbo seco. A las condiciones atmosféricas las temperaturas de saturación adiabática y bulbo húmedo prácticamente son las mismas. Con esta consideración la humedad específica y la humedad relativa del aire se pueden calcular fácilmente mediante las ecuaciones 255, 256 y 262, asociando T2 a la temperatura de bulbo húmedo y T1 a la temperatura de bulbo seco. En la figura 138 se muestra en forma esquemática dos termómetros acondicionados para medir las temperaturas de bulbo seco y de bulbo húmedo. Este método es el más utilizado para la determinación de la humedad del aire debido a su gran simplicidad y constituye el fundamento del funcionamiento de muchos higrómetros, sin embargo dado los adelantos de la electrónica, en la actualidad existen instrumentos provistos con sensores fabricados con materiales que cambian sus propiedades eléctricas al estar en contacto con atmósferas con mayor o menor humedad, de tal manera que este cambio produce una señal eléctrica que permite leer y registran directamente la humedad del aire. Cada vez más se utilizan estos instrumentos y la tendencia que se presenta indica que hacia el futuro los higrómetros de bulbo seco y bulbo húmedo serán remplazados por dispositivos electrónicos y digitales para la medida de la humedad del aire. Figura 59: Disposición de termómetros para determinar temperaturas de bulbo seco y de bulbo húmedo Carta psicrométrica La carta psicrométrica es un diagrama donde se encuentran representadas las propiedades como humedad específica, humedad relativa, entalpía, volumen específico, presión de vapor, temperatura de bulbo seco y temperatura de bulbo húmedo, para un estado determinado de la mezcla de aire y vapor de agua a presión constante, que generalmente UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA es de 1 atmósfera o 101.325 kPa. En el eje vertical y hacia el lado derecho se representan las humedades específicas () y en el eje horizontal las temperaturas de bulbo seco (Tbs). Las unidades dependen del sistema que se utilice, por lo general se presentan cartas psicrométricas para el SI y para el sistema inglés. Para cada humedad específica del aire atmosférico existe una temperatura de saturación, es decir una temperatura donde la humedad relativa es del 100%. Cada pareja de valores de temperatura de saturación y humedad específica determinan un punto en la carta psicrométrica. El conjunto de estos puntos corresponde a la línea de saturación o línea de humedad relativa del 100%, como se observa en la figura 126, en la cual se han representado en forma esquemática sus principales líneas. En ella, por ejemplo, Usted puede apreciar que al seguir la línea de saturación, a mayor temperatura la humedad específica del aire es mayor, en otras palabras, la gráfica muestra de forma visual y cuantitativamente que al aumentar la temperatura aumenta la capacidad del aire para retener agua. Las líneas de humedad relativa constante ( = constante) tienen aproximadamente la misma forma que la línea de saturación y se encuentran por debajo de ésta, en la medida que disminuyen su valor. Otras líneas que aparecen en la carta psicrométrica son las de volumen específico constante, temperatura de bulbo húmedo constante y entalpía constante. La entalpía y el volumen específico tienen sus correspondientes escalas, mientras que la temperatura de bulbo húmedo se lee en el eje horizontal para la coordenada de la intersección con la línea de saturación ya que en este punto la temperatura de bulbo seco y la de bulbo húmedo son iguales. Figura 60: Representación esquemática de la carta psicrométrica UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Cualquier punto en la carta psicrométrica representa un estado particular de la mezcla aire y vapor de agua. Para establecer este punto son suficientes dos propiedades intensivas, por ejemplo, la humedad específica y la temperatura, ya sea de bulbo húmedo o de bulbo seco; la humedad relativa y temperatura de bulbo húmedo o de bulbo seco; la humedad específica y la humedad relativa, o la temperatura de bulbo húmedo y la temperatura de bulbo seco. Cualquiera de estas parejas de datos determinan el estado del aire húmedo y por consiguiente quedan definidas sus otras propiedades. Una línea horizontal en la carta psicrométrica representa estados de humedad específica constante a diferentes temperaturas y a presión constante. Una línea vertical representa estados donde la temperatura de bulbo seco es constante a diferentes humedades. Por ejemplo el cambio del estado A hacia el estado B, ilustrado en la figura 140, indica un calentamiento del aire, manteniendo una humedad específica constante; observe que en este proceso la humedad relativa del aire disminuye. Al contrario si el proceso se da de B hacia A, se produce un enfriamiento a humedad específica constante con un aumento de la humedad relativa y si el enfriamiento continúa bajo estas condiciones se llegará a una temperatura donde la humedad relativa alcanza el valor del 100%, es decir, el aire se satura y se produce la condensación; tal temperatura, como ya conoce, corresponde al punto de rocío. Por los puntos A y B pasan las correspondientes líneas de temperatura de bulbo húmedo constante cuyos valores se leen sobre el eje horizontal para la intersección de estas líneas con la línea de saturación. Observe como la diferencia (TbsB -TbhB) es mayor que la diferencia entre (TbsA – TbhA) ¿qué significado tiene este comportamiento? Cuando se alcanza el punto de rocío, ¿qué relación hay entre la temperatura de bulbo seco, la temperatura de bulbo húmedo y la temperatura de saturación? Figura 61: Procesos de calentamiento o enfriamiento a humedad constante UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Una línea vertical en la carta psicrométrica representa estados de temperatura constante del aire para diferentes contenidos de humedad bajo una presión también constante. El cambio de estado de A hacia B, ilustrado en la figura 127, indica que el aire gana humedad y este proceso continúa hasta que el aire se satura, es decir, la línea vertical alcanza a la línea de saturación. En este proceso la humedad relativa aumenta. El proceso contrario implica que el aire a temperatura constante pierde humedad. La diferencia entre los valores de las humedades específicas de los puntos A y B corresponde al agua ganada o perdida por unidad de masa de aire seco. La diferencia entre estos valores permite calcular fácilmente la cantidad de agua retirada de un material que ha sido sometido a un secado o a una deshidratación si se conoce la humedad específica inicial del aire utilizado en este proceso y su correspondiente flujo másico; también permite calcular la cantidad de agua que se requiere suministrar al aire para que alcance una determinad humedad relativa para que cumpla con las condiciones apropiadas para crear un ambiente propicio para el almacenamiento de algunos productos alimenticios. Figura 62: Procesos de humidificación o deshumidificación En la figura 129 se representan otros procesos donde simultáneamente varían la temperatura y la humedad del aire, por ejemplo el proceso de A hacia B, representa un UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA calentamiento con humidificación, mientras que el proceso en la dirección opuesta, es decir, de B hacia A, implica un enfriamiento con disminución de la humedad específica del aire. Es interesante que observe como cambian las temperaturas de bulbo húmedo y la humedad relativa en estos procesos. En el proceso de C hacia D se presenta un aumento de la temperatura con disminución de la humedad específica, el proceso inverso desde D hacia C corresponde al enfriamiento con humidificación. Muchos de estos procesos se presentan en el acondicionamiento de aire y en las operaciones de secado. Con los datos de humedad específica y temperatura para un estado determinado se pueden calcular la cantidad de agua y de aire seco presentes en un volumen definido de aire a una presión dada. Figura 63: Procesos con cambio de temperatura y humedad La carta psicrométrica constituye una herramienta muy valiosa para todo ingeniero ya que ahorra muchos cálculos como los realizados en el ejemplo 68; por mucho tiempo ésta fue la fuente de datos para las diferentes aplicaciones técnicas, sin embargo, actualmente a través de Internet se encuentran programas que proporcionan en forma inmediata los valores de las propiedades psicrométricas en forma rápida y precisa si se conocen dos variables y la presión atmosférica o la elevación sobre el nivel del mar. En la figura 130 se muestra una interfase de uno de estos programas.1 El programa funciona en forma intuitiva y muy sencilla, en la tabla del lado izquierdo aparecen los datos que se deben introducir. Se debe elegir en primer lugar el sistema de unidades con el cual se quiere trabajar, luego se establecen la temperatura del aire y la altitud sobre el nivel del mar, enseguida se selecciona o bien la temperatura de bulbo húmedo, la humedad relativa o el punto de rocío y finalmente se da clic en el botón “Calcular” e inmediatamente se actualizan los valores de las propiedades como la presión 1 MILLÁN, José A. Psicrometría. En: http://www.sc.ehu.es/nmwmigaj/CartaPsy.htm. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA atmosférica, la presión de saturación, la presión parcial del vapor de agua, la entalpía y el volumen específico. Figura 64: Interfase de usuario de un software para psicrometría. La ventaja del software sobre la carta psicrométrica salta a la vista. En primer lugar los datos que se necesitan se obtienen en forma simultánea e instantánea lo que implica un apreciable ahorro de tiempo, por otro lado, para cada presión se requiere de una carta diferente y este factor constituye una gran limitante. El software en cambio proporciona los datos para cualquier presión. En los ejemplos siguientes se utilizaran los datos de las propiedades psicrométricas para resolver algunos problemas prácticos. Ejemplo 73 El reporte meteorológico de una ciudad situada a 1600 m sobre el nivel del mar indica una temperatura de 25 ºC y una humedad relativa del 85%. Calcular la cantidad de agua presente en 50 m3 del aire atmosférico. Análisis del problema La altura sobre el nivel del mar determina la presión atmosférica, con los valores de la temperatura y la humedad relativa se determina la presión parcial del agua en el aire. Con este dato y suponiendo un comportamiento de gas ideal se halla la masa de agua mediante la ecuación de estado. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Solución del problema A 1600 m sobre el nivel del mar la presión es de 83.5 kPa. A esta presión, a 25 ºC y para una humedad relativa del 85%, la presión parcial del agua es de 2,69 kPa. Dato obtenido del software “Carta psicrométrica”. m H 2O n H 2O M H 2O m H 2O ( p H 2O )VM H 2O RT kg (2.69kPa)(50m 3 )(18 ) kmol 0.978 kg kJ (8.31 )(298K ) kmol.K Ejemplo 74 Se desea diseñar un dispositivo de acondicionamiento de aire que trabaje a una altura de 2600 m sobre el nivel del mar y maneje un flujo másico de 30 m 3/min de aire atmosférico a 12 ºC y 35% de humedad relativa y lo acondicione mediante un calentamiento inicial hasta que alcance una temperatura de a 20 ºC y luego mediante una adición de vapor de agua hasta elevar la humedad relativa al 55% y la temperatura a 25 ºC. Determinar la potencia calorífica que requiere para el calentamiento y la cantidad de vapor de agua que se debe proporcionar. Análisis del problema El acondicionador de aire debe tener una sección de calentamiento y una sección de humidificación, el aire fluye a través de ellas. Se define como volumen de control la región del dispositivo de acondicionamiento que se indica en la figura 131. La circulación del aire y el suministro de vapor se modelan mediante un proceso de flujo permanente de dos entradas y una salida. A las condiciones iniciales se determina el valor de las presiones parciales del vapor de agua y del aire seco, con los cuales se hallan las masas correspondientes utilizando la ecuación de los gases ideales. Aplicando la primera ley de la termodinámica se determina la cantidad de calor requerida en el proceso de calentamiento del aire a humedad constante. Ya que en este proceso no hay trabajo ni tampoco cambios apreciables de energía cinética y de energía potencial, entonces el calor transferido será igual a la diferencia entre la entalpía de salida y la entalpía de entrada al proceso. Como este proceso se realiza a humedad específica constante, entonces el punto de rocío del aire en este proceso no cambia y este criterio se utiliza para evaluar la entalpía del aire luego de la etapa de calentamiento. La segunda pregunta se responde aplicando la ley de conservación de la materia. La diferencia entre la cantidad de agua que contiene el aire al final del proceso de humidificación y la que presenta al inicio corresponde al agua que se debe suministrar. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Figura 65: Datos del ejemplo y diagrama psicrométrico Solución del problema Propiedades del aire para las condiciones de entrada Altitud SNM 2600 𝑚 Presión atmosférica Temperatura Presión de saturación 12 º𝐶 Humedad relativa Presión parcial H2O 35 % Punto de rocío −2.62 º𝐶 Entalpía específica Humedad específica 0.0042 Volumen específico Entalpía específica a 20 º𝐶 luego del calentamiento 73.9 𝑘𝑃𝑎 1.4 𝑘𝑃𝑎 0.49 𝑘𝑃𝑎 𝑘𝐽 22.56 𝑘𝑔𝐴. 𝑆. 𝑚3 1.1141 𝑘𝑔𝐴. 𝑆. 𝑘𝐽 30.68 𝑘𝑔𝐴. 𝑆. Propiedades del aire para las condiciones de salida Humedad específica a 25 º𝐶 y 55% de humedad relativa 0.0150 Datos obtenidos del programa “Carta psicrométrica” Primera etapa: calentamiento a humedad específica constante pas P p H 2O 73.9 kPa 0.49 kPa 73.41 kPa mas p as V M as RT m3 kg )(28.97 ) min kmol 126.93 kg min kPa.m 3 (8.314 )(285K ) kmol.K (73.41kPa)(30 Teniendo en cuenta que la humedad específica del aire en la primera etapa es constante, la primera ley se reduce a kg kJ kJ Q mas (h20C h12C ) 26.93 30.68 - 22.56 218.7 min kg min kJ 1 min Q (218.7 )( ) 3.64kW min 60 s Balance de materia en la segunda etapa del proceso UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA mas (2 ) mH 2O(v ) mas (3 ) La masa de vapor suministrada se despeja de la anterior ecuación mH 2O ( v ) mas (3 2 ) (26.93 kg kJ kg )(0.0150 0.0042) 0.29 min kg min El acondicionamiento de aire se hace más necesario cuando las condiciones ambientales de una región son de gran humedad y alta temperatura ya que bajo esas condiciones el cuerpo humano no puede liberar con facilidad el calor generado lo que ocasiona una seria sensación de incomodidad, también bajo estas condiciones el crecimiento de microorganismos y la actividad enzimática se ven favorecidos. En el ejemplo siguiente se requiere determinar la cantidad de agua y de calor retirada por una unidad de acondicionamiento de aire para entre a una cava de almacenamiento de vinos. Ejemplo 75 El aire de la atmósfera de una región que se encuentra a 1000 m sobre el nivel del mar, está a 28 ºC y tiene 80% de humedad relativa; debe acondicionarse para que entre a una cava como aire saturado a 10 ºC, para lo cual se utiliza un dispositivo que maneja un flujo másico de aire de 15 m3/min, donde primero se enfría hasta alcanzar la temperatura de rocío y luego mediante enfriamiento posterior se condensa el agua, manteniendo las condiciones de saturación, hasta alcanzar la temperatura final. ¿Cuál es la humedad específica final? ¿Qué cantidad de agua por minuto se debe retirar? ¿Qué cantidad de calor por minuto se debe retirar en todo el proceso? Análisis del problema En regiones con gran humedad y temperaturas altas se utilizan unidades de acondicionamiento de aire provistas de mecanismos para enfriar, y retirar el agua que se condensa. En primer lugar se especifica un volumen de control como el indicado en la figura 145 y se considera un proceso de flujo permanente con una entrada y dos salidas. La humedad específica del aire al enfriarse permanece constante y su humedad relativa aumenta hasta alcanzar el 100%. En este punto, un posterior enfriamiento produce la condensación y este fenómeno continúa hasta alcanzar la temperatura final. El agua que se condensa se supone que se retira a la temperatura final del aire. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Figura 66: Datos del ejemplo y diagrama psicrométrico Solución del problema Propiedades del aire para la condiciones de entrada Altitud SNM 1000 𝑚 Presión atmosférica Temperatura Presión de saturación 28 º𝐶 Humedad relativa Presión parcial H2O 80% Punto de rocío 24.2 º𝐶 Entalpía específica 89.7 𝑘𝑃𝑎 3.78 𝑘𝑃𝑎 3.03 𝑘𝑃𝑎 𝑘𝐽 83.56 𝑘𝑔𝐴. 𝑆. Humedad específica 0.0217 Volumen específico 𝑚3 0.9965 𝑘𝑔 Propiedades para condiciones de salida 10 º𝐶 y h. relativa 100% Humedad específica en kg de agua/kg de aire seco 0.0086 Entalpía específica en kJ/kg de aire seco 31.82 Datos obtenidos del programa “Carta psicrométrica” Cálculo de masa de aire seco pas P p H 2O 89.7kPa 3.03kPa 86.67 kPa mas p as V M as RT m3 kg )(28.97 ) min kmol 15.20 kg min kPa.m 3 (8.314 )(298K ) kmol.K (86.67kPa)(15 Cálculo del flujo másico de agua condensada mas (1 ) mas (3 ) mH 2O (l ) mH 2O (l ) mas (1 3 ) (15.20 kg agua kg )(0.0217 0.0086) min kg aire seco mH 2O (l ) 0.199 Cálculo de la transferencia de calor kg min UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Q mas (h10C h28C ) hH 2O (l 10C ) Del software propagua: hH 2O (l 10C ) 42 Q (15.20 kg min kJ kg kg kJ kJ )(31,82 - 83,56) (0.199 )(42 ) kg min kg Q 778 kJ min UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA ACTIVIDADES DE AUTOEVALUACIÓN DE LA UNIDAD 2 Conceptualización y análisis 9 1. Explique por qué razón la fricción es un proceso irreversible, cuál es el comportamiento de este proceso. 2. Clasifique los siguientes procesos en reversibles e irreversibles e indique como cambia la entropía global tanto del sistema y los alrededores. a. Condensación de vapor de agua 50 ºC y 100 kPa b. Evaporación del agua a 120,23 ºC y 200 kPa c. Mezcla en igual proporción molar de oxígeno y nitrógeno d. Expansión isotérmica de un gas ideal e. Compresión adiabática de una mezcla aire combustible gaseoso. 3. Analice los enunciados para la segunda ley de la termodinámica e indique que generalizaciones se pueden realizar a partir de ellos. 4. ¿Pueden, dos máquinas térmicas que trabajan entre las mismas temperaturas tener eficiencias diferentes? Argumente su respuesta. 5. ¿Qué significa que el coeficiente de rendimiento de un refrigerador sea igual a 1? 6. La entropía es una propiedad que se define solo para transformaciones reversibles. Entonces, ¿qué método se utiliza para determinar el cambio de entropía en un proceso irreversible? 7. ¿Qué significado tiene para un determinado proceso un cambio de entropía negativo en el sistema y positivo en el universo? 8. Explique como se puede calcular el cambio de entropía en una reacción química. 9. Indique que posibilidades tiene de realizarse en forma espontánea o irreversible, un proceso químico que al realizarse libera calor e implica un aumento de la entropía. 10. ¿Durante un proceso adiabático reversible, la entropía del sistema aumenta o disminuye? Explique su respuesta. Autoevaluación 9 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Preguntas de selección múltiple. En un tiempo no mayor de 15 minutos seleccione la opción correcta para cada pregunta. Compare con la información de retorno. Si el resultado es inferior al 70%, vuelva a estudiar este capítulo. No avance hasta no tener claros los conceptos involucrados en estas preguntas. 1) La segunda ley de la termodinámica permite 6) Al ocurrir un proceso irreversible la entropía establecer del universo a) b) c) d) un balance de energía la dirección de un proceso el cambio de entalpía el cambio de energía interna 2) Un ejemplo de un proceso reversible puede ser a) b) c) d) 7) a) la expansión libre de un gas b) la mezcla de dos gases ideales c) el flujo de corriente eléctrica por una resistencia d) la compresión isotérmica de un gas 3) Uno de los principios de Carnot dice que ninguna máquina térmica a) b) c) d) calor transferido y temperatura calor suministrado y trabajo calor específico y temperatura cambio de volumen y trabajo 5) La propiedad que permanece constante en un proceso adiabático reversible es la a) b) c) d) temperatura energía interna entropía entalpía. Problemas de aplicación 9 0,29 Cp d) 0,14 Cp c) 8) Cuando un mol de un gas A se mezcla con un mol de gas B el cambio de entropía en este proceso es a) b) c) d) 9) cambio de entropía es igual a la relación entre El cambio de entropía durante el calentamiento de 0,5 moles de un gas ideal a presión constante desde 300 hasta 400 K, es a) 0,29 R b) 0,14 R a) puede tener una eficiencia del 100% b) tiene una eficiencia menor que una máquina ideal c) tiene una eficiencia mayor que la máquina de Carnot d) tiene una eficiencia igual a la máquina de Carnot 4) En un proceso isotérmico reversible el disminuye aumenta no cambia no se puede determinar 2R ln 2 Rln 0,5 0,5R ln 2 2R ln 0,5 Si el calor latente de vaporización del etanol a 78,3 ºC es de 204,26 cal/g, su entropía de vaporización en cal/gK, es a) b) c) d) 2,61 0,75 0,58 0,54 10) La tercera ley de la termodinámica establece que la entropía de una sustancia pura, perfectamente cristalina a 0 K, es a) b) c) d) máxima cero menor que cero mayor que cero UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Resuelva en forma individual o en grupo los siguientes problemas, compare los resultados con la información de retorno. Si encuentra dificultades revise nuevamente la teoría, discuta con sus compañeros, si persiste las dudas, plantéelas en la sesión de tutoría. 1. Determine la máxima cantidad de trabajo que puede producir una máquina ideal que trabaja entre 360 y 900 K si de la fuente de alta temperatura recibe, en forma de calor, 5.000 kJ. Calcule también el calor que se pierde en este proceso. 2. Calcule el tiempo que se necesitaría para congelar 5,0 kg de agua que se encuentra a 25 ºC si la potencia del refrigerador ideal que se utilizaría es de 2,0 kW. 3. Determine la potencia en kW de una bomba calorimétrica para que suministre 80.000 kJ/h si el coeficiente de la bomba calorimétrica es de 2,5. 4. Calcule el trabajo involucrado en cada una de las etapas de un ciclo de Carnot realizado por 0,25 moles de un gas ideal si inicialmente, el gas, se encuentra a 80 kPa y 17 1C, durante la compresión isotérmica la presión aumenta hasta 100 kPa y después de la compresión adiabática, la temperatura llega a 927 1C. (Se asume para un gas ideal que γ = 1,4). 5. Si un sistema formado por 2,5 moles de nitrógeno se expande isotérmicamente hasta reducir la presión hasta la mitad del valor inicial. ¿Cuál el cambio de entropía en este proceso? 6. En un recipiente de paredes adiabáticas se colocan en contacto 150 g de hielo a 0C con 250g de agua líquida a 70C Determine el cambio de entropía. SUSTANCIA H2O (s) H2O(l) CALOR ESPECIFICO 9 cal/(mol.K) 18 cal / (mol.K) CALOR DE FUSION 79.7 cal/ g 7. Determine el cambio de entropía durante la mezcla de 15 moles de nitrógeno, 3 moles de oxígeno y 2 moles de CO2 a la presión de 1 atmósfera y temperatura de 300 K. 8. Calcule el trabajo realizado y el volumen final luego de un proceso isotérmico donde la entropía de 0,2 kmol de aire aumenta en 3,6 kJ/K si la presión inicial es 600 kPa y la temperatura 400 K. 9. Calcule la cantidad de energía que es necesario suministrar en forma de calor y el cambio de entropía para evaporar 25 Kg de agua que se encuentra como líquido saturado a 73 kPa en el interior de un tanque donde la presión se mantiene constante. 10. Calcule la cantidad de calor retirada, el % de vapor que se condensa y el cambio de entropía, cuando 2,0 kg de vapor de agua que se encuentran en un tanque cerrado a 150 ºC y 120 kPa se enfría hasta una temperatura de 80 ºC. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Conceptualización y análisis 10 1. Explique las características de todo ciclo termodinámico ¿Qué significado tiene el área encerrada por las líneas correspondientes a las trayectorias de un ciclo termodinámico en un diagrama Ts? 2. ¿Qué semejanzas y diferencias encuentra entre el ciclo de Otto y el ciclo Diesel? 3. Entre dos rangos de presiones iguales ¿cuál de los ciclos anteriores tiene una mayor eficiencia? 4. Establezca una relación de correspondencia entre cada una de las etapas del ciclo de Brayton y los componentes necesarios para el funcionamiento de una turbina. 5. ¿En qué procesos difieren los ciclos de potencia de gas y los ciclos de potencia de vapor? 6. Describa cada uno de los cambios que ocurren en la sustancia de trabajo durante la etapa de expansión isobárica de un ciclo de Rankine 7. Si en un ciclo ideal de Rankine se mantienen constantes las condiciones a la entrada de la turbina y se reduce la presión en el condensador que efecto tiene sobre la eficiencia del ciclo? 8. Explique la función que cumple el capilar o la válvula en un sistema de refrigeración por compresión de vapor. 9. ¿Qué características termodinámicas debe poseer una sustancia para que pueda ser utilizada como refrigerante? 10. ¿Cuáles son las principales aplicaciones de los sistemas de refrigeración de gas? Autoevaluación 10 Preguntas de selección múltiple. En un tiempo no mayor de 12 minutos seleccione la opción correcta para cada pregunta. Compare con la información de retorno. Si el resultado es inferior al 70%, vuelva a estudiar este capítulo. No avance hasta no tener claros los conceptos involucrados en estas preguntas. 1) En los ciclos ideales de potencia la sustancia de trabajo es a) b) c) d) el combustible gaseoso el aire los gases de combustión la mezcla carburante 6) El fluido de trabajo cambia de fase en el ciclo de a) b) c) d) Carnot Diesel Brayton Rankine UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 2) El funcionamiento de un motor a gasolina se estudia mediante el ciclo de a) b) c) d) Otto Diesel Brayton Rankine 3) El ciclo de Brayton se utiliza para modelar el funcionamiento de a) b) c) d) 7) Mediante el ciclo inverso de Carnot se estudia el comportamiento ideal de a) b) c) d) 8) una caldera una central termoeléctrica un motor de 4 tiempos una turbina motores y bombas térmicas bombas y compresores refrigeradores y bombas térmicas condensadores y evaporadores En un ciclo de refrigeración, se requiere del proceso de estrangulamiento debido a que en él se produce a) b) c) d) aumento de la presión aumento de la capacidad calorífica descenso de la temperatura descenso de la entalpía 4) Si en un ciclo de Otto la relación de compresión aumenta se puede deducir que a) b) c) d) la eficiencia disminuye la energía disminuye aumenta el trabajo producido en el ciclo aumenta la cantidad de calor suministrado 5) En un ciclo Diesel el calor requerido se suministra en el proceso de a) b) c) d) expansión isotérmica expansión isobárica compresión isotérmica isocórico 9) El COP de una bomba de calor ideal que extrae calor a -13 ºC y lo cede a 27 ºC, es a) b) c) d) 0.15 0,48 2,1 6,5 10) Si se quisiera aprovechar directamente la energía solar con fines de refrigeración el sistema más apropiado sería a) b) c) d) refrigeración por absorción refrigeración de gas ciclo inverso de Carnot compresión de vapor Problemas de aplicación 10 Resuelva en forma individual o en grupo los siguientes problemas, compare los resultados con la información de retorno. Si encuentra dificultades revise nuevamente la teoría, discuta con sus compañeros, si persiste las dudas, plantéelas en la sesión de tutoría. 1) En un ciclo ideal de Otto de aire estándar se dan las siguientes condiciones: a) Temperatura inicial 298,0 K b) Presión inicial 120,0 kPa c) Temperatura después de la compresión adiabática 700,0 K d) Calor suministrado 24.600 kJ/kmol UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Calcule la relación de compresión, la relación de presiones máxima a mínima y la eficiencia del ciclo. 2) Un ciclo ideal de Diesel opera con una relación de compresión de 9.0 y las condiciones iniciales son 27 1C y 92 kPa. El volumen inicial del cilindro es de 7,72 x 10-3 m3. Si al aire se le suministran 4.3 kJ en forma de calor durante el proceso de expansión isobárica determine la presión y temperatura al final de cada proceso y la eficiencia del ciclo. 3) Un ciclo de Brayton simple que usa aire como fluido de trabajo tiene una relación de presiones de 12. Si el aire entra al compresor 300 K y 80 kPa, y a la turbina a 1.250 K ¿cuál será la temperatura a la salida del compresor y a la salida de la turbina? Determine el trabajo del compresor, el trabajo producido por la turbina y el calor transferido durante los procesos isobáricos. 4) Calcular la potencia de una planta de vapor que trabaja con un ciclo ideal de Rankine simple entre 3,5 MPa y 60 kPa. La temperatura del vapor a la entrada de la turbina es de 420 1C y el vapor circula a través del ciclo a razón de 25 kg/s. 5) Una nevera utiliza refrigerante 12 como sustancia de trabajo y funciona mediante un ciclo ideal de refrigeración por compresión de vapor entre 0.1 y 0.65 MPa. El flujo másico del refrigerante es de 0,056 kg/s. Calcular la potencia calorífica retirada del espacio refrigerado, la potencia calorífica cedida al ambiente y la potencia suministrada por el compresor. Conceptualización y análisis 11 1. Establezca las diferencias entre flujo permanente o estable y flujo transitorio 2. Con un ejemplo explique el concepto de trabajo de flujo 3. Plantee una ecuación general que muestre el principio de conservación de energía en un volumen de control. 4. Explique la razón por la cual los procesos de estrangulamiento se utilizan en refrigeración. 5. Explique si se presentan o no cambios en la densidad de un fluido gaseoso cuando pasa por un compresor que trabaja en un proceso de flujo estable. 6. Plantee una ecuación para el balance energético en un evaporador. 7. ¿Cómo cambia la temperatura y la densidad en una tobera? 8. ¿Qué sucede cuando un líquido saturado se somete a un proceso de estrangulamiento? UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 9. ¿Por qué razón aumenta la temperatura de un fluido que se llena a un tanque vacío mediante conexión a una línea de alimentación a presión alta? 10. Un operario abandonó por un tiempo su trabajo dejando por descuido abierta la válvula de un tanque de aire comprimido, cuando regresó encontró que el tanque estaba recubierto de hielo. Explique ¿por qué pudo haber ocurrido tal fenómeno? Autoevaluación 11 Preguntas de selección múltiple. En un tiempo no mayor de 12 minutos seleccione la opción correcta para cada pregunta. Compare con la información de retorno. Si el resultado es inferior al 70%, vuelva a estudiar este capítulo. No avance hasta no tener claros los conceptos involucrados en estas preguntas. 1) Si en cualquier punto de un volumen de control las propiedades de un fluido en un instante determinado son iguales, se dice que el flujo es a) b) c) d) estable uniforme permanente estacionario 2) El caudal volumétrico de un fluido a través de una tubería depende de a) b) c) d) 7) 8) a) b) c) d) aumenta cuatro veces aumenta dos veces disminuye dos veces disminuye cuatro veces 5) En un intercambiador de calor donde no se presentan pérdidas de energía hacia el 9) isentrópico isoentálpico isocórico adiabático Cuando un fluido pasa a través de una tobera, experimenta un aumento de a) b) c) d) 4) Si el diámetro de una tubería se reduce a w = – h q = h q – w = h q – w = u + p v El coeficiente Joule Thomson de un gas es una medida de la variación de la temperatura con respecto a la presión durante un proceso a) b) c) d) energía cinética energía potencial energía total entalpía la mitad la velocidad La primera ley para un proceso de flujo permanente donde solo se encuentra un dispositivo como una bomba o un compresor se expresa mediante la ecuación a) b) c) d) densidad y área de la tubería densidad y velocidad velocidad y diámetro de la tubería velocidad y caída de presión 3) En un punto de un volumen de control la suma de la energía interna del fluido más el trabajo de flujo es igual, para ese punto, a la a) b) c) d) 6) entalpía presión energía cinética energía interna Al llenar un recipiente con un fluido procedente de una línea de carga se presenta igualdad entre la energía interna del fluido y la a) b) c) d) entalpía en la línea de carga entalpía en el interior del recipiente energía cinética al entrada entropía antes de entrar al recipiente UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA exterior, el cambio de entalpía de uno de los fluidos, es igual al a) b) c) d) trabajo de flujo cambio de temperatura cambio de energía interna calor transferido 10) Cuando se abre la válvula de un cilindro que contiene un gas se presenta a) b) c) d) aumento de entalpía aumento de energía disminución de temperatura disminución del volumen específico Problemas de aplicación 11 Resuelva en forma individual o en grupo los siguientes problemas, compare los resultados con la información de retorno. Si encuentra dificultades revise nuevamente la teoría, discuta con sus compañeros, si persiste las dudas, plantéelas en la sesión de tutoría. 1. Para obtener agua caliente a 85 ºC que se requiere en un proceso de escaldado, se mezclan en una cámara, vapor saturado 180 kPa y agua líquida a 180 kPa y 15 ºC. Si el agua fría se suministra a razón de 1,5 kg/s determine el caudal másico del vapor. 2. Para suplir las necesidades de agua de una planta procesadora de alimentos se bombea agua desde un pozo a 15 metros bajo la superficie, hasta la parte más alta de la edificación situada a 20 m sobre el suelo mediante una bomba de 1,5 kW, Si se descarta cualquier pérdida de energía por fricción o por transferencia de calor determine, el máximo flujo de agua que puede mantenerse mediante este sistema de bombeo. 3. Un calentador eléctrico tiene una resistencia de 15,0 kW. Si el agua entra de manera permanente a 14 ºC y 110 kPa, determine el flujo másico para que el agua salga continuamente a 65 ºC. 4. Una turbina adiabática se alimenta mediante 7,0 kg/s de vapor sobrecalentado a 400 ºC y 10 MPa. El vapor sale a 75 kPa y con una calidad del 90%. Si se desprecian los cambios de energía cinética y de energía potencial, determine la potencia de la turbina. 5. Un cilindro de paredes metálicas inicialmente vacío y tiene una capacidad de 0,20 m3, se carga con oxígeno proveniente de una línea de llenado a 200 kPa y 10 ºC hasta que la presión en el cilindro llega 200 kPa. Determine la temperatura y la masa en el interior del cilindro después del proceso. Conceptualización y análisis 12 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 1. Se desea proporcionar agua caliente para un proceso a razón de 20 L/min. Ud. como futuro ingeniero qué criterios tendría en cuenta para recomendar una determinada fuente de calefacción para atender a esta necesidad? 2. Analice y explique los cambios energéticos que tienen lugar en un proceso de liofilización. 3. Consulte y explique en que consisten los sistemas de evaporación de triple efecto. 4. ¿Cómo se podrían alcanzar temperaturas tan bajas como para licuar el aire? 5. ¿Puede la temperatura de saturación adiabática ser mayor que la temperatura de una mezcla de aire y vapor de agua? Justifique su respuesta 6. ¿Qué relación existe entre la humedad relativa del aire atmosférico y la diferencia entre las temperaturas de bulbo seco y de bulbo húmedo? 7. Explique ¿cómo podría calcularse el agua retirada durante un proceso de secado, si se conocen las temperaturas de bulbo seco y de bulbo húmedo tanto a la entrada como a la salida de un secador de túnel y el flujo másico del aire utilizado? 8. ¿Cómo se representan en una carta psicrométrica procesos de calentamiento con humidificación? 9. ¿Qué intercambios de materia y energía se presentan durante el secado de un material? 10. ¿Cuál temperatura de bulbo húmedo será mayor, la del aire con una humedad relativa de 50% o la del aire con humedad relativa del 90% a igual temperatura y presión? Justifique su respuesta. Autoevaluación 12 Preguntas de selección múltiple. En un tiempo no mayor de 10 minutos seleccione la opción correcta para cada pregunta. Compare con la información de retorno. Si el resultado es inferior al 70%, vuelva repasar los conceptos involucrados en cada una de las preguntas que no respondió acertadamente. 1) Una de las propiedades de la leche, necesarias 6) La relación entre la presión parcial del vapor para determinar el calor requerido durante la de agua en el aire atmosférico y la presión de pasterización, es su vapor del agua a una determinada temperatura se denomina a) entropía b) volumen específico a) humedad específica c) calor latente b) humedad relativa d) calor específico c) fracción molar d) presión de saturación 2) La temperatura en el interior de un autoclave, lleno con vapor saturado, se determina si se 7) Si la temperatura del aire permanece conoce constante y su temperatura de bulbo húmedo disminuye, significa que UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA a) b) c) d) la presión la velocidad del vapor el flujo másico del vapor el calor de vaporización 3) El funcionamiento de un compresor se modela mediante un ciclo donde la etapa de compresión es un proceso adiabático reversible, por tanto la propiedad que se mantiene constante en este proceso es a) b) c) d) entalpía entropía temperatura presión a) b) c) d) 8) Si la humedad específica del aire es constante, al enfriarse, aumenta a) b) c) d) 9) la humedad del aire aumenta la entalpía del aire aumenta la presión de saturación disminuye la presión parcial de H2O disminuye el punto de rocío la presión de vapor del agua la humedad relativa el volumen específico El aire atmosférico se satura más fácilmente cuando 4) La expansión de un gas al atravesar un orificio o conducto capilar, implica una disminución de a) b) c) d) volumen específico entalpía temperatura entropía 5) En la elaboración industrial del bocadillo se utilizan marmitas abiertas con camisa de vapor, la energía necesaria para la evaporación, en estos casos procede directamente de la a) condensación del vapor b) combustión de un combustible c) expansión del vapor d) entalpía de la solución a) b) c) d) se calienta y humidifica se enfría y se humidifica solo se enfría solo se humidifica 10) La temperatura de bulbo húmedo de una mezcla aire-vapor de agua, permanece constante, durante un proceso de a) b) c) d) expansión adiabática calentamiento con humidificación enfriamiento a humedad constante enfriamiento adiabático e isobárico Problemas de aplicación 12 Resuelva en forma individual o en grupo los siguientes problemas, compare los resultados con la información de retorno. Si encuentra dificultades revise nuevamente la teoría, discuta con sus compañeros, si persiste las dudas, plantéelas en la sesión de tutoría. 1. Cuando a un flujo permanente de aire seco se suministra una potencia calorífica de 30 kW, a presión constante, el gas se calienta desde 20 ºC hasta 110 ºC. Si el cp promedio en este rango de temperaturas puede tomarse como 1,0045 kJ/(kg.K) ¿cuál será el caudal másico del gas. 2. A una marmita para escaldado de vegetales, llega vapor saturado seco a 150 ºC y sale con UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA una calidad del 60%. Determinar la cantidad de de vapor que sería necesario utilizar en el proceso de elevar la temperatura de 250 kg de agua desde 15 hasta 70 ºC si la presión se mantiene constante en 1 atmósfera. 3. La lectura de los manómetros en una línea de vapor, se encuentra relacionada con la temperatura y el estado de saturación del vapor. Calcular la presión que debe registrar el manómetro de un autoclave, en un sitio donde la presión atmosférica es de 75,0 kPa, para que la temperatura en el interior sea de 130 ºC? Si en ese sitio la presión que se lee en el manómetro es de 200,0 kPa, cuál será la temperatura? 4. Se desea conocer la cantidad de agua y el calor retirado por kg de aire seco en una unidad de acondicionamiento de aire si se conoce que el aire entra a una temperatura de 32 ºC, presión de 101,3 kPa y humedad relativa del 80%; el aire sale a una temperatura de 15 ºC, presión de 95,0 kPa y 40% de humedad relativa. 5. Se desea concentrar por evaporación 100,0 kg/h de un jugo que contiene un 5% de sólidos hasta aumentar la concentración al 30% para lo cual se insufla, en el líquido, aire en contracorriente a 50 ºC, 1,0 atmósferas y 5,0 % de humedad relativa; si el aire se enfría adiabáticamente y sale saturado ¿qué flujo másico de aire se necesita? Figura 67: Evaporación por contacto directo con aire UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA FUENTES DOCUMENTALES DE LA UNIDAD 2 Abbot, & Ness, V. (s.f.). Termodinámica. Mc Graw Hill. Agüera, J. (1989). Propagua. Obtenido de Software de Termodinámica: http://www.tecnun.es/asignaturas/termo/SOFTWARE/SoftTD.htm Agüera, J. (1998). Progases. Obtenido de Software de Termodinámica: http://www.tecnun.es/asignaturas/termo/SOFTWARE/SoftTD.htm Ayuso, L. E. (1989). Termodinámica. Bogotá: Unisur. Boxer, G. (1990). Termodinámica. Addison & Wesley Iberoamericana. Cengel, Y., & Boles, M. (2003). Termodinámica. México: Mc Graw Hill. Cisneros, Á. E. (2006). Termodinámica. Bogotá: Unad. Faires, V. (1980). Thermodynamics. New York: The Mc Millan Company. Hougen, O., Watson, K., & Ragatz, R. (1988). Principios de los procesos químicos. Barcelona: Reverté. Jones, & Dugan. (1999). Fundamentos de termodinámica. México: Prentice-Hall Hispanoamericana. Levenspiel. (1999). Fundamentos de termodinámica. Prentice-Hall Hispanoamericana. Madison, J. (1998). Confusement. Obtenido de http://www.joshmadison.com/software/ Manrique, J. (2001). Termodinámica. México: Oxford University Press. Millán, J. (s.f.). Cálculos Psicrométricos. http://www.sc.ehu.es/nmwmigaj/CartaPsy.htm Obtenido de Moran, M., & Shapiro, H. (1993). Fundamentos de termodinámica técnica. Barcelona: Reverté. National Institute of Standards and Technology. (s.f.). Libro del Web de Química de Nist. Obtenido de http://webbook.nist.gov/chemistry/ National Institute of Standards and Technology. (s.f.). Propiedades termofísicas de sistemas fluidos. Obtenido de http://webbook.nist.gov/chemistry/fluid/ Reynolds, P. (1980). Ingeniería termodinámica. México: Mc Graw Hill. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Russell, L., & Adebiyi, G. (2000). Termodinámica clásica. México: Pearson Educación Latinoamericana. Shavit, A., & Gutfinger, C. (1995). Thermodynamics, from concepts to applications. Londres: Prentice Hall. Smith, J., & Van Ness, H. (1982). Introducción a la termodinámica en ingeniería química. México: Mc Graw Hill. Van Wylen, G., Sonntag, R., & Borgnakke, C. (2003). Fundamentos de termodinámica. México: Limusa. Wark, K., & Richards, D. (2001). Termodinámica. Madrid: Mc Graw Hill. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA INFORMACIÓN DE RETORNO UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA INFORMACIÓN DE RETORNO 1 Respuestas a preguntas de selección múltiple 1. b 6. c 2. d 7. b 3. c 8. c 4. c 9. a 5. a 10. b Problemas de aplicación 1. a) La presión del gas es igual a la suma de la presión atmosférica más la presión ejercida por la fuerza externa. A su vez esta presión es igual a la fuerza sobre el área transversal. P Patm Pext 101kPa 20 N 10000cm 2 1kPa ( )( ) 107.7 kPa 1000Pa 30cm 2 1m 2 b) Se utiliza la ecuación de estado para determinar la temperatura P1V1 107700 Pa.0.001m 3 T1 518.4 K 0.7 g J nR ( )8.31( ) g mol.K 28 mol T2 0.8T1 0.8(518.4K ) 414.7 K c) V2 2. V1 J )(414.7 K ) mol.K 0.0008 m 3 0.8 L 107700 Pa V 800cm 3 h 26.7 cm A 30cm 2 0.025(8.31 J )(298K ) mol.K 0.066 m 3 66 L 75000 Pa P2 (1 0.40)(75kPa) 45 kPa 2mol(8.31 V2 (75kPa)(66 L) 45kPa 110 L UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Figura 68: Diagrama PV para el proceso isotérmico 3. La secuencia de procesos conforman un proceso cíclico. Para trazar la trayectoria se deben determinar las condiciones de presión y volumen iniciales y en cada uno de los estados intermedios. n 2 moles P1 1 atm V1 (2 moles )( P2 P1 1 atm 22.4 L 1 mol T1 273 K ) 44.8 L T2 2T1 2(273 K ) 546 K V2 2V1 2(44.8 L) 89.6 L T3 T2 P3 V3 3V1 3(44.8 L) 134.4 L P2V2 (1 atm)(89.6 L) 0.67 atm V3 134.4 L V4 V3 P4 T4 T1 P3T4 (0.67 atm)(273 K ) 0.33 atm T3 546 K Figura 69: Diagrama PV para el proceso cíclico UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA PV 4. n RT (250kPa)(0.1 m 3 ) 0.0104 kmol 10.4 moles kJ (8.31 )(288 K ) kmol.K 16 g mCH 4 (10.4 moles )( ) 166.4 g 1 mol Ya que las paredes del tanque son rígidas el proceso que ocurre es isocórico, por tanto V2 V1 P2 P1T2 (250 kPa)(303 K ) 263 kPa T1 288 K Figura 70: Diagrama PV - Proceso isocórico Figura 71: Diagrama PT - Proceso isocórico 5. Para calcular la presión parcial de cada gas es necesario determinar el número de moles y la fracción molar de cada uno de ellos. 1 mol n N 2 (7000 g )( ) 250 moles 28 g UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 1 mol nCO2 (4400 g )( ) 100 moles 44 g x N2 250moles 0.71 350moles xCO2 100moles 0.29 350moles PN2 x N2 P 0.71(300 kPa) 213 kPa PCO2 xCO2 P 0.29(300 kPa) 87 kPa Asumiendo que las paredes del sistema son rígidas y que la temperatura se mantiene constante la presión será directamente proporcional al número de moles. Entonces se calcula el número de moles de nitrógeno adicionales y con ese dato se determina el nuevo número de moles totales y la presión final. 1 mol n N 2 (2000 g )( ) 71.4 moles 28 g P ntotales 350 71.4 421.4 moles (300 kPa)(421.4 moles ) 350 moles 361.2 kPa INFORMACIÓN DE RETORNO 2 Respuestas a preguntas de selección múltiple 1. b 6. d 2. c 7. c 3. c 8. b 4. b 9. a 5. b 10. c Problemas de aplicación 1. 5 TºC ( )(Tº F 32) si 9 9T 5T 160 4T 160 TºC Tº F T T 40 TK 40 273.15 233.15 K TR 40 459.67 419.67 R 2. Tº P 500 100 4 TºC 100 0 Tº P 500 100 20 Tº F 212 32 9 Tº P 4TºC Tº P 4TºC 100 20 Tº P Tº F 9 Tº P 100 4TºC 9Tº P 900 20Tº F 640 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 20 (Tº F 32) 9 20Tº F 260 Tº P 9 Tº P 100 3. En primer lugar se debe calcular el área de transferencia y remplazar los valores en la ecuación para la tasa de transferencia de calor por conducción. A (3 m)(5 m) 15 m 2 Q. k t A 15 K T W 0.7( )(15 m 2 )( ) 1050 W x m.K 0.15 m 4. La forma de transmisión de calor es la de conducción por lo tanto se despeja el cambio de temperatura de la ecuación 23, correspondiente a la tasa de transferencia de calor para la conducción. A .R 2 .( 0.3 m ) 2 0.071 m 2 2 ( 600 W )( 0 . 0015 m) Q x T 0.062 K 0.062 º C W kt A 2 (204 ))(0.071 m ) m.K . Dado que la temperatura de la superficie exterior debe ser mayor que la de la superficie interior T Texterior Tint erior luego 𝑇𝑆𝑢𝑝𝑒𝑟𝑓𝑖𝑐𝑖𝑒 𝐸𝑥𝑡𝑒𝑟𝑖𝑜𝑟 = 102.06 º𝐶 5. Si el objeto se puede considerar como un cilindro, debe irradiar calor desde todas las caras, entonces se debe calcular el área correspondiente a la superficie total. A 2(R 2 ) (2R) L 2 ( 0.20 m 2 4 Q . A(Ts4 Talr ) 0.8(5.67 x10 8 ) 2 2 (0.20 m)(0.40 m) 0.565 m 2 W )(0.565 m 2 )[(600 K ) 4 (300 K ) 4 ] m2 K 4 Q . 3114 W INFORMACIÓN DE RETORNO 3 Respuestas a preguntas de selección múltiple 1. b 6. c 2. c 7. b 3. d 8. c Problemas de aplicación 1. W VIt (110 V )(5 60 s C )(5 min)( ) 165000 J s min 4. a 9. d 5. b 10. d UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 2. F .r (10 N )( W 2 .n. 2.54 cm 2 1 m )( ) 0.127 N .m 100 cm W. 2. .n. 2 (3000 giros)(0.127 N .m) 1 min ( ) t (1 min) 60 s W . 40 W 1 mol 3. nCO (280 g )( 28 g W nRT ln( ) 10 moles W (10 moles )(8.31 110 kPa J )(400 K ) ln( ) 53498 J mol.K 550 kPa W P(V2 V1 ) 4. V1 mgy t V2 W V1 P J )(330 273) K mol.K 0.050m 3 50 L 200000 Pa (2 mol)(8.31 V2 ( . 5. W V2 P ) nRT ln( 1 ) V1 P2 90 kJ 1000 L )( ) 50 L 500 L 200 kPa m3 m )(12 m) s2 2352 W 2.35 kW 10 s (200 kg)(9.8 INFORMACIÓN DE RETORNO 4 Respuestas a preguntas de selección múltiple 1. c 6. d 2. b 7. a 3. b 8. c 4. a 9. b 5. c 10. d Problemas de aplicación 1. V 0.40 m 3 400 L P 2000kPa x 1.0 La masa y el volumen del sistema permanecen constantes ya que se trata de un sistema cerrado de paredes rígidas. Por lo tanto el volumen específico debe mantenerse también constante. El volumen específico se determina mediante las UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA tablas de vapor saturado o software de propiedades termodinámicas del agua como “PROPAGUA” o “WASP for windows”. m3 v 0.0996 a la presión de 2000 𝑘𝑃𝑎 kg A la presión de 1500 𝑘𝑃𝑎, v g 0.1318, v f 0.001154 entonces 0.0996 0.001154 0.7535 0.1318 0.001154 0.40 m 3 V mvapor inicial 4.016 kg v m3 0.0996 kg mvapor final (0.7535)4.016 kg 3.03 kg x mvapor condensado 4.02 kg 3.03 kg 0.99 kg 2. A 150 kPa la temperatura de saturación es de 111.37 ºC, luego a 300 ºC el vapor se encuentra como vapor sobrecalentado y el volumen específico a las condiciones estas condiciones es de 1.7570 m3/kg, encontrado por medio del software PROPAGUA. a. Este volumen específico permanece constante, por lo tanto para determinar la temperatura y presión a las cuales se debe presentar el cambio de fase se busca en las tablas o con ayuda del software las condiciones de saturación para las cuales el volumen específico de vapor saturado sea de 1.7570 estas condiciones son: presión de 96.15 𝑘𝑃𝑎 y temperatura de 98.5 º𝐶. b. A 80 ºC la presión de saturación es de 47.4 𝑘𝑃𝑎. c. A las condiciones finales los volúmenes específicos del vapor y del líquido son respectivamente 3,4087 y 0,001029 m3/kg. Con estos datos se calcula la calidad del vapor x 1.7570 0.001029 0.5037 3.4087 0.001029 Lo cual significa que a 80 ºC hay aproximadamente la misma cantidad de vapor que de líquido. mvapor inicial mvapor final 0.180 m 3 0,102 kg m3 1.7570 kg (0.5037)0.102 kg 0.0514 kg mlíquido 0.102 kg 0.0514 kg 0.0506 kg 3. Utilizando la ecuación de gas ideal se calcula el volumen molar UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA V kPa.m 3 .400 K m3 kmol.K 0.6651 5.000 kPa kmol 8.314 RT P Para calcular el volumen utilizando la ecuación de estado se recurre al método de ensayo y error donde se busca el volumen molar para el cual la presión se aproxime a 5.000 kPa. Como los cálculos son repetitivos se recomienda utilizar una hoja electrónica de cálculo. Se comienza con el volumen molar encontrado por la ecuación de gas ideal y se disminuye o aumenta convenientemente hasta alcanzar la condición indicada. kPa.m 6 kPa.m 3 366 .400 K RT a kmol.K kmol 2 P 2 4517 kPa V b V m3 m3 2 (0.6651 0.0428) (0.6651 ) kmol kmol 8.314 𝑚3 Presión, 𝑘𝑃𝑎 Volumen molar, 𝑘𝑚𝑜𝑙 0,6651 4.517 0,5900 5.026 0,5910 5.018 0,5930 5.003 0,5932 5.002 0,5935 4.999,8 0,5934 5.000,5 𝑚3 En consecuencia el volumen molar del CO2 a 5 MPa y 400 K es de 0.5935 𝑘𝑔 . Por otra parte n 5kg( 1 kmol 44.0 kg ) 0.1136 kmol y con los datos anteriores se calculan lo volúmenes. m3 Vgas ideal (0.1136kmol) x0.6651( ) 0.0756 m 3 kmol m3 Vgas real (0.1136kmol) x0.5935( ) 0.0674 m 3 kmol Entre los dos datos se presenta una desviación de más del 12% lo cual justifica la utilización de las ecuaciones de gases reales. Sugerencia, calcule el volumen molar utilizando las otras ecuaciones de estado para gases reales y obtenga sus propias conclusiones. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 30kg 1.0356 kmol kg 28.97 kmol (500 kPa)(5 m 3 ) PV T 290.4 K nR kPa.m 3 (1.0356 kmol)(8.314 kmol.K 5 m3 m3 V 4.8281 1.0356 kmol kmol 4. n T (V b) a (P 2 ) R V kPa.m 6 m3 136 kmol (20000 kPa kmol 2 ) kPa.m 3 m3 2 8.314 (4.8281 ) kmol.K kmol (4.8281 0.0428) T 291.1 K En este caso no se justifica utilizar la ecuación de estado de van der Waals o cualquier otra ecuación de estado para gases reales ya que la desviación es menor del 1%. 5. A 363 K y 210 kPa tanto el oxígeno como el nitrógeno se pueden considerar como gases ideales ya que la temperatura es muy superior a las temperaturas críticas y la presión está muy por debajo de las presiones críticas. Por lo tanto el número de moles totales se puede calcular utilizando la ecuación de estado de gas ideal. si PO2 2PN 2 nO2 2n N 2 PV (210kPa)(0.050m 3 ) n 0.003478 kmol 3.478 moles RT kPa.m 3 363K 8.314 kmol.K n nO2 n N2 3.478 2n N2 n N2 3.478 3.478 1.159 moles 3 2(1.159 moles ) 2.319 moles nN2 nO2 g ) 74.20 g mol g (1.159 moles )(28.0 ) 32.45 g mol mO2 (2.319 moles )(32,0 mN2 INFORMACIÓN DE RETORNO 5 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Respuestas a preguntas de selección múltiple 1. d 6. a 2. b 7. c 3. a 8. b 4. b 9. c 5. c 10. b Problemas de aplicación W 50 kJ 1. Q ? U 40 kJ Q U W 40 kJ 50 kJ 10 kJ El signo positivo indica que se transfiere calor al sistema. 2. Q1 1200 kcal Q2 800 kcal La primera ley establece que Wciclo Qciclo Q1 Q2 (1200 800)kcal 400 kcal .. W (400 3. U ? kcal ciclos min kJ )(40 )(60 )(4.187 ) 1117 kW ciclo min uto s kcal W 1000 kJ H 1000 kcal Si la presión permanece constante entonces Q H El cambio de emergía interna se calcula a partir de la primera ley U Q W H W (1000 kcal) (1000 kJ )( 4. n 2.5 moles W (2.5 moles )(8.314 T cte 1 kcal 4.187 kJ W Q nRT ln( V2 ) V1 ) 761 kcal V2 2V1 1 kmol kJ )(380 K )( ) ln 2 5.48 kJ kmol.K 1000 moles 5. Como el proceso que se realiza es isobárico, la primera ley establece que el calor transferido es igual al cambio de entalpía. En las tablas de vapor o utilizando cualquier software sobre propiedades termodinámicas del agua se determina el valor de la entalpía inicial bajo la consideración de que la calidad del vapor inicial es igual a 1. Al ceder calor al medio ambiente, el vapor se condensa, hasta alcanzar un nuevo valor de entalpía, el cual se determina mediante el calor transferido. Con este valor y con las condiciones de saturación se encuentra la calidad al final del proceso. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Q H m(h2 h1 ) h2 (2716.4 h2 h1 Q m (2000 kJ ) kJ kJ ) 1716.4 kg 2.0 kg kg x h1 hg 2716.4 h f 535.4 kJ kg kJ kg 1716.4 535.4 0.54 2716.4 535.4 INFORMACIÓN DE RETORNO 6 Respuestas a preguntas de selección múltiple 1. b 6. c 2. d 7. b 3. a 8. c 4. d 9. b 5. b 10. b Problemas de aplicación 1. Si no hay intercambio de calor con el medio exterior se puede considerar que todo el calor transferido por la leche caliente es igual al ganado por la leche fría. Por otra parte, debido al contenido de grasa, el calor específico de la leche entera es diferente del calor específico de la leche descremada; estos valores se obtienen de la tabla de calores específicos para algunos alimentos. Ql .e Calor ganado por leche entera Ql .d Calor cedido por leche descremada Ql .e Ql .d ml .e c pl.e (t e t l .e ) ml .d c pl.d (t e t l .d ) te ml .d c pl.d t l .d ml .e c pl.e t l .e ml .d c pl.d ml .e c pl.e kcal kcal )(60º C ) 30kg(0.74 )(5º C ) kg.º C kg.º C 53.7 º C kcal kcal 170kg(0.95 ) 30kg(0.74 ) kg.º C kg.º C 170kg(0.95 te 2. Para calcular el calor necesario se debe primero calcular la cantidad de agua evaporada. msólidos 0.35(250 kg) 87.5 kg magua final 87.5kg(0,4) 58.3 kg 0.6 magua inicial 250 kg 87.5 kg 162.5 kg magua evaporada 162.5 kg 58.3 kg 104.2 kg 𝑘𝐽 A 75 𝑘𝑃𝑎, ℎ𝑔 = 2663 y ℎ𝑓 = 384 de tal manera que ℎ𝑓𝑔 = 2279 𝑘𝑔 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Luego Q mh fg (104.2kg)(2279 kJ ) 237472 kJ kg 3. Q maceite c p aceite (t 2 t1 ) (50kg)(0.40 kcal )(130º C 18º C ) 2240 kcal kg.º C Utilizando el software “propagua” se encuentran los valores de la entalpía inicial y de la entalpía final. Si se suponen despreciables las pérdidas de calor, el cambio de entalpía del vapor debe corresponder al calor necesario para elevar la temperatura del aceite. kJ kJ h 1039 kg kg Q 2.240kcal 4.187kJ mvapor ( )( ) 10.5 kg kJ h kcal 1039 kg 1mol 4. T1 293 K , P1 400 kPa , V2 30 L , n (70 g )( ) 2.5 moles 28 g kPa.m 3 (0.0025kmoles)(8.314 )(293K ) nRT1 kmol . K V1 0.0152 m 3 15.2 L P1 400kPa h1 2775 kJ kg h2 1736 Como el proceso es adiabático P1V1 P2V2 P2 P1V1 V2 cal mol.K 1.4 cal Cv 4.9 mol.K (400 kPa)(15.2 L)1.4 P2 154.4 kPa (30 L)1.4 Cp V P T2 2 2 nR 6.9 (0.030 m 3 )(154.4 kPa) kPa.m 3 (0.0025kmol) 8.314 kmol.K 223 K El trabajo en un proceso adiabático se puede calcular ya sea en función de las temperaturas, ecuación 130 o en función de presión y volumen. Ecuación 133. cal )(223K 293K ) mol.K 4.187 J ) 3590 J 1W2 857.5 cal 857,5 cal ( 1 cal W2 nC v (T2 T1 ) 2.5moles (4.9 1 o también 1W2 P2V2 P1V1 154.4kPa(0.030m 3 ) 400kPa(0.0152m 3 ) 1 1 1.4 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA W2 3.62 kJ 1 El signo positivo indica que el sistema realiza trabajo. 5. n 0.020 kmoles P1 50 kPa T1 300 K kPa.m 3 )(300 K ) kmol . K V1 0.998 m 3 50kPa 1.597 m 3 V ) 480 K V2 (1.60)(0.998 m 3 ) 1.597 m 3 T2 T1 2 300 K ( V1 0.998 m 3 (0.020kmol)(8.314 W2 P(V2 V1 ) 50kPa(1.597 0.998)m 3 29.9 kJ 1 kJ )(480 300) K 88.2 kJ kmol.K kJ H nC p (T2 T1 ) 0.02kmol(33.3 )(480 300) K 119.9 kJ kmol.K U nC v (T2 T1 ) 0.02kmol(24.5 INFORMACIÓN DE RETORNO 7 Respuestas a preguntas de selección múltiple 1. b 6. d 2. d 7. c 3. c 8. b 4. a 9. b 5. b 10. a Problemas de aplicación 1. a) H Ro 4H ofNO( g ) 6H ofH 2O( g ) 4H ofNH3( g ) La entalpía molar del oxígeno por tratarse de un elemento es igual a cero. Buscando los valores de los calores de formación en las tablas se obtiene: H Ro 4(21.60 kcal kcal kcal ) 6(57.80 ) 4(11.04 ) 214.8 kcal mol mol mol El signo negativo indica que la reacción es exotérmica. kcal kcal kcal kcal ) 2(22.06 ) 2(98.23 ) (193.91 ) mol mol mol mol H Ro 15.35 kcal . El signo positivo indica que la reacción es endotérmica o b) H R (330.90 o c) H R (235.80 kcal kcal kcal ) (151.90 ) (68.32 ) 15.58 kcal mol mol mol Reacción exotérmica UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA d) H Ro (270.3 kcal kcal kcal kcal ) (94.05 ) (57.80 ) 2(226.5 ) mol mol mol mol H Ro 30.85 Reacción endotérmica 2. a) Reacción de combustión del etano C2H6(g) + (7/2)O2(g) H f C2 H 6 2 H f CO2 3 H f H 2O H C C2 H 6 o o o o 2CO2(g) + 3H2O (g) H C C2 H 6 372.82 o kcal mol kcal kcal kcal ) 3(68.32 ) (372.82 ) mol mol mol kcal o H f C2 H 6 20.24 mol b) Reacción de combustión del eteno C2H4(g) + 3O2(g) 2CO2(g) + 2H2O (g) o o o o kcal o H f C2 H 4 2 H f CO2 2 H f H 2O H C C2 H 4 H C C2 H 4 337.23 mol kcal kcal kcal o H f C2 H 4 2(94.05 ) 2(68.32 ) (337.23 ) mol mol mol kcal o H f C2 H 6 12.49 mol c) Reacción de combustión del ácido oxálico H2C2O4(g) + ½O2(g) 2CO2(g) + H2O (g) o o o o kcal o H f H 2C2O4( s ) 2 H f CO2 H f H 2O H C H 2C2O4 H C C2 H 4 58.82 mol kcal kcal kcal o H f H 2C2O4( s ) 2(94.05 ) (68.32 ) 58.82 mol mol mol kcal o H f H 2C2O4( s ) 197.6 mol d) Reacción de combustión de la glucosa C6H12O6(g) + 6O2(g) 6CO2(g) + 6H2O (g) o o o o kcal o H f C6 H12O6 ( s ) 6 H f CO2 6 H f H 2O H C C6 H12O6 ( s ) H C C6 H12O6 ( s ) 673 mol kcal kcal kcal o H f C6 H12O6 ( s ) 6(94.05 ) 6(68.32 ) (673 ) mol mol mol kcal o H f H 2C2O4( s ) 301.2 mol H o f C2 H 6 2(94.05 3. a) Reacción CH3OH(l) + ½O2(g) HCHO(g) + H2O(l) H H H C HCHO( g ) kcal kcal kcal H Ro (173.65 ) (134.67 ) 38.98 mol mol mol o R b) Reacción C2H5OH(l) + O2(g) o C CH3OH ( l ) o CH3COOH(l) + H2O(l) o o C C2 H 5OH ( l ) C CH3COOH( l ) H H H kcal kcal kcal H Ro (326.70 ) (208.34 ) 118.36 mol mol mol o R UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA c) Reacción C2H4(g) + H2(g) C2H6(g) H H o R H Ro (337.23 o C C2 H 4 ( g ) H C H 2 ( g ) H C C2 H 6 ( g ) o o kcal kcal kcal kcal ) (68.32 ) (372.82 ) 32.73 mol mol mol mol d) Reacción C2H4(g) + H2O(l) C2H5OH(l) o o C C2 H 4 ( g ) C C2 H 5OH ( l ) H H H kcal kcal kcal H Ro (337.23 ) (326.70 ) 10.53 mol mol mol o R 𝑘𝑐𝑎𝑙 4. El calor de combustión del metano es −212.80 𝑚𝑜𝑙 , entonces la masa de de metano necesaria para producir 20000 𝑘𝑐𝑎𝑙 ℎ será igual a: kcal h (16 g ) 1504 g m kcal mol 212.80 mol 20000 5. Los calores de combustión del propano, etano y butano que aparecen en las tablas son 𝑘𝑐𝑎𝑙 respectivamente 530.60, 372.82 y 212.80 . Se calcula el número de moles y se 𝑚𝑜𝑙 determina las moles de cada gas, el calor producido será igual a la suma del calor aportado por cada gas. n (1 atm )(1000 L) 40.9 moles atm.L 0.082 (298 K ) mol.K n prop 0.25(40.9 moles ) 10.2 moles Q prop (10.2 moles )(530.60 kcal ) 5428.5 kcal mol net 0.15(40.9 moles ) 6.1 moles Qet (6.1 moles )(372.82 kcal ) 2288.5 kcal mol nmet 0.60(40.9 moles ) 24.6 moles Qmet (24.6 moles )(212.80 kcal ) 5525.1 kcal mol Q (5428.5 2288.5 5525.1)kcal 13242.1 kcal UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA INFORMACIÓN DE RETORNO 8 Respuestas a preguntas de selección múltiple 1. b 6. c 2. c 7. b 3. a 8. b 4. d 9. d 5. c 10. a Problemas de aplicación 1. n H 2O 180 kg 10 kmol kg 18 kmol n KOH Relación de disolución 112 kg 2 kmol kg 56 kmol n H 2O n KOH 10 kmol 2 kmol Para esta relación el calor de disolución es −11.600 Luego Q (11600 5 kmol 𝑘𝑐𝑎𝑙 𝑘𝑚𝑜𝑙 kcal )(2 kmol) 23200 kcal . El signo negativo significa calor kmol liberado o producido. 2. n H 2O 25.0 kg 1.39 kmol kg 18 kmol Relación de disolución n HCl n H 2O n KOH (25.0 kg)(0.36) 0.247 kmol kg 36.45 kmol 1.39 kmol 0.247 kmol 5.63 kmol 𝑘𝑐𝑎𝑙 Para esta relación el calor de disolución es −15200 𝑘𝑚𝑜𝑙 Luego Q (15200 kcal )(0.247 kmol) 3754 kcal kmol 3. El calor de reacción a volumen constaste representa el cambio en la energía interna, mientras que a presión constante es igual al cambio de entalpía. Entonces el problema se reduce a encontrar el cambio de entalpía en función del cambio de energía interna y el cambio en el número de moles. Ecuación química H2(g) + (1/2)O2(g) H2O(l) H U n(RT ) 67.45 kcal g 1000 mol kcal U ( )(2.0 )( ) 67450 2.0 g mol kmol kmol H (67450 kcal kcal kcal ) (0 (1 0.5))(1.987 )(298K ) 68338 kmol kmol.K mol UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 4. Si la reacción se realizara a condiciones normales de presión y temperatura, el calor liberado debe corresponder al producido durante la reacción. Ahora bien, como los productos de combustión salen a temperaturas más altas, parte del calor generado en la reacción se emplea en el calentamiento de los gases de combustión, el cambio de fase del agua y calentamiento del exceso de aire (oxígeno y nitrógeno). Entonces el calor liberado en este proceso corresponde al calor generado por la reacción menos el calor utilizado en aumentar la entalpía de los productos de combustión y el exceso de aire de 25 ºC hasta 900 ºC. Reacción de combustión a condiciones normales CH4(g) + 2O2(g) CO2(g) + 2H2O(l) Reacción balanceada considerando el exceso de aire utilizado y salida de gases a 900 ºC. CH4(g) + 4,8(O2(g) +3.76N2(g)) Sustancias H CO2(g) o f + 2H2O(g) + 2.8O2(g) + 18.0N2(g) o Metano -74873 Oxígeno 0 Gas carbónico -393522 Agua líquida -285830 Agua gaseosa -241826 Nitrógeno 0 Datos: entalpías en kJ/kmol o o H C H 298 H 900 -890303 ---------------- 10029 8659 9359 ----9904 8664 41388 27921 37421 ----31960 26907 Cambios de entalpía de los productos de combustión y aire en exceso o Coeficientes Sustancias H (kJ) (kmoles) Metano ---Oxígeno 2,8 53934 Gas carbónico 1 28062 Agua líquida (evaporación) 2 88008 Agua gaseosa 2 44112 Nitrógeno 18 328374 Cambio global de entalpía 542490 Calor liberado durante la combustión de un kmol de metano Calor utilizado para el cambio global de entalpía Calor liberado a medio exterior 890303 kJ 542490 kJ 347813 kJ 5. Para calcular la temperatura de llama adiabática se sigue la secuencia ilustrada en el ejemplo 37. Los datos iniciales son los mismos del problema anterior. Según primera ley para este sistema n ( H f H T H 298 ) P H f metano o P o o o UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Sustancias Calores de formación Gas carbónico Agua Oxígeno Nitrógeno n Coeficientes (kmol) -393522 -241826 - P H o o H 298 f 1.0 2.0 2.8 18.0 -393522 -483652 - 24 -877174 Sumatorias Calor de formación del metano 9359 9904 8659 8664 o P H 298 9359 19808 24245 155952 209364 -74873 Sumatoria entalpías de productos Entalpía molar si los gases fueran solo nitrógeno Temperatura inicial para ensayo y error Productos de o H 1360 combustión Gas carbónico 3039 Agua 51576 Oxígeno 44198 Nitrógeno 42260 Sumatorias Diferencias con respecto a entalpías de los productos n n o P 1011665 kJ 42507 kJ 1360 K o H 1360 H 1320 63039 103152 123754 760680 1050625 60735 49782 42755 40889 38960 n o P H 1320 60735.0 99564.0 119714.0 736002.0 1016015.0 o H 1315 60448 49559 42575 40718 n o P H 1315 60448.0 99118.0 119210.0 732924.0 1011700.0 4349.8 34.8 Como la diferencia entre las entalpías calculadas de los productos y la sumatoria de las entalpías a 1315 K se acerca a cero, se toma ésta como la temperatura máxima que alcanzaría el sistema bajo las condiciones propuestas. INFORMACIÓN DE RETORNO 9 Respuestas a preguntas de selección múltiple 1. b 6. b 2. d 7. d 3. c 8. a 4. a 9. c 5. c 10. b Problemas de aplicación 1. Primero se calcula la eficiencia de la máquina térmica ideal y con este valor se determina el trabajo realizado y el calor perdido. Tf 360 0.6 Tc 900 W Qc 0.6(5000 kJ ) 3000 kJ 1 1 Q f Qc W 5000 kJ 3000 kJ 2000 kJ UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 2. La temperatura de congelación del agua es 0 ºC y se asume que la temperatura ambiente es de 25 ºC entre estas dos temperaturas se determina el coeficiente de operación del refrigerador ideal. Con este valor se calcula la cantidad de calor retirada por unidad de tiempo. Por otro lado se determina la cantidad de calor que se debe retirar para transformar 5.0 kg de agua a 25 ºC en hielo a 0 ºC. Este proceso ocurre a presión constante. COP Tf Tc T f 273 K (298 273) K Q f (COP)Ws 10.92(2.0 10.92 kJ kJ ) 21.84 s s Q Qsencible Qlatente cal )(25º C ) 125000 cal g.º C cal Qlatente m(h fusión ) 5000 g (79.7 ) 398500 cal g Q 125000cal 398500cal 523500 cal Qsencible mc p t 5000 g (1.0 . Q 523500 cal 1kcal 4.187kJ t ( )( ) 100 s kJ 1000cal 1kcal Qf 21.84 s Qc 3. Ws 4. Primero se recomienda calcular las condiciones de P, V y T COPBC kJ h 36000( kJ )( 1h ) 10 kW 2.5 h 3600s 90000 Proceso 1-2 Compresión isotérmica P1 80k Pa, V1 T1 290 K kPa.m 3 )(290 K ) kmol.K 0.00753 m 3 7.53 L 80kPa P 80kPa T2 T1 290 K V2 V1 ( 1 ) (7.53L)( ) 6.02 L P2 100kPa (2.5 x10 4 kmol)(8.314 P2 100kPa, Proceso 2-3 Compresión adiabática T3 927º C 273 1200 K P3V3 P2V2 P y T3 T2 2 P3 ( 1 ) UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA ( ) 1, 4 T 1 290 11, 4 P3 P2 2 (100kPa) 14413 kPa 1200 T3 ( 1 ) 1 P 100kPa 1, 4 V3 V2 2 (6.02 L) 0.173 L 14.413kPa P3 Proceso 3-4 Expansión isotérmica V4 V3 P3 P4 y T4 1200 K T Proceso 4-1 Expansión adiabática P4 P1 1 T4 1 ( 1, 4 ( ) ) 290 11, 4 P4 80kPa 11530 kPa 1200 P V4 V3 3 P4 14413kPa (0.173L)( ) 0.216 L 11530kPa Cálculo del trabajo en cada proceso V2 kPa.m 3 6.02 L 4 (2.5 x10 kmol)(8.314 )(290 K ) ln 0,135 kJ 1W2 nRT1 ln kmol.K 7.53L V1 W3 2 P3V3 P2V2 (14413kPa)(0.173L) (100kPa)(6.02 L) 4728.6kJ 1 1 1.4 V4 kPa.m 3 0.216 L 4 W nRT ln ( 2 . 5 x 10 kmol )( 8 . 314 )(1200 K ) ln 1728 kJ 3 4 3 V kmol.K 0.108L 3 P1V1 P4V4 (80kPa)(7.53L) (11530kPa)(0.216 L) 4720.2 kJ 4W1 1 1 1.4 Observe que teóricamente el trabajo en los procesos adiabáticos debe ser igual y de signo contrario. 5. V P V2 ) y para un proceso isotérmico 2 1 , entonces V1 P2 V1 P P kJ S nR ln( 1 ) (2.5 x10 3 kmol)(8.314 ) ln( 1 ) 0.0144 kJ / K P2 kmol.K 0.5P1 J S 14.4 K S nR ln( 6. El cambio de entropía corresponde a la suma del cambio de entropía del hielo al fundirse y el cambio de entropía del agua al enfriarse. En primer lugar se debe calcular la temperatura final de equilibrio, lo cual se logra considerando que el sistema es UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA adiabático y por tanto el calor cedido por el agua debe ser igual al calor ganado por el hielo. Qagua maguac p (Tequilibrio Tagua) Qhielo mhielo h fusión Qhielo Qagua mhielo h fusión maguac p (Tequilibrio Tagua) Tequilibrio Tagua mhielo h fusión maguac p cal ) g Tequilibrio 70 º C 22.18 º C cal (250 g )(1.0 ) g.º C (150 g )(79.7 En este caso la temperatura de equilibrio es mayor de 0 ºC lo que significa que todo el hielo se funde y el agua procedente del hielo, magua-h, aumenta su temperatura hasta llegar al equilibrio lo que implica también un aumento de entropía. Por tanto: S S fusión hielo S agua_ h S agua S fusión hielo mhielo fundidoh fusión T fusión S agua_ h magua_ h c p ln( S agua maguac p ln( Tequilibrio Tagua_ h Tequilibrio Tagua S 49.73 (150 g )(79.7 273K ) (150 g )(1.0 ) (250 g )(1.0 cal ) g 49.73 cal K cal 295.18K cal ) ln( ) 11.72 g.K 273K K cal 295.18K cal ) ln( ) 37.43 g.K 343K K cal cal cal cal 11.72 37.43 24.02 K K K K 7. Cambio de entropía en una mezcla de gases S mezcla nRxi ln xi x N2 15 moles 20 moles 0.75 S (20 mol)(1.987 xO2 3 moles 20 moles 0.15 xCO2 2 moles 20 moles 0.10 cal cal )(0.75 ln 0.75 0.15 ln 0.15 0.10 ln 0.10) 29.0 mol.K K UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA V2 V y W nRT ln 2 W TS V1 V1 kJ W (400 K )(3.6 ) 1440 kJ K kPa.m 3 (0.2kmol)(8.314 (400 K ) kmol.K V1 1.11 m 3 600kPa 8. Para un proceso isotérmico S nR ln ( V2 V1e S ) nR ( (1.11 m )e 3.6 kJ / K ( 0.2 kmol )( 8.314kJ / kmol.k 3 ) 9.67 m 3 9. Problemas de este tipo se resuelven utilizando las tablas de propiedades termodinámicas del agua o programas de computador que ofrecen la misma información. En este caso se utiliza el software “Propagua” de la ya mencionada universidad de Córdoba España. El estado inicial corresponde a líquido saturado y el estado final a vapor saturado para los cuales se tienen los siguientes valores a 73 𝑘𝑃𝑎. h f 381.48 hg 2661.84 kJ kg s f 1.20486 kJ kg s f 7.46719 kJ kg.K kJ kg.K kJ 57009 kJ kg kJ kJ S m( s g s f ) (25 kg)(7.46719 1.20486) 156.4 kg.K K Q m(hg h f ) (25 kg)(2661.84 381.48) 10. A 150 ºC y 120 kPa el agua se encuentra como vapor sobrecalentado. El proceso de condensación se realiza a volumen constante. Para las condiciones iniciales se encuentran los siguientes valores h 2774.38 kJ kg s 7.5267 kJ kg.K v 1.6107 m3 kg El estado final, a la temperatura de 80 ºC corresponde a equilibrio líquido vapor donde la presión de saturación es de 47.4 kPa y los datos para líquido saturado y vapor saturado son los siguientes hg 2643.72 h f 334.9 kJ kg kJ kg kJ kg.K kJ s f 3.66155 kg.K s g 7.61317 v g 3.4087 m3 kg v f 0.0010292 m3 kg Como el volumen y la masa permanecen constantes entonces el volumen específico también se mantiene constante con lo cual se calcula la calidad del vapor: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA x v vf vg v f 1.6107 0.0010292 0.472 3.4087 0.0010292 Cálculo de las propiedades en el estado final: h h f xh fg 334.9 0.472(2643.72 334.9) 1420 kJ kg s s f xs fg 3.66155 0.472(7.6317 3.66155) 5.5355 Calor retirado Q mh (2.0 Kg )(2774.80 1420) kJ kg.K kJ 2709.6 kJ kg % de vapor condensado (1 0.472) *100 52.8% Cambio de entropía S ms (2.0 kg)(7.5267 5.5355) kJ kJ 3.9824 kg.K K INFORMACIÓN DE RETORNO 10 Respuestas a preguntas de selección múltiple 1. b 6. d 2. a 7. c 3. d 8. c 4. c 9. d 5. b 10. a Problemas de aplicación Para la solución de los problemas propuestos se utilizará el software PROGASES ya mencionado. En todas las tablas los datos en negrillas son utilizados como referencia para hallas las otras propiedades. 1. Para responder a las preguntas planteadas se deben conocer las propiedades termodinámicas del gas para cada estado. Estas se determinar de las condiciones iniciales y de los procesos sucesivos los resultados se muestran en la tabla siguiente: Estado 1 2 3 4 Presión, 𝑘𝑃𝑎 120.0 2559 6086 326.0 Temperatura, 𝐾 298.0 700.0 1.664.4 810.5 Energía interna 𝑘𝐽 𝑘𝑚𝑜𝑙 Entropía, 𝑘𝐽 𝑘𝑚𝑜𝑙.𝐾 6189.4 14911.7 39511.7 17483.6 U 3 U 2 Q 17236.2 24600 41836.2 Relación de compresión 196412 196412 218139 218139 kJ kmol 20.6472 9 2.2739 Volumen, 𝑚3 𝑘𝑚𝑜𝑙 20.6472 2.2739 2.2739 20.6472 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA 6086 50.7 120 (1 ) 1 9 (11, 4) 0.58 Eficiencia del ciclo 1 r Relación de presiones 2. Para determinar las propiedades de cada estado, las cuales se resumen en la tabla siguiente, es necesario primero calcular el número de moles y el calor suministrado por mol de aire: n q 4.3 kJ 2.85 x10 4 kmol V1 7.72 x10 3 m 3 2.85 x10 4 kmol V1 m3 27.1118 kmol 15087 kJ (en este valor aumenta la entalpía del estado 2) V 1 27.1118 m3 V2 3.0124 9 9 kmol Estado Presión, 𝑘𝑃𝑎 92 1.938 1.938 199 1 2 3 4 Eficiencia del ciclo Entalpía, Temperatura, 𝐾 𝑘𝐽 𝑘𝑚𝑜𝑙 300 702 1163 647 1 rc 1 𝑚3 𝑘𝑚𝑜𝑙 𝑘𝐽 𝑘𝑚𝑜𝑙.𝐾 8725.5 20797.5 35884.5 19093.7 1 (9 r 1 rc 1 Volumen, Entropía, 198.817 198.817 215.248 215.248 27.1118 3.0124 4.9909 27.1118 (11.4 ) )(1.661, 4 1) 0.54 1.4(1.66 1) 3. Se determinan las propiedades de cada estado a partir de las coediciones iniciales P2 12P1 12(80 kPa) 960 kPa Estado Presión, 𝑘𝑃𝑎 1 2 3 4 80 960 960 80 Temperatura, 𝐾 300 603.6 1250 663.0 Entalpía, 𝑘𝐽 𝑘𝑚𝑜𝑙 Volumen, Entropía, 𝑚3 𝑘𝑚𝑜𝑙 𝑘𝐽 𝑘𝑚𝑜𝑙.𝐾 8722.5 17752.9 38845.5 19582.1 199.979 199.979 223.542 223.542 31.1786 5.2279 10.8259 68.9076 Temperatura a la salida del compresor 603.6 K Temperatura a la salida de la turbina 663.0 K Intercambio de energía en cada uno de los procesos: Proceso 1a2 2a3 3a4 4a1 𝑘𝐽 𝑘𝐽 Tipo de proceso Trabajo, 𝑘𝑚𝑜𝑙 Calor, 𝑘𝑚𝑜𝑙 Compresión isentrópica -6447.6 0 Expansión isobárica 5374.1 21098.6 Expansión isentrópica 14245.0 0 Compresión isobárica -3018.3 -10856.6 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Trabajo en el compresor: −6447.6 𝑘𝐽 𝑘𝑚𝑜𝑙 𝑘𝐽 Trabajo realizado por la turbina 14245 𝑘𝑚𝑜𝑙 4. La potencia de la planta termoeléctrica se determina calculando el trabajo neto producido. Las propiedades termodinámicas del agua se hallan utilizando el software PROPAGUA. Estado Título, x 1 2 3 4 0 L V 0.90 Presión, 𝑏𝑎𝑟 Entalpía, Temperatura, ℃ 0.60 35 35 0.60 Entropía, 𝑘𝐽 𝑘𝑔 85.95 86.17 420 85.95 Volumen, 𝑑𝑚3 𝑘𝑔 𝑘𝐽 𝑘𝑔.𝐾 359.90 363.54 3270.0 2430.45 1.1455 1.1455 6.9113 6.9113 1.0333 1.0317 87.48 2466.0 Wciclo Qciclo (h3 h2 ) (h4 h1 ) (3270.0 363.54)(2430.45 359.90) kJ kg kJ kg kg kJ Potencia (25 )(835.9 ) 20898 kW s kg Wciclo 835.9 5. A partir de los datos que aparecen en las tablas se determinan las propiedades para el refrigerante 12 en cada estado. Estado Título, x Presión, 𝑘𝑃𝑎 1 2 3 4 1 V 0 0.3071 𝑘𝐽 𝑘𝐽 Temperatura, ℃ Entalpía, 𝑘𝑔 Entropía, 𝑘𝑔.𝐾 100 650 650 100 -30.0 38.76 25.0 -30.0 Calor retirado del espacio refrigerado = (174.5 59.6) 114.9 Calor cedido al ambiente = (59.6 207.4) 147.8 174.5 207.4 59.6 59.6 kJ kg kJ kg kJ kg kg kJ 6.43 kW Potencia calorífica espacio refrigerado = (0.056 )(114.9) s kg kg kJ 8.28 kW Potencia calorífica cedida al ambiente = (0.056 )(147.8) s kg Trabajo del compresor = (207.4 174.5) 32.9 0.7183 0.7183 0.2233 0.2478 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Potencia del compresor = (0.056 kg kJ )(32.9) 1.84 kW s kg Recuerde que el signo solo significa el sentido de la transferencia de calor de acuerdo con el convenio existente. INFORMACIÓN DE RETORNO 11 Respuestas a preguntas de selección múltiple 1. b 6. a 2. c 7. b 3. d 8. c 4. b 9. a 5. d 10. c Problemas de aplicación 1. Propiedades del agua: Estado Presión, 𝑘𝑃𝑎 𝑘𝐽 Temperatura, ℃ Entalpía, 𝑘𝑔 Entrada 1 Vapor saturado 180 Entrada 2 Agua líquida 180 Salida 180 Datos obtenidos del software PROPAGUA 117 15 85 2701.5 63.10 355.99 . kg s m1 h1 m2 h2 m3 h3 kJ kg kJ kg kJ m1 (2701.5 ) (1.5 )(63.10 ) (m1 1.5 )(355.99 ) kg s kg s kg . . m2 1.5 . . . Despejando se obtiene . m1 (1.5 kg kJ kg kJ )(355.99 ) (1.5 )(63.10 ) kg s kg s kg 0.187 kJ kJ s (2701.5 ) (355.99 ) kg kg 2. Dado que no hay mas información, es válido considerar despreciables la transferencia de calor, el cambio en la energía cinética, temperatura y presión entre los puntos de carga y descarga del fluido. En consecuencia el trabajo proporcionado por la bomba será igual al cambio en la energía potencial w e p g ( z 2 z1 ) o también: . W m. g ( z 2 z1 ) UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA kg.m 2 kJ J N .m s (1.5 )(1000 )1.0 1.0 s kJ J N W 4.37 kg m m g ( z 2 z1 ) s (9.8 2 )(20 (15))m s 3. En este caso el calor suministrado por unidad de tiempo es igual al cambio de entalpía de la corriente de agua. Q m (h2 h1 ) . Entalpías del agua líquida Estado 𝑘𝐽 Presión, 𝑘𝑃𝑎 Temperatura, ℃ Entalpía, 𝑘𝑔 Entrada 110 14 Salida 110 65 Datos obtenidos del software Propagua. m Q (h2 h1 ) (15.0 58.87 272.08 kJ ) s (272.08 58.87) kJ kg 0.070 kg s El problema también se resuelve calculando el cambio de entalpía en función del calor específico del agua líquida y el cambio de temperatura. 4. En este caso no se consideran los cambios de energía cinética ni de energía potencial, y como además, la turbina es adiabática no hay transferencia de calor por tanto: W m (h2 h1 ) Propiedades del agua: Estado Presión, 𝑘𝑃𝑎 Entrada Vapor sobrecalentado 10.000 Salida Vapor húmedo x = 0,90 75 Datos obtenidos del software Propagua. Entonces W m (h2 h1 ) (7.0 𝑘𝐽 Temperatura, ℃ Entalpía, 𝑘𝑔 400 167,8 3.100 2.559 kg kJ kJ )(2559 3100) 3787 s kg s 5. En este caso la ecuación de balance de energía establece que la entalpía del fluido en la línea de llenado es igual a la energía interna en el recipiente. Propiedades del oxígeno: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Presión, 𝑘𝑃𝑎 Estado Temperatura, 𝐾 Energía 𝑘𝐽 interna, 𝑘𝑚𝑜𝑙 Entalpía, Volumen 5866.3 8219.2 molar, 𝑘𝑚𝑜𝑙 11.7647 8219.2 11489.8 16.3529 Corriente de 200 283 entrada Estado final 200 393 Datos obtenidos del software Progases. 𝑘𝐽 𝑘𝑚𝑜𝑙 𝑚3 La temperatura final es de 393 𝐾 32 kg )( ) 0.39 kg 16.3529 m 1 kmol Masa de CO2 = (0.20 m 3 )( 1 kmol 3 INFORMACIÓN DE RETORNO 12 Respuestas a preguntas de selección múltiple 1. d 6. b 2. a 7. d 3. b 8. c 4. c 9. b 5. a 10. d Problemas de aplicación 1. Al aplicar la primera ley de la termodinámica se establece que: Q m h m c p (T2 T1 ) Q m c p (T2 T1 ) m 0.332 30 kW kJ (1.0045 )(383 293) K kg.K kg s 2. El calor requerido para elevar la temperatura del agua proviene de la condensación del vapor y se puede calcular mediante el cambio de entalpía entre el estado de vapor húmedo con una calidad de 60% y vapor seco a 150 ºC y la correspondiente presión de saturación. Utilizando el software “propagua” para estas condiciones se obtiene: h1 (150º C , x 1.0) 2745 kJ kg q h (1900 2745) h2 (150º C , x 0.6) 1900 kJ kg kJ kJ 845 kg kg El calor necesario para calentar el agua se calcula en función del cambio de temperatura: UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Q mcp(T2 T1 ) (250 kg)(4.187 Masa de vapor necesario m kJ )(70 15)º C 57571 kJ kg.º C 57571kJ 68.13 kg kJ 845 kg 3. La presión absoluta es igual a la presión atmosférica más la presión manométrica. La presión absoluta se calcula considerando que en el interior del autoclave el agua se encuentra en condiciones de saturación. Por lo tanto a 130 ºC corresponde una presión de saturación de 270.1 kPa. Pm (270.1 75.0) kPa 195.1 kPa Para determinar la temperatura a la presión manométrica de 225,0 kPa, primero se calcula la presión absoluta y con ese valor se determina la temperatura de saturación. Pab (225.0 75.0) kPa 300.0 kPa Según las propiedades termodinámicas de agua la temperatura de saturación a 300,0 kPa corresponde 133,5 ºC 4. La cantidad de agua condensada por kg de aire seco se calcula por la diferencia entre la humedad inicial y la humedad final y el calor retirado por el cambio de entalpía. Las condiciones iniciales y finales permiten conocer las propiedades del aire: Propiedades Condiciones iniciales Condiciones finales Temperatura, ºC 32 15 Presión, kPa 101.3 95 Humedad relativa, % 80 40 𝑘𝑔 𝑑𝑒 𝐴𝑔𝑢𝑎 Humedad absoluta, 𝑘𝑔 𝑑𝑒 𝐴.𝑆. 0.0243 0.0045 𝑘𝐽 Entalpía del aire, 𝑘𝑔 𝑑𝑒 𝐴.𝑆. 94.30 26.47 Datos obtenidos del programa “Carta psicrométrica” mH 2O 0.0045 0.0243 q (26.47 94.30) kg Agua kg A.S . 0.0198 kg Agua kg A.S . kJ kJ 67.83 kg A.S . kg A.S . Los signos indican que tanto el agua como el calor se retiran del aire. 5. Cálculo de la masa de agua evaporada UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Balance de masa para los sólidos kg kg kg (100.0 )(0.05) m j (0.30) m j h 16.7 h 0.30 h kg mH 2O (100.0 m j ) (100.0 16.7)kg 83.3 h 5 Si el aire se enfría adiabáticamente hasta saturarse, significa que la temperatura de bulbo húmedo se mantiene constante, cambiando la humedad y la temperatura de bulbo seco hasta que ésta se hace igual a la de bulbo húmedo. Con esta consideración se determinan las condiciones iniciales y finales del aire. Propiedades Condiciones iniciales Condiciones finales 50 20.8 Temperatura, ℃ 101.3 101.3 Presión, 𝑘𝑃𝑎 5 100 Humedad relativa, % 20.8 20.8 Temperatura de Bulbo húmedo, ℃ 𝑘𝑔 𝑑𝑒 𝐴𝑔𝑢𝑎 Humedad absoluta, 𝑘𝑔 𝑑𝑒 𝐴.𝑆. 0.0038 0.0155 Datos obtenidos del programa “Carta psicrométrica” Balance de agua en el aire: mas (0.0038 kg Agua kg A.S . 83.3 mas ) mH 2O mas (0.0155 h kg Agua h ) 7120 maire 7230 7120 kg A.S . h kg A.S . maire mas mas (0.0155 kg A.S . kg A.S . kg Agua (0.0155 0.0038) maire 7120 kg Agua kg Agua kg A.S . ) kg A.S . kg Agua 0.0155 h kg A.S . kg Aire Húmedo h UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA ANEXOS UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Tabla 7: Calores específicos para algunos productos alimenticios Producto alimenticio % Agua 𝑘𝑐𝑎𝑙 Calor específico, 𝑘𝑔.℃ Caldos --0,74 Sopa de repollo --0,90 Sopa de arveja --0,98 Sopa de papa 88 0,94 Pescado frito 60 0,72 Pescado fresco 80 0,86 Pescado seco salado 16-20 0,41-0,44 Mantequilla 14-15,5 0,49-0,51 Margarina 9-15 0,42-0,50 Aceite vegetal --0,35-0,45 Crema, 45-65% grasa 57-73 0,73-0,78 Leche entera 87,5 0,73-0,78 Leche descremada 91 0,95-0,96 Alcachofas 90 0,93 Zanahorias frescas 86-90 0,91-0,94 Pepino cohombro 97 0,98 Lentejas 12 0,44 Champiñones frescos 90 0,94 Champiñones secos 30 0,56 Cebollas 80-90 0,86-0,93 Arvejas secas 14 0,44 Papas 75 0,84 Espinacas 85-90 0,90-0,94 Manzanas 75-85 0,89-0,96 Ciruelas frescas 75-78 0,84 Ciruelas secas 28-35 0,53-0,59 Tocino 50 0,48 Carne magra de res 72 0,82 Carne grasa de res 51 0,69 Carne cocida 57 0,73 Huesos --0,40-0,60 Carne de cordero 90 0,93 Carne grasa de cerdo 39 0,62 Carne magra de cerdo 57 0,73 Embutidos 72 0,82 Pan 44-48.5 0,65-0,68 Cuajada 60-70 0,78 Harina 12-13,5 0,43-0,45 Clara de huevo 87 0,92 Yema de huevo 48 0,67 Fuente: The fundamentals of Food Engineering by STANLEY E. CHARM. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Tabla 8: Calores de formación y disolución de algunos compuestos Fuente: datos adaptados de Perry Biblioteca del Ingeniero Químico y Hougen, Watson, Ragatz Principios de los Proceso Químicos (Estado: s = sólido cristalino, sln = solución diluida, l = líquido, g = gas) Compuesto SALES DE SODIO Acetato de sodio Bromuro de sodio Carbonato de sodio Carbonato de sodio 10 H2O Bicarbonato de sodio Clorato de sodio Cloruro de sodio Fluoruro de sodio Fosfato trisódico Fosfato disódico Nitrato de sodio Nitrito de sodio Oxalato de sodio Sulfato de sodio Sulfato ácido de sodio Sulfito de sodio Bisulfito de sodio Sulfuro de sodio Yoduro de sodio SALES DE POTASIO Acetato de potasio Carbonato de potasio Clorato de potasio Cloruro de potasio Cromato de potasio Nitrato de potasio Sulfato de potasio Sulfito de potasio Tiosulfato de potasio Yoduro de potasio SALES DE CALCIO Carburo de calcio Carbonato de calcio Cloruro de calcio Cloruro de calcio 6 H2O Fosfato de calcio Nitrato de calcio Oxalato de calcio monohidrato Sulfato de calcio 𝑘𝑐𝑎𝑙 𝑘𝑐𝑎𝑙 Estado Hof, 𝑚𝑜𝑙 Moles de agua Hos, 𝑚𝑜𝑙 l CH3COONa NaBr Na2CO3 Na2CO3.10H20 NaHCO3 NaClO3 NaCl NaF Na3PO4 Na2HPO4 NaNO3 NaNO2 Na2C2O4 Na2S04 NaHSO4 Na2SO3 NaHSO3 Na2S NaI s s s s s s s s s s s s s s s s sln s s -169,8 -86,03 -270,3 -975,6 -226,5 -85,73 -98,23 -136,0 -460 -417,4 -101,54 -86,6 -314,3 --330,9 -269,2 -260,6 -206,6 -89,2 -68,84 400 400 1.000 1000 600 200 -4,32 -0,15 -5,6 +16,5 +4,0 +4,95 +0,93 +0,06 -13,9 -6,04 +5,11 +3,5 +3,8 -0,56 -1,4 -3,2 800 -15,16 -1,81 CH3COOK K2CO3 KClO3 KCl K2CrO4 KNO3 K2SO4 K2SO3 K2S2O3 KI s s s s s s s s sln s -173,2 -273,93 -93,50 -104,2 -330,49 -117,76 -342,6 -266,9 -274 -78,88 1.000 -3,68 -7,63 +9,96 +4,16 +4,49 +8,35 +5,68 -2,2 500 4,93 s s s s s s s s -15,0 -288,45 -190,0 -623,15 -986,2 -224,0 -399,1 -342,42 -19,82 +3,43 -4,51 -4,25 Fórmula CaC2 CaCO3 CaCl2 CaCl2.6H2O Ca3(PO4)2 Ca(NO3)2 CaC2O4.H2O CaSO4 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Calores de formación y disolución de algunos compuestos (Continuación) Compuesto SALES DE AMONIO Carbonato de amonio Bicarbonato de amonio Cloruro de amonio Nitrato de amonio Oxalato de amonio Sulfato de amonio Bisulfato de amonio SALES DE HIERRO Carbonato de hierro (II) Cloruro de hierro (II) Cloruro de hierro (III) Sulfato de hierro (II) Sulfato de hierro (II) SALES DE COBRE Acetato de cobre (II) Carbonato de cobre (II) Cloruro de cobre (II) Nitrato de de cobre (II) Sulfato de cobre (II) SALES DE MAGNESIO Carbonato de magnesio Cloruro de magnesio Sulfato de de magnesio SALES DE MANGANESO Carbonato de manganeso Cloruro de manganeso Sulfato de manganeso SALES DE PLOMO Acetato de plomo (II) Carbonato de plomo (II) Cloruro de plomo (II) Nitrato de de plomo (II) Sulfato de plomo (II) SALES DE CINC Acetato de cinc Carbonato de cinc Cloruro de cinc Sulfato de cinc Yoduro de cinc Fórmula Estado Hof, 𝑘𝑐𝑎𝑙 𝑚𝑜𝑙 (NH4)2CO3 (NH4)HCO3 NH4Cl NH4N03 (NH4)2C2O4 (NH4)2SO4 (NH4)HSO4 sln s s s s s s -225,11 -203,7 -75,38 -87,27 -268,72 -281,86 -244,83 FeCO3 FeCl2 FeCl3 FeSO4 Fe2(SO4)3 s s s s sln -178,7 -81,15 -96,8 -220,5 -653,62 Cu(CH3COO)2 CuCO3 CuCl2 Cu(NO3)2 CuSO4 s s s s s -213,2 142,2 -52,3 -73,4 -184,0 MgCO3 MgCl2 MgSO4 s s s MnCO3 MnCl2 MnSO4 Moles de agua Hos, 𝑘𝑐𝑎𝑙 𝑚𝑜𝑙 l 2100 800 +6,78 +3,62 +6,16 +8,12 +1,48 -0,76 200 -19,5 -31,1 -15,5 -2,7 en HCl(sln) 800 -6,3 -10,4 -17,51 -266 -153,4 -305,5 -37,06 -21,81 s s s -213,9 -115,3 -254,24 400 -16,7 -14,96 Pb(CH3COO)2 PbCO3 PbCl2 Pb(NO3)2 PbSO4 s s s s s -230,05 -167,3 -85,85 -107,35 -219,5 -2,1 +9,0 Zn(CH3COO)2 ZnCO3 ZnCl2 ZnSO4 ZnI2 s s s s s -258,1 -194,2 -99,40 -233,8 --49,98 -9,8 -17,08 -19,45 -13,19 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Calores de formación y disolución de algunos compuestos (Cont.) Compuesto BASES Amoniaco Amoniaco Hidróxido de amonio Hidróxido de sodio Hidróxido de potasio Hidróxido de magnesio Hidróxido de calcio Hidróxido de bario Hidróxido de Aluminio Hidróxido de hierro (II) Hidróxido de hierro (III) Hidróxido de manganeso (II) Hidróxido de cinc ÁCIDOS Ácido clorhídrico Ácido fosfórico Ácido nítrico Ácido sulfúrico Ácido acético Ácido oxálico nonohidrato ÓXIDOS Óxido de sodio Óxido de potasio Óxido de magnesio Óxido de calcio Óxido de bario Óxido de aluminio Óxido de hierro (II) Óxido de hierro (III) Óxido de manganeso (II) Óxido de manganeso (IV) Óxido de plomo (II) Óxido de cinc Monóxido de carbono Dióxido de carbono Óxido de nitrógeno (I) Óxido de nitrógeno (II) Óxido de nitrógeno (III) Óxido de nitrógeno (IV) Óxido de nitrógeno (V) Tetróxido de dinitrógeno Óxido de fósforo (V) Dióxido de azufre Trióxido de azufre AGUA Fórmula Estado Hof, 𝑘𝑐𝑎𝑙 𝑚𝑜𝑙 Moles de agua Hos, 𝑘𝑐𝑎𝑙 𝑚𝑜𝑙 l NH3 NH3 NH4OH NaOH KOH Mg(OH)2 Ca(OH)2 Ba(OH)2 Al(OH)3 Fe(OH)2 Fe(OH)3 Mn(OH)2 Zn(OH)2 l g 1.H2O s s s s s amorfo s s s s -16,06 -11,04 -87,64 -101,99 -101,78 -221,0 -235,8 -226,2 -304,2 -135,8 -197,0 -163,4 -153,5 -3,26 -8,28 -10,25 -13,22 -3,88 -12,38 HCl H3PO4 HNO3 H2SO4 CH3COOH H2C2O4.H2O g s l l l c -22,06 -306,2 -41,40 -193,91 -116,4 -340,9 400 -17,96 -3,1 -7,97 -22,99 -0,34 +8,70 Na2O K20 MgO CaO BaO Al2O3 FeO Fe2O3 MnO MnO2 PbO ZnO CO CO2 N2O NO N2O3 NO2 N2O5 N2O4 P205 SO2 S03 H2O H2O s s s s s s s s s s s s g g g g g g g g g g s l g -99,45 -86,2 -143,84 -151,9 -133,4 -399,09 -64,3 -196,5 -92,0 -232,1 -52,07 -83,17 -26,42 -94,05 +19,49 +21,60 +20,0 +8,01 +3,6 +2,31 -360,0 -70,96 -94,45 -68,32 -57,80 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Tabla 9: Calores de combustión de algunos compuestos orgánicos Fuente: datos adaptados de Perry Biblioteca del Ingeniero Químico y Hougen, Watson, Ragatz Principios de los Proceso Químicos (Estado: s = sólido, l = líquido, g = gas). Productos finales CO2(g), H2O(l) Compuesto ELEMENTOS Hidrógeno Carbono HIDROCARBUROS Metano Etano Eteno (etileno) Etino (acetileno) Propano Propeno (propileno) n-Butano 2-metilpropano (isobutano) n_Pentano n-Hexano Ciclohexano Benceno Metilbenceno (tolueno) n-Octano Naftaleno n-Decano ALCOHOLES, ÉTER Y FENOL Metanol Metanol Etanol Etanol Etilenglicol Propanol 2-propanol n-Butanol Glicerina n-Pentanol (alcohol amílico) Éter etílico Fenol Aldehídos, cetonas y ésteres Metanal (formaldehído) Etanal (acetaldehído) Propanona (acetona) Propanona (acetona) Acetato de metilo Acetato de etilo Acetato de etilo Acetato de amilo Fórmula Estado HoC, 𝑘𝑐𝑎𝑙 𝑚𝑜𝑙 H2 C g grafito -68,32 -94,05 CH4 C2H6 C2H4 C2H2 C3H8 C3H6 C4H10 C4H10 C5H12 C6H14 C6H12 C6H6 C7H8 C8H18 C10H8 C10H22 g g g g g g g g g l l l l l s l -212,8 -372,8 -337,2 -310,6 -530,6 -492,0 -688,0 -686,3 -845,2 -995,0 -936,9 -789,1 -934,5 -1.307,5 -1.231,6 -1.620,1 CH30H CH30H C2H5OH C2H5OH HOC2H4OH C3H7OH CH3CH(OH)CH3 C4H9OH CH2OH-CHOH-CH2OH C5H11OH C2H5OC2H5 C6H5OH g l g l l l l l l l l l -182,6 -173,6 -336,8 -326,7 -284,5 -483,6 -481,1 -638,2 -396,3 -786,7 -952,6 -731,5 HCHO CH3CHO CH3COCH3 CH3COCH3 CH3COOCH3 CH3COOC2H5 CH3COOC2H5 CH3COOC5H11 g g g l g g l l -134,7 -285,0 -435,3 -427,8 -397,5 -547,5 -538,8 -1.040 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Calores de combustión de algunos compuestos orgánicos (Continuación) Compuesto ÁCIDOS Metanoico (fórmico) Metanoico (fórmico) Etanoico (acético) Etanoico (acético) Láctico Cítrico Benzoico Palmítico Esteárico Oleico Anhídrido acético CARBOHIDRATOS d-Glucosa l-Fructosa Lactosa Sacarosa Almidón Celulosa Acetato de celulosa COMPUESTOS NITROGENADOS Productos finales N2(g) CO2(g), H2O(l) Urea Trimetilamina 1,3,5-Trinitrobenceno Nitrobenceno Anilina COMPUESTOS HALOGENADOS Productos finales CO2(g), HCl(sln), H2O(l) Cloruro de metilo Cloroformo Cloroformo Tetracloruro de carbono Tetracloruro de carbono Cloruro de etilo Cloruro de etileno Acido cloroacético COMPUESTOS CON AZUFRE Productos finales CO2(g), SO2(g), H2O(l) Sulfuro de carbonilo Sulfuro de carbono Sulfuro de carbono Sulfuro de dimetilo Sulfuro de dimetilo Metil mercaptano Etil mercaptano Fórmula Estado HoC, kcal/mol HCOOH HCOOH CH3COOH CH3COOH CH3CH(OH)COOH C6H8O7 C6H5COOH C15H31COOH C17H35COOH C17H37COOH CH3CO-O-OCCH3 g l g l s s s s s l l -75,7 -64,6 -219,8 208,34 -325,8 -474,3 -771,5 -2.379 -2.697 -2.668 -426,0 C6H12O6 C6H12O6 C12H22O11 C12H22O11 s s s s -673 -675 -1.350 -1.349 -4.177 -4.179 -4.495 NH2CONH2 N(CH3)3 C6H3(NO2)3 C6H5NO2 C6H5NH2 s l s l l -151 -578 -664 -739 -812 CH3Cl CHCl3 CHCl3 CCl4 CCl4 C2H5Cl C2H4Cl2 ClCH2COOH g g l g l g l s -182,1 -121,8 -114,3 -92,0 -84,2 -339,7 -296,8 -172,2 SCO CS2 CS2 S(CH3)2 S(CH3)2 CH3SH C2H5SH g g l g l g l -132,2 -263,5 -257,0 -457,1 -450,2 -298,7 -448,0 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Tabla 10: Propiedades termodinámicas del agua equilibrio líquido vapor Fuente: datos generados del software PROPAGUA de José Agüera Soriano Presión Absoluta bar Temperatur a de saturación ºC Entalpía específica hf hg 𝑘𝐽 𝑘𝐽 𝑘𝑔 𝑘𝑔 Entropía específica sf sg Volumen específico vf vg 𝑘𝐽 𝑘𝐽 𝑑𝑚3 𝑑𝑚3 𝑘𝑔.𝐾 𝑘𝑔.𝐾 𝑘𝑔 𝑘𝑔 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Propiedades termodinámicas del agua equilibrio líquido vapor (Continuación…) Presión Absoluta bar Temperatura de saturación ºC Entalpía específica hf hg 𝑘𝐽 𝑘𝐽 𝑘𝑔 𝑘𝑔 Entropía específica sf sg Volumen específico vf vg 𝑘𝐽 𝑘𝐽 𝑑𝑚3 𝑑𝑚3 𝑘𝑔.𝐾 𝑘𝑔.𝐾 𝑘𝑔 𝑘𝑔 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Propiedades termodinámicas del agua equilibrio líquido vapor (Continuación…) Presión Absoluta bar Temperatura de saturación ºC Entalpía específica hf hg 𝑘𝐽 𝑘𝐽 𝑘𝑔 𝑘𝑔 Entropía específica sf sg Volumen específico vf vg 𝑘𝐽 𝑘𝐽 𝑑𝑚3 𝑑𝑚3 𝑘𝑔.𝐾 𝑘𝑔.𝐾 𝑘𝑔 𝑘𝑔 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Propiedades termodinámicas del agua equilibrio líquido vapor (Continuación…) Presión Absoluta bar Temperatura de saturación Entalpía específica hf hg Entropía específica sf sg Volumen específico vf vg UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA ºC 𝑘𝐽 𝑘𝐽 𝑘𝐽 𝑘𝐽 𝑑𝑚3 𝑑𝑚3 𝑘𝑔 𝑘𝑔 𝑘𝑔.𝐾 𝑘𝑔.𝐾 𝑘𝑔 𝑘𝑔 Propiedades termodinámicas del agua equilibrio líquido vapor (Continuación…) Presión Temperatura Entalpía específica Entropía específica Volumen específico UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Absoluta bar de saturación ºC hf 𝑘𝐽 𝑘𝑔 hg sf 𝑘𝐽 𝑘𝐽 𝑘𝑔 𝑘𝑔.𝐾 sg vf 𝑘𝐽 𝑑𝑚3 𝑘𝑔.𝐾 𝑘𝑔 vg 𝑑𝑚3 𝑘𝑔 Propiedades termodinámicas del agua equilibrio líquido vapor (Continuación…) UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Presión Absoluta bar Temperatura de saturación ºC Entalpía específica hf hg 𝑘𝐽 𝑘𝐽 𝑘𝑔 𝑘𝑔 Entropía específica sf sg Volumen específico vf vg 𝑘𝐽 𝑘𝐽 𝑑𝑚3 𝑑𝑚3 𝑘𝑔.𝐾 𝑘𝑔.𝐾 𝑘𝑔 𝑘𝑔 Propiedades termodinámicas del agua equilibrio líquido vapor (Continuación…) UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Presión Absoluta bar Temperatura de saturación ºC Entalpía específica hf hg 𝑘𝐽 𝑘𝐽 𝑘𝑔 𝑘𝑔 Entropía específica sf sg Volumen específico vf vg 𝑘𝐽 𝑘𝐽 𝑑𝑚3 𝑑𝑚3 𝑘𝑔.𝐾 𝑘𝑔.𝐾 𝑘𝑔 𝑘𝑔 Tabla 11: Propiedades termodinámicas del agua vapor sobrecalentado Fuente: datos generados del software PROPAGUA de José Agüera Soriano UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Listado entre 0,02 y 190 bar y entre 0 y 800 ºC Tempe ratura t ºC Presión p = 0,02 bar Entalpía Entropía Volumen específica específica específico h s v 𝑘𝐽 𝑘𝐽 𝑑𝑚3 𝑘𝑔 𝑘𝑔. 𝐾 𝑘𝑔 Presión p = 0,24 bar Entalpía Entropía Volumen específica específica específico h s v 𝑘𝐽 𝑘𝐽 𝑑𝑚3 𝑘𝑔 𝑘𝑔. 𝐾 𝑘𝑔 Propiedades termodinámicas del agua vapor sobrecalentado UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA (Continuación…..) Tempe ratura t ºC Presión p = 0,46 bar Entalpía Entropía Volumen específic específica específico a s v 𝑘𝐽 h 𝑑𝑚3 𝑘𝐽 𝑘𝑔. 𝐾 𝑘𝑔 𝑘𝑔 Presión p = 0,95 bar Entalpía Entropía Volumen específica específica específico h s v 𝑘𝐽 𝑘𝐽 𝑑𝑚3 𝑘𝑔 𝑘𝑔. 𝐾 𝑘𝑔 Propiedades termodinámicas del agua vapor sobrecalentado UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA (Continuación…) Tempe -ratura t ºC Presión p = 2,00 bar Entalpía Entropía Volumen específic específic específico a a v h s 𝑑𝑚3 𝑘𝐽 𝑘𝐽 𝑘𝑔 𝑘𝑔 𝑘𝑔. 𝐾 Presión p = 3,10 bar Entalpía Entropía Volumen específica específic específico h a v 𝑘𝐽 s 𝑑𝑚3 𝑘𝐽 𝑘𝑔 𝑘𝑔 𝑘𝑔. 𝐾 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Propiedades termodinámicas del agua vapor sobrecalentado (Continuación…) Tempe -ratura t ºC Presión p = 4,40 bar Entalpía Entropía Volumen específica específica específico h s v 𝑘𝐽 𝑘𝐽 𝑑𝑚3 𝑘𝑔 𝑘𝑔. 𝐾 𝑘𝑔 Presión p = 6,60 bar Entalpía Entropía Volumen específica específica específico h s v 𝑘𝐽 𝑘𝐽 𝑑𝑚3 𝑘𝑔 𝑘𝑔. 𝐾 𝑘𝑔 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Propiedades termodinámicas del agua vapor sobrecalentado (Continuación…) Tempe -ratura t ºC Presión p = 8,80 bar Entalpía Entropía Volumen específic específica específico a s v 𝑘𝐽 h 𝑑𝑚3 𝑘𝐽 𝑘𝑔. 𝐾 𝑘𝑔 𝑘𝑔 Presión p = 12,50 bar Entalpía Entropía Volumen específic específica específico a s v 𝑘𝐽 h 𝑑𝑚3 𝑘𝐽 𝑘𝑔. 𝐾 𝑘𝑔 𝑘𝑔 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Propiedades termodinámicas del agua vapor sobrecalentado (Continuación…) Temperatura t ºC Presión p= 18,00 bar Entalpía Entropía Volumen específic específica específico a s v 𝑘𝐽 h 𝑑𝑚3 𝑘𝐽 𝑘𝑔. 𝐾 𝑘𝑔 𝑘𝑔 Presión p = 27,00 bar Entalpía Entropía Volumen específic específica específico a s v 𝑘𝐽 h 𝑑𝑚3 𝑘𝐽 𝑘𝑔. 𝐾 𝑘𝑔 𝑘𝑔 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Propiedades termodinámicas del agua vapor sobrecalentado (Continuación…) Tempe -ratura t ºC Presión p = 38,00 bar Entalpía Entropía Volumen específica específic específico h a v 𝑘𝐽 s 𝑑𝑚3 𝑘𝐽 𝑘𝑔 𝑘𝑔 𝑘𝑔. 𝐾 Presión p = 49,00 bar Entalpía Entropía Volumen específica específica específico h s v 𝑘𝐽 𝑘𝐽 𝑑𝑚3 𝑘𝑔 𝑘𝑔. 𝐾 𝑘𝑔 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Propiedades termodinámicas del agua vapor sobrecalentado (Continuación…) Tempe -ratura t ºC Presión p = 70,00 bar Entalpía Entropía Volumen específica específic específico h a v 𝑘𝐽 s 𝑑𝑚3 𝑘𝐽 𝑘𝑔 𝑘𝑔 𝑘𝑔. 𝐾 Presión p = 92,00 bar Entalpía Entropía Volumen específica específica específico h s v 𝑘𝐽 𝑘𝐽 𝑑𝑚3 𝑘𝑔 𝑘𝑔. 𝐾 𝑘𝑔 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Propiedades termodinámicas del agua vapor sobrecalentado (Continuación…) Temperatura t ºC Presión p = 135,0 bar Entalpía Entropía Volumen específica específica específico h s v 𝑘𝐽 𝑘𝐽 𝑑𝑚3 𝑘𝑔 𝑘𝑔. 𝐾 𝑘𝑔 Presión p = 190,0 bar Entalpía Entropía Volumen específica específica específico h s v 𝑘𝐽 𝑘𝐽 𝑑𝑚3 𝑘𝑔 𝑘𝑔. 𝐾 𝑘𝑔 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Tabla 12: Propiedades termodinámicas del vapor de agua saturado y seco. Tabla de temperatura (Unidades Inglesas) Fuente: Ayuso Martínez, Luis Evaristo (1995). Termodinámica. Bogotá: Unisur. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Tabla 13: Propiedades termodinámicas del vapor de agua saturado y seco. Tabla de presión (Unidades inglesas) Fuente: Ayuso Martínez, Luis Evaristo (1995). Termodinámica. Bogotá: Unisur. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Propiedades termodinámicas del vapor de agua saturado y seco. Tabla de presión (Unidades inglesas) (Continuación) Fuente: Ayuso Martínez, Luis Evaristo (1995). Termodinámica. Bogotá: Unisur. UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Tabla 14: Propiedades termodinámicas del agua líquida (Unidades inglesas) Fuente: Ayuso Martínez, Luis Evaristo (1995). Termodinámica. Bogotá: Unisur UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Tabla 15: Propiedades termodinámicas del oxígeno saturado Fuente: Ayuso Martínez, Luis Evaristo (1995). Termodinámica. Bogotá: Unisur Tabla 16: Propiedades termodinámicas del oxígeno sobrecalentado Fuente: Ayuso Martínez, Luis Evaristo (1995). Termodinámica. Bogotá: Unisur UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Tabla 17: Propiedades termodinámicas del nitrógeno saturado Fuente: Ayuso Martínez, Luis Evaristo (1995). Termodinámica. Bogotá: Unisur Tabla 18: Propiedades termodinámicas del nitrógeno sobrecalentado Fuente: Ayuso Martínez, Luis Evaristo (1995). Termodinámica. Bogotá: Unisur UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Tabla 19: Propiedades termodinámicas del amoniaco. Mezclas líquido vapor entre las temperaturas de -30 A 60 ºC Fuente: Datos obtenidos del software “Thermodynamic properties of refrigerants and refrigerants mixtures Versión 4.0 National Institute of Standard and Technology” T º𝐶 -30.00 -30.00 -25.00 -25.00 -20.00 -20.00 -15.00 -15.00 -10.00 -10.00 -5.00 -5.00 0.00 0.00 5.00 5.00 10.00 10.00 15.00 15.00 20.00 20.00 25.00 25.00 30.00 30.00 35.00 35.00 40.00 40.00 45.00 45.00 50.00 50.00 55.00 55.00 60.00 60.00 P 𝑘𝑃𝑎 119.5 119.5 151.5 151.5 190.1 190.1 236.2 236.2 290.8 290.8 354.8 354.8 429.4 429.4 515.7 515.7 615.0 615.0 728.4 728.4 857.3 857.3 1003 1003 1167 1167 1350 1350 1555 1555 1782 1782 2033 2033 2310 2310 2614 2614 Volumen (v) 𝑚3 𝑘𝑔 0.9635 0.1476E-02 0.7713 0.1490E-02 0.6235 0.1504E-02 0.5085 0.1519E-02 0.4182 0.1534E-02 0.3466 0.1550E-02 0.2893 0.1566E-02 0.2431 0.1583E-02 0.2055 0.1600E-02 0.1747 0.1619E-02 0.1493 0.1638E-02 0.1281 0.1658E-02 0.1105 0.1680E-02 0.9567E-01 0.1702E-02 0.8313E-01 0.1725E-02 0.7247E-01 0.1750E-02 0.6336E-01 0.1777E-02 0.5554E-01 0.1804E-02 0.4880E-01 0.1834E-02 Densidad 𝑘𝑔 𝑚3 1.038 677.5 1.297 671.2 1.604 664.9 1.967 658.5 2.391 652.0 2.885 645.3 3.457 638.6 4.114 631.8 4.867 624.8 5.725 617.7 6.700 610.4 7.804 603.0 9.050 595.4 10.45 587.6 12.03 579.6 13.80 571.3 15.78 562.9 18.00 554.2 20.49 545.2 Entropía 𝑘𝐽 𝑘𝑔. 𝐾 5.778 0.1856 5.695 0.2763 5.615 0.3657 5.540 0.4538 5.467 0.5408 5.398 0.6266 5.331 0.7114 5.267 0.7951 5.204 0.8779 5.144 0.9598 5.086 1.041 5.029 1.121 4.974 1.200 4.919 1.279 4.866 1.357 4.813 1.435 4.761 1.512 4.709 1.589 4.658 1.665 Entalpía 𝑘𝐽 𝑘𝑔 1404.0 44.3 1411.1 66.6 1418.0 89.0 1424.6 111.7 1430.8 134.4 1436.7 157.3 1442.2 180.4 1447.3 203.6 1452.0 227.0 1456.3 250.5 1460.1 274.3 1463.5 298.2 1466.3 322.4 1468.5 346.8 1470.2 371.4 1471.2 396.3 1471.5 421.5 1471.0 446.9 1469.7 472.8 Cp Fase 𝑘𝐽 𝑘𝑔. 𝐾 2.268 V 4.447 L 2.321 V 4.474 L 2.379 V 4.501 L 2.442 V 4.528 L 2.510 V 4.556 L 2.582 V 4.586 L 2.660 V 4.617 L 2.743 V 4.649 L 2.831 V 4.683 L 2.926 V 4.720 L 3.027 V 4.758 L 3.135 V 4.799 L 3.252 V 4.843 L 3.378 V 4.891 L 3.515 V 4.943 L 3.666 V 5.001 L 3.831 V 5.066 L 4.015 V 5.140 L 4.220 V 5.225 L UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Tabla 20: Propiedades termodinámicas del amoniaco. Mezclas líquido vapor entre las presiones de 100 A 2.700 kPa Fuente: Datos obtenidos del software “Thermodynamic properties of refrigerants and refrigerants mixtures Versión 4.0 National Institute of Standard and Technology” T º𝐶 P 𝑘𝑃𝑎 100.0 100.0 300.0 300.0 500.0 500.0 700.0 700.0 900.0 900.0 1100. 1100. 1300. 1300. 1500 1500 1700 1700 1900 1900 2100 2100 2300 2300 2500 2500 2700 2700 -33.60 -33.60 -9.23 -9.23 4.14 4.14 13.81 13.81 21.53 21.53 28.03 28.03 33.68 33.68 38.71 38.71 43.25 43.25 47.41 47.41 51.25 51.25 54.83 54.83 58.17 58.17 61.33 61.33 Volumen (v) 𝑚3 𝑘𝑔 1.138 0.1466E-02 0.4061 0.1536E-02 0.2503 0.1580E-02 0.1815 0.1614E-02 0.1424 0.1644E-02 0.1171 0.1671E-02 0.9934E-01 0.1696E-02 0.8617E-01 0.1719E-02 0.7600E-01 0.1741E-02 0.6790E-01 0.1763E-02 0.6129E-01 0.1783E-02 0.5580E-01 0.1803E-02 0.5115E-01 0.1823E-02 0.4716E-01 0.1842E-02 Densidad 𝑘𝑔 𝑚3 0.8787 682.0 2.463 650.9 3.995 633.0 5.510 619.4 7.023 608.2 8.541 598.4 10.07 589.6 11.60 581.6 13.16 574.2 14.73 567.3 16.31 560.7 17.92 554.5 19.55 548.5 21.20 542.8 Entropía 𝑘𝐽 𝑘𝑔. 𝐾 5.840 0.1195 5.456 0.5541 5.278 0.7808 5.159 0.9403 5.068 1.065 4.995 1.169 4.934 1.259 4.880 1.337 4.832 1.408 4.788 1.472 4.748 1.531 4.711 1.586 4.676 1.637 4.644 1.685 Entalpía 𝑘𝐽 𝑘𝑔 1398.6 28.3 1431.7 137.9 1446.4 199.6 1455.3 244.9 1461.2 281.6 1465.2 312.9 1468.0 340.3 1469.8 365.0 1470.9 387.6 1471.4 408.4 1471.4 427.8 1471.0 446.1 1470.3 463.3 1469.2 479.7 Cp 𝑘𝐽 𝑘𝑔. 𝐾 2.232 4.429 2.521 4.561 2.728 4.643 2.902 4.711 3.059 4.770 3.205 4.825 3.344 4.878 3.479 4.929 3.612 4.980 3.744 5.031 3.875 5.083 4.008 5.137 4.142 5.192 4.279 5.250 Fase V L V L V L V L V L V L V L V L V L V L V L V L V L V L UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Tabla 21: Propiedades termodinámicas del aire, estado de gas ideal Presión p = 101,325 kPa Peso molecular M = 28,964 kg/kmol Fuente: datos generados del software PROGASES de José Agüera Soriano Temperatura º𝐶 𝑘𝐽 Capacidad calorífica molar, 𝑘𝑚𝑜𝑙.𝐾 a volumen a presión constante constante Energía interna 𝑘𝐽 𝑘𝑚𝑜𝑙 Entalpía 𝑘𝐽 𝑘𝑚𝑜𝑙 Entropía 𝑘𝐽 𝑘𝑚𝑜𝑙 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Propiedades termodinámicas del aire, estado de gas ideal (Continuación….) Presión p = 101,325 kPa Temperatura º𝐶 Capacidad calorífica molar, 𝑘𝐽 𝑘𝑚𝑜𝑙.𝐾 Peso molecular M = 28,964 kg/kmol Energía interna 𝑘𝐽 𝑘𝑚𝑜𝑙 Entalpía 𝑘𝐽 𝑘𝑚𝑜𝑙 Entropía 𝑘𝐽 𝑘𝑚𝑜𝑙 Temperatura º𝐶 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Tabla 22: Calores específicos de algunos gases a temperaturas de 300 K UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA Gas Aire Argón Butano Dióxido de carbono Monóxido de carbono Etano Etileno Helio Hidrógeno Metano Neón Nitrógeno Octano Oxígeno Propano Vapor de agua Calor específico a presión constante 𝑘𝐽 cp ( ) Calor específico a volumen constante 𝑘𝐽 cv ( ) Relación 𝑘𝑔.𝐾 cv Ar C4H10 Constante R de gas ideal 𝑘𝐽 𝑘𝑔. 𝐾 0,2870 0,2081 0,1433 1,005 0,5203 1,7164 0,7180 0,3122 1,5734 1,400 1,667 1,091 CO2 0,1889 0,846 0,657 1,289 CO 0,2968 1,040 0,744 1,400 C2H6 C2H4 He H2 CH4 Ne N2 C8H18 O2 C3H8 0,2765 0,2964 2,0769 4,1240 0,5182 0,4119 0,2968 0,0729 0,2598 0,1885 1,7662 1,5482 5,1926 14,307 2,2537 1,0299 1,039 1,7113 0,918 1,6794 1,4897 1,2518 3,1156 10,183 1,7354 0,6179 0,743 1,6385 0,658 1,4909 1,186 1,237 1,667 1,405 1,299 1,667 1,400 1,044 1,395 1,126 H2O 0,4615 1,8723 1,4108 1,327 Fórmula 𝑘𝑔.𝐾 cp Fuente: Fundamentals of Calssical Thermodinamics Gordon J. Van Wylen y Richard E. Sonntag Tabla 23: Capacidades caloríficas molares a presión constante de algunos gases en función de la temperatura UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA – UNAD ESCUELA DE CIENCIAS BÁSICAS, TECNOLOGÍA E INGENIERÍA CONTENIDO DIDÁCTICO DEL CURSO: 201015 – TERMODINÁMICA C p a bT cT 2 dT 3 , C p Gas Aire Dióxido de azufre Trióxido de azufre Butano Dióxido de carbono Monóxido de carbono Etano Etileno Hidrógeno Metano Nitrógeno Oxido nitroso Oxígeno Propano Vapor de agua en kJ /( kmol.K ) T en K a b x 10 28,11 0,1967 0,4802 -1,966 Rango de temperatura K 273-1.800 SO2 25,78 5,795 -3,812 8,612 273-1.800 SO3 16,40 14,58 -11,20 32,42 273-1.300 C4H10 3,96 37,15 -18,34 35,00 273-1.500 CO2 22,26 5,981 -3,501 7,469 273-1.800 CO 28,16 0,1675 0,5372 -2,222 273-1.800 C2H6 C2H4 H2 CH4 N2 N2O O2 C3H8 6,900 3,95 29,11 19,89 28,90 24,11 25,48 -4,04 17,27 15,64 -0,1916 5,024 -0,1571 5,8632 1,520 30,48 -6,406 -8,344 0,4003 1,269 0,8081 -3,562 -0,7155 -15,72 7,285 17,67 -0,8704 -11,01 -2,873 10,58 1,312 31,74 273-1.500 273-1.500 273-1.800 273-1.500 273-1.800 273-1.500 273-1.800 273-1.500 H2O 32,24 0,1923 1,055 -3,595 273-1.800 Fórmula 2 c x 10 5 d x 10 9 Fuente: Datos adaptados de los presentados en Termodinámica de Yunus A. Çengel y Michael A. Boles