1 LABORATORIO Nº 1 Hidratos de Carbono OBJETIVO * Estudiar
Anuncio

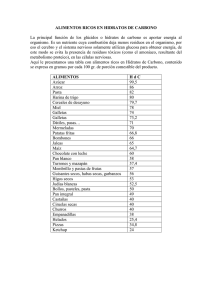
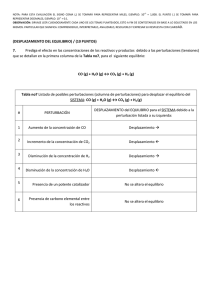
Laboratorio Nº 1 Hidratos De Carbono Universidad Nacional del Nordeste Licenciatura en Ciencias Biológicas LABORATORIO Nº 1 Hidratos de Carbono OBJETIVO * Estudiar los colores característicos y los precipitados que se forman cuando se trata a los azúcares con diferentes reactivos. Para ello se realizarán las reacciones señaladas en la "marcha esquemática" para la identificación de hidratos de carbono. INTRODUCCIÓN TEÓRICA Los hidratos de carbono son sustancias orgánicas que contienen grupos aldehídos o cetónicos potenciales (que en su estado libre poseen un intenso poder reductor) y numerosos grupos alcohólicos secundarios y primarios. A causa de la similitud de sus estructuras y reacciones, resulta difícil identificarlos y determinarlos. Los ensayos que se llevan a cabo con los hidratos de carbono son de tres tipos: 1. Estudio de las propiedades ópticas y de las formas de los cristales aislados de las soluciones en que se encuentran, o estudio de los cristales de ciertos derivados. 2. Estudio de la fermentación por acción de levaduras, hongos o bacterias. 3. Estudio de los colores característicos y de los precipitados que se forman cuando se los trata con: • Iodo • Fenoles o aminas aromáticas • Soluciones alcalinas o débilmente ácidas de iones metálicos pesados. • H3PO4 85 %. En el Trabajo Práctico se realizarán reacciones de caracterización de hidratos de carbono correspondientes al grupo 3. a) Reacción con yodo: Es una reacción que se utiliza para determinar la presencia de polisacáridos. Se basa en la formación de un complejo coloreado entre el I2 y el polisacárido. El color de ese complejo depende del polisacárido presente. Almidón: Amilosa: azul Amilopectina: rojo-violáceo (si están presentes los dos componentes predomina el azul). Glucógeno: rojo-violáceo. Dextrinas: rojo-violáceo. b) Reacción con fenoles y aminas aromáticas: Los hidratos de carbono en presencia de ácidos fuertes no oxidantes (HCl, H2SO4) y en caliente, son deshidratados produciendo furfural y derivados furfúricos. HO Hexosas Química Biológica HC O HC OH HC CH HC OH HC OH CH2OH CH C HOH2C + 3 H2O C O C H O Hidroximetil-furfural 1 Laboratorio Nº 1 Hidratos De Carbono Universidad Nacional del Nordeste Licenciatura en Ciencias Biológicas HC O HC OH HC OH HC OH HC CH HC + 3 H2O C O CH2OH Pentosas C H O Hidroximetil-furfural Estos compuestos se condensan con aminas aromáticas (bencidina) y con fenoles (resorcinol, orcinol, α-naftol) dando origen a derivados coloreados. OH H2N CH3 OH NH2 OH HO Bencidina Resorcinol OH Orcinol α-naftol Las reacciones de este tipo que se realizarán en el Trabajo Práctico son las de Molish y Seliwanoff. c) Reacciones con iones metálicos: Los azúcares que poseen en su molécula un grupo carbonilo libre o potencialmente libre tienen la propiedad, en medio alcalino o débilmente ácido, de reducir los iones Cu2+ y Ag+ a Cu+ y Ag0, respectivamente. Se basan en este principio las reacciones de Fehling y Barfoed, que se realizarán en el Trabajo Práctico. d) Reacciones con ácido fosfórico al 85 %: Es una reacción específica para fructosa. En presencia de dicho azúcar se produce una coloración amarilla. e) Formación de osazonas: Cuando se calienta un hidrato de carbono con función aldehídica o cetónica libre con acetato de fenilhidracina, se produce una condensación que se traduce, en muchos casos, en la formación de un precipitado cristalino de sustancias llamadas osazonas. Fenilhidracina HC O HC OH R H2N NH HC N NH C N NH R Las osazonas tienen estructuras cristalinas características y también puntos de fusión y tiempos de precipitación, que sirven para la identificación de azúcares. Cuando los azúcares difieren sólo en los carbonos 1 y 2, la formación de la osazona no permite diferenciarlos por la forma de los cristales pues todos ellos darán la misma osazona. Química Biológica 2 Laboratorio Nº 1 Hidratos De Carbono Química Biológica Universidad Nacional del Nordeste Licenciatura en Ciencias Biológicas 3 Laboratorio Nº 1 Hidratos De Carbono Universidad Nacional del Nordeste Licenciatura en Ciencias Biológicas ACTIVIDADES 1) Reacción de Molish: Objetivo: Detectar la presencia de hidratos de carbono. Reactivos: - H2SO4 concentrado - α-naftol al 5 % en alcohol etílico 95 % REACTIVOS Bl. 1 2 Sol. Glucosa 1 % 0,5 mL Sol. Proteica 0,5 mL H2O 2,5 mL 2,0 mL 2,0 mL 0,5 mL 0,5 mL 0,5 mL α-naftol Agitar, inclinar el tubo y agregar por las paredes: H2SO4 (c) 2,0 mL 2,0 mL 2,0 mL Resultado positivo: En presencia de hidratos de carbono se observará un anillo de color rosado violáceo en la interfase de los dos líquidos, al cabo de unos segundos. 2) Reacción con Iodo: Objetivo: Detectar presencia de polisacáridos. Reactivos: Solución de yodo 0,01 M en KI 0,1 M REACTIVOS Bl. 1 2 Sol. Almidón 1 % 3 gotas Sol. Glucosa 1 % 3 gotas H2O 2,0 mL 2,0 mL 2,0 mL Sol. de Yodo 2 gotas 2 gotas 2 gotas Agitar bien los tubos Resultado positivo: En presencia de almidón: color azul intenso. En presencia de glucógeno o dextrinas: rojo violáceo. 3) Reacción de Fehling: Objetivo: Detectar la presencia de azúcares reductores. Reactivos: - Solución I: CuSO4 al 7,5 % - Solución II: NaOH 25 g - Tartrato doble de Na y K 35 g - H2O c.s.p. 100 mL En el momento de usar mezclar partes iguales de I y II y diluir al 20 % en agua destilada. Se han intentado varias explicaciones del comportamiento químico del reactivo de Fehling, entre ellas la siguiente: CuSO4 + 2 NaOH Química Biológica → Cu(OH)2 + Na2SO4 4 Laboratorio Nº 1 Hidratos De Carbono Universidad Nacional del Nordeste Licenciatura en Ciencias Biológicas El Cu(OH)2 es prácticamente insoluble pero en presencia del ión tartrato se forma un quelato complejo (entre el Cu2+ y el tartrato ) que disminuye la concentración del ión cúprico por debajo de la necesaria para la precipitación del hidróxido cúprico. En presencia de aldehídos el cobre se reduce al estado cuproso, estado en el cual no forma un complejo estable con el ión tartrato y precipita como óxido cuproso color pardo rojizo. REACTIVOS Bl. 1 2 Sol. glucosa 1 % 0,5 mL Sol. sacarosa 1 % 0,5 mL H2O 1 mL 0,5 mL 0,5 mL Reactivo de Fehling 2 mL 2 mL 2 mL Agitar, colocar en un baño de agua hirviente durante unos 10 minutos y dejar enfriar. Resultado positivo: En presencia de azúcar reductor se observa un precipitado pardo rojizo. 4) Reacción de Barfoed: Objetivo: Diferenciación entre monosacáridos y disacáridos. Reactivos: - Acetato de cobre cristalizado 90 g - Ácido acético glacial 6 mL - H2O destilada c.s.p. 1000 mL Nota: se debe filtrar la solución antes de usar. Tiempo = 0 es el momento en que se introducen los tubos en el baño. REACTIVOS Bl. 1 2 Sol. Glucosa 1 % 0,5 mL Sol. Lactosa 1 % 0,5 mL H2O 1 mL 0,5 mL 0,5 mL Reactivo de Barfoed 2 mL 2 mL 2 mL Agitar, colocar en un baño de agua hirviente y anotar el tiempo en que aparece el precipitado. Resultado positivo: Aparición del precipitado en 5 - 7 minutos: monosacárido; más de 7 minutos: disacárido. 5) Reacción de Seliwanof: Objetivo: Diferenciación entre aldosas y cetosas. Reactivos: - Resorcinol 0,05 g - HCl concentrado 100 mL REACTIVOS Bl. 1 2 Sol. Fructosa 1 % 3 gotas Sol. Glucosa 1 % 3 gotas H2O 3 gotas React. de Seliwanoff 1,5 mL 1,5 mL 1,5 mL Agitar, calentar en un baño de agua hirviente. Resultado positivo: Cetosa: color rojo intenso. Química Biológica 5 Laboratorio Nº 1 Hidratos De Carbono Universidad Nacional del Nordeste Licenciatura en Ciencias Biológicas 6) Reacción con Ácido Fosfórico 85 %: Objetivo: Identificación de fructosa. Reactivos: H3PO4 85 % REACTIVOS Sol. Fructosa 1 % Sol. Glucosa 1 % H2O H3PO4 85 % Bl. 2 gotas 1,0 mL 1 2 gotas 1,0 mL 2 2 gotas 1,0 mL Agitar, calentar en un baño de agua hirviente durante un minuto y observar el color inmediatamente. Resultado positivo: color amarillo: fructosa. CUESTIONARIO 1. ¿A qué se denomina hidrato de carbono? 2. ¿Cuál o cuáles son los grupos funcionales de los hidratos de carbono? 3. Explique brevemente cuál es la diferencia entre un azúcar reductor y un azúcar no reductor. 4. Esquematice las reacciones que hará en el presente práctico, indicando cuál es el fin de cada una de ellas. BIBLIOGRAFÍA Morrison, Boyd. Química Orgánica. Fondo Educativo Interamericano. S.A. México. 1996. Fox, Mary. Química Orgánica. Segunda edición. Addison Wesley. México. 2000. Blanco, A. Química biológica. Séptima edición. Editorial El Ateneo. Química Biológica 6