Rilvipirina (pdf 99 kb)
Anuncio

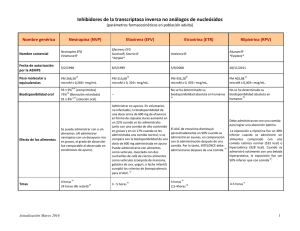
RILPIVIRINA Informe de la Comisión de Farmacia y Terapéutica Tratamiento de la infección por el virus de la inmunodeficiencia humana de tipo 1 (VIH-1) HOSPITAL REINA SOFÍA CÓRDOBA 1.- Identificación del fármaco: ® Nombre Comercial: Edurant Presentaciones: E/30 comprimidos 25mg Laboratorio: Janssen Cilag SA Precio adquisición: PVL – 7,5% + 4% IVA = 229,47 €. Precio unidad: 7,64 € Grupo Terapéutico: Denominación: Antivirales para uso sistémico, ITINAN (inhibidor de la transcriptasa inversa no análogo de nucleósidos). Código ATC: J05AG05 Vía de administración: oral. 2.- Solicitud: Dr. Antonio Rivero .E. Infecciosas. Fecha solicitud: 18 febrero 2013 3.- Justificación y Resumen del informe: 3.1 Resumen de las ventajas aportadas por el solicitante en la GINF: • Perfil de tolerabilidad favorable de rilpivirina comparado con el gold standard EFV, especialmente en las cuatro primeras semanas. i • Su dosificación una vez al día y la baja carga de comprimidos son ventajas que podrían facilitar el cumplimiento del tratamiento al paciente. • Mejor perfil de tolerabilidad de Rilpivirina frente a EFV, en cuanto a efectos adversos neurológicos, psiquiátricos, exantema y lípidos. 3.2. Resumen del informe En el momento actual el tratamiento antirretroviral (TARV) de elección se basa en combinaciones de al menos tres fármacos antirretrovirales (GeSida/PNS) dentro de la terapia antirretroviral de inicio. Diferentes artículos de revisión realizados por expertos acerca del tratamiento de inicio con efavirenz comentan que a pesar de su eficacia, presentaría desventajas como su baja barrera genética y su perfil de tolerabilidad (efectos adversos a nivel de sistema nervioso central de tipo agudo, que pueden persistir en el tiempo, afectación de los parámetros lipídicos o exantema). En la práctica clínica, aproximadamente el 20% de los pacientes que inician TAR con FTC/TDF/EFV interrumpen la pauta en el primer año de tratamiento. Además, no se recomienda su uso en pacientes con antecedentes neuropsiquiátricos y en mujeres que quieran quedarse embarazadas. Por todo ello, este grupo plantean la necesidad del uso de antiretrovirales de inicio con un perfil de tolerabilidad y eficacia similar a efavirenz, que facilite su cumplimiento. La EMA, que evaluó el registro de rilpivirina, concluyó que el perfil de tolerabilidad de rilpivirina comparado con EFV es favorable, especialmente en las cuatro primeras semanas. Su dosificación una vez al día y la baja carga de comprimidos son ventajas que podrían facilitar el cumplimiento del tratamiento. En el análisis por subgrupos planeado a priori, tanto en pacientes con carga viral basal >100.000 cop/ml como ≤ 100.000 copias/ml se confirmó la no-inferioridad de rilpivirina respecto a efavirenz. Las tasas de respuesta de los pacientes con carga viral ≤100.000 cop/ml tratados con rilpivirina fueron mayores que con efavirenz [90% vs 84% respectivamente, IC 95%: 6,6 (1,6; 11,5)]. Siendo la tasa de fracaso virológico en este grupo de pacientes similar en ambos brazos (3,8% RPV y 3,3% EFV) a las 48 semanas. Se estima que durante un año, en un hospital con una media de 1.000 pacientes adultos en tratamiento, podrían 1 iniciar 100-120 pacientes naïve, de los cuáles 60-70 con carga viral basal ≤ 100.000 copias/ml. 4.- Farmacología Indicaciones clínicas formalmente aprobadas y fecha de aprobación: EMEA / AEMPS / FDA: Rilpivirina (Edurant®), en combinación con otros medicamentos antirretrovirales, está indicado para el tratamiento de la infección por el virus de la inmunodeficiencia humana de tipo 1 (VIH-1) en pacientes adultos con una carga viral ≤ 100.000 copias/ml que no han recibido tratamiento antirretroviral previamente (naïve). Mecanismo de acción Rilpivirina es un ITINAN diarilpirimidínico del VIH-1. La actividad de rilpivirina se basa en una inhibición no competitiva de la transcriptasa inversa (TI) del VIH-1. Rilpivirina no inhibe las polimerasas α, β y γ del ADN celular humano. Página 1 Posología, forma de preparación y administración.-La dosis recomendada de Rilpivirina es de un comprimido de 25 mg una vez al día. Pacientes de edad avanzada.- La información en pacientes mayores de 65 años es limitada. No es necesario ajustar la dosis de Rilpivirina en los pacientes de edad avanzada. Población pediátrica.-No se ha establecido todavía la seguridad y eficacia de Rilpivirina en niños menores de 18 años. Insuficiencia hepática.- La información sobre el uso de Rilpivirina en pacientes con insuficiencia hepática leve o moderada (clases A o B de Child-Pugh) es limitada. No es necesario ajustar la dosis en estos pacientes, aunque se debe utilizar con precaución en pacientes con insuficiencia hepática moderada. No se ha estudiado Rilpivirina en pacientes con insuficiencia hepática grave (clase C de Child-Pugh). Insuficiencia renal.- Rilpivirina ha sido principalmente estudiado en pacientes con función renal normal. No es necesario ajustar la dosis en pacientes con insuficiencia renal leve o moderada. Rilpivirina se debe utilizar con precaución en los pacientes con insuficiencia renal grave o nefropatía terminal. La combinación de Rilpivirina con un inhibidor potente del CYP3A (por ejemplo, un inhibidor de la proteasa del VIH potenciado con ritonavir) únicamente se debe utilizar en pacientes con insuficiencia renal grave o nefropatía terminal si el beneficio supera el riesgo. El tratamiento con Rilpivirina resultó en un precoz y pequeño aumento de la media de los niveles de creatinina sérica, la cual permaneció estable a lo largo del tiempo y no se consideró clínicamente relevante. Farmacocinética Absorción. Tras la administración oral, la concentración plasmática máxima de rilpivirina se alcanza por lo general en el plazo de 4-5 horas. Se desconoce la biodisponibilidad absoluta. Efecto de los alimentos sobre la absorción La administración en ayunas o únicamente con una bebida nutricional puede disminuir las concentraciones plasmáticas de rilpivirina, lo que podría reducir su efecto terapéutico. Distribución. Rilpivirina se une aproximadamente en un 99,7 % a las proteínas plasmáticas in vitro, principalmente a la albúmina. No se ha evaluado en seres humanos la distribución de rilpivirina en otros compartimentos que no sean el plasma (p. ej., líquido cefalorraquídeo, secreciones genitales). Biotransformación Los estudios in vitro indican que rilpivirina experimenta fundamentalmente un metabolismo oxidativo mediado por el sistema del citocromo P450 (CYP) 3A. Eliminación.- La semivida de eliminación terminal de rilpivirina es de 45 horas aproximadamente. Tras la administración oral de dosis únicas de 14C-rilpivirina, se recuperó en las heces y la orina un promedio del 85 % y el 6,1 % de la radiactividad, respectivamente. En las heces, se detectó un promedio del 25 % de la dosis administrada de rilpivirina intacta. En la orina se detectaron únicamente cantidades mínimas de rilpivirina intacta (< 1 % de la dosis). Contraindicaciones Rilpivirina no se debe administrar conjuntamente con los siguientes medicamentos, dado que se pueden producir descensos significativos de las concentraciones plasmáticas de rilpivirina como consecuencia de la inducción enzimática del CYP3A o del aumento del pH gástrico, lo que puede causar la pérdida del efecto terapéutico: - Antiepilépticos como carbamacepina, oxcarbacepina, fenobarbital y fenitoína - Antimicobacterianos como rifabutina, rifampicina y rifapentina - Inhibidores de la bomba de protones, como omeprazol, esomeprazol, lansoprazol, pantoprazol y rabeprazol - El glucocorticoide sistémico, dexametasona, excepto como tratamiento de dosis única - Hierba de San Juan o Hipérico (Hypericum perforatum). Características comparadas con otros medicamentos similares: El tratamiento antirretroviral (TARV) de elección se basa en combinaciones de al menos tres fármacos antirretrovirales. En la presente tabla se adjuntan las características de los fármacos que se utilizan actualmente en pacientes con VIH según GeSida/PNS dentro de la terapia antirretroviral de inicio. Características comparadas con otros medicamentos similares Rilpivirina Nombre Efavirenz (EFV) Atazanavir (ATV) (RPV) Presentación comp 25 mg comp 600 mg comp 300 mg Posología Características diferenciales 600mg EFV/24 h EFV es un inhibidor no competitivo de la transcriptasa inversa (TI) del 25 mg RPV/24h Rilpivirina es un inhibidor no competitivo de la transcriptasa inversa (TI) del VIH-1. 300/100 mg ATV/r /24h ATV es un inhibidor de la proteasa (IP) del VIH-1. Página 2 Darunavir (DRV) comp 400 mg 800/100 mg DRV/r /24 h DRV es un inhibidor de la proteasa (IP) del VIH1. Raltegravir (RAL) comp 400 mg 400 mg RAL/12 h Raltegravir es un inhibidor de la transferencia de las hebras de la integrasa activo VIH-1. frente al VIH-1. Está indicado en el tratamiento antiviral combinado del VIH-1 en adultos infectados, adolescentes y niños de 3 años de edad y mayores. Está indicado en combinación con otros medicamentos antirretrovirales para el tratamiento de la infección por VIH-1 en pacientes adultos con una carga viral ≤ 100.000 copias/ml que no han recibido tratamiento antirretroviral previamente (naïve). Está indicado para el tratamiento de pacientes adultos infectados por VIH-1 en combinación con otros medicamentos antirretrovirales. Está indicado en pacientes adultos sin experiencia previa al TAR en combinación con otros ARV. En pacientes adultos previamente tratados con TAR sin mutaciones asociadas a resistencia a darunavir y que tienen una carga viral < 100.000 copias/ml y un recuento de linfocitos CD4+ ≥ 100 células x 106/l. Está indicado en combinación con otros fármacos antirretrovirales para el tratamiento de la infección por el virus de la inmunodeficienci a humana (VIH-1) en pacientes adultos. 5.- Evaluación de la eficacia: La evaluación de la eficacia y seguridad se realizará en base a los dos ensayos clínicos pivotales: Ensayo TMC278-C209 (ECHO); rilpivirina vs. efavirenz con emtricitabina y tenofovir (Molina JM et al. Lancet 2011) y TMC278-C215 (THRIVE); rilpivirina vs. Efavirenz con dos inhibidores de la transcriptasa inversa análogos a nucleósidos. (Cohen CJ et al Lancet 2011). Y a la revisión de la combinación de resultados de eficacia y seguridad (Resultados combinados de eficacia y seguridad de los dos ensayos pivotales ECHO y THRIVE (Cohen JC et al. AIDS 2012)). Ensayo Clínico ECHO.-Molina JM, Cahn P, Grinsztejn B, et al. Rilpivirine versus efavirenz with tenofovir and emtricitabine in treatment-naive adults infected with HIV-1 (ECHO): a phase 3 randomised doubleblind active-controlled trial. Lancet. 2011 Jul 16;378(9787):238-46. - Diseño: E. C Fase III, multicéntrico, randomizado, doble ciego, controlado con tratamietno activo. Los pacientes fueron asignados al azar a recibir una vez al día 25 mg de rilpivirina o 600 mg / día de efavirenz. Ambos brazos estaban a su vez en tratamiento con tenofovir y emtricitabina. - Objetivo principal demostrar la no inferioridad (12% de margen) de rilpivirina a efavirenz en términos del porcentaje de pacientes con respuesta confirmada (carga viral <50 copias por ml), a las 48 semanas - Criterios de inclusión: pacientes afectos de VIH-1, sin tratamiento previo, con una carga viral igual o superior a 500 copias / mL . - Nº pacientes: 690 adultos.- 346 fueron asignados al grupo de rilpivirina y 344 al grupo de efavirenz - Variable principal a las 48 semanas: - CV < 50 cop/ml (ITT-TLOVR) -Tipo de análisis: intención de tratar (ITT). Tratamiento Grupo experimental N = 346 Grupo control N = 344 RPV 25 mg una vez al día acompañado de 2 inhibidores de la transcriptasa inversa análogos de nucleósidos (tenofovir / emtricitabina) EFV 600 mg una vez al día acompañado de 2 inhibidores de la transcriptasa inversa análogos de nucleósidos (tenofovir / emtricitabina) Resultados Variable principal de resultado (48 semanas) - CV < 50 cop/ml (ITT-TLOVR) Resultado grupo experimental Resultado grupo control Diferencia porcentual de respuesta 83% 83% -0,4 ( ICdel 95%: 5.9 – 5.2) El ensayo confirma la no inferioridad con un margen del 12% (variable principal) La incidencia de fracaso virológico fue del 13% (rilpivirina) versus 6% (efavirenz) en ITT-TLOVR) Las RA de grado 2-4 fueron más frecuentes en el grupo de pacientes tratados con efavirenz (RPV 16% vs EFV 31%), Las interrupciones debidas a eventos adversos fueron del 2% en el brazo de tratamiento con rilpivirina y del 8% en el grupo tratado con efavirenz. La erupción cutánea, mareos y sueños anormales o pesadillas fueron las más frecuentes. El aumento de los lípidos plasmáticos fueron significativamente menores con rilpivirina. Ensayo Clínico THRIVE.Cohen CJ, Andrade-Villanueva J, Clotet B, et al. Rilpivirine versus efavirenz with two background nucleoside or nucleotide reverse transcriptase inhibitors in treatment-naive adults infected with HIV-1 (THRIVE): a phase 3, randomised, non-inferiority trial. Lancet. 2011 Jul 16;378(9787):229-37 - Diseño: E. C Fase III, multicéntrico, randomizado, doble ciego, para determinar la eficacia y seguridad de rilpivirina comparado con efavirenz en pacientes infectados por VIH – 1, sin tratamiento previo. 48 semanas de duración Adultos sin tratamiento previo de VIH-1-infected fueron aleatorizados 1:1 a rilpivirina 25 mg una vez al día o 600 mg de efavirenz una vez al día. Todos tenían como tratamiento TDF / FTC, zidovudina / lamivudina o abacavir / lamivudina . Estudio de No superioridad. Objetivo principal: Proporción de pacientes con carga viral inferior a 50 copias en la semana 48. Determinar la no inferioridad (12% margen) - Nº de pacientes: 678. 340 pacientes fueron asignados al grupo de rilpivirina y 338 al grupo de efavirenz. Tasa de abandonos: Página 3 4% grupo rilpivirina y 7% brazo efavirenz - Variable principal a las 48 semanas: - CV < 50 cop/ml (ITT-TLOVR) -Tipo de análisis: intención de tratar (ITT). Tratamiento Grupo Grupo control experimental RPV 25 mg una vez al día acompañado de 2 inhibidores de la transcriptasa inversa análogos de nucleósidos (TDF/FTC, 3TC/ABC o 3TC/AZT en el estudio THRIVE) Variable principal de resultado (48 semanas) EFV 600 mg una vez al día acompañado de 2 inhibidores de la transcriptasa inversa análogos de nucleósidos (TDF/FTC, 3TC/ABC o 3TC/AZT en el estudio THRIVE) Resultado grupo experimental CV < 50 cop/ml (ITTTLOVR) Resultados Resultado grupo control 86% 82% Diferencia, % (95% CI) 3.5% (-1,7-8,8%) P< 0,001 El ensayo confirma la no inferioridad con un margen del 12% (variable principal). Para pacientes naive con carga viral ≤ 100.000 cop/ml se obtuvieron los mejores resultados La tasa de fracaso virológico fue del 7,1% (rilpivirina) versus 5,3% (efavirenz) en ITT-TLOVR) Rilpivirina fue mejor tolerado que efavirenz en términos de una menor incidencia de interrupciones (4% de los pacientes en el grupo rilpivirina y 7% en el grupo de efavirenz) debidas a eventos adversos, especialmente debido al sistema nervioso central efectos secundarios como insomnio, depresión, mareos, o debido a la erupción, si se compara con los pacientes que tomaron efavirenz. La adherencia al tratamiento fue mayor (95% de los pacientes) en el grupo de rilpivirina, frente al 90% en el grupo en tratamiento con efavirenz. Cohen CJ, Molina JM, Cahn P, et al. Efficacy and Safety of Rilpivirine (TMC278) Versus Efavirenz at 48 Weeks in Treatment-Naive HIV-1–Infected Patients: Pooled Results From the Phase 3 Double-Blind Randomized ECHO and THRIVE Trials. J Acquir Immune Defic Syndr. 2012 May 1;60(1):33-42. -Nº de pacientes: Se incluyeron 690 pacientes del estudio ECHO y 678 pacientes del THRIVE, los cuales habían completado 48 semanas de tratamiento o lo habían interrumpido antes. Diseño: ensayo fase III aleatorizado, doble ciego, doble enmascaramiento con control activo. EL diseño de ambos ensayos fue idéntico salvo tratamiento control. La duración fue de 96 semanas. -Tratamiento grupo activo y tratamiento grupo control: En el ensayo ECHO, el tratamiento de base consistió en los ITIAN(t) tenofovir disoproxil fumarato más emtricitabina. En el ensayo THRIVE, el tratamiento de base consistió en 2 ITIAN(t) seleccionados por el investigador: tenofovir disoproxil fumarato más emtricitabina o zidovudina más lamivudina o abacavir más lamivudina. En ECHO, la aleatorización se estratificó en función de la carga viral. En THRIVE, la aleatorización se estratificó atendiendo a la carga viral y al tratamiento de base con ITIAN(t). - Objetivo primario: evaluar la no inferioridad (en términos de porcentaje de pacientes con respuesta viral confirmada < 50 copias/ml definida por TLOVR) de rilpivirina 25 mg una vez al día vs. Efavirenz 600 mg/día con un margen de no inferioridad de 12%. -Criterios de inclusión: Pacientes adultos naïve infectados por VIH-1 con una carga plasmática basal > 5000 copias/ml y con sensibilidad confirmada a los inhibidores de la transcriptasa inversa análogos a nucleótidos (ITIAN). -Criterios de exclusión: Tratamientos concomitantes contraindicados, esperanza de vida < 6 meses, presencia de una enfermedad definitoria de SIDA (excepto Sarcoma de Kaposi y síndrome de emanciación por VIH), infección aguda por VIH-1, coinfección por VIH-2, enfermedad activa clínicamente significativa, pacientes con factores de riesgo para prolongación del intervalo QTc, embarazo o lactancia, ausencia de métodos eficaces de control de la natalidad, tasa de filtración glomerular estimada < 50 ml/min. Se excluyeron a todos aquellos pacientes que habían documentado resistencias asociadas a mutaciones de algún inhibidor de la transcriptasa inversa no análogo a nucleósido (ITINAN) de una lista de 39 mutaciones ( La lista incluía A98G, L100I, K101E/P/Q, K103H/N/ S/T, V106A/M, V108I, E138A/G/K/Q/R, V179D/E, Y181C/I/V, Y188C/H/L, G190A/C/E/Q/S/T, P225H, F227C, M230I/L, P236L, K238N/T, and Y318F). -Pérdidas: en ambos ensayos hubo el mismos porcentaje de pérdidas, 38% en ambos. -Tipo de análisis: ITT-TLOVR: análisis por intención de tratar, tiempo hasta la pérdida de la respuesta virológica. Resultados Variable evaluada estudio en el Resultado principal, %: -Respuesta (carga viral < 50 copias/ml)§#. Objetivo de no inferioridad de rilpivirina vs. Efavirenz. Resultados secundarios, %: -No-respuesta. -Fracaso virológico† -Discontinuación por acontecimientos adversos (AA). -Discontinuación por motivos no relacionados con AA¶ -Adherencia>95%(M-MASRI)@,% Rilpivirina + Tratamiento de base. (N =686) Efavirenz + Tratamiento de base. (N = 682) RAR (95% IC) p NNT 84,3% (578/686) 82,3 %(561/682) 2,0 (-2,0; 6,0) >0.05 - 9,0%(61/686) 4,8%(32/682) ND ND ND 2,0%(13/686) 6,7%(45/682) ND ND ND 4,5%(30/686) 5,7%(38/682) ND ND ND N= 547 N= 492 Página 4 Carga viral < 50copias/ml Fracaso virológico† Discontinuación por acontecimientos adversos (AA). Discontinuación por motivos no relacionados con AA¶ 88%(481/547) 7% (38/547) 2%(11/547) 88%(432/492) 4%(20/492) 4%(20/492) 0.8 (-3.1; 4.8) ND ND >0.05 ND ND ND ND 3%16/547) 3%(15/492) ND ND ND -Adherencia<95%(M-MASRI)@,% N= 80 N= 95 Carga viral < 50copias/ml Fracaso virológico† Discontinuación por acontecimientos adversos (AA). Discontinuación por motivos no relacionados con AA¶ 66%(52/80) 19%(15/80) 4%(3/80) 68%(64/95) 9%(8/95) 11%(10/95) 2.2 (-11.8; 16.1) ND ND >0.05 ND ND ND ND 11%(8/80) 12%(11/95) ND ND ND 83,5% (459/550) 87,1% (88/101) 88,6% (31/35) 82,4% (450/546) 80,6% (83/103) 84,8% (28/33) 1,0 (-3,4; 5,5) 6,5 (-3,6; 16,7) 3,7 (-12,7; 20,1) >0.05 >0.05 >0.05 - N=368 N= 330 90%(331/368) 4%(15/368) 2%(7/368) 84%(272/330) 3%(10/330) 6%(20/330) 6.6 (1.6; 11,5) ND ND >0.05 ND ND ND ND 4%(15/368) 7%(23/330) ND ND ND N= 249 N= 270 80%(199/249) 13%(32/249) 2%(5/249) 83%(224/270) 5%(13/270) 9%(24/270) 3.04 (-3.6; 9.7) ND ND >0.05 ND ND ND ND 6%(15/249) 4%(11/270) ND ND ND N=69 N=82 70%(48/69) 22%(15/69) 4%(2/69) 76%(62/82) 11%(9/82) 7%(5/82) 6 (-8.2; 20.3) ND ND >0.05 ND ND ND ND 4%(2/69) 6%(4/82) ND ND ND 58,8% (20/34) 80,4% (156/194) 86,9% (272/313) 90,3% (130/144) 80,6% (29/36) 81,7% (143/175) 82,4% (253/307) 82,9% (136/164) 21,7 (0.74;42.7) 1,3 (-6,7:9.3) -4,5 (-10,1;1.2) -7.3 (-15;0.17) >0.05 >0.05 >0.05 >0.05 con N= 62 N= 28 por 29% (18/62) 43% (12/28) 13.8 (-7.71;35.36) >0.05 por 63% (39/62) 54% (15/28) -9.33(-31.37; 12.71) >0.05 por 68% (42/62) 32% (9/28) -35.6 (-14.7;-56.4) >0.05 por 71% (44/62) 57% (16/28) -13.82 (-35.3;7.71) >0.05 N=39 N= 15 Resultados por subgrupos -Por tratamiento con ITIAN Carga viral < 50 copias/ml(%) Tenofovir/emtricitabina. Zidovudina/lamivudina Abacavir/lamivudina -Por carga viral al inicio, %: ≤ 100.000 (copias/ml): Carga viral < 50copias/ml Fracaso virológico† Discontinuación por acontecimientos adversos (AA). Discontinuación por motivos no relacionados con AA¶ - Por carga viral al inicio, %: >100.000 copias/ml y ≤ 500.000 copias/ml Carga viral < 50copias/ml Fracaso virológico† Discontinuación por acontecimientos adversos (AA). Discontinuación por motivos no relacionados con AA¶ - Por carga viral al inicio, %: >500.000 (copias/ml): Carga viral < 50copias/ml Fracaso virológico† Discontinuación por acontecimientos adversos (AA). Discontinuación por motivos no relacionados con AA¶ -Por recuento de CD4 al inicio (células/microlitro). Carga viral < 50copias/ml (%): <50 >50-199 >200-349 >350 Análisis de resistencia Fallo virológico resistencias,%: - Fallo virológico sin RAM ITINAN y/o ITIAN: Fallo virológico con RAM ITINAN: Fallo virológico con RAM ITIAN: Fallo virológico con RAM ITINAN y/o ITIAN: - Incidencia de mutaciones por RAM de ITINAN en pacientes con fallo virológico, %: ND Página 5 E138K K103N K101E H221Y V90I Y181C V189I V106M L100I V179I E138Q 72% (28/39) 0 21% (8/39) 15% (6/39) 13% (5/39) 13% (5/39) 13% (5/39) 0 5% (2/39) 5% (2/39) 5% (2/39) 0 73% (11/15) 7% (1/15) 0 0 0 0 20% (3/15) 7% (1/15) 0 0 ND ND 13.8 (-4-.04; 31.7) ND ND ND ND ND 1.54 (-12.86; 15.9) ND ND ND ND >0.05 ND ND ND ND ND >0.05 ND ND ND ND ND ND ND ND ND ND N=número de pacientes por grupo de tratamiento; ND= no determinada. * Intención de tratar, tiempo hasta la pérdida de la respuesta virológica. ± Basado en una aproximación normal. § Pacientes que alcanzaron una respuesta virológica (dos cargas virales consecutivas < 50 copias/ml) y la mantuvieron hasta la semana 48. # Diferencia prevista en las tasas de respuesta (IC del 95 %): 1,6 % (-2,2 %; 5,3 %); valor p < 0,0001 (ausencia de inferioridad en un margen del 12 %) a partir del modelo de regresión logística, incluidos los factores de estratificación y el estudio. † Incluye pacientes que presentaron un repunte (carga viral confirmada ≥ 50 copies/ml después de ser respondedores), o pacientes en los que nunca llegó a alcanzarse la supresión viral (carga viral < 50 copias/ml no confirmada, en pacientes con tratamiento en curso o que interrumpieron debido a falta o pérdida de eficacia). ¶ por ejemplo, pérdida de seguimiento, incumplimiento, retirada del consentimiento. @ M-MASRI: cuestionario de medida de adherencia. Conclusión: En la semana 48, rilpivirina una vez al día y efavirenz 600 mg / día tuvieron tasas de respuestas similares. Considerando ambos ensayos de forma global, la tasa de fracaso virologíco fue mayor con rilpivirina (9% vs 4,8%), pero hubo más abandonos debido a los efectos adversos con efavirenz (7,6% vs 3,4%). Los efectos adversos de grado 2 a 4, en ambos ensayos de forma conjunta, relacionados con el tratamiento fue del 15,9% en el grupo de rilpivirina y de 31,1% en el brazo de efavirenz. Los trastornos psiquiátricos fueron los más frecuentes (22,7%-efavirenz- vs 14,9%-rilpivirina-). Las alteraciones lipidicas también se asoció, con más frecuencia, al tratamiento con efavirenz . Revisiones sistemáticas 1. Canadian Agency for Drugs and Technologies in Health señalan la indicación de rilpivirina en combinación con otros antirretrovirales para el tratamiento de pacientes adultos VIH-1 naïve basado en los resultados de los ensayos clínicos pivotales. - También hacen referencia a que rilpivirina en dosis única diaria supone una ventaja para el paciente naïve. ® 2. Scottish Medicines Consortium “NHS Scotland” Se aprueba la indicación de rilpivirina (Edurant ) y ® rilpivirina en combinación (Eviplera ) para el tratamiento de pacientes adultos VIH-1 naïve con carga viral ARN < 100.000 copias/ml, basados en los resultados de los ensayos clínicos pivotales. 3. Food and Drug Administration, “FDA” aprueba el uso de rilpivirina en combinación con otros antirretrovirales para el tratamiento de pacientes adultos VIH-1 naïve, como alternativa a la terapia inicial, basado en los ensayos clínicos pivotales, considerando algunos aspectos como: - En pacientes naïve con carga viral ARN > 100.000 copias/ml se observaron más fallos virológicos que en pacientes con carga viral ARN < 100.000 copias/ml en el grupo de rilpivirina vs. Efavirenz. - La tasa de fracaso virológico observado en los sujetos tratados rilpivirina confiere mayor tasa de resistencia al tratamiento en general y también resistencia cruzada a los ITINAN en comparación con efavirenz. - Rilpivirina desarrolla más resistencias a lamivudina/emtricitabina comparado con efavirenz. 4. DHHS. “Panel on Antiretroviral Guidelines for Adults and Adolescents” (2013) y “Recommendations of the International Antiviral Society–USA Panel” (2012; IAS-USA) recomiendan: RPV/TDF/FTC como régimen alternativo a la terapia inicial por: Datos limitados de durabilidad de la respuesta al tratamiento (48 semanas). Respuesta virológica inferior de RPV vs. EFV en pacientes con cargas virales ARN del VIH> 100.000 copias / mL, donde también se han observado mayor tasa de resistencias a ETR durante los ensayos clínicos. 5. GESIDA-PNS (2013). Recomiendan de forma no unánime RPV/TDF/FTC como una de las pautas de inicio, según el grupo de expertos, por las siguientes razones: o Es preciso realizar previamente un estudio genotípico que descarte mutaciones de resistencia a ITINAN. o Mayor riesgo de fracaso virológico que con TDF/FTC/EFV en pacientes con CVP >100.000 copias/mL. o Evitar si se utilizan inhibidores de la bomba de protones. 6. EACS. European AIDS Clinical Society. - Recomiendan el uso RPV/TDF/FTC como primera línea de tratamiento solo si la del VIH < 100.000 copias / mL. - Contraindicada con la toma concomitante de inhibidores de la bomba de protones. - Los antagonistas H2 serán administrados 12 h antes del antirretroviral o 4 h después. Página 6 carga viral ARN 6.- Evaluación de la seguridad Descripción de los efectos adversos más significativos combinados de los ensayos ECHO y THRIVE Referencia: Cohen CJ, Molina JM, Cahn P, Clotet B, Fourie J, Grinsztejn B, et al. Efficay and safety of rilpivirine (TMC278) versus efavirenz at 48 weeks in treatment-naive HIV-1 infected patients: pooled results from the phase 3 double-blind randomized ECHO and THRIVE trials. J Acquir Immune Defic Syndr 2012;60:33-42. Resultados de seguridad Variable de seguridad evaluada en el estudio Rilpivirina (N=686) Efavirenz (N=682) P Efectos adversos (EA): Cualquier EA Cualquier EA ≥ grado 2 EA que motivaron discontinuación Cualquier EA grave (incluyendo muerte) Muerte 616 (90%) 109 (16%) 23 (3%) 45 (7%) 629 (92%) 212 (31%) 52 (8%) 55 (8%) n.s. <0.0001 n.s. n.s. 1 (0.1%) 4 (1%) n.s. 7 (1%) 4 (1%) 9 (1%) 11 (2%) 12 (2%) 5 (1%) 56 (8%) 43 (6%) 25 (4%) 15 (2%) 16 (2%) 17 (2%) <0.0001 n.s. n.s. n.s. n.s. n.s. 62 (9%) 42 (6%) 37 (5%) 38 (6%) 34 (5%) 33 (5%) 69 (10%) 60 (9%) 30 (4%) 102 (15%) 122 (18%) 60 (9%) n.s. n.s. n.s. n.s. n.s. n.s. 35 (5%) 66 (10%) n.s. 117 (17%) 55 (8%) 102 (15%) 56 (8%) 21 (3%) 258 (38%) 179 (26%) 155 (23%) 87 (13%) 93 (14%) <0,0001 <0,0001 <0,001 <0,05 <0,0001 EA ≥grado 2 relacionados con el tratamiento que ocurrieron en ≥2% pacientes: Rash Mareos Sueños anormales/pesadillas Cefalea Insomnio Náuseas Alteraciones de laboratorio secundarias al tratamiento grado 3 ó 4 en ≥5% pacientes: Cualquier alteración analítica grado 3 ó 4 Hipofosfatemia Aumento amilasa pancreática Hiperglucemia Aumento LDL-colesterol grado 2-3 Aumento colesterol total grado 2-3 Aumento aspartato aminotransferasa (AST) Aumento alalnino aminotransferasa (ALT) EA de interés (de cualquier grado) que ocurrieron en ≥ 10% pacientes: Cualquier EA neurológico Mareos Cualquier EA psiquiátrico Sueños anormales/pesadillas Rash RAR NNH 15% 7 7% 15 21% 18% 8% 5% 11% Rilpivirina ha demostrado, de manera estadísticamente significativa, una menor aparición de rash y de eventos neuropsiquiátricos respecto a efavirenz, mostrando un perfil de seguridad y tolerabilidad similar para el resto de eventos adversos estudiados .- Evaluación del coste Comparación de costes del tratamiento evaluado frente a terapia de referencia Medicamento RILPIVIRINA (EDURANT® 25mg) Precio envase 229,47€ PVL – 7,5% + 4% IVA Precio unitario 7,65€ PVL – 7,5% + 4% IVA Posología 25mg QD Coste/ mes 229,47€ Coste anual 2.791,83€ Coste incremental -310,16€ EFAVIRENZ (SUSTIVA® 600mg) 254,96€ 8,50€ 600mg QD 254,96€ 3.102,00€ Terapia de referencia 8.- Conclusiones EFICACIA. Rilpivirina es una opción en arsenal de tratamiento antiretroviral para conseguir el objetivo terapéutico recomendado por las guías de práctica clínica: carga viral indetectable (<50 copias/ml) en pacientes sin tratamiento previo. Los estudios fase III han demostrado eficacia comparable con efavirenz, con un perfil de tolerabilidad más favorable (fundamentalmente menos efectos adversos neuropsiquiátricos y alteraciones Página 7 lipídicas). La fácil posología de un comprimido al día, podría facilitar su cumplimento y por consiguiente una mayor adherencia al tratamiento ARV. SEGURIDAD: Rilpivirina presenta mayor tolerabilidad que efavirenz, en especial en lo referente a los efectos neurológicos, psiquiátricos. Ello podría suponer una menor tasa de abandono de tratamiento por estos efectos y por consiguiente la adherencia, de los pacientes al mismo, sería mayor. PAUTA: La pauta de dosificación de rilpivirina por ficha técnica es 25 mg 1 vez al día (1 comp/24h) COSTE: El tratamiento con Rilpivirina en pacientes naïve con CV≤ 100.000 copias/ml sería una alternativa más coste-eficaz y compartiría la pauta de inicio con efavirenz. No obstante, habría que considerar la próxima comercialización del genérico de efavirez. Ello supondría una reducción, al menos del 30%, del precio actual. Por lo que quedaría el costo del comprimido en 5,95 € La CFT acuerda la inclusión de Rilpivirina en la guía farmacoterapéutica para el tratamiento de la infección por el virus de la inmunodeficiencia humana de tipo 1 (VIH-1), en combinación con otros medicamentos antirretrovirales, de pacientes adultos con una carga viral ≤ 100.000 copias/ml que no han recibido tratamiento antirretroviral previamente. 9.- Bibliografía 1.EPAR product information EDURANT® Agencia Europea del Medicamento (EMA) http://www.ema.europa.eu/docs/en_GB/document_library/EPAR__Product_Information/human/002264/WC500118874.pdf 2.-Cohen CJ, Molina JM, Cahn P, et al. Efficacy and safety of rilpivirine (TMC278) versus efavirenz at 48 weeks in treatment-naive HIV-1-infected patients: pooled results from the phase 3 double-blind randomized ECHO and THRIVE Trials. J Acquir Immune Defic Syndr. 2012 May 1;60(1):33-42. 3. - Molina JM, Cahn P, Grinsztejn B, et al. Rilpivirine versus efavirenz with tenofovir and emtricitabine in treatmentnaive adults infected with HIV-1 (ECHO): a phase 3 randomised doubleblind active-controlled trial. Lancet. 2011 Jul 16;378(9787):238-46. 4.- Cohen CJ, Andrade-Villanueva J, Clotet B, et al. Rilpivirine versus efavirenz with two background nucleoside or nucleotide reverse transcriptase inhibitors in treatment-naive adults infected with HIV-1 (THRIVE): a phase 3, randomised, non-inferiority trial. Lancet. 2011 Jul 16;378(9787):229-37. 6. - Cohen CJ, Molina JM, Cassetti I, et al. Week 96 efficacy and safety of rilpivirine in treatment-naïve, HIV-1 patients in two Phase III randomised trials. AIDS 2012 Dec 3. [Epub ahead of print] 7. - Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the use of antirretroviral agents in HIV-1 infected adults and adolescents. Department of Health and Human Services. April 2012 http://www.aidsinfo.nih.gov/contentfiles/lvguidelines/adultandadolescentgl.pdf 8.- Thompson MA, Aberg JA, Hoy JF et al. Antiretroviral Treatment of Adult HIV Infection: 2012 Recommendations of the International Antiviral Society–USA. JAMA 2012, 4:387:402. http://jama.jamanetwork.com/article.aspx?articleid=1221704 9. - Scotish Medicines Consortium http://www.scottishmedicines.org.uk/SMC_Advice/Advice/758_12_rilpivirine_Edurant/rilpivirine_Edurant 10.- Canadian Agency for Drugs and Technologies in Health http://www.cadth.ca/media/cdr/complete/cdr_complete_Edurant_Feb-17-12_e.pdf 11.- Informe de la agencia americana “Food and Drug Administration” sobre las recomendaciones de prescripción de rilpivirina. Reference ID: 2949710. Revisado en marzo 2013. 12.European AIDS Clinical Society Guidelines. Disponible en http://www.europeanaidsclinicalsociety.org/index.php?option=com_content&view=article&id=59:eacsguidelines&catid=37:guidelines&Itemid=41 13.- Borrador de Documento de consenso de Gesida y PNS sobre el tratamiento antirretroviral del adulto (enero2013). Disponible en: http://www.msc.es/ciudadanos/enfLesiones/enfTransmisibles/sida/publicaciones/profSanitarios/docConsensoTARG esida_PNS2013_21Enero.pdf (último acceso el 19 de nmarzo de 2013) 14.Ficha técnica del rilpivirina. Disponible en: http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/002264/human_med_001513.js p&mid=WC0b01ac058001d124 Página 8