Problemas de ácido-base
Anuncio

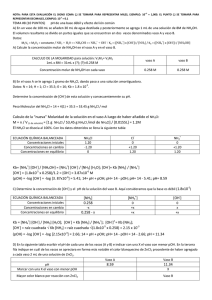
Problemas de ácido-base Problema 5 Partiendo de NH4Cl y 2 litros de NH3 0.1M ¿Cómo prepararía una disolución tampón a pH=12? Datos: M(NH4Cl)=53.5 g/mol; pKb=4.75 NH4Cl → NH4+ + Cl- Kh = Ka NH4+ + H2O ⇔ NH3 + H3O+ Kb = NH3 + H2O ⇔ NH4+ + OH- [H O ]⋅ [NH ] = [NH ] + 3 3 + 4 [OH ]⋅ [NH ] − [NH 3 ] + 4 Si pH = 12 ⇒ [H3O+] = 10-12 M ó [OH-] = 10-2 M Se puede suponer que [NH3] en equilibrio es prácticamente la inicial al añadir NH4Cl. Al ser una base débil, en disolución acuosa se encuentra poco disociado según se puede deducir de su constante de equilibrio Kb = 10-4.75, pero además el equilibrio se desplaza hacia la izquierda debido a la adición de un ion común como es el ion amonio. Lo mismo se podría decir de la hidrólisis del ion amonio de manera que su concentración es prácticamente igual a la de la sal añadida a la disolución. Por tanto: [NH3] = [NH3]0 ; [NH4+] = [NH4+]0 K b ⋅ [NH 3 ]0 10− 4.75 ⋅ 0.1 K b ⋅ [NH 3 ] −2 OH = = 10 ≈ = NH 4+ NH 4+ 0 NH 4+ 0 [ − ] [ ] [NH ] = 10 10 ⋅ 0.1 = 1.78 × 10 + 4 −4.75 −2 [ −4 M ] [ ] Para preparar 1 litro de disolución tampón añadiría a 1 L de disolución de amoniaco 0.1 M: m(NH4Cl) = n(NH4Cl) Mw(NH4Cl) = n(NH4+) Mw(NH4Cl) = V(L)x[NH4+]x Mw(NH4Cl) = = 1(L) x 1.78·10-4(mol/L) x 53.5(g/mol) = 0.0095 g Añadir 0.0095 g de NH4Cl en 1 L de disolución de amoniaco 0.1 M