procedimientos quirúrgicos en las neuropatías ópticas
Anuncio

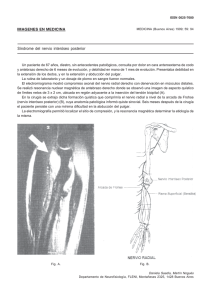
CAPÍTULO 16 PROCEDIMIENTOS QUIRÚRGICOS EN LAS NEUROPATÍAS ÓPTICAS FENESTRACIÓN DE LA VAINA DEL NERVIO ÓPTICO Jorge Satorre DESCOMPRESIÓN DEL CANAL ÓPTICO Manuel Mañós BIOPSIA DE LA ARTERIA TEMPORAL Jorge Arruga En el presente capítulo se van a describir las tres técnicas quirúrgicas que poseen interés en relación con el manejo de las afecciones del nervio óptico. En primer lugar, la fenestración de la vaina del nervio óptico (FVNO), una operación que realizan los oftalmólogos especializados en cirugía orbitaria. En segundo lugar, la descompresión del canal óptico (DCO), una intervención que suelen practicar los otorrinolaringólogos. Y en tercer lugar, la biopsia de la arteria temporal (BAT), que puede ser efectuada por cirujanos generales y también por oftalmólogos. FENESTRACIÓN DE LA VAINA DEL NERVIO ÓPTICO A lo largo de la historia de la Oftalmología las nuevas técnicas quirúrgicas han pasado con frecuencia por períodos de crítica, rechazo u ostracismo antes de conseguir una plena aceptación, y la FVNO no ha sido una excepción a este hecho (1). Fue De Wecker (2) quien en 1872 realizó esta intervención por primera vez, pero en su primera época dicha técnica se aplicó con indicaciones poco precisas. Durante los años 60 del pasado siglo Hayreh (3) estudió experimentalmente la patogenia del papiledema crónico y demostró que la FVNO era efectiva para prevenir la pérdida visual secundaria a éste. En la década de los años 80 Corbett (4) puso en evidencia que la hipertensión intracraneal (HTI) idiopática o seudotumor cerebral no era un proceso tan benigno como se creía (de hecho, se había denominado hipertensión intracraneal benigna). En este sentido, se constató que un grupo importante de pacientes padecía una pérdida visual permanente, incluso siendo portadores de derivaciones lumboperitoneales funcionantes (5). Además, con el advenimiento de las técnicas modernas de neuroimagen (TC y RM) se pudo comprobar que los pacientes con seudotumor cerebral presentaban una dilatación del espacio subaracnoideo alrededor del nervio óptico (ver capítulo 4). En base a estos hechos y a partir de tres estudios diferentes aparecidos en 1988 (6,7,8), comenzó el período de aceptación de la técnica como tratamiento de la HTI, aunque no se conoce todavía con certeza su mecanismo de acción (9,10). A este respecto,se han sugerido 3 diferentes posibilidades: • La FVNO provoca una proliferación fibrosa alrededor del nervio óptico que impide que la presión del LCR se trasmita a la zona distal (11). • La FVNO funciona como una fístula, a través de la cual sale el LCR (12). • Detrás de la FVNO se forma una ampolla fibrótica por la que se filtra el LCR (13). En cualquier caso, el efecto de la FVNO es el control de la presión en el espacio subaracnoideo del nervio óptico, como se ha comprobado por la reducción del espacio perióptico en la RM postoperatoria (14), aunque no se normalice necesariamente la presión intracraneal, un hecho demostrado experimentalmente por Seiff y Shah (15). Técnica Quirúrgica Se han descrito 3 vías de abordaje a la porción más distal del nervio óptico, a cuyo nivel se realiza la fenestración de la duramadre para descomprimirlo: 326 Neuropatías ópticas: diagnóstico y tratamiento Figura 16-1. Fotografía quirúrgica de una FVNO. El nervio óptico queda expuesto en la zona situada inmediatamente por detrás del globo ocular. Figura 16-2. Fotografía quirúrgica de una FVNO (continuación). Se muestra una franja de duramadre, después de haber practicado tres incisiones perforantes sobre la misma. Figura 16-3. Fotografía quirúrgica de una FVNO (continuación). Se puede apreciar una fenestración efectuada en la duramadre, a nivel de la zona más distal del nervio óptico (entre las cabezas de flecha). • Abordaje medial transconjuntival (16,17). • Abordaje superomedial por el pliegue palpebral superior (18). • Abordaje lateral con (8) o sin (17,19) osteotomía. La técnica que expondremos de forma detallada es la medial transconjuntival, que es la más utilizada por nosotros y por otros autores (16,17), en tanto que las otras dos técnicas pueden ser consultadas en las referencias bibliográficas aportadas (8,18,19). Excepto en los niños, preferimos realizar el procedimiento quirúrgico bajo anestesia local, ya sea peribulbar, retrobulbar o subtenoniana, aun teniendo en cuenta que con este tipo de anestesia no podremos utilizar la midriasis como indicador de isquemia durante la cirugía. Bajo microscopio quirúrgico, se inicia la intervención con una peritomía conjuntival de 360° en base fórnix, se desinserta el músculo recto interno, y se coloca una sutura de tracción en el muñón de su inserción, a fin de traccionar suavemente el globo ocular hacia arriba y afuera. Se separa el recto interno y se accede directamente al extremo distal del nervio óptico siguiendo el curso intrascleral de la arteria ciliar posterior, que aparece como una línea escleral pigmentada anteroposterior. Cuando no se identifica esta señal, se intenta localizar el nervio óptico entre las dos venas vorticosas. En intervenciones bajo anestesia general, es preciso monitorizar el tamaño pupilar durante las maniobras de tracción. Así, si sobreviene una midriasis, ello es indicación de que se está produciendo una isquemia del nervio, por lo que se debe volver a colocar el globo ocular en su posición anatómica. A continuación se abre la cápsula de Tenon en su reflexión posterior, y se observa como protruye a ambos lados del nervio óptico la grasa orbitaria, la cual se separa, dejando aislado en el centro al nervio. Por la superficie de la duramadre que lo rodea cursan los vasos y los nervios ciliares, que son desplazados hacia los lados de forma roma. Una vez expuesta la duramadre (fig. 16-1), se procede a realizar en ella, o bien tres incisiones lineales en dirección anteroposterior (fig. 16-2), o bien una fenestración rectangular (fig. 16-3). Las incisiones se inician 2 mm por detrás de la unión del nervio óptico con el globo ocular y se extienden unos 3-4 mm hacia atrás. No se debe manipular el nervio más allá de los 8 mm, ya que la ACR penetra en el mismo entre los 9 y 13 mm posteriores al globo ocular. Al efectuar la primera incisión en la duramadre hay que comprobar la salida de LCR en abundancia, e inmediatamente des- Capítulo 16. pués se lleva a cabo la ruptura de las trabéculas aracnoideas circundantes al nervio óptico mediante un disector. Una vez descomprimido el nervio, se procede a reinsertar el músculo recto interno y a suturar la conjuntiva. Este abordaje medial transconjuntival presenta la ventaja de ser el acceso más directo a la parte distal del nervio óptico, pero tiene los inconvenientes de precisar la desinserción del recto interno y de proporcionar una visualización oblicua del nervio. El abordaje superomedial por el pliegue palpebral superior, descrito recientemente, evita desinsertar músculo alguno, ya que se accede al nervio óptico por el espacio comprendido entre el recto interno, el oblicuo superior y el complejo elevador-recto superior. No obstante, el nervio se halla a mayor distancia por este acceso que por el transconjuntival. El abordaje lateral, con osteotomía o sin ella, es el que requiere más manipulación, ya que el nervio óptico está situado a una distancia aún mayor. Por esta vía no se desinserta músculo alguno, si bien se debe traccionar el recto externo, ya sea en sentido superior o inferior. Aunque por cualquiera de los tres abordajes pueden lesionarse los nervios ciliares al separarlos para exponer la duramadre, esta complicación es más frecuente por el abordaje lateral, ya que el ganglio ciliar está situado junto a la parte externa del nervio óptico. La lesión del propio nervio óptico es muy infrecuente, pero son precisamente las fibras maculares las que siguen su trayecto por la parte temporal del mismo, por lo que están más expuestas lesionarse por este abordaje. Algo similar ocurre con la vascularización coroidea responsable de la región macular, cuya localización es predominantemente temporal. En contrapartida, el abordaje lateral ofrece una visión perpendicular del nervio óptico y, por tanto, su fenestración es más controlable. Las reintervenciones son difíciles por cualquiera de las vías expuestas, ya que la identificación de los planos y estructuras es más difícil debido a la fibrosis producida tras la cirugía previa. Tabla 16-1. 1. 2. 3. 4. Indicaciones de la FVNO HTI idiopática Papiledema crónico Hemorragia subaracnoidea en el nervio óptico Desprendimiento de la retina no regmatógeno asociado a malformaciones papilares Procedimientos quirúrgicos en las neuropatías ópticas 327 A nivel experimental, la FVNO ha sido practicada en conejos mediante la utilización de un láser libre de electrones, de baja energía, sin que se produjeran alteraciones histopatológicas mayores que con la cirugía convencional (20). Indicaciones y Resultados Las indicaciones de la FVNO han ido variando durante estos últimos años, y a este respecto se reseñan en la tabla 16-1 las que se consideran vigentes en la actualidad. La principal de ellas es el seudotumor cerebral que no responde al tratamiento médico, con pérdida significativa o progresiva de función visual como sintomatología predominante (ver capítulo 8). Esto es válido sobre todo para las situaciones con un pronóstico más desfavorable, como es el caso de la insuficiencia renal crónica (IRC) (21). De acuerdo con Corbett, el enfoque terapéutico actual de la HTI idiopática se basa en la cuantía de la afectación de la función visual. Esta última debe ser valorada con preferencia respecto a otros aspectos de la enfermedad como el grado del papiledema, los niveles de presión intracraneal, la presencia de diplopia, la frecuencia de los oscurecimientos transitorios visuales o las alteraciones de los PEV (8). La efectividad de la FVNO varía según las diferentes series, aunque en las más largas publicadas, el porcentaje de mejora o estabilización visual en pacientes con seudotumor cerebral es del 68-94% (22,23). No obstante, si se estudian por separado los casos agudos y los crónicos, se constata una mejoría visual tras la FVNO en el 100% de los primeros, mientras que en los segundos el porcentaje desciende al 31% (24) (fig. 16-4). La función visual se recupera antes de que desaparezca la elevación papilar, la cual puede tardar desde días hasta semanas en regresar (fig. 16-5). Cuando existe una pérdida visual grave bilateral se pueden fenestrar ambos nervios ópticos (fig. 16-4). No obstante, debido a que una FVNO unilateral puede mejorar el papiledema de los dos ojos, aconsejamos operar en un primer tiempo el ojo con mayor afectación visual y, si no mejora el fondo del ojo contralateral, fenestrar el nervio óptico de éste último en un segundo tiempo. En nuestro estado actual de conocimientos, no es posible vaticinar durante el preoperatorio en qué pacientes mejorará el papiledema de ambos ojos tras la FVNO de un solo lado. Es importante señalar que un éxito inicial tras la FVNO 328 Neuropatías ópticas: diagnóstico y tratamiento Figura 16-4. Campimetrías computarizadas a umbral antes y después de la FVNO en una mujer con hidrocefalia obstructiva congénita y fracaso tardío de una derivación ventrículo-peritoneal. La visión se deterioró hasta amaurosis OD y percepción luminosa OI, y no mejoró tras el recambio valvular, por lo que se le practicó una FVNO bilateral. A partir de entonces experimentó una mejoría visual progresiva, hasta llegar a percepción de luz OD y 0,3 con un campo visual normal en OI, a pesar de una palidez papilar importante en AO. (Programa G1. Octopus Field Analyzer). no garantiza una protección permanente sobre la función visual y, de hecho, en un 10-32% (23) de los pacientes la visión, tras mejorar al principio, vuelve a empeorar después. El deterioro de la función visual puede sobrevenir en cualquier momento tras la FVNO, se presenta como una pérdida progresiva del campo visual y no se acompaña necesariamente de reducción de la agudeza ni de papiledema (22). Se desconoce cuáles son los factores de Figura 16-5. Evolución oftalmoscópica de la papila de una paciente con HTI idiopática sometida a una FVNO. (A) papiledema agudo preoperatorio. (B) resolución parcial del papiledema 2 semanas después de la intervención. (C) resolución total del papiledema 4 meses más tarde. riesgo específicos que predisponen al fracaso de la FVNO. En el postoperatorio inmediato han sido descritos casos de sangrado en la vaina del nervio, infección o bloqueo de la fenestración por la grasa orbitaria (25). Los fracasos tardíos son debidos, en cambio, a un cierre anatómico de la fenestración producido por fibrosis, lo cual condiciona que la reintervención resulte complicada debido al mayor peligro de oclusión vascular o de necrosis por inflamación postquirúrgica (22). Por ello, en caso de fracasar la FVNO nosotros preferimos la realización de una derivación lumboperitoneal. Otras indicaciones de esta técnica en nuestra experiencia son los casos de papiledema crónico, de causas diversas. Entre ellas se incluyen los tumores cerebrales no resecables (26), la hidrocefalia con HTI aguda por obstrucción de válvula ventrículo-peritoneal y la HTI no controlable por meningitis criptocócica en el contexto de un SIDA (27). La recuperación de la función visual en estos casos depende de la cronicidad del cuadro clínico y de su causa específica. La hemorragia intravaginal del nervio óptico (ver capítulo 13) se ha descrito asociada a traumatismos craneoencefálicos (TCE) y periorbitarios o a lesiones accidentales por inyecciones retrobulbares, siendo la pérdida de función visual debida a una oclusión de la VCR asociada o no a una oclusión de la ACR. En estos casos está indicada la FVNO con evacuación del contenido hemático, y si se descomprime a tiempo el espacio subaracnoideo que rodea al nervio, el cuadro visual puede mejorar, aunque con frecuencia el tratamiento llega cuando el daño neurorretiniano es irreversible. Por otro lado, el desprendimiento no regmatógeno de la retina asociado con una malformación papilar (foseta, coloboma, morning glory) (ver capítulo 6) se puede producir por la existencia de una comunicación entre el espacio subaracnoideo del nervio óptico anómalo y el espacio subretiniano. Estos casos presentan una dificultad quirúrgica añadida, ya que la FVNO se debe efectuar por detrás de la malformación del nervio óptico, pero es posible en ocasiones obtener una reaplicación de la retina tras la realización de esta técnica, según nuestra experiencia y la de otros autores (28). Es importante reseñar que, aunque la FVNO fue propuesta como tratamiento de la neuropatía óptica isquémica anterior no arterítica (NOIA-NA), según los resultados del estudio multicéntrico emprendido al respecto, la fenestración no sólo no es útil en estos casos, sino que empeora el cuadro clínico (29). A partir de Capítulo 16. Procedimientos quirúrgicos en las neuropatías ópticas Tabla 16-2. Figura 16-6. Relaciones vasculares del nervio óptico. El nervio óptico (→) discurre por el canal óptico (CO), acompañado por la primera rama de la arteria carótida (ACI), la arteria oftálmica (AO). Esta última a nivel del vértice orbitario sigue un trayecto paralelo a la vaina del nervio, situándose por debajo del mismo, aunque en ocasiones se coloca en posición medial. Algunas de sus ramas, como la arteria central de la retina (ACR), se originan en la vecindad del tercio posterior de la porción orbitaria del nervio. Otras ramas de la oftálmica son las arterias etmoidales anterior (AEA) y posterior (AEP). (Modificada de Parra Duque (38)). estas conclusiones hemos desestimado la indicación de la FVNO en la NOIA-NA. Finalmente, esta técnica ha sido utilizada al objeto de obtener biopsias de la vaina meníngea del nervio óptico para el diagnóstico de algunas neuropatías ópticas infiltrativas (30). Complicaciones En nuestra experiencia las complicaciones de este procedimiento quirúrgico son poco habituales y, la mayor parte de las veces, transitorias. La más frecuente de ellas es la midriasis postquirúrgica autolimitada, por manipulación del nervio ciliar posterior nasal en el abordaje medial conjuntival, seguida de la endotropia (sobre todo tras FVNO bilateral) y del dellen corneal, ambos autolimitados. No obstante, se han descrito también diversas complicaciones más graves, aunque infrecuentes (31). Éstas comprenden microhipemas, glaucoma agudo por cierre angular, oclusión de la ACR, de rama o de arteria ciliorretiniana, infarto coroideo, neuropatía óptica postquirúrgica y hemorragia intraparenquimatosa del nervio óptico u orbitaria. Existen casos excepcionales de amaurosis postoperato- 329 Características anatómicas del canal óptico • Sigue un trayecto de dirección superior y medial respecto al vértice orbitario • Su longitud es de 5,5-11,5 mm, y sus diámetros, 5-9 mm el proximal y 4-6 mm el distal • La duramadre que rodea al nervio dentro del canal, en el extremo orbitario se desdobla en 2 capas, una se continúa con la periórbita y la otra forma la cubierta neural, mientras que en el extremo craneal se continúa con la duramadre intracraneal • En el trayecto interior el espacio subaracnoideo del nervio es muy estrecho, lo que facilita fenómenos de trombosis y/o cizallamiento vascular • El hueso que forma el canal es más delgado a nivel proximal (ala esfenoidal) y más grueso en el agujero óptico, si bien en el 4% de los seres humanos el canal presenta dehiscencias óseas • El tubérculo óptico es la zona ósea más dura del canal y sus relaciones con las estructuras sinusales varían según la neumatización de sistema etmoido-esfenoidal ria reversible con los corticoides intravenosos, cuya patogenia se ha atribuido a la distensión del nervio óptico durante las maniobras quirúrgicas (32). DESCOMPRESIÓN DEL CANAL ÓPTICO La neuropatía óptica traumática (NOT) se presenta como una complicación muy grave de los traumatismos craneoencefálicos (TCE) con afectación directa o indirecta del nervio óptico, o bien de traumatismos orbitarios simples, la incidencia de todos los cuales ha aumentado durante los últimos años. Alrededor del 2% de los TCE cerrados presentan cierto grado de afectación del nervio óptico, supuestamente a nivel del canal óptico, con un pronóstico visual desfavorable (33). Sin embargo, no hay unanimidad con respecto al esquema terapéutico a seguir con estos pacientes (ver capítulo 13), ya que la eficacia de la cirugía mediante DCO para la NOT no está demostrada de forma incuestionable. Técnica Quirúrgica El canal óptico presenta una serie de características anatómicas fundamentales (34) (fig. 16-6), que se hallan 330 Neuropatías ópticas: diagnóstico y tratamiento Figura 16-7. Apertura sucesiva del etmoides anterior (A), del etmoides posterior (B) y del seno esfenoidal (C). (Modificada de Parra Duque (38)). Figura 16-8. Descompresión del canal óptico. A: nervio óptico; B: fresa diamantada. (Modificada de Parra Duque (38)). Figura 16-9. Distancias entre las arterias etmoidales y el agujero óptico. CLA: cresta lagrimal anterior; CLP: cresta lagrimal posterior; EA: arteria etmoidal anterior; EP: arteria etmoidal posterior; AO: agujero óptico. (Modificada de Parra Duque (38)). resumidas en la tabla 16-2. El nervio óptico está fijado al agujero óptico, de modo que un traumatismo frontal causante de una inclinación cefálica posterior brusca puede producir una lesión del propio nervio o de su vascularización. La inercia del globo ocular provoca un estiramiento del nervio, que se halla fijado en el agujero óptico, a cuyo nivel el anillo de Zinn y la grasa orbitaria actúan como amortiguadores, evitando la avulsión y la compresión nerviosa en muchos casos (41). El tratamiento quirúrgico se lleva a cabo bajo anestesia general, principalmente mediante 3 tipos de intervenciones: • Vía endoscópica trans-etmoido-esfenoidal. • Vía externa trans-órbito-etmoido-esfenoidal. • Vía combinada trans-conjuntival y endoscópica. Para la vía endoscópica trans-etmoido-esfenoidal se realiza una etmoido-esfenoidectomía (33,39,41,35,36) con preservación del cornete medio. Después de efectuada, se penetra en el esfenoides por su pared anterior a nivel de la última celda etmoidal, donde abomba la pared anterior del esfenoides, y se procede a la extirpación total de ésta (fig. 16-7). Una vez visualizado el tubérculo óptico, se elimina el hueso que rodea al nervio mediante fresado, desde la lámina papirácea en contacto con la periórbita (fig. 16-8), hasta alcanzar el tubérculo e identificar el anillo de Zinn. A partir de allí se prosigue la apertura del canal óptico de delante a atrás, exponiendo los 180° mediales del nervio, desde el vértice orbitario hasta el quiasma óptico. Algunos autores son además partidarios de practicar una apertura en la vaina del nervio óptico por su parte superior, evitando así la lesión de la arteria oftálmica, pero esta maniobra es motivo de controversia, debido al riesgo de provocar una fístula de LCR. Para la vía externa trans-órbito-etmoido-esfenoidal se realiza una incisión desde la parte más medial de la ceja, y se desciende hasta el nivel medio entre el canto orbitario medial y el dorso nasal. Una vez alcanzado el periostio, se despega éste en primer lugar y la periórbita en segundo lugar, evitando la salida de grasa. Se desplaza entonces el globo ocular hacia afuera, quedando así expuesta la sutura frontoetmoidal, lo que permite la identificación de la base del cráneo (fig. 16-9). A continuación, se penetra en el etmoides desde el unguis y se realiza la exéresis completa de la lámina papirácea, para seguir con una etmoidectomía anterior y posterior y se penetra también en el esfenoides. Tras completar la extirpación de la lámina papirácea se identifica el Capítulo 16. canal óptico y se procede a la exposición del nervio mediante el fresado de los 180° mediales del canal, de delante a atrás. Se prosigue con la exéresis del resto de la cubierta ósea (fig. 16-10) y, al igual que en la técnica precedente, se puede proceder o no a la apertura de la vaina, para finalmente cerrar en dos planos. Por último, la DCO por via combinada trans-conjuntival y endoscópica combina un abordaje externo transconjuntival con un abordaje transetmoido-esfenoidal por vía endoscópica. Se realiza una incisión medial en la conjuntiva posterior a la carúncula hasta llegar al hueso. A continuación, se procede sucesivamente a un despegamiento subperióstico, una cauterización de ambas arterias etmoidales y una perforación ósea justo por delante del anillo de Zinn. Luego se aborda el canal óptico por vía endonasal trans-etmoido-esfenoidal, tal y como se ha descrito antes, y por vía endoscópica se despega la órbita hasta exponer el nervio óptico, el cual puede ser visualizado en toda su longitud. Este procedimiento ofrece como ventajas la ausencia de incisiones faciales y el control tridimensional de la descompresión del nervio (37,38). Entre las técnicas descritas nosotros preferimos la vía externa, ya que permite un control más adecuado de las estructuras orbitarias así como una mejor y menos arriesgada identificación del nervio óptico, siendo además las complicaciones importantes muy poco frecuentes. A pesar de ello, en los casos en que la anatomía presenta una disposición favorable, y en manos de personal con experiencia, puede practicarse también la vía endoscópica endonasal. Indicaciones y Resultados La DCO está basada en el mismo principio que la descompresión del nervio facial tras haber sufrido un traumatismo, como consecuencia del cual el edema, un fragmento óseo o una hemorragia pueden provocar una lesión permanente por compresión. Para que la DCO sea beneficiosa debe realizarse bajo una técnica y dentro de un intervalo correctos, con el fin de revertir una neuropraxia producida por los mecanismos citados, y obtener una mejoría de la visión. A falta de unas conclusiones definitivas existen 4 actitudes diferentes, a saber, la abstención terapéutica (39,40), la megadosis de corticosteroides (41,42,43) (ver capítulo 15), los corticoides más cirugía (39,41,42,44) y la DCO quirúrgica inme- Procedimientos quirúrgicos en las neuropatías ópticas 331 Figura 16-10. Esquema que ilustra el abordaje externo transetmoido-esfenoidal. (Modificada de Weisman RA, Savino PJ. Otolaryngol Clin N Am 1991; 24: 56). diata. En este sentido, la presencia de una amaurosis inicial con evidencia clínica y radiológica de lesión del nervio óptico es, a criterio de algunos autores, indicación para realizar una DCO de entrada, con posibilidades de recuperación visual (41,44,45,46). Por el contrario, según otros autores la incapacidad para percibir la luz o para contar los dedos, así como la abolición de los PEV, harían infructuosa la DCO (47,48,49,50), con un riesgo añadido de complicaciones quirúrgicas. A pesar de toda esta controversia, existen evidencias a favor de que una descompresión del canal óptico practicada dentro de un período breve de tiempo en casos de neuropraxia inducida por compresión, puede ir seguida de una mejoría de la visión (39,45,35,51). Nosotros somos partidarios de realizar cirugía, siempre que esta pueda realizarse de forma precoz, a pesar de que en nuestra corta experiencia los éxitos han sido muy escasos. Entre las diferentes opciones, lo habitual es seguir esquemas terapéuticos similares o modificados del de Steinsapir (ver capítulo 13) (52) y, a este respecto, es probable que el tiempo y la gravedad de pérdida visual sean los factores pronósticos más determinantes (45,53). Los mejores resultados han sido obtenidos en casos operados durante las primeras 48 horas y en aquéllos en los que el paciente cuenta dedos o percibe la luz (39), pero en la mayoría de publicaciones el grado de mejora no se indica de forma clara y detallada. La realización de un estudio multicéntrico siguiendo unos criterios de selección uniformes podría ofrecer más datos que nos ayudaran a contestar a la pregunta sobre si la cirugía es beneficiosa para el tratamiento de la NOT y bajo qué premisas debe o no realizarse. No obs- 332 Neuropatías ópticas: diagnóstico y tratamiento tis de células gigantes (ACG) (ver capítulo 10). El diagnóstico de la ACG posee una importancia decisiva, ya que su pronóstico visual es muy grave, y el tratamiento corticoideo instaurado a tiempo puede evitar una pérdida irreversible de la visión. Las diferentes arterias originadas a partir del arco aórtico son afectadas de forma segmentaria por el proceso inflamatorio en el curso de la ACG, tal y como han demostrado los estudios necrópsicos (58). Técnica Quirúrgica Figura 16-11. Trayecto de la arteria temporal superficial (T). Por delante del conducto auditivo externo se produce su división en una rama frontal (F) y otra rama parietal (P). tante, el International Optic Nerve Trauma Study fue interrumpido a los 2 años de su comienzo, debido a la imposibilidad para randomizar los casos estudiados (53). Además de la NOT, se han propuesto otras indicaciones para la DCO, con aparentes buenos resultados, como es el caso de la compresión del nervio óptico por procesos neoplásicos (54), por displasia fibrosa o por osteopetrosis (55). En esta última enfermedad, se ha constatado asimismo la regresión de la estenosis del canal óptico después de practicar un trasplante de médula ósea (56). Complicaciones Las complicaciones de la DCO son poco frecuentes. La lesión del contenido orbitario puede provocar afectación de los músculos oculares extrínsecos con diplopia consecutiva. El hematoma a tensión es la complicación indirecta más frecuente, y si no se reconoce y trata de forma precoz puede provocar una pérdida grave de la visión (52). La clínica consiste en equimosis conjuntival, exoftalmos y elevación de la presión intraocular. Por último, las lesiones de la arteria carótida interna provocan hemorragias inmediatas fatales (57), fístulas carótido-cavernosas o aneurismas intracavernosos. BIOPSIA DE LA ARTERIA TEMPORAL La biopsia practicada sobre la arteria temporal superficial constituye un procedimiento destinado a obtener la verificación anatomopatológica de la arteri- La arteria temporal superficial es una rama terminal de la carótida externa que se origina a nivel de la glándula parótida, sigue un trayecto ascendente (fig. 16-11) y se divide a su vez en dos ramas, parietal y frontal, con posibles variaciones anatómicas (59). Para la obtención de la BAT, tras rasurar la zona operatoria, es preciso en primer lugar identificar el trayecto del vaso que se va a biopsiar, mediante visualización directa o palpación, y a este respecto, la rama frontal es la más asequible. Una vez identificada la arteria, se señala un trazo de unos 3 cm sobre la piel con la ayuda de un marcador estéril. Cuando ello no es factible, otra posibilidad es empezar la marca 1 cm por delante del trago y prolongarla unos 3 cm hacia arriba y algo adelante, lo que permite casi siempre encontrar algún tramo arterial transversal (60). Se procede después a la preparación del campo operatorio y a la infiltración anestésica de la piel y del tejido subcutáneo, a ambos lados del trayecto marcado. A continuación, se efectúa una incisión de la piel y de la grasa subcutánea (fig. 16-12A) hasta que es visible la fascia del músculo temporal. Se practica entonces una disección (fig. 16-12B) para individualizar el trayecto real de la arteria, que aparece como una estructura cilíndrica de 2-3 mm de diámetro y color pálido o rosado, al contrario de la vena, cuya coloración es púrpura. La arteria se liga mediante dos suturas con la máxima separación posible (fig. 16-13A), a fin de realizar luego la excisión del fragmento comprendido entre ambas (fig. 16-13B), y la muestra biópsica obtenida se remite al laboratorio en un frasco con formol. Finalmente, se completa la hemostasia, se sutura la herida cutánea y se coloca un vendaje compresivo, que se mantendrá durante un mínimo de 24 horas, con el fin de evitar un sangrado tardío a través de la herida. Capítulo 16. Figura 16-12. Fotografía quirúrgica de la técnica biópsica. (A) Incisión con bisturí en el extremo proximal de la marca cutánea e introducción de una pinza mosquito en la herida, cuyos brazos se abren, a fin de proteger los vasos y evitar su sangrado al proseguir la incisión. (B). Disección con tijera roma a partir de la fascia del músculo temporal hasta la visualización directa de la arteria temporal superficial, liberándola de sus adherencias a los tejidos circundantes. Procedimientos quirúrgicos en las neuropatías ópticas 333 Figura 16-13. Fotografía quirúrgica de la técnica biópsica (continuación). Ligadura de la arteria mediante dos suturas con material no reabsorbible, colocando primero la sutura proximal y luego la distal, cuya separación mínima ha de ser de 2 cm, en razón del carácter segmentario de la arteritis (A). Excisión del fragmento de la arteria comprendido entre las dos ligaduras, con el empleo de una tijera, primero por el cabo distal y luego por el proximal, cauterizando a continuación ambos cabos (B). Recientemente se ha introducido la utilización de la ecografía duplex en color para detectar la presencia de un edema de la pared arterial consecutivo a la ACG (61), como exploración coadyuvante a la biopsia (fig. 16-14). Indicaciones y Resultados En todos los casos sospechosos de ACG está indicada la práctica de una BAT. Las manifestaciones oftalmológicas más importantes de esta afección se reseñan en la tabla 16-3. Si los mencionados trastornos afectan a pacientes mayores de 50 años y se acompañan de síntomas generales (claudicación mandibular, cervicalgia, dolor a la palpación, etc.) y/o de datos de laboratorio alterados (aumento de la PCR y de la VSG, sobre todo), el cuadro clínico es sugestivo de arteritis (62). De especial dificultad diagnóstica son los casos conocidos como arteritis oculta de la temporal, en los que la afectación oftalmológica no está acompañada de sintomatología sistémica (63). La BAT permite obtener una confirmación por anatomía patológica (fig. 16-15) de la sospecha diagnóstica basada en los datos obtenidos mediante la historia y los exámenes clínicos. Cuando coinciden la cefalea, la claudicación mandibular y el dolor a la palpación temporal, la especificidad es del 95% respecto al diagnóstico histológico, mientras que la presencia de uno de los 3 tras- Figura 16-14. Ecografía duplex en color de la arteria temporal. En casos de arteritis se constata un halo hipoecogénico a nivel de la pared arterial (A), correspondiente al edema inflamatorio, que no se observa en los individuos normales (B). (Caso del Dr. R. Vila. Barcelona). Tabla 16-3. Manifestaciones oftalmológicas de la arteritis de la temporal • Amaurosis fugax • Pérdida visual por NOIA o NOIP, oclusión arteriolar retiniana, isquemia coroidea o infarto occipital • Diplopia por paresia de un nervio motor ocular u oftalmoplejia internuclear • Alteraciones pupilares • Síndrome ocular isquémico 334 Neuropatías ópticas: diagnóstico y tratamiento en los casos de arteritis activa, el intervalo aproximado trascurrido entre el comienzo de la corticoterapia y la obtención de la BAT había sido de 7 días. Como norma, se recomienda practicar la biopsia arterial durante las primeras 2 semanas del tratamiento con los corticoides. En raras ocasiones, la BAT ha aportado un diagnóstico diferente de la ACG, habiéndose descrito un caso en el que aparecieron células metastásicas procedentes de un adenocarcinoma pulmonar (68). Complicaciones Figura 16-15. Histopatología de una arteritis de la temporal. (A) Infiltrado inflamatorio crónico en la arteria y a su alrededor con presencia de células gigantes. (B) Disrupción de la lámina elástica en la pared arterial. tornos posee una sensibilidad del 100% (64). Por lo que se refiere a los datos de laboratorio, la especificidad de la PCR y la VSG combinadas es del 97%, de acuerdo con Hayreh (62), en tanto que la sensibilidad de la primera de ellas es del 100% para el diagnóstico de ACG. Dado el carácter segmentario de la arteritis, se aconseja practicar para el examen microscópico secciones perpendiculares a la luz arterial, a intervalos de 0,25 a 0,5 mm (65). En cuanto a la BAT contralateral, los diversos estudios efectuados han demostrado un promedio de 4% de resultados anatomopatológicos asimétricos, por lo que algunos autores recomiendan la práctica sistemática de biopsias bilaterales (66). En casos de sospecha clínica clara sin confirmación histológica está indicado proseguir el tratamiento, siempre después de efectuar un diagnóstico diferencial con otros procesos, como infecciones, colagenosis, neoplasias o IRC (67). Con arreglo a las características de los hallazgos biópsicos, se ha establecido una distinción entre la arteritis activa y la arteritis resuelta (65). Corresponden a la primera variedad los infiltrados de linfocitos, macrófagos y células gigantes multinucleadas, mientras que caracterizan a la segunda la fibrosis de las túnicas media y adventicia. McDonnell observó que, La BAT es una técnica relativamente inocua. Además de los posibles efectos indeseados comunes a otros procedimientos efectuados bajo anestesia local (v.gr: síncope vagal, reacciones alérgicas), la principal complicación descrita ha consistido en un AVC (69). También se pueden producir trastornos locales diversos, tales como lesión del nervio facial (70), úlceras cutáneas y hemorragia intra o postoperatoria. CONCLUSIONES En síntesis, la fenestración de la vaina del nervio óptico es hoy en día un método aceptado para descomprimir el nervio óptico en la HTI con pérdida importante o progresiva de función visual. A su vez, la eficacia de la descompresión del canal óptico para el tratamiento de la NOT sigue siendo en la actualidad motivo de controversia, al igual que sucede con las demás alternativas terapéuticas para esta afección. Finalmente, la biopsia de la arteria temporal es hoy por hoy el único método que permite obtener un diagnóstico de certeza en la neuropatía óptica isquémica consecutiva a la ACG. BIBLIOGRAFÍA 1. Satorre J, Vila J, Mateos JM et al. Fenestración de la vaina del nervio óptico. Arch Soc Esp Oftalmol 1995; 68: 27586. 2. De Wecker L. An incision of the optic nerve in cases of neuroretinitis. First Ophthalmol Congress Report 1872; 4: 11-4. 3. Hayreh SS. Pathogenesis of oedema of the optic disc. Doc Ophthalmol 1968; 24: 289-411. Capítulo 16. 4. Corbett JJ, Savino PJ, Thompson HS et al. Visual loss in pseudotumor cerebri. Arch Ophthalmol 1982; 39: 461-74. 5. Kelman SE, Sergott RC, Cioffi GA et al. Modified optic nerve decompression in patients with functioning lumboperitoneal shunts and progressive visual loss. Ophthalmology 1991; 98: 1449-53. 6. Brouman ND, Spoor TC, Ramocki JM. Optic nerve sheath decompression for pseudotumor cerebri. Arch Ophthalmol 1988; 106: 1378-83. 7. Sergott RC, Savino PJ, Bosley TM. Modified optic nerve sheath decompression provides long-term visual improvement for pseudotumor cerebri. Arch Ophthalmol 1988; 106: 1384-90. 8. Corbett JJ, Nerad JA, Tse DT et al. Results of optic nerve sheath fenestration for pseudotumor cerebri. The lateral orbitotomy approach. Arch Ophthalmol 1988; 106: 1391-7. 9. Keltner JL. Optic nerve sheath decompression. How does it work? Has its time come? Arch Ophthalmol 1988; 106: 1365-9. 10. Liu GT, Volpe NJ, Galetta SL (eds.). Neuro-Ophthalmology. Diagnosis and Management. Philadelphia: Saunders, 2001: p. 211-3. 11. Davidson SI. A surgical approach to pleocephalic disc oedema. Trans Ophthalmol Soc UK 1969; 89: 669-90. 12. Keltner JL, Albert DM, Lubow M et al. Optic nerve decompression. A clinical pathologic study. Arch Ophthalmol 1977; 95: 97-104. 13. Tsai JC, Petrovich MS, Sadun AA. Histopathological and ultrastructural examination of optic nerve sheath decompression. Br J Ophthalmol 1995; 79: 182-5. 14. Sallomi D, Taylor H, Hibbert J et al. The MRI appearance of the optic nerve sheath following fenestration for benign intracranial hypertension. Eur Radiol 1998; 8: 1193-6. 15. Seiff S, Shah L. A model for the mechanism of optic nerve sheath fenestration. Arch Ophthalmol 1990; 108: 1326-9. 16. Galbraith JEK, Sullivan JH. Decompression of the perioptic meninges for relief of papilledema. Am J Ophthalmol 1973; 76: 687-92. 17. Rootman J, Stewart B, Goldberg RA (eds.). Orbital Surgery. A conceptual approach. Philadelphia: LippincottRaven, 1995: p. 250-5. 18. Pelton RW, Patel BCK. Superomedial lid crease approach to the medial intraconal space. Ophthalmol Plast Reconstr Surg 2001; 17: 241-53. 19. Kersten RC, Kulwin DR. Optic nerve sheath fenestration through a lateral canthotomy incision. Arch Ophthalmol 1993; 111: 87-4. 20. Joos KM, Shen JH, Shetlar DJ et al. Optic nerve sheath fenestration with a novel wavelength produced by the free electron laser (FEL). Lasers Surg Med 2000; 27: 191-205. 21. Guy J, Johnston PK, Corbett JJ et al. Treatment of visual loss in pseudotumor cerebri associated with uremia. Neurology 1990; 40: 28-32. 22. Spoor TC, McHenry JG. Long-term effectiveness of optic nerve sheath decompression for pseudotumor cerebri. Arch Ophthalmol 1993; 111: 632-5. Procedimientos quirúrgicos en las neuropatías ópticas 335 23. Banta JT, Farris BK. Pseudotumor cerebri and optic nerve sheath decompression. Ophthalmology 2000; 107: 1907-12. 24. Spoor TC, Ramocki JM, Madion MP et al. Treatment of pseudotumor cerebri by primary and secondary optic nerve sheath decompression. Am J Ophthalmol 1991; 112: 17785. 25. Mauriello JA, Shaderowfsky P, Gizzi M et al. Management of visual loss after optic nerve sheath decompression in patients with pseudotumor cerebri. Ophthalmology 1995; 102: 441-5. 26. Sergott RC. Optic nerve sheath decompression: history, techniques and indications. Int Ophthalmol Clin 1991; 31: 71-81. 27. Garrity JA, Herman DC, Imes R et al. Optic nerve sheath decompression for visual loss in patients with acquired immunodeficiency syndrome and cryptococcal meningitis with papilledema. Am J Ophthalmol 1993; 116: 472-8. 28. Irvine AR, Crawford JB, Sullivan JH. The pathogenesis of retinal detachment with mornig glory disc and optic pit. Retina 1986; 6: 146-50. 29. Ischemic Optic Neuropathy Decompression Trial Research Group. Optic nerve decompression surgery for nonarteritic anterior ischemic optic neuropathy (NAION) is not effective and may be harmful. JAMA 1995; 272: 625-32. 30. Dayan MR, Elston JS, McDonald B. Bilateral lymphomatous optic neuropathy diagnosed on optic nerve biopsy. Arch Ophthalmol 2000; 118: 1455-7. 31. Plotnik JL, Kosmorsky GS. Operative complications of optic nerve sheath decompression. Ophthalmology 1993; 100: 683-90. 32. Brodsky MC, Rettele GA, Rock L. Protracted postsurgical blindness with visual recovery following optic nerve sheath fenestration. Arch Ophthalmol 1998; 116: 107-9. 33. Sofferman RA. Sphenoethmoid approach to optic nerve decompression. Operative Technique. Otolaryngol Head Neck Surg 1991; 2: 150-6. 34. Stammberger H, Kennedy DW. Paranasal sinuses: anatomic terminology and nomenclature. The Anatomic Terminology Group. Ann Otol Rhinol Laryngol 1995, suppl. 104: 7-16. 35. Girard BC, Bouzas EA, Lamas G et al. Visual improvement after transetmoid-sphenoid decompression in optic nerve injuries. J Clin Neuroophthalmol 1992; 12: 142-8. 36. Luxenberger W, Stammberger H, Jebeles JA et al. Endoscopic optic nerve decompression: the Graz experience. Laryngoscope 1998; 108: 873-82. 37. Kuppersmith RB, Alford EL, Patrinely JR et al. Combined transconjuctival/intranasal endoscopic approach to the optic canal in traumatic optic neuropathy. Laryngoscope 1997; 107: 311-5. 38. Blanco G, Patrinely JR, Soparkar CNS, et al. Traumatismos orbitarios. En: Suárez C (ed.). Tratado de Otorrinolaringología y Cirugía de cabeza y cuello. Guadalajara: Proyectos Médicos, 1999: p. 2310-27. 39. Lubben B, Stoll W, Grozenbach U. Optic nerve decompression in the comatose and conscious patients after trauma. Laryngoscope 2001; 111: 320-8. 336 Neuropatías ópticas: diagnóstico y tratamiento 40. Levin LA, Joseph MP, Rizzo JF et al. Optic canal decompression in indirect optic nerve trauma. Ophthalmology 1994; 101: 566-9. 41. Parra Duque LA. Endoscopic optic nerve decompression in traumatic optic neuropathy. En: Stamm AC, Draft W (eds.). Micro-endoscopic surgery of the paranasal sinuses and skull base. Berlin: Springer, 2000: p. 441-9. 42. Spoor TC, Mc Henry J. Management of TON. J Craniomaxillofac Trauma 1996; 2: 14-26. 43. Chen HY, Tsai RK, Wang HZ. Intravenous methyl-prednisolone in treatment of traumatic optic neuropathy. Kaohsiung J Med Sci 1998; 14: 577-83. 44. Kountakis SE, Maillard AA, El-Harazi SM et al. Endoscopic optic nerve decompression for traumatic blindness. Otolaryngol Head Neck Surg 2000; 123: 34-7. 45. Li KK, Teknos TN, Lai A et al. Traumatic optic neuropathy: result in 45 consecutive surgically treated patients. Otolaryngol Head Neck Surg 1999; 120: 5-11. 46. Mine S, Yamakami I, Yamamura A et al. Outcome of traumatic optic neuropathy. Comparison between surgical and nonsurgical treatment. Acta Neuro-Chirurgica (Viena) 1999; 141: 27-30. 47. Cook MW, Levin LA, Joseph MP et al. Traumatic optic neuropathy. A meta-analysis. Arch Otolaryngol Head Neck Surg 1996; 122: 389-92. 48. Schmidtbauer JM, Muller E, Hoh H et al. Early trans-sphenoid decompression in indirect traumatic optic neuropathy. HNO 1998; 46: 152-6. 49. Maurer J, Hinni M, Mann et al. Optic nerve decompression in trauma and tumor patients. Eur Arch Otorhinolaryngol 1999; 256: 341-5. 50. Lieb WE, Maurer J, Muller-Forell W et al. Microsurgical endonasal decompression in traumatic and neoplastic optic nerve compression. Opthalmologie 1996; 93: 194-8. 51. Issikawa A, Okabe H, Nakagawa Y et al. Treatment and following-up of traumatic optic neuropathy. Neuroopthalmology (Japón) 1996; 13: 175-83. 52. Steinsapir KD, Goldberg RA. Traumatic optic neuropathy. Surv Ophthalmol 1994; 38: 487-518. 53. Levin LA, Beck R, Joseph M et al. The treatment of traumatic optic neuropathy. Ophthalmology 1999; 106: 1268-77. 54. Li KK, Lucarelli MJ, Bilyk JR et al. Optic nerve decompression for compressive neuropathy secondary to neoplasia. Arch Otolaryngol Head Neck Surg 1997; 123: 425-9. 55. Hwang JM, Kim IO, Wang KC. Complete visual recovery in osteopetrosis by early optic nerve decompression. Pediatr Neurosurg 2000; 33: 328-32. 56. Kerr NC, Wang WC, Mohadjer Y et al. Reversal of optic canal stenosis in osteopetrosis after bone marrow transplant. Am J Ophthalmol 2000; 130; 370-2. 57. Bihat NJ (ed.). Endoscopic sinus surgery: new horizons. San Diego-London: Singular Publishing Group, 1997: p. 162-6. 58. Wilkinson IMS, Ross Russell RW. Arteries of the head and neck in giant cell arteritis. A pathological study to show the pattern of arterial involvement. Arch Neurol 1972; 27: 378-91. 59. Marano SR, Fisher DW, Gaines C et al. Anatomic study of the superficial temporal artery. Neurosurgery 1985; 16: 786-9. 60. Tomsak RL. Superficial temporal artery biopsy. A simplified technique. J Clin Neuroophthalmol 1991; 11: 202-4. 61. Schmidt WA, Kraft HE, Vorpahl K et al. Color duplex ultrasonography in the diagnosis of temporal arteritis. N Engl J Med 1997; 337: 1336-42. 62. Hayreh SS, Podhadjsky PA, Raman R et al. Giant cell arteritis: Validity and reliability of various diagnostic criteria. Am J Ophthalmol 1997; 123: 285-96. 63. Hayreh SS, Podhadjsky PA, Zimmerman B. Occult giant cell arteritis: Ocular manifestations. Am J Ophthalmol 1998; 125: 521-6. 64. Vilaseca J, González A, Cid MC et al. Clinical usefulness of temporal artery biopsy. Ann Rheum Dis 1987; 46: 282-5. 65. McDonnell PJ, Moore GW, Miller NR et al. Temporal arteritis. A clinicopathologic study. Ophthalmology 1986; 93: 518-30. 66. Miller NR. Giant cell arteritis. J Neuroophthalmol 2000; 20: 219-20. 67. Hedges TR, Gieger GL, Albert DM. The clinical value of negative temporal artery biopsy specimens. Arch Ophthalmol 1983; 101: 1251-4. 68. Bhatti MT, Furman J, Gupta S et al. Superficial temporal artery biopsy diagnostic for lung carcinoma. Am J Ophthalmol 2001; 132: 135-8. 69. Fisher CM. Discusión de: Schlezinger NS, Schatz NJ. Giant cell arteritis (temporal arteritis). Trans Am Neurol Assoc 1971; 96: 12. 70. Scott KR, Tse DT, Kronisch JW. Temporal artery biopsy technique: a clinico-anatomical approach. Ophthalmic Surg 1991; 22: 519-25.