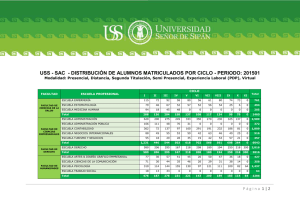
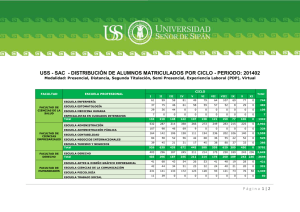
INFORME TECNICO Dr. Severin
Anuncio

“PF2” Una sustancia natural obtenida de la planta Caléndula Officinalis y desarrollada en laboratorio ha demostrado ser un potenciador del sistema inmunológico y ha conseguido reducir la formación de células cancerosas. La “PF2”, es la responsable, según las observaciones, de la reducción del tamaño de tumores que parecían incurables. Ha tenido éxito en enfermos terminales (casos anecdóticos) y es capaz, además, de reducir los efectos secundarios de la quimioterapia. El Dr. José Manuel Frías, a mediados de los 90, descubrió que una molécula, la “PF2”, era muy activa contra el cáncer. Frías puso su descubrimiento en manos del catedrático y profesor de Farmacología y Medicina de la Universidad de Illinois (Chicago) John Pezzuto. El doctor Pezzuto y su equipo se han encargado de desarrollar el estudio en torno a sus propiedades anticancerígenas para crear con ella un mecanismo específico para el tratamiento del cáncer. La molécula “PF2” se ha revelado como un potente inmunomodulador, capaz de potenciar el sistema inmunológico humano, concretamente los linfocitos. La potenciación del sistema inmunológico supone por sí misma un arma contra el cáncer, capaz, según se ha comprobado, de reducir el crecimiento de tumores aparentemente incurables y de frenar el desarrollo de metástasis, es decir, la aparición de nuevos tumores diseminados en el cuerpo del paciente oncológico avanzado. La potenciación del sistema inmunológico –que con la “PF2” se expresa en la potenciación de los linfocitos-- permite optimizar además los tratamientos tradicionales ya que facilita seguir con los ciclos de quimioterapia o radioterapia, eliminando sus efectos secundarios, que pueden ser altamente nocivos, y posibilita la continuidad y la repetición de las terapias en pacientes que de otro modo no podrían resistirlas más. "La “PF2” tiene una intensa actividad antitumoral indirecta –explica John Pezzuto-estimulando el sistema inmunológico, reduciendo incluso el tamaño del tumor cuando éste está ya formado. Al ser de origen natural no presenta toxicidad y es además capaz de amortiguar los efectos secundarios de la químio y la radioterapia." Según los investigadores, la “PF2” estimula la producción de linfocitos, monocitos y neutrófilos, las tres principales familias celulares del sistema inmunológico que deben ocuparse de impedir el crecimiento de un tumor canceroso. Al mismo tiempo, añade, detiene y reduce la formación del tumor. “Eso lo convierte en un oncolítico indirecto (liquidador del cáncer), ya que provoca una reducción de las células cancerosas que invaden un órgano, al tiempo que potencia las del sistema inmunológico", explicó Eugenii Severin, director del Centro de Investigación de Diagnosis y Terapia Molecular, de Moscú. "La “PF2” es un inmunomodulador muy eficaz". "Supimos –explicó el profesor Pezzuto– que la “PF2” había dado resultados positivos en enfermos terminales e investigamos cómo actúa esa sustancia, descubriendo que lo que hacía era estimular el sistema inmunológico. Ahora trabajamos para llegar a su aprobación como medicamento por la Food and Drug Administration, la FDA". Pezzuto se ha referido también al tema en los siguientes términos: "En EEUU solo el 2% de las personas que sufren cánceres metastásicos, como el de pulmón, logran superar los cinco años de vida". Antes había dicho que "no se conocen vacunas contra el cáncer y la quimioterapia generalmente fracasa, al menos en condiciones de malignidad y metástasis". La “PF2”, por su poder inmunomodulador, se perfila además como un elemento capaz no solo de reducir tumores y metástasis, sino que por su capacidad de potenciar la inmunidad natural del cuerpo, podría ser lo más parecido que existe hasta la fecha a una vacuna contra el cáncer. Pezzuto hizo hincapié en la importancia de disponer entre el arsenal terapéutico de un producto que tuviera ese efecto protector. "Tras un procedimiento especial de extracción, la “PF2” ha demostrado ser esperanzadora en el tratamiento de pacientes con cáncer e incluso tener una acción profiláctica que podría desembocar en una futura vacuna contra el cáncer, lo que haría desaparecer el miedo al factor hereditario". El científico relató como las investigaciones que se hicieron poniendo en contacto el producto liofilizado con una gran variedad de cultivos de células cancerosas humanas no ofrecieron como resultado una actividad inhibitoria del crecimiento, como cabría esperar de cualquier agente estándar de quimioterapia contra el cáncer, sin embargo "se observó una importante estimulación linfocítica que sugirió una actividad inmunomoduladora". Los trabajos prosiguieron aplicando a la sustancia un fraccionamiento por bioactividad y utilizando la estimulación linfocítica como referente se identificaron moléculas de polisacáridos como principios activos y "se aisló un componente clave, llamado “PF2”, cuya estructura primaria quedó clarificada y se examinó detalladamente su potencial para estimular la proliferación de células de inmunorespuesta". Los investigadores vieron como esa estimulación era –en las células aisladas del bazo de un ratón– veinte veces mayor que el estimulador que se había utilizado como control, la Concanavalina A, una proteína que es un inmunomodulador que solo se puede utilizar en los laboratorios por presentar una alta toxicidad para los seres humanos. La estimulación crecía si se coadyuvaba al “PF2” con un coestimulador. "Estos resultados –ha dicho el doctor John Pezzuto a la comunidad médica– sugieren que el potencial de la “PF2” aumenta la respuesta inmunológica en combinación con la propia respuesta del sistema inmunológico humano. En resumen, la “PF2” parece útil como tratamiento contra el cáncer." Y no solo contra el cáncer, ya que su acción de potenciación del sistema inmunológico es una esperanza contra las infecciones más graves. "La “PF2” –concluyó el profesor americano– como antitumoral indirecto es compatible con los tratamientos de quimioterapia y radioterapia. Además es de utilidad para la reducción de los efectos secundarios de estas terapias. Por lo tanto, podría ser de utilidad para aquellos pacientes oncológicos que presentan intolerancia a los tratamientos tradicionales." Para que la “PF2” sea considerada un medicamento han de pasar varios años. Pezzuto espera que en cinco años el proceso haya acabado y la FDA dé su autorización. La investigación con enfermos de cáncer ha comenzado a ser aplicada a enfermos, en varias clínicas de Moscú, y posteriormente se ha utilizado en EEUU y España a más de 3.000 personas. La ausencia de toxicidad en el tratamiento prolongado con la “PF2”, comprobada hasta ahora en modelos animales, podría permitir administrar la sustancia en altas concentraciones si la expansión y agresividad del tumor lo requieren, añadieron los investigadores. Caracterización Estructural del Polisacárido “PF2” (Inmunoestimulador) Extracto El cáncer metastático es una enfermedad recalcitrante con limitadas opciones terapéuticas. De los tratamientos actuales los productos naturales juegan un papel dominante y las terapias alternativas o complementarias están siendo investigadas con mayor intensidad. Uno de estos productos es la nueva molécula “PF2”, extraída mediante un novedoso proceso patentado a nivel mundial de la Caléndula Officinalis L. (Asteraceae). Este material ha sido usado para el tratamiento de cánceres humanos con algunos éxitos. La investigación del producto liofilizado no ha revelado una actividad inhibitoria de crecimiento directo con una variedad de células de cáncer humano, pero se ha observado estimulación linfocítica, que nos sugiere actividad inmunomoduladora. El fraccionamiento guiado por bioactividad condujo a la identificación de polisacáridos como componentes activos, uno de los cuales estaba compuesto por a-L-arabinofuranosa, bD-galactopyranosa, y a-L-rhamnopyranosa, con un peso molecular de aproximadamente 480,000 Da. Las correlaciones de amplio rango entre el C-1 y C-6 de Gal y Gal’ en el espectro HMBC sugirieron una base b-D-galactopyranosa con 1® 6. Ara fue ligada en 1® 3 a Gal, como se sugiere por la correlación de amplio rango entre el C-1 de Ara y el C-3 de Gal. Del espectro 1H NMR, el ratio de tipos de azúcar fue 3:1:2:2:1 (Ara:Ara’:Gal:Gal’:Rha) de acuerdo a los valores de integración de los picos de protones. Claramente, se requiere trabajo adicional para caracterizar completamente el valor terapéutico de la “PF2”. De todos modos, los resultados actuales otorgan una explicación creíble de cómo esta sustancia puede funcionar como agente antitumoral en un marco auxiliar. Introducción A pesar de los años de búsqueda intensiva, el cáncer se mantiene como la mayor causa de muerte en el mundo. Una vez que la enfermedad ha alcanzado un estado de metástasis maligno, las opciones de tratamiento son limitadas y el grado de supervivencia es bajo. Como resultado, además de los programas de desarrollo de fármacos estándares, se ha puesto mayor énfasis en pasos terapéuticos tradicionales o alternativos. Varios informes de naturaleza anecdótica han indicado una prometedora actividad antitumoral en pacientes diagnosticados con varios tipos de cáncer. Basado en estos informes, hemos investigado el potencial biológico de este material. Los esfuerzos iniciales se han centrado en una creciente actividad inhibitoria en células cancerígenas humanas en cultivo. De todos modos, no se ha observado una actividad significante. Por lo tanto, hemos investigado el potencial inmunomodulador, empleando un modelo in Vitro. Los resultados los exponemos en el presente estudio. Materiales y Métodos Esta sustancia en estudio, es un producto acuoso que se prepara del material de la planta usando un determinado proceso descubierto por el Dr. José M. Frías. Para el presente análisis, el extracto acuoso (120 L) fue liofilizado para conseguir un polvo de color tostado (800 g). Resultados y Discusión Basado en los informes sobre el potencial de la “PF2”, como mediador de efectos terapéuticos en pacientes de cáncer, hemos elegido evaluar el potencial biológico de este material en varios sistemas modelos. Primero, ya que es bien conocido que los agentes anti cáncer efectivos tales como paclitaxel, vinblastine, y camptothecin son potentes inhibidores de proliferación de células, la “PF2” se evaluó por actividad antiproliferativa con un panel de células cancerosas humanas. Cuando se probó con una variedad de tipos de células (pecho, colon, próstata, melanoma, carcinoma de pulmón de células escamosas, etc.), el material era inactivo para concentraciones relativamente altas (p. ejemplo, 100 mg/mL) (datos no mostrados). Por lo tanto, para explorar la posibilidad de los efectos indirectos, el material de test se evaluó como potencial inmunoestimulador empleando células aisladas de bazo de ratón. Se observó una significante actividad, y este sistema de prueba se empleó como guía para dirigir el aislamiento de los constituyentes activos. Según lo dicho, se procedió con el fraccionamiento por bioensayo de un extracto acuoso de la sustancia en estudio, a través de una serie de precipitaciones de MeOH, se repitieron los pasos de solubilización y centrifugación, y cromatografía de las fracciones activas sobre columnas de filtración de gel Sephadex, llevó al aislamiento de un polisacárido activo, denominado polisacárido A (1). La hidrólisis de este polisacárido, seguido por un análisis de placa fina de celulosa (TLC), llevó a la identificación de a-Larabinofuranosa, b-D-galactopyranosa, y a-L-rhamnopyranosa como azúcares compuestos. Más adelante, usando dextrans con un rango de diferentes pesos moleculares como estándares de referencia, el polisacárido aislado se determinó que tenía un peso molecular de 480,000 Da por comparación con columnas de filtración con gel. Un completo estudio de respuesta a dosis se realizó para establecer el potencial del polisacárido A (1) para estimular la proliferación de células con inmunorespuesta aisladas del bazo del ratón. En ausencia de un coestimulador (p. ejemplo, Con A), de concentraciones en el rango 0.1-100 mg/mL, se observó estimulación dependiente de la dosis hasta un máximo de más de 20 veces mayor que el control. En relación a otros productos naturales no tóxicos evaluados en nuestro laboratorio, esta respuesta fue altamente significativa y potente. La respuesta obtenida en presencia de una concentración fija del co-estimulador (Con-A) fue también notable. Bajo estas condiciones experimentales, se observó que la estimulación incrementaba de una manera dependiendo de la dosis de más de 100% del control. Estos datos sugirieron que el potencial del polisacárido A permitían aumentar la respuesta inmune en combinación con el propio sistema del huésped. En resumen, la “PF2” se pronostica como un útil tratamiento para el cáncer, pero se necesitan posteriores ensayos preclínicos y clínicos para establecerse desde un punto de vista aceptable científicamente. De todos modos, el presente informe pone en evidencia que la “PF2” es capaz de mediar una respuesta que pueda ser muy útil para una variedad de enfermedades humanas, incluyendo el cáncer. La inmunoterapia es un área de gran interés actual, de una forma directa para la reducción de la carga de los tumores, o para restaurar la inmunodeficiencia que resultan de las agentes estándar de quimioterapia. Aunque queda por probar, basándonos en los datos de este informe de ensayo “In Vitro” y el modo de acción anticipado, parece probable que se pueda crear un régimen de tratamiento saludable de la “PF2” en seres humanos. Diseñando ensayos clínicos de este tipo, será importante incluir preparaciones estandarizadas para control de calidad y resultados reproducibles, y comúnmente se estandarizan estas preparaciones en base a un componente activo único. El Polisacárido A sería un buen candidato para usarse con esta capacidad. Reconocimientos Los autores están agradecidos al Dr. Fang Ji-Nian, Instituto Shangai de Materia Medica, Academia China de la Ciencia, Shangai, PRC, por la determinación del peso molecular y al Dr. José M. Frías, por suministrar el extracto acuoso del que se deriva la “PF2”. Referencias: •1 Richardson, MA, Sanders T, Palmer JL, Greisinger A, Singletary SE Complementary/alternative medicine use in a comprehensive cancer center and the implications for oncology. J Clin Oncol 2000 Jul 18:2505-14. •1 Pezzuto, J.M: Plant-derived Anticancer Agents, Biochen, Pharmacol., 53: 121- 133,1997. •1 Likhitwitayawuid, k., Angerhofer, C.k., Cordell, G.A., Pezzuto, J.M., and Ruangrungsi, N. Cytotoxic and Antimalarial Bisbenzylisoquinole Alkaloids from Stephania erecta. J. Nat.Prod.56: 30-38, 1993. •1 Mar, W., Tan, G.T., Cordell, G.A., Pezzuto, J.M., Jurcic, K,. Redl, K,.Steinke, B., and Wagner, H. Biological Activity of Novel Macrocyclic Alkaloids (Budmunchiamines) from Alibizia amara detected on the Basis of Interaction with DNA. J.Nat. Prod.,54: 1531-1542, 1991. •1 Calis I., Yürüker, A., Tasdermir, Wright, A.D., Sticher, O., Luo, Y.-D and Pezzuto, J.M. Ct¡yckiartane Triterpene Glycosides from melanophruruis.Planta Med., 63: 183-186, 1997. the Roots of Astragalus TABLA 1. 13 CNMR datos del polisacarido A (1) (D2O, referidos a DSS, 125 MHz) Sugar linkages C-1 C-2 C-3 C-4 C-5 C-6 Araf-(1-» 110.1 85.0d 74.5d 86.7d 63.2t -- 84.7d ->3)-Araf-(1 -» 119.d 84.0d 79.4d 86.5d 63.9t -- 83.9d 63.7t 83.7d 64.8t ->6)-Galp-(1-> 106.1d 72.9d 75.3d 72.2d 76.4d 69.2t ->3)-Galp-(1->) 105.9d 73.5d 82.8d 73.5d 76.1d 69.2t ->6) 105.8d Rhap-81-> 100.2d 72.2d 73.5d 72.5d 71.1d 19.2q TABLA 2 ESTIMULACIÓN DE PROLIFERACIÓN LINFOCITO MEDIADA POR EL POLISACARIDO A(1) dpm +/- S.D. (% incrementado) Conc. No Con A Con Con.A (8mg/ml) 0.1 330 +/- 34 (4) 44820 +/- 2501(4) 1 795 +/- 57(152) 71509 +/- 8533(66) 5 1453 +/- 437(360) 74248 +/- 5630(73) 10 1932 +/- 190(511) 89819 +/- 2687(109) 25 2569 +/- 236(713) 88171 +/- 7266(105) 50 4868 +/- 1465 (1440) 100757 +/- 7499(134) 100 7771 +/- 709(2359) 85002 +/- 4287 (98) INFORME DE PROGRESO. BIOACTIVIDAD DIRIGIDA, PROTOCOLO DE AISLAMIENTO FITOQUÍMICO. INTRODUCCIÓN: El intento del aislamiento de un polisacárido activo homogéneo de la mezcla activa de “PF2” RS8A preparado de HPLC fue fallida debido a la intrasferibilidad de las condiciones analíticas del HPLC. De ahí, una investigación posterior sobre la separación potencial de moléculas cribadas cromatograficamente usando Sephadex G 50 fuera iniciada como el medio de separación. Consecuentemente, un polisacárido homogéneo fue aislado, bioensayado, y su estructura parcial aclarada por NMR espectroscópicos. RESULTADOS Y DISCUSIÓN: I. Aislamiento de polisacárido activo “PF2” RS8B-2. Una parte(2.0g) del poco activo “PF2” RS9 (LT = 73,5%), el cual fue preparado por el 67% MEOH, precipitación de “PF2” R (ver diagrama de Flujo) fue elegido como material de prueba. La razón, es que aunque el “PF2” RS9 es menos activo que “PF2” RS8, su proximidad a la fracción más activa, Sin embargo presagia a su contenido potencial del mismo polisacárido, aunque en más pequeña concentración, y además su bajo nivel de actividad es más utilizable como material de prueba. Consecuentemente la muestra de “PF2” RS9 fue disuelta en H2O y centrifugada. La supernatant fue sometida a Sephadex (G-25, 150µm, 80 g) columna de la separación cromatográfica con H2O como el eluent. Las bandas de color marrón fueron reunidas y designada como “PF2” RS9A (0,3g). Un análisis de la 1H NMR espectra de “PF2” RS9A y la anteriormente definida como la combinación del polisacárido activo “PF2” RS8A se mostraron idénticas. De esta manera, “PF2” RS9A (0,2g) fue combinado con la reservas existentes de “PF2” RS8 (1.4g), designado como " “PF2” RS8B" y sometida a una nueva separación con Sephadex G-50(20-80µm, 68g). Elution con H20 produjo seis fracciones (“PF2”RS8B-1,-2,-3,-4,-5 y -6). El análisis cromatográfico HPLC de estas fracciones (Figuras 1-12) mostraron que únicamente la fracción “PF2” RS8B-2 es homogénea usando tanto una suave dispersión evaporativa como la identificación UV (Figuras 3 y 4). La estructura parcial de este aislamiento fue determinada por el análisis de NMR. Es nota de interés que “PF2” RS8B-2, el cual representa el 33.7% del total de la fracción separada, dio 1H NMR y 13C NMR spectra (Figura 15 y 16) que son muy similar a esos de “PF2” RS8A (Figura 13 y 14) indicando que el polisacárido principal en el “PF2” RS8A es “PF2” RS8B-2. “PF2” RS8B-2 fue sometido por bioensayo y encontrado para exponer una transformación linfocita (LT) actividad de ÷6203 como comparación de la actividad de ÷3532 obtenida por “PF2” RS8A (Tabla 2) en el mismo experimento. Este polisacárido homogéneo (“PF2”RS8B-2) así aparece para ser dos veces casi tan activo como su mezcla original (“PF2” RS8A). Para propósitos comparativos, la transformación linfocita determinó los datos de la actividad para “PF2” RS8A el 14/04/00 y el 25/04/00, además están presentados en la Tabla 2. TABLA 2 EFECTOS DE LA MUESTRAS PF2RS8A Y “PF2”RS8B-2 DE LA TRANSFORMACIÓN LINFOCITA (RATON SMC)* MUESTRA No Con A “PF2”RS8A (08/18) “PF2”RS8B-2 Media + S.D % Media + S.D. % 0 165 +31 0 197+51 0 0.01 311+41 +91 205+49 +24 0.1 371+51 +127 361+76 +83 1 556+26 +237 649+48 +229 10 3829+380 +2220 2348+305 +1092 100 5993+1760 +3532 12417+3153 Con A 8m g/ml 1762+349 +6203 1507+250 MUESTRA No Con A “PF2”RS8A (04/14) “PF2”RS8B-2(04/25) Media + S.D % Media + S.D. % 0 900 +195 0 290+112 0 0.01 940+105 +4 665+159 +129 0.1 2549+410 +183 475+239 +64 1 4857+927 +440 542+130 +87 10 8830+816 +881 1979+344 +582 100 10565+449 +1074 14233+2079 +4808 EL RATモN ERA FEMENINO Efecto de las Muestras PF-1, “PF2”, PF-1-MEOH, “PF2”-MEOH, PF-1-5 and PF-1-6 sobre la transformación Limfocita (Rat SMC)* Muestra Con A 8ug/ml PF-1 Con A 8ug/ml “PF2” PF-1- MeOH “PF2”-MeOH Media ± S.D % Media ± S.D % Media ± S.D % Media ± S.D % 0 61298±4812 0 65886±4698 0 64388±4051 0 55309±1664 0 0.01 62429±6195 +2 62508±7283 -5 68105±4455 +6 64090±3335 +16 0.1 59490±6476 -3 57382±3942 56939±2385 13 -12 49688±4063 -10 1 58256±8719 -5 52524±3143 59939±5596 20 -7 -8 51103±3714 10 51895±3986 -15 100 75082±4516 +22 63282±1932 47605±2814 50748±3207 28 -21 49375±3681 -11 -4 -3 -10 62266±3738 49668±5683 Muestra Con A 8ug/ml PF-1 “PF2” Media ± S.D % Media ± S.D % 0 73225±5445 0 68429±3889 0 0.01 70886±4579 -3 61771±2917 -4 0.1 65244±2027 -11 58575±2420 14 1 58994±5671 -20 51320±1685 25 10 56560±2139 -23 49984±672 27 100 84661±9308 +16 54647±3197 % % 24 *El ratón era femenino Efecto de las Muestras PF-1, “PF2”, PF-1-MEOH, “PF2”-MEOH, PF-1-5 y PF-1-6 sobre la transformación linfocítica (Mouse SMC)* Sample No Con A No Con A PF-1 Media ± “PF2” % PF-1- MeOH “PF2”-MeOH Media ± Media ± % Media ± 2518±211 0 2074±174 0 1721±237 0 % % 0 1469±302 0 0.01 1660± +13 1592±268 -38 1943±752 -6 2399±39 0.1 2723± +85 2751±285 +8 2457±396 +17 2292±467 ±33 1 6309± +329 6260±403 +145 2326±3 10 3734± +154 5660±416 +121 5061±773 +143 4204±344 ±144 100 1183± -19 +86 4766±532 873±250 +12 -58 ±39 2644±495 ±65 807±97 -52 Sample No Con A PF-1 Media ± “PF2” % Media ± % 0 2515±265 0 2253±281 0 0.01 2584±235 +1 3851±569 +71 0.1 2643±322 +3 5356±492 +138 1 6464±646 +153 10110±1272 +344 10 6870±485 +169 9915±387 +340 100 1917±408 -25 +385 *El ratón era femenino 10930±993 % % INTRODUCCIÓN La meta de este estudio fue investigar y caracterizar la actividad inmunomoduladora de la sustancia original, llamada “PF2” y su posible aplicación en oncología clínica. Los inmunomoduladores se usan en la práctica clínica para estimular y normalizar la función del sistema inmunológico. Casi todas las enfermedades, incluso las tóxicas y los desórdenes nerviosos conducen a diferentes cambios y trastornos en el sistema inmunológico, principalmente: -Disminución del suero inmunoglobulino, -Cambios de actividad en los linfocitos T y B, -Cambios en el equilibrio de sub-poblaciones de linfocitos T -Disminución de la actividad de fagotitos. Todos estos síntomas son la característica de las diferentes formas de desordenes de deficiencia inmunológica. Los inmunomoduladores son usados en los métodos modernos de corrección de inmunodeficiencias para facilitar el tratamiento de la enfermedad y para evitar infecciones y complicaciones auto inmunes. Las propiedades inmunocorrectivas de inmunomoduladores pueden ser utilizadas con éxito en tratamiento y prevención de enfermedades oncológicas, porque las células inmunocompetentes juegan un papel principal en el proceso de eliminación de las células tumorales por otra parte tales procesos patológicos como la progresión tumoral y la formación de metástasis son particularmente controladas por el sistema inmunológico. Estos procesos tan complicados dependen de la actividad de las células tumorales así como de las células inmunocompetentes. El uso de los inmunomoduladores en la medicina oncológica es esencial y puede ser objetivo para la mejora de la identificación de objetivos por las células inmunoconpetentes y puede ser dirigida específicamente hacia la selección de un tipo de tumor celular o usarla para mejorar la resistencia del conjunto del organismo. PARTE I. ANÁLISIS DE LA DOCUMETACIÓN CAPITULO 1. RESPUESTA INMUNE ANTI-TUMORAL En los últimos años la inmunología del tumor ha tenido un progreso considerable y esta recibiendo cada vez más atención. Este incremento del interés esta justificado por varias razones. En primer lugar, la noción de antígenos tumorales específicos, que inicialmente afectaba a toda la superficie celular de las proteínas reconocidas por anticuerpos, se extendió a células T epítopos expuestas por moléculas MHC y reconocidas por células T especificas (1). El campo de la inmunología tumoral ha cambiado ampliamente, desde entonces respecto al análisis y la manipulación de reacciones de las células T. Los resultados hasta ahora obtenidos con modelos animales han llegado a ser tan espectaculares que las expectativas se han elevado con respecto a la inmunoterapia de tumores humanos. El principal problema en el desarrollo de una respuesta celular antitumoral es la identificación de los antígenos tumorales por las Células T. La identificación de tales epítopos está relacionado con la inmunogenicidad de los tumores. Diferentes métodos son usados para mejorar la inmunogenicidad de los tumores, entre ellos la transfección de genes los cuales podrían posiblemente incrementar la inmunogenética de las células tumorales, tales como genes citoquina. Los primeros resultados obtenidos en tumores de ratones modelos (2.3) fueron, de hecho notablemente exitosos y decenas de ensayos clínicos están actualmente en marcha. 1.1 ANTIGENOS TUMORALES ESPECÍFICOS Los primeros estudios sugerían la existencias de antígenos tumorales específicos, los cuales son exclusivos únicamente para las células tumoráles. La especificación de estos ATE también depende del origen del tejido de las células tumorales y del nivel de diferenciación de las células en ese tejido. El sistema inmunológico reconoce ATE y desarrolla anticuerpos específicos contra ATE. Alguno de los ATE son específicas para ciertos niveles de diferenciación celular. Entre ellos antígenos onco-fetales alfa fetoproteínico y antígenos carcinoembriónicos, receptores de los factores de crecimiento, tales como transferencias de receptores, receptores IL-2 y receptores de insulina, los cuales son específicos únicamente por la proliferación de las células de origen linfoide y están presentes únicamente en pequeñas cantidades sobre la superficie de la célula madura. Otro objetivo inmunogénico, presente en el tumor celular son los gangliosidos. La inmunoterapia pasiva en melanoma y neuroblastoma con anticuerpos anti-gangliosidos resultaron insignificante en la remisión de estos tumores (4.5). Anticuerpos supresores tumorales p53 se encontraron en ratones con sarcoma, causado por methychilandren (6). Todos estos datos muestran que ATE, identificadas por anticuerpos específicos pueden ser ambas proteínas mutantes o normales pero presentadas en gran cantidad, o teniendo algunos cambios en el nivel de glicolisación. Así es mejor referirse a estos tumores de moléculas específicas como tumores de epítopos específicos y no como tumores de antígenos específicos. Como fue mostrado al comienzo de los 40 días, los ratones inmunizados con cyngenic a los que químicamente se les provocó el tumor celular pueden rechazar un injerto del mismo tumor. Los antígenos fueron exclusivos para cada sujeto a los que químicamente se le produjo el tumor, puesto que la protección especifica fue obtenida contra la inmunización, pero no contra otros tumores, incluso si lo causó el mismo carcinogen. Los antígenos responsables del rechazo tumoral fueron calificados como Transplantes de antígenos tumorales específicos, (T.A.T.E.). La diversidad de la naturaleza molecular de estos antígenos disminuyó la esperanza de identificación de estructuras comunes que pueden ser usadas para diagnósticos o propósitos terapéuticos. Actualmente se acepta que los carcinógenos puedan causar la aparición de nuevos antígenos. Pero siempre no está claro si el resultado posterior es a partir de la mutación celular de los genes o a partir de genes silentes preexistiendo activados. Las Células T son capaces de reconocer únicamente antígenos MHC presentados sobre las células superficiales. Las células auxiliares CD4+T y las células CD8-T (linfocitos citotóxicos, CTLs) identifican pequeños péptidos, los cuales se originaron tras la elaboración de una molécula más grande dentro de la célula, y se presentan mediante las moléculas MHC I o MHC II respectivamente. La presentación de antígenos celulares (macrófagos, células B, dendríticas células), expresan MHC II y presentan anfígenos externos a las células T. Este camino incluye la endocitosis de la proteína natural, su metabolización, la formación compleja de pequeños productos péptidos con MHC II hasta terminar en endosomas, emigración a las células superficiales y la identificación por las células CD4+T. La molécula CD4 está ligada permanentemente al área (región) de la MHCII. Las proteínas Endógenas (Proteínas vírales, proteínas integrantes de células normales, etc.) son tratados de formas diversas. Después de la metabolización interna de la célula los péptidos se cargan dentro de los surcos que presentan los péptidos de MHC I en la retícula endoplasmática. Las moléculas MHC I son inestables si no son cargadas con un péptido. Las células T la cual identifica el peptido presentado por moléculas de clase I expresada como CD8. lo que la ata al área constante de las moléculas de clase I MHC (8). Como consecuencia, las proteínas endógenas están perfectamente identificadas por CD8+CTLs en el contexto de MHC I ya que los antígenos exógenos están principalmente identificado por auxiliares CD4 - T en el contexto de MHC II. Sin embargo, hay además ayudantes específicos para las células T y CTLs específicos para MHC II. Los Pépticos, eluted de MHC I son normalmente sobre 9 grandes amino ácidos, mientras que los péptidos eluted de MHCII son normalmente más grandes y variados en tamaños. La primera estructura antigénica es detectada con regularidad sobre las células tumorales ya que el objetivo por las células T fueron la inmunidad de antígenos vírales. Los otros objetivos pueden ser antígenos originados a partir de péptidos con la estructura alterada a partir de una expresión anormal de proteínas normales. Varios Antígenos tumorales específicos, los cuales parecían ser proteínas mutantes CTL fueron identificados. Además las proteínas producto de oncogenes alterados o genes supresores tumorales alterados pueden ser un posible objetivo para las células T. Tienen varias características en común. Lo primero de todo, estas proteínas están presentes en todo el tumor celular y la mutación de sus genes es necesaria por tumorigenesis. El término simultáneo de oncogenes y de Genes Supresores Tumorales (TSG) dirige a la proliferación preferencial de células malignas. El bloqueo de la expresión de genes alterados puede ser la forma de tratamiento efectiva contra el Cáncer. Solamente este hecho motivó la identificación del tiempo actual de 10 TSG entre más de 100 oncogenes, el papel que el péptido produce en el desarrollo de la inmunidad contra el cáncer tienen respuestas poco claras. Varias muestras de tales proteínas mutantes serán discutidas más adelante. Proteína Mutante p53. Mutaciones esporádicas en p53 TSG son los cambios genéticos más comunes en tumores humanos. La mutación p53 fue encontrado en el 73% de los casos de humanos en el cáncer de colon., 30-50% en el cáncer de mama, 50% cáncer de pulmón y el 100% de los casos de pequeñas células de carcinomas en el pulmón. (10). La posibilidad de la generación de los clones de CTI.s específicos para p53 y posiblemente de terapia antitumor por inmunización con péptido especifico p53 fueron mostrados(11).Encogen bcr/abl. Mas del 95% de los pacientes con leucemia mielogénica crónica (CML) conlleva el desplazamiento t(9,22) (q34,q11). Es el desplazamiento de la c-abl protooncogene (abl) sobre el cromosoma 9 el punto de ruptura que agrupa el área (bcr) sobre el cromosoma 9 al punto de ruptura que agrupa el área (22) sobre el cromosoma 22 produce los cromosomas philadelphia y dirige a la formación de la fusión de genes llamada bcr/abl, la cual codifica a 210kDa proteínas quimérico con actividad anormal de la tirosina quinasa (12,13) la abl y genes bcr son expresados por células normales y de esta manera las proteínas codificadas son probablemente no inmuogenicas, sin embargo la unión de segmentos de áreas de la bcr/abl proteína quimérica está compuesta por una secuencia de abl aminoácidos que unen a aminoácidos ver que son manifestados únicamente por células malignas. La inmunización de ratones con péptidos sintéticos corresponde a bcr/abl uniendo áreas sacadas del péptido específico CD4+, de clase II restringido a células T, las proteínas bcr/abl representan un potencial agente antitumoral relacionado con el suceso de la transformación y manifestados en la gran mayoría de los pacientes con CML. El ras oncogenes. Mutación de protooncogenes está entre las alteraciones más frecuentes encontradas en los males humanos. De esta manera las mutaciones de la Ki-ras, N-ras, o Ha-ras son encontrados aproximadamente en 905 de carcinomas de páncreas , 50% carcinoma de colon y el 25% de leucemia mielogenica aguda, pero en menos que el 5% de carcinomas de mama (15,16,17,18,19). Los ras oncogenes son activados por puntos de mutaciones. La vacunación con péptidos sintéticos correspondientes al área multada de proteínas ras obtuvo alguna respuesta de la célula T. Otro mecanismo puede explicar la manifestación de un antigeno tumoral sobre la célula transformada. Si un gen es silencioso o manifiesta bajo nivel en el tejido normal, y si es activado en el tumor celular la sobre manifestación de la inmutación la propia proteina puede dirigir a las producciones de un grupo de representación de la propia proteína las cuales son objetivos potenciales para el antitumor CTLs.(21,22) 1.2. PORQUE SON TUMORES POBREMENTE INMUNOGENICOS ? 1.2.1 Antígenos bajos o expresión MHC clase I. La baja regulación de MHC I ha sido demostrado que ocurre en muchas leucemias de animales y humanos, linfomas y tumores sólidos. La idea generalmente aceptada es que la perdida de la expresión MHC I y la consecuente incapacidad de las células para presentar péptidos específicos tumorales, a clones CTL pueden inducir a un escape de los respectivos tumores celulares de control Inmunológico. La baja regulación de la expresión MHC I puede ser la consecuencia del proceso oncogénico en si mismo, ya que fue mostrado que algunos oncogenes, por ejemplo C-myc y N- myc son capaces de bloqueo de genes de expresión MHC I en células melanómicas y neuroblastómicas (24). Interferón, TNF y algunos otros linfoquines pueden activar la expresión de MHC I sobre las células tumorales. 1.2.2. Carencia de moléculas co-estimuladoras ( B7-CD28/CTLA-4) La estimulación máxima de las células T, responden a un peptido/MHC complejo necesitado de una segunda señal co-estimulatoria normalmente repartida por células que presentan antígenos, por ejemplo células B activadas, macrófagos o células dendríticas. La ocupación de la célula T receptora en ausencia de una señal co - estimuladora induce a un estado de insensibilidades en la célula T, caracterizada por una baja producción y proliferación de IL-2 en respuesta a consecuentes exposiciones a antigenos, incluso en la presencia de una señal co - estimulado. Este antígeno específico en estado duradero de insensibilidad ha sido llamado energía. Aunque los mecanismos moleculares de la energía de la célula T no está completamente indirigida, la evidencia sugiere que un camino coestimulatorio supone la interacción de células T- superficiales, antígenos CD-28 y CTLA-4 con su ligando B7, expresados sobre APS.(25). El antígeno CD 28 está constitutivamente expresado en el 95% de las células CD4+. el 50% de las células CD8+ y timocitos coexpresando CD4 y CD8 y ello regula la producción de células T mediante mecanismos transcripcionales y post transcripcioneales (26). CTL4+ es el ligando segundo, y es prácticamente indetectable sobre el resto de las células T, pero se expreso en los subconjuntos activados de la células CD4+ y CD8+ en ~ 1/30 –50 los niveles de CD28 (27). B7, como CD28 y CTLA-4 es un miembro de la súper familia del gen de la inmunoglobulina y se expresa en las células B activadas y macrófagos y constitutivamente sobre células dendríticas (28). La función de CTLA en la célula T activada puede ser para promover de forma eficaz la interacción entre CD 28 y B7. Bloqueando la co-estimulación del receptor CD28 en la presencia continuada de un antígeno extraño puede conducir a la insensibilidad de la Célula T. La inducción de la activación y proliferación de la célula T es un proceso de dos etapas: Primero: El reconocimiento similar de un complejo específico de péptidos /MHC por los receptores de la Célula T conduce a la activación de la tiroxina kinases en las células T y a la transmisión citoplasmática por la cola citoplásmica de la molécula MHC, la cual causa la expresión incrementada de B7 sobre APC (29,30). En Segundo Lugar: B7 obra recíprocamente con sus contra receptores naturales, CD28. CTLA-4, en la célula-T induce un estimulo independiente, probablemente mediante la fosforilación de tiroxina de péptidos específicos, incluyendo la fosfolipasa C-1 y poner en funcionamiento señales calcio dependientes y calcio independientes. Esto conduce posteriormente a la producción de IL-2 y de las citoquinas y a la proliferación de copias específicas de células T.(25,26). En contraste, cuando el antígeno del péptido es presentado por MHC en ausencia de B7, los clones de la célula T son incapaces de detectar niveles de IL-2 y proliferar. La mayoría de los tumores se derivan de las células parénquimal o mesenquimal, que no expresan B7, así que la capacidad del tumor celular para actuar eficazmente, ATE puede ser deteriorada seriamente y esa carencia de coestimulación puede ser un importante mecanismo confiriendo una baja inmunogenicidad incluso a las células tumorales que expresan MHC y ATE. 1.2.3. Factores Inmunosupresivos (TGF-b and IL-10) Ha sido largamente postulado que las células malignas pueden secretar factores inmunosupresores que podrían contribuir a la evasión inmunológica. Probablemente la mejor caracterización del cáncer relacionadas a factores inmunosupresores es el factor de transformación del crecimiento (TGFb). Inhibe la actividad del numero de otros citoquines, inhibida la proliferación de células T y B, así como la generación de LAK y CTL, bloquea la actividad citolítica y abajo reguló la expresión de MHC y del receptor IL-2.(31). Otro Inmunorepresores – IL 10 – es además secretado por las células tumorales y por supresivos T (pero no CTLs) y algunas otras células(33). 1.3 LOS EFECTOS CELULARES EN EL SISTEMA DE DEFENSA ANTI-TUMORAL DEL ORGANISMO. Una gran cantidad de diferentes mecanismos de reconocimiento y eliminación de células transformadas y virus- infectados fueron desarrollados por los organismos. Diversas células desempeñan un importante papel en el sistema de defensa antitumoral, incluyendo macrófagos, los monocitos, neutrófilos activados, células Nk, TCLs. Hay dos etapas en el proceso de la respuesta celular al tumor. En la primera etapa, efectos no específicos celulares, monocitos y macrófagos, eosinofilos activados y células NK se reclutan en el proceso de Inflamación y juegan un papel conductor en las primeras 18 horas del contacto con las células tumorales. Durante la 2ª Etapa, Tumores específicos CTLs llegaron a ser activados y comenzaron a proliferar y provocaron la respuesta específica contra las células malignas. Los antígenos, reconocidos por los monocitos-macrófagos y neutrófilos que están sobre la superficie de la célula tumorales todavía son detectados. Las células NK reconocen antígenos y algunos otros antígenos de origen desconocidos. Las células asesinas reconocen los antígenos que cubren las células, Pero solamente los CTLs reconocen antígenos (Tumorales, virales, etc) asociado cada uno con moléculas MHC de clase I o de clase II. Hay dos tipos posibles de tumores celulares malignos con resultado de la interacción con células effector. El Tipo de célula maligna necrótica ocurre después de la interacción de células tumorales con células NK, neutrófilos, y parcialmente macrófagos. El tipo de célula maligna Apoptosica ocurre después de la interacción con CTLs, monocitos y macrófagos. El proceso que conduce a la apoptosis está durando entre 18-48 horas y este proceso es controlado mediante varios genes (37). Un factor muy significativo que se debe evaluar en el pronóstico de la enfermedad es la actividad de CTLs contra las células autologous.(38). Como fue mostrado por Uchida et al. que no solamente la actividad citotóxica de los linfocitos periféricos sanguíneos del paciente contra las células tumorales se correlaciona con el tiempo que continua con vida el paciente después de la operación, pero el nivel de la actividad citotóxica, incrementada por inmunomoduladores además se correlaciona con el pronostico de la enfermedad (38).Varios inductores de la actividad citotóxica fueron estudiados , entre ellos IL-2, medicamento autorizado streptococcal 432 o complejo proteinico-azucarado Sizoforan. Los resultados de estos estudios pueden animar al uso de los inmunomoduladores en la práctica clínica. CAPITULO 2. INMUNOTERAPIA DEL CANCER Varios acercamientos al tratamiento anti-cáncer, basado en la activación de los diversos encadenamientos del sistema inmune de defensa fueron desarrollados durante la investigación intensiva en el campo de la inmunología tumoral. La complejidad del tema no permitirá discutir cada acercamiento en detalles, así que en esta revisión mencionaremos solamente a alguno de ellos: La mielotrasplantación: La trasplantación de los tallos celulares después de la quimioterapia y de la radioterapia; inmunoterapia celular adoptiva del cáncer y metástasis basada en la inoculación del anti-tumoral CTLs activado, inmunización activa específica. La administración post-quirúrgica de la vacuna anti-tumoral, pasiva inmunización con los anti- ATE anticuerpos (39,40,40). El otro acercamiento se ocupa del desarrollo de los anticuerpos bioespecíficos, el cual puede unir a los ATE y las células T receptoras y obtener CTLs(42). Este acercamiento también se llama retargeting del TCLs no específico hacia las células del cáncer. Varios anticuerpos bioespecíficos bifuncionales son generalmente usados en casos anti-CD3/ antiATE con CD28/ anti-ATE (42). Un montón de esfuerzos se hacen hacia el desarrollo de vacunas anti-idiotypic para las vacunaciones. Esta aproximación sugiere el uso de los anticuerpos anti-idiotypic para las vacunaciones. Fue mostrado en los estudios con animales, que la inmunización con anticuerpos anti-idiotypic inhibe el crecimiento tumoral. Los ensayos clínicos mostraron el desarrollo de inmunorespuestas celulares anti-tumorales y humorales en los pacientes con carcinoma colonrectal, linfomas de las células B y de las células T de la piel (43). Debe ser acentuado que cada caso clínico separado requiere un acercamiento individual, basado en la inmunogeneticidad del tumor y en la capacidad del organismo para desarrollar inmunorespuestas. CAPITULO 3 EFECTOS ANTI-TUMORALES E INMUNOMODULADORES DE LAS SUSTANCIAS DERIVADAS DE LAS PLANTAS USADAS EN ONCOLOGÍA CLÍNICA. El efecto de los inmunomoduladores o de los inmunomodificadores de la inmunorespuesta no está especificado y está dirigido hacia la estimulación del sistema de defensa del organismo en general. La opción y la optimización de la estrategia del tratamiento con inmunomoduladores deben ser ajustadas en cada caso clínico específico. El grupo de inmunomoduladores incluye algunos productos bacterianos, sustancias derivadas de las plantas y limfoquinas. Las acciones anti-tumorales de estos medicamentos se basan en la potenciación de los efectos mecánicos o de la inhibición de los componentes supresores, en los efectos y el mediar de las características del medicamento en sí mismo y en el incremento de la resistencia del organismo en general (44). Entre los medicamentos estan BCG y Corinebacterium parvum (44), productos derivados del Streptococci y Enterotoxon B de Stafilococci (45). Linfoquinas recombinantes (Interferones, IL-2, TNFa) son también extensamente utilizados como inmunomoduladores (46,47,48). Su acción se basa en el bloqueo de la proliferación de las células tumorales, su lysis, en la activación de los efectos celulares como efectos hormonales. Los extractos de la planta y la sustancias derivadas de las plantas se convierten en Inmunomoduladores cada vez más populares en Rusia (49). Estos medicamentos son muy conocidos y se utilizan desde épocas antiguas en China, Japón, y Corea. Pero aquí debemos mencionar el hecho de que la carencia de los resultados bien documentados del uso clínico de estos medicamentos hace difícil evaluar sus efectos sobre la progresión de la enfermedad. El grupo de medicamentos derivados de las plantas que se utilizan en oncología clínica y que tienen efectos directos anti-tumorales incluye: *Vinblastin, derivado de la planta Vinca Rosea y Catharantus Rosea, La vincrestin derivada de Vinca Rosea tiene efectos antiproliferantes y se usa extensamente en la practica clínica para la regresión del crecimiento tumoral. *Podophyllin, derivado de podopfhyllum pellatum, colhamin and colhicin (de Cholchicium Speciosum Stev.)Taxol y sus derivados (de Taxux brevifolia Nutt). Ellinticin (de ochrosia elliptica Labill.), Kamptotecin (from Camphotheca acuminata Decne) y algunos otros también se convierten en medicamentos muy populares y se usan en ontología clínica. El centro de investigación ruso del cáncer de la academia rusa de ciencias creó la base de datos de los productos naturales, los cuales tienen actividad anti-tumoral. Algunas de las sustancias derivadas de las plantas que no tienen efecto anti-tumoral directo, pero parecen ser inmunomoduladores. Este grupo de medicamentos incluye adaptogenes biológicamente activos, tales cono Eleutherococcus, Ganoderma Lucidim, PSK, OK-432, etc. y el grupo de vitaminas. Estas sustancias se utilizan extensamente en combinación con los citostáticos (38,39). Los inmunomoduladores adaptogenes derivados de las plantas no tienen generalmente ninguna actividad citotóxica, sino que estimulan el inmunosistema ( El incremento de la inmunidad de la célula T ,disminuye o bloquea la actividad del supresor, estimula la producción natural de células asesinas, el interferón, la producción de IL-2.) Los estudios del mecanismo de la acción de Eleutherococcus mostraron su capacidad de inducir la producción del interferon-g por los linfocitos humanos. Cuando se utiliza en la practica clínica Eleutherococcus reduce las reacciones tóxicas después de la quimioterapia, incrementa la duración de la vida, normaliza las subpoblaciones de los linfocitos y reduce la probabilidad de la progresión recíproca de la enfermedad (53,54). Datos similares fueron obtenidos en ensayos clínicos con el uso de los otros inmunomoduladores derivados de las plantas. La sustancia activa de estos medicamentos es el polisacárido específico. Los polisacáridos de Eleuterococcus estimulan la producción del interferón en la cultura del linfocito, una actividad citotóxica de CTLs e incrementan las células del bazo (56). Muchas de las sustancias derivadas de la plantas usadas en la medicina china tradicional, son capaces de aumentar la producción del interferón y la actividad de células NK (49). Proteoglycan, derivado del hongo Coriolus versikalov llamado Krestin-PSK, es utilizado como inmunomodulador en Japón para el tratamiento del cáncer de estómago, carcinoma colorectal, del cáncer de pulmón, del cáncer de pecho y de algunos otros, ( 38,57,58,59). Efectos similares tienen el Letinan (polisacarido derivado del hongo Lentinum edodes) (60).Applanatum (de Ganordena lucidum), Por ultimo también reduce el dolor, así pueden minimizar el uso de las sustancias narcóticas. Se demostró que esos polisacáridos estimulan la actividad de fagocitos (61) y de macrófagos.(62) Algunas especulaciones sugieren que la contaminación de productos bacterianos, presentes en tales sustancias derivadas de las plantas pueden también permitirse potenciar los efectos inmunoestimulantes. En conclusión podemos decir que la fitoinmunoterapia es el campo mas rápidamente desarrollado de las investigaciones científicas y probablemente no ayudaran únicamente al desarrollo de nuevos medicamentos anti-tumorales efectivos si no que también comprenderán los mecanismos moleculares de sus acciones. MATERIALES Y MÉTODOS CULTIVO CELULAR Las líneas celulares humana QQS, SKVLB, SKOV3, Lm9, astrocytoma línea celular , la línea celular de ratones Sp2/0, B16 ( Moscú, Centro médico ecológico de investigación ) fueron cultivadas en RPMI media (Gibco), suplimentada con 10%FCS (sigma, E.E.U.U.) 100u/ml de penicilina (Gibco), 100mkg/ml de streptomycine (Gibco) (R10). Linfocitos periféricos sanguíneos (PBLs) fueron aislados por centrifugación Ficoll-Pague se cultivan en R10. La proliferación linfocíta se estimula mediante la Con A (Gibco, 10 mkg/ml). PRUEBA DE VIABILIDAD El índice de supervivencia de las células bajo acción de diversas sustancias fue evaluado por el análisis de MTT (basado en la evaluación de la formación de los cristales del formazane del tetradolium por célula vivas). Las células fueron bien incubadas en la placa 96 con diversas concentraciones del compuesto estudiado (Tres medidas paralelas para cada concentración ) durante 3 días; entonces 200 mkl de cultivo medido fue añadido a 50 mkl de la solución de MTT (1mg/ml) de 2-4 horas. Después de que la reacción de color fuera completa, los cristales del formazane fueron disueltos en el 150 mkl del dimethylsulfoxide y la densidad óptica en 540 ejecutados fue medida. El índice de la supervivencia de la célula fue evaluado en el porcentaje del correspondiente control (64,65). EVALUACIÓN DE LOS EFECTOS DE LA “PF2” EN LA ACTIVIDAD CITOTÓXICA DEL PBLs La actividad CTLs de la “PF2” estimula los linfocitos periféricos sanguíneos humanos contra los objetivos (Células tumorales humanas) y se evalúa de forma estándar la realización de análisis Cr o el análisis MTT. EVALUACIÓN DEL EFECTO DE LA “PF2” SOBRE LA ACTIVIDAD CITOTÓXICA DE SPLENOCITES. La actividad citotóxica de Splenocites en ratones C57Black contra las células B16 de melanoma de ratones y de ratones Balb/C contra las células Sp2/0 fue medida por metodo(73). Los objetivos celulares fueron incubados en el depósito de plata 96 en 2 x 104 con efectos celulares (en diluciones 1:10, 1:2, 1:40). “PF2” fue agregada a los medios de cultivo o administrada intraperitonealmente en ratones durante 3 días. Después de las 24 horas de incubación 3h thymidin fue añadido a los depósitos (1,25 mkCi/en cada depósito). Después de las 24 horas de incubación con células thymidines se cosechó en filtros y la radioactividad se detectó en el centelleo del contador. El nivel de citotoxidad fue calculada de acuerdo a la siguiente formula: Indice citotóxico=cpm/min(control)-cpm/min(efecto) / cpm/min(control) El control de suspensión de Splenocytes y animales experimentales (después de la administración de “PF2”) se preparó en R10. Las células viables fueron contadas en un contenedor celular. Los glóbulos rojos fueron lysed por 0.87%NH4CI. EVALUACIÓN DE LOS DAÑOS DE DNA La estructura DNA fue estudiada por técnicas fluorometrica (74) y su modificaciones (72), usando fluorimeter (Jasco FP 550), con una longitud de onda de520nm. emisión de 590nm. El bromuro de ethidium fue usado como un fluorofor. El ratio de desnaturalización básica de DNA (en porcentajes de DNA de doble trenzado) fue evaluada después de 30min. La incubación de la célula lysate en PH12,8 en 0ºC, después de 60 min de incubación a 15ºC. Cantidad de doble trenzado de DNA fue contada usando la formula: D= (P_B)/(T-B)100% B- fluorescencia básica (fluorescencia de otros componentes excepto doble trenzada DNA). T-control de fluorescencia de doble trenzado DNA más otros componentes. P-resultando fluorescencia de la permanencia después de la desnaturalización del doble trenzado DNA. EVALUACIÓN DE LA ACTIVIDAD ANTI-TUMORAL DE LA “PF2” EN MODELOS ANIMALES. Las células de melanomas de línea celular Sp2/0 fueron inoculados diariamente intraperitonalmente en ratones Balb/c. Para la inducción de tumores sólidos las células Sp2/0 fueron inoculadas subcutáneamente en ratones Balb/c en 0.1 ml de PBS. Empezando por el segundo día después de la inoculación del tumor celular. “PF2” en volumen 0.04 ml, fue administrada a 8 ratones 4 veces al día directamente por vía oral. PBs solo fue administrado para los animales del grupo control. El tamaño del tumor fue medido de 1-3 días. La relativa actividad antitumoral de la “PF2” fue evaluada por el cambio en el ratio de supervivencia, incrementando la duración de la vida (ILF), y reduciendo el tamaño tumoral. La siguiente formula fue utilizada para la calculación del aumento de duración de la vida.(ILF). ILF = 100 x (T/C-1) T- cuanto se alarga la vida en días en los animales tratados. C- cuanto se alarga la vida en el grupo de animales control (no tratados). El volumen del tumor fue calculado, usando la siguiente formula: L – diámetro exterior del tumor. W diámetro interior del tumor. ACTIVIDAD MITOGENICA DE “PF2” La actividad mitogénica de “PF2” fue determinada por la capacidad de las sustancias probadas para estimular la proliferación de linfocitos. PBLs se incubó en el depósito de plata 96 en R10 el cultivo medio con diferentes diluciones de “PF2” durante 3 días. 3H thymidine (0.2mkci/por depósito) fue añadido a los depósitos 24 horas antes del final de la incubación. Las células fueron recogidas en filtros y la radioactividad fue medida en contadores centelleantes (LKB). el índice de estimulación fue calculado como ratio de radioactividad de las células incubadas con el control mitiguen (Fitohemagglutinin, PHA). RESULTADOS Y DISCUSIÓN CAPITULO 1 Características Biológicas del Inmunomodulador “PF2” La meta de este estudio fue la caracterización de la actividad anti-cancerigena de la sustancia, llamada “PF2”. Los resultados preliminares del estudio han presentado muestras de actividad citotóxica de esta sustancia contra los diferentes canceres humanos. La sustancia tiene un color marrón. Para caracterizar la actividad anti-tumoral de la “PF2” tenemos varios criterios, entre ellos la actividad citotóxica contra las células malignas y normales “In Vitro”, efectos mito génicos sobre PBLs humanos , La capacidad para potenciar la secreción de los factores citotóxicos por linfocitos, también fue estudiada la capacidad para estimular la actividad citotóxica de PBL humano. El mismo criterio fue utilizado para caracterizar la actividad biológica de la “PF2” después de la depuración parcial. La necesidad de tal depuración fue causada por la inesterilidad de la sustancia presente o del precipitado. Además las sustancias fue contaminada con bacterias y levaduras. Los resultados de la pruebas bacteriológica de “PF2” se muestran en la Tabla 1.1. La concentración de la endotoxina fue 25u/ml. La depuración parcial de “PF2” fue alcanzada por la centrifugación, seguida por filtración a través del filtro de 0.22 mM (fig.1.1-1.3, Tabla 1.2) TABLA 1.1 RESULTADOS DE LOS ANÁLISIS BACTERIOLÓGICOS DE “PF2” Y DE SU SENSIBILIDAD A LOS ANTIBIÓTICOS. Bacteria antibióti ca Penicillin E.coli Enterococcus insensible lactosa-negativo esherihia Levomecitin sensible Tetracyclin sensible Lincomicin sensible sensible sensible sensible Piopen sensible sensible sensible Gentamicin sensible sensible sensible Oleandomycin sensible Polymixin B sensible Cefalotin sensible Ampicilin sensible sensible insensible sensible TABLA 1.2 La secreción de los factores citotóxicos por PBLs humano “In Vitro” después de la incubación durante 18 horas con las diferentes concentraciones de “PF2” y Staphylococcus enterotoxin B (SEB). Células tumorales humanas de línea celular SKVLB fueron utilizados cono efectos de la célula en estos experimentos. “PF2” Actividad citotóxica Actividad Citotóxica dilución “PF2” no-estéril “PF2” estéril - 100 100 1/105 100 101 1/104 96 103 1/103 99 100 1/102 99 100 1/101 90,3 85,8 SEB 0,1nM 27,1 27,1 PHA 20 mg/ml 13,8 13,8 La posible asociación de la actividad citotóxica de linfocitos con el nivel de expresión de los receptores superficiales de linfocitos fue estudiado mediante análisis FACS, después de la incubación de PBLs con receptores específicos anticuerpos monoclonales (Becton Dickinson). Los resultados de estos experimentos se muestran en la Tabla 1.3. Es obvio, que la “PF2” no tiene efecto en la expresión de los antigenos superficiales de PBLs y no estimula su proliferación ( no incrementa las células con IL-2 receptor CD25- y HLA DR antígeno se encontró). Esta observación conduce a la conclusión que el incremento de la actividad citotóxica no es consecuencia de los cambios en la diferenciación celular, pero es probablemente debido a los cambios en las funciones celulares. FIG 1.1 RATIO DE SUPERVIVENCIA FIG. 1.1 La actividad citotóxica de “PF2” contra los diferentes tumores celulares y PHA- estimulado PBLs humano in Vitro. -·- Linfocitos estimulados + Astrocitoma -*- Astraciclin- carcinoma ovárico resistente en humanos (SKVLB) -o- Carcinoma ovárico humano -ñ- Linfoma humano de células T,QOS. -◊ - Linfoma humano de Células B, lm9. FIG. 1.2: Actividad mitogénica de “PF2” estériles y no estériles. La estimulación del índice después de la estimulación del PBLs con PHA (20 mkg/ml) fue utilizada como un control positivo. FIG.1.3 Los efectos estimulantes de la “PF2” esterilizado y no esterilizado sobre la actividad citotóxica de PBls humano contra célula en comparación con el testigo (3). FIG.1.4 Los efectos de la “PF2” sobre la actividad citotóxica de PBLs humano (A), monocitos (B), neutrofilos (c), 1 –testigo, 2-en la presencia de “PF2” (1:200) contra las células SKVLB. Los efectos fueron evaluados por los objetivos celulares de los ratios de supervivencia. TABLA 1.3 EFECTOS DE LA “PF2” (DILUCIÓN 1:200) EN LA EXPRESIÓN DE LA SUPERFICIE RECEPTORA DE PBLs (24 HORAS DE INCUBACIÓN). Subpoblación de Linfocitos, % Marcador CD3+ CD20+ CD4+ CD8+ CD16CD25+ HLA-DR Células T Células B Auxiliar T Supresor T Células NK (Activación de marcadores) 68 6 32 33 20 4 6 “PF2” 1:200 68 4 33 35 21 5 5 Los efectos citotóxicos de monocitos/macrófagos y neutrofilos especialmente pueden ser debidos a la "explosión oxigénica" - Proceso que conduce a la generación de estas células del metabolismo activo de oxígeno, que determinan los efectos citotóxicos de estas células. HCT- pruebas que utilizamos para determinar los efectos de la “PF2” sobre el nivel de la actividad neutrofílica. Los resultados de estos experimentos se muestran en la Tabla 1.4 Los efectos del activador zymozan fue evaluado como un testigo y parecía ser parecido con los efectos de la “PF2”. TABLA 1.4 ACTIVACIÓN PERIFÉRICA SANGUÍNEA DE NEUTRÓFILOS MEDIANTE “PF2” Sustancia Actividad de Neutrófilos, % Control (Actividad espontánea) 0 Zimozan 59.2 “PF2” 1:200 46.9 Los efectos citotóxicos de "Explosión oxigénica" está acompañado por el daño del DNA de estos efectos celuláres. Integridad y estructura de neutrófilos DNA, fueron estudiados después de su incubación con “PF2” para evaluar su actividad citotóxica y los resultados se muestran en la tabla 1.5 TABLA 1.5 ACUMULACIÓN DE DAÑOS EN DNA DE NEUTRÓFILOS Y LINFOCITOS DE LA PERIFERIA SANGUÍNEA DESPUÉS DE SU INCUBACIÓN DURANTE 30 MINUTOS CON “PF2”. Daños en el DNA, % “PF2” dilución Linfocitos Neutrofilos 0 0 1:1000 1.2 6.7 1:100 3.4 18.1 1.10 3.5 22.9 Como puede verse, la “PF2” induce a la secreción de Neutrófilos de metabolismos con oxigeno activo, que daña DNA de esas células. El mismo mecanismo no especificado puede determinar efectos citotóxicos de monocitos / macrófagos y neutrófilos contra los tumores celulares en presencia de la “PF2” FIG.1.5 Los efectos de la “PF2”(1:200) sobre la actividad citotóxica de PBLs humano contra las células K562 calculadas en el análisis estándar de liberalización de Cromo. A – después de la Incubación de efectos y objetivos con “PF2”, B – después de la preincubación de objetivos con “PF2” durante 24 horas. 1 – testigo 2 –1 la presencia de “PF2”. La actividad citotóxica del PBLs fue estudiada en el análisis de liberación de Cromo después de 4 horas de incubación de PBLs (efectos) con células K562 (Objetivos). Como se muestra en la Fig. 1.5 que la actividad citotóxica de PBLs posteriormente incrementa su estimulación con “PF2”. Es más, se muestra que la actividad citotóxica se incrementa significativamente después de la preincubación de los objetivos celulares con “PF2” durante 24 horas. Este dato sugiere que la presencia de “PF2” en los objetivos medios sensibilizados (células malignas) los hace más susceptibles a los efectos. Los incrementos de la actividad citotóxica de PBLs de pacientes de cáncer mediante “PF2” se muestran en la Tabla 1.6. El PBLs de pacientes de cáncer por “PF2” se muestran en la Tabla 1.6. El PBLs de 2 pacientes en el grupo muestra algunas diferencias en el nivel de actividad citotóxicas. Pacientes D tenían excepcionalmente un índice alto de actividad citotóxica, y pacientes B con células B Leukosis no tienen actividad citotóxica de PBLs debido al predominio de células B. TABLA 1.6 EFECTOS DE LA “PF2” (DILUCIÓN 1:200) EN LA ACTIVIDAD CITOTÓXICA DE PACIENTES CON CÁNCER El índice objetivo / efecto es 1:100 CTI,% Pacientes Diagnósticos Objetivo testigo SKVLB Objetivo testigo SKOV3 A Cáncer de la vesícula biliar 13.6 23.9 12.9 18.8 F Cáncer de esófago 0 21.1 0 19.3 L Cáncer de Laringe 11.3 15.9 5.9 9.6 C Cáncer de Colon 0 13.9 11.8 16.0 D Cáncer ovárico 54.8 49.9 40.9 38.8 B Leucosis de la célula B 0 0 0 0 El efecto de la “PF2” (dilución 1:200) en la actividad citotóxica del PBLs de los El efecto de la “PF2” sobre la capacidad de las células malignas para vencer la Las células SKVLB expresan la resistencia de múltiples medicamentos, gene mdrl y se resisten a antibióticos como antracycline. Los efectos de la “PF2” se comparó con los efectos positivos del Verapamil. El tratamiento con Verapamil hace a las células SKVLB susceptibles a los antracyclines. Los resusltados de estos experimentos se muestran en la fig. 1.6. En éste experimento “PF2” no tiene efecto sobre la susceptibilidad de las células resistentes SKVLB, y además no cambia la susceptibilidad de las células sensibles al doxorubicina de línea celular SCOV. Dos conclusiones principales se pueden trazar de éste experimento: - “PF2” no tiene efecto sobre la susceptibilidad de células sensibles a la doxorubicina, además no cambia la actividad antitumoral del doxorubicina. Eso hace posible el uso de la “PF2” en combinación con los medicamentos comunes anti-cáncer. - “PF2” no tiene efecto en la susceptibilidad de las células resistentes a los múltiples medicamentos antibióticos. FIG 1.6 Figura 1.6. Los efectos de la “PF2” sobre la actividad citotóxica del doxorubicina contra las células SKOV3 (1.2.3.) y SKLVB (4,5,6) células resistentes a múltiples medicamentos: 1 y 4 en presencia de doxorubicina. 2 y 5 en presencia de “PF2” (1:200) y doxorubicina. 3 y 6 en presencia de doxorubicina y verapamil (20 mcM). LAS SIGUIENTES CONCLUSIONES PUEDEN SER TRAZADAS DESDE LOS RESULTADOS DE LOS EXPERIMENTOS DESCRITOS EN ÉSTE CAPÍTULO: 1. La “PF2” no tiene efectos mitogénicos en los PBLs humanos “In Vitro”. 2. La “PF2” no induce la secreción de los factores citotóxicos por PBLs humanos “In Vitro”. 3. La “PF2” no cambia la actividad de los medicamentos anti-tumorales (por ejemplo doxorubicina). 4. La “PF2” no tiene efectos reversibles sobre los múltiples medicamentos resistentes al cáncer celular. 5. La “PF2” incrementa la actividad citotóxica de los linfocitos, monocitos y neutrofilos en la sangre periférica de los pacientes sanos y con cáncer contra el objetivo de las células malignas en los experimentos “In Vitro”. 6. La alta concentración de “PF2” es citotóxica contra la rápida proliferación de las células normales y malignas. CAPITULO 2 EFECTO DE LA “PF2” SOBRE LA ACTIVIDAD CITOTÓXICA DE RATONES SPLENOCYTES FRENTE A LAS CÉLULAS TUMORALES. Para caracterizar los posibles efectos de la “PF2” sobre las células inmunocompetentes “In Vivo”, los ratones splenocytes fueron tratados con una concentración mínima no toxica de “PF2” “In Vitro”. La toxicidad de “PF2” fue estudiada sobre las células de melanoma de ratón línea B 16 (Fig. 2.1). Los datos muestran que las diferentes preparaciones de “PF2” tienen diferentes efectos citotóxicos sobre las células tumorales. De acuerdo a los datos de toxicidad la siguiente dilución de preparados “PF2” fue usada para evaluar sus efectos sobre la actividad citotóxica de splenocytes de C57 ratones negros “In Vitro”: N12. N14 fueron probados en dilución 1:200, N7 –1:5000. Los resultados se muestran en la Tabla 2.1. Todos los preparados tenían efectos sobre la actividad estimulante de ratones splenocytes cuando el ratio efectos / objetivos fue 1:20. N12 había estimulado actividad citotóxica en todos los ratios efectos/ objetivos estudiados. TABLA 2.1 EFECTOS DE LOS DIFERENTES PREPARADOS DE “PF2” (N7, N12, N14) SOBRE LA ACTIVIDAD CITOTÓXICA DE LOS RATONES NEGROS SPLENOCYTES c57 NEGRO, EN CONTRA DE LAS CÉLULAS DE MELANOMAS DE RATÓN B16 “IN VITRO”. LOS EFECTOS FUERON EVALUADOS DE ACUERDO AL RATIO DE SUPERVIVENCIA DE LOS OBJETIVOS CELULARES. RATIO CTI, % DILUCIÓN DE “PF2” EFECTOS OBJETIVOS N7 1:5000 N12 1:200 N 1:200 1:5 3.5 0 14.1 1.6 1:10 18.0 14.0 34.5 14.1 1:20 35.4 66.2 68.0 60.4 FIG 2.1 FIG. 2.1 La actividad citotóxica de los diferentes preparados de la “PF2” (N7, N14,N12) contra las células melanomas de ratón B16 “In Vitro”. TABLA 2.2 EFECTOS DE “PF2” (FRACCIÓN N14) SOBRE LA ACTIVIDAD CITOTÓXICA DE RATÓN SPLENOCYTES CONTRA LAS CÉLULAS MALIGNAS AUTOLOGOUS (MIELOMA DE RATÓN LÍNEA CELULAR Sp2/0) “IN VITRO”. RATIO CTI,% EFECTOS / OBJETIVOS “PF2” 1:20 8.3 19.3 1:40 30.8 33.5 Estos datos muestran que la “PF2” estimula la actividad citotóxica de ratones splenocytes y que diferentes preparados de “PF2” tienen efectos diferentes. Para estudiar los efectos de la “PF2” “In Vivo”, “PF2” fue administrada a ratones C57negro y Balb/c , diariamente durante 3 días, por vía oral. Las dosis diarias eran de 0.5ml y fue administrado en 4 dosis. Los bazos fueron quitados y la suspensión splenocytes fue preparada de acuerdo a materiales y métodos. Las Células de mieloma de ratón, línea celular B16 fue usada como objetivo para los ratones Splenocytes de C57negros, Sp2/o fue usado como objetivo para los ratones Balb/c. Los resultados muestran que 3 días de administración de “PF2” incrementa la actividad citotóxica de células inmunocompetentes contra células tumorales allogenic. (Tabla 2.3). TABLA 2.3 Actividad citotóxica de ratones splenocytes después de 3 días de tratamientos con “PF2” (dosis diarias 0.5 ml). Ratio efectos / objetivos Splenocytes-C57Negro Objetivos-B16 1:10 1:20 1:40 Splenocytes-Balb/c Objetivos-Sp2/0 1:20 1:40 R CTI, % at Fracciones io o b je ti v o s c el ul a r es o b je ti v o/ ef e ct o s C o n 1 tr ol 2 3 4 1: 2, S 5 K 1: O 5 V 3 1: 1 0 0 7. 0 3 0 1 0 7. 2 4. 8 1. 5 1 8. 2 4. 8 1 6. 4 2 3. 7 2. 4 1 7.2 3. 17.3 0 30.4 2 6. 8 S K V L B 1: 2, 0 5 0 1: 5 0 1: 0 0 0 0 0 0 0 0 0 0 0 0 5 “PF2” 3. 1 16.9 8. 18.0 9 36.3 1 5. CTI,% Control CTI,% “PF2” 25.4 40.8 65.3 37.5 52.4 68.5 5.7 22.7 12.4 37.0 1 0 1 Como se puede ver, la “PF2” induce el incremento de actividad citotóxicas de células inmunocompetentes contra las células malignas de ambos tanto “In Vitro” como “In Vivo”. CAPITULO 3 FRACCIONAMIENTO Físico-QUÍMICO DE LA “PF2”” Y EL Análisis DE LA ACTIVIDAD Biológica DE LAS FRACCIONES. Tres propuestas fueron elegidas para el fraccionamiento de la “PF2”: 1. Fase - inversa cromatográfica sobre el Nucleosil C4. 2. Fraccionamiento por etanol y extracción de cloroformo, seguido de una precipitación con 80% de sulfato de amonio. 3. Extracción por hexane, cloroformo y etanol. Las fracciones fueron analizadas por su capacidad para modificar la actividad citotóxica de PBLs contra los carcinomas ováricos humanos línea celular SKVLB y SCOV3. Los resultados se muestran en la tabla 3.1. TABLA 3.1 Actividad biológica de la fracción, obtenida mediante fase inversa cromatográfica. De la “PF2” sobre el Nucleosil C4 en agua-acetonitril gradient con la presencia de 0.1%TFA. Las fracciones 3, 4 y 5 estimulan la actividad citotóxica de PBLs. Fracción I reprime su actividad. Desde entonces los carbohidratos son elementos esenciales de extractos de plantas de agua, la presencia de carbohidratos fue analizada en diferentes porciones del “PF2” mediante la reacción con fenol y ácido sulfúrico. Los Carbohidratos fueron encontrándose el extracto completo y en fracciones 1 y 2 no activas “In Vitro” y estuvieron ausentes en las fracciones 3,4 y 5, activo “In Vitro”. TABLA 3.2 Efectos biológicos de porciones diferentes de la “PF2”, obtenidas por la extracción con solventes diferentes o por un preparado de sulfato de amonio sobre la actividad citotóxica de PBLs. Ratio CTI, % Objetivos objetivo/ efecto Control I II III IV V “PF2” SKOV3 1:2,5 1:5 1:10 0 7,3 17,2 4.5 12.8 17.1 0 0 5,2 6.3 17.4 17.8 0.4 1.5 12.3 0 14.1 20.4 5.2 20.0 27.2 SKVLB 1:2,5 1:5 1:10 0 0 0 0 0 25.2 0 3.5 19.8 0 17.2 31.3 0 10.1 19.4 0 0 8.0 Los resultado, resumidos en la Tabla 3.2 mostraron la distribución de la actividad biológica de “PF2” en fracciones, obtenidas por el fraccionamiento de la “PF2” con etanol y cloroformo y por la preparación con 80% de sulfato de amonio. Los datos muestran de cloroformo y parcialmente polimerizado, probablemente en la forma presente de componentes de proteína, que se muestran por la presencia de actividad biológica en la fracción 5, obtenidas después de la precipitación de sulfato amónico. Aquí deberíamos mencionar que estos resultados demuestran únicamente una evaluación cualitativa de la actividad biológica. CARACTERIZACIÓN DE LAS FRACCIONES El extracto I fue obtenido después de la evaporación de ~ 1 mg. de “PF2”. Tenía un agradable olor, parecido a anethol o eugenol. Una fina capa cromatográfica (TLC) (n-C6P14; AcoEt, 1:1) manifestó una serie de manchas rectangulares (Rf. 0.9, 0.7, 0,57), visible bajo rayos UV en invisible después del calentamiento. Gas liquido cromatografico (GLC) (Cromatografia Hewlett-Packard 5890A, integrador Hewlett-Packard 3393 A, columna capilar ultra-2 (0,33 µm, fase liquida, capa de 25m X 0.2mm), gas- nitrógeno, Temperatura perfilada: 800C (min. isotérmico, línea creciente con la proporción de 108/m hasta 2900C) manifestó un montón de sustancias diferentes en la muestra de PF-2 (95 picos), la intensidad más alta de pico (t 10.6min.) fue 17,2%, 17 picos tenían mas intensidad del 1%. 2 extractos fueron obtenidos después de la evaporación de ~ 2-3 mg de “PF2”. TLC reveló una serie de manchas Rf>0,7 (UV, débil) .0,59(), 0,44( UV,), 0,40 () y vigilar de cerca el comienzo (UV). 2 extractos fueron fraccionados sobre las columna con silicagel silpearl. 2A GLC ( En las mismas condiciones experimentales ) 16 picos, max. t 5.64mim (25,3%) y 7.57min. (26,2%). 2B TLC 9n-C6H14, AcOEt, 1:1) ; Rf 0,57. () 2C TLC Rf.0.46 y – 0.33 (uv) Precipitado 3 (0,34g), color negro, obtenido por la evaporación de suspensión de agua. Supernatant 4 (i.20g) obtenido por la evaporación del rotor, porción (128 mg) fue analizado en la columna con Sephadex G-15 V0_ 20ml, dilución de agua, Fig 3.2) En una porción de 2.0ml la presencia de carbohidratos fue analizada mediante la reacción con Fenol y ácido sulfúrico. Elution adicional por 20ml de una seria dilución de la fracción 4D. Los pesos de las fracciones fueron: 16.8 18.0 36.3 4A..... 3mg, 4B......42mg, 4C.........29mg, 4D……3mg (algunas perdidas menores pueden ser debidos a la irreversible absorción del material durante la filtración del gel). 4C contiene cristales con colores claros. m.b. no orgánicos. FIG. 3.1 Fraccionamiento de la “PF2” usando TLC, para la nueva separación del preparado 2 mediante extracción de cloroformo y filtración de gel sobre Sephadex G-15 de la fracción que puede no ser extraídas mediante cloroformo y hexane y no es soluble en etanol.- significa la capacidad de la fracción de estimular la actividad citotóxica de PBLs, - sin tales efectos. FIG. 3.2 FIG. 3.2. Separación de la fracción 4 sobre Sephadex G-15 (Curva elution) Casi toda la actividad tóxica de la porción 4 estaba determinada por la sustancias en la fracción 4D. La Fracción 4A la cual no tenía actividad citotóxica propia, tenía el más alto efecto estimulante sobre la actividad Citotóxica de PBLs. Este dato muestra que las diferentes substancias en “PF2” determina su propia actividad citotóxica y su capacidad para estimular la actividad Citotóxica de PBLs. El Fraccionamiento de la “PF2” y el análisis de la fracción mostró que los efectos estimulantes de la “PF2” sobre la actividad citotóxica, del PBLs está determinada mediante la mezcla de múltiple componentes de sustancias lipofílicas, extraídas por hexane y cloroformo. Pero la conclusión final sobre la posibilidad del uso de la “PF2” en la práctica clínica puede ser realizada únicamente después de las pruebas adicionales en modelos animales. FIG. 3.3 FIG 3.3 La actividad citotóxica de las fracciones 4, 4A, 4B, 4C, 4D contra los carcinoma humano, línea celular SCOV3. CAPITULO 4: ARREGLO DE LAS CONDICIONES DE PREPARACIÓN Y ALMACENAJE DE LA “PF2”. LA “PF2” es la extracción de los componentes activos de la materia prima mediante un nuevo procedimiento patentado a nivel mundial: 1. Extracción de agua a 25ºC. 2. Extracción de agua a 37ºC. 3. Extracción de Ethanol (10%) a 25ºC. 4. Extracción de Ethanol (10%) a 37ºC. La extracción se hizo con el agua o el ethanol desde 300g/l de la materia prima. Este valor se eligió de acuerdo a los requisitos presentados. Durante los procesos de extracción las muestras fueron recogidas cada 3 días. La extracción fue seguida mediante la centrifugación y la esterilización a través de filtros de 0.22 . Se formaron precipitados durante el almacenaje de estos extractos. La actividad biológica de los extractos fue evaluada mediante los siguientes criterios: 1. Actividad citotóxica de los extractos. 2. Efecto de los extractos sobre la actividad citotóxica humana PBLs "In Vitro". Estas características se compararon con la características preparación estándar de la “PF2”, actividad biológica de la “PF2”, preparado mediante la disolución de los productos liofilizados. Después de la extracción mediante los procedimientos 1-3, los extractos no son tóxicos en dilución 1:400, mediante el procedimiento 4 – 1:1600. Estas diluciones de los extractos se probaron por su capacidad para estimular la actividad citotóxica del PBLs. La preparación estándar se probó en dilución 1:500, a causa de su importante poder tóxico. TABLA 4.1 Los efectos de las diferentes preparaciones (preparados de acuerdo con los diferente procedimientos de extracción.) sobre la actividad citotóxica del PBLs. Objetivo celulares – Carcinoma ovárico humano células línea SCVLB. Actividad Citotóxica, régimen de extracción Tiempo de extracción (días) 1 3 Ratio objetivos/ I efectos II III IV 1:5 1:10 1:5 1:10 22 40 19 51 33 57 22 40 27 56 30 48 38 68 33 64 1:5 1:10 1:5 1:10 1:5 1:10 1:5 1:10 6 9 12 15 26 39 32 50 41 48 53 53 Control “PF2” “PF2” 1:5 1:10 no 40 59 33 50 34 56 34 54 46 55 29 58 35 49 28 49 30 40 49 56 41 49 19 34 40 46 Dilución 1:4000 Dilución 1:500 40 53 46 63 Con ello se mostró que la actividad biológica se conserva únicamente después de la extracción por procedimiento I (extracción de agua a 25ºC, 1-3 días) Una extracción más grande conduce a la desaparición de la actividad biológica. TABLA 4.2 Efectos de la liofilización sobre la actividad biológica de “PF2” examinada por sus efectos estimulantes sobre la actividad citotóxica de PBLs. Actividad Citotóxica, % Ratio objetivos/ efectos Control sin “PF2” “PF2” antes liofilización “PF2” después de liofilización 1:5 1:10 40 59 71 71 58 66 La actividad antitumoral de la preparación estéril fue comparada con la misma actividad de la preparación antes de la esterilización (actividad inicial) en los modelos animales, usando la línea celular Sp2/O. Los resultados (Tabla 4.3.) mostraron que la actividad biológica de la “PF2” se reduce después de su esterilización, eso puede ser la evidencia de la contribución parcial de los efectos antitumorales de producción bacteriana a los efectos antitumorales de la “PF2” sin esterilizar. Como se mostró en clínicas, algunas bacterias, por ejemplo Lactobacillus caseu tiene efectos antitumorales. TABLA 4.3 Frecuencia de la formación de tumores en ratones Balb/c después del tratamiento con “PF2” estéril y no - estéril (administración intraestomacal (vía oral) 8 veces al día, dosis diaria 0.04 ml). “PF2” preparación Frecuencia de formación tumoral -­‐ 90 “PF2” no estéril 25 “PF2” estéril 50 El Siguiente esquema fue elegido para la preparación del inmunomodulador desde la sustancia inicial de la “PF2”: 1. Centrifugación (Beckman centrifugadora j2-21, rotor N14, 13000r/min. 30 min.) 2. Esterilización de la filtración a través de filtro de 0.22 micras 3. Almacenaje en frascos estériles de 250ml (+4º C)* *- Las condiciones de almacenaje permiten la formación del preparado marrón sobre el fondo del frasco. CAPITULO 5 EVALUACIÓN DE LA ACTIVIDAD BIOLÓGICA DE “PF2” EN LOS MODELOS ANIMALES. 5.1 ESTUDIOS TOXICOLÓGICOS. La toxicidad de la “PF2” fue estudiada en los modelos de ratón. La “PF2” fue administrada intraperitonealmente en ratones Balb/C en diferentes dosis. El porcentaje de supervivencia fue determinado a las 24 horas de haber administrado la “PF2”. (Tabla 5.1.1.) TABLA 5.1.1 Toxicidad de una administración única intraperitoneal (dosis diferentes). Dosis mg/kg 0.56 5.6 28.0 volumen/raton ml 0.12 1.2 6.0 de “PF2” Supervivencia, % 100 100 0 LD50/24 estuvo entre 5.6mg/kg y 28.0mg/kg. De acuerdo con este dato “PF2” no es un componente tóxico. (Clasificación de WHO). 5.2 ESTUDIO DE LOS EFECTOS ANTITUMORALES DE LA “PF2”. Los efectos antitumorales de “PF2” fue estudiado en los ratones modelos. Los tumores fueron generados por inoculación subcutánea de los animales en experimento (ratones Balb/c) con las células mielomas de ratón Sp2/0 (0.5 ml de células en 0,1 ml de placebo). La primera vez la “PF2” fue administrado 24 horas después de la inoculación de las células malignas y después de ello se administró diariamente, 4 veces al día, 8 ml /kg. Los resultados se muestran en la tabla 5.2.1. TABLA 5.2.1 Los efectos de la administración diaria intraestomacal de “PF2” (0,04ml 4 veces al día) sobre el tumor desarrollado. Grupo Frecuencia de tumores desarrollados después de un mes de tratamiento, % Control 91 “PF2” 20 Los datos muestras que la “PF2” tiene una actividad antitumoral en modelos de ratón “In Vivo”. Para evaluar los efectos terapéuticos, la “PF2” fue usado para el tratamiento fueron tratados con “PF2” intraestomacalmente (vía oral) con una dosis de 40ml/kg ,8 veces al día (dosis más alta que en el experimento anterior), los animales del grupo de control obtuvieron únicamente placebo. Los resultados se muestran en la Fig. 5.2.1. Del tratamiento de animales con “PF2” resultó una significativa inhibición del crecimiento de los tumores. Para elegir el protocolo optimo de la administración de la “PF2” fueron probados varias combinaciones en el mismo modelo de ratón. 1. 2. 0.04 ml de “PF2” 4 veces por día. 0.1 ml de “PF2” 8 veces por día. 3. 0.2 ml de “PF2” 8 veces por día durante 14 días, y 0.05ml veces un día. 4. 8 Grupo de control, PBS. Los resultados se muestran en la Figura 5.2.2. El protocolo 3 fue elegido como optimo por la cohibición del crecimiento tumoral en los animales experimentados. Los datos experimentales están resumidos en la Tabla 5.2.2. FIG 5.2.1 Tamaño del tumor en cm3 Días FIG. 5.2.1. La dinámica del crecimiento del tumor inducido Sp2/o tumor inducido en los animales controlados (1) y después del tratamiento con administración de “PF2”. FIG. 5.2.2 Tamaño del tumor en cm3 FIG. 5.2.2 Dinámica de crecimiento del tumor inducido Sp2o en los grupos experimentales y de control de animales. Protocolo de la administración de “PF2”: 1. 4 veces por día, 0.04ml por ratón 2. 8 veces por día, 0,1ml por ratón 3. 8 veces por día, 0,2ml por ratón durante 14dias, entonces 8 veces al día 0,05ml por ratón. 4. Grupo de control. TABLA 5.2.2 Actividad anti-tumoral de “PF2” (dosis diferentes) utilizadas en el protocolo con administración diferente. Frecuencia de la Frecuencia formación Ratio de la de la Protocolo de Incremento del tumor un media de administración completa de la media mes después supervivencia, disminución de “PF2” de vida, % de en días. del tumor tratamiento; % 1. 0.04 ml, 4 30 veces al día 20 67.1 61.3 2. 0.1 ml, veces al día 30 20 56.7 36.6 3. 0.2 ml, 8 veces al día 14 días, y luego 8 10 veces al día 0.05 ml. 40 72.7 74.6 4. 0 41.6 - - 8 90 5.3 COMBINACIÓN DE “PF2” TUMORALES Y SU USO “IN VIVO” CON MEDICAMENTOS ANTI- La acción combinada de “PF2” y conjugada de alfaFP con Vinblastina fue estudiada en los ratones modelos conjugada fue administrada intraperitonealmente, diariamente durante 7 días, (15 mkg-kg de Vinblastina, diariamente). La “PF2” fue administrada diariamente, 8 veces / día, 0.05ml cada dosis. El efecto de esta dieta está resumido en la Tabla 5.3.1. TABLA 5.3.1. La frecuencia de formación de tumores en ratones Balb/c después de la inoculación con células tumorales, seguidos por la administración de la conjugación alfaFP-VP y “PF2”. Medicamento Dosis Frecuencia de la formación del tumor en %. 1.Control - 90 2. alfaFP-VB 15µ/kg de VB, 7 días, i/p 60 3. “PF2” 0.05ml, 8 veces/día, diariamente 25 4. alfaFP - VB + “PF2” Similar a 2,3 25 Los resultados prueban la posibilidad del uso combinado de “PF2” con medicamentos quimioterapéuticos. 5.4 POSIBLE USO DE LA “PF2” PARA LA PREVENCIÓN DEL CÁNCER. La capacidad de la “PF2” para prevenir la formación de tumores fue estudiada en los mimos modelos de ratones. Los animales fueron inyectados con “PF2” diariamente intraestomacalmente (vía oral), 8 veces al día 0.05 ml por dosis. Entonces la administración de la “PF2” se paró. El grupo experimental y el de control de animales fueron inoculados con células Sp2/o (0.5ml). 90 días después de la inoculación todos grupo de control desarrollaron tumores y murieron. Estos experimentos prueban la evidencia que la “PF2” es altamente efectivo en la prevención de la formación del Cáncer. Tabla 5.3.2 Frecuencia de la formación del tumor en ratones después de la administración preventiva de la “PF2” Sustancias Frecuencia de la formación de Tumores en % PBS 100 “PF2" 0 CONCLUSIONES: 1. “PF2” reduce significadamente la frecuencia de la formación del tumor. 2. “PF2”, cuando se utilizó en altas dosis, consiguió el incremento de la vida de los animales tratados. 3. “PF2” impidió el crecimiento tumoral. 4. La “PF2” es muy efectiva en la prevención de la formación del tumor, por lo tanto puede ser utilizada para la prevención del cáncer CONCLUSIONES GENERALES: Los resultados definitivos del informe demuestran que el estudio de la sustancia llamada “PF2” es claramente antitumoral, no solo debido a la directa acción citotoxica y citostatic, sino también debida a la activación de las defensas des sistema del organismo en general. Se demuestra la capacidad para prevenir el CÁNCER en los modelos animales donde la “PF2” ha probado ser un efectivo agente previsor. Estas propiedades de la inmunomodulador. “PF2” nos permiten calificarlo como un Nuevos estudios están planificados para investigar la actividad antitumoral en la radiación inducida y en los modelos tumorales cancerigenos inducidos. Su baja toxicidad y su alta actividad antitumoral en los experimentos con animales hace ver a la “PF2” como candidata para su uso en la fase I de las pruebas clínicas para la investigación de su posible uso en la terapia contra el cáncer. Resumiendo todos los datos experimentales, revisando el manuscrito, llegamos a las siguientes conclusiones: 1. La “PF2” no tiene efectos mitogénicos en PBLs “In Vitro” sobre humanos. 2. PBLs. La “PF2” no induce a la secreción de factores citotóxicos en 3. La “PF2” no cambia la actividad antitumoral de las medicinas (por ejemplo doxorubicina). 4. La “PF2” no tiene efectos reversibles sobre los múltiples medicamentos resistentes de las células cancerosas. 5. La “PF2” incrementa la actividad citotóxica de los linfocitos, monocitos y neutrófilos de los donantes saludables y de pacientes de cáncer contra el objetivo de las células malignas "In Vitro". 6. La alta concentración de “PF2” es citotóxica contra la rápida proliferación de las células malignas. 7. La “PF2” induce al incremento de la actividad citotóxica de las células inmuno incompetentes las células malignas tanto "In Vitro" como "In Vivo". 8. El fraccionamiento de la “PF2” y el análisis de sus fracciones mostraron que la estimulación de los efectos de la “PF2” sobre la actividad citotóxica del PBLs están determinadas por los múltiples componentes mixtos de sustancias lipofílicas, extraídas por hexane y cloroformo y por la molécula altamente soluble en el agua, conteniendo la fracción hidratos de carbono. 9. Los estudios llevados en los modelos animales como ratones con tumores, inducidos por inoculación del tumor celular autologous, mostró que la “PF2” de los animales tratados. La “PF2” impide el crecimiento del tumor y pareció ser muy efectiva en la prevención de la formación del cáncer, así que puede ser usada para la prevención del cáncer. REFERENCIAS: 1. Roth C., Rochlitz Ch., Kourilsky Ph. Adv.Immunol..1994, 57, 281-351. 2. LeyV., Langlade-Demoyen P., Kourilsky P., Larsen-Sciard E.L. Eur.J Imunol., 1991, 21,851-854. 3. Rusel S.J., Eccles S.A., Flemming, Johnson C.A., Collins M.K.L. Int.JCancer. 24-251 4. Hoghton A.N., Mintzer D., Cordon- Cardo C. et al.Proc.Natl.Acad.Sci. 1242-1246. 5. Cheung N.K.V., Munn D., Kushner B.H. et al.Nucl.Med.Biol., 1989,16, 6. Deleo A.B., Jay G., Appella E., Dubois G.C., Law L.W. Old L.J. Proc.Natl. Acad.Sci., 1979, 76,2420-2424 7. Schreiber H. Ward P.L., Rowley D.a., Straus H. Ann.Rev., Immunol. 1988 8. Parnes J.R. Adv.Immuno., 1989,44,265-311. 9. Bishop V. Cell, 1991, 64, 235-247. 10. Hollstein M., Sidransky D.,Vogelstein B., Harris C. Science, 1991, 253,49-53. 11. Houbiers J:G.A., Nijman H.W., van der Burg S.H., tt al Eur.J.Immunol., 2072 -2077. 12. 315, Shtivelman E.B., Lifshitz R.P., Gale R.p., Ganaane T. Nature, 1985. 13. Hermans A., Heistercamp N., von Linden M. et al. Cell. 1987, 51, 33-37. 14. Chen W., Peace D.J., Rovira D.K. et al Proc Natl. Acad.Sci., 1992,89. 15. Almoguera C., Shibata D., Forrester K. et al, Cell, 1988, 53, 549-544. 16. Bos J.L., Fearon E.R., Hamilton S.R. et al. Nature, 1987, 327, 293-297, 17. Bos J.L., Velaan-de vris M., van der Eb A.J. et al .Blood, 1987, 69, 18. Farr C., Saiki R., Erlich H.A. et al Proc.Natl.Acad. Sci, 1988, 85,1629-1633 19. Rochlitz C.F., Scott G.K., Dodson J.m. et al. Cancer Res. 1989. 49, 357-360. 20. Fenton R.J., Taub D.T., Kwak L.W., Simith M.R. Longo D.L. J.Natl. Cancer Inst., 1993, 85,1294-1302. 21. Boon T.adv.Cancer Res., 1992,58, 177-210 22. Wang P., Vegh Z., Vanki F., Klein E. Int. J.Cancer, 1992,52,517522 23. Browing M.j., Bodmer W.F. Curr.Oppinion Immunol., 1992, 4, 613618. 24 246. Schrier P.L., Peltenburg L.T.C. Adv. Cancer Res., 1993, 60, 181- 24. Freeman G.J., Gray G.S., Gray G.S., Gimmi C.D. et al. J.Exp.Med., 1991, 174, 625- 631. 367. 26. Jenkins M.K., Johnson J.G. Curr. Opinion Immunol. 1993, 5, 361- 27. Linsley P.S., Greene J.L., Tan P., Bradshaw J.et al. J.Exp.Med., 1992,176, 28. Schwarz R.H. Science, 1990, 248, 1349-1356. 29. Nabavi N., Freeman G.j., Gault A. et al. Nature, 1992, 360, 266268. 30. Bascar S., Ostrand-Rosenberg S., Nabavi N. et al. Proc. Natl.Acad.Sci, Sulitzeanu D. Adv.Cancer Re., 1993, 60, 247267. 31. Gotlieb W.H., Abrams J.S., Watson J.M. et al .Cytokine, 1992, 4, 385-390. 32. Gastl J.A., Abrams J.s., Nanus D.M. Int. J. Cancer, 1993, 55, 96-101. 33. Cavallo F., Giovarelli M., Gulino A. et al J. Immunol., 1992, 149, 3627-3635. 34. Hock H., Dorsh M., Kuncendorf U. et al. Proc.Natl. Acad.,Sci,. 1993. 35. Hock H., Dorsh M,. kincendorf U. Cancer Res., 1993, 53, 714716. 36. Vermes I., Haanen C. Adv Clin.Chem., 1994, 31, 177-246. 37. Uchida A. Cancer Immuno. Immonother. 1993, 37,75-83 38. Shirmacher V., Beckhove Ph., Kruger A. et al. Int.J. Oncol., 1995, 39. Rietmuller G., Schneider E., Johnson J.P. Curr. Opin.Immunol., 1993,5. 40. Jurcic J.G., Schienberg D.A. antibody, Immunoconjugates and Radio Pharmaceuticals, 1994, 7, 203-223. 5687-5690. 41. Beun G.D.M., van de Velde, Fleuren G.J. Immunol.Today, 1994, 15.11-15 42. Chatterjee M.B., Foon K.A., Kohler H. Cancer Immunol.Imminother., 43. Clinical immunology and allergology (Rus). Ed. L. Ieger.Moscow. Medicine.1990, Vol 2, p. 475-506. 44. Newell K.A., Ellenhorn H.D.I., Bruce D.S., Blueston J.A. Proc. Natl., Acad.Sci., 1991, 88, 1074-1078 45. Tracey K.j.,Cerami A. Ann.Rev.Cell.Biol., 1993,9.317-343. 46. Sidhu F.s., Bollon A.P. Pharmac Ther.,1993,57,79-128. 47. Kupin V.I.Back to the future.,M.,p111 48. Use of the plants in medicine. Turova A.. D. M., Medicine, 1974, p. 320. 49. Dannikov H.H. Cure is possible. Traditional medicine against cancer.M.Labirint. 1993.p.320. 50 Yang Jicheng, Ling Jingshan, J.Integrated Tradicional and Western Med., 1986, 6, 231-233. 51 Kunpin V,L., Polevaia E.B. Vopr.Oncologii, 1986, 7, 21-26. 22 Kupin V.L, Polevaia E.B. Sov.Medicina. 1987,5,114-116 53 Yo- Yong Li J. Traditional Chinese Med. 1988, 135-140. 54. Xie Shu-Sheng<lu-Feng<Qin Feng-Hua Chinese J. Microbiol.Immunol., 153-155 54 Kenichi M., Morita L,Oguchi Y., J.Clin.Lab.Immunol. 1987,24,143-149 56 Shigeki Takashima, Yoshiro kinami, Itsuo Miazaki, Jpn J.Cancer . Chemother.,1988, 15 2229-2236 57 Hitoshi Komaki. Yoshihosa Quizuka, Kinro Mihara Jpn. H.Cancer. hemopher.,1988, 15, 2801-2804 58 Takeshi Inagaki, Kimito Morise, Hayato Matunaga Jpn, J.Cancer. Chemother, 1988, 15, 319-324. 59 Wooles W.R., Di Luzio. In the book: Stimulators of the immunitet. Moscow. Medicine 60 Seljelid R., Rogweld j., Lundwal A. Exp.Cell.Res., 1981, 131,121-129. 61 Shigeru Yoshizawa, Takachiko Horiuchi, Hirota Fujikio. Phitotherapy. Res, 1987,1, 44-47. 62 Mosman T. J. Immunol. Meth., 1983,65,55-63 63 Alley M.C. et al. Cancer Res., 1988,48, 589-601 64 Boyum A.Scand J.Clin. Lab.Invest., 1968,21 Suppl. 97, 9-18 65 Douros J.,Suffnes M., Cancer Treatment Rev., 1981, 8, 63-87. 66 Cassady J.M., Baird W.M., Chang G.J.J. Nat.Prod., 1990, 53, 23-41 67 Mashkovski M.D. Terapeutic drugs. M.Medicina, 1993, Vol II, 527-532. 68 Hadden J.W.,Intern.J.Immunorehabilitation, 1996,3,3-10 69. Bimboim H.C., Jevcae J.J.Cancer Res. 1981, 70 hiery D.,Rigaud o., Duraton L,. Moustachi E., Magdelenat H. 71 Radiat.Res., 1985, 102,347-358 72 Kos F.J. Immunol.Cell,Biol,. 1989,67,433-436 73 Apryshko G.M., Reshetnikova V.V., Lesnaya N.A., Gerasimova G.K. 74 The database on antitumor natural products. Abstr of 9- th NCI-EORTC 75 symposium on new drugs in cancer therapy. March 12-15. 1996.Amsterdam 76 Annals of Oncology, March, 1996, v, 7 Suppl., 113. 77 I shizuka M., Kanatsu M., Yamashita T. et al .Int.J. Immunopharmac N2, 133-139 78 Demande de brevet dinvention en France 19505054 EL ANÁLISIS DE LA “PF2” POR MEDIO DE LA GRAN CALIDAD DEL LIQUIDO CROMATOGRÁFICO Y SDS-ELECTROPHORESIS HPLC: La pruebas de la “PF2” fueron resueltas sobre la columna "Nucleosil 30-7C4" (Macherey-Nagel, 3.50 mm.) La elution de la sustancias absorbentes en 214 nm fue realizado por una pendiente lineal (0-80% de acetonitril, conteniendo 0,1% de ácido trifluoracetico. Los resultados de las resoluciones están presentados en la figura 1. Los picos fueron combinados separadamente, liofilizado y analizado en los experimentos con células humanas. SDS-Electrophoresis; durante el transcurso de la resolución de la “PF2” sobre elecrophoregramma nos hemos encontrado con 4 bandas de proteínas principales con aproximadamente una masa molecular de: 100,70,50 y 42 kDa (Figura 2). LOS EFECTOS DE LA “PF2” SOBRE EL NIVEL CELULAR Nosotros hemos investigado: 1. Los efectos de esterilización de la “PF2” por filtración sobre su capacidad para estimular la actividad citotóxicas de leucocitos mononucleares (ML) hacia las células tumorales humanas "In Vitro". 2. Los efectos de los picos separados de “PF2” tras el alto rendimiento liquido cromatográfico HPLC, sobre CTA de ML hacia carcinomas ováricos SKVLB células. Los efectos de la “PF2” respecto a la resistencia (SKVLB) y sensibilidad (SKOV3) para células carcinomas ováricas en comparación con Verapamil- la sustancia capaz de transformar la resistencia de las células SKVLB. Los resultados: 1. CTA fue estimada como un superviviente de los objetivos celulares en co-cultivación con ML en la presencia de “PF2” en dilución 1:100. El superviviente de objetivos celulares como SKVLB y SKOV3 (Carcinomas humanos ováricos resistentes y sensibles a antracilinic y antibioticos respectivamente) fue medido después del lavado de ML en MTT- test. Se mostró (Tabla 1) que la esterilización del ACTIVIDAD CITOTOXICA % SKOV3 como objetivo celular SKVLB como objetivo celular Inmuno Inmuno Inmuno Inmuno Control noControl noEsteril Esteril esteril esteril 1:1.2 21.9 2.8 13.1 0 6.2 25.6 1:2.5 31.6 4.0 16.2 8.5 14.3 18.5 1:5 34.7 6.6 12.0 10.3 26.6 - 1:10 48.5 21.6 46.3 39.2 26.6 44.0 TABLA 1 2. TABLA 2. INFLUENCIA DE LOS PICOS SEPARADOS DE “PF2” SUPERVIVIENTES DE LAS CELULAS SKVLB. MUESTRAS SUPERVIVENCIA DE CELULAS % Control 100 “PF2” (1:100) 100 “PF2" pico nº 1 84.4 pico nº 2 85.9 nº3 97.2 nº 4 89.5 nº 5 85.7 TABLA 3. LOS EFECTOS DE LOS PICOS SEPARADOS DE LA “PF2” SOBRE CTA DE ML HACIA LAS CÉLULAS SKVLB. ACTIVIDAD CITOTOXICA % CONTROL “PF2” PICOS 1:1.2 1:2.5 6.2 14.3 1 2 3 4 5 0 0 20.5 11.3 0 6.4 0 18.7 10.0 9.0 Como se puede ver desde las Tablas los picos separados de “PF2” no tienen actividad citotóxicas. Pero algunos de ellos estimulan CTA de ML con un alcance bastante alto. Ciertamente los experimentos necesitan más cautela para probarlos. 3. Los resultados obtenidos están representados en la Tabla 4 y permite concluir que “PF2” no tiene influencia sobre las actividades antitumorales de doxorubicina en comparación con el Verapamil. Así, que podemos concluir que los efectos de “PF2” sobre CTA de ML no combinaba con la funciones de la proteína p170(MDR, resistentes a múltiples medicamentos). TABLA 4 LOS EFECTOS DE LA “PF2” (1:100) Y VERAPAMIL (20nM) SOBRE LA ACTIVIDAD ACTIVIDAD ANTITUMORAL DE DOXORUBICIN HACIA SKVLB y SKOV3 CELULAS “IN VITRO”. Células supervivientes, % Células SKVLB Células SKOV3 DR+ DR+ DR+ DR+ DR DR “PF2” VER “PF2” VER 100 100 0 0.03 89 91 91 0.06 72 91 74 0.12 58 68 52 0.24 53 0.48 45 1.2 20 58 57 18 36 20 20 93 89 92 96 91 95 89 72 4 2.5 87 80 40 5.0 67 73 - 10.0 43 49 40 GRAFICO SOBRE LA ACTIVIDAD CITOTÓXICA DE LOS LINFOCITOS SKOV3/UNSTIM. GRAFICO SOBRE LA ACTIVIDAD CITOTÓXICA DE LOS LINFOCITOS SKVLB/STIM GRAFICO SOBRE LA ACTIVIDAD CITOTÓXICA DE LOS LINFOCITOS SKVLB/ UNSTIM. LOS RESULTADOS DE ANÁLISIS DE TOXICIDAD DE LA “PF2” 27 de marzo de 1995 La toxicidad de la “PF2” registrada entre 0.55g/kg. La administración de desarrollo de toxicidad aguda). Lo estimado LD50 para fue entre 10 y 28 kg. Conclusión: De acuerdo a los Principios y métodos de la determinación de toxicidad de sustancias químicas de la UN programa ambiental y WHO (Criterio higiénico de las condiciones ambientales,1981) la “PF2” no es tóxica y no tiene ningún efecto dañino o perjudicial. Este documento lo firma el Director general del Centro investigación de Diagnósticos moleculares y terapias de Moscú. El profesor E.S. Severin DETERMINACIÓN DE LA TOXICIDAD DE LA “PF2” de La toxicidad de la “PF2” fue probada sobre ratones (Balb/c) (Peso 1820g) por inyección intraperitoneal con diferentes concentraciones de “PF2” en las siguientes dosis: 1. 0.12ml (correspondientes a 0.55g/kg de peso) (lo mismo fue utilizado para el tratamiento con pacientes humanos). 2. 1.20ml (5.5g/kg) 3. 6.00ml (28g/kg) A los ratones controlados le fueron dados el mismo volumen de solución fisiológica. (Se utilizaron, 3 animales por cada grupo). En 24 horas ratones los cuales habían recibido 28g/kg murieron, los otros dos grupos y el grupo control estuvieron vivos durante 14 días, ( el tiempo necesario para el desarrollo de toxicidad aguda). Así que, “PF2” tiene una toxicidad de (LD50) entre 5.5 y 28g/kg, medidas conducidas en concordancia con los "Principios y métodos de la determinación de las sustancias químicas" de la UN programa medioambiental y WHO (Criterio higiénico de las condiciones medioambientales.1981). Consecuentemente los componentes de la sustancias de “PF2” no causa ningún efecto perjudicial al las concentraciones en el rango de 3-5 g/kg y además no es tóxico (Academia nacional de Ciencias, 1975). Para la investigación con el fin de saber cuando la “PF2” puede llegar a ser venenosa se necesitaría repetir diariamente las inyecciones de “PF2” durante 5-12 días. En nuestro experimento, los ratones recibían diariamente 4 dosis orales correspondientes a 0.55g/kg, estuvieron vivos durante 12 días y no mostraron ninguna diferencia de los ratones controlados. “PF2” EXPERIMENTO Nº 20 El siguiente experimento utilizando mieloma fue un éxito ( usando 16 ratones): El día que empezó el experimento sería llamado día "A". A. 16 ratones Balb/c fueron inyectados a "A", con 10 células de mieloma sp2/0. B. 5 de esos 16 ratones, dos días después de "A", empezaron a ser tratados oralmente con una dosis de “PF2” proporcional al volumen que se da en pacientes humanos. NINGUNO DE ESOS 5 RATONES DESARROLLARON NINGÚN TUMOR VISIBLE - 1 ratón sin embargo murió 30 días después de "A", sin ningún tumor visible. - Otro ratón murió 39 días después de "A", pero ellos tenia pequeños tumores sólidos con un diámetro de unos 3 mm). - 3 de ellos están vivos 50 días después del día "A" y con buena salud. C. Los 7 ratones controlados - que no llevaban la “PF2” murieron entre 37 y 40 días después de recibir una fuerte dosis de cáncer (mieloma), descrito en A. D. 4 ratones, sobre el día 26 después de "A", empezaron a ponerse “PF2” (después de la formación de visibles tumores- la tallas de los tumores fueron de 27x30, 10x24, 14x17 y 12x18mm). EL TRATAMIENTO DE LA “PF2” DETUVO EL CRECIMIENTO DE LOS TUMORES 2 de ellos murieron el día 41 2 de ellos todavía estaban vivos el día 50 y los tumores han parado su crecimiento y son de la misma talla que el día que empezaron a tomar “PF2”. CONCLUSIONES DESPUÉS DEL EXPERIMENTO Nº 20 1. La “PF2” tiene una influencia en el tiempo de aparición del tumor, por ejemplo: -Los tumores en ratones no tratados aparecieron sobre el día 19. -Los tumores en ratones tratados empezaron a aparecer sobre el día 26. 2. La “PF2” administrada oralmente en ratones con tumores formados (día 26) retardaron y pararon el desarrollo de tumores que habían aparecido el día 26 después de la inyección con mieloma se menciona en el apartado A. “PF2” EXPERIMENTO Nº 21 Los criterios siguientes del 1 al 4 fueron usados para este experimento con los parámetros adicionales (usando 50 ratones): 1. Tiempo de aparición del tumor. 2. Tamaño del tumor y dinámica de su desarrollo. 3. Duración de la vida de los ratones tratados y de los no tratados. 4. Autopsia de los principales órganos (bazo, hígado, etc.) de ratones que murieron. 50 ratones modelos Balb/c (Peso 18 - 20g) con 0.1ml (107 células) fueron inoculadas subcutáneamente con células mieloides. En el experimento nº 20 usamos una doble inyección tanto subcutáneamente como intraperitonealmente. Las células fueron obtenidas del tumor extraído de los ratones usados en el experimento nº 20, homogenizados, lavados con PBS y centrifugados. Para el control de viabilidad y cálculo de la cantidad de tinte especial - Trypan azul fue utilizado. A - 20 ratones fueron utilizados como control sin tratamiento. B - 30 ratones fueron alimentados con “PF2” por un nuevo procedimiento, con las siguientes concentraciones orales: b.1 10 ratones- 4 veces x 0.4ml por día (lo mismo que en el exp. 20 b.2 10 ratones - 8 veces x 0.1 ml por día b.3. 10 ratones- 8x 0.2 ml por día. En el ultimo grupo - dosis máxima recibida (10 veces más alta que en el experimento 20) Dos ratones después de 10 días de experimento inesperadamente desarrollaron edemas y murieron. Después que redujéramos la dosis al 50%. La situación del día 19 del experimento: A. Grupo sin tratamiento - 17 de 20 desarrollaron tumores visibles b.1 grupo con 4 x 0.04 (0.16ml diariamente) 1 de 10 desarrollaron un pequeño tumor b.2 grupo con 8 x 0.05 (0.04 ml diariamente) 1 de cada 8 desarrollaron 1 pequeño tumor b.3 grupo con 8 x 0.1 (0.8 ml diariamente) 2 de 10 desarrollaron tumores pequeños. LOS RESULTADOS DEL EXPERIMENTO CON RATONES EN EL DIA 50DESDE EL20/03/1995AL6/05/1995. A. GRUPO CONTROLADO (20 RATONES) MIELOMA DE RATÓN Sp 2/o Situación en el día 40 - 26-04-1995: 18 ratones tenían un tumor, desde 26/04/1997, 3 ratones con tumores empezaron a ser tratados con Vinblastine una vez a la semana y 3 ratones con tumores empezaron a ser tratados con Vinblastine junto con “PF2”. Situación en el día 50 - 6/05/1995: 14 ratones de este grupo controlado han muerto, y además 3 nuevos ratones tratados únicamente con Vinblastine murieron. Por lo tanto de los ratones controlados 17 ratones del total han muerto. Únicamente 1 ratón de los tres tratados con Vinblastine junto “PF2” está todavía vivo: En el día 40 y en el 50 tenían la misma talla de tumor 25 X 35 mm ( El mismo resultado que tuvimos en el primer experimento con ratones), pero 2 ratones de este grupo murieron (cuando se inyecto con Vinblastine habíamos elegido los ratones con los tumores más grandes-probablemente era demasiado tarde). Al mismo tiempo dos ratones los cuales no tenían tumores en el día 40 no tenían tumores visibles. Las razones son desconocidas. Finalmente, de ese grupo 3 ratones están todavía vivos: de los cuales 2 sin tumores y 1 (El cual fue tratado con Vinblastine y “PF2” con tumor. B. 10 RATONES INYECTADOS CON MIELOMA DE RATON Sp2o FUERON ALIMENTADO CON “PF2” 4 VECES CON 40µL (DETERMINACIÓN DE LA DOSIS). Situación en el día 40: 6 ratones tenían pequeños tumores, 4 ratones no tenían tumores. Situación en el día 50: 8 ratones estaban todavía vivos - 5 de ellos tenían tumores de tamaño pequeños. Los resultados: 1. Retraso en el crecimiento de tumores. 2. Muerte de 2 ratones 3. Aparición del tumor en un ratón más. Los 2 ratones (los que han muerto) habían recibido “PF2” contaminado - de acuerdo con nuestros experimentos con células, esta remesa fue altamente contaminada mediante almacenamiento. Ahora en este grupo tenemos 8 ratones 5 de los cuales tienen tumores. Comenzando el 5 de mayo 2 de ellos con tumores aún recibiendo “PF2” con alfa-fetoproteina vinblastina conjugada. C 10 RATONES INYECTADOS CON MIELOMA DE RATÓN Sp2/o FUERON ALIMENTADOS CON “PF2” ,8 VECES 100µl (DETERMINACIÓN DE LA DOSIS). Situación el en día 40: tenían. Situación en el día 50: tienen tumores. 6 ratones tenían pequeños tumores, 4 no 8 ratones todavía vivían - 6 de ellos Los resultados: 1. Los tumores han crecido pero mas lentamente 2. 2 ratones han muerto 3. aparición de tumores en 2 ratones más. Los dos ratones que han muerto habían recibido “PF2” contaminado de acuerdo con nuestro experimento celular, esta remesa estaba altamente contaminada mediante bacteria y levadura - probablemente la mala calidad de este lote es la única razón de su muerte estuvo (demasiado tiempo fuera de la nevera). Confirmando instrucciones de almacenaje. Ahora en este grupo nosotros tenemos 8 ratones, 6 de los cuales tienen tumor. Dos de ellos (con tumor) empezaron el 5 de mayo cuando aun recibían “PF2” a ser inyectados con alfa-fetoproteina: Vinblastina conjugada. D 8 RATONES INYECTADOS CON MIELOMA DE RATÓN Sp2o FUERON ALIMENTADOS CON “PF2”, 8VECES 50ml (determinación de la dosis) Situación en el día 40: Dos ratones tenían pequeños tumores 6 no tenían. Situación en el día 50: Todos los ratones estaban vivos y solo 2 de ellos tenían tumores( como en el día 40). Nuestras conclusiones: 1. “PF2” retrasa el crecimiento de tumores 2. Paraliza las muertes. 3. Paraliza la aparición de nuevos tumores. Ahora en día 6 de mayo tenemos en este grupo 8 ratones, 2 de los cuales teniendo tumores, y todavía recibiendo “PF2” fue inyectado con alfa-fetoproteina : Vinblastina conjugada. La dosis administrada en este grupo es la más apropiada. Algunos comentarios al experimento con el grupo D: Al empezar experimento nosotros teníamos 10 ratones en este grupo. Fueron tratados con altas dosis de “PF2”. Los 2 ratones han muerto en comienzo del experimento, después que cambiáramos la medida de dosis (entre B y C). Los mejores resultados probablemente se pueden explicar por rotura de la estimulación de la inmunidad al comienzo de formación del tumor y siguiendo de la dosis tardía. el el la la la