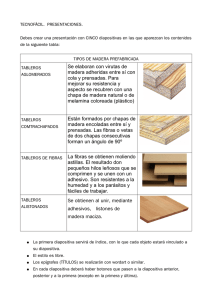
La reparación tisular empieza muy temprano en el proceso de
Anuncio

Diapositiva 1 Maria T. Ramírez ,MD. Patología .U. Valle Diapositiva 2 Reparación Celular Curación es una respuesta a la injuria tisular, y representa un intento del organismo para restaurar la integridad a un tejido injuriado.Se superpone a la respuesta inflamatoria. Diapositiva 3 Tipos de reparación • Regeneración • Reparación por tejido conectivo La reparación tisular empieza muy temprano en el proceso de inflamación. La curación es un proceso dinámico, que incluye mediadores solubles, células sanguíneas, matriz extracelular y células parenquimatosas. La reparación celular incluye dos procesos dicotómicos. O se produce la regeneración del tejido injuriado por células parenquimatosas del mismo tipo celular o se reemplaza por tejido conectivo (fibrosis), teniendo como resultado una cicatriz. Diapositiva 4 Regeneración • células especializadas Reparación • tejido de granulación Diapositiva 5 REGENERACIÓN Diapositiva 6 Slide 4.1 En la regeneración , el tejido lesionado se reemplaza por células especializadas para recuperar su morfología y función inicial. En la reparación no es posible recuperar el tejido original y éste es reemplazado por una neoformación vascular o tejido de granulación, el cual evoluciona para formar una cicatriz. Hablamos de regeneración cuando se recupera la morfología y la función normal de un tejido lesionado. Esta se logra a través de la proliferación de la población de células basales, que posteriormente se diferencian. El número de células en una población determinada , puede ser alterado por incremento o disminución de la proporción de muerte celular (Apoptosis) o por cambios en la proporción de proliferación o diferenciación. la proliferación celular puede estar estimulada por factores de crecimiento intrínsecos, injuria y muerte celular. Los mediadores bioquímicos presentes en el microambiente pueden estimular o inhibir el crecimiento celular. El control regulatorio más importante es la inducción de las células en reposo ( fase Go) para entrar al ciclo celular. Diapositiva 7 PROLIFERACION CELULAR • Clasificación de las células por potencial proliferativo – Lábiles – Estables – Permanentes Diapositiva 8 Slide 4.2 Las células del cuerpo se dividen en tres grupos, de acuerdo a su capacidad regenerativa y su relación con el ciclo celular. Con la excepción de los tejidos compuestos primariamente de células permanente ( músculo cardiaco y neuronas), la mayoría de los tejidos maduros contienen proporciones variables de células en continua división, células quiescentes que ocasionalmente regresan al ciclo celular y células que no se dividen. Las células lábiles están en continua división, pasando de una mitosis a otra. Las células permanentes han salido del ciclo celular y están destinadas a morir sin divisiones posteriores. Las células estables o quiescentes en fase Go no están en el ciclo pero pueden ser inducidas a re-entrar al ciclo celular, bajo un estímulo apropiado. Diapositiva 9 Células lábiles – Epidermis – Mucosa intestinal – Médula ósea Diapositiva 10 Diapositiva 11 • Constante recambio • Vida corta • Apoptosis Células estables • renovación lenta • Hepatocitos • Reemplazo rápido ante la pérdida. • Células de los túbulos proximales del riñón Un paciente que sufre un politraumatismo, con choque hipovolémico , con disminución del flujo sanguíneo al riñón e isquemia subsiguiente; puede presentar una falla renal, por NECROSIS TUBULAR AGUDA, Si este paciente es manejado adecuadamente, las células del epitelio tubular renal se regenerarán completamente, con recuperación de la función renal . En el caso de una resección parcial del hígado, los hepatocitos inician su regeneración rápidamente por división celular hasta conseguir reemplazar el tejido que se ha perdido. Diapositiva 12 Células permanentes • No se dividen • Miocitos cardiacos • Neuronas • Una vez mueren son fagocitados por macrófagos • Cicatriz de colágeno Diapositiva 13 Células madre • Medicina regenerativa • Esperanza reparar injuria: – Corazón – Cerebro – Músculo esquelético Diapositiva 14 Las células del miocardio y las neuronas, pertenecen a la población de células permanentes, sin capacidad de dividirse. Por lo tanto en el caso de un infarto del miocardio, los miocitos no se recuperan, son reemplazados por una cicatriz fibrosa, sin capacidad contráctil, que se puede reflejar como un área hipotónica en la ecografía. En el caso de destrucción de algún área cerebral, las neuronas son reemplazadas por una proliferación del tejido glial de soporte. La investigación está enfocada a lograr que estas células sean recuperadas, usando en algunos casos células embrionarias, en otros células madre adultas, de la médula ósea, que inyectadas en el sitio de la injuria y bajo ciertos estímulos puedan diferenciarse y reemplazar a las que se han perdido. Los estudios han funcionado a nivel experimental con ratones y principalmente en casos de isquemia de músculo esquelético de extremidades sometidas a isquemia. Las células madre tienen la capacidad de renovarse y de generar lineas celulares diferentes. Para dar lugar a estas líneas, necesitan ser mantenidas durante la vida del organismo. Este mantenimiento se alcanza por dos mecanismos: la replicación asimétrica en la cual una de las células hijas retiene su capacidad de renovarse a si misma y la otra se diferencia. El otro mecanismo es la diferenciación estocástica, en la cual una población es mantenida por el balance entre las divisiones celulares que generan sea células madre que se renuevan o dos células que se van a diferenciar, conocidas como células madre embrionarias que son pluripotenciales y entonces pueden generar todos los tejidos del organismo. Diapositiva 15 Células madre embrionarias • Pluripotenciales • Permite el estudio de pasos y señales de diferenciación • Modelos experimentales: producción de ratones knockout • Uso futuro para repoblar órganos dañados – Hígado – Miocardio • En animales: – Células pancreáticas productoras de insulina – Células nerviosas • Terapia de clonación La primera etapa en la producción de ratones knockout ,es la inactivación o deleción de un gen de células embrionarias cultivadas. Las células se inyectan al blastocisto, se implantan en el útero de una madre subrogada. El blastocisto modificado genéticamente desarrolla un embrión, porque el defecto genético no es letal. Con técnica similar se han desrrollado ratones “knock-in”, en los cuales una secuencia de DNA mutada reemplaza la secuencia endógena. Se pueden producir ratones con deficiencias genéticas específicas para un sólo tejido o célula o tener “deficiencias genéticas condicionales”, es decir que puedan ser activadas e inactivadas en animales adultos. Diapositiva 16 Reprogramación de células diferenciadas • Clonación reproductiva • Repararación órganos – Ética – Ineficiente – Deficiencia en metilación de histonas en las células embrionarias reprogramadas Diapositiva 17 Pluripotencialidad de células madre embrionarias • Expresión de factores de transcripción: – – – – Oct3/4 Sox2 C-myc Kfl4 – – – – Oct3/4 Sox2 Nanog Lin8 – Proteína Nanog previene la diferenciación Células iPS, sin embrión, reprogramadas La efectividad de estos procedimientos en animales está bajo intenso estudio y hay mucho debate acerca de los asuntos éticos asociados con la derivación de células embrionarias de blastocistos humanos. Células diferenciadas de tejidos adultos pueden ser reprogramadas para llegar a ser pluripotenciales, por transferencia de su núcleo a un oocito enucleado y estos oocitos implantados en una madre subrogada, generan embriones clonados que dan lugar a animales adultos. Es la clonación reproductiva. La esperanza está en la clonación terapéutica, en el tratamiento de las enfermedades humanas. Se ha visto que la pluripotencialidad de las células embrionarias de ratón depende de la expresión de cuatro factores de transcripción, mientras que la proteína nanog previene la diferenciación. Las células reprogramadas iPS son capaces de generar células de origen endodérmico, mesodérmico y ectodérmico. Diapositiva 18 Células madre • Presentes en muchos tejidos de animales adultos • Contribuyen al mantenimiento de la homeostasis • Capacidad renovación prolongada . Diapositiva 19 Replicación asimétrica: En cada división una célula retiene la capacidad de renovarse a si misma y la otra se diferencia y se convierte en una población madura que no se divide. caracterización • Marcadores específicos? • Identificación de células madre en varios tejidos incluyendo cerebro • Plasticidad de desarrollo (médula ósea) • Algunas son similares a células embrionarias. Diapositiva 20 Células madre adultas • Capacidad de diferenciación restringida, usualmente específica de línea • Médula ósea • Transdiferenciación • Plasticidad del desarrollo Nichos tisulares Trasdiferenciación: un cambio en la diferenciación de un tipo de célula a otro Plasticidad :multiplicidad de opciones de diferenciación Diapositiva 21 Médula ósea • Células madre hematopoyéticas – Células sanguíneas • Células estromales – – – – – Condrocitos Osteoblastos Adipocitos Mioblastos Precursores de células endoteliales • Factor estimulante de colonias de los granulocitos y macrófagos Diapositiva 22 Células madre tisulares • Hígado: canales de Hering-células ovales hepatocitos y células biliares. – Hepatitis fulminante – Carcinogénesis – Cirrosis avanzada Las células madre hematopoyéticas, pueden reconstituir la médula ósea después de radiación y son usadas ampliamente en el tratamiento de enfermedades hematológicas. Pueden obtenerse de médula ósea, cordón umbilical, sangre periférica de individuos que reciben citocinas, como factor estimulante de los granulocitos, factor estimulante de colonias, los cuales movuilizan HSC. Las células madre estromales, producen diferentes células dependiendo del tejido al cual migren. Migran al tejido injuriado y generan células estromales u otras líneas celulares, pero no parecen participar en la homeostasis normal. El hígado contiene células madre progenitoras en los canales de Hering, la unión entre los hepatocitos y el sistema ductal biliar. Las células ovales son bipotenciales, generan hepatocitos y células del epitelio biliar. En contraste con las células madre en los tejidos proliferantes, células madre hepáticas, funcionan como una reserva secundaria activada sólo cuando la proliferación de hepatocitos es bloqueada. La proliferación de células ovales y su diferenciación son prominentes en los hígados de pacientes que se recuperan de falla hepática fulminante, tumorogénesis hepática, y en algunos casos de hepatitis crónica y cirrosis avanzada. Diapositiva 23 Células madre tisulares • Cerebro: • Células madre neurales (células precursoras neurales) – Bulbo olfatorio – Giro dentado hipocampo Diapositiva 24 Células madre tisulares • Músculo esquelético – Replicación de células satélite • Músculo cardíaco – Células similares a progenitoras? El dogma establecido de que no hay regeneración de neuronas nuevas, es ahora incorrecto. Las NSCs, células precursoras neurales, son capaces de generar neuronas, astrocitos y oligodendrocitos. Es ahora claro que estas neuronas son integradas en los circuitos neurales bajo condiciones fisiológicas y patológicas y más ampliamente que pueden ser el propósito de la neurogénesis adulta. Hay mucha esperanza en que el transplante de células madre o la inducción de diferenciación de células precursoras neurales, pueda ser usado en tratamiento de ACVs, Parkinson, Alzheimer e injuria de la médula espinal. Los miocitos de músculo esquelético no se dividen, el crecimiento y regeneración ocurre por replicación de células satélites. Estas células localizadas por encima de la lámina basal de los miocitos, constituye una reserva de células madre que generan miocitos diferenciados después de la injuria. La presencia de células madre en el corazón permanece en debate. Se ha propuesto que pueda contener células similares a progenitoras, con capacidad de generar progenie después de la injuria, pero no durante el envejecimiento fisiológico. Diapositiva 25 La curación de las heridas es un proceso complejo, pero ordenado, que vamos a tomar como ejemplo para ver de forma sencilla la reparación celular de los tejidos. La función principal de la piel es servir de barrera protectora contra el ambiente. La pérdida de la integridad de grandes proporciones de la piel como resultado de injuria o enfermedad puede llevar a incapacidad mayor o a la muerte. El objetivo primario del tratamiento de las heridas es el cierre rápido y una cicatriz funcional y estética satisfactoria. Diapositiva 26 La curación es un proceso que requiere tiempo…. Yago: ¿Qué herida se ha curado sino poco a poco? Otelo: Acto II; Escena III Diapositiva 27 Estas son las fases ordenadas de la curación de las heridas. Podemos ver como los procesos se superponen en el tiempo. Slide 4.19 Diapositiva 28 Diapositiva 29 Los resultados de la cicatrización van a depender del tipo de herida y de las complicaciones que presente. Una herida neta, limpia, realizada por un médico y suturada bajo las condiciones adecuadas, permitirá un afrontamiento de los bordes y una cicatriz lineal en la mayoría de los casos. Una herida con pérdida de tejido, tendrá una mayor proliferación de tejido de granulación para llenar el defecto y permitir el afrontamiento posterior de los bordes de la piel. El resultado será una cicatriz más ancha que puede tener un grado de retracción. Si una herida de bordes netos ha sido suturada, pero si se infecta, los puntos deben ser retirados, para permitir la salida del material purulento y así se convierte en una herida abierta que cicatrizará por segunda intención. Diapositiva 30 REPARACION DE HERIDAS HEMOSTASIA Diapositiva 31 INFLAMACION REGENERACION REPARACION DE HERIDAS ELEMENTOS CELULARES Hemostasia Plaquetas Inflamación Polimorfonucleares, Macrófagos Regeneración Fibroblastos, Células endoteliales Queratinocitos En el caso de las heridas, lo primero que ocurre es la hemostasia para detener el sangrado. El coágulo formado provee una matriz provisional para la migración celular. Mediadores vasoactivos y factores quimiotácticos generados por las vías del complemento y de la coagulación, reclutan leucocitos polimorfonucleares al sitio de la injuria. Otros mediadores derivados de las plaquetas y del endotelio vascular van a favorecer la producción de fibroblastos y de tejido de granulación. Un resumen de los elementos celulares en cada uno de los pasos del proceso de reparación de las heridas. Las plaquetas no solamente facilitan la formación del coágulo, secretan varios mediadores como factor de crecimiento derivado de las plaquetas que atrae y activa macrófagos y fibroblastos .Los neutrófilos limpian el área de partículas extrañas y bacterias y son a su vez retirados con la costra o fagocitados por los macrófagos. Los monocitos también infiltran el sitio de la herida y llegan a ser macrófagos activados que liberan factores de crecimiento, tales como factor de crecimiento derivado de las plaquetas y factor de crecimiento del endotelio vascular, lo cual inicia la formación del tejido de granulación. El factor de crecimiento derivado de las plaquetas es un potente quimiotáctico y mitógeno para fibroblastos. Los factores de crecimiento derivados de los macrófagos y monocitos, son necesarios para la iniciación y propagación de nuevo tejido en las heridas. Así, los macrófagos parecen tener un papel importante en la transición entre la inflamación y la reparación. Diapositiva 32 REPARACION DE HERIDAS CRONOLOGIA Queratinocitos Angiogénesis Plaquetas Macrófagos Cicatrización Polimorfonucleares Fibroblastos 0 24 48 72 Tiempo (horas) Diapositiva 33 HEMOSTASIA 96+ La secuencia cronológica de la actividad de los diferentes elementos. Las plaquetas actúan inmediatamente, seguidas en las primeras 48 horas por los neutrófilos. A las 72 horas los macrófagos, fibroblastos, queratinocitos o células de la epidermis y angiogénesis. La formación de la cicatriz ocurre después del cuarto día. Diapositiva 34 En una incisión quirúrgica, se produce disrupción focal de la membrana basal epitelial, y muerte de unas pocas células epiteliales y del tejido conectivo. Como resultado la regeneración epitelial, predomina sobre la fibrosis. Diapositiva 35 El espacio, rápidamente se llena con un coágulo de sangre y fibrina con un importante papel de las plaquetas. Diapositiva 36 Cuando la superficie vascular es lesionada, se exponen factores XII y XI y la calicreína ,con activación de la vía intrínseca de la coagulación. 20 Diapositiva 37 El resultado será la formación de una malla de fibrina, que servirá como una matriz provisional en el sitio de la herida. 21 Diapositiva 38 REPARACION DE HERIDAS PROPIEDADES DEL COAGULO • Barrera protectora temporal • Matriz para la migración celular • Reservorio de citoquinas y factores de crecimiento Diapositiva 39 Proteínas de los gránulos alfa de las plaquetas Prot. plasmáticas Albúmina IgG Fibrinógeno Factor V FvW Etc. FP4 Prot. plaquetarias Reparación tisular -TG PDGF PDAF PDEGF TGF-alfa TGF-beta H-FGF Diapositiva 40 Una vez formado el coágulo de fibrina, se produce la formación del tejido de granulación, por debajo del mismo y las células epidérmicas inician su proliferación desde los bordes de la herida. Diapositiva 41 Al ocurrir la herida, se disparan los mecanismos de la inflamación, que como sabemos es una respuesta inespecífica ante la injuria celular de cualquier tipo. INFLAMACIÓN Diapositiva 42 Ante la injuria, el endotelio es activado y los polimorfonucleares neutrófilos que se desplazan regularmente por el centro de la luz de los capilares, migran por diapédesis al sitio de la lesión. Limpian el área de partículas extrañas y bacterias y posteriormente son eliminados con la costra o son fagocitados por los macrófagos. Diapositiva 43 En respuesta a factores quimiotácticos, tales como fragmentos de proteínas de la matriz extracelular, factor de crecimiento transformante beta y proteína 1; los monocitos también infiltran el sitio de la herida y se convierten en macrófagos activados, que estimulan la liberación de factores de crecimiento como el factor de crecimiento derivado de las plaquetas y del crecimiento del endotelio vascular, los cuales inician la formación del tejido de granulación. Slide 3.22 Diapositiva 44 Diapositiva 45 MATRIZ EXTRACELULAR • Componentes mayores – Colágeno – Membranas basales – Fibras elásticas. – Fibronectina – Proteoglicanos Por mucho tiempo, predominó el concepto de que el papel más importante en la reparación de tejidos lo ejercían las células y que la matriz extracelular servía únicamente de soporte para la actividad de las mismas. Está demostrado, que la matriz extracelular y sus componentes juega un papel muy importante y que es necesaria la “comunicación” por medio de proteínas, para que se realice el proceso. La fibronectina, una proteína que une factores de la matriz con las células por medio de las integrinas, permite que se activen receptores y se produzcan señales solubles que activarán al núcleo celular para que se produzca la proliferación celular. Diapositiva 46 Slide 4.12 Esta gráfica que muestra la interacción de la matriz extracelular con los factores de crecimiento en las células y los mecanismos mediante los cuales se induce el crecimiento celular, la diferenciación y la síntesis de proteínas, también nos sirve para explicar cómo los macrófagos se unen a proteínas específicas de la matriz extracelular por medio de sus receptores de integrinas, una acción que estimula la fagocitosis de microorganismos y fragmentos de matriz extracelular, por parte de los macrófagos. La adherencia a la matriz extracelular también estimula los monocitos a sufrir metamorfosis a macrófagos inflamatorios o reparativos. Por otra parte la adherencia induce a los monocitos y macrófagos a expresar factor estimulante de colonias 1, una citocina necesaria para la sobrevida de monocitos y macrófagos; factor de necrosis tumoral alfa, una potente citocina inflamatoria; y factor de crecimiento derivado de las plaquetas un potente quimiotáctico y mitógeno para fibroblastos. Los factores de crecimiento derivados de monocitos y macrófagos son necesarios para la iniciación y propagación de nueva formación de tejido en las heridas, porque animales depletados de macrófagos tienen defectos en la reparación de las heridas. Los macrófagos tienen un papel crucial en la transición entre inflamación y reparación. El resultado final de la interacción con los receptores ,es la activación de la cascada de fosforilación de las proteínas que estimula las células quiescentes a incorporarse al ciclo de crecimiento celular. Diapositiva 47 REPARACION Diapositiva 48 Reparación por tejido conectivo • Angiogénesis. • Fibrosis • Remodelación (maduración y organización de la cicatriz) En resumen la reparación por tejido conectivo incluye tres eventos: la angiogénesis, la fibrosis por producción de colágeno y la remodelación. Diapositiva 49 En la curación de las heridas es necesaria la formación de vasos, células inflamatorias, fibroblastos y colágeno, lo cual se logra por la producción de factores de crecimiento :TGF (Factor de crecimiento transformante), PDGF: derivado de las plaquetas). b-FGF: (Factor básico de crecimiento de fibroblastos) Diapositiva 50 Un sencillo esquema para representar la pérdida del epitelio escamoso de la piel, la ruptura de la membrana basal, la formación de la matriz provisional, la migración de los queratinocitos dirigida a la epidermización y la activación de metaloproteinasas y fibroblastos. Diapositiva 51 La Reepitelización de las heridas se inicia horas después de la injuria. Las células epidérmicas de los folículos rápidamente remueven la sangre coagulada y el estroma dañado del espacio de la herida. Al mismo tiempo las células sufren alteración fenotípica marcada que incluye retracción de los tonofilamentos intracelulares, disolución de la mayoría de los desmosomas intercelulares y formación de filamentos de actina citoplasmática, los cuales permiten el movimiento celular. Además las células epidérmicas no se adhieren a las de la dermis por la disolución de los hemidesmosomas de la membrana basal, lo cual permite el movimiento lateral de las células epidérmicas. La expresión de receptores de integrinas en las células epidérmicas, les permite interactuar con una variedad de proteínas de la matriz extracelular (fibronectina y vibronectina) que son interpuestas con el colágeno tipo I del estroma y entrelazadas con el coágulo de fibrina en el espacio de la herida. La colagenasa producida por las células epidérmicas, permite que se degrade la matriz extracelular y así las células epidérmicas migran entre el colágeno de la dermis y la costra de fibrina. Uno o dos días después de la injuria, las células epidérmicas en el margen de la herida empiezan a proliferar detrás de las células en migración. Cuando la reepitelización se inicia las proteínas de la matriz reaparecen en una secuencia ordenada desde el margen hacia adentro como una cremallera que se cierra. En esta gráfica se muestran los factores de crecimiento necesarios para el movimiento celular. Diapositiva 52 Formación del tejido de granulación Los vasos sanguíneos aparecen en el coágulo de fibrina a medida que las células epidérmicas restauran la herida. Se muestran las proteinasas necesarias para el movimiento celular. El nuevo estroma, llamado también tejido de granulación empieza a ocupar el espacio de la herida al 4° día de la injuria. Macrófagos, fibroblastos y vasos sanguíneos se mueven al espacio de la herida al mismo tiempo. Los macrófagos proveen factores de crecimiento necesarios para estimular la fibroblasia y la angiogénesis. ,Los fibroblastos producen nueva matriz extracelular, necesaria para soporte de las células y los vasos sanguíneos llevan oxígeno y nutrientes para sostener el metabolismo celular. Factores de crecimiento, especialmente factor derivado de las plaquetas, factor de crecimiento transformante beta-1 y moléculas de la matriz extracelular, estimulan los fibroblastos del tejido alrededor de la herida para proliferar, expresar los receptores de integrinas y migrar al espacio de la herida. Después de migrar a la herida los fibroblastos comienzan la síntesis de matriz extracelular que gradualmente se reemplaza por una matriz colágena. Una vez que se ha depositado suficiente matriz, los fibroblastos dejan de producir colágeno y el tejido de granulación rico en fibroblastos se reemplaza por una cicatriz relativamente acelular. Las células en la herida sufren apoptosis, disparada por señales desconocidas. La disregulación del proceso, ocurre en desórdenes fibróticos como la formación de queloide, la morfea y la escleroderma. Diapositiva 53 Diapositiva 54 Diapositiva 55 Neovascularización La formación de nuevos vasos es necesaria para sostener el tejido de granulación recientemente formado es un proceso complejo. La angiogénesis inicialmente se atibuyó al factor de crecimiento transformante acídico y básico y posteriormente se han encontrado muchas otras moléculas : Factor de crecimiento endotelial, factor de crecimiento transformante beta, angiogenina, angiotropina, angiopoetina I y trombospondina, la baja tensión de oxígeno y el ácido láctico elevado. Muchas de estas moléculas inducen angiogénesis por estimulación del factor de crecimiento básico de fibroblastos, factor de crecimiento endotelial,por macrófagos y células endoteliales. Las células epidérmicas de la herida secretan grandes cantidades de factor de crecimiento del endotelio vascular. El factor de crecimiento fibroblástico básico sostiene el crecimiento vascular los primeros tres días y el factor de crecimiento del endotelio vascular es crítico durante los días 4 a 7. Además de los factores angiogénicos, también son necesarios receptores endoteliales y una matriz extracelular apropiada. Los receptores de fibronectina por las células endoteliales permiten la conducción de las células endoteliales a la herida y por otra parte la expresión y la actividad de las proteasas también son necesarias para la angiogénesis. Diapositiva 56 Diapositiva 57 Un corte histológico coloreado con hematoxilina eosina, en donde vemos la proliferación vascular en medio de un tejido colágeno, que tiñe de azul con la coloración especial de tricrómico. Slide 4.13 Diapositiva 58 Proliferación Fibroblastos y células endoteliales Migran al tejido dañado de áreas adyacentes Proliferan e incrementan actividad Depósito de colágeno Miofibroblastos Angiogénesis Inician contracción de la herida En la cicatrización de las heridas proliferan además de las células epidérmicas, los fibroblastos y células endoteliales responsables de la producción de colágeno y de la formación de vasos. Los miofibroblastos, son fibroblastos modificados, con capacidad contráctil, cuya función es iniciar la contracción de la herida. Esto explica por qué la cicatriz final es de menor tamaño que la herida inicial. Diapositiva 59 Fibroblastos en la reparación de heridas • Proliferación – Máxima a los 3 días • Migración (comienza a los 4 días) – Quimioatracción • PDGF, TGF-, IL-4 – Sustratos • Fibronectina • GAG • Otros componentes de la MEC • Síntesis – Colágeno – MMP – Citoquinas • PDGF-beta • FGF-7 Diapositiva 60 Qué es el colágeno? Cuál célula lo produce? Un es una proteína, producido por los fibroblastos Colágeno • Proteína fibrosa- estructural • Fibroblasto sintetiza el tropocolágeno que se ensambla para formar fibrillas de colágeno ricas en hidroxiprolina, hidroxilisina y glicina y es degradado y remodelado por enzimas proteolíticas llamadas colagenasas, • Fibroblasto sintetiza fibras elásticas y de reticulina Diapositiva 61 Macrófagos Acido láctico procolágeno Tropo colágeno Fibroblastos glicosaminoglicanos Proteoglicanos ACTIVIDAD FIBROBLASTICA DURANTE LA PROLIFERACION colágeno Diapositiva 62 Remodelación Orientación de las fibras de colágeno Reabsorción del colágeno tipo III Reeemplazo con colágeno tipo I Cicatriz final similar al tejido original Una vez formado el colágeno, se produce la remodelación del mismo y esta depende de un equilibrio entre su síntesis y su catabolismo. La degradación del colágeno es llevada a cabo por varias enzimas proteolíticas llamadas metaloproteinasas. Diapositiva 63 Tipos de cicatrización de las heridas Diapositiva 64 Una herida puede cerrar por primera intención o por segunda intención. Cuál es la diferencia? Hablamos de cicatrización por primera intención, cuando hay una herida de bordes netos y limpios, generalmente por una incisión quirúrgica, que permite un afrontamiento adecuado. Diapositiva 65 La cicatrización por segunda intención ocurre cuando ha habido pérdida de tejido, la herida tiene bordes irregulares o se ha infectado una herida quirúrgica y se han tenido que retirar los puntos de sutura para permitir la salida de material purulento. El proceso tardará más tiempo, porque es necesario que se forme mas tejido de granulación para llenar el defecto y la cicatriz usualmente, será mayor. Diapositiva 66 SEGUNDA INTENCION Diapositiva 67 Cicatrización por primera intención Requerimientos: • Ausencia de infección de la herida • Hemostasia perfecta • Afrontamiento correcto de los bordes • Ajuste por planos anatómicos de la herida durante la sutura. En el caso de una incisión quirúrgica o de una herida de bordes netos, limpia, que es suturada en el tiempo adecuado, el objetivo es que cicatrice por primera intención, para lo cual se deben cumplir requisitos mínimos. Diapositiva 68 Diapositiva 69 Cicatrización por segunda intención • • • • • • Lenta Tejido de granulación bien definido Cicatriz retraída Pérdida de substancia Dificultad para afrontar los bordes Infección de la herida Diapositiva 70 • Más inflamación • Más tejido de granulación • Contracción de la herida Características de la cicatrización por segunda intención. Diapositiva 71 6 horas 2 días Diapositiva 72 Curación de la herida • Inducción de una respuesta inflamatoria aguda • Regeneración de células parenquimatosas • Migración y proliferación de células del tejido conectivo y parenquimatosas • Síntesis de proteínas de la matriz extracelular • Remodelación • Colagenización y maduración del colágeno. Diapositiva 73 Un resumen de los eventos en la curación de las heridas. Diapositiva 74 Diapositiva 75 Diapositiva 76 Diapositiva 77 Diapositiva 78 Diapositiva 79 Diapositiva 80 Diapositiva 81 Factores que retardan la cicatrización Locales Generales • Edad • Deficiencia de proteínas • Bajos niveles de vitamina C ( cofactor para la hidroxilación del procolágeno) • Esteroides y AINES • Temperatura Diapositiva 82 • • • • • • • • Infección Cuerpos extraños Hematoma Tensión de la herida por sutura Suplencia sanguínea/ isquemia Inflamación continuada Sequedad de la herida Excesivo movimiento Propiedades de la piel • Viscoelasticidad • Tensión de la piel: cicatrices hipertróficas en tórax y hombros • Si la tensión es más rápida que la capacidad de estiramiento: estrías En la cicatrización de las heridas se deben tener en cuenta factores tanto locales como generales que pueden retardar el proceso. Es así como a un paciente desnutrido, que requiere una intervención quirúrgica electiva, se le mejoran primero sus condiciones nutricionales, para garantizar que después del acto quirúrgico pueda cicatrizar adecuadamente. Las heridas ganan solamente el 20% de su fuerza en las primeras tres semanas, tiempo durante el cual el colágeno fibrilar se ha acumulado relativamente rápido y se ha remodelado por contracción de la herida. Después de esto, la proporción a la cual la piel gana fuerza tensil es lenta, reflejando menor proporción de acumulación de colágeno y remodelación con formación de bandas anchas e incremento en el número de las uniones cruzadas intermoleculares. De todas maneras las heridas nunca alcanzan la misma fuerza tensil que la piel no injuriada. A máxima fuerza, una cicatriz tiene solamente el 70% de la piel normal. Esta es una de las razones, por las cuales no se recomienda tener un parto ni trabajo de parto, después de una cesárea. La fuerza de las contracciones durante el trabajo de parto puede ocasionar la ruptura uterina. Diapositiva 83 FUERZA TENSIL • Remoción de la sutura 10% • Incremento rápido en las 4 primeras semanas • Al tercer mes 70-80% Diapositiva 84 Reparación anormal de las heridas Diapositiva 85 Anormalidades de la cicatrización • Cicatriz hipertrófica • Cicatriz queloide • Cicatriz atrófica Las cicatrices hipertróficas y queloides , se caracterizan por una excesiva acumulación de colágeno en las heridas. Se han descrito anormalidades en la migración celular, inflamación, síntesis y secreción de proteínas de la matriz extracelular, citoquinas y de la remodelación de la matriz de la herida. También se han propuesto mutaciones en genes regulatorios ( p53). Diapositiva 86 La diferencia entre un queloide y una cicatriz hipertrófica. El queloide es una proliferación exagerada ante una injuria mínima y puede presentarse como una tumoración. La cicatriz hipertrófica no sobrepasa los bordes de la herida. Diapositiva 87 Una imagen histológica ,en la cual se observa la proliferación desordenada de fibras gruesas de colágeno, en medio de las cuales hay estructuras vasculares. Diapositiva 88 Una cicatriz atrófica y acrómica, después de una laparotomía en el ángulo superior. En la parte inferior una cicatriz queloide y a la derecha una cicatriz hipertrófica. 70 Diapositiva 89 Diapositiva 90 Diapositiva 91 Reparación anormal de las heridas Fisiopatología de los queloides • Alteración en la migración celular • Aumento de actividad de citoquinas fibrogénicas – TGF-beta1 – IGF – IL-1 • Respuesta celular exagerada a la acción de citoquinas – de receptores de TGF-beta • Alteración del fenómeno de apoptosis Diapositiva 92 Diapositiva 93 Efecto de TGF-2 sobre la cinética de fibroblastos Cicatriz hipertrófica y apoptosis Diapositiva 94 Reparación anormal de las heridas Diabetes Mellitus • Neuropatía – Formación de úlceras por insensibilidad • Isquemia – aporte oxígeno y nutrientes • Infección – Alteración de fagocitosis y quimiotaxis • Alteración de la vascularización • de la síntesis de colágeno • de la producción de proteinasas Las úlceras de los pacientes diabéticos son un ejemplo de cómo múltiples defectos bioquímicos y fisiológicos pueden llevar a un daño en la cicatrización. Ocurren en pacientes con problemas de sensibilidad cutánea, por la neuropatía, lo cual les impide aliviar la presión local. La isquemia secundaria a enfermedad vascular impide la curación al reducir la suplencia de oxígeno y otros nutrientes. Las úlceras de los pacientes diabéticos son propensas a la infección porque hay un daño en la función y quimiotaxis de los granulocitos. También muestran una inflamación prolongada, daño en la neovascularización, disminución de la síntesis de colágeno, aumento en los niveles de las proteinasas y defectos en la función de los macrófagos.