Información del Documento Original
Anuncio

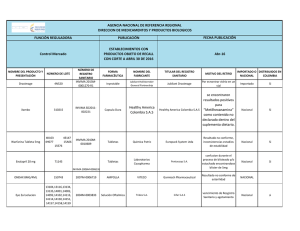
Or igin al República de Colombia Ministerio de Salud y Protección Social Instituto Nacional de Vigilancia de Medicamentos y Alimentos – INVIMA RESOLUCIÓN No. 2013034394 DE 20 de Noviembre de 2013 Por la cual se concede un Registro Sanitario El Director de Medicamentos y Productos Biológicos del Instituto Nacional de Vigilancia de Medicamentos y Alimentos INVIMA, en ejercicio de las facultades Legales Conferidas en el Decreto 2078 de 2012, Resolución No. 2012030820 del 19 de Octubre de 2012, Decreto Reglamentario 677 de 1995 y Ley 1437 de 2011. ANTECEDENTES oc um en to Que mediante resolución No. 2012011818 de 2 de Mayo de 2012 el INVIMA Aprobó la Evaluación Farmacéutica para el producto FURAZOLIDONA 100 mg TABLETAS a favor de LABORATORIOS ANDROMACO S.A. con domicilio en CHILE. Que mediante radicado No. 2013015269 del 14/02/2013, el señor Mauricio Peñuela Becerra, actuando en calidad de representante legal de Labinco S.A,solicitó concesión del Registro Sanitario en la modalidad de Fabricar y Vender al producto FURAZOLIDONA 100mg Tabletas a favor de Laboratorios Andromado S.A con domicilio en Chile. Que mediante Auto No. 2013002877 de 2 de Mayo de 2013, la Dirección de Medicamentos y Productos Biológicos solicitó la siguiente información: lD “1. En el contrato celebrado entre la sociedad titular LABORATORIOS ANDROMACO S.A., y la sociedad fabricante LABINCO S.A., en el folio 18, en la cláusula undécima de estudios de estabilidad se consigna que ANDROMACO y/ o sus filiales contratará los estudios de estabilidad de un tercero, al que LABINCO enviará los lotes piloto para tal fin. Sírvase indicar quien es el laboratorio encargado de los estudios de estabilidad del producto de la referencia, y allegar el contrato celebrado entre la sociedad titular y el laboratorio encargado de los estudios de estabilidad, consignando el nombre del producto y los estudios que se llevaran a cabo. 2. En el boceto para el blister no indican el lugar a marcar el No. de lote y la Fecha de Vencimiento. En los bocetos de las cajas debe consignar la forma farmacéutica aprobada: tabletas, y consignar la ubicación del laboratorio fabricante. Allegarlas corregidas. 3. Dadas las presentaciones comerciales e institucionales aprobadas en la Evaluación Farmacéutica, indicar en que parte del envase van ubicadas las etiquetas allegadas en los folios 36 y 37 y en caso de ser parte de los envases del producto , estas deben conservar el mismo diseño de las cajas, por cuanto las cajas llevan color azul en su diseño y las etiquetas no, además las etiquetas llevan una cabeza negra.” Que mediante radicado No. 2013084707 del 31/07/2013, el señor Mauricio Peñuela Becerra, actuando en calidad de representante legal de Laboratorios Andrómaco S.A., respondió el Auto No. No. 2013002877 de 2 de Mayo de 2013. de CONSIDERACIONES DEL DESPACHO Frente a los documentos técnicos / legales allegados por el interesado con radicado No. 2013015269 del 14/02/2013 , este Despacho se permite hacer las siguientes consideraciones: ac ión Que mediante radicado No. 2013084707 del 31/07/2013, el señor Mauricio Peñuela Becerra, actuando en calidad de representante legal de Laboratorios Andrómaco S.A., respondió el Auto No. 2013002877 de 2 de Mayo de 2013, allegando y/ o aclarando la información inicial radicado con el No. No. 2013015269 del 14/02/2013 para acceder a la solicitud de concesión del Registro Sanitario en la modalidad de Fabricar y Vender al producto FURAZOLIDONA 100mg Tabletas a favor de Laboratorios Andromado S.A., con domicilio en Chile. En cuanto a los materiales de empaque – cajas- allegadas con la respuesta al auto, no se aprueban por cuanto no se corrigieron en el sentido de indicar la ubicación del laboratorio fabricante tal como lo requiere el literal b) artículo 72 del Decreto 677/95 y se solicitó en el numeral 2 del auto y en cuanto al requerimiento de numeral 3, no se indico en que lugar del envase van ubicadas las etiquetas marcadas como institucionales. Inf orm Que de acuerdo a las definiciones generales del Decreto 677/95 , un Medicamento: Es aquél “ preparado farmacéutico obtenido a partir de principios activos, con o sin sustancias auxiliares, presentado bajo forma farmacéutica que se utiliza para la prevención, alivio, diagnóstico, tratamiento, curación o rehabilitación de la enfermedad.Los envases, rótulos, etiquetas y empaques hacen parte integral del medicamento, por cuanto éstos garantizan su calidad, estabilidad y uso adecuado.” Subrayado fuera del texto. Instituto Nacional de Vigilancia de Medicamentos y Alimentos – INVIMA Carrera 68D 17-11/21 PBX: 2948700 Bogotá - Colombia www.invima.gov.co Página 1 de 3 Or igin al República de Colombia Ministerio de Salud y Protección Social Instituto Nacional de Vigilancia de Medicamentos y Alimentos – INVIMA RESOLUCIÓN No. 2013034394 DE 20 de Noviembre de 2013 Por la cual se concede un Registro Sanitario El Director de Medicamentos y Productos Biológicos del Instituto Nacional de Vigilancia de Medicamentos y Alimentos INVIMA, en ejercicio de las facultades Legales Conferidas en el Decreto 2078 de 2012, Resolución No. 2012030820 del 19 de Octubre de 2012, Decreto Reglamentario 677 de 1995 y Ley 1437 de 2011. Conforme a la definición citada, el medicamento de la referencia NO se puede comercializar sin la aprobación de los materiales de empaque y envase – cajas y etiquetas - como parte integral del mismo y los cuales garantizan entre otros, su uso adecuado, por lo tanto éstos debe ser allegados dentro del plazo estipulado en le articulo segundo, para su evaluación. oc um en to Que revisada la base de datos del INVIMA, mediante 2011026387 del 19 de julio del 2011, el INVIMA concedió recertificación de Buenas Practicas de Manufactura BPM al laboratorio fabricante LABORATORIO INTERNACIONAL DE COLOMBIA S.A. LABINDO S.A. con domicilio Bogota - para fabricar en área de producto no estéril, principios activos comunes, sólido, en la forma farmacéutica de tabletas con o sin cubierta, con una vigencia hasta el 04 de agosto del 2014. Que con base en el Decreto 677 de 1995, Decreto 2086 de 2010, la norma farmacológica No. 4.2.6.0.N10, y la documentación allegada por el interesado previo estudio técnico y legal, la Dirección de Medicamentos y Productos Biológicos, RESUELVE Inf orm ac ión de lD ARTICULO PRIMERO.- Conceder REGISTRO SANITARIO por el término de CINCO (5) años al PRODUCTO: FURAZOLIDONA 100 mg TABLETAS REGISTRO SANITARIO No.: INVIMA 2013M- 00147 20 VIGENTE HASTA: TIPO DE REGISTRO: FABRICAR Y VENDER TITULAR(ES): LABORATORIOS ANDROMACO S.A. con domicilio en CHILE FABRICANTE(S): LABORATORIO INTERNACIONAL DE COLOMBIA S.A. LABINCO S.A. con domicilio en BOGOTA - D.C. VENTA: CON FORMULA FACULTATIVA FORMA FARMACEUTICA: TABLETA VIA ADMINISTRACIÓN: ORAL PRINCIPIOS ACTIVOS: Cada TABLETA contiene FURAZOLIDONA 100 mg PRESENTACIÓN COMERCIAL: CAJA x 20, 30, 100, 250, 1000 TABLETAS EN BLISTER PVC AMBAR/ALUMINIO. USO INSTITUCIONAL: CAJA x 20, 30, 100, 250, 1000 TABLETAS EN BLISTER PVC AMBAR/ALUMINIO. INDICACIONES: INFECCIONES PRODUCIDAS POR GÉRMENES SENSIBLES A LA FURAZOLIDONA. NOTA DE FARMACOVIGILANCIA: LOS REPORTES E INFORMES DE FARMACOVIGILANCIA DEBEN PRESENTARSE A LA DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS CON LA PERIODICIDAD ESTABLECIDA EN LA RESOLUCIÓN Nº 2004009455 DEL 28 DE MAYO DE 2004. CONTRAINDICACIONES Y ADVERTENCIAS: PACIENTES CON DAÑO EN LA FUNCIÓN RENAL O CON INSUFICIENCIA DE LA ENZIMA GLUCOSA - 6 - FOSFATO DESHIDROGENASA. PRIMER TRIMESTRE DE EMBARAZO. NIÑOS LACTANTES MENORES DE UN (1) MES DE NACIDOS. NO ADMINISTRAR CONCOMITANTEMENTE CON ALCOHOL. OB SERVACIONES: LAS CONTRAINDICACIONES Y ADVERTENCIAS DEBEN APARECER EN LAS ETIQUETAS Y EMPAQUES, MAS LA FECHA DE VENCIMIENTO, EL NUMERO DE LOTE Y UNA FRANJA VERDE CON LA LEYENDA "MEDICAMENTO ESENCIAL". EL TITULAR Y FABRICANTE AUTORIZADO EN EL REGISTRO SANITARIO, ADQUIEREN LA OBLIGACIÓN DE MANTENER LAS BUENAS PRACTICAS DE MANUFACTURA VIGENTES DURANTE LA VIGENCIA DEL REGISTRO SANITARIO. TVU ACEL40°NAT30°3M 3LOT RAD2011132982 “TODA INFORMACIÓN CIENTÍFICA, PROMOCIONAL O PUBLICITARIA SOBRE LOS MEDICAMENTOS DEBERÁ SER REALIZADA CON ARREGLO A LAS CONDICIONES DEL REGISTRO SANITARIO Y A LAS NORMAS TÉCNICAS Y LEGALES PREVISTAS EN EL ARTÍCULO 79 DEL DECRETO 677 DE 1995.” Instituto Nacional de Vigilancia de Medicamentos y Alimentos – INVIMA Carrera 68D 17-11/21 PBX: 2948700 Bogotá - Colombia www.invima.gov.co Página 2 de 3 Or igin al República de Colombia Ministerio de Salud y Protección Social Instituto Nacional de Vigilancia de Medicamentos y Alimentos – INVIMA oc um en to RESOLUCIÓN No. 2013034394 DE 20 de Noviembre de 2013 Por la cual se concede un Registro Sanitario El Director de Medicamentos y Productos Biológicos del Instituto Nacional de Vigilancia de Medicamentos y Alimentos INVIMA, en ejercicio de las facultades Legales Conferidas en el Decreto 2078 de 2012, Resolución No. 2012030820 del 19 de Octubre de 2012, Decreto Reglamentario 677 de 1995 y Ley 1437 de 2011. VIDA UTIL: DOS (2) AÑOS A PARTIR DE LA FECHA DE FABRICACION CONSERVADO EN LAS CONDICIONES DE ALMACENAMIENTO. CONDICIONES DE ALMACENAMIENTO: CONSERVESE A TEMPERATURA MENOR DE 30°C EN SU EMPAQUE ORIGINAL. EXPEDIENTE No.: 20041602 RADICACIÓN No.: 2013015269 ARTICULO SEGUNDO : De be alle gar de ntro de los (30) días cale ndario s iguie nte s a la notificación de la pre se nte Re solución; boce tos de foie y cajas cao lo r para las pre se ntacione s come rciale s e ins titucionaleaprobadas s , donde se incluya e lnúme ro de l re g is tros anitario y ajus tar s us te xtos de acue rdo a lo dispue s to e n la pre se nte Re solución y e l articulo 72 de l De cre to 677 /95.OBS ERVACIONES : Las cajas tanto para las pre s e ntacione s come rciale s como las institucionale s de be n s e r alle gadas comple tas con e l fin de ve rificar la dis tribución de te xtos de ntro de las mis mas . No se ace pta la s ola e tique ta marcada para uso Ins titucional para pe gar e n caja, por cuanto no s e conoce n los te xtos de las otras caras de las cajas. ARTICULO TERCERO.- Contra la presente Resolución procede únicamente el Recurso de Reposición, que deberá interponerse ante el DIRECTOR DE MEDICAMENTOS Y PRODUCTOS BIOLOGICOS, del Instituto Nacional de Vigilancia de Medicamentos y Alimentos INVIMA, dentro de los DIEZ (10) días siguientes a su notificación, en los términos señalados en el Código de Procedimiento Administrativo y de lo Contencioso Administrativo. ARTICULO CUARTO.- La presente Resolución rige a partir de la fecha de su ejecutoria. Dada en Bogotá, D.C. a los COMUNIQUESE, NOTIFIQUESE Y CUMPLASE 20 de Noviembre de 2013 de lD Este espacio, hasta la firma se considera en blanco ____________________________________________ CARLOS AUGUSTO SANCHEZ ESTUPIÑAN DIRECTOR DE MEDICAMENTOS Y PRODUCTOS BIOLOGICOS Inf orm ac ión Proye ctó: Técnico: L. Be rmúde z Le gal: D. Be lalcázar Revis ó: L. Gil Instituto Nacional de Vigilancia de Medicamentos y Alimentos – INVIMA Carrera 68D 17-11/21 PBX: 2948700 Bogotá - Colombia www.invima.gov.co Página 3 de 3